- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn quốc gia TCVN 4584:1988 Nước thải - Phương pháp phân tích vi khuẩn
| Số hiệu: | TCVN 4584:1988 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Uỷ ban Khoa học Nhà nước | Lĩnh vực: | Tài nguyên-Môi trường |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
01/01/1988 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 4584:1988
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 4584:1988
TIÊU CHUẨN QUỐC GIA
TCVN 4584 : 1988
NƯỚC THẢI – PHƯƠNG PHÁP PHÂN TÍCH VI KHUẨN
Waste water – Methods of sanitarybacteryological analysis
Lời nói đầu
TCVN 4584 : 1988 do Viện vệ sinh dịch tễ biên soạn, Bộ Y tế đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng trình duyệt, Ủy ban Khoa học nhà nước (nay là Bộ Khoa học và Công nghệ) ban hành.
Tiêu chuẩn này được chuyển đổi năm 2008 từ Tiêu chuẩn Việt Nam cùng số hiệu thành Tiêu chuẩn Quốc gia theo quy định tại khoản 1 Điều 69 của luật Tiêu chuẩn và Quy chuẩn kỹ thuật và điểm a khoản 1 Điều 6 Nghị định số 127/2007/NĐ-CP ngày 1/8/2007 của Chính phủ quy định chi tiết thi hành một số điều của Luật Tiêu chuẩn và Quy chuẩn kỹ thuật.
NƯỚC THẢI – PHƯƠNG PHÁP PHÂN TÍCH VI KHUẨN
Waste water – Methods of sanitarybacteryological analysis
Tiêu chuẩn này quy định các phương pháp phân tích vi khuẩn để tìm các chỉ số nhiễm bẩn và một số loại vi khuẩn gây bệnh ở trong nước thải sinh hoạt và nước thải công nghiệp.
1. Quy định chung
1.1 .Trước khi tiến hành phân tích vi khuẩn, các dụng cụ thí nghiệm bằng thủy tinh phải được rửa sạch, phơi hoặc sấy khô, bao gói và khử khuẩn ở nhiệt độ 180 °C trong 1 h.
1.2. Các dung dịch, thuốc thử và môi trường cần thiết để nuôi cấy vi khuẩn theo yêu cầu, cần chuẩn bị đầy đủ.
1.3. Bàn làm việc phải lát gạch men chịu axit, trước và sau khi làm việc phải lau mặt bàn bằng dung dịch phenol 5%.
1.4. Tiến hành kỹ thuật phân tích vi khuẩn cần thực hiện trong điều kiện vô khuẩn, khử khuẩn không khí buồng làm việc (buồng vô khuẩn) bằng đèn tia cực tím ít nhất 1 h. Sau khi làm việc xong cũng phải khử khuẩn bằng tia cực tím. Nếu không có đèn tia cực tím thì xông foocmalin qua một đêm. Sau khi khuẩn bằng foocmalin phải trung hòa hơi foocmalin bằng dung dịch ammoniac ít nhất 2 h, rồi mới vào làm việc.
1.5. Sau mỗi đợt nuôi cấy vi khuẩn, những dụng cụ thí nghiệm phải được tiệt khuẩn bằng sức nóng của lò hấp ướt hoặc ngâm trong dung dịch hóa chất diệt khuẩn mạnh theo quy định rồi mới được rửa.
1.6. Phải có các lò hấp khử khuẩn dụng cụ thí nghiệm sạch sẽ và bán riêng biệt.
2. Lấy mẫu
2.1. Dụng cụ lấy mẫu
Dùng loại chai thủy tinh, nút mài có dung tích 100 ml; 500 ml; 1 000 ml đã được sấy khô tiệt khuẩn ở nhiệt độ 180 °C trong 1 h.
Dụng cụ lấy nước thải, là một quang sắt, lắp chai để lấy nước thải ở các độ sâu khác nhau.
Thùng đựng đá hoặc phích đá để bảo quản các mẫu nước sau khi lấy và để chuyển mẫu về phòng thí nghiệm.
2.2. Vị trí và thời gian lấy mẫu
Nước thải bao gồm: Nước thải chưa xử lý, nước thải đã được xử lý. Vị trí và thời gian lấy mẫu tùy thuộc vào mục đích kiểm tra phân tích và đặc điểm của nguồn nước.
2.2.1. Lấy mẫu nước thải chưa xử lý
a) Đối với nước thải chưa xử lý, thải ra có định kỳ, phải lấy mẫu ngay lúc nước thải ra, không phụ thuộc giờ, ngày, tháng, mùa … các điểm lấy mẫu:
– cống tập trung;
– điểm xả (ra sông, hồ, biển …);
– các điểm cách xa điểm xả 1 km, 3 km …
b) Đối với nước thải chưa xử lý thải ra liên tục khi lấy mẫu nước thải phải theo lịch nghiên cứu như định kỳ theo mùa, thời tiết, tháng, ngày giờ …
Các điểm lấy mẫu giống như nước thải, thải ra có định kỳ.
2.2.2. Lấy mẫu nước thải đã được xử lý
Phải lấy mẫu nước trước khi xử lý và sau khi đã xử lý.
Các điểm lấy mẫu:
– Cống tập trung của phân xưởng; Bể xử lý (lắng - lọc);
– Hệ thống nước đã được làm sạch (đã thu hồi các hóa chất, độc chất, xử lý các chất hữu cơ, thuốc sát trùng);
– Điểm xả (ra sông, hồ, biển…);
– Các điểm cách xa điểm xả là 1 km, 5 km, 10 km …
2.2.3. Lấy mẫu nước thải của hệ thống cống rãnh chung của thành phố (gồm nước thải sinh hoạt và nước thải công nghiệp).
Các điểm lấy mẫu:
– Cống gần cơ sở xả nước thải;
– Cống tập trung của các đường cống thành phố;
– Điểm xả của cống thành phố ra sông, hồ;
– Các điểm cách xa điểm xả 1 km, 5 km, 10 km …
2.2.4. Lấy mẫu nước thải ở các nhà máy xử lý nước thải
Các điểm lấy mẫu:
– Cống lớn tập trung tất cả nước thải đổ về;
– Hệ thống xử lý (các bể lắng, lọc …);
– Hệ thống nước đã được xử lý;
– Điểm xả ra sông, hồ, biển;
– Các điểm cách xa điểm xả 1 km, 5 km, 10 km …
2.3. Tiến hành lấy mẫu
Mỗi một mẫu nước lấy ở một điểm, cần lấy một lượng từ 100 ml đến 500 ml. Nếu nước thải quá bẩn thì chỉ cần lấy 100 ml, nếu nước thải đã được xử lý trước khi đưa ra điểm xả thì lấy 500 ml. Dùng dụng cụ lấy nước (quang chai bằng sắt) có khối lượng nặng để làm chìm chai, có hệ thống dây kéo để mở và đóng nút chai, lấy nước ở độ sâu từ 30 cm đến 50 cm. Nếu không có quang lấy nước có thể dùng dây hoặc que, sào. Lấy nước ở các điểm xả (sông, hồ) cách điểm xả từ 1 km, 3 km, 5 km … Tùy theo yêu cầu của công tác nghiên cứu, trong đó cần lấy ở ba vị trí.
– Một mẫu ở giữa dòng;
– Một mẫu lấy ở bờ phải, cách bờ ít nhất 2 m;
– Một mẫu lấy ở bờ trái, cách bờ ít nhất 2 m;
Mẫu nước lấy xong, đóng nút vô khuẩn buộc gói mẫu nước. Trên mẫu cần ghi nhãn mẫu nước như sau: Loại nước thải; điểm lấy mẫu nước thải; thời gian lấy mẫu (ngày, tháng, năm …); số mẫu phân tích (về số vi khuẩn); nơi yêu cầu; tên người lấy mẫu. Sau khi lấy mẫu, cho các chai mẫu nước thải vào hộp bảo quản (nhôm, tôn) mỗi chai một hộp.
2.4. Vận chuyển và bảo quản mẫu
Các mẫu phải được vận chuyển tới phòng thí nghiệm sớm. Thời gian không quá 3 h từ khi lấy mẫu. Nếu vận chuyển xa mẫu nước cần bảo quản ở nhiệt độ từ 4 °C đến 6 °C (dùng phích đá hoặc thùng đựng đá).
Những mẫu nước thử đưa về phòng thí nghiệm cần giữ ở tủ lạnh nếu chưa được kiểm nghiệm ngay. Thời hạn không quá ba ngày.
3. Xác định tổng số vi khuẩn
3.1. Nguyên tắc
Xác định trong mực nước số lượng vi khuẩn khí và kỵ khí tùy tiện có khả năng mọc trên môi trường thạch thường ở 37 °C ± 0,5 °C trong 24 h.
3.2. Cách lấy mẫu
Theo Điều 2 của tiêu chuẩn này.
3.3. Chuẩn bị phòng thí nghiệm
3.3.1. Dụng cụ thí nghiệm và thiết bị thí nghiệm
Theo TCVN 2680 : 1978 Điều 12
3.3.2. Môi trường nuôi cấy vi khuẩn
Thạch thường theo Phụ lục 1, Điều 22
Nước muối sinh lý theo Phụ lục 1, Điều 2.
3.4. Tiến hành xác định
Pha mẫu thử ra các nồng độ bằng nước sinh lý vô khuẩn 3,5 ‰. Nếu nước thải quá bẩn thì pha loãng 1/1 000, 1/10 000, 1/100 0000 …Nếu nước thải đã được xử lý, sát khuẩn hoặc nước thải công nghiệp thì chỉ cần pha loãng tới 1/10, 1/100.
Dùng chỉ viết kính, ghi số mẫu thử, độ pha loãng, ngày tháng, trên hộp lồng Petri. Dùng ống hút chia độ vô khuẩn hút nước thử: 1 ml của từng nồng độ, cho vào trung tâm hộp lồng trước. Mỗi nồng độ dùng một ống hút riêng biệt. Làm ít nhất từ 2 đến 3 độ pha loãng.
Thạch thường đã đun chảy (cách thủy) cho tan đầu rồi để nguội 45 °C. Bên cạnh ngọn đèn cồn mở hé hộp lồng đã có nước thử, đổ vào chừng 10 ml thạch thường. Đóng nắp hộp, xoay nhẹ vòng tròn trái, phải trên mặt bàn để trộn đều với nước thạch. Chờ khi trên mặt thạch đông lại, úp ngược mặt thạch mang để tủ ấm 37 °C trong 24 h.
3.5. Đếm khuẩn lạc
Đếm khuẩn lạc vi khuẩn hiếu khi sau khi nuôi ở tủ ấm từ 18 h đến 24 h. Đếm bằng máy đếm hoặc bằng mắt thường qua ánh sáng tự nhiên. Dùng bút chì, châm các khuẩn lạc qua hộp Petri để đếm. Vi khuẩn hiếu khí. Mỗi khuẩn lạc là một mầm vi khuẩn phát triển. Ở những hộp Petri có nhiều khuẩn lạc thì kẻ làm 4 ô đều nhau để đếm từng ô cho dễ dàng. Những đĩa có khuẩn lạc mọc đầy (từ 300 khuẩn lạc trở lên) thì không đếm.
3.6. Tính kết quả
Tổng số khuẩn lạc vi khuẩn hiếu khí trong 1 ml mẫu thử bằng trung bình cộng của các hộp thạch đã nuôi cấy tính theo công thức:
N = ![]()
Trong đó:
nK là số khuẩn lạc trong đĩa thạch K
K là số đĩa thạch tiến hành thí nghiệm
Ví dụ:
Đĩa thạch một: cấy 1 ml nước thải nguyên chất nhiều không đếm được;
Đĩa thạch hai: cấy 1 ml nước thải pha loãng đến 1/10, có 300 khuẩn lạc;
Đĩa thạch ba: cấy 1 ml nước thải pha loãng đến 1/100, có 30 khuẩn lạc.
Kết quả như sau:
N = ![]() = 3000 Klac/ml
= 3000 Klac/ml
CHÚ THÍCH: Tùy theo yêu cầu của công tác nghiên cứu kiểm tra từng loại nước thải mà xác định một hoặc cả hai loại vi khuẩn: Psychophile (ở nhiệt độ 18 °C đến 20 °C) Mesophile (ở nhiệt độ 37 °C). Loại sau này thường là loại vi khuẩn thối rữa và gây bệnh.
4. Xác định trực khuẩn Coli phân (fecal coli)
4.1. Xác định trực khuẩn coli phân trong môi trường lỏng
4.1.1. Nguyên tắc
Cấy một lượng nước thử vào trong môi trường lỏng nghèo đạm nuôi ở nhiệt độ (44 ± 0,5) °C trong 48 h.
Nhận định sự mọc đục môi trường, lên men đường lactoza, sinh hơi, sinh indol ở các ống nuôi cấy, rồi tính chỉ số theo bảng ước tính MPN (Most Probable number).
4.1.2. Cách lấy mẫu
Theo Điều 2 của tiêu chuẩn này
4.1.3. Chuẩn bị phòng thí nghiệm
4.1.3.1. Dụng cụ thí nghiệm và thiết bị
Theo TCVN 2680:1978, Điều 1, 2.
4.1.3.2. Môi trường và dung dịch
Có thể dùng một trong các loại môi trường lỏng để nuôi cấy nước thử sau đây:
Pepton lactoza 10‰ lục sáng, chuẩn bị theo Phụ lục 1, Điều 35.
Pepton Lactoza đỏ trung tính chuẩn bị theo Phụ lục 1, Điều 36.
Canh thang Lactoza axit boric, chuẩn bị theo Phụ lục 1, Điều 19.
Canh thang Lactoza đỏ trung tính chuẩn bị theo theo Phụ lục 1, Điều 20.
Các môi trường và dung dịch khác:
Pepton thường, chuẩn bị theo Phụ lục 1, Điều 13.
Nước muối sinh lý 8,5 ‰ chuẩn bị theo số 1, Điều 2.
Thuốc thử Kovac, chuẩn bị theo số 1, Điều 9.
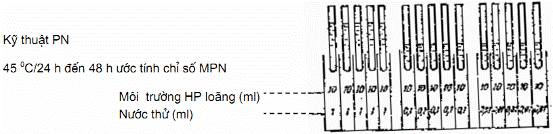
4.1.4. Tiến hành xác định (Hình 1)
Trên một giá nhiều lỗ, xếp ba hàng ống nghiệm kích thước 18 mm x 180 mm. Mỗi hàng năm ống môi trường (mỗi ống đóng sẵn 10 ml môi trường. Dùng ống hút chia độ để:
Cấy mẫu nước vào năm ống của hàng đầu tiên, mỗi ống 10 ml.
Cấy mẫu nước vào năm ống của hàng thứ hai, mỗi ống 1 ml
Cấy mẫu nước vào năm ống của hàng thứ ba, mỗi ống 1 ml pha loãng 1/10
Mỗi nồng độ phải dùng một dùng một ống hút riêng biệt.
Khi cấy xong, lắc nhẹ giá ống nghiệm cho hòa đều nước thử với môi trường, đem để tủ ấm (44 ± 0,5) °C.
Sau 48 h, nhận định những ống lên men đường lactoza sinh hơi, mọc đục môi trường. Ghi số lượng những ống đã lên men sinh hơi, mọc đục và ống Pasteur, hút chừng 0,5 ml cấy chuyển sang ống môi trường peptone thường mang để tủ ấm (44 ± 0,5) °C trong 24 h, vi khuẩn sẽ mọc đục trong ống. Nhỏ 10 giọt thuốc thử Kowas để tìm Indol. Nếu phản ứng Indol dương tính sẽ xuất hiện một vòng đỏ thắm trên mặt môi trường trong ống pepton. Nhận định các ống cấy: nếu lên men, sinh hơi, sinh Indol là dương tính.
CHÚ THÍCH 1: Phương pháp này dùng cho nuôi cấy tìm trực khuẩn coli trong nước sạch (nước máy) và nước thải đã được xử lý.
CHÚ THÍCH 2: Đối với nước máy và nước thải đã được xử lý có thể cấy nước thử như sau:
1 ống x 50 ml (N) nguyên chất
5 ống x 0,1 ml (N)
Kết quả theo Bảng 3, Phụ lục 2.
CHÚ THÍCH 3: Nếu nước thải bẩn có thể pha loãng thêm và cấy như sau:
5 ống x 1 ml (N)
5 ống x 0,1 ml
Kết quả theo Bảng 2, Phụ lục 2
CHÚ THÍCH 4: Nếu ở độ pha loãng cuối cùng và 5 ống đều dương tính thì cần phải pha loãng thêm để cấy tiếp.
Kết quả có thể suy ra từ Bảng 2, Phụ lục 2.
4.1.5. Tính kết quả
Trong Bảng tính ước lượng MPN để tính chỉ số trực khuẩn coli trong nước thử
Tính chỉ số MPN (most probable number) Phụ lục 2, Bảng 1.
Đếm số ống lên men, sinh hơi, sinh Indol của các nồng độ rồi tra bảng ước tính các nồng độ MPN.
VÍ DỤ
Năm ống của hàng đầu tiên cấy 10ml mẫu thử: dương tính (lên men, sinh hơi, sinh Indol).
Năm ống của hàng thứ hai cấy 1ml mẫu thử: có 3 ống dương tính (lên men, sinh hơi, sinh Indol).
Năm ống của hàng thứ ba cấy 0,1ml: không có ống nào dương tính.
Từ bảng số sẽ là: 530 - Tra bảng NPN sẽ cho kết quả là 79 coli/100 ml.
4.2. Xác định trực khuẩn coli phân trong môi trường đặc.
4.2.1. Nguyên tắc
Cấy một lượng nước nhỏ trong thạch đĩa Endo, khuẩn lạc E, coli mọc có màu đỏ ánh kim.
4.2.2. Cách lấy mẫu
Theo Điều 2 của tiêu chuẩn này.
4.2.3. Chuẩn bị phòng thí nghiệm.
4.2.3.1. Dụng cụ thí nghiệm và thiết bị
Theo TCVN 2680 : 1978, Điều 1,2.
4.2.3.2. Môi trường dung dịch
Môi trường Endo chuẩn bị theo Phụ lục 1, Điều 23.
Nước muối sinh lý 8,5 ‰ chuẩn bị theo Phụ lục 1, Điều 2.
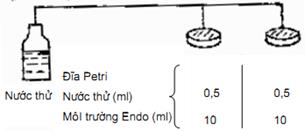
4.2.4. Tiến hành xác định (Hình 2).
Tùy loại nước thải mà quyết định độ pha loãng để phân tích nuôi cấy vi khuẩn. Dùng nước cất hoặc nước muối sinh lý vô khuẩn để pha loãng như sau:
Dùng chì viết kính, ghi số mẫu thử, độ pha loãng, ngày tháng trên nắp hộp Pétri. Dùng ống hút vô khuẩn hút mẫu nước thử (lắc đều) cho vào hai đĩa Pétri vô khuẩn, mỗi đĩa 0,5 ml.
Thạch Endo đã pha chế, đem đun cách thủy cho tan đều rồi để nguội đến 45 0C. Mở hé hộp lồng đã có mẫu nước thử 0,5 ml, đổ vào chừng 10 ml thạch Endo. Đóng nắp hộp, xoay tròn nhẹ nhàng để hòa đều.
Chờ khi mặt thạch đông lại, mang để tủ ấm ở (44 ± 0,5) °C, úp ngược hộp thạch, nuôi cấy trong 24 h.
4.2.5. Đếm khuẩn lạc và tính kết quả.
Đếm khuẩn lạc mọc ở trong và trên mặt thạch Endo, có màu đỏ thẫm, ánh kem ở hai đĩa cấy 0,5 ml.
Tổng số khuẩn lạc sẫm màu, ánh kim của hai đĩa thạch đã cấy là lượng coli trong 1ml.
Nếu mẫu nước thử pha loãng ra 1/10, 1/100, 1/1 000 v.v... khi có kết quả thì phải nhân số khuẩn lạc mọc trên hai đĩa thạch với các hệ số: 10, 100, 1 000 v.v…
Số lượng trực khuẩn coli phân có trong 100ml nước thải chưa pha sẽ là:
X = A x 100
Trong đó:
A Số vi khuẩn coli phân có trong hai đĩa thạch Endo;
100 Quy về thể tích 100 ml nước thải chưa pha.
Ví dụ: Hai đĩa thạch Endo, cấy ở nồng độ pha loãng 1/10 đếm được 20 khuẩn lạc. Vậy số trực khuẩn coli phân trong 100 ml nước thải chưa pha là:
20 x 10 x 100 = 20 000
Sơ đồ phân lập trực khuẩn coli phân trong môi trường lỏng nhiều ống
Kỹ thuật MPN
| - nhiệt độ (44 °C ± 0,5 °C)/48 g - tìm phản ứng Indol - tra bảng ước lượng MPN |
| |
|
| ||
|
Pepton lactoza axit boric (ml) Nước thử (ml) | ||
|
| Hình 1 | |
|
| Các ống dương tính tiến hành làm phản ứng tìm Indol | |
Sơ đồ phân lập trực khuẩn coli phân trên môi trường đặc
- Nhiệt độ (44 °C ± 0,5 °C)/ 24 g.
- Đếm số khuẩn lạc ánh kim trên mạch thạch.
Hình 2
5. Xác định liên cầu khuẩn đường ruột (streptococus faecalis)
5.1. Xác định liên cầu khuẩn đường ruột
5.1.1. Nguyên tắc.
Liên cầu khuẩn đường ruột có thể phát triển trong môi trường lỏng có axit - natri - glucoza - ở nhiệt độ thích hợp 45 °C trong 48 h.
5.1.2. Cách lấy mẫu
Theo Điều 2 của tiêu chuẩn này.
5.1.3. Chuẩn bị phòng thí nghiệm.
5.1.3.1. Dụng cụ thí nghiệm và thiết bị theo TCVN 2680 : 1978, Điều 1,2.
5.1.3.2. Môi trường nuôi cấy
Môi trường H.P đậm đặc chuẩn bị theo Phụ lục 1, Điều 25.
Môi trường H.P. loãng chuẩn bị theo Phụ lục 1, Điều 26.
Nước nuôi sinh lý 8,5 ‰ đóng ống đúng 9ml, chuẩn bị theo Phụ lục 1, Điều 2.
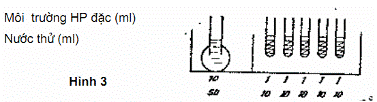
5.1.4. Tiến hành xác định (Hình 3)
Trên một giá xếp hai hàng ống: năm ống môi trường HP đậm đặc và bốn ống môi trường HP loãng.
Nước thử pha ra nồng độ: N (nguyên chất): 1/10; 1/100; 1/1 000.
Dùng ống hút vô khuẩn lấy mẫu nước thử (lắc đều) và cấy vào:
5 ống môi trường HP đặc, mỗi ống 10 ml mẫu nước thử N
4 ống môi trường HP loãng, mỗi ống 1 ml mẫu nước thử ở độ pha loãng dần: N; 1/10; 1/100; 1/1000.
Cấy xong lắc nhẹ hòa đều nước với môi trường, mang để tủ ấm ở 45 °C. Sau 48 h, nhận xét các ống cấy: đục chuyển màu (từ tím sang vàng) là dương tính.
5.1.5. Tính kết quả
Căn cứ vào các ống dương tính, ước tính kết quả như sau:
ống thứ nhất (chuyển màu, mọc đục)
| Dương tính: | 20 liên cầu/l → 2 liên cầu /100 ml |
| ống thứ hai: | 40 liên cầu/l → 4 liên cầu /100 ml |
| ống thứ ba: | 60 liên cầu/l → 6 liên cầu /100 ml |
| ống thứ tư: | 80 liên cầu/l → 8 liên cầu /100 ml |
| ống thứ năm: | 100 liên cầu/l → 10 liên cầu /100 ml |
| Cả năm ống cấy 10 ml và thêm ống cấy 1 ml (N) | |
| Dương tính: | 100 liên cầu/l → 10 liên cầu/100 ml. |
Nếu cùng trong điều kiện trên và thêm độ pha loãng 1/10 dương tính 10 000 liên cầu/lít →
1 000/100 ml.
Nếu cùng trong điều kiện trên và thêm độ pha loãng 1/100 dương tính: 100 000 liên cầu/lít →10 000/100 ml.
Nếu cùng trong điều kiện trên và thêm độ pha loãng 1/1 000 dương tính: 1000 000 liên cầu/lít → 100 000/100 ml.
CHÚ THÍCH: Nếu nước thải bẩn thì cấy lượng nước thải ở nồng độ đầu là 1 ml (N) và dùng môi trường HP loãng.
5.2. Xác định liên cầu khuẩn đường ruột trong môi trường lỏng nhiều ống kỹ thuật NPN
5.2.1. Nguyên tắc
Theo Điều 5.1 của tiêu chuẩn này.
5.2.2. Cách lấy mẫu
Theo Điều 2 của tiêu chuẩn này.
5.2.3. Chuẩn bị phòng thí nghiệm
5.2.3.1. Dụng cụ thí nghiệm và thiết bị theo TCVN 2680 : 1978 Điều 1,2.
5.2.3.2. Môi trường cấy
Môi trường HP đậm đặc chuẩn bị theo Phụ lục 1, Điều 25.
Môi trường HP loãng chuẩn bị theo Phụ lục 1, Điều 26.
5.2.4. Tiến hành xác định (Hình 3).
Xếp vào giá ống nghiệp ba hàng ống mỗi hàng năm ống môi trường HP loãng. Dùng ống hút vô khuẩn hút mẫu nước thử cho vào môi trường HP theo các độ pha loãng: N, 1/10, 1/100, mỗi ống 1 ml.
5 ống x 1 ml (N)
5 ống x 1 ml (1/10)
5 ống x 1 ml (1/100).
Nếu nước thải tương đối sạch thì không pha loãng, cấy vào môi trường HP đậm đặc theo các thể tích nước như sau:
1 ống x 50 ml (N)
5 ống x 10 ml (N)
Tiến hành xác định xong, đem để tủ ấm ở 45 °C.
Sau 48 h, nhận xét những ống mọc đục chuyển màu (từ tím sang vàng) là dương tính.
5.2.5. Tính kết quả
Đến số ống dương tính, đem tra bảng tính ước số MPN, sẽ cho các chỉ số 1 lên cầu 100 ml. (tra Bảng 2 và Bảng 3 Phụ lục 2)
CHÚ THÍCH
1 Mỗi độ pha loãng phải dùng một ống hút riêng biệt.
2 Nếu ở độ pha loãng cuối cùng còn dương tính thì phải pha loãng thêm và nuối cấy tiếp.
3 Nếu muốn kiểm tra khuẩn lạc điển hình và hình thể của liên cầu trùng đường ruột thì cấy chuyển các ống dương tính sang môi trường thạch SLANETZ và nhuộm gram xem hình thể.
5.3. Xác định liên cầu khẩn đường ruột trong môi trường đặc.
5.3.1. Nguyên tắc.
Cấy một lượng nhỏ nước thải trong môi trường thạch có natri 8zit, có khả năng diệt các loại vi khuẩn khác chỉ để cho liên cầu khuẩn đường ruột mọc
5.3.2. Cách lấy mẫu
Theo Điều 2 của tiêu chuẩn này
5.3.3. Chuẩn bị phòng thí nghiệm
5.3.3.1. Dụng cụ và thiết bị theo TCVN 2680 : 1978, Điều 1,2.
5.3.3.2. Môi trường nuôi cấy
- Thạch SLANETZ và BARTLEY: Phụ lục 1, Điều 27
- Nước muối sinh lý 8,5 ‰ : Phụ lục 1, Điều 2
5.3.4 Tiến hành xác định (Hình 4)
Tùy theo loại nước thải mà quyết định độ pha loãng để nuôi cấy. Nếu nước thải bẩn thì pha loãng ra 1/10, 1/100.
Cấy mỗi mẫu nước thải vào hai đĩa thạch SLANETZ và BARTLEY. Môi trường thạch SLANETZ và BARTLEY đã được pha chế theo công thức hoặc ở dạng khô, đóng gói sẵn (Meck). Khi dùng đun cách thủy cho tan đều, để nguội tới 45 °C, đổ ra đĩa Pétri, mỗi đĩa khoảng 10 ml. Khi thạch đông, có thể cấy nước thải trên mặt thạch.
Dùng ống hút vô trùng cho 0,1 ml nước thải vào giữa đĩa thạch SLANETZ dùng que cấy vi khuẩn cấy ria đều khắp mặt thạch để vào tủ ấp ở 45 °C trong 24 h. úp ngược hộp thạch.
5.3.5. Tính kết quả
Sau 24 h đến 48 h, các khuẩn lạc mọc trên mặt thạch SLAN - ETZ tròn trong mầu hồng sáng là khuẩn lạc của liên cầu trùng đường ruột (streptococcus faecalis).
Đếm số khuẩn lạc điển hình trên đĩa thạch, nhân với 1000 sẽ cho kết quả liên cầu trùng đường ruột (streptococcus faecalis).
Đếm số khuẩn lạc điển hình trên đĩa thạch, nhân với 1 000 sẽ cho kết quả liên cầu/100ml.
Chú thích Nếu cấy nước thải pha loãng 1/10 hay 1/100 thì kết quả trên phải nhân thêm với các hệ số 10, 100 v.v…
Sơ đồ phân lập liên cầu thẳng đường ruột trong nước thải

Sơ đồ phân lập liên cầu khuẩn trong môi trường đặc

Hình 4
6. Xác định vi khuẩn kỵ - khí nha bào (closthidium- Pereringens)
6.1. Nguyên tắc
Dựa trên tính chất sinh vật của CI.Porfringens có nha bảo chịu được nhiệt độ 750C x 10 min, sinh H2S, trong môi trường Wilson Blair khuẩn lạc có màu đen.
6.2. Cách lấy mẫu
Theo Điều 2 của tiêu chuẩn này
6.3. Chuẩn bị phòng thí nghiệm
6.3.1. Dụng cụ thí nghiệm và thiết bị, theo TCVN 2680 : 1978 Điều 1.2.
6.3.2. Môi trường nuôi cấy vi khuẩn
– môi trường Wilson - Blair (cải tiến) Phụ lục 1 (thạch Glucoza sunfit).
– môi trường thạch TSN (WSN a gar): môi trường này là loại môi trường khô, đóng gói sẵn (của Merk), khi dùng thì cân đong theo hướng dẫn sử dụng. Cần bao nhiêu thì pha bấy nhiêu, vì không để được lâu.
– nước muối sinh lý 8,5 ‰ để pha loãng mẫu thử. Phụ lục 1 Điều 2.
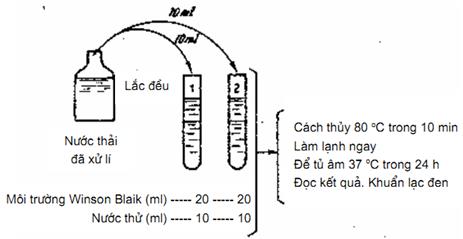
6.4. Tiến hành xác định (Hình 5)
Đun cách thủy cho tan đều môi trường thạch cấy vi khuẩn kỵ khí clostridiam Perfringenm, khi các ống môi trường nóng, tùy theo nước thải sạch hay bẩn, cho mẫu nước thử vào như sau:
10 ml mẫu nước thử (nếu là nước thải đã xử lý sạch);
1 ml mẫu nước thử (nếu là nước thải chưa xử lý);
0,1 ml mẫu nước thử (nếu là nước thải quá bẩn).
Để hai ống môi trường đã cấy nước thử vào nồi đun cách thủy ở 80 °C trong 10 min, lấy ra làm lạnh ngay dưới vòm nước cho thạch đông lại. Mang để tủ ấp 37 °C trong 24 h. Clostridun perfringens mọc thành khuẩn lạc đen tròn, đường kính khoảng 1 mm trở lên. Để lâu khuẩn lạc sẽ phát triển to hơn. Cần đếm khuẩn lạc sớm không quá 24 h. Nếu để lâu Cl.Perfringens sẽ mọc lan, sinh khí (H2S) nhiều, không đếm được. Nếu ống cấy 0,1 ml mẫu nước thử, lượng khuẩn lạc Cl.Perfringens còn quá nhiều khó đếm thì phải pha loãng hơn ra 1/100 cho dễ đếm.
6.5. Tính kết quả
Số lượng clostridium perfringens trong 10 m3 nước thải được tính theo công thức:
N/10 ml =![]()
Trong đó:
n1 số vi khuẩn trong ống số 1;
n2 số vi khuẩn trong ống số 2.
- nếu cấy theo thể tích 1 ml nước thử: thì N phải nhân với 10.
- nếu cấy theo thể tích 1ml nước thử: thì N phải nhân với 100.
Sơ đồ xác định C1 pereringens trong nước
Hình 5
7. Xác định phẩy khuẩn tả (vitro choletes)
7.1. Nguyên tắc
Phẩy khuẩn tả phát triển nhanh trong môi trường pepton kiềm mặn sau 3 h đến 4 h. Hình thể đặc biệt, trên môi trường chizis khuẩn lạc màu đen có quầng trắng, lên men đường sacaroza và sinh iazôn.
7.2. Cách lấy mẫu
Theo Điều 2 của tiêu chuẩn này.
7.3. Chuẩn bị phòng thí nghiệm
7.3.1. Dụng cụ thí nghiệm và thiết bị
Theo TCVN 2680 : 1978 Điều 1, 2
7.3.2. Môi trường và dung dịch.
Nước muối sinh lý 8,5 ‰ vô khuẩn chuẩn bị theo Phụ lục 1, Điều 2;
Nước pepton mặn 30 ‰ chuẩn bị theo Phụ lục 1, Điều 37;
Môi trường nước pepton, Phụ lục 1, Điều 47; Kali nitrat;
Môi trường thạch Chizia, chuẩn bị theo Phụ lục 1, Điều 38;
Môi trường Basilow, chuẩn bị theo Phụ lục 1, Điều 45;
7.4. Tiến hành xác định
7.4.1. Tiến hành xác định phân lập nhanh (cần trong vụ dịch) (Hình 6).
Cặn nước thải đã được ly tâm, đem cấy ngay vào ống pepton 30 ‰ pH 9. Để tủ ấm 37 °C trong 3 h đến 6 h hớt váng, cấy truyền sang ống môi trường pepton mặn khác thứ 2 và thứ 3.
Hớt váng cấy chuyển sang một ống thạch nghiêng cho thuần khiết và làm tiêu bản để soi tươi, nhuộm Gram xem hình thể và tính chất di động.
Qua kính hiển vi: soi tươi thấy di động, nhuộm Gram, thấy vi khuẩn bắt màu Gram âm, và hình thể dấu phẩy thì kết luận sơ bộ là có hình thể phẩy khuẩn tả.
7.4.2. Tiến hành xác định phân lập qua nhiều môi trường và các phản ứng (Hình 7).
Để xác định chủng loại, cần phải nuôi cấy qua nhiều môi trường phân lập, làm phản ứng ngưng kết với kháng huyết thanh tả (OGAWA, YNABA…), phản ứng sinh vật hóa học và tìm thực khuẩn thể (Phage):
a) Cấy chuyền và cấy vào môi trường phân lập.
Cấy cặn nước thải vào pepton mặn 30 ‰ pH 9. Cấy chuyền 3 lần rồi hớt váng cấy ria vào thạch Chizia.
Để tủ 37 °C. Sau 10 h phẩy khuẩn tả mọc sớm khuẩn lạc màu đen có quầng trắng (còn các loại vi khuẩn khác bị ức chế, sau 30 h mới mọc).
Tìm khuẩn lạc nghi ngờ, làm tiêu bản lam kính, nhuộm gram xem hình thể, nếu thấy hình thể dấu phẩy và bắt đầu màu Gram âm thì làm tiếp các khâu sau:
b) Làm lên men đường và không sinh hơi
Chủ yếu để xem sự lên men đường, để định loại phẩy khuẩn tả gây bệnh hoặc không gây bệnh.
Trên một giá xếp (ít nhất) 3 ống môi trường Basilow, cho vào 5 giọt đường (mỗi ống một loại đường). Dùng 3 loại đường: Sacharose, Mannose, Arabinose đã được tinh chế đóng sẵn vào ống 1 ml.
Cấy khuẩn lạc nghi ngờ (đã nuôi cấy) hoặc vài giọt canh trùng ở nước pepton mặn, vào các ống môi trường Basilow. Nếu có vi khuẩn tả mọc thì ống môi trường sẽ đổi màu: từ xanh sang vàng và chỉ lên men đường Saccharose.
c) Phản ứng tìm iazôn (cholera - rothe).
Vi khuẩn nghi ngờ, cấy sang ống môi trường, peptone kali nitrat để tủ ấm 37 °C sau 24 h, cho vào trong ống 1 ml axit clohidric (HCl), đặc. Nếu có màu đỏ hồng là Indol dương (nếu màu rõ thêm thì cho 0,5 ml cồn amilic, lắc đều). Mặt môi trường có một vòng đỏ thắm.
| Loại | Sacarôza | Nanôza | Arabinôza | Indôn | Ghi chú |
| I II | + + | + + | - - | + + | gây bệnh |
d) Phản ứng ngưng kết trên ống
Dùng huyết thanh tả ogawa và Inaba.
Lấy 2 ống môi trường pepton, rồi bỏ vào 10 giọt kháng huyết thanh ogawa và Inaba vào mỗi ống. Sau đó cấy canh khuẩn nghi tả vào 2 ống. Để tủ ấm 37 °C trong 4 h, rồi xem hiện tượng ngưng kết trên ống. Nếu là vi khuẩn tả thì sẽ ngưng kết, hạt nhỏ trong ống pepton .
e) Dùng thực khuẩn thể (Phagiơ).
Canh khuẩn non cây trong môi trường pepton mặn 30 ‰, hoặc canh thang sau 6 h. Lấy canh khuẩn láng đều trên địa thạch thường, để tủ ấm 37 °C cho khô, rồi mang ra rỏ một giọt Phagiơ vào. Đem để tủ ấm trong 4 h đến 6 h. Sau đó đọc kết quả: Nếu chỗ rỏ giọt Phagiơ vào, thấy trong (làm tan vi khuẩn) là có phẩy khuẩn tả (V. Ektor mọc lờ mờ, V. cholérae thì tan hết).
7.5. Đánh giá kết quả
Kết luận phẩy khuẩn tả căn cứ vào:
– Mọc và phát triển nhanh trong môi trường pepton kiềm mặn 3 h đến 6 h.
– Khuẩn lạc điển hình trên môi trường phân lập
| – Phản ứng sinh vật hóa học: | - Saccharose | + |
|
| - Indon | + |
– Ngưng kết với các kháng huyết thanh đặc hiệu
– Hình thể điển hình: Soi tươi : di động
Nhuộm gram : bắt màu Gram âm hình dấu phẩy.
CHÚ THÍCH: Nếu phòng thí nghiệm có trang bị đủ kháng huyết thanh tả các loại và Phagiơ tả thì làm:
- Phản ứng ngưng kết trên ống;
- Tìm thực khuẩn thể tả.
để định chuẩn loại phẩy khuẩn tả.
Sơ đồ xác định phẩy khuẩn tả
Xác định nhanh
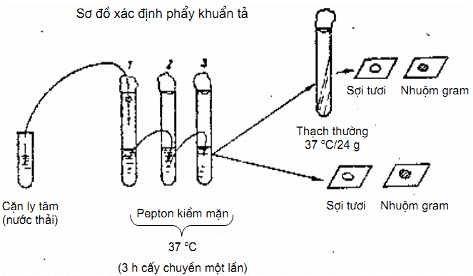
Hình 6
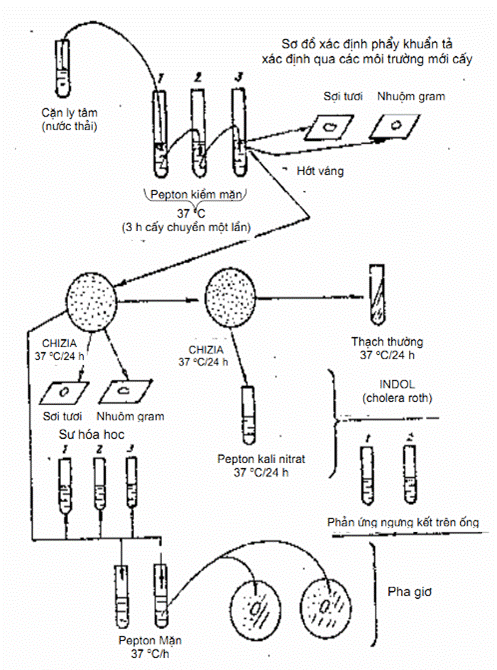
Hình 7
8. Xác định tụ cầu váng gây mủ (staphylococus pyogennes aureus)
8.1. Nguyên tắc
Dựa trên tính chất sinh vật hóa học của tụ cầu khuẩn là làm tan máu, làm huyết tương đồng, lên men đường manit. Hình thể chùm nho khi nhuộm soi.
8.2. Cách lấy mẫu
Theo Điều 2 của tiêu chuẩn này.
8.3. Chuẩn bị phòng thí nghiệm
8.3.1. Dụng cụ và thiết bị theo TCVN 2680 : 1978 Điều 1,2.
8.3.2. Môi trường nuôi cấy.
Pepton mặn 10 % chuẩn bị theo Phụ lục 1, Điều 39;
Thạch màu chuẩn bị theo Phụ lục 1, Điều 46;
Thạch Chapman chuẩn bị theo Phụ lục 1, Điều 40;
Dung dịch natri xitrat 3,8 %;
Huyết tương thô.
8.4. Tiến hành xác định (Hình 8)
Nếu là nước thải sinh hoạt, nước thải sản xuất (nước cống thải, nước thải nhà máy da, nhà máy giấy, nhà máy đường, xí nghiệp đậu phụ, lò sát sinh…) thì dùng một lượng nước 100 ml, lọc qua phèn lọc Seitz, hoặc ly tâm lấy cặn để nuôi cấy. Nếu là nước thải đã xử lý, và thải ra các nguồn sông, hồ v.v… nước bể bơi thải ra, thì dùng một lượng từ 1 l + 2 l, lọc qua lọc Seitz hoặc ly tâm cặn để nuôi cấy.
a) Cấy trong môi trường pepton mặn 10 %
Lấy cặn đã ly tâm, cấy vào môi trường pepton mặn 10 %, để tăng sinh và phong phú cầu khuẩn. Để các ống hoặc bình pepton mặn vào trong tủ ấm 37 °C trong 24 h.
b) Cấy vào môi trường thạch máu
Sau 24 h, hớt váng ở ống pepton mặn, cấy ria sang thạch máu mỗi mẫu nước cấy ít nhất 2 đĩa. Để trong tủ ấm 37 °C.
Sau 24 h, nhận xét khuẩn lạc theo màu sắc, tính chất tan huyết, và làm đồ phiến, nhuộm Gram, xem hình thể vi khuẩn (điển hình, hình chùm nho).
c) Cấy vào môi trường thạch Chapman
Dùng que cấy chọn một khuẩn lạc điển hình, cấy ria thạch đã Chapman để kiểm tra tính chất lên men đường mannit. Để tủ ấm 37 °C trong 48 h. Nếu môi trường chuyển sang màu vàng và lên men đường mannit.
d) Phản ứng làm đông huyết tương (coagulaza)
Cho 0,50 ml huyết tương thô vào trong một ống nghiệm nhỏ rồi cấy vào vài giọt canh trùng tụ cầu. Để tủ ấm 37 °C trong 6 h. Sau đó đọc kết quả: huyết tương đông lại, dốc ngược ống nghiệm, huyết tương không đổ ra khỏi ống.
Cách làm huyết tương: Hòa 1 ml máu thô với 0,35 ml dung dịch natri xitrat 3,8 % đem ly tâm và lấy huyết tương ở trên.
8.5. Kết quả
Căn cứ vào các khâu nuôi cấy phân lập và các phản ứng trên phòng thí nghiệm cần phải có kết quả ít nhất là của 4 tính chất để xác định tụ cầu vàng gây bệnh:
Tính chất tan huyết (+)
Lên men đường mannit (+)
Coagulaza (+)
Hình thể điển hình: hình chùm nho.
Sơ đồ xác định tụ cầu vàng gây mủ trong nước thải
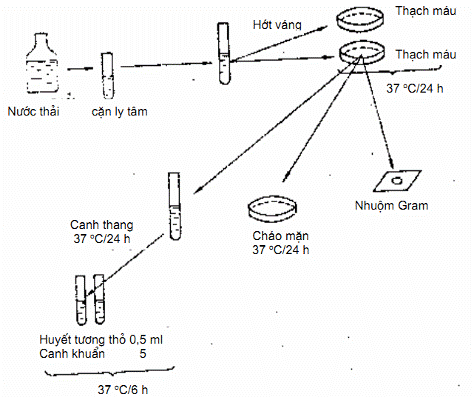
Hình 8
9. Xác định trực khuẩn mủ xanh (pseudomonas aeruginosa)
9.1. Nguyên tắc
Trong môi trường thạch màu ở 37 °C, trong 24 h trực khuẩn mủ xanh làm tan huyết làm cho môi trường có màu xanh, mùi hắc đặc biệt.
9.2. Cách lấy mẫu
Theo Điều 2 của tiêu chuẩn này.
9.3. Chuẩn bị phòng thí nghiệm
9.3.1. Dụng cụ và thiết bị
Theo TCVN 2680 : 1978, Điều 1, 2.
9.3.2. Môi trường nuôi cấy, thuốc thử
Thạch thường (thạch nghiêng) chuẩn bị theo Phụ lục 1, Điều 36;
Canh thang thường chuẩn bị theo Phụ lục 1, Điều 17;
Thạch máu chuẩn bị theo Phụ lục 1, Điều 46;
Thạch T.T.C citrat chuẩn bị theo Phụ lục 1, Điều 34;
Thuốc nhuộm Gram chuẩn bị theo Phụ lục 1, Điều 42.
9.4. Tiến hành xác định (Hình 9)
Ly tâm hoặc lọc nước thải qua lọc Seitz lấy cặn. Dùng que cấy vi khuẩn lấy cặn để nuôi cấy vào các loại môi trường sau:
a) Cấy vào 1 đĩa thạch máu và 1 đĩa thạch T.T.C citrat. Để trong tủ ấm 37 °C. Sau 24 h, quan sát khuẩn lạc điển hình.
b) Dùng que cấy lấy khuẩn lạc cấy vào canh thang để tăng sinh và cấy vào 1 ống thạch nghiêng để trong tủ ấm 37 °C trong 24 h.
c) Làm phiền đồ, nhuộm gram, xem hình thể qua kính hiển vi.
9.5. Kết quả
a) Trên thạch T.T.C citrat, nuôi ở nhiệt độ 37 °C trong 24 h. Khuẩn lạc có màu đỏ nâu.
Trên thạch máu ở 37 °C trong 24 h khuẩn lạc màu xám, nhũn nhỏ, tan huyết ít và sinh sắc tố (môi trường có màu xanh).
b) Trên thạch nghiêng (Thạch thường) ở 37 °C trong 24 h khuẩn lạc mọc và có sắc tố màu xanh. Trực khuẩn 1 saudomonas Aeruginoza mọc trên các môi trường đều có sắc tố và có mùi thơm hắc.
c) Nhuộm Gram soi kính hiển vi: Trực khuẩn Ps.Aéruginoza.
Gram ẩm: Hình thể một que thẳng, hai đầu tròn.
Sơ đồ tìm trực khuẩn mủ xanh
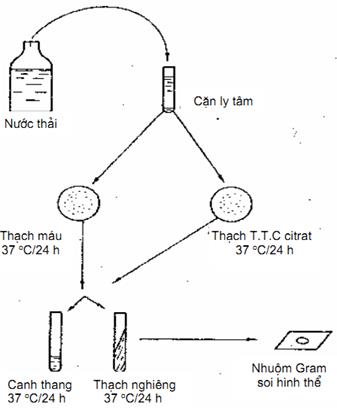
Hình 9
10. Xác định trực khuẩn thương hàn và phó thương hàn (salmonella typhi và salmonella para typhi)
10.1. Nguyên tắc
Dựa trên các đặc tính sinh hóa, trực khuẩn thương hàn và phó thương hàn A, B, C đều là động, không lên men đường lactoza. Trực khuẩn thương hàn không sinh hơi, các phó thương hàn đều sinh hơi.
10.2. Cách lấy mẫu
Theo Điều 2 của tiêu chuẩn này.
10.3. Chuẩn bị phòng thí nghiệm
10.3.1. Dụng cụ thí nghiệm và thiết bị theo TCVN 2680 : 1978 Điều 1, 2.
10.3.2. Môi trường nuôi cấy
Canh thang Rappaport chuẩn bị theo Phụ lục 1, Điều 21;
Thạch Leifson chuẩn bị theo Phụ lục 1, Điều 28;
Thạch Bismuth sunfit chuẩn bị theo Phụ lục 1, Điều 29;
Thạch Kligler chuẩn bị theo Phụ lục 1, Điều 30;
Thạch thường (nghiêng) chuẩn bị theo Phụ lục 1, Điều 36;
Nước muối sinh lý 8,5 ‰ chuẩn bị theo Phụ lục 1, Điều 2;
Kháng huyết thanh Salmonella đơn giá, đa giá.
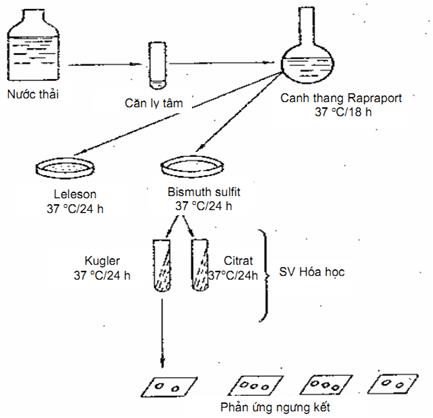
10.4. Tiến hành xác định (Hình 10).
Lọc qua lọc Seitz hay ly tâm, lấy cặn, cấy vào một bình canh thang Rappaport, nuôi ở nhiệt độ 37 °C (tủ ấm 37 °C). Sau 18 h, cấy từ canh thang Rappaport sang một đĩa thạch Leifson hay một đĩa thạch Bismuth sunfit nuôi ở tủ ấm 37 °C trong 24 h.
Sau 24 h quan sát khuẩn lạc. Trên môi trường Bismuth sunfit khuẩn lạc có màu đen, bẹt, ánh kim, xung quanh xám. Dùng que cấy lấy khuẩn lạc nghi ngờ, cấy sang thạch Kligler. Nuôi ở tủ ấm 37 °C trong 24 h.
Nếu trên thạch Kligler thấy sinh hơi, sinh H2S, di động, lactose âm tính thì làm tiếp phản ứng ngưng kết trên phiến kính với các kháng huyết thanh Salmonella.
b) Phản ứng ngưng kết với kháng huyết thanh KHT. Trên một lam kính ở hai đầu giỏ 1 giọt kháng huyết thanh đa giác 0. Salmonella và 1 giọt kháng huyết thanh vi đứng riêng rẽ; Dùng que cấy lấy khuẩn lạc nghi ngờ đã nuôi ở môi trường Kligler, làm ngưng kết, trộn đều với hai giọt kháng huyết thanh trên.
Nếu ngưng kết với kháng huyết thanh đa giác. Salmonella, và Vi, thì tiếp tục làm ngưng kết với kháng huyết thanh 0 của từng nhóm A, B, C, D, E và kháng huyết thanh H từng nhân tố.
- Nếu ngưng kết với kháng huyết thanh 0 nhóm D (9, 12); kháng huyết thanh H (d) và kháng huyết thanh Vi sẽ kết luận là Salmonella Typhi.
- Nếu ngưng kết với KHT/0, nhóm A (1, 2, 12) và a là Salmonella para typhi A;
- Nếu ngưng kết với KHT/0 nhóm B (1, 4, 5, 12) b và 1, 2 là Salmonella para typhi B;
- Nếu ngưng kết với KHT/0 nhóm C (6, 7) và c, 1,5 là Salmonella para typhi C.
c) Phản ứng sinh vật hóa học.
Phân loại Salmonella: cấy vào 2 loại môi trường sau đây để định loại Salmonella.
| Loại | Thạch Kligler | Sitrat | |||
| Di động | Sinh hơi | Lactose | H2S | ||
| Sal typhi Sal. paratyphi A Sal. paratyphi B Sal. paratyphi C | + + + + | - + + + | ± - - - | ± ± + + | ± - + + |
10.5. Kết luận
Căn cứ vào quá trình nuôi cấy phân lập, phản ứng sinh vật hóa học, phản ứng ngưng kết với kháng huyết thanh để kết luận.
Nếu không có kháng huyết thanh Salmonella, thì có thể căn cứ vào khuẩn lạc điển hình trên môi trường phân lập và phản ứng sinh vật hóa học để kết luận.
11. Tìm phagiơ đường ruột (entero phagiơ)
11.1. Nguyên tắc
Dựa trên đặc tính dung giải vi khuẩn đặc hiệu cực phagiơ trong môi trường nuôi cấy vi khuẩn để xác định gián tiếp các loại vi khuẩn có trong nước.
11.2. Cách lấy mẫu
Theo Điều 2 của tiêu chuẩn này.
11.3. Chuẩn bị phòng thử nghiệm
11.3.1. Dụng cụ thí nghiệm và thiết bị
Theo TCVN 2680 : 1978, Điều 1, 2.
11.4.2. Môi trường và các chủng vi khuẩn.
Canh thang thường chuẩn bị theo Phụ lục 1, Điều 17;
Thạch thường (đóng bình cầu) chuẩn bị theo Phụ lục 1, Điều 36;
Thạch mèn 7 ‰ hoặc 5 ‰ chuẩn bị theo Phụ lục 1, Điều 35;
Nước muối 8,5 ‰ chuẩn bị theo Phụ lục 1, Điều 2;
Chủng vi khuẩn các loại: E coli, B Salmonella, Shigella…
11.4. Phương pháp tìm một loại Phagiơ (Hình 11)
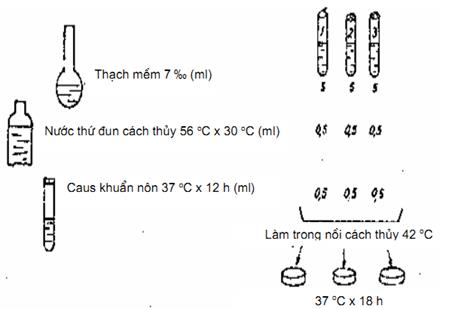
11.4.1. Cách tiến hành
Cấy chủng E. coli B vào cạnh thang thường (đóng ống 8 ml). Sau 12 h lấy canh khuẩn non để làm. Trước khi làm phải khử ngưng kết với kháng huyết thanh để xác định chủng mạnh hay yếu.
Sơ đồ xác định trực khuẩn thương hàn
Hình 10
Đun cách thủy nước thử, chừng 10 ml ở 56 °C + 50 °C trong 30 min.
Thạch thường đun cách thủy cho nóng chảy, rồi để nguội khoảng 45 °C đổ vào ba đĩa Petri mỗi đĩa chừng 10 ml, sau đó để vào tủ ấm vô khuẩn, mở hé hộp Petri cho khô mặt chạch. Hai đĩa dùng để tìm Phagiơ, một đĩa dùng để cấy chủng làm chứng. Trên một giá, xếp ba ống nghiệm vô khuẩn nhỏ cỡ 12 mm x 120 mm. Giá ống nghiệm được đặt trong nồi cách thủy có nhiệt độ ấm 42 °C.
Dùng ống hút riêng biệt.
Cho vào ống số một và ống số hai, mỗi ống:
Thạch mềm 7 ‰ 5 ml
Nước thải 0,5 ml
Canh khuẩn non E.coli B 0,5 ml
Cho vào ống số 3 (ống chứng):
Thạch mềm 7 ‰ 5 ml
Canh khuẩn non E.coli B 0,5 ml
Cho canh khuẩn vào sau cùng, lắc nhẹ ống nghiệm, sau đó đổ ngay ra đĩa thạch thường (mặt thạch phải khô). Láng đều khắp mặt thạch. Đợi thạch đông, mang để tủ ấm 37 °C, úp ngược hộp thạch.
11.4.2. Đọc kết quả
Sau 3 h + 18 h, Pha giơ sẽ mọc trên mặt thạch có chủng E.coli B tạo thành vòng vô khuẩn, tròn đều, trong suốt. Còn xung quanh là những khuẩn lạc vi khuẩn mọc đầy. Những vòng vô khuẩn do Phagiơ của E.coli B tạo nên gọi là Plaques hay Plaque là đơn vị sinh ra một vùng vô khuẩn, viết tắt là PFU (Plaque forming unit).
11.4.3. Tính kết quả
Đếm số Plaques ở trên hai đĩa thạch tổng số plaques trên hai đĩa thạch cấy 0,5 ml nước thải là số đơn vị plaques trong 1 ml (PFU/ml).
Ví dụ: đĩa một có 30 plaques
đĩa hai có 40 plaques
Như vậy trong 1 ml nước thải (đã thử) có 70 PFU (70 PFU/ml).
11.5. Phương pháp tìm nhiều loại phagiơ (Hình 12)
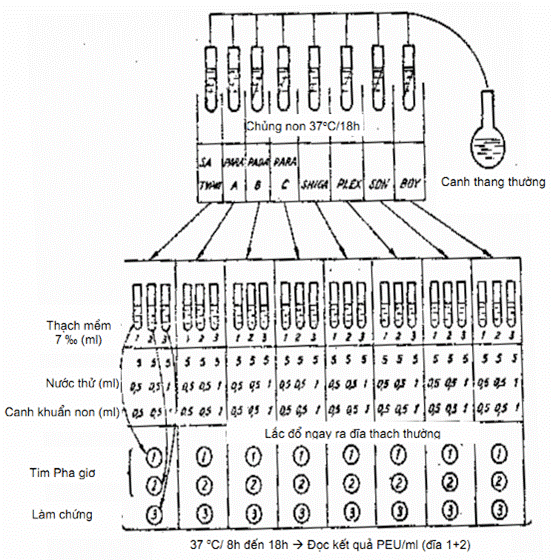
11.5.1. Tiến hành xác định
Cấy các chủng vi khuẩn đường ruột: Salmonella Typhi; Salm.para A; Salm.para B; Salm.para C; Shigella Shiga; Flexner; Sonnei Boydii, mỗi chủng vào một ống canh thang thường, sau 8 h đến 12 h lấy canh khuẩn non để làm (cần chọn các chủng có hoạt lực mạnh).
Nếu làm nhiều mẫu nước một lúc thì cấy các chủng sang thạch nghiêng, để tủ ấm 37 °C trong 18 h. Sau đó lấy các ống chủng ra cho vào mỗi ống 10 ml canh thang thường, dùng tay lăn nhẹ vòng tròn để khuẩn lạc trên mặt thạch nghiêng bong ra. Như vậy sẽ được canh khuẩn của các chủng đã nuôi cấy.
Đun cách thủy mẫu thử (nước thải) ở nhiệt độ 56 °C + 60 °C trong 30 min. Thạch thường đun cách thủy cho tan hết, rồi để nguội tới 45 °C, đổ vào các đĩa Petri, tính đủ số đĩa. Ví dụ: tìm 8 loại Phagiơ đường ruột, thì mỗi một mẫu nước cần 24 đĩa thạch.
Xếp các ống nghiệm vô khuẩn, nhỏ, cỡ 12 mm x 120 mm vào giá, xếp làm ba hàng. Dùng chì viết kính ghi số mẫu thử.
Hàng thứ nhất :8 ống tìm Phagiơ
Hàng thứ hai :8 ống tìm Phagiơ
Hàng thứ ba : 8 ống làm chứng.
Giá ống nghiệm được đặt trong nồi cách thủy có nhiệt độ ấm 42 °C. Dùng các ống hút riêng biệt. Cho vào hàng thứ nhất và hàng thứ hai, mỗi ống:
Thạch mềm 7 ‰ 5 ml
Nước thải 0,5 ml
Canh khuẩn non từng loại 0,5 ml
Cho vào hàng thứ ba, mỗi ống:
Thạch mềm 7 ‰ 5 ml
Canh khuẩn non từng loại 0,5 ml
Cho canh khuẩn vào sau cùng, lắc đều, sau đó đổ ngay ra đĩa thạch thường, đợi thạch mềm đông lại, mang để tủ ấm 37 °C, từ 8 h + 18 h, úp ngược hộp thạch.
11.5.2. Đọc kết quả
Sau 8 h đến 18 h, trên mặt thạch có các chủng, nếu các Phagiơ tương ứng sẽ tạo thành vòng vô khuẩn tròn đều, trong suốt, xung quanh là những khuẩn lạc mọc đầy (vòng vô khuẩn gọi là Plaque PFU). Các đĩa thạch làm chứng thì chỉ có những khuẩn lạc của vi khuẩn.
11.5.3. Tính kết quả.
Đếm số Plaques ở từng cặp đĩa thạch hàng thứ nhất và hàng thứ hai. Tổng số Plaques của hai đĩa hàng thứ nhất và hàng thứ hai là số Plaques của một loại Phagiơ tương ứng với các vi khuẩn trên, có trong
1 ml nước thải (PFU/ml).
Sơ đồ tìm một loại phagiơ
Hình 11
Sơ đồ tìm nhiều loại phagiơ
Hình 12
Phụ lục 1
Dung dịch thuốc thử và môi trường nuôi cấy vi khuẩn
1. Nước cất một lần và hai lần
Dùng để pha chế thuốc thử, dung dịch và môi trường.
Đóng nước cất vào các bình 1 000 ml, 500 ml, 100 ml v.v… Hấp vô khuẩn 120 °C trong 20 min. Các bình chai đóng nước cất đều được rửa sạch sấy khô. Nước cất để pha môi trường thì không cần đóng gói hấp vô khuẩn và chỉ cần nước cất một lần, vì làm môi trường còn qua các giai đoạn lọc, sấy, hấp.
2. Nước muối sinh lý
Dùng để pha chế các mẫu thử ra các độ loãng.
| Công thức: | Muối tinh khiết | 8,5 g |
|
| Nước cất | 1 000 ml |
Lọc qua giấy lọc, đóng vào các bình, chai 500 ml, 200 ml… hấp vô khuẩn 120 °C trong 20 min.
3.Dung dịch Fucsin basic 3 %
Công thức: Fucsin basic 3 g
Rượu etylic hoặc cồn 900 100 ml.
Hòa tan 3 g fucsin basic trong cồn, để tủ ấm 37 °C + 40 °C trong nhiều giờ, lọc qua giấy lọc, dùng dần.
4. Dung dịch natri sunfit 20 %.
| Công thức: | Natri sunfit khan (Na2SO3) | 20 g |
|
| Nước cất vô khuẩn | 80 ml. |
Cân đong theo công thức trên, hòa tan 20 g natri sunfit dùng đũa thủy tinh quấy đều. Cách thủy 15 min. Chỉ pha trước khi dùng.
5. Dung dịch sunfat sắt 5 %.
| Công thức: | Amoni sunfat sắt | 5 g |
|
| Nước cất vô khuẩn | 95 ml |
Hòa tan 5 g amonium sunfat sắt trong 95 ml nước cất vô trùng quấy lắc cho tan đều, không cần cách thủy, đựng trong chai màu, dùng dần.
6. Dung dịch đỏ trung tính 1 %
| Công thức: | Đỏ trung tính | 1 g |
|
| Nước cất | 100 ml |
Cân đong theo công thức trên, lắc đều cho hòa tan, dùng làm chỉ thị màu, trong một số môi trường nuôi cấy vi khuẩn.
7. Dung dịch đỏ Fenola 0,2 %
| Công thức: | Đỏ fenola | 0,2 g |
|
| Nước cất | 100 ml |
Hòa tan 0,2 g đỏ fenola trong 100 ml nước cất, lắc đều. Dung dịch đỏ Fenola dùng trong một số môi trường nuôi cấy vi khuẩn.
8. Dung dịch lục sáng 1 %
| Công thức: | Lục sáng vert brillant | 1 g |
|
| Nước cất | 100 ml |
Hòa tan 1g lục sáng trong 100ml nước cất, để ở nhiệt độ 40 °C trong một ngày, lọc qua giấy lọc dùng dần để pha môi trường nuôi cấy vi khuẩn.
9. Thuốc thử Fthylic kowac
| Công thức: | Para dimetylaminobenzandehit | 5 g |
|
| Rượu izoamilic | 75 g |
|
| Axit clohidric | 25 g |
Cân đong theo công thức trên, hòa tan 5 g para dimetylamunobenzandehit trong rượu izoamilic. Cho axit clohidric từ từ. Thuốc thử đựng trong chai màu, dùng dần.
10. Thuốc thử phản ứng cytochron oxydasa
| Công thức: | Tetrametin penin diaminhidroclorit | 0,1 g |
|
| Natri thiosufat DAB7 | 0,02 g |
|
| Trilon B | 0,01 g |
|
| Nước cất | 10 ml |
Cân đong theo công thức trên, hòa tan trong nước cất, bảo quản ở độ lạnh 4 °C. Đựng trong chai màu, dùng để thử phản ứng dương tính với Pseudomonas aerugimona cho màu xanh lam.
11. Nước thịt
Nước thịt là một trường cơ sở để chế các môi trường khác.
| Công thức: | Thịt bò (hoặc trâu) | 500 g |
|
| Nước máy | 1 000 ml |
Cách làm: Thịt lạng hết mỡ, gân, thái nhỏ, xay, đem cân đong theo công thức trên. Để tủ lạnh + 4 °C trong 12 h đến 15 h. Sau đó đun nhỏ lửa 60 °C trong 1 h. Đun sôi tiếp trong 1 h. Dùng đũa khuấy đều khi đun, đủ thời gian thì tắt lửa, để nguyên ở nhiệt độ thường cho lắng cặn. Dùng ống hút cao su hút phần nước trong ở trên, đóng vào các bình, chai, hấp vô khuẩn, 120 °C trong 20 min.
Nếu nước thịt lắng không tốt, thì phải lọc bằng giấy lọc hoặc bằng bông có bọc vải gạo.
12. Nước dạ dày 30 % (Pepton Martin)
| Công thức: | Dạ dày lợn xay (hoặc thái nhỏ) | 300 g |
|
| Nước cất nóng 50 °C Axit clohidric P | 1 000 ml 10 ml |
Cách làm: Dạ dày lợn tươi (không bị ôi chua). Mở nước nhỏ rửa sạch, tránh mở vòi nước mạnh sẽ mất đi dịch vị, để ráo nước lọc hết mỡ ở đường cong dạ dày, thái từng miếng nhỏ cho vào cối xay. Nếu đủ lượng theo công thức trên, cho vào chậu thủy tinh hoặc chậu sành, sứ, cho nước ấm một ít vào quấy đều, dùng đũa thủy tinh, hoặc dùng đũa tre quấy đều.
Mang để tủ ấm 56 °C trong 24 h. Trong 6 h đầu, mỗi giờ quấy lên một lần.
Sau 24 h, thủy phân, đem đun ở ngọn lửa nhẹ 80 °C. Hớt mỡ nổi ở trên bỏ đi. Khi tới 80 °C thì không đun nữa để ở nhiệt độ thường trong 18 h. Để lắng cặn, hôm sau dùng ống cao su hút nước trong ở trên, Điều chỉnh pH 7,2 đến 7,4. Đóng vào các chai 1 000 ml, 500 ml. Hấp vô khuẩn 120 °C trong 20 min.
13. Pepton thường
Công dụng: Nuôi cấy các vi khuẩn thông thường và thử phản ứng Indol
| Công thức: | Nước dạ dày 30 % | 1 000 ml |
|
| Nước tinh khiết | 5 g |
Cách làm: Điều chỉnh đến pH 7,2 đến 7,4 đong vào các ống nghiệm 16 mm x 100 mm mỗi ống 5 ml.
Đóng nút bông không thấm nước và bọc đầu ống nghiệm đã nút bông bằng giấy dầy. Xếp vào hộp hay giá có lỗ thông thoáng đem hấp vô khuẩn ở 120 °C trong 20 min.
| Công thức: | Pepton bột | 20 g |
|
| Muối tinh khiết | 5 g |
|
| Nước cất | 1 000 ml |
Cách làm: Điều chỉnh pH 7,2 đến 7,4. Lọc qua giấy lọc, đóng vào các ống nghiệm 16 mm x 1160 mm mỗi ống 5 ml. Đóng nút bông không thấm nước và bọc đầu ống nghiệm đã nút bông bằng giấy dầy. Hấp vô khuẩn ở 120 °C trong 20 min.
14. Pepton Lactoza đặc
Công dụng: Nuôi cấy tìm E.coli trong nước
| Công thức: | Pepton bột (bactopepton) | 30 g |
|
| Lactoza | 10 g |
|
| Muối tinh khiết | 10 g |
|
| Nước cất | 1 000 ml |
Cách làm: Điều chỉnh pH 7,2 đến 7. Lọc qua giấy lọc, đóng ống 18 mm x 180 mm có ống sinh hơi Durham. Hấp vô khuẩn ở 120 °C trong 20 min.
15. Pepton lactoza 10 % lục sáng.
Công dụng: Nuôi cấy tìm E.coli trong nước
| Công thức: | Pepton bột (Bacto pepton) | 10 g |
|
| Lactoza | 20 g |
|
| Muối tinh khiết | 5 g |
|
| Nước cất | 1 000 ml |
|
| Dung dịch đỏ trung tính 1 % | 20 ml |
Cách làm: Cân đong theo công thức trên quấy đều, Điều chỉnh đến pH 7. Lọc qua giấy lọc, đong vào ống nghiệm 166 ml hoặc 18 ml, mỗi ống 10ml có ống sinh hơi. Hấp vô khuẩn ở nhiệt độ 120 °C trong 20 min.
17. Canh thang thường
Công dụng: dùng để pha chế các môi trường khác, và dùng để nuôi cấy tìm các loại vi khuẩn, trực khuẩn, tụ cầu khuẩn, liên cầu khuẩn.
| Công thức 1: | Nước thịt | 500 ml |
|
| Nước dạ dày 30 % | 500 ml |
|
| Muối tinh khiết | 5 g |
| Công thức 2: | Nước thịt | 1 000 ml |
|
| Pepton bột | 10 g |
|
| Muối tinh khiết | 5 g |
Cách làm: cân đong lượng nước thịt và nước dạ dày (hoặc pepton bột) cho muối tinh khiết (NaCl) đủ theo công thức, Điều chỉnh pH bằng dung dịch natri hidroxit NaOH 40 %. Đóng vào chai hấp lắng cặn ở 120 °C trong 30 min pH phải đạt 7,8 đến 8 để khi hấp lắng cặn, pH sẽ tụt xuống từ 0,2 đến 0,4 là đúng độ pH yêu cầu cuối cùng 7,4.
Sau khi hấp lắng cặn xong thì tiến hành đóng ống nghiệm loại 16 mm x 160 mm. Dùng giây cao su, hút phần nước trong ở trên cho sang bình khác để cho vào ống nghiệm mỗi ống khoảng 8 ml. Sau đó đem hấp vô khuẩn 120 °C trong 20 min.
18. Canh thang lactoza 1 %
Công dụng: Nuôi cấy tìm E.coli trong nước, xem tính chất lên men dùng lactoza và sinh hơi.
| Công thức 1: | Nước thịt | 500 ml |
|
| Nước pepton 30 % | 500 ml |
|
| Lactoza | 10 g |
| Công thức 2: | Canh thang thường | 1 000 ml |
|
| Lactoza | 10 g |
Điều chỉnh pH và cho vào ống nghiệm 16 mm x 160 mm mỗi ống 10 ml, có ống sinh hơi, hấp vô khuẩn ở 110 °C trong 20 min.
| Công thức 3: | Cao thịt | 3 g |
|
| Pepton bột | 10 g |
|
| Lactoza | 10 g |
|
| Nước cất | 1 000 ml |
Đun nhỏ lửa lọc qua giấy lọc, Điều chỉnh pH đến 7. Cho vào các ống nghiệm mỗi ống 10 ml, có ống sinh hơi. Hấp vô khuẩn ở 110 °C trong 20 min.
19. Canh thang Lactoza axit boric
Công dụng: Nuôi cấy tìm E.coli trong nước.
| Công thức 1: | Canh thang thưởng | 1 000 ml |
|
| Lactoza | 10 ml |
|
| Axit boric | 3 g |
|
| Dung dịch lục sáng 1% | 1 ml. |
Cân đong theo công thức trên hòa đều, phân phối vào các ống nghiệm 16 mm x 160 mm mỗi ống 10 ml, có ống sinh hơi, hấp vô khuẩn 110 °C trong 20 min.
| Công thức 2: | Cao thịt | 3 g |
|
| Pepton bột | 10 g |
|
| Lactoza | 10 g |
|
| Axit boric | 3 g |
|
| Nước cất | 1 000 ml |
|
| Dung dịch lục sáng 1% | 1 ml. |
Cân đong theo công thức trên, Điều chỉnh pH cuối cùng yêu cầu bằng 7, đun ở ngọn lửa nhẹ, lọc qua giấy lọc, phân phố vào các ống nghiệm mỗi ống 10 ml, có ống sinh hơi, hấp vô khuẩn ở 110 °C trong 20 min.
20. Canh thang lactoza đỏ trung tính
Công dụng: Nuôi cấy tìm vi khuẩn E.coli trong nước
| Công thức: | Canh thang thường | 1 000 ml |
|
| Lactoza | 20 g |
|
| Dung dịch đỏ trung tính 1% | 20 ml |
Điều chỉnh pH đến 7, lọc qua giấy lọc, cho vào ống nghiệm 16 mm x 160 mm mỗi ống 10 ml, hoặc hình cầu 50 ml, 100 ml. Hấp vô khuẩn ở 110 °C trong 20 min.
21. Canh thang Eappaporit
Công dụng: Nuôi cấy, tăng sinh trực khuẩn Samonella
| Công thức: | Pepton Muối tinh khiết | 5 g 8 g |
|
| Kali dihidrophotphat | 1,6 g |
|
| Megie clorua Lục malachit | 40,0 g 0,12 g |
|
| Nước cất | 1 000 ml |
Cân đong theo công thức trên, hòa tan, lọc qua giấy lọc, Điều chỉnh đến pH cuối cùng là 7. Đóng vào các ống nghiệm 10 ml hoặc đóng bình cầu 50 ml đến 100 ml. Hấp vô khuẩn ở 110 °C trong 20 min.
| Công thức 2: | Dung dịch A |
| ||
|
| Pepton | 59 g | ||
|
| Natri clorua | 95 g | ||
|
| Kali dihidrophotphat | 19 g | ||
|
| Nước cất | 1 000 ml | ||
|
| Lọc qua giấy lọc |
| ||
|
| Dung dịch B |
| ||
|
| Magiê clorua | 425 g | ||
|
| Nước cất | 1 000 ml | ||
|
| Dung dịch C |
| ||
|
| Lục xẫm | 1,3 g | ||
|
| Nước cất | 100 ml | ||
Ba dung dịch trên hấp vô khuẩn 110 °C trong 20 min, bảo quản ở tủ lạnh khi dùng thì pha ra các dung dịch sau:
Dung dịch A. C đậm đặc
|
| Dung dịch A | 90 ml |
|
| Dung dịch C | 10 ml |
Dung dịch A.C loãng
|
| Dung dịch A | 90 ml |
|
| Dung dịch C | 10 ml |
|
| Nước cất vô khuẩn | 1 000 ml |
22. Môi trường thạch thường
Công dụng: Nuôi cấy vi khuẩn và pha chế ra nhiều môi trường khác.
| Công thức 1: | Nước thịt | 500 ml |
|
| Nước dạ dày 30% | 500 ml |
|
| Muối tinh khiết | 5 g |
|
| Thạch sợi agar | 25 g |
Cách làm: Cân đong theo công thức, trừ thạch. Điều chỉnh pH 7,4 đến 7,6, cho vào nồi nhôm. Thạch đã rửa sạch cho vào khăn vải vắt khô, cho tiếp vào. Hấp lắng cặn 120 °C trong 30 min. Khi lò nguội, lấy thạch ra, để đông hẳn cắt bỏ phần cặn ở đáy. Đun cách thủy phần thạch trong cho tan dần. Kiểm tra lại độ pH theo yêu cầu. Lọc qua vải lọc, bằng nhiều lớp gạo, rồi đóng vào các bình và ống nghiệm. Hấp vô khuẩn ở 110 °C trong 20 min.
23. Môi trường thạch endo
Công dụng: Nuôi cấy tìm vi khuẩn đường ruột. Khuẩn lạc coli phân, có ánh kim.
| Công thức: | Thạch thường | 100 ml |
|
| Lactoza | 1 g |
|
| Dikali photphat | 0,34 g |
|
| Natri sunfit khan | 0,25 g |
|
| Fucsin basi 4 % | 1 ml |
Cách làm: Cân đong theo công thức trên, cách thủy 1 h. Cho tan đều để nguội 45 °C đến 50 °C. Đổ đĩa Petri chừng 10 ml mỗi đĩa.
24. Môi trường thạch Glucoza sunfit (Wilson - Blair cải tiến)
Công dụng: Nuôi cấy tìm vi khuẩn Clostridium Perfringen trong nước
| Công thức: | Thạch thường 30 % | 100 ml |
|
| Glucoza | 2 g |
|
| Natri sunfit khan | 2 g |
|
| Dung dịch phèn sắt 5 % | 1 ml |
Cách làm: Thạch thường đun nóng chảy, cách thủy cho tan đều. Hòa tan Glucoza và Natri sunfit trong một ít nước rồi cho vào bình thạch trên lắc đều. Sau cùng cho phèn sắt. Phân phối vào các ống nghiệm 18 mm x 180 mm. Mỗi ống 10 ml đóng nút và bọc giấy dầy đầu ống. Xếp vào giỏ sấy hấp và hấp vô khuẩn ở 110 °C trong 20 min.
Chú thích Natri sunfit không để lâu được chỉ pha trước khi dùng.
25. Môi trường lỏng H.P đậm đặc (của Hajna và Perry)
Công dụng: Nuôi cấy tìm liên cầu khuẩn đường ruột trong nước
| Công thức: | Pepton bột | 40 g |
|
| Glucoza | 10 g |
|
| Photphat monopotaxic | 3 g |
|
| Natri axit | 1 g |
|
| Tìm bromocrésola | 0,064 g |
|
| Nước cất | 1 000 ml |
Cách làm: Cân đong theo công thức, hòa tan ở ngọn lửa nhẹ. Điều chỉnh pH 6,9 đến 7. Lọc qua giấy lọc, phân phối vào các ống nghiệm 18 mm x 180 mm, mỗi ống 10 ml. Đóng nút và bọc giấy đầu ống. Hấp vô khuẩn 110 °C trong 20 min.
26. Môi trường lỏng H.P loãng
| Công thức: | Pepton bột | 20 g |
|
| Glucoza | 10 g |
|
| Photphat bipotaxic | 4 g |
|
| Photphat monopotaxic | 1,5 g |
|
| Natri axit | 0,5 g |
|
| Tìm bromocresola | 0,032 g |
|
| Nước cất | 1 000 ml |
Cách làm: Như môi trường H.P đậm đặc.
Nếu không có pepton bột, thì dùng pepton Martin 30 % - 1 000 ml, theo công thức trên và không cho nước cất.
27. Môi trường Natri azit (Môi trường Slanetz và Bartley)
Công dụng: Nuôi cấy phân lập liên cầu khuẩn đường ruột đặc hiệu.
| Công thức: | Tryptoza Cao thịt Dextroza | 20 g 5 g 2 g |
|
| Dinatri hidrophotphat Natri azit | 4 g 0,4 g |
|
| Tétrazolium clorua Thạch agar bột | 0,1 g 10 g |
|
| Nước cất | 1 000 ml |
Đun nóng, lọc, Điều chỉnh pH 7,2 đến 7,4. Cho natri azit vào sau cùng. Hấp vô khuẩn ở 120 °C trong 20 min.
| Công thức 2: | Thạch thường | 1 000 ml |
|
| Dextroza | 4 g |
|
| Dikali hidrophotphat | 8 g |
|
| Triphenintétrasoliumclorit | 0,8 g |
|
| Natri azit | 0,4 g |
Cách thủy đun tan ở nhiệt độ 80 °C trong 1 h pH 7,2 đến 7,6. Cho natri azit sau cùng. Khi dùng thì đun cách thủy lại, tan đều để nguội 45 °C, đổ ra đĩa petri 10 ml.
28. Môi trường thạch leifson
Công dụng: Nuôi cấy tìm trực khuẩn thương hàn
Công thức: Theo công thức môi trường khô đóng gói sẵn.
|
| Cao thịt | 5 g |
|
| Pepton | 5 g |
|
| Lactoza | 10 g |
|
| Natri xitrat | 6 g |
|
| Natri thiosunfat | 5,4 g |
|
| Amoni xitrat sắt | 1,0 g |
|
| Natri dezoxicolat | 3,0 g |
|
| Đỏ trung tính | 0,62 g |
|
| Thạch agar bột | 12,00 g. |
Cân đong 47,5 g môi trường khô trên, pha trong 1 l nước cất. Đun trên ngọn lửa nhẹ hoặc để ở nơi cách thủy 15 min, khuấy nhẹ đo và Điều chỉnh pH ở nhiệt độ 37 °C. Đong vào bình cầu, hấp vô khuẩn ở 110 °C trong 20 min.
Khi dùng, cách thủy bình cầu môi trường, cho tan, đổ đĩa petri 10 ml mỗi đĩa để nuôi cấy phân lập vi khuẩn thương hàn.
29. Môi trường thạch bitmut sunfit
Công dụng: Nuôi cấy tìm trực khuẩn thương hàn. Tác dụng kìm hãm hầu hết các vi khuẩn khác, trừ vi khuẩn thương hàn (salmonella), khuẩn lạc Salmonella mọc tốt, chấm đen ở giữa, bẹt, ánh kim.
| Công thức: | Thạch thường | 1 000 ml |
|
| Glucoza | 5 g |
|
| Dinatri hidrophotphat | 4 g |
|
| Bitmut sunfit | 8 g |
|
| Sắt (II) sunfat | 0,3 g |
|
| Dung dịch lục sáng 2,5% | 1 ml |
Đun tan chảy trong 40 min. Khi dùng đổ đĩa Petri 1 ml cho mỗi đĩa. Để tủ lạnh được 2 ngày.
30. Thạch Kligler
Công dụng: Để phân lập các vi khuẩn đường ruột, xem tính chất lên men sinh hơi, sinh H2S và tính chất di động hay không.
| Công thức 1: | Cao thịt | 3 g |
|
| Pepton | 20 g |
|
| Chiết xuất men (men bia) | 3 g |
|
| Muối tinh khiết | 5 g |
|
| Thạch agar bột | 12 g |
|
| Nước cất | 1 000 ml |
Hấp vô khuẩn rồi cho vào các chất sau đây:
|
| Lactoza | 10 g |
|
| Glucaza | 1 g |
|
| Sắt (II) sunfat (Fe2SO4) | 0,3 g |
|
| Natri hiposunfit | 0,3 g |
|
| Phenola đỏ | 0,025 g |
|
| pH cuối cùng | 7,4 |
Hấp cách thủy trong 30 min. Đóng ống nghiệm nhỏ 12 mm x 120 mm cho ống thạch có 2 phần: phần dưới cao đứng, chừng 2,5 cm phần trên nghiêng mặt thạch.
| Công thức 2: | Thạch thường | 500 ml |
|
| Canh thang thường | 500 ml |
|
| Lactoza | 10 g |
|
| Glucoza | 1 g |
|
| Sắt (II) sunfat (Fe2SO4) | 0,3 g |
|
| Natri hiposunfit | 0,3 g |
|
| Phenola đỏ | 0,025 g |
|
| pH cuối cùng | 7,4 |
Hấp cách thủy trong 30 min. Đóng ống nghiệm nhỏ như trên.
31. Canh thang lục xám
Công dụng: Nuôi cấy tăng sinh vi khuẩn Pseudomonas
| Công thức: | Pepton | 5 g |
|
| Cao thịt | 3 g |
|
| Dung dịch lục xẫm 1,3% | 8 ml |
|
| Nước cất | 1 000 ml |
Pepton và cao thịt hòa vào 1 l nước cất, đun tan trong 1 h sau đó Điều chỉnh pH bằng axit clohidric (HCl) và Natri hidroxit (NaOH) đến 7,3 đến 7,4. Sau cùng cho dung dịch lục xám (vert Malichit) 1,3 % đóng ống 10 ml, 50 ml, 100 ml theo yêu cầu công tác nuôi cấy. Hấp vô khuẩn ở 120 °C trong 20 min.
32. Canh thang PSEUDO
Công dụng: Nuôi cấy tang vi sinh vi khuẩn Pseudomonas
| Công thức: | Canh thường | 500 ml |
|
| Kristal violet 0,1 % | 3 ml |
Cách thủy 50 °C cho tan đều, sau cho:
|
| Kali tetathionát | 12 g |
|
| pH cuối cùng | 7,2. |
Đóng vào các bình cầu, ống nghiệm theo yêu cầu: 100 ml, 50 ml, 10 ml. Hấp vô khuẩn ở 120 °C trong 20 min.
33. Canh thang selenit
Công dụng: Nuôi cấy tăng sinh vi khuẩn Pseudomonas và Salmonella.
| Công thức: | Pepton | 5 g |
|
| Natri selenit (khan) | 4 g |
|
| Lactoza | 4 g |
|
| Kali dihidrophotphat | 10 g |
|
| Nước cất | 1 000 ml |
Cân đong theo công thức trên, hòa tan ở ngọn lửa nhẹ, pH cuối cùng 7 ± 0,3. Cho vào các bình cầu và ống nghiệm 18 mm x 180 mm và hấp ướt ở nhiệt độ 100 °C trong 20 min.
CHÚ THÍCH: Môi trường này có đóng gói sẵn ở dạng bột khô của các hãng sản xuất nước ngoài. Khi dùng thì cân đong theo công thức chỉ dẫn.
34. Môi trường T.T.c Xitrat (Abdou - 1972)
Công dụng: Nuôi cấy phân lập vi khuẩn Pseudomonas
| Công thức: | Pepton | 20 g | |
|
| D.L. Alanin | 2 g | |
|
| Natri xitrat | 10 g | |
|
| Kali sunfat (K2SO4) | 8,6 g | |
|
| Kali clorua (KCl) | 1,4 g | |
|
| Magiê sunfat (MgSO4. 7H2O) | 1,4 g | |
|
| Triphenyltetrasolium clorit | 2 g | |
|
| Thạch bột (agar) | 15 g | |
|
| Nước cất | 1 000 ml | |
Cân đong theo công thức trên. Hòa tan các chất trên, trừ triphenyltetrasolium clorit (T.T.C) thì cho sau cùng pH cuối cùng là 7,2. Hấp vô khuẩn 120 °C trong 20 min sau khi đóng vào các bình cầu. Hấp xong, cho thêm T.T.C và hấp cách thủy lại trong 15 min.
35. Thạch nền 5 %
Công dụng: Nuôi cấy phân lập các vi khuẩn, tìm tính di động.
| Công thức: | Thạch thường 25 ‰ | 100 ml |
|
| Canh thang thường | 400 ml |
|
|
|
|
Hấp cách thủy 100 °C trong 1 h hoặc hấp 110 °C trong 30 min.
36. Thạch nghiêng (thạch thường)
Công dụng: Nuôi cấy phân lập vi khuẩn
Công thức và cách làm: Thạch thường đun nóng chảy cho tan đều đổ vào các ống nghiệm 18 mm x 180 mm, mỗi ống khoảng 15 ml không cho dính vào miệng ống. Cho vào lò hấp vô khuẩn ở 110 °C trong 20 min. Lấy các giá thạch ra khi còn nóng để nghiêng theo yêu cầu. Chờ thạch đông xếp ống đứng thẳng ống thạch sẽ thành thạch nghiên vững chắc.
37. Nước pepton mặn 30 %
Công dụng: Phân lập phẩy khuẩn tả
| Công thức: | Pepton | 20 g |
|
| Muối tinh khiết | 30 g |
|
| Nước cất | 1 000 ml |
Nếu không có pepton bột thì dùng pepton martin (nước dạ dày 30 % - 1 000 ml).
Hỗn hợp đun tan, Điều chỉnh pH 8,8 đến 9, đóng vào các bình, chai và hấp 120 °C trong 30 min để dự trữ dùng dần.
Khi dùng đóng ống nghiệm 16 mm x 160 mm, 8 mm đóng nút bông không thấm nước, bọc đầu bằng giấy. Đem hấp vô khuẩn 110 °C trong 25 min.
38. Môi trường chizna
Công dụng: Nuôi cấy phân lập phẩy khuẩn tả.
| Công thức: | Thạch thường | 1 000 ml |
|
| Magiê clorua (MgCl2.6H2O) | 1 g |
|
| Kali nitrat (KNO3) | 1 g |
|
| Kali telurit 1 % | 3 ml |
|
| Axit rosalic 0,5 % | 10 ml |
|
| Anidon 5 % | 100 ml |
Bình thạch thường 25 % đã có sẵn, cho magie clorua, kali nitrat, asilon 5 % vào. Đun cách thủy lắc đều, để nguội tới 30 °C đến 40 °C thì cho kali telurit 4 % và axit rosalic. Lắc đều, đổ ra đĩa Petri mỗi đĩa chừng 10 ml đến 15 ml. Môi trường có màu hồng.
Phẩy khuẩn tả có thể mọc sớm từ 10 h đến 12 h, khuẩn lạc tả màu đen có quầng trắng.
39. Môi trường pepton mặn 10 %
Công dụng: tăng sinh cầu khuẩn đường ruột và tự cầu khuẩn
| Công thức: | Pepton | 15 g |
|
| Muối tinh khiết | 100 g |
|
| Nước cất | 1 000 ml |
Cân đong theo công thức trên lọc qua giấy lọc, đóng vào bình cầu, ống nghiệm. Hấp vô khuẩn 110 °C trong 20 min. Độ pH cuối cùng là: 7,4.
40. Môi trường thạch chapkann
| Công thức: | Thạch thường | 1 000 ml |
|
| Muối tinh khiết | 70 g |
|
| Đường manit | 10 g |
|
| Fenola đỏ | 0,025 g |
Cân đong các thứ trên cho vào bình thạch thường, đem hấp vô khuẩn 110 °C trong 15 min hoặc cách thủy trong 30 min. Độ pH cuối cùng là 7,4. Mối trường có màu đỏ da cam. Khi dùng thì cách thủy lại, và đổ đĩa Petri mỗi đĩa 10 ml.
41. Môi trường tín tinh thể (violet cristallisee)
Công dụng: Nuôi cấy phân lập tụ cầu khuẩn và kiểm tra xem tính chất khuẩn lạc tụ cầu.
| Công thức: | Thạch thường 5 % | 100 ml |
|
| Tím tinh thể 1/300 000 | 10 ml |
Đun tan chảy thạch thường, rồi cho thêm dung dịch tím tinh thể 1/300 000, lắc đều. Khi dùng thì đổ đĩa Petri mỗi đĩa 10 ml.
42. Dung dịch nhuộm gram
+ Dung dịch gentian violet (tím Gentian):
| Tím Gentian | 1 g |
| Rượu eltylic (cồn 900) | 10 ml |
| Axit fenic (kết tinh) | 2 g |
| Nước cất | 100 ml |
+ dung dịch Lugol:
| Iot kim loại | 1 g |
| Kali iodua | 2 g |
| Nước cất | 200 g |
+ Dung dịch fucsin 1/10:
- Fucsin fenic đặc
| Fucsin kiềm | 1 g |
| Rượu etylic (cồn 900) | 10 ml |
| Axit fenic | 5 g |
| Nước cất | 100 ml |
Pha ra:
- Fucsin 1/10
| Fucsin fenic đặc | 10 ml |
| Nước cất | 90 ml |
43. Dung dịch bảo quản phẩy khuẩn tả
Công dụng: bảo quản bệnh phẩm nghi có phẩy khuẩn tả.
| Công thức: | Axit boric | 3,1 g |
|
|
| Natri clorua | 20 g |
|
|
| Kali clorua | 3,75 g |
|
|
| Natri hidroxit | 133,5 g | pH: 8,5 |
|
| Nước cất | 1 000 ml |
|
Cách làm: Cân đong theo công thức trên. Hòa tan axit boric và kali clorua trong 20 ml nước cất ấm. Sau đó cho nước cất dần dần vào cho vừa đủ, 100 ml. Lọc qua giấy lọc sau đó cho vào ống nghiệm 18 mm x 180 mm mỗi ống 10 ml. Hấp vô khuẩn 110 °C trong 30 min.
44. Dung dịch bảo quản vi khuẩn lỵ và thương hàn
Công dụng: dung dịch bảo quản shighella và salmonella.
| Công thức: | Nước cất | 750 ml |
|
| Glyxêrin | 250 ml |
|
| Muối tinh khiết | 5 g |
|
| Photphat monopotaxic | 1 g |
|
| Photphat bipotaxic | 3,1 g |
|
| pH cuối cùng: | 7,2 đến 7. |
Cách làm: Hỗn hợp đun tan, Điều chỉnh pH 7,4 đến 7,6 lọc qua giấy lọc đóng vào các chai, bình ống nghiệm. Hấp vô khuẩn trong 30 min.
45. Môi trường Bapsikow
Công dụng: Môi trường có chỉ thị màu, dùng trong nuôi cấy vi khuẩn, thử phản ứng sinh vật hóa học để phân biệt các loại vi khuẩn hiếu khí, khi lên men đường sẽ làm chuyển màu: từ xanh sang vàng.
| Công thức: | Pepton | 15 g |
|
| Muối tinh khiết | 6 g |
|
| Dinatri photphat | 6 g |
|
| Natri hidroxit (NaOH) 20% | 6 ml |
|
| Nước cất | 1 000 ml |
|
| Dung dịch bromothymol |
|
|
| Xanh 1,5 % (pha trong cồn) | 6 ml |
|
| pH cuối cùng: | 7,4 đến 7,5. |
Cách làm: Cân đong theo công thức, riêng natri hidroxit NaOH và bromothymol xanh thì cho sau. Hỗn hợp đun tan cho natri hidroxit NaOH 20 %.
Điều chỉnh pH 7,8 bằng axit clohidric HCl tinh khiết, vi môi trường kiềm (có thể cho tới 5 ml đến 6 ml HCl).
Đóng vào chai bình 500 ml, 1 000 ml và hấp ở 120 °C trong 30 min.
Hôm sau lấy ra lọc qua giấy lọc, kiểm tra độ pH 7,4 đến 7,5 rồi cho thêm bromothymol xanh, môi trường sẽ có màu xanh lá mạ.
Cho vào ống 16 mm x 160 mm, mỗi ống 5 ml. Đóng nút bông. Hấp vô khuẩn 110 °C trong 30 min.
Chú thích Có thể thay thế Pepton bột bằng nước dạ dày 30% - 1 000 ml và không cho nước cất.
46. Môi trường thạch máu
Công dụng: Nuôi cấy phân lập xác định một số loại vi khuẩn gây bệnh.
- Xem tính chất tan máu do các vi khuẩn gây ra.
| Công thức: | Thạch thường | 100 ml |
|
| Máu cừu (đã loại tơ huyết) | 5 ml |
Cách làm: Thạch thường cách thủy (hoặc đun chảy tan đều) rồi để nguội tới 50 °C, dùng ống hút chia độ vô khuẩn hút 5 ml máu cừu, hoặc máu thỏ (đã loại tơ huyết). Xoay nhẹ bình thạch máu cho hòa đều. Bình thạch mẫu có màu đỏ tươi.
Thạch máu được đóng vào ống nghiệm 18 mm x 180 mm và để nghiêng và đổ đĩa Petri chừng 10 ml.
Tiến hành: đóng thạch máu ống và đổ đĩa Petri, phải thực hiện thật vô khuẩn.
Chú thích Loại tư huyết có hai cách
1) Trong 1 bình cầu có 20 viên bi,đã được đóng gói sấy khô vô khuẩn. Khi lấy mẫu ở tim thỏ hoặc động mạch cảnh cừu đưa vào bình có bi, lắc nhẹ đều, không có bọt là được.
2) Trong một bình cầu có 5 ml natri xitrat 5% vô khuẩn cho 100ml máu cừu vào lắc nhẹ đều.
Hai cách trên, máu sẽ được loại huyết tơ không đông. Dùng cách loại tư huyết bằng các viên bi có thể giữ ở tủ lạnh 6 ngày. Dùng thuốc chống đông natri xitrat chỉ giữ được 2 ngày.
Chỉ nên bảo quản thạch máu ở nhiệt độ + 4 °C.
47. Môi trường nước Pepton, Kali nitrat
Công dụng: trong nuôi cấy phân lập nhảy khuẩn (tìm phản ứng choleraroth).
| Công thức: | Pepton bột | 5 g |
|
| Kali nitrat | 1 g |
|
| Nước cất | 1 000 ml |
Cách làm: Đun nhỏ lửa, tan đều, pH = 8,5. Lọc và đóng vào ống nghiệm 16 mm x 160 mm. Mỗi ống 5 ml. Hấp vô khuẩn ở 110 °C trong 30 min. Dùng dần.
Phụ lục 2
Các bảng ước tính chỉ số MPN
| Bảng chỉ số MPN/100 ml | Khi cấy 5 ống x 10 ml nước thử 5 ống x 1 ml nước thử 5 ống x 0,1 ml nước thử |
Bảng 1
| Số ống dương tính |
| Số ống dương tính |
| ||||
| 10 ml | 1 ml | 0,1 ml | 10 ml | 1 ml | 0,1 ml | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 0 0 0 1 1 1 1 1 2 2 2 2 2 2 3 3 3 3 3 3 3 4 4 4 4 4 | 0 1 2 0 0 1 1 2 0 0 1 1 2 3 0 0 1 1 2 2 3 0 0 1 1 1 | 1 0 0 0 1 0 1 0 0 1 0 1 0 0 0 1 0 1 0 1 0 0 1 0 1 2 | 2 0 4 2 4 4 6 6 5 7 7 9 9 12 8 11 11 14 14 17 17 13 17 17 21 26 | 4 4 4 4 4 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 | 2 2 3 3 4 0 0 0 1 1 1 2 2 2 3 3 3 3 4 4 4 4 4 5 5 5 5 5 | 0 1 0 1 0 0 1 2 0 1 2 0 1 2 0 1 2 3 0 1 2 3 4 0 1 2 3 4 | 22 26 27 33 34 23 31 43 33 46 63 49 70 94 79 109 141 175 130 172 221 278 345 240 348 542 918 1609 |
| Bảng chỉ số MPN/100 ml | Khi cấy 5 ống x 1 ml nước thử 5 ống x 0,1 ml nước thử 5 ống x 0,01 ml nước thử |
Bảng 2
| Số ống dương tính | MPN 100ml | Số ống dương tính | MPN 100ml | ||||
| 1 ml | 0,1 ml | 0,01 ml | 1 ml | 0,1 ml | 0,01 ml | ||
| 0 0 0 1 1 1 1 1 2 2 2 2 2 2 3 3 3 3 3 3 3 4 4 4 4 4 4 | 0 1 2 0 0 1 1 2 0 0 1 1 2 3 0 0 1 1 2 2 3 0 0 1 1 1 2 | 1 0 0 0 1 0 1 0 0 1 0 1 0 0 0 1 0 1 0 1 0 0 1 0 1 2 0 | 20 20 40 20 40 40 60 60 50 70 70 90 90 120 80 110 110 140 140 170 170 130 170 170 210 260 220 | 4 4 4 4 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 | 2 3 3 4 0 0 0 1 1 1 2 2 2 3 3 3 3 4 4 4 4 4 5 5 5 5 5 | 1 0 1 0 0 1 2 0 1 2 0 1 2 0 1 2 3 0 1 2 3 4 0 1 2 3 4 | 260 270 330 340 230 310 430 330 460 630 490 700 940 790 1090 1410 1750 1300 1720 2210 2780 3450 2400 3480 5420 9180 16090 |
| Bảng chỉ số MPN/100 ml | Khi cấy 1 ống x 50 ml nước thải 5 ống x 10 ml nước thải |
Bảng 3
| Số ống dương tính | MPN/100 ml | |
| 50 ml | 10 ml | |
| 0 0 0 0 1 1 1 1 1 | 1 2 3 4 0 1 2 3 4 | 1 2 4 5 2 3 6 9 16 |
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 4584:1988 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 4584:1988 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 4584:1988 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 4584:1988 DOC (Bản Word)
