- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 11319:2016 ISO 14852:1999 Xác định khả năng phân hủy sinh học hiếu khí hoàn toàn của các vật liệu nhựa trong môi trường nước-Phân tích lượng cacbon dioxit phát sinh
| Số hiệu: | TCVN 11319:2016 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Tài nguyên-Môi trường , Công nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2016 |
Hiệu lực:
|
Đang cập nhật |
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 11319:2016
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 11319:2016
TIÊU CHUẨN QUỐC GIA
TCVN 11319:2016
ISO 14852:1999
XÁC ĐỊNH KHẢ NĂNG PHÂN HỦY SINH HỌC HIẾU KHÍ HOÀN TOÀN CỦA CÁC VẬT LIỆU NHỰA TRONG MÔI TRƯỜNG NƯỚC - PHÂN TÍCH LƯỢNG CACBON DIOXIT PHÁT SINH
Determination of the ultimate aerobic biodegradability of plastic materials in an aqueous medium - Method by analysis of evolved carbon dioxide
Lời nói đầu
TCVN 11319:2016 hoàn toàn tương đương với ISO 14852:1999 và đính chính kỹ thuật 1:2005
TCVN 11319:2016 do Tổng cục Môi trường biên soạn, Bộ Tài nguyên và Môi trường đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Do việc sử dụng chất dẻo ngày càng gia tăng việc thu hồi và thải bỏ vật liệu này trở thành một vấn đề lớn. Vì là ưu tiên hàng đầu nên việc thu hồi cần phải được đẩy mạnh, tuy nhiên thu hồi hoàn toàn chất dẻo là một việc khó khăn. Ví dụ, các chất dẻo chủ yếu từ các hàng hóa tiêu dùng rất khó để thu hồi hoàn toàn. Các ví dụ khác về các chất dẻo khó thu hồi là lưới đánh cá, màng phủ trong nông nghiệp và các polyme tan được trong nước. Các vật liệu bằng chất dẻo này có xu hướng bị rò rỉ ra khỏi các hệ thống xử lý nước khép kín và đi vào trong môi trường. Hiện nay, chất dẻo có khả năng phân hủy sinh học nổi lên như một lựa chọn mà có khả năng giải quyết các vấn đề môi trường này. Vật liệu bằng chất dẻo như các sản phẩm hoặc bao gói được đưa đến khu xử lý tạo compost có khả năng phân hủy sinh học tiềm ẩn. Bởi vậy, việc xác định khả năng phân hủy sinh học tiềm ẩn của các vật liệu này là rất quan trọng và đưa ra chỉ dẫn về khả năng phân hủy sinh học trong các môi trường tự nhiên.
XÁC ĐỊNH KHẢ NĂNG PHÂN HỦY SINH HỌC HIẾU KHÍ HOÀN TOÀN CỦA CÁC VẬT LIỆU NHỰA TRONG MÔI TRƯỜNG NƯỚC - PHÂN TÍCH LƯỢNG CACBON DIOXIT PHÁT SINH
Determination of the ultimate aerobic biodegradability of plastic materials in an aqueous medium - Method by analysis of evolved carbon dioxide
CẢNH BÁO Trong nước thải, bùn hoạt tính, đất và compost có thể tồn tại các sinh vật gây bệnh, do đó cần có biện pháp đề phòng thích hợp khi xử lý các chất này. Nên cẩn thận với các chất thử có độc tính và các chất chưa biết rõ tính chất.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp xác định mức độ phân hủy sinh học hiếu khí của vật liệu chất dẻo, bao gồm cả các vật liệu có chứa các phụ gia, bằng cách đo lượng cacbon dioxit sinh ra. Vật liệu thử được cho tiếp xúc trong một môi trường tổng hợp dưới các điều kiện thử nghiệm với vật liệu cấy được lấy từ bùn hoạt hóa, compost hoặc đất.
Nếu sử dụng bùn hoạt hóa không thích ứng làm vật liệu cấy thì phép thử này mô phỏng quá trình phân hủy sinh học xảy ra trong môi trường nước tự nhiên; nếu sử dụng vật liệu cấy đã được cho tiếp xúc trước hoặc trộn sẵn thì có thể sử dụng phương pháp này để kiểm tra khả năng phân hủy sinh học tiềm ẩn của vật liệu thử.
Các điều kiện được sử dụng trong tiêu chuẩn này không cần thiết phải giống với các điều kiện tối ưu để quá trình phân hủy sinh học tối đa xảy ra, nhưng tiêu chuẩn này được xây dựng để xác định khả năng phân hủy sinh học tiềm ẩn của các vật liệu chất dẻo hoặc đưa ra chỉ dẫn về khả năng phân hủy sinh học của vật liệu trong các môi trường tự nhiên.
Phương pháp này giúp cho việc đánh giá khả năng phân hủy sinh học có thể được cải thiện bằng cách tính toán cân bằng cacbon (tùy chọn, xem phụ lục C).
Phương pháp này áp dụng cho các loại vật liệu sau:
- Polyme tổng hợp và/hoặc tự nhiên, polyme đồng trùng hợp (copolyme) hoặc hỗn hợp của cả hai;
- Vật liệu chất dẻo có các phụ gia như chất hóa dẻo, chất màu hoặc các hợp chất khác;
- Polyme tan được trong nước;
- Vật liệu mà trong các điều kiện của phép thử không ức chế các vi sinh vật có trong vật liệu cấy. Có thể xác định các ảnh hưởng ức chế bằng cách sử dụng phương án kiểm soát ức chế hoặc một phương pháp thích hợp khác (ví dụ xem ISO 8192[3]). Nếu vật liệu thử ức chế vi sinh vật trong vật liệu cấy thì sử dụng loại vật liệu cấy khác hoặc sử dụng vật liệu cấy được phơi nhiễm trước với nồng độ thử thấp hơn.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 6834:2000 (ISO 8245:1999), Chất lượng nước - Hướng dẫn xác định cacbon hữu cơ tổng số (TOC) và cacbon hữu cơ hòa tan (DOC).
TCVN 6489:2009 (ISO 9439:1999), Chất lượng nước - Đánh giá khả năng phân hủy sinh học hiếu khí hoàn toàn của các hợp chất hữu cơ trong môi trường nước - Phép thử sự giải phóng cacbon dioxit.
TCVN 6981:2001 (ISO 10634:1995), Chất lượng nước - Hướng dẫn chuẩn bị và xử lý hợp chất hữu cơ ít tan trong nước để đánh giá sự phân hủy sinh học trong môi trường nước.
ISO/TR 15462:1997, Water quality - Selection of tests for biodegradability (Chất lượng nước - Lựa chọn các phép thử phân hủy sinh học).
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này, áp dụng các thuật ngữ và định nghĩa sau đây
3.1
Phân hủy sinh học hiếu khí hoàn toàn (ultimate aerobic biodegradation)
Phân hủy một hợp chất hữu cơ bởi các vi sinh vật khi có mặt oxy, tạo thành cacbon dioxit, nước và muối khoáng của nguyên tố bất kỳ có mặt (quá trình khoáng hóa) cộng với sinh khối mới.
3.2
Bùn hoạt hóa (activated sludge)
Sinh khối tạo thành trong quá trình xử lý hiếu khí nước thải do sự phát triển của vi khuẩn và các vi sinh vật khác khi có mặt của oxy hòa tan.
3.3
Hàm lượng chất rắn lơ lửng trong bùn hoạt hóa (concentration of suspended solids in an activated sludge)
Lượng chất rắn thu được bằng cách lọc hoặc ly tâm một thể tích bùn hoạt hóa biết trước và sấy khô ở khoảng 105 °C đến khối lượng không đổi.
3.4
Cacbon vô cơ hòa tan (dissolved inorganic carbon)
DIC
Phần cacbon vô cơ trong nước mà không thể loại bỏ được bằng quá trình phân tách pha quy định, ví dụ bằng cách ly tâm trong 15 min ở 40 000 m.s-2 hoặc bằng cách lọc qua màng lọc có đường kính lỗ từ 0,2 μm đến 0,45 μm.
3.5
Lượng cacbon dioxit sinh ra theo lý thuyết (theoretical amount of evolved carbon dioxide)
ThCO2
Lượng cacbon dioxit tối đa theo lý thuyết được sinh ra sau khi oxy hóa hoàn toàn một hợp chất hóa học, được tính từ công thức phân tử, biểu thị bằng mlligam cacbon dioxit sinh ra trên miligam hoặc gam hợp chất thử.
3.6
Tổng số cacbon hữu cơ (total organic carbon)
TOC
Tất cả cacbon có trong một hợp chất hữu cơ, hòa tan hoặc lơ lửng trong nước.
3.7
Cacbon hữu cơ hòa tan (dissolved organic carbon)
DOC
Phần cacbon hữu cơ trong nước mà không thể loại bỏ được bằng quá trình phân tách pha quy định, ví dụ bằng cách ly tâm trong 15 min ở 40.000 m.s-2 hoặc bằng cách lọc qua màng lọc có đường kính lỗ từ 0,2 μm đến 0,45 μm.
3.8
Giai đoạn thích ứng (lag phase)
Thời gian, tính bằng ngày, từ khi bắt đầu phép thử cho đến khi đạt được sự thích nghi và/hoặc sự chọn lọc thích nghi của vi sinh vật phân hủy và khi đó mức độ phân hủy sinh học của một hợp chất hóa học hoặc chất hữu cơ đạt được khoảng 10 % của mức độ phân hủy sinh học tối đa.
3.9
Mức độ phân hủy sinh học tối đa (maximum level of biodegradation)
Mức độ phân hủy sinh học, tính bằng phần trăm, của một hợp chất hóa học hoặc chất hữu cơ trong một phép thử mà trên mức đó sự phân hủy sinh học không còn xảy ra thêm nữa.
3.10
Giai đoạn phân hủy sinh học (biodegradation phase)
Thời gian, tính bằng ngày, từ khi kết thúc giai đoạn thích ứng của phép thử cho đến khi đạt được khoảng 90 % mức phân hủy sinh học tối đa.
3.11
Giai đoạn ổn định (plateau phase)
Thời gian, tính bằng ngày, từ khi kết thúc giai đoạn phân hủy sinh học cho đến khi kết thúc phép thử.
3.12
Tiếp xúc trước (pre-exposure)
Quá trình tiếp xúc trước vật liệu cấy với hợp chất hóa học hoặc chất hữu cơ cần thử để tăng khả năng của vật liệu cấy phân hủy sinh học vật liệu thử bằng cách làm thích nghi và/hoặc chọn lọc các vi sinh vật.
3.13
Làm thích nghi trước (pre-conditioning)
Quá trình tiếp xúc trước vật liệu cấy trong các điều kiện của phép thử sau đỏ nhưng không có mặt của hợp chất hóa học hoặc chất hữu cơ cần thử để cải thiện tính năng của phép thử bằng cách cho vi sinh vật thích nghi với các điều kiện của phép thử.
4 Nguyên tắc
Khả năng phân hủy sinh học của một vật liệu chất dẻo được xác định bằng cách sử dụng các vi sinh vật hiếu khí trong môi trường nước. Hỗn hợp thử gồm môi trường vô cơ, vật liệu thử hữu cơ (nguồn cacbon và năng lượng duy nhất) có nồng độ cacbon hữu cơ từ 100 mg/I đến 2000 mg/l và vật liệu cấy là bùn hoạt hóa hoặc huyền phù của đất hoạt tính hoặc compost. Hỗn hợp này được khuấy trộn trong các bình thử và được làm thoáng khí bằng không khí không có cacbon dioxit trong một khoảng thời gian tùy thuộc vào động học của quá trình phân hủy sinh học, nhưng không được quá 6 tháng. Lượng cacbon dioxit sinh ra trong quá trình phân hủy sinh học được xác định bằng phương pháp phân tích phù hợp, như các ví dụ trong Phụ lục A và B.
Mức phân hủy sinh học, biểu thị bằng phần trăm, được xác định bằng cách so sánh lượng cacbon dioxit sinh ra với lượng cacbon dioxit sinh ra theo lý thuyết (ThCO2). Kết quả thử là mức phân hủy sinh học tối đa được xác định từ giai đoạn ổn định của đồ thị phân hủy sinh học. Ngoài ra, có thể tính toán cân bằng cacbon để cung cấp thông tin bổ sung cho quá trình phân hủy sinh học (xem phụ lục C).
Khác với TCVN 6489 (ISO 9439), sử dụng được cho các hợp chất hữu cơ khác nhau, tiêu chuẩn này được sử dụng để xác định khả năng phân hủy sinh học của các vật liệu chất dẻo. Các yêu cầu đặc biệt này tác động đến việc lựa chọn vật liệu cấy và môi trường thử và có khả năng cải thiện sự đánh giá khả năng phân hủy sinh học thông qua việc tính cân bằng cacbon.
5 Môi trường thử
Quá trình ủ phải được thực hiện trong bóng tối hoặc trong ánh sáng khuếch tán, trong một không gian khép kín không chứa các hơi có thể ức chế vi sinh vật và được duy trì ở nhiệt độ không đổi, tốt nhất từ 20 °C đến 25 °C, dao động trong khoảng ± 1 °C hoặc tại nhiệt độ thích hợp khác phụ thuộc vào vật liệu cấy sử dụng và môi trường cần đánh giá.
CHÚ THÍCH Đối với vật liệu cấy compost, sử dụng nhiệt độ cao hơn có thể phù hợp.
6 Thuốc thử
Chỉ sử dụng thuốc thử loại tinh khiết phân tích.
6.1 Nước cất hoặc nước khử ion, không có độc tố (đặc biệt là đồng) và có hàm lượng DOC nhỏ hơn 2 mg/I.
6.2 Môi trường thử
Tùy thuộc vào mục đích của phép thử, có thể sử dụng môi trường thử khác nhau. Ví dụ, nếu mô phỏng một môi trường tự nhiên thì sử dụng môi trường thử chuẩn (6.2.1). Nếu vật liệu thử được sử dụng ở nồng độ cao hơn thì sử dụng môi trường thử tối ưu (6.2.2) với lượng đệm và nồng độ chất dinh dưỡng cao hơn.
6.2.1 Môi trường thử chuẩn
6.2.1.1 Dung dịch A
Hòa tan
Kali dihydro photphat khan (KH2PO4) 8,5 g
Dikali hydro phophat khan (K2HPO) 21,75 g
Dinatri hydro photphat dihydrat (Na2HPO4.2H2O) 33,4 g
Amoni clorua (NH4CI) 0,5 g
trong nước (6,1) và cho thêm nước đến 1 000 ml.
CHÚ THÍCH Có thể kiểm tra thành phần chính xác của dung dịch bằng cách đo pH, giá trị phải bằng 7,4.
6.2.1.2 Dung dịch B
Hòa tan 22,5 g magie sunphat heptahydrat (MgSO4.7H2O) trong nước (6.1) và thêm nước đến 1 000 ml.
6.2.1.3 Dung dịch C
Hòa tan 36,4 g canxi clorua dihydrat (CaCl2.2H2O) trong nước (6.1) và thêm nước đến 1 000 ml.
6.2.1.4 Dung dịch D
Hòa tan 0,25 g sắt (III) clorua hexahydrat (FeCl3.6H2O) trong nước (6.1) và thêm nước đến 1 000 ml.
Chuẩn bị dung dịch này ngay trước khi sử dụng để tránh kết tủa, hoặc thêm một giọt axit clohydric đậm đặc (HCl) hoặc một giọt dung dịch nước của etylendiamintetraaxetic axit 0,4 g/l (EDTA).
6.2.1.5 Chuẩn bị
Để chuẩn bị 1 lít môi trường thử thì thêm vào khoảng 500 ml nước (6.1)
- 10 ml dung dịch A;
- 1 ml mỗi dung dịch từ B đến D.
Cho thêm nước (6.1) đến 1000 ml.
6.2.2 Môi trường thử tối ưu
Môi trường thử này được đệm cao và chứa nhiều chất dinh dưỡng vô cơ hơn. Cần phải giữ pH không đổi trong hệ thống trong suốt quá trình thử ngay cả khi nồng độ của vật liệu thử cao. Môi trường này chứa khoảng 2400 mg/l photpho và 50 mg/l nitơ và vì thế rất thích hợp với vật liệu thử có nồng độ cao, có thể lên đến 2000 mg/l cacbon hữu cơ. Nếu sử dụng vật liệu thử có nồng độ cao hơn thì tăng hàm lượng nitơ lên để giữ được tỉ lệ C:N khoảng 40:1.
6.2.2.1 Dung dịch A
Hòa tan
Kali dihydro photphat khan (KH2PO4) 37,5 g
Dinatri hydro photphat dihydrat (Na2HPO4.2H2O) 87,3 g
Amoni clorua (NH4Cl) 2,0 g
trong nước (6.1) và cho thêm nước đến 1 000 ml.
6.2.2.2 Dung dịch B
Hòa tan 22,5 g magie sunphat heptahydrat (MgSO4.7H2O) trong nước (6.1) và thêm nước đến 1 000 ml.
6.2.2.3 Dung dịch C
Hòa tan 36,4 g canxi clorua dihydrat (CaCl2.2H2O) trong nước (6.1) và thêm nước đến 1 000 ml.
6.2.2.4 Dung dịch D
Hòa tan 0,25 g sắt (III) clorua hexahydrat (FeCl3.6H2O) trong nước (6.1) và thêm nước đến 1 000 ml.
6.2.2.5 Dung dịch E (dung dịch vết nguyên tố, tùy chọn)
Hòa tan trong 10 ml dung dịch nước HCl (25 %, 7,7 mol/l) theo thứ tự sau:
10 mg ZnCl2 100 mg MnCl2.4H2O, 6 mg H3BO3, 190 mg CoCI2.6H2O, 3 mg CuCI2.2H2O, 240 mg NiCI2.6H2O, 36 mg Na2MoO4.2H2O, 33 mg Na2WO4.2H2O và 26 mg Na2SeO3.5H2O và cho thêm nước đến 1000 ml (6.1).
6.2.2.6 Dung dịch F (dung dịch vitamin, tùy chọn)
Hòa tan vào 100 ml nước (6.1) 0,6 mg biotin, 2,0 mg niacinamin, 2,0 mg p-aminobenzoate, 1,0 mg axit pantotenic, 10,0 mg pyridoxal hydrocloma, 5,0 mg cyanocobalamlne, 2,0 mg axit folic, 5,0 mg riboflavin, 5,0 mg DL-thioctic axit và 1,0 mg thiamine dichloride hoặc sử dụng dung dịch 15 mg chất chiết men trong 100 ml nước (6.1). Lọc dung dịch này qua thiết bị lọc màng để khử trùng (xem 7.6).
CHÚ THÍCH Dung dịch E và F là tùy chọn và không yêu cầu nếu sử dụng nồng độ vật liệu cấy vừa đủ, ví dụ như bùn hoạt hóa, đất hoặc compost. Nên chuẩn bị các phần 1 ml một và bảo quản lạnh cho đến khi sử dụng.
6.2.2.7 Chuẩn bị
Để chuẩn bị 1 lít môi trường thử thêm vào khoảng 800 ml nước (6.1)
- 100 ml dung dịch A;
- 1 ml từng dung dịch từ B đến D và, tùy chọn E và F.
Cho thêm nước (6.1) đến 1000 ml và đo pH.
CHÚ THÍCH Có thể kiểm tra thành phần chính xác của dung dịch bằng cách đo pH, giá trị phải bằng 7,0 ± 0,2.
6.3 Dung dỊch pyrophotphat
Hòa tan 2,66 g natri pyrophotphat khan (Na4P2O7) trong nước (6.1) và cho thêm nước đến 1 000 ml
6.4 Chất hấp thụ cacbon dioxit, các hạt xút hoặc chất hấp thụ khác thích hợp.
7 Thiết bị, dụng cụ
Tất cả các thiết bị thử phải sạch và đặc biệt không có vật liệu vô cơ và độc tố.
Sử dụng các thiết bị thí nghiệm thông thường và các thiết bị, dụng cụ sau:
7.1 Bình thử nghiệm, gồm các bình thủy tinh (như bình tam giác hoặc chai) được thiết kế để có thể đuổi sạch khí và khuấy hoặc lắc, có lắp ống không thấm khí CO2. Các bình phải được đặt trong một phòng có nhiệt độ không đổi hoặc trong một thiết bị, dụng cụ ổn nhiệt (như bể cách thủy).
7.2 Hệ thống cấp khí không chứa CO2, có khả năng cung cấp vào từng bình thử nghiệm không khí không chứa cacbon dioxit ở tốc độ dòng trong khoảng từ 50 ml/min đến 100 ml/min, được giữ ổn định với độ chính xác ± 10 % (xem ví dụ về hệ thống gồm cả các bình thử trong Phụ lục A).
7.3 Thiết bị phân tích dùng để xác định cacbon dioxit, bao gồm các thiết bị thích hợp có đủ độ chính xác, ví dụ thiết bị phân tích CO2 hoặc DIC hoặc thiết bị xác định việc chuẩn độ sau khi hấp thụ hoàn toàn trong một dung dịch kiềm (xem ví dụ trong Phụ lục B). Lưu ý rằng nếu sử dụng thiết bị phân tích có detector IR thì không cần sử dụng khí không chứa CO2.
7.4 Thiết bị phân tích dùng để xác định cacbon hữu cơ tổng số (TOC) và cacbon hữu cơ hòa tan (DOC) [xem TCVN 6634 (ISO 8245)].
7.5 Cân phân tích (loại sử dụng trong phòng thí nghiệm)
7.6 Thiết bị ly tâm hoặc thiết bị lọc có tấm màng lọc (cỡ lỗ 0,45 μm) không hấp phụ hoặc giải phóng cacbon hữu cơ.
7.7 Thiết bị đo pH (loại sử dụng trong phòng thí nghiệm)
7.8 Máy khuấy từ hoặc máy lắc (loại sử dụng trong phòng thí nghiệm)
8.1 Vật liệu thử
Vật liệu thử phải là vật liệu có khối lượng đã biết và chứa lượng cacbon đủ tạo một lượng CO2 mà có thể được xác định chính xác bằng hệ thống phân tích sử dụng. Tính TOC theo công thức hóa học hoặc xác định bằng kỹ thuật phân tích phù hợp [ví dụ phân tích nguyên tố hoặc xác định theo TCVN 6634 (ISO 8245)] và tính lượng ThCO2. Sử dụng nồng độ vật liệu thử sao cho hàm lượng TOC ít nhất bằng 100 mg/l. Lượng vật liệu thử tối đa bị giới hạn bởi lượng oxy cung cấp cho hệ thống thử và môi trường thử được sử dụng. Khi sử dụng môi trường thử tối ưu (6.2.2), nồng độ của vật liệu thử phải ở mức sao cho lượng TOC không vượt quá 2 000 mg/l, nghĩa là tỷ lệ C:N khoảng 40:1. Nếu sử dụng nồng độ cao hơn thì phải tăng lượng nitơ trong môi trường thử.
CHÚ THÍCH Nên ưu tiên sử dụng vật liệu thử ở dạng bột nhưng cũng có thể sử dụng vật liệu dạng màng, mảnh nhỏ hay các hạt định hình; Kích thước và hình dạng của vật liệu thử có thể ảnh hưởng đến khả năng phân hủy sinh học của chúng. Nếu để so sánh các loại vật liệu chất dẻo khác nhau thì nên sử dụng các vật liệu có hình dạng tương tự nhau. Nếu vật liệu thử có dạng bột thì phải sử dụng các hạt nhỏ đã biết trước sự phân bố kích thước và nên sử dụng phân bố kích thước hạt với đường kính tối đa là 250 μm. Tương tự như vậy, kích thước của thiết bị sử dụng cũng phụ thuộc vào thể loại vật liệu thử. Phải đảm bảo chắc chắn rằng không có các thay đổi cơ học không mong muốn xảy ra do các điều kiện của phép thử, ví dụ như là cơ cấu khuấy. Việc gia công, chế biến vật liệu thử không có ảnh hưởng đáng kể đến sự phân hủy của vật liệu (ví dụ trong trường hợp sử dụng vật liệu dạng bột đối với các hỗn hợp). Có thể xác định hàm lượng hydro, oxy, nitơ, photpho và lưu huỳnh cũng như khối lượng phân tử của vật liệu thử bằng phương pháp sắc ký thẩm thấu gel (ví dụ xem ASTM D 3536-91[1]) hoặc tiêu chuẩn khác thích hợp. Ưu tiên thử nghiệm vật liệu chất dẻo không có phụ gia như chất hóa dẻo. Khi vật liệu chứa các chất phụ gia như vậy thì cần phải có thông tin về khả năng phân hủy sinh học của các chất phụ gia để có thể đánh giá được khả năng phân hủy sinh học của chính vật liệu polyme đó.
Để biết thêm thông tin chi tiết về cách xử lý đối với các hợp chất ít tan trong nước, xem TCVN 6918 (ISO 10634).
8.2 Vật liệu đối chứng
Sử dụng anilin và/hoặc polyme có khả năng phân hủy sinh học tốt làm vật liệu đối chứng [ví dụ bột cellulose vì tinh thể, giấy lọc xenlulo không tàn hoặc poly (β-hydroxybutyrat)]. Nếu có thể, thể loại và kích thước, lượng TOC của vật liệu đối chứng phải có khả năng so sánh được với hình dạng, kích thước và lượng TOC của vật liệu thử.
Có thể sử dụng polyme không phân hủy sinh học (ví dụ polyetylen) có cùng hình dạng với vật liệu thử làm vật liệu đối chứng âm.
8.3 Chuẩn bị vật liệu cấy
Bùn hoạt hóa từ các trạm xử lý nước thải xử lý chủ yếu nước thải sinh hoạt là nguồn phù hợp để cung cấp vật liệu cấy. Bùn này được lấy từ môi trường hiếu khí hoạt động và có sẵn ở khắp một vùng diện tích địa lý rộng lớn, trong đó nhiều loại vật liệu chất dẻo cần được thử nghiệm. Ngoài ra, có thể sử dụng đất và/hoặc huyền phù compost cho quá trình cấy vì với một số loại vật liệu chất dẻo thì hoạt động của nấm đóng vai trò quan trọng đối với quá trình phân hủy sinh học. Khi xác định được quá trình phân hủy sinh học trong một hệ thống xử lý chất thải cụ thể thì lấy vật liệu cấy từ môi trường đó.
Vật liệu cấy này có thể được chuẩn bị từ các nguồn mô tả trong 8.3.1 và 8.3.2 hoặc từ một hỗn hợp của các nguồn này để thu được một quần thể vi sinh vật đa dạng và đông đúc, đủ để tác động đến quá trình phân hủy sinh học. Nếu quá trình hô hấp nội sinh của vật liệu cấy quá lớn thì phải ổn định vật liệu cấy bằng cách làm thoáng khí trước khi sử dụng. Hài hòa nhiệt độ thử với vật liệu cấy được sử dụng (xem chú thích Điều 5).
CHÚ THÍCH Việc xác định đơn vị cụm khuẩn (cfu) của vật liệu cấy sử dụng có thể sẽ hữu ích. Hỗn hợp thử nên chứa khoảng từ 103 đến 106 cfu/ml.
8.3.1 Vật liệu cấy lấy từ trạm xử lý nước thải
Lấy một mẫu bùn hoạt hóa được thu thập từ trạm xử lý nước thải đã được vận hành hoặc khu thí nghiệm xử lý nước thải sinh hoạt. Trộn đều và giữ mẫu dưới các điều kiện hiếu khí và tốt nhất là sử dụng ngay trong ngày (tối thiểu trong 72 h).
Trước khi sử dụng, xác định nồng độ của các chất rắn lơ lửng (ví dụ theo ISO 11923 [3]). Nếu cần thiết, cô đặc bùn này bằng cách để lắng sao cho thể tích của bùn được thêm vào cho phép thử là nhỏ nhất. Thêm một lượng phù hợp để thu được hàm lượng chất rắn lơ lửng trong hỗn hợp cuối từ 30 mg/l đến 1000 mg/l.
CHÚ THÍCH 1 Khi quá trình phân hủy sinh học trong môi trường tự nhiên được mô phỏng hoặc khi tiến hành xác định cân bằng cacbon (xem Phụ lục C) thì nên sử dụng vật liệu cấy có hàm lượng chất rắn lơ lửng là 30 mg/l. Vì các chất rắn có thể cản trở việc xác định cân bằng cacbon nên phải tuân theo quy trình chuẩn bị vật liệu cấy như sau. Lấy 500 ml bùn hoạt hóa và làm đồng nhất trong 2 min với tốc độ trung bình trong một bình trộn hoặc máy trộn phù hợp tốc độ cao. Để hỗn hợp lắng cho đến khi chất lỏng nổi phía trên chứa một lượng không đáng kể các chất lơ lửng nhưng không được lâu hơn 30 min. Gạn lượng chất lỏng nổi phía trên và cho vào bình thử để có được nồng độ là 1 % (V/V) đến 5 % (V/V) trong môi trường thử. Tránh gạn cả các hạt bùn.
CHÚ THÍCH 2 Vật liệu cấy để có thể được làm thích nghi trước nhưng không sử dụng vật liệu cấy đã được cho tiếp xúc trước, nhất là trong trường hợp phép thử mô phỏng đặc tính phân hủy sinh học trong môi trường tự nhiên. Tùy vào mục đích của phép thử có thể sử dụng vật liệu cấy được tiếp xúc trước miễn là trong báo cáo thử nghiệm phải nêu rõ điều này (ví dụ phần trăm phân hủy sinh học = x %, sử dụng vật liệu cấy được tiếp xúc trước) và phương pháp tiếp xúc trước cũng phải được nêu chi tiết trong báo cáo thử nghiệm. Vật liệu cấy được tiếp xúc trước có thể lấy từ các phép thử phân hủy sinh học trong phòng thí nghiệm phù hợp (xem ISO/TR 15462) được thực hiện trong các điều kiện khác nhau hoặc từ các mẫu thử được lấy từ các địa điểm mà ở đó có các điều kiện môi trường tương đương (ví dụ khu vực bị ô nhiễm hoặc trạm xử lý chất thải công nghiệp).
8.3.2 Vật liệu cấy lấy từ đất và/hoặc compost
Hòa 10 g đất màu mỡ hoặc compost lấy từ bãi compost xử lý chất thải, hữu cơ trong 100 ml môi trường thử (6.2.1 hoặc 6 2.2) hoặc trong dung dịch pyrophotphat (6.3) mà thường được sử dụng trong lĩnh vực vi sinh vật đất. Để lắng dung dịch trong khoảng 30 min. Gạn và lọc chất lỏng nổi bên trên qua một phễu lọc thô và cho thêm vật liệu cấy này vào các bình thử để đạt được nồng độ trong môi trường thử từ 1 % (V/V) đến 5 % (V/V). Nếu cần có thể sử dụng lượng vật liệu cấy nhiều hơn nhưng điều này có thể dẫn đến những vấn đề trong việc hình thành cân bằng cacbon. Việc sử dụng compost có thể làm gia tăng số lượng nấm có trong bình thử và cải thiện quá trình phân hủy sinh học của vật liệu chất dẻo. Trong trường hợp này cần phải nêu rõ trạng thái compost được sử dụng trong báo cáo thử nghiệm (ví dụ compost đã ngấu, compost lấy từ pha nóng ở khoảng 50 °C).
Khi cần phải có nồng độ vật liệu cấy cao hơn thì hòa lượng đất hoặc compost nhiều hơn vào trong môi trường thử và pha loãng đến nồng độ thích hợp cho quá trình ủ.
8.4 Thử
Chuẩn bị một số lượng các bình thử sao cho phép thử ít nhất phải có:
a) Hai bình thử dùng để chứa vật liệu thử (ký hiệu FT);
b) Hai bình thử dùng để chứa mẫu trắng (ký hiệu FB);
c) Một bình thử dùng để kiểm tra hoạt tính của vật liệu cấy sử dụng vật liệu đối chứng (ký hiệu FC).
Và nếu có yêu cầu:
d) Một bình thử dùng để kiểm tra khả năng phân hủy không sinh học hoặc sự thay đổi không sinh học trong vật liệu thử, ví dụ bằng phương pháp thủy phân (ký hiệu Fs). Dung dịch thử ở trong bình Fs phải được tiệt trùng, ví dụ như hấp bằng nồi hấp hoặc bổ sung thêm hợp chất vô cơ thích hợp để ngăn chặn hoạt tính của vi sinh vật. Ví dụ sử dụng 5 ml/l dung dịch có chứa 10 g/l thủy ngân (II) clorua (HgCI2). Nếu có yêu cầu thì trong quá trình thử có thể bổ sung thêm cùng một lượng tương tự chất độc này.
e) Một bình dùng làm đối chứng âm (ký hiệu FN), sử dụng một polyme không phân hủy sinh học (ví dụ polyetylen) có cùng kích thước và hình dạng với vật liệu thử.
f) Một bình dùng để kiểm tra tác động ức chế của vật liệu thử đến hoạt động của vi sinh vật (ký hiệu Fl). Đảm bảo rằng tỷ lệ giữa cacbon trong vật liệu thử và vật liệu đối chứng với nitơ trong môi trường ít nhất là C:N - 40:1. Bổ sung thêm nitơ nếu có yêu cầu.
Cho đủ môi trường thử (6.2) và vật liệu cấy (8.3) vào các bình thử theo như quy định tại Bảng 1.
Bảng 1 - Phân bố vật liệu thử và vật liệu đối chứng
| Bình thử | Vật liệu thử | Vật liệu đối chứng | Vật liệu cấy |
| FT Mẫu thử | + | - | + |
| FT Mẫu thử | + | - | + |
| FB Mẫu trắng | - | - | + |
| FB Mẫu trắng | - | - | + |
| FC Kiểm tra vật liệu cấy | - | + | + |
| Fs Kiểm tra sự phân hủy không sinh học (tùy chọn) | + | - | - |
| Fl Kiểm tra ức chế (tùy chọn) | + | + | + |
| Fs Kiểm tra âm tính (tùy chọn) | - | + | + |
Nối các bình thử vào hệ thống tạo không khí không chứa CO2 (xem Phụ lục A). Ủ tại nhiệt độ thử mong muốn (xem Điều 5) và sục khí các bình trong 24 h để đuổi hết cacbon dioxit ra khỏi hệ thống. Nếu thực hiện ở nhiệt độ cao hơn thì phải ngăn chặn việc bổ sung hoặc mất mát chất lỏng bằng thiết bị phù hợp. Sử dụng máy lắc hoặc máy khuấy để khuấy trộn hỗn hợp thử. Nếu quan sát thấy hiện tượng tạo bọt quá nhiều thì thay việc thổi khí bằng việc sục khí ở phía trên, có khuấy trộn. Sau khi sục khí sơ bộ thì nối đầu không khí ra của từng bình vào hệ thống bẫy hoặc đo cacbon dioxit.
Nếu xác định cân bằng cacbon (xem Phụ lục C) thì lấy một lượng thể tích biết trước vừa đủ của môi trường thử đã cấy từ mỗi bình hoặc từ các bình tách biệt để xác định DOC và sinh khối tại thời điểm bắt đầu và kết thúc của quá trình ủ. Khi điều chỉnh thể tích cuối cùng hoặc khi tính toán kết quả thử phải lưu ý đến lượng thể tích đã lấy ra này.
Cho vật liệu thử (8.1), vật liệu đối chứng và vật liệu kiểm chứng âm tính (8.2) vào các bình tương ứng như nêu trong Bảng 1 và bắt đầu phép thử bằng cách thổi sục không khí không chứa CO2 vào các bình để cung cấp đủ lượng oxy cần cho phép thử. Tốc độ thổi từ 50 ml/min đến 100 ml/min là thích hợp.
Tùy thuộc vào tốc độ sinh ra cacbon dioxit mà tiến hành đo theo quãng thời gian đều đặn lượng cacbon dioxit sinh ra trong mỗi chai bằng phương pháp thích hợp và đủ độ chính xác (xem Phụ lục B).
Khi lượng cacbon dioxit giải phóng ra đạt giá trị ổn định (đạt đến giai đoạn ổn định) và không có thêm sự phân hủy sinh học xảy ra thì phép thử coi như đã hoàn thành. Thời gian tối đa là 6 tháng. Trong trường hợp thời gian thử dài thì phải lưu ý đặc biệt đến hệ thống thiết bị (ví dụ độ kín khít của bình thử và hệ thống kết nối, đảm bảo không có cacbon dioxit từ bên ngoài đi vào và không bị rò rỉ).
Tại thời điểm kết thúc phép thử, đo pH, axit hóa tất cả các chai bằng 1 ml axit clohydric đậm đặc để phân hủy cacbonat hoặc bicacbonat và thổi khí để đuổi cacbon dioxit. Tiếp tục sục khí trong 24 h và đo lượng cacbon dioxit sinh ra trong mỗi bình của dãy các bình (FT, FB, FC...).
9 Tính toán và biểu thị kết quả
9.1 Tính toán
9.1.1 Lượng cacbon dioxit sinh ra bởi vật liệu thử
Tính lượng cacbon dioxit sinh ra theo lý thuyết (ThCO2) theo công thức (1), biểu thị bằng miligam:
![]() (1)
(1)
Trong đó
m là khối lượng của vật liệu thử cho vào trong bình thử, tính bằng miligam;
XC là hàm lượng cacbon của vật liệu thử, xác định từ công thức hóa học hoặc phân tích nguyên tố, biểu thị bằng phần khối lượng;
44 và 12 là khối lượng phân tử của cacbon dioxit và khối lượng nguyên tử của cacbon.
Tính toán lượng cacbon dioxit sinh ra theo lý thuyết từ vật liệu đối chứng và hỗn hợp của vật liệu thử và vật liệu đối chứng trong bình Fl.
9.1.2 Phần trăm phân hủy sinh học từ lượng CO2 sinh ra
Từ lượng cacbon dioxit trong mỗi phép đo, tính phần trăm phân hủy sinh học Dt của mỗi bình thử FT theo phương trình (2):
![]() (2)
(2)
Trong đó
∑(CO2)T là lượng cacbon dioxit sinh ra trong từng bình thử FT từ khi bắt đầu phép thử cho đến thời gian t, tính bằng miligam;
∑(CO2)B là lượng cacbon dioxit sinh ra trong bình chứa mẫu trắng FB từ khi bắt đầu phép thử đến thời gian t, tính bằng mlligam
ThCO2 là lượng cacbon dioxit sinh ra theo lý thuyết từ vật liệu thử, tính bằng miligam.
Nếu có thể, tính lượng trung bình đối với các bình thử tiến hành đồng thời. Tương tự tính phần trăm phân hủy sinh học của vật liệu đối chứng trong bình kiểm tra vật liệu cấy FC và nếu có thì tính cả phần trăm phân hủy sinh học của hỗn hợp vật liệu thử và vật liệu đối chứng trong bình kiểm soát ức chế Fl, vật liệu thử trong bình kiểm soát sự phân hủy không sinh học Fs và bình kiểm tra âm tính FN.
Nếu tính cân bằng cacbon thì tính mức độ phân hủy sinh học của vật liệu thử từ lượng cacbon dioxit sinh ra và hàm lượng cacbon trong sinh khối sinh ra trong quá trình thử (Phụ lục C).
9.2 Biểu thị và giải thích kết quả
Lập bảng các giá trị cacbon dioxit sinh ra và giá trị phần trăm phân hủy sinh học tương ứng với từng thời điểm đo và của mỗi bình thử. Đối với mỗi bình thử, vẽ đồ thị đường cong của lượng cacbon dioxit sinh ra và đường cong phần trăm phân hủy sinh học theo thời gian. Nếu thu được các kết quả có thể so sánh đối với hai bình thử tiến hành đồng thời thì có thể vẽ đường cong trung bình.
Mức phân hủy sinh học tối đa được xác định là giá trị trung bình của giai đoạn ổn định trên đồ thị phân hủy sinh học hoặc giá trị cao nhất, ví dụ khi đồ thị đi xuống hoặc đi lên chậm trong giai đoạn ổn định, mô tả mức độ phân hủy sinh học của vật liệu thử. Nếu cân bằng cacbon đã được xác định thì kết quả của xác định này mô tả tổng mức độ phân hủy sinh học.
Khả năng thấm ướt và hình dạng của các miếng vật liệu thử có thể ảnh hưởng đến kết quả và phải tính đến điều này khi so sánh các kết quả thu được từ các vật liệu chất dẻo có cấu trúc hóa học giống nhau.
Thông tin về độc tính của vật liệu thử có thể sẽ hữu ích trong việc giải thích các kết quả thử chỉ ra khả năng phân hủy sinh học thấp.
10 Độ tin cậy của kết quả
Phép thử được coi là tin cậy nếu
a) Mức độ phân hủy sinh học của vật liệu đối chứng (bình kiểm tra vật liệu cấy FC) lớn hơn 60 % tại thời điểm kết thúc phép thử;
b) Lượng cacbon dioxit sinh ra trong bình thử chứa mẫu trắng FB tại thời điểm kết thúc phép thử không vượt quá giá trị giới hạn trên thu được theo kinh nghiệm (giá trị này phụ thuộc lượng vật liệu cấy, ví dụ các thử nghiệm liên phòng đã chỉ ra rằng trong trường hợp có 30 mg/l vật liệu khô thì giá trị này khoảng 90 mg/l).
Nếu trong bình Fl (kiểm tra ức chế, nếu có) phần trăm phân hủy sinh học < 25 % và không quan sát được rõ sự phân hủy của vật liệu thử thì có thể coi như vật liệu thử gây ức chế.
Nếu trong bình Fs (kiểm tra phân hủy không sinh học, nếu có) quan sát được rõ lượng cacbon dioxit (> 10 %) thì quá trình phân hủy không sinh học có thể đã xảy ra.
Nếu có bình FN (kiểm tra âm tính) thì sẽ không quan sát có cacbon dioxit sinh ra.
Nếu các tiêu chí này không đạt được thì lặp lại phép thử bằng cách sử dụng lượng vật liệu cấy được làm thích nghi trước hoặc được tiếp xúc trước.
11 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm ít nhất các thông tin sau đây:
a) viện dẫn tiêu chuẩn này;
b) tất cả thông tin cần thiết để nhận biết vật liệu thử và vật liệu đối chứng, gồm TOC, ThCO2, thành phần và công thức hóa học (nếu biết), hình dạng, thể loại và hàm lượng/nồng độ trong các mẫu thử;
c) các thông số thử chính, gồm thể tích thử, môi trường thử sử dụng, nhiệt độ ủ và pH cuối;
d) nguồn và lượng vật liệu cấy sử dụng, bao gồm chi tiết của việc cho tiếp xúc trước và trạng thái của compost sử dụng;
e) kỹ thuật phân tích được sử dụng gồm nguyên tắc của hô hấp kế và phương pháp xác định TOC, DOC và sinh khối;
f) tất cả các kết quả thử thu được đối với vật liệu thử và vật liệu đối chứng (dạng bảng biểu và đồ thị) bao gồm lượng cacbon dioxit cộng dồn đo được, các giá trị phần trăm phân hủy sinh học và đồ thị tương ứng của các thông số này theo thời gian;
g) khoảng thời gian của giai đoạn thích ứng và giai đoạn phân hủy sinh học, mức phân hủy sinh học tối đa cũng như tổng thời gian thử;
và các thông tin tùy chọn sau, nếu có thực hiện hoặc xác định:
h) kết quả quá trình kiểm tra sự phân hủy không sinh học Fs, kiểm tra ức chế FT và kiểm tra âm tính FN;
i) kết quả việc xác định cân bằng cacbon, bao gồm như:
1) lượng cacbon trong vật liệu thử bị oxy hóa thành cacbon dioxit,
2) lượng tăng DOC trong môi trường thử trong quá trình ủ gây ra bởi các chất có thể hòa tan trong nước,
3) lượng tăng cacbon hữu cơ trong sinh khối trong quá trình thử,
4) hàm lượng cacbon trong polyme cặn tại thời điểm kết thúc phép thử,
5) tổng số lượng cacbon đo được, biểu thị bằng phần trăm cacbon được đưa vào thông qua vật liệu thử;
j) đơn vị cụm khuẩn (cfu/g) có trong hỗn hợp thử được cấy;
k) bất kỳ dữ liệu nào có liên quan (ví dụ khối lượng phân tử ban đầu của mẫu thử, khối lượng phân tử của polyme tồn dư);
Phụ lục A
(tham khảo)
Nguyên tắc của hệ thống do lượng cacbon dioxit sinh ra (ví dụ)
Các bình được lắp theo dãy như nêu trong Hình A.1 và được nối với nhau bằng các ống không thấm khí. Dẫn không khí không chứa CO2 với tốc độ từ 50 ml/min đến 100 ml/min vào trong hệ thống ở áp suất thấp không đổi. Kiểm tra tốc độ dòng khí bằng cách đếm bọt khí hoặc sử dụng thiết bị kiểm soát tốc độ dòng phù hợp. Sử dụng khi tổng hợp không chứa CO2 hoặc khí nén. Trong trường hợp sử dụng khí nén thì loại bỏ khí CO2 bằng cách cho khí đi qua một chai (3) chứa natri cacbonat khô hoặc cho qua ít nhất hai bình rửa khí có chứa, ví dụ như 500 ml dung dịch kali hydroxit 10 mol/L. Có thể sử dụng thêm một bình có chứa 100 ml dung dịch bari hydroxit 0,0125 moI/L và một bình rỗng để nhận biết sự hiện diện của CO2 trong khí khi nó làm đục dung dịch này và để ngăn việc cuốn theo chất lỏng vào trong bình thử nghiệm. Có thể sử dụng một bình rỗng, ở giữa bình thử và bình chứa chất, chỉ thị để ngăn chặn sự kéo theo chất lỏng. CO2 sẽ được sinh ra trong các bình thử nếu quá trình phân hủy sinh học xảy ra và được hấp thụ trong một chai tiếp theo có chứa chất hấp thụ để xác định như mô tả trong Phụ lục B.
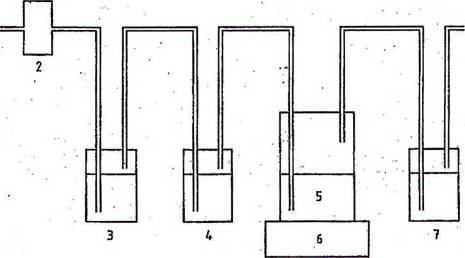
| CHÚ DẪN |
| ||
| 1 | Không khí nén | 5 | Bình thử |
| 2 | Kiểm soát tốc độ dòng | 6 | Thiết bị khuấy |
| 3 | Bẫy cacbon dioxit (ví dụ hai chai rửa có chứa kiềm) | 7 | Bẫy cacbon dioxit (ví dụ hai chai rửa có chứa kiềm) |
| 4 | Chất chỉ thị cacbon dioxit [Ba(OH)2] | ||
| Hình A.1 | |||
Phụ lục B
(tham khảo)
Ví dụ các phương pháp xác định cacbon dioxit sinh ra
B.1 Xác định CO2 bằng cách đo DIC
Khí cacbon dioxit sinh ra được hấp thụ trong dung dịch natri hydroxit (NaOH) và được xác định là cacbon vô cơ hòa tan (DIC) bằng máy phân tích DOC mà không cần tro hóa.
Chuẩn bị dung dịch 0,05 mol/L NaOH trong nước khử ion. Đo lượng DIC của dung dịch này và sử dụng giá trị mẫu trắng này khi tính CO2 sinh ra. Nối vào dây bình thử nghiệm hai chai chứa chất hấp thụ, mỗi chai chứa 100 ml dung dịch NaOH. Dùng một xi phông nhỏ đóng đầu ra của chai cuối cùng để ngăn CO2 từ không khí bên ngoài đi vào dung dịch NaOH. Vào các ngày xác định CO2, lấy chai chứa chất hấp thụ sát cạnh bình thử nghiệm và lấy lượng, mẫu thử đủ lớn để đo DIC (ví dụ 10 ml). Thay chai này bằng chai thứ hai và thêm một chai mới chứa dung dịch NaOH chưa sử dụng vào. Vào ngày cuối cùng, sau khi axit hóa dung dịch thử, đo lượng DIC trong cả hai chai.
Tính lượng CO2 sinh ra theo phương trình (C.1)
![]() (C.1)
(C.1)
Trong đó
(CO2)T là lượng CO2 sinh ra, tính bằng miligam;
DICT là lượng DIC đo được, tính bằng miligam
DlCB là lượng DIC đo được trong bình trắng đối với dung dịch NaOH, tính bằng millgam;
3,67 là tỷ lệ khối lượng phân tử của CO2 (44) trên khối lượng nguyên tử của cacbon (12);
10 là hệ số hiệu chỉnh cho việc sử dụng 100 ml dung dịch NaOH.
B.2 Phương pháp chuẩn độ bằng dung dịch bari hydroxyt
Lượng CO2 sinh ra phản ứng với bari hydroxyt [Ba(OH)2] và kết tủa thành bari cacbonat (BaCO3) [xem phản ứng (C.2)]. Lượng cacbon dioxit sinh ra được xác định bằng phương pháp chuẩn độ dung dịch Ba(OH)2 dư với axit clohydric (HCl) [xem phản ứng (C.3)].
CO2 + Ba(OH)2 → BaCO3 + H2O (C.2)
Ba(OH)2 + 2 HCl → BaCI2 + 2H2O (C.3).
Hòa tan 4,0 g Ba(OH)2.8H2O vào nước khử ion hoặc nước cất tạo thành 1 000 ml để thu được dung dịch 0,0125 mol/L. Nên chuẩn bị một lượng đủ vào, thời điểm thực hiện chuỗi phép thử, ví dụ khoảng 5 L. Lọc vật liệu rắn và xác định chính xác nồng độ bằng phương pháp chuẩn độ với dung dịch HCl chuẩn. Dùng phenolphtalein làm chất chỉ thị hoặc một máy chuẩn độ tự động để xác định điểm kết thúc. Giữ dung dịch sạch trong một bình thử được niêm phong nhằm ngăn sự hấp thụ CO2 từ không khí.
Pha loãng 50 ml dung dịch HCl 1 mol/l (36,5 g/l) đến 1 000 ml với nước khử ion hoặc nước cất để thu được dung dịch 0,05 mol/L.
Khi bắt đầu phép thử, cho chính xác 100 ml dung dịch Ba(OH)2 vào từng chai trong ba chai chứa chất hấp thụ. Tùy vào đặc điểm và lượng vật liệu thử mà điều chỉnh thể tích dùng để bẫy. Định kỳ lấy chai sát với bình thử nghiệm để chuẩn độ. Cũng có thể chuẩn độ khi cần thiết ví dụ như khi chai thứ nhất bị vẩn đục hay trước khi quan sát được kết tủa BaCO3 trong chai thứ hai. Khi bắt đầu phép thử cần chuẩn độ cách ngày và khi đạt đến giai đoạn ổn định thì cách năm ngày chuẩn độ một lần. Sau khi lấy chai hấp thụ ra, ngay lập tức đậy lại để ngăn CO2 từ không khí đi vào. Chuyển vị trí hai chai còn lại vào vị trí gần với bình thử nghiệm và đặt vào cuối dãy một chai mới chứa dung dịch Ba(OH)2 mới. Đặc biệt nếu phép thử diễn ra lâu hơn, xác định chính xác nồng độ của dung dịch. Xử lý tương tự với tất cả các bình chứa vật liệu thử, vật liệu đối chứng, mẫu trắng, bình kiểm soát ức chế và bình kiểm soát vật liệu cấy.
Ngay khi tháo chai ra, chuẩn độ hai hoặc ba phần của dung dịch Ba(OH)2 bằng dung dịch HCl. Ghi lại thể tích dung dịch HCl cần để trung hòa.
Tính lượng CO2 bị bẫy trong bình hấp thụ theo công thức (C.4):
![]() (C.4)
(C.4)
Trong đó:
m là khối lượng CO2 bị bẫy trong chai hấp thụ, tính bằng miligam;
cA là nồng độ chính xác của dung dịch HCl, tính bằng mol trên lít;
cB là nồng độ chính xác của dung dịch Ba(OH)2, tính bằng mol trên lít;
VB0 là thể tích của dung dịch Ba(OH)2 khi bắt đầu phép thử, tính bằng mililit;
VBt là thể tích của dung dịch Ba(OH)2 vào thời điểm t trước khi chuẩn độ, tính bằng mililit;
VBz là thể tích của phần dung dịch Ba(OH)2 dùng để chuẩn độ, tính bằng mililit;
VA là thể tích dung dịch HCl dùng để chuẩn độ, tính bằng mililit;
22 là một nửa của khối lượng phân tử CO2.
Khi áp dụng các điều kiện sau:
- thể tích của dung dịch Ba(OH)2 trước và sau khi hấp thụ chính xác là 100 ml;
- toàn bộ dung dịch dùng để chuẩn độ (VB0 = VBt=VBz);
- nồng độ CB của dung dịch Ba(OH)2 chính xác là 0,0125 mol/l;
- nồng độ CA của dung dịch HCl chính xác là 0,05 mol/l;
sử dụng phương trình (C.5)
m = 1,1 x (50 - VA) (C.5)
Phụ lục C
(tham khảo)
Ví dụ về việc xác định cân bằng cacbon
C.1 Nguyên tắc
Vật liệu chất dẻo thường có thành phần phức tạp hơn so với các hợp chất phân tử thấp. Việc xác định riêng sự giải phóng CO2 hoặc BOD thường là không đủ để xác định đặc tính và chất lượng của khả năng phân hủy sinh học. Trong quá trình phân hủy sinh học, sinh khối mới được hình thành bởi các vi sinh vật và một phần của cacbon có trong vật liệu thử được chuyển vào sinh khối nhưng không bị oxy hóa sinh học. Do vậy, các thông số phân tích như sự giải phóng CO2 và BOD thường không đạt được đến 100 % giá trị lý thuyết mong muốn, mặc dù trong trường hợp này sự phân hủy sinh học của vật liệu thử là hoàn toàn và sự phân rã không đủ có thể bị suy luận không đúng từ các kết quả thử. Việc xác định cân bằng cacbon như mô tả trong phụ lục này có thể hữu ích trong các trường hợp xác nhận lại khả năng phân hủy sinh học hoàn toàn. Vì một cân bằng dựa trên tổng lượng cacbon thu được từ các phép đo sau: lượng cacbon có trong cacbon dioxit, lượng cacbon được sinh ra dưới dạng sinh khối mới, lượng cacbon chuyển vào các chất chuyển hóa hữu cơ tan trong nước, lượng cacbon xác định dưới dạng DOC và lượng cacbon còn lại trong vật liệu polyme chưa được phân hủy. Tổng cacbon được so sánh với lượng cacbon hữu cơ trong vật liệu thử được đưa vào trong hệ thống thử.
C.2 Cách tiến hành
Xác định BOD sinh ra như mô tả trong 8.4.
Lấy các mẫu của môi trường đã cấy tại thời điểm bắt đầu, trước khi cho thêm vật liệu thử và tại thời điểm kết thúc quá trình ủ. Việc lấy mẫu phải được tiến hành cẩn thận để thu được các mẫu thử đại diện. Cho các mẫu qua một tấm lọc màng hoặc ly tâm chúng ở tốc độ khoảng 40 000 m.s-2.
Với từng mẫu, xác định lượng sinh khối trong chất lọc ra hoặc ly tâm theo phương pháp phù hợp, ví dụ bằng phép đo protein. Xác định hoặc tính lượng cacbon trong sinh khối và tính toán sự chênh lệch này từ lượng tăng của cacbon hữu cơ trong sinh khối.
Xác định theo ISO 8245, DOC trong chất lọc của từng mẫu và tính toán lượng tăng cacbon hữu cơ. Nếu có thể, nhận dạng hợp chất hình thành DOC để xác nhận lại sự hình thành của các chất chuyển hóa tan trong nước.
Sử dụng toàn bộ mỗi lượng mẫu còn lại để xác định lượng cacbon trong polyme cặn tại thời điểm kết thúc phép thử. Đây thường là quy trình khó khăn và có thể làm hoặc trực tiếp có thể phân tích riêng polyme (xem phụ lục F) hoặc gián tiếp. Trong trường hợp trực tiếp, chiết và cân polyme cặn và tính lượng cacbon từ thành phần đã biết của polyme. Một phương pháp xác định gián tiếp là rửa, sấy khô, cân phần cặn và xác định cacbon hữu cơ tổng (TOC). Sau đó trừ đi giá trị cacbon sinh khối (nêu trên) để thu được lượng cacbon có trong polyme cặn. Một cách khác là cân chính xác cặn và xử lý chúng bằng phương pháp thích hợp để phá hủy sinh khối nhưng không phá hủy các polyme (điều này phải được kiểm tra trước). Ví dụ như sử dụng natri hypoclorit, loại bỏ phần hòa tan và cân lại mẫu. Coi như tất cả sinh khối đã bị loại bỏ và tính toán từ khối lượng thu được hàm lượng cặn polyme.
C.3 Tính cân bằng cacbon
Tính lượng cacbon bị oxy hóa sinh học CBOD (mg/l) trong vật liệu thử được đưa vào trong hệ thống thử (hàm lượng cacbon CMAT) từ phần trăm phân hủy sinh học Dt thu được trong phép thử hô hấp kế (xem 9.1), theo công thức C.1:
![]() (C.1)
(C.1)
Tính toán lượng tăng của cacbon sinh khối trong các bình thử có chứa vật liệu thử CBlO (mg/I) bằng cách so sánh sinh khối tại thời điểm bắt đầu với thời điểm kết thúc quá trình ủ, lưu ý đến lượng cacbon có trong sinh khối đo được hoặc ước lượng được CB (bắt đầu) và CB(kết thúc) theo công thức C.2.
CBIO= CB (bắt đầu) - CB (kết thúc) (C.2)
Xác định lượng tăng DOC trong suốt quá trình ủ CDOC (mg/l) bằng cách so sánh nồng độ DOC tại thời điểm bắt đầu với thời điểm kết thúc theo công thức (C.3)
CDOC=DOC(kết thúc) - DOC (bắt đầu) (C.3)
Xác định lượng cacbon hữu cơ trong các polyme cặn tại thời điểm kết thúc phép thử CPOL
Tính giá trị chênh lệch của các lượng cacbon chuyển hóa theo phần trăm của cacbon đưa vào CMAT và cộng lại để thu được cacbon tính toán CCALC (%) theo công thức C.4:
CCALC = CBOD + CBIO + CDOC + CPOL (C.4)
C.4 Ví dụ: Cân bằng cacbon của poly(β-hydroxybutyrat)2)
Cho vật liệu thử: CMAT = 600 mg/l = 334,8 mg/l cacbon
Mức độ phân hủy sinh học: Dt = 78 %
|
| CB(bắt đầu) | CB(kết thúc) | CBIO | DOC(bắt đầu) | DOC(kết thúc) | DOC | CBOD |
| mg/l | 3,2 | 61,0 | 57,8 | 2,0 | 22,0 | 20,0 | 261 |
| % CMAT |
|
| 17,2 |
|
| 6,0 | 78 |
Tính cân bằng cacbon: CCALC = 78 % + 17 % + 6 % = 101 % CMAT
Phụ lục D
(tham khảo)
Ví dụ xác định lượng và khối lượng phân tử của polyme không hòa tan trong nước còn lại khi kết thúc phép thử phân hủy sinh học
Sử dụng quy trình đo lượng và khối lượng phân tử của các polyme còn lại khi kết thúc nghiên cứu có thể hữu dụng. Có thể dùng phương pháp sau đây hoặc phương pháp thích hợp khác để phân tích các polyme không hòa tan trong nước nhưng hòa tan trong dung môi hữu cơ không trộn được với nước.
a) Cho hỗn hợp kiểm tra vào phễu chiết, thêm dung môi hữu cơ thích hợp và lắc trong 10 min đến 20 min để chiết các polyme còn lại. Tách lớp dung môi hữu cơ ra khỏi lớp dung dịch. Thêm dung môi mới và lặp lại quy trình.
b) Trộn lẫn các phần hữu cơ chiết được ra và cho bay hơi dung môi đến khô. Hòa tan mẫu chất rắn trong một thể tích nước giải hấp thích hợp.
c) Sử dụng một bơm tiêm vi lượng, tiêm một lượng thích hợp vào thiết bị sắc ký lỏng hiệu năng cao (HPLC) có một cột chứa gel sử dụng trong sắc ký khí thẩm thấu gel. Bắt đầu phân tích và ghi phổ.
d) Xác định lượng polyme có mặt bằng cách sử dụng đồ thị hiệu chuẩn.
e) Xác định khối lượng phân tử polyme bằng cách tiêm vào trong sắc phổ polyme cùng loại, hoặc polyme có cấu trúc tương tự polyme thử mà đã biết khối lượng phân tử. Mối liên hệ giữa thời gian lưu và khối lượng phân tử thu được từ sắc phổ cuối cùng. Tính khối lượng phân tử từ liên hệ này.
Khối lượng phân tử của polyme thử cũng có thể xác định được bằng phương pháp HPLC với detector loại kết hợp giữa quét tia-laser góc hẹp (LALLS) và chỉ số khúc xạ vi sai (RI).
Phụ lục E
(tham khảo)
Thư mục tài liệu tham khảo
[1] ASTM D 3536-91, Molecular weight averages and molecular weight distribution by liquid exclusion chromatography (GEL permeation chromatography- GPC).
[2] ISO 8192:1986, Water quality - Test for inhibition of oxygen consumption by activated sludge.
[3] ISO 11923, Water quality - Determination of suspended solids by filtration through glass-fibre filters.
[4] MüLLER, R.-J., AUGUSTA, J., and PANTKE, M. (1992), An Interlaboratory Investigation Into Biodegradation of Plastics; Part 1: A Modified Sturm Test, Material and Organisms, 27/3, pip. 179- 189.
[5] PüCHNER, p., MUELLER, W.R., and BARDTKE, D. (1995), Assessing the Biodegradation Potential of Polymers in Sreening and Long-term Test Systems, J.Environm. Polymer Degradation, 3, pp. 133-143.
[6] PüCHNER, P., MUELLER, W.R., and BARDTKE, D. (1995), Assessing the ӓaeroben und anaeroben bedingungen, Dissertation, Stuttgart University Fakultat für Bauingenieurwesen, Stuttgarter Berichte zur Abfallwirtschaft, 59, Erich Schmidt Verlag, Berlin.
[7] SPERANDIO, A., and PüCHNER, P. (1993), Bestimmung der Gesamtprotelne als Biomasse- Parameter in wӓßrigen Kulturen und auf Trӓgermaterialien aus Bio-Reaktoren, gwf Wasser; Abwasser, 134, pp.482-485,
[8] URSTADT, S., AUGUSTA J., MüLLER, R.-J., and DECKWER, W.-D. (1995), Calculation of Carbon Balances for the Evaluation of Biodegradability of Polymers, J.Environm. Polymer Degradation, 3 (3), pp. 121-131.
2) Thu thập từ: Puchner (1994) (tài liệu tham khảo [6] trong phụ lục E)
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 11319:2016 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 11319:2016 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 11319:2016 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 11319:2016 DOC (Bản Word)