- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn quốc gia TCVN 13915-3:2023 Chất lượng nước - Các phép đo sinh lý và sinh hóa trên cá - Phần 3
| Số hiệu: | TCVN 13915-3:2023 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Tài nguyên-Môi trường |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
29/12/2023 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 13915-3:2023
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 13915-3:2023
TIÊU CHUẨN QUỐC GIA
TCVN 13915-3:2023
ISO 23893-3:2013
CHẤT LƯỢNG NƯỚC - CÁC PHÉP ĐO SINH LÝ VÀ SINH HÓA TRÊN CÁ - PHẦN 3: XÁC ĐỊNH VITELLOGENIN
Water quality- Biochemical and physiological measurements on fish - Part 3: Determination of vitellogenin
Lời nói đầu
TCVN 13915-3:2023 hoàn toàn tương đương với ISO 23893-3:2013.
TCVN 13915-3:2023 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC 147 Chất lượng nước biên soạn, Viện Tiêu chuẩn Chất lượng Việt Nam đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ TCVN 13915 (ISO 23893), Chất lượng nước - Các phép đo sinh lý và sinh hóa trên cá gồm các tiêu chuẩn sau:
- TCVN 13915-1:2023 (ISO 23893-1:2007), Phần 1: Lấy mẫu cá, xử lý và bảo quản mẫu;
- TCVN 13915-2:2023 (ISO 23893-2:2007), Phần 2: Xác định ethoxyresorufin-o-deethylase (EROD);
- TCVN 13915-3:2023 (ISO 23893-3:2013), Phần 3: Xác định Vitellogenin
Lời giới thiệu
Vitellogenin (Vtg) là một phospholipoglycoprotein lớn được tạo ra giống tiền chất protein lòng đỏ trứng trong gan của động vật đẻ trứng có xương sống, chẳng hạn như cá. Vtg được tiết ra từ tế bào gan qua đường bài tiết, đi vào vòng tuần hoàn và được tế bào trứng đang phát triển hấp thụ. Nồng độ vtg trong huyết tương thường là chỉ thị cho tình trạng trưởng thành của cá cái, xem tài liệu tham khảo [2], [18]. Hơn một thập kỷ trước, một số nghiên cứu đã chứng minh rằng cá đực ở sông và suối có nồng độ Vtg trong huyết tương cao (ví dụ: Tài liệu tham khảo [14], [23]), do các hóa chất hoạt động giống như oestrogen có trong môi trường. Do đó, nhiều nghiên cứu đã chỉ ra rằng Vtg ở cá là một dấu hiệu sinh học có phản ứng cao đối với các hợp chất oestrogen trong cả nuôi cấy tế bào gan in vitro, nghiên cứu bế cá in vivo và nghiên cứu hiện trường, xem Tài liệu tham khảo [1], [2], [10], [13], [16], [20], [26], Do đó, Vtg trong cá trở thành dấu hiệu sinh học được chấp nhận về sự tiếp xúc xenoestrogen và antiestrogen của hóa chất, nước thải và chất thải, đồng thời đã được đề xuất trong thử nghiệm hóa học cũng như các chương trình quan trắc môi trường, ví dụ: Tài liệu tham khảo [13].
Tuy nhiên, các phân tích di truyền và miễn dịch gần đây đã chứng minh sự đa dạng chung của các dạng Vtg ở cá, Tài liệu tham khảo [9], [10], Nồng độ của các protein Vtg tuần hoàn (hoặc các bản mã gen Vtg) trong quá trình tạo trứng và mức độ cảm ứng của chúng bởi oestrogen có vẻ khác nhau giữa các loài và giữa các loại Vtg khác nhau trong một loài. Động học của việc tạo ra các loại vtg khác nhau bằng oestrogen trong cá phụ thuộc vào các yếu tố môi trường (ví dụ: nhiệt độ nước và thời gian chiếu sáng), giai đoạn chu kỳ sống, giới tính, nồng độ và loại hợp chất oestrogen. Dựa vào những phát hiện này, điều quan trọng mà mục tiêu Vtg trong xét nghiệm sinh học về oestrogen, ở một loài cụ thể được chứng minh là dạng oestrogen đáp ứng và xét nghiệm đó được xác nhận với các loài được đề cập trước khi thực hiện chương trình quan trắc [10].
Tài liệu khoa học có rất nhiều ấn phẩm về quy trình xác định Vtg trong mẫu cá, sử dụng xét nghiệm miễn dịch. Trong khi xét nghiệm miễn dịch phóng xạ (RIA) là phương pháp chiếm ưu thế trong những năm 1980 và đầu những năm 1990, ví dụ: Tài liệu tham khảo [4], [29], xét nghiệm hấp thụ miễn dịch liên kết với enzym (ELISA) là nguyên tắc chủ đạo hiện nay. Cả nguyên tắc ELISA sandwich và ELISA cạnh tranh đều đưa ra kết quả nhạy mà không cần sử dụng đồng vị phóng xạ và đã được áp dụng thành công để xác định mức Vtg ở một số loài cá, ví dụ: Tài liệu tham khảo [3], [6], [8], [12], [15], [17], [19], [21], [22], [24], [25], [27], [28], [31], [32].
Tiêu chuẩn này trình bày một quy trình chung cho cả ELISA sandwich và ELISA cạnh tranh để sử dụng cho việc định lượng Vtg trong mẫu huyết tương cá. việc áp dụng các phương pháp tiêu chuẩn hóa rất được khuyến nghị trong các chương trình quan trắc.
CHẤT LƯỢNG NƯỚC - CÁC PHÉP ĐO SINH LÝ VÀ SINH HÓA TRÊN CÁ - PHẦN 3: XÁC ĐỊNH VITELLOGENIN
Water quality- Biochemical and physiological measurements on fish - Part 3: Determination of vitellogenin
CẢNH BÁO — Người sử dụng tiêu chuẩn này cần phải thành thạo với các thực hành trong phòng thử nghiệm thông thường. Tiêu chuẩn này không đề cập tới mọi vấn đề an toàn đối với người sử dụng tiêu chuẩn. Người sử dụng có trách nhiệm xây dựng biện pháp bảo đảm an toàn và sức khỏe phù hợp với các quy định của quốc gia.
QUAN TRỌNG — Điều cần thiết là các thử nghiệm được tiến hành theo tiêu chuẩn này phải được thực hiện bởi nhân viên có trình độ phù hợp.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp đo nồng độ vitellogenin (Vtg) trong mẫu huyết tương cá sử dụng phương pháp phân tích miễn dịch hấp thụ liên kết enzym (ELISA).
Tiêu chuẩn này áp dụng cho cá được lấy mẫu trong môi trường (nước ngọt, nước cửa sông hoặc nước mặn) và cá được tiếp xúc với các chất hoặc chất thải trong phòng thử nghiệm. Phương pháp này là phương pháp định lượng khi sử dụng các kháng thể Vtg và chất chuẩn Vtg đặc trưng cho loài được chọn.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 13915-1 (ISO 23893-1), Chất lượng nước - Các phép đo sinh lý và sinh hóa trên cá - Phần 1: Lấy mẫu cá, xử lý và bảo quản mẫu.
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau đây.
3.1
Giới hạn phát hiện (limit of detection)
LOD
Lượng thấp nhất có thể đo được với độ không đảm bảo thống kê hợp lý.
VÍ DỤ: LOD thường được biểu thị theo giá trị trắng của thuốc thử cộng với ba lần độ lệch chuẩn của nó.
CHÚ THÍCH 1: Phương pháp LOD được xác định bằng cách đưa hệ số pha loãng mẫu vào tính toán.
3.2
Giới hạn định lượng (limit of quantification)
LOQ
Lượng bằng hoặc lớn hơn điểm nồng độ thấp nhất trong đường chuẩn.
VÍ DỤ: LOQ thường được biểu thị bằng giá trị trắng của thuốc thử cộng với 10 lần độ lệch chuẩn của nó.
CHÚ THÍCH 1: LOQ cũng được xác định bằng cách đưa hệ số pha loãng mẫu vào tính toán
3.3
Mẫu trắng nền (matrix blank)
Mẫu đại diện không chứa các mức có thể phát hiện được của chất phân tích.
CHÚ THÍCH 1: Trong tiêu chuẩn này, chất cần phân tích là vitellogenin.
3.4
Tính chọn lọc (selectivity)
Khả năng đo một cách chính xác nhất chất phân tích với sự có mặt của các thành phần dự kiến có trong nền mẫu đó.
CHÚ THÍCH 1: Trong tiêu chuẩn này, chất phân tích là vitellogenin và nền mẫu là huyết tương.
CHÚ THÍCH 2: Tính chọn lọc được thể hiện bằng cách sử dụng “mẫu trắng nền”.
4 Nguyên tắc
Các mẫu huyết tương của cá thu được theo quy định trong TCVN 13915-1 (ISO 23893-1), có bổ sung chất ức chế protease (xem 7.13 và 9.2). Vitellogenin có trong mẫu được xác định bằng phép thử nghiệm miễn dịch dựa trên kháng thể, sử dụng một trong hai phương án đã thiết lập.
Phương án thứ nhất, được gọi là ELISA kiểu sandwich, mẫu huyết tương được cho phản ứng với một kháng thể bắt giữ Vtg đặc hiệu (từ cùng một loài hoặc một loài có quan hệ họ hàng gần), trong giếng của đĩa chuẩn độ được phủ kháng thể. Sau đó, sử dụng một kháng thể phát hiện vtg được gắn nhãn enzym để tạo kháng thể "kiểu sandwich" mà có thể phát hiện được dựa trên cơ chất tạo màu cho nhãn enzym (ví dụ: peroxidase cá ngựa), có thể sử dụng kháng thể thứ cấp được gắn nhãn enzym để xây dựng phép thử, nếu kháng thể phát hiện không được đánh dấu. Dãy chất chuẩn dựa trên mẫu chuẩn tinh khiết (protein vtg từ cùng loài hoặc có quan hệ họ hàng gần) được sử dụng để phát triển mối quan hệ định lượng giữa tín hiệu mẫu và lượng chất chuẩn.
Phương án thứ hai là kỹ thuật ELISA cạnh tranh, trong đó Vtg mẫu cạnh tranh với Vtg tinh khiết được phủ lên thành đĩa chuẩn độ để liên kết với kháng thể Vtg (được gắn nhãn (đánh dấu) hoặc không gắn nhãn) trong dung dịch. Sự phát triển tín hiệu phân tích tuân theo nguyên tắc tương tự như trong kiểu sandwich, mặc dù dãy chất chuẩn tạo ra mối quan hệ tỷ lệ nghịch với cường độ tín hiệu.
Chỉ các kháng thể Vtg hoặc phép thử Vtg đã được chứng minh phù hợp với các tiêu chí tính năng của các loài cá cụ thể được nghiên cứu mới được sử dụng trong quy trình này.
5 Tiêu chí tính năng tối thiểu
Các tiêu chí được liệt kê bên dưới được coi là tính năng tối thiểu có thể chấp nhận được từ quan điểm của người dùng về mục đích thực hiện phân tích Vtg. Các tiêu chí tính năng cụ thể cần được thiết lập cho từng phép phân tích được sử dụng trong nghiên cứu dựa trên tính năng nội bộ (trong phòng thử nghiệm).
| Tính chọn lọc: | Mẫu trắng nền < LOD (với hệ số pha loãng cần thiết để tránh hiệu ứng nền mẫu) |
| Hiệu chuẩn: | Khoảng làm việc của đường chuẩn >10 lần, tốt nhất là 50 lần đến 100 lần với khoảng động được tìm thấy ở nồng độ Vtg. |
| Độ thu hồi: | > 50 % |
CHÚ THÍCH: Đặc trưng của "hiệu ứng nền mẫu" là một vấn đề khó để đảm bảo rằng "mẫu trắng nền" thực sự không có bất kỳ Vtg nào.
6 Môi trường thử nghiệm
Tất cả các thao tác xử lý mẫu huyết tương và chất chuẩn bao gồm phép đo phải được thực hiện ở nhiệt độ (4 ± 2) °C hoặc trên đá bào, trừ khi được chỉ định trong quy trình thử nghiệm.
7 Thuốc thử
Chỉ sử dụng thuốc thử tinh khiết cấp phân tích được công nhận, trừ khi có quy định khác.
7.1 Axit sunfuric, dung dịch dừng phản ứng, 0,3 mol/L hoặc 1,5 mol/L.
7.2 Đá bào.
7.3 Dung dịch đệm phủ, cacbonat-bicacbonat 50 mmol/L, pH 9,6.
7.4 Dung dịch đệm rửa, dung dịch muối đệm phosphat (PBS), pH 7,3, chứa chất tẩy rửa polysorbat 20 nồng độ 0,5 g/L.
7.5 Dung dịch đệm khóa (blocking), dung dịch đệm rửa chứa 10 g/L albumin huyết thanh bò (BSA).
7.6 Dung dịch đệm pha loãng, 10 g/L BSA trong PBS.
7.7 Dung dịch đệm nền, dung dịch đệm phosphat trong xitric, pH 5,0.
7.8 Mẫu đối chứng Vtg
7.9 Kháng thể bắt giữ, đơn dòng hoặc đa dòng kháng Vtg[1])
7.10 Kháng thể phát hiện, kháng Vtg đơn dòng hoặc đa dòng không liên hợp (tiếp hợp) hoặc tiếp hợp với horseradish peroxidase, HRP. Trong phương án thay thế khi kháng thể phát hiện không tiếp hợp, thì kháng thể phát hiện phải được thu hoạch từ loài khác với kháng thể bắt giữ,
7.11 Kháng thể thứ cấp[2]), kháng thể với Fc (có thể kết tinh mảnh) của kháng thể phát hiện, được tiếp hợp với HRP.
7.12 Chất nền peroxidase, tetramethylbenzidin (TMB), hoặc ortho-phenylenediamin (OPD) + H2O2.
7.13 Chất ức chế protease, như aprotinin.
8 Thiết bị, dụng cụ
8.1 Đĩa chuẩn độ 96 giếng, trong suốt, đáy phẳng, hấp thụ.
8.2 Đĩa chuẩn độ 96 giếng, trong suốt, đáy phẳng, không hấp thụ, dành cho kiểu ELISA cạnh tranh.
8.3 Màng làm kín vi đĩa.
8.4 Đầu đọc vi đĩa, bước sóng 450 nm hoặc 490 nm, tùy thuộc vào cơ chất được sử dụng.
8.5 Pipet, có đầu tip dùng một lần, dung tích từ 5 pL đến 1 000 µL.
8.6 Pipet nhiều kênh và bình chứa thuốc thử. Ngoài ra, có thể sử dụng pipet có đầu tip dùng một lần (100 µL).
8.7 Ống nghiệm, dung tích từ 1 mL đến 50 mL.
8.8 Dụng cụ rửa vi đĩa. Nên sử dụng máy rửa đĩa tự động hoặc thủ công, nhưng cũng có thể sử dụng chai bóp hoặc pipet nhiều kênh.
8.9 Máy vortex.
9 Quy trình lấy mẫu
9.1 Lấy mẫu cá
Việc lấy mẫu cần được thực hiện trong môi trường tự nhiên bằng đánh bắt cá hoặc với cá được tiếp xúc với các chất hoặc chất thải trong phòng thử nghiệm như quy định trong TCVN 13915-1 (ISO 23893-1).
Lấy mẫu tối thiểu 10 cá thể cá cùng loài, cùng giới tính và có kích thước đồng đều từ mỗi nhóm để kiểm tra nồng độ Vtg. Không lấy mẫu trong mùa sinh sản vì hành vi và hoạt động sinh lý của cá có thể bị thay đổi bởi hoạt động sinh dục (trừ khi những khía cạnh này là một phần của thiết kế nghiên cứu).
Tính đến các yếu tố có khả năng ảnh hưởng đến nồng độ Vtg, các điều kiện sau phải được xác định và ghi lại trong báo cáo thử nghiệm:
a) Nhiệt độ nước;
b) Ngày;
c) Thời gian trong ngày;
d) Mô tả chung về tình trạng sức khỏe của từng cá thể cá (giới tính, chiều dài, khối lượng cơ thể, sự xuất hiện các tổn thương bên ngoài và bên trong) sự mô tả này thường được báo cáo liên quan đến việc lấy mẫu như trong TCVN 13915-1 (ISO 23893-1).
Tùy theo mục tiêu nghiên cứu, đảm bảo cá đối chứng (từ địa điểm đối chiếu hoặc nhóm phòng thử nghiệm) được lấy từ môi trường có chất lượng sinh thái tốt. Xử lý cá đối chứng và các mẫu thu được theo cách tương tự như xử lý cá từ các nhóm được kiểm tra hoặc xử lý thử nghiệm, trừ việc tiếp xúc với các chất quan tâm.
9.2 Lấy mẫu huyết tương
Sau khi đánh bắt hoặc khi kết thúc tiếp xúc, giết cá và lấy mẫu máu từng cá thể khi được vớt ra khỏi nước, như quy định trong TCVN 13915-1 (ISO 23893-1). Cần lấy càng nhanh càng tốt một lượng máu khoảng 20 µL đến 100 µL hoặc nhiều hơn từ mỗi cá thể cá khi cá bị giết. Mẫu máu được lấy bằng xyranh có heparin, tốt nhất là lấy từ mạch máu ở phần đuôi hoặc chọc vào tim. Mẫu máu phải được xử lý trực tiếp để tạo ra huyết tương bằng cách ly tâm các lọ ở tốc độ 3 000 g trong 10 min ở 4 °C (hoặc 7 000 g trong 3 min) và phần nổi phía trên (huyết tương) được chia thành các phần nhỏ. Mẫu huyết tương được chuyển ngay vào các lọ đã chứa chất ức chế protease (ví dụ: aprotinin ở mức 2 đơn vị chất ức chế trypsin [TIU]/mL).
Quy trình đồng nhất toàn bộ cơ thể cá (WBH) thay thế (xem chú thích): Đồng hóa gan hoặc toàn bộ cơ thể cá trong dung dịch đệm mẫu lạnh (1+2 khối lượng + thể tích; PBS, 10 g/L BSA với aprotinin ở mức 2 TIU/mL) cho đến khi mô được đồng nhất, ví dụ: bằng dụng cụ đồng hóa cầm tay bằng thủy tinh, dung tích 7 mL.
CHÚ THÍCH: Khi sử dụng các loài cá nhỏ (ví dụ: cá gạo, cá sọc vằn), hoặc ấu trùng hoặc cá con từ giống cá lớn hơn, có thể không lấy được đủ lượng huyết tương để xác định vtg. Trong những trường hựp này, gan hoặc WBH có thể được chuẩn bị và sử dụng thay thế (xem Tài liệu tham khảo [9], [10]).
9.3 Bảo quản mẫu huyết tương
Nếu không thể thực hiện phép xác định Vtg vào ngày lấy mẫu, thì phải làm đông lạnh ngay các mẫu huyết tương xuống dưới -70 °C, ví dụ: sử dụng nitơ lỏng hoặc đá khô. Các mẫu này có thể được bảo quản đến 12 tháng trong nitơ lỏng hoặc ở nhiệt độ dưới -70 °C.
Nếu các phép đo Vtg được bắt đầu vào ngày lấy mẫu, thì bước chuẩn bị phải được bắt đầu trong 1 h và các mẫu huyết tương phải được bảo quản ở nhiệt độ bằng hoặc thấp hơn 4 °C.
10 Quy trình phân tích
10.1 Chuẩn bị mẫu
Vtg là phân tử không ổn định và tất cả các mẫu và dung dịch pha loãng chất chuẩn phải được chuẩn bị và giữ trên đá lạnh. Trước khi tiến hành phép xác định, cần chuẩn bị một dãy các mẫu pha loãng. Sau khi làm tan băng các mẫu và chất chuẩn Vtg trên đá, chuẩn bị ít nhất ba độ pha loãng khác nhau của mỗi mẫu và dãy dung dịch pha loãng chất chuẩn có nồng độ gấp đôi trong dung dịch đệm pha loãng/đệm khóa. Mức pha loãng của các mẫu phải nằm trong khoảng từ khoảng 1 → 50 đến 1 → 500 000 và dãy dung dịch pha loãng chất chuẩn phải bao gồm 9 bước pha loãng đến 11 bước pha loãng.
10.2 Xác định vitellogenin
10.2.1 Hiệu chuẩn
Thực hiện hiệu chuẩn sử dụng mẫu đối chiếu Vtg đã tinh sạch. Mẫu đối chiếu được sử dụng để dựng đường chuẩn, dựa vào đường chuẩn để định lượng các mẫu chưa biết, Vtg là phân tử không ổn định và tất cả các mẫu, dung dịch pha loãng chất chuẩn phải được chuẩn bị và giữ trong đá lạnh. Không làm đông lạnh vtg đã hoàn nguyên và tái sử dụng tiếp. Dãy pha loãng [ví dụ: từ 2 ng/mL đến 1 000 ng/mL) được chuẩn bị từ chất chuẩn Vtg mới được hoàn nguyên cần được chạy trong từng phân tích.
10.2.2 Quy trình phân tích 1 - ELISA kiểu sandwich
Các quy trình phân tích 1 và 2 đã mô tả phản ánh các nguyên tắc chung của phương pháp ELISA. Tùy theo loài và nguồn gốc của kháng thể hoặc chất chuẩn được sử dụng, mà các điều kiện thực nghiệm có thể khác nhau, đặc biệt là về thời gian ủ, thành phần dung dịch đệm, độ pha loãng của mẫu và chất chuẩn.
Trong phương pháp ELISA kiểu sandwich, các giếng của vi đĩa được phủ trước bằng kháng thể bắt giữ liên kết đặc hiệu với Vtg trong chất chuẩn và các mẫu được cho vào các giếng. Bổ sung kháng thể phát hiện đặc hiệu Vtg khác để tạo ra lớp nằm giữa vtg và kháng thể. Toàn bộ quy trình mất 2 ngày để hoàn thành.
Quy trình này không áp dụng cho bộ kít thử. Nếu sử dụng bộ kít bán sẵn, cần làm theo hướng dẫn của nhà sản xuất.
10.2.2.1 Phủ trước các đĩa hấp thụ
Trừ khi các đĩa đã được phủ trước bằng kháng thể Vtg thích hợp được mua từ nhà cung cấp, thì việc phủ trước phải được thực hiện trước ngày thực hiện phân tích.
Pha loãng kháng thể bắt giữ trong dung dịch đệm phủ đến 10 µg/mL (yêu cầu 12 mL cho mỗi đĩa).
Bổ sung 100 µL dung dịch này vào tất cả các giếng của tất cả các đĩa được sử dụng.
Đậy kín các đĩa bằng màng làm kín vi đĩa để tránh bay hơi nước và ủ ở 4 °C qua đêm.
Sau khi ủ qua đêm, rửa các giếng ba lần với dung dịch đệm rửa dùng 200 µL cho mỗi giếng.
Khóa các vị trí liên kết không đặc hiệu bằng cách cho 200 µL dung dịch đệm pha loãng vào mỗi giếng và để trong 1 h ở 4 °C.
Làm rỗng tất cả các giếng và úp đĩa lên giấy lụa.
10.2.2.2 Ủ dung dịch chất chuẩn và mẫu pha loãng
Khi có nhiều hơn một đĩa được chạy trong phép phân tích, hoàn thành việc bổ sung cả dung dịch chuẩn và dung dịch mẫu trên một đĩa trước khi chuyển sang đĩa tiếp theo.
Xem cách bố trí đĩa được gợi ý trong Hình 1.
Cho 100 µL dung dịch đệm pha loãng vào mỗi giếng trong số hai giếng liên kết không đặc hiệu [NSB]. Các giếng NSB cần được bao gồm trên mỗi đĩa. Các giếng này được sử dụng để xác định liên kết không đặc hiệu (tín hiệu nền không đặc hiệu).
Bổ sung hai lần lặp lại 100 µL dung dịch pha loãng chất chuẩn Vtg (S1 đến S11).
Bổ sung hai lần lặp lại 100 µL từng dung dịch pha loãng mẫu (P1 đến P36).
Làm kín các đĩa và ủ ở nhiệt độ phòng từ 20 °C đến 25 °C trong 1,5 h.
Đảm bảo thời gian ủ như nhau khi chạy nhiều đĩa, vì việc bổ sung chất chuẩn và mẫu thường mất vài phút. Nếu có sự khác biệt đáng kể về thời gian giữa các đĩa, chúng có thể được đồng bộ hỏa tại thời điểm này: sau 1,5 h ủ, rửa đĩa (bước 8 dưới đây), làm kín và để ở nhiệt độ phòng cho đến khi tất cả các đĩa được rửa xong. Sau đó tiến hành bổ sung kháng thể phát hiện.
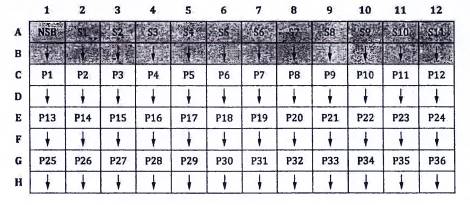
CHÚ DẪN:
| NSB: Giếng liên kết không đặc hiệu | S1 đến S11: chất chuẩn 1 đến 11 | P1 đến P36: các mẫu |
Hình 1 - Cách bố trí đĩa được khuyến nghị cho quy trình ELISA kiểu sandwich
10.2.2.3 Ủ bằng kháng thể phát hiện
Pha loãng kháng thể phát hiện đến độ pha loãng thích hợp trong 12 mL dung dịch đệm pha loãng cho mỗi đĩa được sử dụng trong lần chạy phân tích.
Rửa các đĩa ba lần bằng dung dịch đệm rửa, dùng 300 µL cho mỗi giếng.
Thêm 100 µL kháng thể phát hiện đã pha loãng vào tất cả các giếng.
Làm kín các đĩa và ủ ở nhiệt độ phòng từ 20 °C đến 25 °C trong 0,5 h.
10.2.2.4 Hiện màu
Rửa các đĩa năm lần với dung dịch đệm rửa, dùng 300 µL cho mỗi giếng.
Thêm 100 µL dung dịch nền TMB ở nhiệt độ phòng vào tất cả các giếng (TMB nhạy với ánh sáng và sau khi chuẩn bị cần được giữ ở nơi tối).
Ủ ở nơi tối (đậy các đĩa, ví dụ bằng giấy nhôm) ở nhiệt độ phòng từ 20 °C đến 25 °C trong 20 min.
Dừng phản ứng bằng cách thêm 100 µL dung dịch H2SO4 0,3 mol/L vào tất cả các giếng.
Đọc độ hấp thụ ở bước sóng 450 nm bằng đầu đọc vi đĩa.
10.2.3 Quy trình phân tích 2 - ELISA cạnh tranh
Trong quy trình ELISA cạnh tranh, việc phủ đĩa và ủ mẫu phải được thực hiện qua đêm. Do đó, toàn bộ quy trình mất 2 ngày để hoàn thành.
10.2.3.1 Phủ trước các đĩa
Xem cách bố trí các đĩa như trong Hình 2.
Chuẩn bị dung dịch Vtg đối chiếu (hoặc Vtg đã tinh sạch chỉ cho mục đích phủ) bằng cách pha loãng Vtg gốc trong dung dịch đệm phủ đến nồng độ 100 ng/mL. cần chuẩn bị khoảng 10 mL cho mỗi đĩa để dùng trong phép phân tích.
Cho 100 µL dung dịch phù này vào từng giếng của đĩa 96 giếng hấp thụ [3]). Trên mỗi đĩa giữ lại hai giếng để thêm dung dịch đệm phủ 100 µL làm các giếng NSB.
Làm kín các đĩa phủ bằng màng làm kín đĩa 96 giếng để tránh bay hơi nước và ủ qua đêm ở 4 °C.
10.2.3.2 Chuẩn bị mẫu và chất chuẩn
Pha loãng mẫu và chất chuẩn (Vtg đối chứng) trong dung dịch đệm khóa đến nồng độ thích hợp để đo trong phép phân tích.
Thêm 60 µL từng độ pha loãng với hai lần lặp lại vào các giếng của đĩa không phủ, không có chất hấp thụ.
Chỉ thêm 60 µL dung dịch đệm khóa vào hai giếng NSB và hai giếng để kiểm soát liên kết tối đa.
Thêm 60 µL dung dịch pha loãng thích hợp của kháng thể phát hiện trong dung dịch đệm khóa vào tất cả các giếng trên đĩa.
Trộn nhẹ các đĩa trên máy lắc đĩa, đậy bằng màng làm kín và ủ qua đêm ở 4°C.
10.2.3.3 Khóa (block) các đĩa
Sau khi ủ qua đêm, rửa các đĩa phủ ba lần bằng dung dịch đệm rửa.
Không để các đĩa bị khô, thêm 150 µL dung dịch đệm khóa vào từng giếng và làm kín lại các đĩa. Ủ các đĩa ở 37 °C trong 30 min.
Rửa lại các đĩa phủ ba lần bằng dung dịch đệm rửa.
10.2.3.4 Ủ mẫu
Sau khi ủ qua đêm ở 4 °C, ủ tiếp các đĩa mẫu khoảng 30 min ở 37 °C.
Chuyển 100 µL mẫu và chất chuẩn vào các giếng rỗng của các đĩa phủ đã khóa. Đảm bảo rằng các mẫu NSB được chuyển đúng vào các giếng tương ứng của các đĩa phủ.
Làm kín lại đĩa và ủ trong 1 h ở 37 °C.
Rửa đĩa ba lần bằng dung dịch đệm rửa
Nếu sử dụng kháng thể phát hiện không đánh dấu, thì thêm vào mỗi giếng 125 µL dung dịch pha loãng thích hợp của kháng thể thứ cấp được đánh dấu (ví dụ: IgG-HRP của dê kháng thỏ).
Làm kín lại các đĩa và ủ 2 h ở 37 °C.
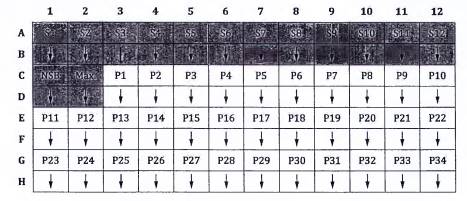
CHÚ DẪN:
| NSB các giếng liên kết không đặc hiệu | S1 đến S12 chất chuẩn 1 đến 12 |
| Max các giếng liên kết tối đa | P1 đến P34 các mẫu |
Hình 2 - Cách bố trí đĩa đối với quy trình ELISA cạnh tranh
10.2.3.5 Hiện màu
Rửa đĩa ba lần bằng dung dịch đệm rửa.
Cho vào mỗi giếng 125 µL dung dịch đệm cơ chất có chứa OPD và H2O2, được chuẩn bị ngay trước khi sử dụng. Dung dịch đệm cơ chất nhạy với ánh sáng và sau khi chuẩn bị xong phải được giữ ở nơi tối (cách khác, cho 125 µL dung dịch cơ chất TMB là chất thay thế cho OPD không gây ung thư).
Ủ các đĩa ở nhiệt độ phòng ở nơi tối cho đến khi hiện màu (thường từ 5 min đến 15 min).
Dừng phản ứng màu bằng cách bổ sung 30 µL dung dịch H2SO4 nồng độ 1,5 mol/L vào mỗi giếng.
Đọc độ hấp thụ của từng giếng trên máy đọc đĩa ở bước sóng 490 nm (450 nm đối với TMB).
10.2.4 Tính toán kết quả - Quy trình ELISA kiểu sandwich
10.2.4.1 Phép trừ các giá trị độ hấp thụ NSB
Trên mỗi đĩa, tính trung bình của các giá trị độ hấp thụ của hai giếng NSB và lấy giá trị độ hấp thụ của tất cả các giếng khác trên cùng một đĩa trừ đi giá trị này. Do đó thu được các giá trị độ hấp thụ đã hiệu chính NSB đối với các dung dịch pha loãng mẫu và chất chuẩn. Giá trị NSB trung bình không được cao hơn 0,2 đơn vị độ hấp thụ.
10.2.4.2 Dựng đường chuẩn
Tính giá trị trung bình của các giá trị độ hấp thụ đã hiệu chính NSB cho từng cặp lặp lại chất chuẩn.
Đơn vị độ hấp thụ của chất chuẩn cao nhất phải cao hơn 2,0.
Chênh lệch nồng độ không được quá 15 % giữa hai giếng lặp lại đối với bất kỳ giá trị chất chuẩn nào.
Vẽ các giá trị độ hấp thụ theo nồng độ Vtg. Thực hiện phân tích hồi quy, sử dụng ví dụ log-log (Hình A.1), chuyển đổi tuyến tính (Hình A.2) hoặc bốn thông số (Hình A.3) của dữ liệu.
Xác định khoảng làm việc của đường chuẩn. Không cần bao gồm các điểm dữ liệu có giá trị độ hấp thụ đã hiệu chính NSB thấp hơn 0,010.
10.2.4.3 Tính toán nồng độ Vtg trong các mẫu
Tính giá trị trung bình của các giá trị độ hấp thụ đã hiệu chính NSB cho từng cặp mẫu lặp.
Tính nồng độ Vtg trong mẫu đã pha loãng sử dụng công thức đối với đường chuẩn đã điều chỉnh xác định được ở trên.
Nhân nồng độ Vtg trong mẫu pha loãng với hệ số pha loãng để có nồng độ Vtg trong mẫu ban đầu.
Sử dụng các hướng dẫn sau đây khi xác định nồng độ Vtg trong các mẫu.
Chênh lệch nồng độ không được quá 15 % giữa hai giếng lặp lại đối với mẫu nhất định. Nếu không, cần lặp lại phép phân tích.
Chỉ nên sử dụng các dung dịch pha loãng mẫu có các giá trị độ hấp thụ nằm trong khoảng làm việc của đường chuẩn (xem ví dụ sau đây).
Nếu tất cả các độ pha loãng của mẫu cho các giá trị độ hấp thụ nằm ngoài khoảng làm việc, thì mẫu đó phải được phân tích lại ở các độ pha loãng khác.
Nếu có nhiều hơn một độ pha loãng của mẫu nằm trong khoảng làm việc của đường chuẩn, thì tính nồng độ Vtg trung bình.
Nếu các độ pha loãng khác nhau cho kết quả tương phản, thì cần thận trọng để xác định độ pha loãng nào là đáng tin cậy nhất, cần chú ý khi sử dụng các mẫu có giá trị độ hấp thụ gần cuối hoặc phần ngang bằng của đường chuẩn vì các phần này của đường chuẩn ít tin cậy hơn. Tốt nhất là các mẫu như vậy nên được phân tích lại với nhiều độ pha loãng hơn.
10.2.5 Tính toán kết quả - Quy trình ELISA cạnh tranh
10.2.5.1 Tính toán liên kết tối đa tương đối
Tính giá trị trung bình của tất cả các giếng lặp lại hai lần (hoặc ba lần) cho cả mẫu, chất chuẩn, NSB và các giếng liên kết tối đa.
Tính liên kết tối đa tương đối bằng Công thức (1):
![]()
Trong đó:
![]() là mật độ quang trung bình của các chất chỉ thị (chất hấp thụ) đối với trường hợp cụ thể;
là mật độ quang trung bình của các chất chỉ thị (chất hấp thụ) đối với trường hợp cụ thể;
NSB là giếng liên kết không đặc hiệu;
B0 là giếng liên kết tối đa
10.2.5.2 Chuẩn bị đường chuẩn
Chuẩn bị đường chuẩn bằng cách vẽ đồ thị các giá trị của B/B0 thu được đối với từng chất chuẩn theo nồng độ Vtg (xem Hình 3).
10.2.5.3 Tính nồng độ Vtg trong các mẫu
Sử dụng đường chuẩn và phần mềm thống kê thích hợp có thể tính được nồng độ Vtg trong từng mẫu huyết tương. Chọn độ pha loãng của mẫu cho các giá trị gần nhất với liên kết 50 % và nằm trong khoảng làm việc từ 30 % đến 80 % B/B0 của phân tích.
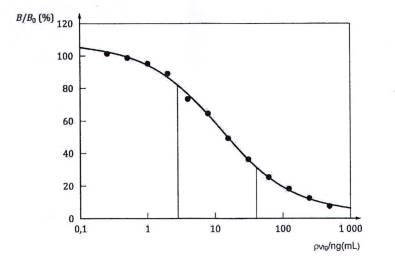
CHÚ DẪN:
B/B0 Giếng liên kết tối đa tương đối
ρVtg Nồng độ Vtg
Các đường thẳng đứng chỉ thị khoảng làm việc xấp xỉ của thử nghiệm (liên kết từ 30 % đến 80 % xấp xỉ từ 2 ng/L đến 40 ng/L Vtg). Sử dụng độ pha loãng thích hợp, B/B0 cho mỗi mẫu cần ở trong khoảng khoảng này, trên phần tuyến tính của đường chuẩn.
Hình 3 - Đường chuẩn Vtg trong quy trình ELISA cạnh tranh điển hình
11 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm ít nhất các thông tin sau:
a) Phương pháp thử đã sử dụng, viện dẫn tiêu chuẩn này TCVN 13915-3 (ISO 23893-3:2013);
b) Ngày và thời gian lấy mẫu, nhiệt độ nước, thông tin về trạm đánh bắt cá (môi trường tự nhiên) hoặc lô cá (phòng thử nghiệm), số lượng cá được lấy mẫu [như quy định trong TCVN 13915-1 (ISO 23893-1)];
c) Đối với từng loài cá: chiều dài, khối lượng cơ thể, giới tính, chẩn đoán tóm tắt về tình trạng sức khỏe của cá [như quy định trong TCVN 13915-1 (ISO 23893-1)];
d) Đối với mỗi loài cá, nồng độ Vtg tính được theo 10.2.4.3 hoặc 10.2.5;
e) Bảng tóm tắt hoặc biểu đồ nồng độ Vtg, ρVtg trong các nhóm cá khác nhau ![]() trong đó s là độ lệch chuẩn), biểu thị sự khác biệt thống kê tính được bằng phương pháp thích hợp;
trong đó s là độ lệch chuẩn), biểu thị sự khác biệt thống kê tính được bằng phương pháp thích hợp;
f) Kết quả từ các chất chuẩn nội (kiểm chứng dương và kiểm chứng âm, CRM, nếu có);
g) Tất cả các chi tiết thao tác không được quy định trong tiêu chuẩn này hoặc được coi là tùy chọn, cùng với các chi tiết về mọi tình huống nào có thể ảnh hưởng đến kết quả.
Phụ lục A
(Tham khảo)
Ví dụ về kết quả: quy trình ELISA kiểu sandwich đối với cá tuế đầu béo
A.1 Khái quát
Xem Bảng A.1 và Hình A.1 đến Hình A.3, nguồn: Tài liệu tham khảo [33].
A.2 Đánh giá xác nhận trong phòng thử nghiệm đơn lẻ - Quy trình ELISA kiểu sandwich Vtg đối với cá tuế đầu béo
Đánh giá xác nhận của một phòng thử nghiệm (nội bộ) được thực hiện dựa trên các hướng dẫn quốc tế, xem Tài liệu tham khảo [5], [11]. Nồng độ Vtg đo được trong mẫu trắng (dung dịch đệm pha loãng, huyết tương hoặc WBH) cũng như trong dung dịch đệm, huyết tương hoặc WBH được thêm chuẩn với các mức Vtg: 0,5 ng/mL, 2,5 ng/mL và 12,5 ng/mL. Các mẫu được chia thành các phần nhỏ và cấp đông lạnh ở -80 °C, trong năm ngày liên tiếp, ba phần nhỏ của từng mẫu được rã đông và phân tích độc lập (n = 15 phép phân tích độc lập). Tất cả các phép tích được thực hiện lặp lại ba lần (ba giếng ELISA cho mỗi độ pha loãng mẫu hoặc chất chuẩn). Ngoài ra, một số mẫu mới thêm chuẩn cũng được phân tích (độ chọn lọc, độ thu hồi).
| Độ chọn lọc (hiệu ứng nền): | không phản ứng ở độ pha loãng ít nhất = 1 → 50 (huyết tương) 1 → 100 (WBH) |
| Hiệu chuẩn và khoảng làm việc: | khoảng tuyến tính 0,1 ng/mL đến 25 ng/mL; 250 lần (n = 15 đường chuẩn) |
| Độ chụm trong ngày: hệ số biến thiên của độ lặp lại Cv,r. | 6,0 % |
| Độ chụm giữa các ngày: hệ số biến thiên của độ lặp lại, Cv,r. | 7,7 % |
| Độ chính xác (độ thu hồi): | 75 % (mẫu cấp đông và rã đông); 79 % đến 106 % (mẫu mới thêm chuẩn) |
| Giới hạn phát hiện (LOD), giới hạn định lượng (LOQ): | LOD 1,0 ng/mL (huyết tương), 4,0 ng/mL (WBH); LOQ 4,5 ng/mL (huyết tương), 11,0 ng/mL (WBH) |
| Độ chụm trong ngày: hệ số biến thiên Độ chụm giữa các ngày: hệ số biến thiên Cv,r: | 4,5 % |
| Độ chụm giữa các ngày: hệ số biến thiên của độ lặp lại Cv,r: | 9,9 % |
| Độ không đảm bảo: | Nhiệt độ ủ và dung dịch đệm tăng ảnh hưởng lớn đến Vtg |
| So sánh với các phương pháp hiện có: | Bộ kit thử Biosene Carp4 Vtg Elisa: R2 > 0,99, bộ kit Competitor FHM[4]) Vtg Elisa: R2 > 0,99 |
CHÚ THÍCH: R2 là hệ số tương quan của đường chuẩn đã thu được bằng phân tích hồi quy tuyến tính.
Bảng A.1 - Đường chuẩn cả tuế đầu béo Vtg trong quy trình ELISA kiểu sandwich: các số đọc hấp thụ và các kết quả hấp thụ NSB
| Chuẩn Vtg các tuế đầu béo Vtg nồng độ | Hấp thụ tại 450 nm | Độ hấp thụ đã hiệu chính NSBa |
| 50 | 4,589 | 4,535 |
| 25 | 3,453 | 3,399 |
| 12,5 | 1,939 | 1,885 |
| 6,25 | 1,029 | 0,975 |
| 3,13 | 0,553 | 0,498 |
| 1,56 | 0,298 | 0,244 |
| 0,78 | 0,169 | 0,115 |
| 0,39 | 0,109 | 0,055 |
| 0,20 | 0,080 | 0,026 |
| 0,10 | 0,066 | 0,012 |
| 0,05 | 0,059 | 0,005 |
| * Giá trị hấp thụ NSB trung bình: 0,054 | ||
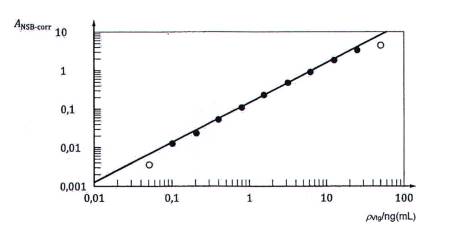
CHÚ DẪN:
| ANSB-corr Độ hấp thụ đã hiệu chính NSB | ρVtg Nồng độ | o Điểm dữ liệu bỏ qua |
Hình A.1 - Đường Log-log phù hợp của đường chuẩn Vtg cá tuế đầu béo trong quy trình ELISA kiểu sandwich
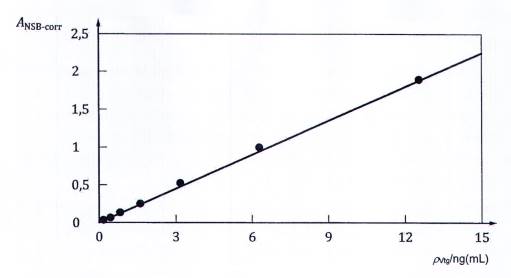
CHÚ DẪN:
| ANSB-corr Độ hấp thụ đã hiệu chính NSB | ρVtg Nồng độ |
|
Hình A.2 - Đường tuyến tính phù hợp của đường chuẩn Vtg cá tuế đầu béo trong quy trình ELISA kiểu sandwich
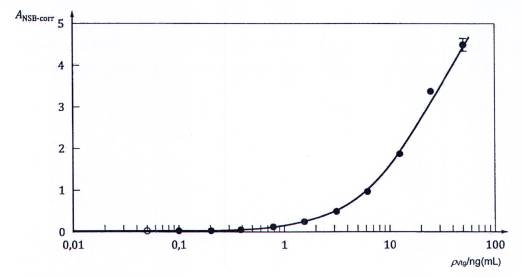
CHÚ DẪN:
| ANSB-corr Độ hấp thụ đã hiệu chính NSB | ρVtg Nồng độ | o Điểm dữ liệu bỏ qua |
Hình A.3 - Đường bốn thông số phù hợp của đường chuẩn Vtg cá tuế đầu béo trong quy trình ELISA kiểu sandwich
A.3 So sánh liên phòng thử nghiệm - quy trình ELISA kiểu sandwich Vtg trên cá tuế đầu béo
A.3.1 Khái quát
So sánh liên phòng thử nghiệm (phép phân tích liên phòng) của kiểu phân tích này với nhiều phòng thử nghiệm đòi hỏi phải thiết lập phức tạp bao gồm cả việc tiếp xúc với số lượng lớn cá để thu được đủ lượng mẫu có nồng độ chất phân tích khác nhau cho các phòng thử nghiệm liên quan. Ngoài ra, việc xử lý và vận chuyển mẫu cần phải được thực hiện trên đá khô hoặc nitơ lỏng để tránh các chu kỳ lặp lại cấp đông - rã đông. Vì những lý do này, không thể có được dữ liệu đánh giá xác nhận liên phòng thử nghiệm trên quy mô đầy đủ cho phương pháp này.
So sánh liên phòng thử nghiệm được thực hiện với bốn phòng thử nghiệm tham gia, xem Tài liệu tham khảo [5], [6]. Vào hai ngày khác nhau, một bộ gồm 18 mẫu thêm chuẩn và không thêm chuẩn (đệm pha loãng, huyết tương và WBH, xem A.2), cũng như các mẫu huyết tương và WBH phát sinh tự nhiên, đã được phân tích.
Các thông số tính năng đã được điều tra là khả năng ứng dụng, độ chụm (độ lặp lại và độ tái lập) và độ chính xác (độ thu hồi).
A.3.2 Độ chụm giữa các ngày: hệ số biến thiên của độ lặp lại
Cv,r: Hệ số biến thiên của độ lặp lại giữa các kết quả thu được đối với một mẫu nhất định vào hai ngày khác nhau. Cv,r Trung bình: Cv,r trung bình đối với tất cả các mẫu được phân tích bởi một phòng thử nghiệm. Cv,r tổng thể: Cv,r trung bình của tất cả các mẫu và các phòng thử nghiệm. Bảng A.2 (từ Tài liệu tham khảo [5]) cho thấy rằng Cv,r tổng thể giữa các kết quả thu được vào hai ngày khác nhau dao động trong khoảng từ 7,7 % đến 37,4 % đối với các phòng thử nghiệm khác nhau. Cv,r tổng thể đối với tất cả bốn phòng thử nghiệm là 16,4 %
Bảng A.2 - Các kết quả độ chụm giữa các ngày (hệ số biến thiên của độ lặp lại) từ bốn phòng thử nghiệm và các mức Vtg đo được
| Mã | Phòng thử nghiệm 1 | Phòng thử nghiệm 2 | Phòng thử nghiệm 3 | Phòng thử nghiệm 1 | ||||||||||||
|
| Ngày 1 ng/mL | Ngày 2 ng/mL | Giá trị trung bình ng/mL | CV,r % | Ngày 1 ng/mL | Ngày 2 ng/mL | Giá trị trung bình ng/mL | CV,r % | Ngày 1 ng/mL | Ngày 2 ng/mL | Giá trị trung bình ng/mL | CV,r % | Ngày 1 ng/mL | Ngày 2 ng/mL | Giá trị trung bình ng/mL | CV,r % |
| PJ | <w.r. | <w.r. | — | — | <w.r. | <w.r. | — | — | <w.r. | <w.r. | — | — | <w.r. | <w.r. | — | — |
| PQ | 0,4 | 0,4 | 0,4 | 2,1 | 0,3 | 0,3 | 0,3 | 1,8 | 0,4 | 0,4 | 0,4 | 6,4 | 0,5 | n.d.b | 0,5 | — |
| PB | 2,0 | 2,0 | 2,0 | 1,9 | 1,4 | 1,6 | 1,5 | 10,0 | 2,1 | 2,1 | 2,1 | 0,8 | n.d. | 1,6 | 1,6 | — |
| PS | 10,0 | 10,5 | 10,3 | 3,1 | 8,5 | 10,4 | 9,4 | 14,5 | 13,0 | 12,5 | 12,7 | 2,8 | 8,1 | 10,1 | 9,1 | 15,7 |
| WJ | <w.r. | <w.r. | — | — | <w.r. | <w.r. | — | — | <w.r. | <w.r. | — | — | 1,0 | <w.r. | 1,0 | — |
| WQ | 0,3 | 0,3 | 0,3 | 13,3 | 0,2 | 0,3 | 0,2 | 17,7 | <w.r. | <w.r. | — | — | <w.r. | 0.2 | 0,2 | — |
| WB | 1,5 | 1,4 | 1,5 | 5,4 | 1,2 | 1,2 | 1,2 | 0,1 | 1,0 | 1,2 | 1,1 | 13,6 | 1,7 | n.d. | 1,7 | — |
| WS | 7,7 | 7,6 | 7,7 | 1,3 | 7,4 | 8,0 | 7,7 | 5,4 | 6,1 | 6,7 | 6,4 | 6,8 | 7,1 | 5,5 | 6,3 | 17,9 |
| BJ | <w.r. | <w.r. | — | — | <w.r. | <w.r. | — | — | <w.r. | <w.r. | — | — | <w.r. | <w.r. | — | — |
| BQ | 0,4 | 0,4 | 0,4 | 1,9 | 0,3 | 0,3 | 0,3 | 17,5 | 0,4 | 0,4 | 0,4 | 11,8 | n.d. | <w.r. | — | — |
| BB | 2,0 | 1,9 | 2,0 | 52 | 1,8 | 1,8 | 1,8 | 1,7 | 2,2 | 1,9 | 2,1 | 8,2 | <w.r. | n.d. | — | — |
| BS | 10,5 | 10,9 | 10,7 | 2,6 | 10,4 | 11,2 | 10,8 | 4,9 | 12,1 | 11,9 | 12,0 | 1,5 | 5,2 | 11,0 | 8,1 | 50,9 |
| PM | 952 | 1 180 | 1 066 | 152 | 1 124 | 919 | 1 021 | 14,2 | 1 574 | 1 192 | 1 383 | 19,6 | 2 289 | 849 | 1 569 | 64,9 |
| PA | 38 642 | 54 454 | 46 548 | 24,0 | 40 192 | 37 687 | 38 939 | 4,6 | 57 282 | 56 422 | 56 852 | 1,1 | n.d. | n.d. | — | — |
| PR | 3 940 983 | 4 883 251 | 4 412 117 | 15,1 | 4 084 024 | 4 374 596 | 4 229 310 | 4,9 | 5 273 682 | 5 116 503 | 5 195 092 | 2,1 | 3 935 890 | >w.r. | 3 935 890 | — |
| WM | 7,92 | <w.r. | 7,92 | — | <w.r. | <w.r. | — | — | <w.r. | <w.r. | — | — | n.d. | <w.r. | — | — |
| WA | 27,0 | 22,4 | 24,7 | 13,3 | 26,3 | 13,1 | 19,7 | 47,1 | <w.r. | <w.r. | — | — | n.d. | <w.r. | — | — |
| WR | 469214 | 516990 | 493 102 | 6,9 | 477 607 | 728 601 | 603 104 | 29,4 | 618 288 | 478 045 | 548 166 | 18,1 | n.d. | 409 530 | 409 530 | — |
| CV,r Trung bình | 79 |
|
|
| 12,4 |
|
|
| 7,7 |
|
|
| 37,4 | |||
| CV,r Tổng thể đối với tất cả các phòng thử nghiệm |
|
|
|
|
|
|
|
|
|
|
| 16,4 | ||||
| >w.r.: Mức hấp thụ cao hơn khoảng làm việc của đường chuẩn. <w.r.: Mức hấp thụ thấp hơn khoảng làm việc của đường chuẩn. —.: Không xác định được do lỗi hoặc biến thiên quá cao | ||||||||||||||||
A.3.3 Độ chụm giữa các phòng thử nghiệm: hệ số biến thiên của độ tái lập
CV,R: Hệ số biến thiên của độ tái lập giữa các kết quả thu được của các phòng thử nghiệm khác nhau đối với một mẫu (trung bình của 2 ngày). CV,R tổng thể: CV,R trung bình cho tất cả các phòng thử nghiệm và các mẫu. Bảng A.3 (từ Tài liệu tham khảo [5]) cho thấy CV,R giữa các kết quả thu được trong bốn phòng thử nghiệm khác nhau dao động trong khoảng từ 7,4 % đến 37,6 % đối với các mẫu khác nhau. CV,R tổng thể cho tất cả các mẫu là 18,6 %.
Bảng A.3 - Kết quả về độ chụm giữa các phòng thử nghiệm (hệ số biến thiên của độ tái lập) từ bốn phòng thử nghiệm và các mức Vtg đo được
| Mã | Trung bình 1 đến 2 ngày, phòng thử nghiệm 1 ng/mL | Trung bình 1 đến 2 ngày, Phòng thử nghiệm 2 ng/mL | Trung bình 1 đến 2 ngày, Phòng thử nghiệm 3 ng/mL | Trung bình 1 đến 2 ngày, Phòng thử nghiệm 4 ng/mL | Trung bình phòng thử nghiệm 1 đến 4 ng/mL | CV,R phòng thử nghiệm 1 đến 4 % |
| PJ | —a | — | — | — | — | — |
| PQ | 0,4 | 0,3 | 0,4 | 0,5 | 0,4 | 18,5 |
| PB | 2,0 | 1,5 | 2,1 | 1,6 | 1,8 | 16,7 |
| PS | 10,3 | 9,4 | 12,7 | 9,1 | 10,4 | 16,3 |
| WJ | — | — | — | — | 1,0 | — |
| WQ | 0,3 | 0,2 | — | — | 0,3 | 15,0 |
| WB | 1,5 | 1,2 | 1,1 | 1,7 | 1,3 | 17,7 |
| WS | 7,7 | 7,7 | 6,4 | 6,3 | 7,0 | 12,3 |
| BJ | — | — | — | — | — | — |
| BQ | 0,4 | 0,3 | 0,4 | — | 0,4 | 15,6 |
| BB | 2,0 | 1,8 | 2,1 | — | 1,9 | 7,4 |
| BS | 10,7 | 10,8 | 12,0 | 8,1 | 10,4 | 21,0 |
| PM | 1 066 | 1 021 | 1 383 | 1 569 | 1 260 | 37,6 |
| PA | 46 548 | 38 939 | 56 852 | — | 47 446 | 20,0 |
| PR | 4 412 117 | 4 229 310 | 5 195 092 | 3 935 890 | 4 515 561 | 12,6 |
| WM | 7,9 | — | — | — | 7,9 | — |
| WA | 24,7 | 19,7 | — | — | 22,2 | 28,7 |
| WR | 493 102 | 603 104 | 548 166 | 409 530 | 528 325 | 20,6 |
| Tổng thể CV,R | 18,6 | |||||
| —: Dữ liệu không thể thu được cho các mẫu này (xem Bảng A.2). | ||||||
A.3.4 Độ thu hồi và độ chệch
Độ thu hồi được xác định bằng công thức sau:
![]()
và độ trệch xác định bằng Công thức:
![]()
Trong đó:
ρ1 là nồng độ đo được trong mẫu thêm chuẩn;
ρ2 là nồng độ đo được trong mẫu không thêm chuẩn;
ρ3 là nồng độ theo lý thuyết.
Các kết quả trong Bảng A.4 (xem Tài liệu tham khảo [5]) cho thấy độ thu hồi và độ chệch thay đổi đôi chút theo cả loại mẫu và nồng độ thêm chuẩn với độ thu hồi tổng thể là 69,4 %.
Bảng A.4 - Các mức Vtg đo được (trung bình của bốn phòng thử nghiệm), độ thu hồi và độ chệch từ phân tích mẫu thêm chuẩn
| Loại mẫu | Mã | Nồng độ lý thuyết ng/mL | Trung bình từ 1 đến 4 phòng thử nghiệm ng/mL | Độ thu hồi từ 1 đến 4 phòng thử nghiệm % |
| Plasma | PJ | 0 | — | — |
| PQ | 0,5 | 0,4 | 74,8 | |
| PB | 2,5 | 1,8 | 73,3 | |
| PS | 12,5 | 10,4 | 83,0 | |
| WBH | WJ | 0 | 1,0 | — |
| WQ | 0,5 | 0,3 | 51,7 | |
| WB | 2,5 | 1,3 | 52,3 | |
| WS | 12,5 | 7,0 | 56,1 | |
| Đệm | BJ | 0 | — | — |
| BQ | 0,5 | 0,4 | 72,7 | |
| BB | 2,5 | 1,9 | 77,7 | |
| BS | 12,5 | 10,4 | 83,2 | |
| Độ thu hồi tổng thể | 69,4 | |||
| Độ chệch | -30,6 | |||
| —: Dữ liệu không thể thu được cho các mẫu này (xem Bảng A.2). | ||||
Thư mục tài liệu tham khảo

[4] Copeland P.A., Thomas P., The measurement of plasma vitellogenin levels in a marine teleost, the spotted seatrout (Cynoscion nebulosus) by homologous radioimmunoassay. Comp. Biochem. Physiol. B. 1988, 91 pp. 17-23

[6] Eidem J.K., Kleivdal H., Kroll K., Denslow N., Van Aerie R., Tyler C. et al., Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin. Aquat. Toxicol. 2006, 78 pp. 202-206

[8] Fenske M., Van Aerle R., Brack S., Tyler C.R., Segner H., Development and validation of a homologous zebrafish (Danio rerio Hamllton-Buchanan) vitellogenin enzyme-linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Physiol. C: Toxicol. Pharmacol. 2001,129 pp. 217-232
[9] Finn R.N., Kristoffersen B.M., Vertebrate vitellogenin gene duplication in relation to the “3r hypothesis”: correlation to the pelagic egg and the oceanic radiation of teleosts. PLoS ONE. 2007, 2 p. e169. DOI: [no rendering defined for element: pub-id ] 10.1371/journal.pone.0000169
[10] Hiramatsu N., Matsubara T., Fujita T., Sullivan C.V., Hara A., Multiple piscine vitellogenins: biomarkers offish exposure to estrogenic endocrine disruptors in aquatic environments. Mar. Biol. 2006, 149 pp. 35-47
[11] IUPAC ANALYTICAL CHEMISTRY DIVISION. Compendium of analytical nomenclature (IUPAC "Orange Book"), |NCZÉDY, J., LENGYEL, T. URE, A.M., editors, 3rd edition. Oxford: Blackwell Science, 1998. Available (viewed 2013-03-01) at: http://www.iupac.org/index.php?id=:94&tx_wfqbe_pi1[bookid]=72
[12] Holbech H., Andersen L., Petersen G.I., Korsgaard B., Pedersen K.L., Bjerregaard p., Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comp. Biochem. Physiol. Part Toxicol. Pharmacol. 2001, 130 pp. 119-131
[13] Hutchinson T.H., Ankley G.T., Segner H., Tyler C.R., Screening and testing for endocrine disruption in fish-biomarkers as “signposts,” not “traffic lights,” in risk assessment. Environ. Health Perspect. 2006, 114 (Suppl 1) pp. 106-114
[14] Jobling S., Nolan M., Tyler C.R., Brighty G., Sumpter J.P., Widespread sexual disruption in wild fish. Environ. Sci. Technol. 1998, 32 pp. 2498-2506
[15] Johnsen H.K., Tveiten H., Willassen N.P., Amesen A.M., Arctic charr (Salvelinus alpinus) vitellogenin: development and validation of an enzyme-linked immunosorbent assay. Comp. Biochem. Physiol. B Biochem. Mol. Biol. 1999, 124 pp. 355-362
[16] Kime D., The effects of pollution on reproduction in fish. Rev. Fish Biol. Fish. 1995, 5 pp. 52-96
[17] Lomax D.P., Roubal W.T., Moore J.D., Johnson L.L., An enzyme-linked immunosorbent assay (ELISA) for measuring vitellogenin in English sole (Pleuronectes vetulus): development, validation and cross-reactivity with other pleuronectids. Comp. Biochem. Physiol, B Biochem. Mol. Biol. 1998,
[18] Mommsen P., Walsh P., Vitellogenesis and oocyte assembly. Fish Physiol. 1988, 11A pp. 347-406
[19] Mourot B., Le Bail P.Y., Enzyme-linked immunosorbent assay (ELISA) for rainbow trout (Oncorhynchus mykiss) vitellogenin. J. Immunoassay. 1995, 16 pp. 365-377
[20] Navas J.M., Segner FI., Vitellogenin synthesis in primary cultures offish liver cells as endpoint for in vitro screening of the (anti)estrogenic activity of chemical substances. Aquat. Toxicol. 2006, 80 pp. 1-22
[21] Nilsen B.M., Berg K., Eidem J.K., Kristiansen S.I., Brion F., Porcher J.M. et al., Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening. Anal. Bioanal. Chem. 2004, 378 pp. 621-633 JaY. HN
[22] Parks L.G., Cheek A.O., Denslow N.D., Heppell S.A., Mclachlan J.A., Leblanc G.A. et al., Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comp. Biochem. Physiol. C Pharmacol. Toxicol. Endocrinol. 1999, 123 pp. 113-125
[23] Purdom C.E., Flardiman P.A., Bye V.J., Eno N.C., Tyler C.R., Sumpter J.P., Estrogenic effects of effluents from sewage treatment works. Chem. Ecol. 1994, 8 pp. 275-285
[24] Schultz I.R., Orner G., Merdink J.L., Skillman A., Dose-response relationships and pharmacokinetics of vitellogenin in rainbow trout after intravascular administration of 17-alpha- ethynylestradiol. Aquat. Toxicol. 2001, 51 pp. 305-318
[25] Sherry J., Gamble A., Fielden M., Flodson P., Burnison B., Solomon K., An ELISA for brown trout (Salmo trutta) vitellogenin and its use in bioassays for environmental estrogens. Sci. Total Environ. 1999, 225 pp. 13-31
[26] Sumpter J., Jobling S., Vitellogenesis as a biomarker for estrogenic contaminants of the aquatic environment. Environ. Health Perspect. 1995, 103 pp. 173-178
[27] Tatarazako N., Koshio M., Hori H., Morita M., Iguchi T., Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the medaka (Oryzias latipes). J. Health Sci. 2004, 50 pp. 301-308
[28] Thorpe K.L., Hutchinson T.H., Hetheridge M.J., Sumpter J.P., Tyler C.R., Development of an in vivo screening assay for estrogenic chemicals using juvenile rainbow trout (Oncorhynchus mykiss). Environ. Toxicol. Chem. 2000, 19 pp. 2812-2820
[29] Tyler C.R., Sumpter J.P., The development of a radioimmunoassay for carp, Cyprinus carpio, vitellogenin. Fish Physiol. Biochem. 1990, 8 pp. 129-140
[30] Tyler C.R., Sumpter J.P., The purification and partial characterization of carp, Cyprinus carpio, vitellogenin. Fish Physiol. Biochem. 1990, 8 pp. 111-120
[31] Tyler C.R., Van Aerie R., Hutchinson T.H., Maddix S., Trip H., An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin. Environ. Toxicol. Chem. 1999, 18 pp. 337-347
[32] Tyler C.R., Van Aerie R., Nilsen M.V., Blackwell R., Maddix S., Nilsen B.M. et al., Monoclonal antibody enzyme-linked immunosorbent assay to quantify vitellogenin for studies on environmental estrogens in the rainbow trout (Oncorhynchus mykiss). Environ. Toxicol. Chem. 2002, 21 pp. 47-54
[33] http://www.biosense.com/docs/FHM_(2005.1).pdf.Available (viewed 2013-03-01) at: http://www.biosense.com/docs/FHM_(2005.1).pdf
[1]) Các mẫu đối chiếu Vtg, đơn dòng hoặc đa dòng kháng thể với Vtg của cá và hoàn thành các kit thử nghiệm (các kit ELISA Vtg) có sẵn ngoài thị trường.
[2]) Các kháng thể thứ cấp đã gắn enzym có sẵn ngoài thị trường.
[3]) Nunc Maxlsorp là ví dụ của sản phẩm có sẵn trên thị trường. Thông tin này được đưa ra để thuận tiện cho người sử dụng và không được chứng thực bởi tiêu chuẩn này.
[4]) Sản phẩm có sẵn ngoài thị trường. Thông tin này đưa ra để thuận tiện cho người sử dụng và không được chứng thực bởi tiêu chuẩn này.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 13915-3:2023 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 13915-3:2023 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 13915-3:2023 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 13915-3:2023 DOC (Bản Word)