- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn quốc gia TCVN 13915-1:2023 Chất lượng nước - Các phép đo sinh lý và sinh hóa trên cá - Phần 1
| Số hiệu: | TCVN 13915-1:2023 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Tài nguyên-Môi trường , Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
29/12/2023 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 13915-1:2023
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 13915-1:2023
TIÊU CHUẨN QUỐC GIA
TCVN 13915-1:2023
ISO 23893-1:2007
CHẤT LƯỢNG NƯỚC - CÁC PHÉP ĐO SINH LÝ VÀ SINH HÓA TRÊN CÁ - PHẦN 1: LẤY MẪU CÁ, XỬ LÝ VÀ BẢO QUẢN MẪU
Water quality- Biochemical and physiological measurements on fish - Part 1: Sampling of fish, handling and preservation of samples
Lời nói đầu
TCVN 13915-1:2023 hoàn toàn tương đương với ISO 23893-1:2007.
TCVN 13915-1:2023 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC 147 Chất lượng nước biên soạn, Viện Tiêu chuẩn Chất lượng Việt Nam đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ TCVN 13915 (ISO 23893), Chất lượng nước - Các phép đo sinh lý và sinh hóa trên cá gồm các tiêu chuẩn sau:
- TCVN 13915-1:2023 (ISO 23893-1:2007), Phần 1: Lấy mẫu cá, xử lý và bảo quản mẫu;
- TCVN 13915-2:2023 (ISO 23893-2:2007), Phần 2: Xác định ethoxyresorufin-o-deethylase (EROD);
- TCVN 13915-3:2023 (ISO 23893-3:2013), Phần 3: Xác định Vitellogenin
Lời giới thiệu
Việc xác định các đáp ứng của dấu hiệu sinh học có thể được sử dụng để phát hiện độc tính của các chất ô nhiễm đã biết cũng như chưa biết, khi chúng xuất hiện đơn lẻ hoặc kết hợp. Do đó, việc đo các dấu hiệu sinh học là cách hiệu quả về chi phí để đánh giá sức khỏe hệ sinh thái. Trong sự kết hợp các phép xác định các chất ô nhiễm đang xảy ra và đang nghi ngờ, thì việc xác định các dấu hiệu sinh học có thể thuận lợi cho việc giải thích các mối quan hệ nhân quả trong môi trường, cũng như trong các thử nghiệm độc tính trong phòng thử nghiệm. Thông tin về các dấu hiệu sinh học thường được sử dụng và diễn giải các đáp ứng của dấu hiệu sinh học được đưa ra trong Phụ lục A và Phụ lục B tương ứng.
Các dấu hiệu sinh học như ethoxyresorufin-O-deethylase (EROD), metallothionein và vitellogenin được sử dụng để phát hiện và định lượng các tác động dưới mức gây chết của các chất ô nhiễm, đặc biệt là ở cá. Tuy nhiên, nhiều biến sinh hóa và sinh lý được sử dụng làm dấu hiệu sinh học rất nhạy cảm không chỉ với sự xáo trộn các chất ô nhiễm mà còn bởi sự điều chỉnh sinh lý và sinh hóa bình thường của cá để đáp ứng với sự thay đổi theo mùa, sự phát triển bình thường và trưởng thành giới tính. Một số biến cũng có thể bị ảnh hưởng bởi áp lực chung đối với các xáo trộn do xử lý trong quá trình lấy mẫu cá và mô cá. Do đó, việc chuẩn hóa các quy trình được sử dụng để lấy mẫu và xử lý mẫu trước khi xác định các biến sinh hóa và sinh lý là rất quan trọng.
Các đáp ứng dưới mức gây chết ở mức độ cá thể thường xảy ra trước khi các tác động được nhìn thấy ở cấp độ quần thể và quần xã. Trong môi trường nước, cá thích hợp để phát hiện các tác động sinh lý của các chất ô nhiễm, bởi vì chúng tiếp xúc cả qua nước và qua các sinh vật làm thức ăn cho chúng. Ngoài ra, sinh lý và sinh hóa của cá khá giống với của người và các động vật có xương sống khác, khiến cho việc so sánh với các nghiên cứu về động vật có vú dễ dàng hơn so với các nghiên cứu về động vật giáp xác và động vật không xương sống khác.
Tiêu chuẩn này nhằm đưa ra hướng dẫn lấy mẫu và là nền tảng để xác định dấu hiệu sinh học ở cá, để có thể sử dụng các phép đo với mục đích:
- Mô tả tình trạng môi trường liên quan đến tác động của các hợp chất do con người gây ra đối với sức khỏe của cá;
- Thực hiện giám sát theo xu hướng thời gian (theo dõi);
- Cung cấp dữ liệu tham khảo và tài liệu để đánh giá tác động từ các nguồn điểm;
- Đánh giá các mối đe dọa môi trường;
- Cung cấp thông tin nền cho các biện pháp môi trường;
- Theo dõi, đánh giá tác động của các biện pháp khắc phục môi trường;
- Tích hợp các đáp ứng của dấu hiệu sinh học với các phép đo khác (ví dụ: sự phong phú của cá, sự phục hồi và tồn dư chất ô nhiễm) để tạo điều kiện thuận lợi cho việc giải thích tình trạng hoặc tác động môi trường.
CHẤT LƯỢNG NƯỚC - CÁC PHÉP ĐO SINH LÝ VÀ SINH HÓA TRÊN CÁ - PHẦN 1: LẤY MẪU CÁ, XỬ LÝ VÀ BẢO QUẢN MẪU
Water quality - Biochemical and physiological measurements on fish - Part 1: Sampling of fish, handling and preservation of samples
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp lấy mẫu cá để xác định các đặc tính sinh hóa và sinh lý, như thành phần và hoạt tính enzym của máu, gan, cơ và các mô khác nhằm đánh giá sức khỏe của cá tại hiện trường cũng như trong phòng thử nghiệm. Các biến sinh hóa và sinh lý được sử dụng cho mục đích này thường được gọi là dấu hiệu sinh học. Tiêu chuẩn này bao gồm các khuyến nghị và các phương pháp để:
- Lấy một lượng cá đại diện tại một địa điểm cụ thể;
- Lấy mẫu mô cá tại hiện trường và trong phòng thử nghiệm và
- Xử lý và bảo quản mẫu trước khi phân tích các thông số sinh hóa và sinh lý
2 Nguyên tắc
Cá có độ tuổi (kích cỡ) và giới tính thuộc loài phù hợp được lấy mẫu tại các địa điểm được chọn vào thời điểm thích hợp trong năm để giảm sự thay đổi do ảnh hưởng sinh học, địa lý và theo mùa. Sử dụng các quy trình lấy mẫu và đo đã chuẩn hóa và do nhân viên có chuyên môn thu thập các mẫu, vận chuyển, bảo quản và phân tích. Bằng cách này, các kết quả thu được theo thời gian cho dữ liệu có thể được sử dụng để phát hiện những thay đổi trong môi trường do các hợp chất do con người gây ra.
Việc lấy mẫu cá và mô cá cần tuân thủ quy định. Điều này có thể bao gồm sự cho phép của chủ sở hữu (đất) về đánh bắt cá, cơ quan quản lý môi trường và nghề cá của khu vực đánh bắt cá và cơ quan quản lý (quyền động vật).
Sức khỏe của cá có thể được đánh giá bằng cách xác định các phương pháp sinh hóa, sinh lý, mô học và bệnh lý. Các biến dưới tế bào và tế bào thường được gọi là dấu hiệu sinh học. Tác động gây độc cơ bản của các chất ô nhiễm, xảy ra ở cấp độ dưới tế bào, dẫn đến sự thay đổi sinh hóa hoặc sinh lý. Đáp ứng này thường diễn ra nhanh và có thể tiến triển xa hơn và gây ra những rối loạn ở cấp độ tổ chức sinh học cao hơn trong cơ thể, dẫn đến những thay đổi ở cấp độ tế bào và mô (cơ quan) (thay đổi mô học). Những điều này cơ thể dẫn đến rối loạn sinh sản và tăng trưởng thậm chí có thể làm chết sinh vật. Do đó, việc theo dõi sức khỏe của cá có thể đóng vai trò như một hệ thống cảnh báo sớm về ảnh hưởng đối với người. Thông qua sự kết hợp với các phép đo khác (quan trắc tích hợp), có thể tương quan (phối hợp) các đáp ứng dấu hiệu sinh học với, ví dụ dư lượng chất ô nhiễm, khoảng cách từ các nguồn điểm và các biến sinh thái nhạy với các chất ô nhiễm.
Về nguyên tắc, phương pháp này có thể được áp dụng cho tất cả các loài cá từ tất cả các loại môi trường (nước ngọt, mặn, lợ, nước lạnh và nước ấm) và ở các môi trường nước nông cũng như nước sâu vừa phải. Tuy nhiên, thường sẽ thuận lợi hơn nếu có sự hạn chế các phương pháp này đến một số loài cá nhất định, có thể được sử dụng làm các loài chỉ thị về sức khỏe của cá. Những loài này phải cố định, sẵn có (có thể đánh bắt ở hầu hết các địa điểm) và có khả năng chống chịu hợp lý với áp lực xử lý. Sinh học và sinh lý học của cá cần được biết rõ để giải thích dữ liệu dễ dàng hơn. Ví dụ về các loài đó là cá rô (Perea fluviatilis) và cá tuyết sông (viviparous blenny, Zoarces viviparus), đã được sử dụng để theo dõi dọc theo bờ biển Thụy Điển.
Tốt nhất là các loài cá được sử dụng tại hiện trường phải phù hợp để giữ trong phòng thử nghiệm cho các nghiên cứu độc tính nhằm điều tra và xác nhận các mối quan hệ nhân quả được phát hiện hoặc nghi ngờ xảy ra tại hiện trường. Các quy trình lấy mẫu nội tạng và mô về cơ bản giống nhau trong cả nghiên cứu thực địa và nghiên cứu trong phòng thử nghiệm. Do đó, quy trình thu thập cá để nghiên cứu thực địa và thu thập nội tạng được mô tả trong các phần riêng biệt.
3 Thiết bị, dụng cụ
3.1 Dụng cụ lấy mẫu cá
3.1.1 Tàu đánh cá, phù hợp với khu vực đánh bắt.
3.1.2 Trang phục làm việc ngoài trời.
3.1.3 Áo phao, có kích thước và độ nổi phù hợp với từng thuyền viên.
3.1.4 Lưới rê, làm từ sợi dệt hoặc sợi nylon, theo quy định và phù hợp để đánh bắt các loài có kích cỡ mong muốn và thả nhẹ cá vào rọ cá bảo quản.
3.1.5 Các dụng cụ khác để đánh bắt cá, ví dụ: sốc điện và lưới, phải được mô tả đủ chi tiết để giải thích và lấy mẫu lặp lại.
3.1.6 Máy đo hệ thống định vị toàn cầu (GPS), để biết vị trí chính xác nơi lấy mẫu.
3.1.7 Bản đồ hàng hải, để đánh dấu vị trí lấy mẫu.
3.1.8 Dao và kẹp, dùng để nhẹ nhàng gỡ cá ra khỏi lưới rê.
3.1.9 Thùng đựng cá, làm bằng gỗ hoặc vật liệu trơ khác để bảo quản cá trước khi lấy mẫu mô.
3.1.10 Thiết bị đo các đặc tính vật lý và hóa học của nước, ví dụ: nhiệt kế, máy đo pH, máy đo độ dẫn điện.
3.1.11 Thiết bị xác định độ sâu của nước, máy đo sâu dùng sóng âm thanh (echo-sounder) hoặc vạch chuẩn có thể được sử dụng để xác định độ sâu.
3.2 Thiết bị, dụng cụ lấy mẫu mô
3.2.1 Cầu tàu, dễ dàng tiếp cận thùng đựng cá và cách phòng thử nghiệm hiện trường trong vòng 100 m.
3.2.2 Vợt cá phù hợp với loài cá và kích cỡ cá.
3.2.3 Phòng thử nghiệm hiện trường, nhà thuyền, nhà để xe hoặc phòng thử nghiệm di động được cung cấp điện.
3.2.4 Gậy cao su, dùng để gây mê cá trước khi lấy mẫu máu.
3.2.5 Thuốc mê, để gây mê cá (chi tiết về cách sử dụng được nêu trong 4.4.3).
3.2.6 Dụng cụ mổ: kẹp, kéo, dao mổ, bơm tiêm, kim tiêm.
3.2.7 Thước, để xác định chiều dài cơ thể cá.
3.2.8 Cân, để xác định khối lượng cơ thể và khối lượng mô (gan, tuyến sinh dục, lá lách).
3.2.9 Máy ly tâm và ống nghiệm, lấy huyết tương.
3.2.10 Phiến kính hiển vi, để chuẩn bị phết máu
3.2.11 Vật chứa mẫu, có kích thước phù hợp với mẫu mô (ví dụ: hộp nhựa có khóa cài).
3.2.12 Bút đánh dấu, không thấm nước và chịu được băng.
3.2.13 Bình chân không chứa nitơ lỏng, dùng để đông lạnh nhanh và bảo quản tạm thời mẫu.
3.2.14 Bình chứa cacbon dioxide rắn, để vận chuyển các mẫu mô được đông lạnh sâu giữa phòng thử nghiệm hiện trường và phòng thử nghiệm phân tích.
3.3 Thiết bị xác định dấu hiệu sinh học cho phòng thử nghiệm hiện trường
3.3.1 Ống haematocrit và máy ly tâm, nếu cần.
3.3.2 Máy đo đường huyết, nếu có yêu cầu.
3.3.3 Máy đo huyết sắc tố, nếu cần.
4 Lấy mẫu cá
4.1 Khía cạnh thống kê
Cá tự nhiên, giống như các loài động vật hoang dã khác, bị ảnh hưởng bởi một số yếu tố tự nhiên bên cạnh những yếu tố do người gây ra. Các yếu tố tự nhiên quan trọng đối với cá là khí hậu, thủy văn, oxy và độ mặn (yếu tố phi sinh học), cũng như tuổi, kích thước, giới tính, sự trưởng thành, tình trạng dinh dưỡng, ký sinh trùng và bệnh (yếu tố sinh học). Tất cả những yếu tố này có thể góp phần vào sự thay đổi tổng thể của các biến đáp ứng được đo. Để phát hiện những thay đổi theo thời gian trong giám sát xu hướng và sự thay đổi địa lý trong việc lập bản đồ nhiễu loạn tiềm ẩn, thì tầm quan trọng của tất cả các yếu tố phi sinh học và sinh học được đề cập ở trên phải được giảm càng nhiều càng tốt.
4.2 Tần suất lấy mẫu và mùa lấy mẫu
Cá cần được lấy mẫu mỗi năm một lần vào mùa thu để tránh ảnh hưởng của sự thay đổi nhanh về điều kiện sinh lý do mùa sinh sản. Trong suốt mùa thu, hầu hết các loài cá không sinh sản và các điều kiện để bắt đủ cá bằng các ngư cụ cố định như lưới rê (3.1.4) và lưới đăng đáy (3.1.5) vẫn tốt vì cá vẫn hoạt động. Lấy mẫu thường xuyên hơn vào các thời điểm khác trong năm thường không cung cấp các thông tin mới trong việc theo dõi xu hướng.
Ở Thụy Điển, cá rô để theo dõi sức khỏe cá được lấy mẫu bằng lưới rê vào tháng 9 và lấy mẫu cá tuyết sông bằng lưới đăng đáy vào tháng 11. Khoảng thời gian phù hợp nhất khác nhau giữa các quốc gia và khu vực do sự khác biệt về khí hậu. Thông thường, chỉ những cá thể cá trưởng thành của một giới tính (ví dụ: cá cái đối với cá rô và cá tuyết sông, cá đực đối với cá bống và cá ngựa vằn) trong một dải kích thước nhất định mới được sử dụng cho từng loài để giảm thiểu ảnh hưởng của giới tính và kích thước.
4.3 Chọn địa điểm lấy mẫu
Trong giám sát sức khỏe cá, điều quan trọng nhất là phải có thông tin càng chi tiết càng tốt về chất thải do con người gây ra tại nơi được sử dụng làm địa điểm tham chiếu. Các địa điểm này cần được giám sát thường xuyên, tốt nhất là hàng năm, để phát hiện các tác động quy mô lớn từ các nguồn ô nhiễm khuếch tán.
Giám sát sức khỏe cá cũng có thể được áp dụng trên quy mô địa phương. Sau đó, vị trí của các điểm lấy mẫu phải được xác định bởi các mục tiêu, thường liên quan đến vị trí của các nguồn ô nhiễm. Một số vị trí thích hợp cần được bố trí lệch khỏi điểm xả thải của địa phương đó hoặc tại các vị trí cần được bảo vệ khỏi sự xáo trộn. Cũng cần chọn một địa điểm tham chiếu có sinh cảnh giống với nơi nhận (bể chứa) nhất có thể.
Một khía cạnh khác được xem xét khi lựa chọn địa điểm lấy mẫu là nơi có sẵn cá và khả năng tiếp cận dễ dàng hợp lý đến địa điểm lấy mẫu, hoặc ít nhất là đến địa điểm mà cá sẽ bị giết để lấy mẫu [nơi để thùng đựng cá (3.1.9)].
4.4 Quy trình lấy mẫu
4.4.1 Yêu cầu chung
Số lượng cá cần đủ để phát hiện sự thay đổi xác định trước trong biến đáp ứng trong một số năm nhất định. Nhà thống kê có kinh nghiệm có thể đưa ra lời khuyên về điều này. Cũng cần cân nhắc rằng số lượng cá bổ sung được lấy mẫu không nhất thiết làm tăng thêm nhiều chi phí của chương trình giám sát.
Ví dụ đối với cá rô và cá tuyết sông, 25 cá thể cái, có tổng chiều dài từ 20 cm đến 30 cm, được lấy mẫu tại mỗi trạm trong chương trình giám sát của Thụy Điển, số lượng này đáp ứng nhu cầu thống kê để xác định sự khác biệt giữa các trạm đối với tất cả các biến đáp ứng giám sát được sử dụng trong chương trình đó và được thể hiện trong Phụ lục A và Phụ lục B. Nếu sử dụng nhiều trạm hơn, như trong bản đồ xáo trộn từ nguồn điểm, nên sử dụng số lượng thấp hơn (10 đến 20) tại mỗi trạm. Bằng cách này, có thể bao gồm nhiều địa điểm hơn với cùng một tổng chi phí. Giới tính của cá phải được xác định và ghi lại và phải lấy đủ số lượng giới tính cần sử dụng. Đối với hầu hết các biến, cá thể cái được ưu tiên, nhưng trong một số nghiên cứu lại cần sử dụng cá thể đực (ví dụ: để xác định vitellogenin trong huyết tương).
4.4.2 Lấy mẫu cá
Có thể đánh bắt cá bằng một số phương pháp (xem trong Tài liệu tham khảo [3]) như câu và dụng cụ đánh bắt bằng điện (Tài liệu tham khảo [1]), nếu chúng cần làm chết ngay tại chỗ, được lấy mẫu trực tiếp và các mẫu được xử lý thích hợp. Tuy nhiên, trong hầu hết các chương trình giám sát dài hạn, cá lớn được đánh bắt bằng lưới rê (3.1.4), bẫy hoặc lưới đăng đáy (3.1.5) để lấy đủ mẫu cá có kích cỡ và giới tính phù hợp.
Để tránh gây căng thẳng không cần thiết cho cá khi chúng bị đánh bắt và giết để lấy mẫu mô, trước tiên chúng phải được đưa vào thùng đựng cá (3.1.9) và giữ ở đó từ 2 ngày đến 4 ngày trước khi giết. Điều này giúp ổn định các biến đáp ứng nhạy với căng thẳng như đường huyết, lactate máu và hematocrit.
Tại hiện trường, tốt nhất là nên đánh bắt cá bằng lưới rê hoặc lưới đăng đáy và giữ sống thông qua việc lấy mẫu thường xuyên được thực hiện bằng thiết bị đánh bắt. Tuy nhiên, cũng có thể sử dụng các kỹ thuật đánh bắt khác để thu cá. Phương pháp được sử dụng hoặc mô tả chi tiết phải được đưa ra trong báo cáo trong những trường hợp đó. Mục đích là cá được lấy mẫu từ các vị trí được xác định trước bằng ngư cụ phù hợp, ví dụ: lưới rê cá rô và lưới đăng đáy cho cá tuyết sông. Lưới rê phải được làm từ vật liệu thích hợp để tạo điều kiện thuận lợi cho việc vớt cá với ít thiệt hại nhất. Lưới phải được điều chỉnh theo loài và kích cỡ của cá được sử dụng trong nghiên cứu. Đối với cá rô có chiều dài cơ thể từ 20 cm đến 30 cm, thì kích thước mắt lưới từ 30 mm đến 33 mm là phù hợp. Lưới rê được sử dụng để lấy mẫu cá cho nghiên cứu quần thể, như được mô tả trong Tài liệu tham khảo [2], là lưới rê đa mắt lưới và không giống với lưới được sử dụng trong tiêu chuẩn này. Có thể sử dụng lưới đăng đáy thông thường để bắt cá tuyết sông.
Lưới nên được giăng từ 3 ngày đến 5 ngày trước khi lấy mẫu cá để lấy mô, để giữ cá trong lồng cá từ 2 ngày đến 4 ngày trước khi lấy mẫu mô. Lưới rê phải được lấy mẫu thường xuyên và ít nhất 12 h một lần, để thu thập càng nhiều cá sống càng tốt. Chúng nên được đặt vào lúc mặt trời lặn và được thu lại khi mặt trời mọc. Điều này cũng có nghĩa là nhân viên phòng thử nghiệm lấy mẫu mô phải duy trì liên lạc với ngư dân địa phương tham gia đánh bắt để kiểm tra xem có đủ cá với kích cỡ phù hợp hay không trước khi họ đến.
Ví dụ về hình thức lấy mẫu được nêu trong Phụ lục C.
4.4.3 Lấy mẫu mô cá
Cá phải được vớt lần lượt ra khỏi thùng đựng cá (3.1.9) bằng vợt cá (3.2.2), cẩn thận để không làm ảnh hưởng đến cá còn lại. Việc lấy mẫu mô phải được thực hiện ở khu vực cách thùng đựng cá dưới 100 m. Địa điểm lấy mẫu (3.2.3) phải có điện, ánh sáng đầy đủ và phải thoải mái hợp lý để nhân viên có thể thao tác an toàn và trong điều kiện làm việc phù hợp. Nhà thuyền, nhà để xe hoặc nhà lưu động là địa điểm thích hợp.
Sau khi bắt được cá, cá bị làm choáng bằng cách dùng thanh gỗ hoặc gậy cao su (3,2.4) đánh vào gáy hoặc gây mê bằng thuốc mê (3.2.5) thích hợp như MS-222 (tricain metan sunfonat hoặc metan sunfonat etyl 3-aminobenzoat). Sau đó, các mẫu cần được lấy theo thứ tự sau: máu, mật, gan, lá lách, cơ, tuyến sinh dục và các mô khác (xem Hình 1).
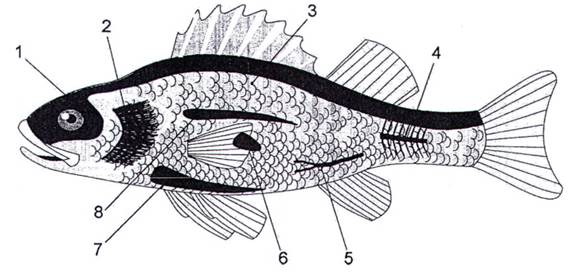
CHÚ DẪN:
1 Não
2 Mang
3 Cơ bắp
4 Xương sống
5 Máu
6 Lách
7 Gan
8 Thận
Hình 1 - Lấy mẫu máu từ mạch máu đuôi bằng xyranh heparin
Nếu một số mô không cần thiết thì chuyển sang mục tiếp theo.
1) Khối lượng cơ thể được xác định chính xác đến gam và tổng chiều dài cơ thể được xác định chính xác đến milimét.
2) Máu được lấy bằng xyranh có heparin từ mạch đuôi (xem Hình 1).
3) Chặt đầu cá.
4) Mổ bụng cá, cẩn thận để không làm hỏng túi mật.
5) Mật được lấy mẫu bằng xyranh (không cần heparin).
6) Gan được lấy ra và cân chính xác đến 0,1 g.
7) Tuyến sinh dục được lấy ra và cân chính xác đến 0,1 g.
8) Lá lách được lấy ra và cân chính xác đến 0,1 g.
9) Đoạn ruột được lấy ra và cân để xác định khối lượng soma.
10) Cắt ra miếng mô cơ (thịt cá) từ một vị trí đã xác định trước.
11) Lấy sỏi tai hoặc các mô khác (xương mắt, vảy) phù hợp để xác định tuổi.
12) Các mẫu mô để kiểm tra mô học được cho vào bình chứa chất bảo quản.
13) Phần còn lại đôi khi được bảo quản đông lạnh để phân tích hóa học sau này hoặc để phân tích sinh hóa hoặc sinh lý bổ sung.
Tất cả các mẫu mô được lấy để đo sinh hóa (gan và cơ) phải được xử lý ngay bằng cách lấy các mẫu con cho các phân tích khác nhau. Các mẫu con phải được lấy từ cùng một bộ phận đối với mỗi biến được phân tích. Điều này rất quan trọng vì các hoạt động của enzym có thể khác nhau trong một cơ quan (như gan). Giải phẫu của gan có thể khác nhau giữa các loài cá. Điều này có thể cần được chuẩn hóa trong các chương trình giám sát quốc gia và khu vực để giảm thiểu các biến thể do biến đổi vi giải phẫu. Điều này rất quan trọng đối với gan, thường được sử dụng để xác định một số biến sinh hóa và cũng để kiểm tra mô học.
Các mẫu máu phải được xử lý trực tiếp để xác định hematocrit bằng cách ly tâm, huyết sắc tố bằng phép đo quang phổ và tạo huyết tương bằng cách ly tâm. Phết máu cho số lượng tế bào máu khác nhau phải được chuẩn bị trực tiếp. Việc xác định lượng đường trong máu và lactate có thể được xác định tại chỗ, hoặc các mẫu máu để xác định lượng glucosa và lactat có thể được lấy mẫu con và được xử lý tiếp trong phòng thử nghiệm phân tích.
Các mẫu huyết tương, mật và các mô khác phải được đặt trong vật chứa có dán nhãn (3.2.11) và được đông lạnh trực tiếp trong nitơ lỏng hoặc tiếp xúc với cacbon đioxit rắn. Việc dán nhãn các vật chứa phải được kiểm tra để chắc chắn rằng chúng chịu được quá trình đóng băng và xử lý mẫu. Các mẫu để kiểm tra mô học và xác định tuổi của cá phải được xử lý theo yêu cầu của các phương pháp được sử dụng.
Toàn bộ quy trình, từ lấy cá ra khỏi thùng đựng cá đến xử lý tất cả các mẫu, không được quá 10 min. Điều này đòi hỏi có sự tập huấn cho nhóm, thường bao gồm hai, ba hoặc bốn người, khi tất cả các mô được đề cập ở trên phải được lấy mẫu. Khi cần lấy ít mô hơn, thì số lượng nhân viên có thể giảm.
Ví dụ về các biến để giám sát sức khỏe cá nêu trên được mô tả chi tiết hơn trong Phụ lục A và ví dụ về sơ đồ lấy mẫu được đưa ra trong Phụ lục D.
4.5 Xử lý mẫu và quy trình phân tích
Tất cả các mẫu không được xác định tại chỗ và được sử dụng để phân tích sinh hóa và hóa học phải được giữ đông lạnh dưới -70 °C cho đến khi phân tích. Nếu các mẫu được bảo quản trong thời gian dài hơn (nhiều thập kỷ, nhiều thế kỷ), thì chúng phải được gửi đến ngân hàng mô được chứng nhận. Các mẫu được sử dụng để phân tích mô học có thể được bảo quản trong ngân hàng với chi phí thấp hơn.
Nếu có thể, phải sử dụng quy trình phân tích tiêu chuẩn, việc lấy mẫu và xử lý mẫu cần theo tiêu chuẩn này và được bổ sung các chi tiết liên quan đến các mẫu cụ thể.
Dữ liệu thô đối với tất cả các thông tin liên quan đến lấy mẫu và dữ liệu phân tích có thể được lưu trữ cùng nhau trong chương trình bảng tính cho phép chuyển giao điện tử dễ dàng
4.6 Thông tin cơ bản (nền)
Việc đánh giá dữ liệu sẽ phù hợp hơn nếu có sẵn thông tin về nồng độ các chất ô nhiễm và đánh giá trữ lượng của các loài cá được sử dụng. Ngoài ra, thông tin về điều kiện khí tượng và thủy văn tại địa điểm lấy mẫu có thể tạo thuận lợi cho việc giải thích, đặc biệt là trong chuỗi dữ liệu thời gian được sử dụng để theo dõi xu hướng.
Khi được sử dụng để lập bản đồ các tác động từ các nguồn điểm, thì việc diễn giải có thể dễ dàng hơn nếu có sẵn dữ liệu so sánh từ các vị trí tham chiếu bên ngoài. Về mặt này, việc sử dụng dữ liệu tương đồng về cá (loài, kích thước và giới tính) và thời gian lấy mẫu là rất quan trọng.
5 Đảm bảo chất lượng
5.1 Yêu cầu chung
Để kết quả đáng tin cậy, một số yếu tố phải được xem xét. Để sử dụng các phép đo sinh hóa và sinh lý trên cá trong đánh giá sức khỏe hệ sinh thái và giám sát môi trường, các yếu tố sau phải được giải quyết:
- Kiểm soát hoặc hiểu biết về ảnh hưởng của các yếu tố tự nhiên đến kết quả;
- Sử dụng thiết kế lấy mẫu phân tầng giúp giảm thiểu sự thay đổi do các yếu tố tự nhiên gây ra;
- Cơ sở thống kê đầy đủ để diễn giải các khác biệt và xu hướng;
- Xác định thời gian lấy mẫu cố định và được tối ưu hóa trong năm liên quan đến các biến quan tâm;
- Sử dụng các phương pháp chuẩn hóa để lấy mẫu (bắt) cá và lấy mẫu mô, như được mô tả trong tiêu chuẩn này.
Tốt nhất nên có một người (trưởng nhóm) chịu trách nhiệm về tất cả các bước trong quá trình điều tra sức khỏe của cá. Người này cũng phải là người chịu trách nhiệm giải thích trong báo cáo chính.
5.2 Lấy mẫu cá
Việc thu thập cá (đánh bắt cá) phải do ngư dân có kinh nghiệm với kiến thức tốt về đánh bắt bằng lưới rê và lưới đăng đáy thực hiện. Người này phải có kiến thức tốt về vùng được đánh bắt. Người đánh cá cũng phải được thông báo về mục đích của cuộc nghiên cứu, để cá được xử lý cẩn thận để không gây ra hư hỏng không cần thiết.
5.3 Lấy mẫu mô
Việc lấy mẫu mô phải do người có kỹ năng và trình độ cần thiết cho công việc thực hiện. Thông thường, cần hai, ba hoặc bốn người để lấy mẫu tất cả các mô từ một cá thể cá trong vòng 10 min. Việc đào tạo về các quy trình lấy mẫu phải được thực hiện trước, các quy trình lấy mẫu, dán nhãn và vận chuyển mẫu đến phòng thử nghiệm/các phòng thử nghiệm để phân tích sinh hóa/hóa học phải được thiết lập và được lập thành văn bản.
5.4 Phân tích sinh hóa/hóa học
Các phép phân tích phải được thực hiện bằng các phương pháp đã được chuẩn hóa hoặc được thiết lập theo cách khác. Phải thiết lập các thói quen kiểm soát nội bộ và bên ngoài đối với công việc của phòng thử nghiệm để đảm bảo chất lượng của dữ liệu phân tích.
5.5 Đánh giá
Việc đánh giá các kết quả phải bao gồm việc so sánh với các nghiên cứu tương tự khác. Do đó, cần có kiến thức chuyên sâu trong lĩnh vực này.
6 Báo cáo
6.1 Yêu cầu chung
Dữ liệu ban đầu từ giám sát môi trường thường được chuyển đến máy chủ lưu trữ dữ liệu được cơ quan quản lý môi trường chứng nhận. Máy chủ lưu trữ dữ liệu mô tả cách phân phối dữ liệu (trong bảng tính điện tử) và/hoặc qua thư. Dữ liệu từ quan trắc môi trường cũng thường xuyên được báo cáo tại các hội nghị, hội thảo chuyên đề và được đăng trên các tạp chí khoa học. Điều này có thể đảm bảo rằng các kết quả có đánh giá khoa học quan trọng.
Các ví dụ về báo cáo lấy mẫu cá trong Phụ lục C và lấy mẫu mô cá được nêu trong Phụ lục D.
6.2 Ghi dữ liệu, lưu trữ dữ liệu
Dữ liệu phải được gửi đến máy chủ lưu trữ dữ liệu dưới dạng dữ liệu chính theo định dạng phù hợp cho phân tích thống kê.
6.3 Đánh giá
Kết quả thường được báo cáo theo giá trị trung bình và độ lệch chuẩn. Việc đánh giá thống kê thường bao gồm các phép thử tham số (phép thử ANOVA) hoặc phép thử phi tham số nếu dữ liệu không được phân bố chuẩn. Dữ liệu thường được so sánh với dữ liệu tương ứng của các năm trước và/hoặc với các địa điểm lấy mẫu khác, để thiết lập sự khác biệt và xu hướng.
Trong các nghiên cứu về sức khỏe của cá, điều cần thiết là phải giải thích sự rối loạn chức năng, điều này có thể dẫn đến sự xáo trộn ở cấp độ quần thể thông qua ảnh hưởng đến sự tăng trưởng, sinh sản và/hoặc tỷ lệ sống. Nếu phát hiện thấy dấu hiệu của sự rối loạn ở cấp độ cá thể thông qua các biến sinh hóa và sinh lý, thì cần điều tra thêm. Hướng dẫn diễn giải các dấu hiệu sinh học khác nhau ở cá được đưa ra trong Phụ lục B.
Phụ lục A
(Tham khảo)
Tóm tắt các biến được sử dụng làm dấu hiệu sinh học ở cá
A.1 Yêu cầu chung
Các biến sau đây đã được sử dụng làm dấu hiệu sinh học trong nghiên cứu môi trường trên cá. Một số phương pháp xác định các biến này trong phòng thử nghiệm cũng cần được chuẩn hóa trong tương lai. Tài liệu tham khảo cho các bài báo khoa học được đưa ra nhằm cung cấp thông tin.
A.2 Hoạt độ ethoxyresorufin-o-deethylase (EROD) trong mô gan
Sự bài tiết các chất ô nhiễm hữu cơ hòa tan được trong lipit ra khỏi cá và các động vật có xương sống khác được hỗ trợ bởi các hệ thống enzym khác nhau, giúp chuyển đổi các hợp chất thu hút chất béo thành các hợp chất ưa nước hơn. Các hợp chất ưa nước có thể được bài tiết dễ dàng hơn qua mật hoặc nước tiểu. Bước đầu tiên trong quá trình giải độc này thường được xúc tác bởi hệ thống enzym có tên cytochrom P450 monooxygenase (trước đây còn được gọi là oxyase chức năng hỗn hợp, MFO). Cytochrom P450 tồn tại ở một số dạng. Một trong số đó, được tìm thấy trong gan cá là cytochrom P450 1A. Enzym này được tạo ra khi cá đã tiếp xúc với các chất như tetraclorodibenzodioxin, các polyclorobiphenyl (PCB) mặt phẳng và hydrocacbon thơm đa vòng.
Phương pháp được sử dụng phổ biến nhất để xác định hoạt độ của enzym này và là để xác định hoạt độ EROD (ethoxyresorufin-O-deethylase). Hoạt động EROD đã được sử dụng làm dấu hiệu sinh học cho cả ô nhiễm dầu và nước thải của nhà máy bột giấy. Trong trường hợp nước thải của nhà máy bột giấy, các tác động đã được phát hiện cách xa nhà máy 40 km, điều này cho thấy việc phát hiện các tác động quy mô lớn hoặc thậm chí trong khu vực.
A.3 Bạch cầu
Cá có một vài loại bạch cầu. Những nghiên cứu nhiều nhất là tế bào lympho, bạch cầu hạt trung tính và tiểu cầu. Tế bào lympho là một phần của hệ thống miễn dịch và là nơi sản xuất và mang kháng thể. Nhiễm trùng do vi khuẩn và các vật thể lạ khác kích hoạt bạch cầu hạt trung tính, làm phá hủy chúng. Các tiểu cầu tham gia vào quá trình đông máu.
Các nghiên cứu về tế bào máu ở cá là một phương pháp tương đối dễ dàng để phát hiện những thay đổi trong hệ thống miễn dịch. Các yếu tố bên ngoài, như tiếp xúc với một số chất ô nhiễm nhất định, có thể làm giảm hệ thống phòng thủ miễn dịch qua việc giảm các tế bào lympho (tế bào bạch huyết) lưu thông. Những thay đổi về số lượng tế bào bạch cầu trong máu cá đã được ghi nhận trong cả nghiên cứu trong phòng thử nghiệm và thực địa khi cá tiếp xúc với nước thải từ các nhà máy bột giấy và công nghiệp gia công kim loại.
A.4 Chuyển hóa carbohydrat và căng thẳng
Tác động được nghiên cứu thường xuyên nhất của sự căng thẳng ở cá là sự tăng đường huyết và lactat trong máu và giảm lượng glycogen trong gan và cơ. Đây là những tác động phụ từ việc tăng tiết hocmon gây căng thẳng từ tuyến yên (hocmon vỏ thượng thận) và mô tuyến thượng thận và cromaffin (cortisol và adrenalin) do hoạt động thần kinh tăng lên. Đây là một đáp ứng tự nhiên giúp cá thể giáp xác huy động năng lượng cần thiết để tấn công đối thủ, bắt mồi hoặc tránh kẻ săn mồi. Nhiều chất ô nhiễm cũng có thể ảnh hưởng đến quá trình chuyển hóa carbohydrat theo những cách khác ngoài căng thẳng thứ cấp. Hai ví dụ về điều này được đưa ra dưới đây:
a) Hàm lượng glycogen trong gan và cơ bị thay đổi đã được quan sát thấy ở cá tiếp xúc với nước thải của nhà máy bột giấy và nhiều hydrocacbon đã clo hóa [pentaclorophenol, PCB, diclorodiphenyltricloroetan (DDT)] cũng như một số loại kim loại nặng (cadimi, chì) cũng có thể ảnh hưởng lên sự trao đổi chất cacbohydrat. Nồng độ glycogen trong mô gan và cơ được đo bằng phương pháp dùng enzym và phương pháp này khá đơn giản mặc dù tốn thời gian.
b) Lactat trong máu là biến nhạy nhất với căng thẳng trong quá trình lấy mẫu. Do đó, phép đo lactat thường được bao gồm trong các nghiên cứu về dấu hiệu sinh học để có thể phát hiện căng thẳng có thể xảy ra trong quá trình lấy mẫu.
A.5 Nồng độ ion trong huyết tương
Các teleost (cá nhiều xương) có cơ chế phát triển tốt để điều hòa ion và thẩm thấu. Do đó, nồng độ của các ion vô cơ được kiểm soát trong giới hạn khá hẹp. Ion natri (Na+) và clorua (Cl-) là những ion chính trong huyết tương và chúng có vai trò quan trọng trong quá trình điều hòa thẩm thấu. Ngoài ra, các ion khác như kali (K+), canxi (Ca2+) và phốt phát (PO43-) được kiểm soát trong giới hạn hẹp. Một ion và quá trình điều hòa thẩm thấu bị rối loạn có thể làm giảm khả năng duy trì các chức năng cơ thể bình thường của cá.
Nhiều chất ô nhiễm, như kim loại và hyđrocacbon đã clo hóa, có thể ảnh hưởng đến quá trình điều hòa ion và do đó ảnh hưởng đến nồng độ các ion trong huyết tương. Nồng độ canxi giảm do tiếp xúc với cadimi và tiếp xúc với nước thải của nhà máy bột giấy có thể làm giảm nồng độ clorua.
A.6 Chỉ số tuyến sinh dục (GSI), chỉ số soma của gan (LSI) và chỉ số tổng thể của gan (LTI)
Chỉ số tuyến sinh dục (GSI) là khối lượng của tuyến sinh dục (buồng trứng hoặc tinh hoàn) được biểu thị bằng phần trăm khối lượng soma. Khối lượng soma là khối lượng tổng trừ đi khối lượng của đường ruột và tuyến sinh dục. Sự phát triển bình thường của các cơ quan sinh sản ở cá được kiểm soát bởi các quá trình tế bào và phân tử, được điều chỉnh bởi các cơ quan nội tiết và các yếu tố khác. Quy định này có thể bị ảnh hưởng bởi các chất ô nhiễm, và điều này cũng có thể làm rối loạn quá trình sinh sản ở cá.
Một dấu hiệu thô sơ nhưng đáng tin cậy về sự rối loạn sinh sản của cá là sự thay đổi kích thước tuyến sinh dục của nó. Kích thước tuyến sinh dục đã giảm ở cá ở vùng nước gần nhà máy bột giấy và ở cá tiếp xúc với PCB và DDT trong phòng thử nghiệm.
Chỉ số soma của gan (LSI) là khối lượng của gan được biểu thị bằng phần trăm khối lượng soma. LSI tăng lên đã được quan sát thấy ở cá tiếp xúc với các chất ô nhiễm hữu cơ cả ở hiện trường (nhà máy bột giấy) và trong phòng thử nghiệm (hydrocacbon đã clo hóa). Sự gia tăng LSI này có thể là kết quả của việc tăng dự trữ chất béo hoặc glycogen và/hoặc kích thích tổng hợp protein trong gan. Cơ chế sau việc tăng LSI vẫn chưa được làm rõ, nhưng có thể xảy ra rối loạn chuyển hóa và/hoặc tăng hoạt độ enzym chuyển hóa chất ô nhiễm.
Chỉ số tổng của gan (LTI) là khối lượng của gan được biểu thị bằng phần trăm tổng khối lượng của cá. Bảng A.1 liệt kê các biến được chọn làm dấu hiệu sinh học trong nghiên cứu môi trường liên quan đến cá.
Bảng A.1 - Danh mục các biến được sử dụng làm dấu hiệu sinh học trên cá
| Chất xác định | Chất phân tích | Đơn vị tính | Phép xác định |
| Chiều dài tổng | Cá thể cá | mm | Bằng thước (±1 mm) |
| Khối lượng tổng | Cá thể cá | g | Bằng cân (± 1 g) |
| Giới tính | Đực hoặc cái |
| M hoặc F |
| Khối lượng Gonad | Gonad | g | Bằng cân (± 0,1 g) |
| Khối lượng Soma | Cá thể không có nội tạng (đường ruột và tuyến sinh dục) nhưng có gan | g | Bằng cân (± 0,1 g) |
| Hệ số điều kiện soma | Khối lượng soma và tổng chiều dài | g/mm | Chiều dài tổng/khối lượng của soma |
| Chỉ số gonadosoma (GSI) | Khối lượng Soma và gonad | % | 100 khối lượng của soma/khối lượng của gona |
| Chỉ số soma gan (LSI) | Khối lượng soma và gan | % | 100 ± khối lượng của soma/khối lượng gam |
| Tổng chỉ số gan (LTI) | Khối lượng gan và khối lượng tổng | % | 100 ± khối lượng tổng/khối lượng bạc |
| Tuổi | Mang, xương tai hoặc vảy | Năm | Nuôi cấu mô và đếm vòng |
| Mô bệnh | Gan, lá lách, v.v.. | % của mẫu đối chứng | Cố định, gắn kết, nhuộm màu, kiểm tra |
| Tế bào máu trắng | Máu | % của tế bào hồng cầu | Nhuộm phết màu và đến sự khác biệt |
| Haematocrit | Máu | % (dung tích) | Ly tâm và đo thể dung tích tế bào |
| Haemoglobin | Máu | g/L hoặc mmol/L | Dụng cụ hiện trường và máy quang phổ |
| Glucose máu | Máu | mmol/L | Dụng cụ hiện trường và máy quang phổ |
| Lactat máu | Máu | mg/100 mL hoặc mmol/L | Dụng cụ hiện trường và máy quang phổ |
| Độc tính mật | Mật | % | Xét nghiệm sinh học |
| Glycogen cơ | Mẫu cơ tại vị trí đã chọn | mg/100 mg (%) | Bảo quản mẫu < -70 °C |
| Cytochrom P450 | Mẩu gan đã chọn | nmol/mg protein | Bảo quản mẫu < -70 °C |
| Ethoxyresorufin-O- deethylase(EROD) | Mẩu gan đã chọn | nmol/mg protein trên min | Bảo quản mẫu < -70 °C |
| Protein | Mẩu gan đã chọn | mg/mL của mẫu | Bảo quản mẫu < -70 °C |
| Glutathione reductase (GR) | Mẩu gan đã chọn | nmol/mg protein trên min | Bảo quản mẫu < -70 °C |
| Metallothionein (MT) | Mẩu gan đã chọn | nmol/mg protein | Bảo quản mẫu < -70 °C |
| Chất cộng ADN | Mẩu gan đã chọn | nmol/mol | Bảo quản mẫu < -70 °C |
| Vitellogenin | Plasma máu | ng/mL plasma | Bảo quản mẫu < -70 °C |
| Plasma clorua | Plasma máu | mmol/L | Bảo quản mẫu < -70 °C |
Phụ lục B
(Tham khảo)
Hướng dẫn giải thích các đáp ứng của dấu hiệu sinh học với các chất chuẩn
B.1 Giới thiệu
Một nhóm các nhà khoa học từ Thụy Điển đã phát triển một chiến lược điều tra tác động môi trường của nước thải nhà máy giấy và bột giấy hiện hành. Chiến lược này bao gồm việc sử dụng một loạt các biến phản ánh cả đặc điểm quần thể và chức năng sinh lý của cá. Ngoài ra, nhóm đã đưa ra các khuyến nghị để giải thích các kết quả và các tiêu chí cụ thể để xác định tác động môi trường không thể chấp nhận được (Tài liệu tham khảo [7]).
Một phần của chiến lược là sử dụng độc tính dưới mức gây chết ở cá để đánh giá những rối loạn không thể chấp nhận được đối với sức khỏe của cá và quần thể cá. Điều này được thực hiện bằng cách chọn các chức năng sinh học quan trọng ở cá, không được phép tác động tiêu cực và ưu tiên cho các dấu hiệu sinh học và chỉ số sức khỏe phản ảnh các chức năng này. Trong hai thập kỷ qua, các biến sinh hóa, sinh lý và bệnh lý đã rất hữu ích như là công cụ nhạy để phát hiện ảnh hưởng sức khỏe ở cá tiếp xúc với nước thải của nhà máy bột giấy, cả trong các thí nghiệm trong phòng thử nghiệm có kiểm soát và ở cá tự nhiên sống ở vùng nước tiếp nhận (Tài liệu tham khảo [1], [5], [6], [7], [8], [9], [11], [12]). Tuy nhiên, vấn đề quan trọng là cách giải thích và đánh giá ý nghĩa sinh học của những sai lệch quan sát được so với các giá trị kiểm soát đối với các biến đơn lẻ và cách thực hiện đánh giá tổng hợp về tác động bất lợi đối với các chức năng sinh học quan trọng ở cá và cuối cùng là tính bền vững của quần thể cá.
Hướng dẫn diễn giải hiện tại về việc sử dụng các dấu hiệu sinh học/chỉ số sức khỏe để đánh giá rủi ro môi trường dựa trên các nghiên cứu về nước thải của nhà máy giấy và bột giấy (Tài liệu tham khảo [11], trong đó đưa ra đề xuất về phương pháp tiếp cận có hệ thống để đánh giá các rối loạn không thể chấp nhận được đối với các chức năng sinh hóa và sinh lý trong cá).
B.2 Các biến phụ thuộc
Một tập hợp các biến ưu tiên, được bổ sung với một số biến hỗ trợ, được nhóm lại theo năm chức năng sinh lý quan trọng sau đây:
- Tăng trưởng, ổn định và chuyển hóa năng lượng;
- Chức năng gan;
- Sinh sản;
- Bảo vệ miễn dịch;
- Bệnh học và huyết học.
Các biến được chọn để chỉ ra tác động bất lợi đối với các chức năng này được nêu trong Bảng A.1.
Ngoài ra, các khuyến nghị được đưa ra cho biết cần có bao nhiêu biến để mô tả các tác động đối với một chức năng sinh lý cụ thể. Nếu các biến này cho thấy độ lệch đáng kể về mặt thống kê so với các giá trị kiểm soát, thì có thể kết luận rằng chức năng này phải chịu tác động bất lợi hoặc nhiễu loạn không thể chấp nhận được. Ngoài ra, các tiêu chí được đưa ra để giải thích tác động tổng hợp đến sức khỏe của cá và sự sống còn của quần thể cá, khi các chức năng sinh lý bị ảnh hưởng xấu. Các hướng dẫn được xây dựng để đánh giá rủi ro môi trường đối với nước thải của nhà máy giấy và bột giấy, với những sửa đổi nhỏ và phù hợp trong việc lựa chọn các biến, chúng cũng có thể được áp dụng cho các loại nước thải công nghiệp và nước thải đô thị khác.
B.3 Chiến lược đánh giá sinh học và diễn giải
B.3.1 Quy định chung
Khi xem xét kiến thức chưa đầy đủ hiện tại về "các giá trị chuẩn" đối với các biến sinh hóa và sinh lý ở các loài cá khác nhau và sự thay đổi thống kê lớn tồn tại đối với một số biến, thì chưa thể đưa ra đánh giá đáng tin cậy về mức độ sai lệch so với các giá trị chuẩn cần thiết để thiết lập tác động nghiêm trọng hoặc sự rối loạn không thể chấp nhận được. Thay vào đó, một chiến lược tốt hơn để đánh giá các kết quả thu được là xem xét tất cả các sai lệch có ý nghĩa thống kê so với cá đối chứng (ở mức p < 0,05) là các tác động đã được chứng minh và để đánh giá mô hình tác động tổng thể dựa trên đánh giá kết hợp của một số biến. Tuy nhiên, trong đánh giá cuối cùng và đánh giá các kết quả kết hợp từ một nghiên cứu cụ thể, sẽ hợp lý nếu tính đến mức độ sai lệch đối với các biến đáp ứng khác nhau.
Cần nhấn mạnh rằng, trước khi giải thích các đáp ứng sinh hóa, sinh lý và bệnh lý, cần xem xét tác động của các yếu tố môi trường khác nhau (nhiệt độ nước, nguồn thức ăn, v.v...). Ngoài ra, cần xác minh rằng cá thử nghiệm đã thực sự tiếp xúc với các chất ô nhiễm hoặc nước thải công nghiệp (ví dụ: bằng cách phân tích các chất có trong mật cá).
Các biến sinh học/dấu hiệu sinh học được chọn với mục đích để phản ánh các chức năng sống quan trọng của cá. Một số chức năng này, như tăng trưởng và sinh sản, có liên quan đến sinh thái cao. Điều này có nghĩa là có sự rối loạn sinh sản đáng kể hoặc giảm tăng trưởng, đã được quan sát thấy trong các thí nghiệm trong phòng thử nghiệm hoặc nghiên cứu thực địa, nên được coi là tác động môi trường không thể chấp nhận được vì những tác động như vậy dự kiến sẽ gây ra hậu quả nghiêm trọng ở cấp độ quần thể và hệ sinh thái. Vì lý do tương tự, tần suất thay đổi bệnh lý tăng lên đáng kể (ví dụ: bào mòn vây, vết thương trên da, khối u, biến dạng xương và các dị tật khác) là không thể chấp nhận được. Những thay đổi đáng kể trong các biến đơn lẻ có thể được chấp nhận nếu chúng không được hỗ trợ bởi các đáp ứng có ý nghĩa trong các biến khác phản ánh cùng một chức năng sinh lý. Dựa trên việc sử dụng một loạt các chỉ số sức khỏe ở cá để đánh giá độc tính dưới mức gây chết, mô hình hệ thống sau đây được đề xuất để xác định sự rối loạn không thể chấp nhận được đối với các chức năng sinh lý quan trọng cũng như tác động không thể chấp nhận được đối với sức khỏe tổng thể của cá và cuối cùng là tác động môi trường không thể chấp nhận được.
B.3.2 Đánh giá rối loạn không thể chấp nhận được đối với chức năng sinh học của cá
Các đáp ứng trong tất cả các biến đại diện cho một chức năng sinh lý cụ thể trong Bảng A.1 được xem xét kết hợp như sau.
- Nếu một hoặc hai biến sai lệch đáng kể (p < 0,05) so với các giá trị kiểm soát, thì thường dẫn đến việc điều tra thêm. Điều này có nghĩa là cần có các nghiên cứu bổ sung để xác nhận xem chức năng sinh học có bị ảnh hưởng hay không.
- Nếu ba biến trở lên trong cùng một nhóm chức năng bị ảnh hưởng đáng kể, thì điều này được hiểu là có sự rối loạn chức năng không thể chấp nhận được.
- Các biến sai lệch, được liệt kê theo hai nhóm chức năng (ví dụ: kích thước gan, glycogen gan, gan nhiễm mỡ) trong Bảng A.1, chỉ được đánh giá trong một nhóm.
Có những trường hợp ngoại lệ sau đây.
- Tăng trưởng: tăng trưởng giảm mạnh, có thể được kết nối hợp lý với các rối loạn nghiêm trọng khác (ví dụ: thay đổi chuyển hóa, rối loạn chức năng gan, tổn thương mô) cần được đánh giá là tác động không thể chấp nhận được đến quần thể cá.
- Sinh sản: tác động đáng kể đến nhiều hơn một trong các điểm cuối, sự trưởng thành về giới tính và sự phát triển của tuyến sinh dục, nên được hiểu là sự rối loạn sinh sản không thể chấp nhận được. Ngoài ra, sự suy giảm khả năng sinh sản được quan sát thấy trong một thử nghiệm sinh sản riêng biệt (ví dụ: thử nghiệm trứng/ấu trùng với cá hồi vân, thử nghiệm sinh sản với cá tuyết sông, thử nghiệm nở với trứng cá rô) là đủ để xác định sự sinh sản bị rối loạn mặc dù không có hoặc chỉ một biến sinh sản trong Bảng A.1 sai lệch đáng kể.
- Thay đổi bệnh lý: tần suất thay đổi bệnh lý của các kiểu loại được đề cập ở trên tăng lên nên được hiểu là tác động không thể chấp nhận được đối với sức khỏe của cá và là tác động môi trường không thể chấp nhận được.
B.3.3 Đánh giá tổng thể về sự rối loạn không thể chấp nhận về tình trạng sức khỏe tổng thể của cá
Nhìn chung, rối loạn không thể chấp nhận được đối với một trong các chức năng sinh lý được liệt kê trong Bảng A.1 sẽ dẫn đến việc điều tra thêm để xác định các tác động phản ánh các chức năng sinh học khác có thể liên quan và tăng rối loạn quan sát được.
Sự rối loạn không thể chấp nhận được của hai hoặc nhiều chức năng sinh lý nên được hiểu là sự rối loạn không thể chấp nhận được đối với sức khỏe của cá và có thể hàm ý rủi ro cao đối với các tác động ở cấp độ quần thể và hệ sinh thái.
Có một ngoại lệ: sinh sản bị rối loạn, tăng trưởng giảm mạnh hoặc tăng tần suất thay đổi bệnh lý nghiêm trọng nên được hiểu là những tác động không thể chấp nhận được đối với sức khỏe của cá và do đó, một trong những rối loạn này, đơn lẻ, cũng đủ để kết luận rằng có thể đã có tác động môi trường không thể chấp nhận được.
B.4 Ứng dụng
Các hướng dẫn giải thích được đề xuất và mô hình hệ thống để đánh giá tác động môi trường của nước thải nhà máy giấy và bột giấy đã được áp dụng cho các kết quả thu được trong một số điều tra về cá trong phòng thử nghiệm cũng như trong nguồn nước tiếp nhận nước thải của nhà máy bột giấy. Các ứng dụng này chỉ ra rằng chiến lược đã xây dựng cung cấp một công cụ tốt để thực hiện đánh giá tổng hợp về những rối loạn không thể chấp nhận được đối với các chức năng sinh học quan trọng ở cá và tác động cuối cùng không thể chấp nhận được đối với sự bền vững của quần thể cá.
Phụ lục C
(Tham khảo)
Báo cáo đề xuất đối với việc lấy mẫu cá
Vị trí:____________ (ví dụ. Holmöarna, vị trí tham chiếu ở Vịnh Bothnian, Thụy Điển)
Ngày lấy mẫu cá : Ngày đến ngày-tháng-năm
Người lấy mẫu cá (tên, địa chỉ, số điện thoại):
____________________________________________________________________
Tổng số cá ước tính trong khay cá bằng gỗ:
Ghi nhận tỷ lệ cá chết trong quá trình bảo quản trong khay cá bằng gỗ:
| Địa điểm lấy mẫu | Vị trí lấy mẫu | Vĩ độ | Kinh độ | Độ sâu nước m | Biện pháp lấy mẫu |
| 1 V. Halörskatan | 3 | N63.41.30 | E20.52,55 | X m | 2 lưới rê |
| 9 | N63.41.18 | E20.52,60 | X m | 2 lưới rê | |
| 10 | N63.41.05 | E20.52,35 | X m | 2 lưới rê | |
| 11 | N63.41.05 | E20.52,65 | X m | 2 lưới rê | |
| 12 | N63.40,96 | E20.52,60 | X m | 2 lưới rê | |
| 2 Ö. Halörskatan | 13 | N63.41.28 | E20.54,10 | X m | 2 lưới đăng đáy |
| 14 | N63.41.10 | E20.54,05 | X m | 2 lưới đăng đáy | |
| 15 | N63.41.14 | E20.54,35 | X m | 2 lưới đăng đáy | |
| 16 | N63.41.08 | E20.53,90 | X m | 2 lưới đăng đáy | |
| 17 | N63.41.13 | E20.53,75 | X m | 2 lưới đăng đáy |
Vị trí_________________ Ngày (ngày-tháng-năm)
Chữ ký
Phụ lục D
(Tham khảo)
Báo cáo đề xuất đối với việc lấy mẫu mô
Vị trí:
_______________________________________________________________
Ngày lấy mẫu (ngày đến ngày - tháng - năm):
Trưởng nhóm lấy mẫu: Tên
Địa chỉ:
________________________________________________________________
Số điện thoại:
Bảng D.1 - Mẫu mô và các kết quả của việc thực hiện phép đo trong quá trình lấy mẫu
| Biến, đơn vị | Mẫu hoặc giá trị đo được | Số cá | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||
| Tổng chiều dài, mm | Được tính |
|
|
|
|
|
|
|
|
|
|
| Tổng khối lượng, g | Được xác định |
|
|
|
|
|
|
|
|
|
|
| Khối lượng gona, g | Được xác định |
|
|
|
|
|
|
|
|
|
|
| Khối lượng soma, g | Được tính |
|
|
|
|
|
|
|
|
|
|
| Yếu tố điều kiện Soma, g/mm | Được tính |
|
|
|
|
|
|
|
|
|
|
| Chỉ số gonadosoma (GSI), % | Được tính |
|
|
|
|
|
|
|
|
|
|
| Khối lượng gan, g | Được xác định |
|
|
|
|
|
|
|
|
|
|
| Chỉ số soma gan (LSI), % | Được tính |
|
|
|
|
|
|
|
|
|
|
| Tổng chỉ số gan (LTI), % | Được tính |
|
|
|
|
|
|
|
|
|
|
| Tuổi, năm | Mang, xương tai hoặc vảy |
|
|
|
|
|
|
|
|
|
|
| Mẫu histopathology | Gan, lá lách, V.V.. để cố định |
|
|
|
|
|
|
|
|
|
|
| Tế bào máu trắng | Phết máu |
|
|
|
|
|
|
|
|
|
|
| Haematocrit, % | Được xác định |
|
|
|
|
|
|
|
|
|
|
| Haemoglobin, g/l hoặc mmol/L | Giá trị máu |
|
|
|
|
|
|
|
|
|
|
| Glucose trong máu, mmol/L | Giá trị máu |
|
|
|
|
|
|
|
|
|
|
| Lactat máu, mg/100 mL hoặc mmol/L | Giá trị máu |
|
|
|
|
|
|
|
|
|
|
| Mẫu cytochrom gan P450 , ca 1 g a |
|
|
|
|
|
|
|
|
|
| |
| Mẫu EROD gan, ca 1 g a |
|
|
|
|
|
|
|
|
|
| |
| Mẫu glutathione reductase (GR), ca 1 g a |
|
|
|
|
|
|
|
|
|
| |
| Mẫu metallothionein (MT), ca 1 g a |
|
|
|
|
|
|
|
|
|
| |
| Mẫu bổ sung DNA gan, ca 1 g a |
|
|
|
|
|
|
|
|
|
| |
| Mẫu plasma vitellogenin, ca 0,5 mL a |
|
|
|
|
|
|
|
|
|
| |
| Mẫu plasma clorua, ca 0,1 mLa |
|
|
|
|
|
|
|
|
|
| |
Bảng D.1 (tiếp theo)
| Biến, đơn vị | Mẫu và giá trị đo được | Số cá | |||||||||
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | ||
| Tổng chiều dài, mm | Được đo |
|
|
|
|
|
|
|
|
|
|
| Tổng khối lượng, g | Được xác định |
|
|
|
|
|
|
|
|
|
|
| Khối lượng Gonad, g | Được xác định |
|
|
|
|
|
|
|
|
|
|
| Khối lượng Somac, g | Được tính |
|
|
|
|
|
|
|
|
|
|
| Yếu tố điều kiện Soma, g/mm | Được tính |
|
|
|
|
|
|
|
|
|
|
| Chỉ số Gonadosoma (GSI), % | Được tính |
|
|
|
|
|
|
|
|
|
|
| Khối lượng gan, g | Được xác định |
|
|
|
|
|
|
|
|
|
|
| Chỉ số soma gan (LSI), % | Được tính |
|
|
|
|
|
|
|
|
|
|
| Tổng chỉ số gan (LTI), % | Được tính |
|
|
|
|
|
|
|
|
|
|
| Tuổi, năm | Mang, xương tai hoặc vảy |
|
|
|
|
|
|
|
|
|
|
| Mẫu Histopathology | Gan, lá lách, v.v.. để cố định |
|
|
|
|
|
|
|
|
|
|
| Tế bào máu trắng | Phết máu |
|
|
|
|
|
|
|
|
|
|
| Haemocrit, % | Ly tâm |
|
|
|
|
|
|
|
|
|
|
| Haemoglobin, g/L hoặc mmol/L | Giá trị hiện trường/phòng thử nghiệm |
|
|
|
|
|
|
|
|
|
|
| Glucose máu, mmol/L | Giá trị hiện trường/phòng thử nghiệm |
|
|
|
|
|
|
|
|
|
|
| Lactat máu, mg/100 mL hoặc mmol/L | Giá trị hiện trường/phòng thử nghiệm |
|
|
|
|
|
|
|
|
|
|
| Mẫu cytochrom P450 gan, ca 1 g a |
|
|
|
|
|
|
|
|
|
| |
| Mẫu EROD gan, ca 1 g a |
|
|
|
|
|
|
|
|
|
| |
| Mẫu Glutathione reductase (GR), ca 1 g a |
|
|
|
|
|
|
|
|
|
| |
| Mẫu Metallothionein (MT), ca 1 g a |
|
|
|
|
|
|
|
|
|
| |
| Mẫu bổ sung DNA gan, ca 1 g a |
|
|
|
|
|
|
|
|
|
| |
| Mẫu Plasma vitellogenin, ca 0,5 mL a |
|
|
|
|
|
|
|
|
|
| |
| Mẫu Plasma clorua, ca 0,1 mL a |
|
|
|
|
|
|
|
|
|
| |
| a Mẫu mô được đông lạnh sâu trong nitơ lỏng (ở -196 °C) và được vận chuyển bằng cacbon dioxit rắn (ở -78 °C); số lượng là gần đúng và khi xác định một số chất phân tích, có thể sử dụng cùng một mẫu mô ban đầu. | |||||||||||
Vị trí_____________ Ngày đến ngày - tháng - năm)_____________________
Chữ ký ___________________________________________________
Thư mục tài liệu tham khảo
[1 ] EN 14011:2003, Water quality - Sampling of fish with electricity
[2] EN 14757:2005, Water quality - Sampling of fish with multi-mesh gillnets
[3] EN 14962:2006, Water quality - Guidance on the scope and selection of fish sampling methods
[4] ANDERSSON, T., FÖRLIN, L. HÄRDIG, J. and LARSSON, A. Physiological disturbances in fish living in coastal water polluted with bleached kraft pulp mill effluents. Can. J. Fish. Aquat. Sci. 1988, 45, pp. 1525-1536
[5] HANSSON, T., LINDESJÖÖ, E., FÖRLIN, L, BALK, L, BIGNERT, A. and LARSSON, A. Long-term monitoring of the health status of female perch (Perea fluviatilis) in the Baltic Sea shows decreased gonad weight and increased hepatic EROD activity. Aquat. Toxicol. 2006, 79, pp. 341-355
[6] LANDNER, L, GRAHN, O., HÄRDIG, J., LEHTINEN, K.J., MONFELT, C. AND TANA, J. A field study of environmental impacts at a bleached kraft pulp mill site on the Baltic Sea coast. Ecotoxicol. Environ. Saf. 1994, 27, pp. 128-157
[7] LARSSON, E., FÖRLIN, L, LINDESJGO, E. AND SANDSTRÖM, O. Monitoring of individual organism responses in fish populations exposed to pulp mill effluents. Paper presented at: 3rd International Conference on Environmental Fate and Effects of Pulp and Paper Mill Effluents, Rororua, New Zealand, 1997-11-09 to 13
[8] LINDESJÖÖ, E. AND THULIN, J. 1990. Fin erosion of perch Perea fluviatilis and ruffe Gymnocephalus cernua in a pulp mill effluent area. Dis. Aquat. Org. 1990, 8, pp. 119-126
[9] LINDESJÖÖ, E., THULIN, J. Histopathology of skin and gills of fish in pulp mill effluents. Dis. Aquat. Org. 1994, 18, pp. 81-93
[10] MUNKITTRICK, K.R., SERVOS, M.R., CAREY, J.H. AND VAN DER KRAAK, G.J. Environmental impact of pulp and paper waste water: Evidence for a reduction at North American pulp mills since 1992. Water Sci. Technol. 1997, 35, pp. 329-338
[11] ROBERTS, R.J., editor. Fish pathology. Bailliere Tindall, London, 1978, 318 p.
[12] SANDSTRÖM, O., editor. Environmental impact of pulp and paper mill effluents: A strategy for future environmental nsk assessment. Report from an expert group appointed by the Swedish Forest Industries Water and Air Pollution Research Foundation and the Swedish Environmental Protection Agency (SEPA). Swedish Environmental Protection Agency, Stockholm, 1997, 83 p. (SEPA Report 4785)
[13] TANA, J., ROSEMARIN, A., LEHTINEN, K.J., HÄRDIG, J., GRAHN, O. and Landner, L. Assessing impacts on Baltic coastal ecosystems with mesocosm and fish biomarker tests: A comparison of new and old wood pulp bleaching technologies. Sci. Total Environ. 1994, 145, pp. 213-234
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 13915-1:2023 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 13915-1:2023 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 13915-1:2023 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 13915-1:2023 DOC (Bản Word)