Quyết định 5772/QĐ-BYT 2021 Biểu mẫu và quy trình cấp “Hộ chiếu vắc xin”
- Tổng hợp lại tất cả các quy định pháp luật còn hiệu lực áp dụng từ văn bản gốc và các văn bản sửa đổi, bổ sung, đính chính…
- Khách hàng chỉ cần xem Nội dung MIX, có thể nắm bắt toàn bộ quy định pháp luật hiện hành còn áp dụng, cho dù văn bản gốc đã qua nhiều lần chỉnh sửa, bổ sung.
thuộc tính Quyết định 5772/QĐ-BYT
| Cơ quan ban hành: | Bộ Y tế |
| Số công báo: | Đang cập nhật |
| Số hiệu: | 5772/QĐ-BYT |
| Ngày đăng công báo: | Đang cập nhật |
| Loại văn bản: | Quyết định |
| Người ký: | Trần Văn Thuấn |
| Ngày ban hành: | 20/12/2021 |
| Ngày hết hiệu lực: | Đang cập nhật |
| Áp dụng: | |
| Tình trạng hiệu lực: | Đã biết Vui lòng đăng nhập tài khoản gói Tiêu chuẩn hoặc Nâng cao để xem Tình trạng hiệu lực. Nếu chưa có tài khoản Quý khách đăng ký tại đây! |
| Lĩnh vực: | Y tế-Sức khỏe, COVID-19 |
TÓM TẮT VĂN BẢN
Cụ thể, quy trình cấp "Hộ chiếu vắc xin" cho người dân gồm 03 bước: Các cơ sở tiêm chủng rà soát, xác minh, xác thực thông tin người dân tiêm chủng vắc xin COVID-19 theo quy định pháp luật; Các cơ sở tiêm chủng thực hiện ký số dữ liệu tiêm chủng vắc xin COVID-19 trên Nền tảng Quản lý tiêm chủng COVID-19; Cục Y tế dự phòng - Bộ Y tế thực hiện ký số giấy xác nhận tiêm chủng vắc xin phòng COVID-19 tập trung.
Bên cạnh đó, "Hộ chiếu vắc xin" sẽ hiển thị các trường thông tin: Họ và tên; Ngày tháng năm sinh; Quốc tịch; Bệnh dịch mà chứng nhận nhắm tới; Số mũi tiêm đã nhận; Ngày tiêm; Liều số; Vắc xin; Sản phẩm vắc xin; Nhà cung cấp hoặc sản xuất vắc xin; Mã số của chứng nhận. Các thông tin trên sẽ được ký số, mã hoá và được đóng gói dưới dạng mã QR định dạng 2D. Mã QR hết hạn sau 12 tháng kể từ ngày khởi tạo.
Ngoài ra, Bộ Y tế còn hướng dẫn việc Chuẩn hóa dữ liệu tiêm chủng vắc xin COVID-19; Quy trình kỹ thuật tạo mã QR; Danh mục các bảng mã quốc tế về loại Vắc xin; Tên nhà sản xuất/thương hiệu...
Quyết định này có hiệu lực kể từ ngày ký.
Xem chi tiết Quyết định5772/QĐ-BYT tại đây
tải Quyết định 5772/QĐ-BYT
|
BỘ Y TẾ ______ Số: 5772/QĐ-BYT |
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập - Tự do - Hạnh phúc _____________________ Hà Nội, ngày 20 tháng 12 năm 2021 |
QUYẾT ĐỊNH
Ban hành Biểu mẫu và quy trình cấp “Hộ chiếu vắc xin”
_______
BỘ TRƯỞNG BỘ Y TẾ
Căn cứ Luật Phòng, chống bệnh truyền nhiễm năm 2007;
Căn cứ Nghị định số 75/2017/NĐ-CP ngày 20 tháng 6 năm 2017 của Chính phủ Quy định Chức năng, nhiệm vụ quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Theo đề nghị của Cục trưởng Cục Công nghệ thông tin,
QUYẾT ĐỊNH:
Điều 1. Ban hành kèm theo Quyết định này Biểu mẫu và quy trình cấp “Hộ chiếu vắc xin”.
Điều 2. Biểu mẫu và quy trình cấp “Hộ chiếu vắc xin” ban hành theo Quyết định này được áp dụng thống nhất tại tất cả các cơ sở tiêm chủng trên cả nước.
Điều 3. Quyết định này có hiệu lực kể từ ngày ký, ban hành.
Điều 4. Các Ông, Bà: Cục trưởng Cục Công nghệ thông tin, Cục trưởng Cục Y tế dự phòng, Chánh Văn phòng Bộ, Chánh Thanh tra Bộ, Vụ trưởng, Cục trưởng, Tổng Cục trưởng các Vụ, Cục, Tổng cục thuộc Bộ Y tế; Thủ trưởng các đơn vị trực thuộc Bộ Y tế; Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc Trung ương; Thủ trưởng y tế các ngành và các đơn vị có liên quan chịu trách nhiệm thi hành Quyết định này./.
|
Nơi nhận: - Như điều 4; - PTTg. Vũ Đức Đam (để báo cáo); - Bộ trưởng Nguyễn Thanh Long (để báo cáo); - Các bộ: Ngoại giao, Công an, Thông tin và Truyền thông (để phối hợp); - Các Thứ trưởng Bộ Y tế; - Lưu: VT, CNTT. |
KT. BỘ TRƯỞNG THỨ TRƯỞNG
Trần Văn Thuấn |
|
BỘ Y TẾ _______
|
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập - Tự do - Hạnh phúc ________________________
|
BIỂU MẪU VÀ QUY TRÌNH CẤP “HỘ CHIẾU VẮC XIN”
(Ban hành kèm theo Quyết định số 5772/QĐ-BYT ngày 20 tháng 12 năm 2021 của Bộ Y tế)
1. Biểu mẫu “Hộ chiếu vắc xin”
1.1. Các trường thông tin hiển thị:
1. Họ và tên;
2. Ngày tháng năm sinh;
3. Quốc tịch;
4. Bệnh dịch mà chứng nhận nhắm tới;
5. Số mũi tiêm đã nhận;
6. Ngày tiêm;
7. Liều số;
8. Vắc xin;
9. Sản phẩm vắc xin;
10. Nhà cung cấp hoặc sản xuất vắc xin;
11. Mã số của chứng nhận.
Các thông tin trên sẽ được ký số, mã hoá và được đóng gói dưới dạng mã QR định dạng 2D. Yêu cầu cụ thể sẽ được mô tả tại Mục 4.
1.2. Các thông tin trên bao gồm họ và tên và ngày sinh kết hợp với giấy tờ định danh khác như CMND, CCCD hay hộ chiếu để giúp định danh người sở hữu.
1.3. Các thông tin về bệnh dịch mà chứng nhận nhắm tới, vắc xin, loại vắc xin và nhà cung cấp hoặc sản xuất sẽ được hiển thị tương ứng với tài liệu “COVID-19 vaccine tracker and landscape” của WHO được cập nhật trên Cổng thông tin điện tử của WHO và “Value Sets for EU Digital COVID Certificates” do Liên minh Châu Âu (EU) ban hành.
1.4. Ngày tiêm và số mũi tiêm đã nhận để xác định thông tin tiêm chủng.
1.5. Mã QR hết hạn sau 12 tháng kể từ ngày khởi tạo.

Hình 1: Minh họa Chứng nhận điện tử đã tiêm vắc xin COVID-19 của Việt Nam trên thiết bị di động
2. Quy trình cấp “Hộ chiếu vắc xin”
2.1. Sơ đồ quy trình
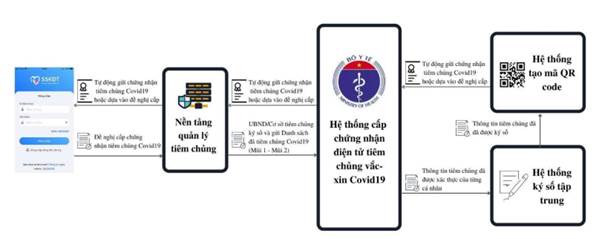
2.2. Mô tả quy trình
- Bước 1: Các cơ sở tiêm chủng rà soát, xác minh, xác thực thông tin người dân tiêm chủng vắc xin COVID-19 theo hướng dẫn tại Công văn số 8938/BYT-DP ngày 21/10/2021 của Bộ Y tế về việc hướng dẫn quy trình xác minh thông tin và tiêm chủng vắc xin COVID-19 và Công văn số 9438/BYT-CNTT ngày 5/11/2021 của Bộ Y tế về việc hướng dẫn Quy trình xác thực thông tin người dân trên Nền tảng Quản lý tiêm chủng COVID-19.
- Bước 2: Các cơ sở tiêm chủng thực hiện ký số dữ liệu tiêm chủng vắc xin COVID-19 trên Nền tảng Quản lý tiêm chủng COVID-19. Nền tảng Quản lý tiêm chủng COVID-19 kết nối, chia sẻ dữ liệu tiêm chủng với Hệ thống Quản lý cấp chứng nhận tiêm chủng vắc xin COVID-19 đáp ứng theo các quy định về kết nối dữ liệu y tế do Bộ Y tế ban hành.
Dữ liệu tiêm chủng vắc xin COVID-19 trên Nền tảng Quản lý tiêm chủng COVID-19 cần đáp ứng quy định tại Mục 3 và Mục 4.
- Bước 3: Cục Y tế dự phòng - Bộ Y tế thực hiện ký số giấy xác nhận tiêm chủng vắc xin phòng COVID-19 tập trung. Chứng nhận được cấp sử dụng định dạng mã QR theo tiêu chuẩn của EU quy định tại Mục 5.
Các ứng dụng phòng chống dịch quốc gia và các ứng dụng tiện ích khác (nếu được sự đồng ý của cá nhân người sử dụng) tiếp nhận và lưu giữ xác nhận tiêm chủng vắc xin phòng COVID-19 dạng mã QR theo hướng dẫn trao đổi dữ liệu y tế do Bộ Y tế ban hành.
3. Chuẩn hóa dữ liệu tiêm chủng vắc xin COVID-19
|
TT |
Thông tin |
Ví dụ |
|
Thông tin cá nhân |
||
|
1 |
Họ và tên |
Nguyễn Văn A |
|
2 |
Ngày sinh |
20/10/1999 |
|
3 |
Số điện thoại |
0912345678 |
|
4 |
Số Chứng minh thư nhân dân/Căn cước công dân |
001123456789 |
|
5 |
Số hộ chiếu |
Nếu có |
|
6 |
Quốc tịch |
Việt Nam |
|
Mũi tiêm số 1 |
||
|
7 |
Vắc xin* |
EU/1/20/1528 |
|
8 |
Loại vắc xin* |
1119305005 |
|
9 |
Nhà cung cấp/sản xuất* |
ORG-100030215 |
|
10 |
Mũi tiêm số |
1 |
|
11 |
Ngày tiêm |
20/6/2021 |
|
12 |
Tên đơn vị tiêm chủng |
|
|
13 |
Tên cơ sở quản lý |
|
|
Mũi tiêm số 2 |
||
|
14 |
Vắc xin* |
EU/1/20/1528 |
|
15 |
Loại vắc xin* |
1119305005 |
|
16 |
Nhà cung cấp/sản xuất* |
ORG-100030215 |
|
17 |
Mũi tiêm số |
2 |
|
18 |
Ngày tiêm |
20/7/2021 |
|
19 |
Tên đơn vị tiêm chủng |
|
|
20 |
Tên cơ sở quản lý |
|
|
21 |
Tổng số liều đã tiêm |
2 |
|
Chữ ký số của cơ sở tiêm chủng |
||
*Vắc xin, loại vắc xin và nhà cung cấp hoặc sản xuất điền theo thông tin tại Mục 4. Danh mục các bảng mã quốc tế
4. Danh mục các bảng mã quốc tế
4.1. Bệnh dịch
|
Code |
Tên bệnh dịch |
|
840539006 |
COVID-19 |
4.2. Loại Vắc xin
|
Code |
Tên loại vắc xin |
|
1119305005 |
Vắc xin antigen SARS-CoV-2 |
|
1119349007 |
Vắc xin mRNA SARS-CoV-2 |
|
J07BX03 |
Vắc xin Covid-19 khác |
4.3. Sản phẩm Vắc xin
|
Code |
Tên sản phẩm vắc xin/ tên vắc xin |
|
EU/1/20/1528 |
Comirnaty/ Pfizer |
|
EU/1/20/1507 |
Spikevax (previously COVID-19 Vaccine Moderna)/Moderna |
|
EU/1/21/1529 |
Vaxzevria/ Astrazeneca |
|
EU/1/20/1525 |
COVID-19 Vaccine Janssen/ Janssen |
|
Hayat-Vax |
Hayat-Vax/ Hayat-Vax |
|
BBIBP-CorV |
BBIBP-CorV/ Vero-Cell |
|
Sputnik-V |
Sputnik-V/ Sputnik |
|
Abdala |
Abdala/ Abdala |
4.4. Tên nhà sản xuất/thương hiệu
|
Code |
Tên nhà sản xuất/thương hiệu |
|
ORG-100030215 |
BioNTech Manufacturing GmbH |
|
ORG-100031184 |
Rovi Pharma Industrial Services, S.A, Spain Recipharm Monts, France |
|
ORG-100001699 |
AstraZeneca, AB |
|
ORG-100001417 |
Janssen-Cilag International NV |
|
ORG-100023050 |
Gulf Pharmaceutical Industries |
|
ORG-100020693 |
Beijing Institute of Biological Products Co., Ltd |
|
CIGB |
Cuba CIGB (Center for Genetic Engineering and Biotechnology) |
5. Quy trình kỹ thuật tạo mã QR
5.1. Quy trình khởi tạo mã QR
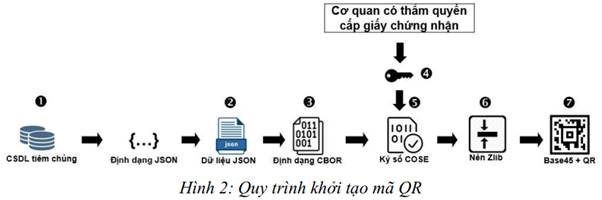
5.2. Yêu cầu kỹ thuật với các bước trong quy trình khởi tạo mã QR
|
STT |
Nội dung |
Yêu cầu kỹ thuật |
|
1 |
Định dạng dữ liệu tại phần II |
Định dạng Json (theo RFC 7159) |
|
2 |
Chuyển dữ liệu JSON thành CBOR |
Sử dụng thuật toán chuyển đổi định dạng JSON thành định dạng CBOR (theo RFC 8392) |
|
3 |
Ký số |
Sử dụng thuật toán ký số RSA (theo RFC 8230) 2048 bits cùng thuật toán băm SHA-256 (theo ISO/IEC 101183:2004) |
|
4 |
Mã hoá và nén dữ liệu CBOR |
Sử dụng giao thức COSE (theo RFC 8152) |
|
5 |
Nén dữ liệu đã được COSE |
Sử dụng thuật toán Zlib (theo RFC 1950) |
|
6 |
Thay đổi cấu trúc dữ liệu |
Sử dụng thuật toán BASE45 |
|
7 |
Tạo hình ảnh 2D |
Sử dụng thuật toán ASCII (theo phần 3 tài liệu ICAO 9303) và hình thành mã vạch QR (theo ISO/IEC 18004:2015) |
|
THE MINISTRY OF HEALTH No. 5772/QD-BYT |
THE SOCIALIST REPUBLIC OF VIETNAM Hanoi, December 20, 2021 |
DECISION
On promulgating the template and procedure for issuance of “Vaccine passports”
___________
THE MINISTER OF HEALTH
Pursuant to the 2007 Law on Prevention and Control of Infectious Diseases;
Pursuant to the Government’s Decree No. 75/2017/ND-CP dated June 20, 2017, defining the functions, tasks, powers and organizational structure of the Ministry of Health;
At the proposal of the Director of the Information Technology Department,
DECIDES:
Article 1. To promulgate together with this Decision the template and procedure for issuance of “Vaccine passports”.
Article 2. The template and procedure for issuance of “Vaccine passports” provided in this Decision shall be applied uniformly at all vaccination establishments nationwide.
Article 3. This Decision takes effect from the date of its signing.
Article 4. The Director of the Information Technology Department, Director of the General Department of Preventive Medicine, Chief of Office of the Ministry of Health, Chief Inspector of the Ministry of Health, General Directors of General Departments and Directors of Departments under the Ministry of Health; heads of units under the Ministry of Health; Directors of Health Departments of provinces and centrally-run cities; leaders in charge of health of all relevant sectors and units shall be responsible for implementing this Decision./.
For the Minister
The Deputy Minister
TRAN VAN THUAN
|
THE MINISTRY OF HEALTH |
THE SOCIALIST REPUBLIC OF VIETNAM |
THE TEMPLATE AND PROCEDURE
FOR ISSUANCE OF “VACCINE PASSPORTS”
(Issued together with the Ministry of Health’s Decision No. 5772/QD-BYT
dated December 20, 2021)
1. “Vaccine passport” template
1.1. Displayed information shall include:
1. Full name;
2. Date of birth;
3. Nationality;
4. Targeted disease;
5. Number of vaccine shots;
6. Date of vaccination;
7. Dose number;
8. Vaccines;
9. Vaccine products;
10. Vaccine suppliers or manufacturers;
11. Code of the certificate.
The data would be e-signed, encrypted and presented through a 2D QR code. Specific requirements are provided in Section 4.
1.2. The above information includes full name and date of birth together with other identification papers such as people’s identity card or citizen’s identity card or passport for identifying the holder.
1.3. The information about targeted disease, vaccines, vaccine types and vaccine suppliers or manufacturers shall be displayed in correspondence with the document “COVID-19 vaccine tracker and landscape” published on the WHO’s portal and the document “Value Sets for EU Digital COVID Certificates” promulgated by the European Union (EU).
1.4. Date of vaccination and number of vaccine shots serve the identification of vaccination information.
1.5. QR codes shall expire after 12 months from the date of creation.
Image 1: An illustration of how Vietnam's Covid-19 vaccine passport
is presented on a mobile phone.
2. Procedure for issuance of “Vaccine passports”
2.1. Procedure map
2.2. Procedure description
- Step 1: Vaccination establishments review, verify and authenticate information about people who are vaccinated against COVID-19 in accordance with the Ministry of Health’s Official Dispatch No. 8938/BYT-DP dated October 21, 2021, on guiding the procedure for information verification and vaccination against COVID-19 and the Ministry of Health’s Official Dispatch No. 9438/BYT-CNTT dated November 5, 2021, on guiding the procedure for verifying people's information on the COVID-19 Immunization Management Platform.
- Step 2: Vaccination establishments digitally sign COVID-19 vaccination data on the COVID-19 Immunization Management Platform. The COVID-19 Immunization Management Platform is connected and shared with the COVID-19 Vaccine Immunization Certification Management System in accordance with the Ministry of Health’s regulations on connection of medical data.
The vaccination data on the COVID-19 Immunization Management Platform shall satisfy the requirements prescribed in Sections 3 and 4.
- Step 3: The General Department of Preventive Medicine under the Ministry of Health shall digitally sign the certificate of vaccination against COVID-19. The certificate shall be presented with a QR code according to the EU standards prescribed in Section 5.
National disease prevention applications and other utility applications (if approved by users) shall receive and store the confirmation of vaccination against COVID-19 in the form of a QR code in accordance with the Ministry of Health’s instructions on medical data exchange.
3. Standardization of COVID-19 vaccination data
|
No. |
Information |
Example |
|
Personal information |
||
|
1 |
Full name |
Nguyen Van A |
|
2 |
Date of birth |
October 20, 1999 |
|
3 |
Phone number |
0912345678 |
|
4 |
Number of people’s identity card/citizen’s identity card |
001123456789 |
|
5 |
Number of passport |
If any |
|
6 |
Nationality |
Vietnam |
|
The 1st vaccine shot |
||
|
7 |
Vaccine* |
EU/1/20/1528 |
|
8 |
Vaccine type* |
1119305005 |
|
9 |
Supplier/manufacturer* |
ORG-100030215 |
|
10 |
Shot number |
1 |
|
11 |
Date of vaccination |
June 20, 2021 |
|
12 |
Name of vaccination establishment |
|
|
13 |
Name of management establishment |
|
|
The 2nd vaccine shot |
||
|
14 |
Vaccine* |
EU/1/20/1528 |
|
15 |
Vaccine type* |
1119305005 |
|
16 |
Supplier/manufacturer* |
ORG-100030215 |
|
17 |
Shot number |
2 |
|
18 |
Date of vaccination |
July 20, 2021 |
|
19 |
Name of vaccination establishment |
|
|
20 |
Name of management establishment |
|
|
21 |
Total number of vaccine shots
|
2 |
|
E-signature of vaccination establishment |
||
*Regarding “Vaccine, vaccine type and supplier/manufacturer”, fill in the information according to Section 4. List of international code tables
4. List of international code tables
4.1. Disease
|
Code |
Name of disease |
|
840539006 |
COVID-19 |
4.2. Vaccine type
|
Code |
Name of vaccine type |
|
1119305005 |
Antigen vaccines against SARS-CoV-2 |
|
1119349007 |
mRNA vaccines against SARS-CoV-2 |
|
J07BX03 |
Other vaccines against COVID-19 |
4.3. Vaccine product
|
Code |
Name of vaccine/vaccine product |
|
EU/1/20/1528 |
Comirnaty/ Pfizer |
|
EU/1/20/1507 |
Spikevax (previously COVID-19 Vaccine Moderna)/Moderna |
|
EU/1/21/1529 |
Vaxzevria/ Astrazeneca |
|
EU/1/20/1525 |
COVID-19 Vaccine Janssen/ Janssen |
|
Hayat-Vax |
Hayat-Vax/ Hayat-Vax |
|
BBIBP-CorV |
BBIBP-CorV/ Vero-Cell |
|
Sputnik-V |
Sputnik-V/ Sputnik |
|
Abdala |
Abdala/ Abdala |
4.4. Vaccine supplier/manufacturer
|
Code |
Name of vaccine supplier/manufacturer |
|
ORG-100030215 |
BioNTech Manufacturing GmbH |
|
ORG-100031184 |
Rovi Pharma Industrial Services, S.A, Spain Recipharm Monts, France |
|
ORG-100001699 |
AstraZeneca, AB |
|
ORG-100001417 |
Janssen-Cilag International NV |
|
ORG-100023050 |
Gulf Pharmaceutical Industries |
|
ORG-100020693 |
Beijing Institute of Biological Products Co., Ltd |
|
CIGB |
Cuba CIGB (Center for Genetic Engineering and Biotechnology) |
5. Technical procedure for generating QR codes
5.1. The QR code initialization procedure
Image 2: The QR code initialization procedure
5.2. Technical requirements for steps in the QR code initialization procedure
|
No. |
Content |
Requirements |
|
1 |
Data format in Part II |
Json format (according to RFC 7159) |
|
2 |
Convert JSON data to CBOR data |
Use the algorithm to convert JSON data to CBOR data (according to RFC 8392) |
|
3 |
E-sign |
Use the 2048-bit RSA digital signature algorithm 2048 bits (according to RFC 8230) together with the SHA-256 hashing algorithm (according to ISO/IEC 101183:2004) |
|
4 |
Encrypt and compress CBOR data |
Use the COSE protocol (according to RFC 8152) |
|
5 |
Compress COSE data |
Use the Zlib algorithm (according to RFC 1950) |
|
6 |
Change data structure |
Use the BASE45 algorithm |
|
7 |
Create 2D images |
Use the ASCII algorithm (according to Part 3 in the ICAO 9303 document) and generate a QR barcode (according to ISO/IEC 18004:2015) |
Vui lòng Đăng nhập tài khoản gói Nâng cao để xem đầy đủ bản dịch.
Chưa có tài khoản? Đăng ký tại đây
Lược đồ
Vui lòng Đăng nhập tài khoản gói Tiêu chuẩn hoặc Nâng cao để xem Lược đồ.
Chưa có tài khoản? Đăng ký tại đây
Chưa có tài khoản? Đăng ký tại đây
Chưa có tài khoản? Đăng ký tại đây
 Pháp lý doanh nghiệp
Pháp lý doanh nghiệp