Nếu chưa có tài khoản Quý khách đăng ký tại đây!
Tiêu chuẩn quốc gia TCVN 13915-2:2023 Chất lượng nước - Các phép đo sinh lý và sinh hóa trên cá - Phần 2
- Thuộc tính
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Đây là tiện ích dành cho thành viên đăng ký phần mềm.
Quý khách vui lòng Đăng nhập tài khoản LuatVietnam và đăng ký sử dụng Phần mềm tra cứu văn bản.
Tiêu chuẩn Việt Nam TCVN 13915-2:2023
| Số hiệu: | TCVN 13915-2:2023 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Tài nguyên-Môi trường |
| Ngày ban hành: | 29/12/2023 | Hiệu lực: | |
| Người ký: | Tình trạng hiệu lực: | Đã biết Vui lòng đăng nhập tài khoản gói Tiêu chuẩn hoặc Nâng cao để xem Tình trạng hiệu lực. Nếu chưa có tài khoản Quý khách đăng ký tại đây! | |
TIÊU CHUẨN QUỐC GIA
TCVN 13915-2:2023
ISO 23893-2:2007
CHẤT LƯỢNG NƯỚC - CÁC PHÉP ĐO SINH LÝ VÀ SINH HÓA TRÊN CÁ - PHẦN 2: XÁC ĐỊNH ETHOXYRESORUFIN-O-DEETHYLASE (EROD)
Water quality - Biochemical and physiological measurements on fish - Part 2: Determination of ethoxyresorufin-O-deethylase (EROD)
Lời nói đầu
TCVN 13915-2:2023 hoàn toàn tương đương với ISO 23893-2:2007.
TCVN 13915-2:2023 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC 147 Chất lượng nước biên soạn, Viện Tiêu chuẩn Chất lượng Việt Nam đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ TCVN 13915 (ISO 23893), Chất lượng nước - Các phép đo sinh lý và sinh hóa trên cá gồm các tiêu chuẩn sau:
- TCVN 13915-1:2023 (ISO 23893-1:2007), Phần 1: Lấy mẫu cá, xử lý và bảo quản mẫu;
- TCVN 13915-2:2023 (ISO 23893-2:2007), Phần 2: Xác định ethoxyresorufin-o-deethylase (EROD);
- TCVN 13915-3:2023 (ISO 23893-3:2013), Phần 3: Xác định Vitellogenin
Lời giới thiệu
Phép đo dấu hiệu sinh học ô nhiễm trên cá, như phép đo các hoạt tính biến đổi sinh học của enzym, có khả năng dùng để cung cấp thông tin về các mức tiếp xúc, khả dụng sinh học và ảnh hưởng sinh học sớm của các chất có trong hệ sinh thái dưới nước. Phép đo hoạt tính của enzym EROD cho phép chẩn đoán sự tiếp xúc của cả với các chất gây cảm ứng của cytochrome P450 1A, như Polycorinat biphenyls (PCBs) nhất định, hydrocacbon thơm đa vòng (PAHs) và dioxin. Rất nhiều công trình nghiên cứu cung cấp bằng chứng cho mức độ của các nghiên cứu đã thực hiện (xem Thư mục tài liệu tham khảo).
Sự cảm ứng của hoạt tính EROD cho thấy sự có mặt của các chất gây cảm ứng như những chất đã đề cập ở trên. Tuy nhiên, không có sự cảm ứng phản ánh sự tiếp xúc của cá với các chất ô nhiễm hữu cơ, bao gồm cả hiện tượng ức chế sự cảm ứng EROD về khả năng biến đổi các biến sinh học của chất gây cảm ứng hoặc chất nồng độ tiếp xúc thấp.
Việc áp dụng phương pháp tham chiếu chuẩn được khuyến cáo dùng trong chương trình quan trắc. Các thực hành hiệu chuẩn liên phòng bằng phép đo hoạt tính enzym EROD thực hiện từ năm 1991 đã đưa ra nhiều nguồn lỗi, những lỗi này rất dễ tránh (pha loãng resorufin, xác định protein, tính toán hoạt tính enzym v.v..) một khi các phòng thử nghiệm thành thạo việc phân tích các hoạt tính enzym và các yếu tố có khả năng gây lỗi.
CHẤT LƯỢNG NƯỚC - CÁC PHÉP ĐO SINH LÝ VÀ SINH HÓA TRÊN CÁ - PHẦN 2: XÁC ĐỊNH ETHOXYRESORUFIN-O-DEETHYLASE (EROD)
Water quality - Biochemical and physiological measurements on fish - Part 2: Determination of ethoxyresorufin-O-deethylase (EROD)
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp đo hoạt tính enzym ethoxyresorufin-O-deethylaza (EROD) trên phân đoạn sau khi loại ty thể của dịch đồng thể mô (chất đồng nhất) gan cá (phần dưới tế bào chứa hoạt tính EROD) sử dụng phương pháp đo huỳnh quang trong cuvet hoặc vi đĩa.
Phương pháp này áp dụng cho cá được lấy mẫu trong môi trường tự nhiên (nước ngọt hoặc nước mặn) hoặc đã tiếp xúc với các chất hoặc chất thải trong phòng thử nghiệm.
Phương pháp này có thể áp dụng cho các giá trị EROD lớn hơn hoặc bằng 1 pmol/(min.mg) protein. Có thể thu được độ nhạy cao hơn bằng cách sử dụng phương pháp dùng cuvet (ống nghiệm)
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 13915-1 (ISO 23893-1), Chất lượng nước - Các phép đo sinh lý và sinh hóa trên cá - Phần 1: Lấy mẫu, xử lý và bảo quản mẫu cá.
3 Nguyên tắc
Lấy mẫu cá và mổ cá như trong TCVN 13915-1 (ISO 23893-1) để lấy các miếng gan. Các chất đồng nhất của gan cá được chuẩn bị bằng cách nghiền (đồng hóa) và ly tâm để thu lấy phân đoạn S9 nổi phía trên. Hoạt tính enzym EROD trong các phân đoạn S9 được xác định bằng cách đo mức tăng huỳnh quang do sự biến đổi 7-ethoxyresorufin thành resorufin. Huỳnh quang được ghi lại theo lượng resorufin sử dụng dải hiệu chuẩn (ngoại chuẩn của resorufin hoặc của rhodamin B). Hoạt tính EROD liên quan đến lượng protein trong phân đoạn S9.
4 Môi trường thử nghiệm
Tất cả các thao tác xử lý và thử nghiệm phân đoạn S9 phải được thực hiện ở nhiệt độ xấp xỉ 4 °C (ví dụ: xử lý trong nước đá nghiền), trừ phản ứng enzym phải được thực hiện ở 20 °C ± 2 °C.
5 Thuốc thử
Chỉ sử dụng thuốc thử loại tinh khiết cấp phân tích được công nhận, trừ khi có quy định khác.
5.1 Nước siêu tinh khiết, có độ dẫn điện dưới 1 μS/cm.
5.2 Kali clorua, dung dịch 150 mmol/L
Hòa tan 11,2 g KCI (khối lượng phân tử tương đối là 74,6) trong 1 L nước (5.1). Dung dịch này ổn định trong 6 tháng ở nhiệt độ 4 °C ± 3 °C.
5.3 Dung dịch đệm phosphat, 100 mmol/L; pH 7,8 ± 0,1.
Thành phần ion và độ pH có thể ảnh hưởng đến hoạt độ EROD và các điều kiện tối ưu có thể khác nhau giữa các loài. Dung dịch đệm sau đây dự kiến cho các giá trị hoạt độ EROD tương đương đối với hầu hết các loài cá.
Chuẩn bị hai dung dịch sau, A và B:
- Dung dịch A: hòa tan 17,4 g K2HPO4 (khối lượng phân tử tương đối là 174,2 ở dạng khan) trong 1 L nước (5.1);
- Dung dịch B: hòa tan 13,6 g KH2PO4 (khối lượng phân tử tương đối là 136,1 ở dạng khan) trong 1 L nước (5.1).
Chỉnh dung dịch A đến pH 7,8 ± 0,1 bằng dung dịch B.
Dung dịch này có thể ổn định 6 tháng ở nhiệt độ 4 °C ± 3 °C.
5.4 Glyxerol (20 %) trong dung dịch đệm phosphat
Cho một lượng 20 % glyxerol (C3H8O3; khối lượng phân tử tương đối 92,1) vào dung dịch đệm phosphat (5.3). Nồng độ cuối cùng là 20 % glyxerol và 100 mmol/L phosphat.
5.5 Dung dịch gốc resorufin (108 mg/L)
Hòa tan khoảng 10,8 mg resorufin (muối natri C12H6NNaO3; khối lượng phân tử tương đối 235,2) trong 100 mL dimetylsunfoxit (DMSO) ở nơi tối, lắc trong 2 h. Đọc mật độ quang ở bước sóng 572 nm trên máy quang phổ. Tính nồng độ resorufin chính xác, c, bằng milimol trên lít, sử dụng Công thức (1):
| (1) |
Trong đó:
D là mật độ quang (tương ứng với số bước sóng hấp thụ tính bằng cm-1);
ε là hệ số tắt phân tử (đối với resorufin, các giá trị ε= 73,2 (mmol/L)-1 cm-1 ở 572 nm (Tài liệu tham khảo [17]) và 54,0 ±1,1 (mmol/L)-1 cm-1 (Tài liệu tham khảo [36]) đã được báo cáo lại};
l là độ dài đường quang, tính bằng centimét.
Chuẩn bị dung dịch này tại thời điểm xác định và bảo quản các phần dung dịch này đông lạnh ở -20 °C và tránh ánh sáng. Các phần dịch này có thể bảo quản được 6 tháng.
CHÚ THÍCH: Resorufin rất không ổn định trong điều kiện ánh sáng ban ngày.
5.6 Dung dịch làm việc resorufin
Pha loãng dung dịch gốc (5.5) với DMSO để thu được khoảng 10 mL dung dịch làm việc 11,5 μmol/L. Chuẩn bị dung dịch này tại thời điểm xác định.
5.7 Dung dịch chuẩn Rhodamin B
Hòa tan 25 mg rhodamine B (C28H30N2O3; khối lượng phân tử tương đối là 442,55) trong 250 mL ete etylen glycol monometyl. Pha loãng dung dịch này với ete etylen glycol monometyl, sao cho thu được dung dịch chuẩn 0,1 µmol/L để bảo quản thành các phần thích hợp. Dung dịch này ổn định trong 6 tháng ở nơi tối và ở nhiệt độ 4 °C ± 3 °C.
5.8 Nicotinamit adenin dinucleotit phosphat (NADPH)
Đối với phương pháp vi đĩa, hòa tan 19,2 mg β-NADPH (C21H26N7Na4O17P3); khối lượng phân tử tương đối 833,35) trong 2 mL nước (5.1) để thu được nồng độ 10 mmol/L.
Chuẩn bị dung dịch này tại thời điểm xác định và tránh ánh sáng trong bể nước đá.
CHÚ THÍCH: Đối với phương pháp dùng cuvet (ống nghiệm), hòa tan 41,7 mg NADPH trong 1 mL nước (5.1) để thu được nồng độ 50 mmol/L.
5.9 Dung dịch gốc 7-Ethoxyresorufin
Chuẩn bị dung dịch gốc chứa 7-ethoxyresorufin (C12H6NaO3) đặc; khối lượng phân tử tương đối 235,17), ví dụ: 5 mg/mL trong DMSO. Bảo quản dung dịch này ở nơi tối với nhiệt độ phòng tối đa là 1 năm.
5.10 Dung dịch làm việc 7-ethoxyresorufin (46 µmol/L)
Đo nồng độ chính xác của dung dịch gốc (5.9) bằng phép đo quang phổ ở bước sóng 482 nm sử dụng Công thức (1). Ở bước sóng 482 nm, hệ số hấp thụ phân tử là 2,25 x 104 (mol/L)-1cm-1.
Pha loãng dung dịch gốc (5.9) bằng DMSO để thu được dung dịch làm việc 46 µmol/L để dùng cho phương pháp vi đĩa. Chuẩn bị dung dịch này tại thời điểm xác định.
CHÚ THÍCH: Dung dịch làm việc 400 μmol/L được sử dụng cho phương pháp dùng cuvet (ống nghiệm).
5.11 β-Naphthoflavone hòa tan trong dầu lạc
Để bơm một liều β-naphthoflavone (C19H12O2, khối lượng phân tử tương đối 272,3) vào cá theo khối lượng trên phần khối lượng cá là 50 mg/kg (bơm 10 μL dung dịch vào dầu cho mỗi gam cá), chuẩn bị dung dịch β-naphthoflavone trong dầu lạc với nồng độ 5 mg/mL Dung dịch này được lắc kỹ và gia nhiệt đến độ 45 °C ± 5 °C trong nồi cách thủy để cải thiện tính đồng nhất.
6 Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ thông thường của phòng thử nghiệm và các dụng cụ sau đây.
6.1 Ống đông lạnh.
6.2 Bình chứa niter lỏng hoặc tủ đông lạnh, đặt ở nhiệt độ dưới -70 °C.
6.3 Máy đo quang phổ huỳnh quang dùng cuvet hoặc vi đĩa, dùng cho đĩa 96 giếng.
CHÚ THÍCH: Việc sử dụng các vi đĩa màu trắng đục cho phép giảm đáng kể nhiễu nền huỳnh quang.
6.4 Máy ly tâm.
6.5 Máy đồng nhất, kiểu Potter Elvehjem hoặc loại tương đương.
6.6 Máy đo pH.
6.7 Máy đo quang phổ.
7 Lấy mẫu và chuẩn bị mẫu
7.1 Lấy mẫu cá
Việc lấy mẫu cần được thực hiện trong môi trường tự nhiên bằng cách đánh bắt cá hoặc trong phòng thử nghiệm trên cá đã tiếp xúc với các chất hoặc chất thải như được quy định trong TCVN 13915-1 (ISO 23893-1).
Lấy mẫu ít nhất 10 cá thể cá cùng loài, cùng giới tính và có kích thước đồng đều từ mỗi nhóm để kiểm tra hoạt tính EROD.
Không lấy mẫu vào mùa sinh sản vi môi trường sống của cá và các hoạt động sinh lý của chúng có thể bị thay đổi do hoạt động sinh dục.
Các yếu tố có khả năng ảnh hưởng đến hoạt tính EROD, phải được xác định và ghi lại trong báo cáo thử nghiệm:
a) Nhiệt độ nước;
b) Mô tả chung về tình trạng sức khỏe của từng cá thể cá (giới tính, chiều dài, khối lượng cơ thể, khối lượng gan, khối lượng tuyến sinh dục, các tổn thương bên ngoài và bên trong) điều này thường được báo cáo liên quan đến việc lấy mẫu như trong TCVN 13915-1 (ISO 23893-1).
Tùy thuộc vào mục tiêu của nghiên cứu, đảm bảo rằng cá đối chứng (từ địa điểm tham chiếu hoặc nhóm phòng thử nghiệm) được lấy từ môi trường có chất lượng sinh thái thỏa đáng. Xử lý cá đối chứng và các mẫu của chúng theo cách tương tự như xử lý cá từ các nhóm được kiểm tra hoặc xử lý thực nghiệm, trừ việc tiếp xúc với các chất quan tâm.
7.2 Giết cá và mổ cá
Sau khi đánh bắt hoặc khi kết thúc tiếp xúc, làm chết cá và mổ lấy gan khi vừa bắt cá ra khỏi nước như quy định trong TCVN 13915-1 (ISO 23893-1). Lấy mẫu một miếng nhỏ hơn 1 g từ cùng một phần gan của mỗi cá thể cá càng sớm càng tốt sau khi cá chết, cẩn thận để không để mật làm nhiễm bẩn gan khi mổ.
7.3 Bảo quản
Nếu không thể thực hiện phép xác định vào ngày lấy mẫu, thì các mẫu gan phải được đông lạnh ngay ở nhiệt độ dưới -70 °C, ví dụ bằng cách sử dụng nitơ lỏng hoặc đá khô. Các mẫu sau đó có thể được bảo quản trong 3 tháng trong nitơ lỏng hoặc ở nhiệt độ dưới -70 °C (6.2).
Nếu các phép đo EROD được thực hiện vào ngày lấy mẫu thì bước chuẩn bị (8.1) phải được bắt đầu trong vòng 1 h và các mẫu gan phải được bảo quản ở nhiệt độ dưới 4 °C.
8 Cách tiến hành
8.1 Chuẩn bị các phân đoạn
Trước khi tiến hành phép xác định, rửa mẫu gan trong dung dịch kali clorua (5.2) và sau đó đồng hóa mẫu trong 4 mL dung dịch đệm phosphat (5.3) bằng cách nghiền trong máy đồng nhất (6.5). Nếu sử dụng các mẫu gan nhỏ hơn (hoặc lớn hơn), thì nên giảm (hoặc tăng) thể tích dung dịch đệm để giữ cố định tỷ lệ gan trong dung dịch đệm là 1 g : 4 mL. Thực hiện việc tăng (hoặc giảm) thể tích dung dịch đệm ở nhiệt độ khoảng 4 °C bằng cách duy trì đệm phosphat ở nhiệt độ đó. Quá trình nghiền phải thực hiện trong vòng 0,5 min đến 2 min, các điều kiện và thời gian nghiền từng mẫu phải giống nhau.
Ly tâm các chất đồng nhất ở 10 000 g (khoảng 90 000 m/s2), ở nhiệt độ 4 °C ± 3 °C trong 10 min đến 20 min. Thu hồi chất lỏng nổi phía trên (phân đoạn S9) và bảo quản ở nhiệt độ 4 °C ± 3 °C. Tiến hành xác định enzym trong vòng 1 h sau khi thu hồi phần nỗi phía trên.
CHÚ THÍCH: Có thể làm đông lạnh nhanh các chất đồng nhất của gan trong các ống đông lạnh (6.1) đến nhiệt độ dưới -70 °C, sử dụng ví dụ như nitơ lỏng, trong các điều kiện nêu trong 7.3 với điều kiện là các mẫu gan (7.3) chưa được đông lạnh trước đó. Trong trường hợp đông lạnh trước, thì các mẫu gan phải được đồng nhất trước như ở trên, nhưng sử dụng glyxerol trong dung dịch đệm phosphat (5.4).
8.2 Xác định protein
Đối với từng phân đoạn S9, tiến hành xác định protein theo Tài liệu tham khảo [22] hoặc Tài liệu tham khảo [2], sử dụng các bộ kit thử nghiệm bán sẵn. Nồng độ của chất chuẩn protein [albumin huyết thanh bò (BSA)] phải được kiểm tra bằng máy đo quang phổ nếu sử dụng các chất chuẩn của phòng thử nghiệm.
8.3 Xác định hoạt tính EROD
8.3.1 Hiệu chuẩn
8.3.1.1 Tổng quát
Tiến hành hiệu chuẩn lấy dung dịch làm việc resorufin (5.6) hoặc dung dịch chuẩn rhodamin B (5.7) làm cơ sở. Huỳnh quang của rhodamine B cao gấp 1,2 lần so với huỳnh quang của resorufin ở nồng độ phân tử tương đương.
8.3.1.2 Hiệu chuẩn bằng resorufin
Độ tuyến tính của đường chuẩn phải được xác định; các mẫu cần được đo trong phần tuyến tính của đường chuẩn. Các mẫu có hoạt tính cao phải được pha loãng. Khoảng tuyến tính của đường chuẩn phụ thuộc vào thiết bị được sử dụng và việc cài đặt thiết bị.
Thiết lập dải này bằng cách pha loãng dung dịch làm việc resorufin (5.6) với DMSO ở các hệ số pha loãng sau: 1; 5; 10; 50 và 100.
Chuẩn bị hỗn hợp phản ứng theo 8.3.2.1, thay 7-ethoxyresorufin bằng resorufin và phân đoạn S9 bằng dung dịch protein (BSA hoặc dịch chiết protein của các loài cá được nghiên cứu). Nên sử dụng nồng độ protein giống nhất có thể với nồng độ của các phân đoạn S9 đang được phân tích.
Đo huỳnh quang theo 8.3.2.2. Huỳnh quang đo được tỷ lệ thuận với nồng độ resorufin. Đảm bảo rằng chỉ phần tuyến tính của đường chuẩn được sử dụng để định lượng.
8.3.1.3 Hiệu chuẩn bằng rhodamin B
Cho dung dịch chuẩn rhodamin B (5.7) vào cuvet hoặc vào 3 giếng của vi đĩa tùy thuộc vào máy đo phổ huỳnh quang (6.3) được sử dụng.
CHÚ THÍCH: Có tính đến hiệu chuẩn xen kẽ rhodamin B/resorufin (trong điều kiện hỗn hợp phản ứng), dung dịch rhodamin B được sử dụng làm chất chuẩn. Không cần phải thêm thuốc thử.
Đo huỳnh quang theo 8.3.2.2. Giá trị huỳnh quang thu được này chia cho 1,2 là bằng huỳnh quang của dung dịch resorufin có nồng độ 0,1 µmol/L.
8.3.2 Xác định
8.3.2.1 Chuẩn bị hỗn hợp phản ứng
Đối với mỗi phân đoạn S9, chuẩn bị hỗn hợp phản ứng bằng cách bổ sung các dung dịch nêu trong Bảng 1, luôn kết thúc bằng dung dịch NADPH, vào cuvet hoặc vi đĩa. Tạo ba lần lặp lại cho phương pháp vi đĩa và nếu có thể thực hiện cho cả phương pháp dùng cuvet.
Bảng 1 - Chuẩn bị hỗn hợp phản ứng
Dung dịch | Thể tích của dung dịch được đưa vào trong | Nồng độ dung dịch | Nồng độ cuối cùng trong hỗn hợp phản ứng | ||
Cuvet | Vi dĩa | Cuvet | Vi đĩa | ||
Dung dịch đệm phosphat (5.3) | 1,96 mL | 200 μL | 100 mmol/L | 100 mmol/L | Khoảng 100 mmol/L |
7-Ethoxyresorufin(5.10) | 10 μL | 10 μL | 400 μmol/L | 46 μmol/L | 2 μmol/L |
Phân đoạn S9 (8.1) | 20 μL | 10 μL | 5 mg đến 10 mg protein trên mL | 1,1 mg đến 2,3 mg protein trên mL | 50 μg đến 100 μg protein trên mL |
NADPH (5.8) | 20 μL | 11,5 μL | 50 mmol/L | 10 mmol/L | 0,5 mmol/L |
Ghi lại thời điểm thêm dung dịch NADPH (5.8) là thời điểm bắt đầu phản ứng enzym. Phản ứng có thể bắt đầu luôn hoặc sau 1 min đến 2 min tùy thuộc vào loài cá. Kết thúc ghi sau 2 min giai đoạn phản ứng. Tốc độ được xác định từ giai đoạn phản ứng, không bao gồm giai đoạn trễ.
Có thể trộn lượng cần thiết 7-ethoxyresofurin vào dung dịch đệm phosphat ở nồng độ cuối cùng mong muốn (2 µmol/L) trước khi cho vào cuvet hoặc các giếng của vi đĩa. Đối với hiệu chuẩn bằng resorufin (8.3.1.2), cũng có thể chuẩn bị lượng dung đệm phosphat cần thiết đã chứa sẵn dung dịch resorutin theo cách tương tự.
8.3.2.2 Đo huỳnh quang
Khi sử dụng máy đo phổ huỳnh quang đơn sắc (6.3), thì huỳnh quang được đo ở bước sóng cực đại của resorufin và khi sử dụng máy đo quang phổ huỳnh quang có bộ lọc (6.3), huỳnh quang được đo ở các bước sóng kích thích từ 530 nm đến 535 nm và bước sóng phát xạ từ 580 nm đến 590 nm.
Tính độ dốc của mức tăng huỳnh quang phụ thuộc vào thời gian tại một số điểm đo sử dụng hồi quy tuyến tính. Nếu máy đo phổ huỳnh quang không có chức năng này, thì tính độ dốc trên cơ sở điểm đầu và điểm cuối.
8.4 Kiểm tra độ nhạy của thuốc thử sinh học và sự phù hợp với phương pháp
Cần kiểm tra độ nhạy của lô cá được sử dụng trong phòng thử nghiệm (kiểm chứng dương) đối với mỗi lần thử nghiệm dải nồng độ chất hoặc nước thải, số lượng cá được gây mê bằng β-naphthoflavone (5.11) giống với số lượng được sử dụng trong các nhóm thử nghiệm khác (ít nhất là 10 cá thể). Thời gian tiếp xúc phải đủ để cho phép cảm ứng (ví dụ: 96 h).
Từng cá thể cá được cân và tiêm β-naphthoflavone vào màng bụng theo khối lượng của cá (ví dụ: 100 μL được tiêm vào cá thể cá nặng 10 g).
Đối với cá nhỏ, ví dụ như cá sọc vằn, có thể sử dụng nước tiếp xúc với các chất gây cảm ứng (β-naphthoflavone hòa tan trong DMSO và các chất thử nghiệm), thì tiếp xúc 48 h có thể đủ để gây cảm ứng.
Đối với liều tiêm 50 mg/kg, cá được tiêm (kiểm chứng dương) có thể gây cảm ứng EROD tương đối cao so với cá đối chứng (kiểm chứng âm) và cũng như so sánh với cảm ứng đo được bằng hầu hết các chất thử nghiệm và nước thải hoặc ở hầu hết các loài cá từ môi trường tự nhiên. Ví dụ, tốc độ cảm ứng (bằng hoạt độ trong cá được tiêm β-naphthoflavone chia cho hoạt độ trong cá kiểm chứng) thường ở khoảng 10 (và luôn cao hơn 3) đối với cá chép và trong khoảng 100 (và luôn cao hơn 30) đối với cá hồi (Tài liệu tham khảo [11]).
9 Biểu thị kết quả
9.1 Tính toán hoạt độ EROD
Đối với mỗi phân đoạn S9, tính đương lượng resorufin từ độ dốc huỳnh quang của mẫu. Độ dốc huỳnh quang này, tính bằng đơn vị huỳnh quang trên min, có liên quan đến dải nồng độ resorufin (8.3.1.2), bằng cách chia độ dốc cho hệ số tỷ lệ giữa huỳnh quang và resorufin hoặc liên quan đến chất chuẩn rhodamin B (8.3.1.3). Đối với mỗi phân đoạn S9, tính hoạt độ EROD, Aerod, bằng picomol trên min trên miligam protein, theo Công thức (2):
| (2) |
Trong đó:
R là đương lượng resorufin, tính bằng picomol trên microlit trên min hoặc nanomol trên microlit trên min, khi thích hợp;
Vr là tổng thể tích của hỗn hợp phản ứng, tính bằng microlit;
p là nồng độ của tổng số protein có trong phân đoạn S9, tính bằng miligam trên microlit;
VS9 là thể tích của phân đoạn S9 có trong hỗn hợp phản ứng, tính bằng microlit.
9.2 Xử lý thống kê dữ liệu
Trước tiên, kiểm tra độ phân bố chuẩn của cùng một lô (cùng trạm đánh bắt cá hoặc cùng nồng độ, cùng giới tính) và tính đồng nhất của các phương sai (ví dụ: bằng phép thử Levene).
Nếu dữ liệu gốc hoặc dữ liệu đã chuyển đổi không phân bố chuẩn hoặc không có phương sai đồng nhất, thì sử dụng các phép thử phi tham số (ví dụ: phép thử Mann và phép thử U Whitney).
Sau đó, kiểm tra sự khác biệt thống kê giữa các EROD của các lô khác nhau (phép thử ANOVA, f-Student), và đặc biệt là giữa lô tiếp xúc và lô kiểm soát trong phòng thử nghiệm hoặc môi trường tự nhiên (hiện trường).
Trình bày các kết quả ở dạng đồ thị và bảng (được cung cấp dưới dạng số học hoặc hình học cho các nhóm khác nhau và với khoảng tin cậy 95 %). Các ví dụ về kết quả của mẫu trong phòng thử nghiệm và mẫu môi trường tự nhiên (hiện trường) được nêu trong Phụ lục A.
10 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm ít nhất các thông tin sau:
a) Viện dẫn tiêu chuẩn này;
b) Ngày lấy mẫu, nhiệt độ nước, thông tin về trạm đánh bắt cá (môi trường tự nhiên) hoặc lô cá (phòng thử nghiệm), số lượng cá được lấy mẫu [như quy định trong TCVN 13915-1 (ISO 23893-1)];
c) Đối với từng loài cá: kích thước, khối lượng, giới tính, tỷ lệ tuyến sinh dục, tóm tắt chẩn đoán về tình trạng sức khỏe của cá [như quy định trong TCVN 13915-1 (ISO 23893-1)];
d) Đối với mỗi loài cá, hoạt độ EROD tính được theo 8.1;
e) Các giá trị thu được trên lô kiểm chứng âm (cá không bị tiếp xúc) và lô kiểm chứng dương (cá có EROD);
f) Tất cả các chi tiết thao tác không được quy định trong tiêu chuẩn này hoặc được coi là tùy chọn, cùng với các chi tiết bất thường có thể ảnh hưởng đến kết quả.
Phụ lục A
(Tham khảo)
Ví dụ về kết quả
A.1 Ví dụ về phòng thử nghiệm
Cá hồi vân (Oncorhynchus mykiss) còn nhỏ được tiếp xúc trong 96 h với nước thải đô thị nồng độ cao hoặc thấp. Để thu được kiểm chứng dương, một lô 10 cá thể cá hồi đã được tiêm β-naphthoflavone với liều 50 mg/kg. Dữ liệu thô được liệt kê trong Bảng A.1 và các biện pháp thống kê kết quả tổng hợp đối với các lô mẫu khác nhau được đưa ra trong Bảng A.2.
Bảng A.1 - Dữ liệu thô từ ví dụ phòng thử nghiệm
Mã | Lô | Kích thước mm | Cân nặng g | EROD pmol/(min-mg) protein |
Cá hồi 001 | Đối chứng âm | 86 | 7,9 | 11 |
Cá hồi 002 | Đối chứng âm | 93 | 9,8 | 8 |
Cá hồi 003 | Đối chứng âm | 90 | 9,4 | 7 |
Cá hồi 004 | Đối chứng âm | 90 | 10,4 | 13 |
Cá hồi 005 | Đối chứng âm | 102 | 12,8 | 9 |
Cá hồi 006 | Đối chứng âm | 100 | 11,6 | 10 |
Cá hồi 007 | Đối chứng âm | 100 | 12,7 | 9 |
Cá hồi 008 | Đối chứng âm | 90 | 9,8 | 6 |
Cá hồi 009 | Đối chứng âm | 91 | 8,6 | 5 |
Cá hồi 010 | Đối chứng âm | 84 | 7,5 | 10 |
Cá hồi 011 | Đối chứng dương | 98 | 12,1 | 205 |
Cá hồi 012 | Đối chứng dương | 110 | 17 | 779 |
Cá hồi 013 | Đối chứng dương | 92 | 9,7 | 285 |
Cá hồi 014 | Đối chứng dương | 112 | 15,3 | 820 |
Cá hồi 015 | Đối chứng dương | 105 | 13,7 | 730 |
Cá hồi 016 | Đối chứng dương | 92 | 9,2 | 530 |
Cá hồi 017 | Đối chứng dương | 98 | 10,8 | 616 |
Cá hồi 018 | Đối chứng dương | 98 | 11,5 | 542 |
Cá hồi 019 | Đối chứng dương | 93 | 11,7 | 347 |
Cá hồi 020 | Đối chứng dương | 104 | 15,3 | 412 |
Cá hồi 021 | 2 % thể tích nước thải | 100 | 11,7 | 8 |
Cá hồi 022 | 2 % thể tích nước thải | 96 | 10,2 | 7 |
Cá hồi 023 | 2 % thể tích nước thải | 102 | 12,3 | 10 |
Cá hồi 024 | 2 % thể tích nước thải | 90 | 8,2 | 15 |
Cá hồi 025 | 2 % thể tích nước thải | 82 | 6,7 | 15 |
Cá hồi 026 | 2 % thể tích nước thải | 92 | 9,7 | 14 |
Cá hồi 027 | 2 % thể tích nước thải | 96 | 10,5 | 7 |
Cá hồi 028 | 2 % thể tích nước thải | 92 | 9,8 | 6 |
Cá hồi 029 | 2 % thể tích nước thải | 78 | 6,2 | 9 |
Cá hồi 030 | 2 % thể tích nước thải | 92 | 10,4 | 9 |
Cá hồi 031 | 10 % thể tích nước thải | 100 | 12 | 39 |
Cá hồi 032 | 10 % thể tích nước thải | 92 | 9,7 | 26 |
Cá hồi 033 | 10 % thể tích nước thải | 84 | 7,8 | 37 |
Cá hồi 034 | 10 % thể tích nước thải | 100 | 12,5 | 26 |
Cá hồi 035 | 10 % thể tích nước thải | 87 | 8,1 | 27 |
Cá hồi 036 | 10 % thể tích nước thải | 110 | 14 | 40 |
Cá hồi 037 | 10 % thể tích nước thải | 94 | 9,8 | 27 |
Cá hồi 038 | 10 % thể tích nước thải | 92 | 9,5 | 22 |
Cá hồi 039 | 10 % thể tích nước thải | 95 | 9,7 | 77 |
Cá hồi 040 | 10 % thể tích nước thải | 102 | 12,7 | 25 |
Cá hồi 041 | 33 % thể tích nước thải | 98 | 11,1 | 77 |
Cá hồi 042 | 33 % thể tích nước thải | 86 | 7,9 | 68 |
Cá hồi 043 | 33 % thể tích nước thải | 98 | 10,1 | 42 |
Cá hồi 044 | 33 % thể tích nước thải | 92 | 8,7 | 83 |
Cá hồi 045 | 33 % thể tích nước thải | 87 | 7,3 | 51 |
Cá hồi 046 | 33 % thể tích nước thải | 94 | 9,5 | 80 |
Cá hồi 047 | 33 % thể tích nước thải | 102 | 11,7 | 103 |
Cá hồi 048 | 33 % thể tích nước thải | 94 | 9,6 | 46 |
Cá hồi 049 | 33 % thể tích nước thải | 82 | 6,3 | 51 |
Cá hồi 050 | 33 % thể tích nước thải | 87 | 7,3 | 68 |
Cá hồi 051 | 67 % thể tích nước thải | 95 | 10,2 | 77 |
Cá hồi 052 | 67 % thể tích nước thải | 87 | 8,4 | 59 |
Cá hồi 053 | 67 % thể tích nước thải | 86 | 7,9 | 65 |
Cá hồi 054 | 67 % thể tích nước thải | 105 | 14,6 | 102 |
Cá hồi 055 | 67 % thể tích nước thải | 95 | 10 | 72 |
Cá hồi 056 | 67 % thể tích nước thải | 102 | 12,9 | 49 |
Cá hồi 057 | 67 % thể tích nước thải | 92 | 9,8 | 119 |
Cá hồi 058 | 67 % thể tích nước thải | 104 | 13,2 | 69 |
Cá hồi 059 | 67 % thể tích nước thải | 87 | 7,6 | 96 |
Cá hồi 060 | 67 % thể tích nước thải | 100 | 11,3 | 62 |
Bảng A.2 - Các biện pháp thống kê dữ liệu của các lô khác nhau từ phòng thử nghiệm
Đơn vị | Số cá | Chiều dài thân (trung bình ± SD) mm | Khối lượng thân (trung bình ± SD) g | EROD (trung bình ± SD) pmol/(min.mg) protein | EROD trung bình cộng hình học (95 % khoảng tin cận CI95) pmol/(min.mg) protein |
Đối chứng âm | 10 | 93 ±6 | 10,1 ± 1,9 | 9 ± 2 | 8 (6, 11) |
Đối chứng dương | 10 | 100 ±7 | 12,6 ± 2,6 | 527 ± 13 | 488 (347, 672) |
2 % thể tích nước thải | 10 | 92 ± 7 | 9,6 ± 2,0 | 10 ± 3 | 9 (7,13) |
10 % thể tích nước thải | 10 | 96 ± 8 | 10,6 ± 2,1 | 35 ± 16 | 32 (24, 43) |
33 % thể tích nước thải | 10 | 92 ± 6 | 9,0 ± 1,8 | 67 ± 19 | 64 (51,79) |
67 % thể tích nước thải | 10 | 95 ± 7 | 10,6 ± 2,4 | 77 ± 22 | 74 (60, 91) |

CHÚ DẪN:
X Phần thể tích nước thải, %
Y EROD [pmol/(min.mg) protein] - Thang logarit
a Đối chứng âm
b Đối chứng dương
Hình A.1 - Đồ thị thể hiện các dữ liệu trong Bảng A.2
Sau khi chuyển đổi dữ liệu EROD sang logarit cơ số 10, phương sai là đồng nhất giữa các lô (phép thử Levene). (Xem Hình A.1).
Các hoạt độ EROD của các kiểm chứng dương lớn hơn đáng kể so với các hoạt độ của các mẫu (tỷ lệ cảm ứng giữa cả hai lô là 488/8 = 61).
Các hoạt độ EROD của cá trong lô tiếp xúc với 2 % thể tích nước thải không khác biệt đáng kể so với hoạt độ EROD của cá kiểm chứng (phép thử t-Student theo logarit cơ số 10 của dữ liệu cho p = 0,43 ).
Mặt khác, hoạt độ EROD của các lô khác lớn hơn đáng kể so với hoạt độ của cá của lô đối chứng (phép thử t-Student theo logarit cơ số 10 của dữ liệu cho p ≤ 0,01).
Do đó, nước thải được thử nghiệm gây ra hoạt độ EROD trong cá hồi từ nồng độ 10 % thể tích trong nước và trong thời gian tiếp xúc là 96 h.
A.2 Ví dụ về môi trường tự nhiên
Ví dụ về môi trường tự nhiên ở đây bao gồm so sánh các hoạt độ EROD được đo trong cá bơn (Limanda limanda) được lấy mẫu từ hai địa điểm biển tại vịnh Seine: một địa điểm hầu như không bị ô nhiễm và một địa điểm bị ô nhiễm. Dữ liệu thô được liệt kê trong Bảng A.3 và các biện pháp thống kê về kết quả tổng hợp đối với các lô khác nhau được đưa ra trong Bảng A.4.
Bảng A.3 - Dữ liệu thô từ ví dụ về môi trường tự nhiên
Mã | Lô | Chiều dài thân mm | EROD pmol/(min.mg) protein |
Cá Bơn 001 | Địa điểm hầu như không bị ô nhiễm | 265 | 58 |
Cá Bơn 002 | Địa điểm hầu như không bị ô nhiễm | 245 | 19 |
Cá Bơn 003 | Địa điểm hầu như không bị ô nhiễm | 235 | 49 |
Cá Bơn 004 | Địa điểm hầu như không bị ô nhiễm | 210 | 51 |
Cá Bơn 005 | Địa điểm hầu như không bị ô nhiễm | 240 | 31 |
Cá Bơn 006 | Địa điểm hầu như không bị ô nhiễm | 235 | 98 |
Cá Bơn 007 | Địa điểm hầu như không bị ô nhiễm | 235 | 27 |
Cá Bơn 008 | Địa điểm hầu như không bị ô nhiễm | 260 | 35 |
Cá Bơn 009 | Địa điểm hầu như không bị ô nhiễm | 230 | 25 |
Cá Bơn 010 | Địa điểm hầu như không bị ô nhiễm | 220 | 39 |
Cá Bơn 011 | Địa điểm bị ô nhiễm | 290 | 396 |
Cá Bơn 012 | Địa điểm bị ô nhiễm | 300 | 463 |
Cá Bơn 013 | Địa điểm bị ô nhiễm | 290 | 372 |
Cá Bơn 014 | Địa điểm bị ô nhiễm | 290 | 348 |
Cá Bơn 015 | Địa điểm bị ô nhiễm | 290 | 483 |
Cá Bơn 016 | Địa điểm bị ô nhiễm | 300 | 429 |
Cá Bơn 017 | Địa điểm bị ô nhiễm | 260 | 344 |
Cá Bơn 018 | Địa điểm bị ô nhiễm | 260 | 199 |
Cá Bơn 019 | Địa điểm bị ô nhiễm | 290 | 330 |
Cá Bơn 020 | Địa điểm bị ô nhiễm | 270 | 321 |
Bảng A.4 - Các biện pháp thống kê của các lô khác nhau từ ví dụ của môi trường tự nhiên
Đơn vị | Số cá | Chiều dài thân (trung bình ± SD) mm | EROD (trung bình ± SD) pmol/(min.mg) protein | EROD Trung bình nhân (95 % Khoảng tin cậy, CI95) pmol/(min.mg) protein |
Địa điểm hầu như không bị ô nhiễm | 10 | 238 ±17 | 43 ± 23 | 39 (27,55) |
Địa điểm bị ô nhiễm | 10 | 284 ± 15 | 369 ± 82 | 358 (298,446) |
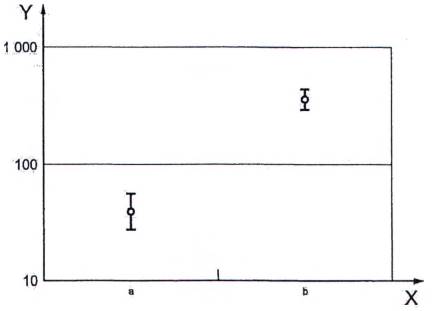
CHÚ DẪN:
X Đơn vị
Y EROD [pmol/(min.mg) protein] - Thang logarit
a Đối chứng âm
b Đối chứng dương
Hình A.2 - Đồ thị thể hiện các dữ liệu của Bảng A.4
Sau khi chuyển đổi dữ liệu EROD sang logarit cơ số 10, các phương sai là đồng nhất giữa các lô (phép thử Levene). (Xem Hình A.2.)
Các hoạt độ EROD của cá được lấy mẫu từ địa điểm bị ô nhiễm lớn hơn đáng kể (phép thử t-Student theo logarit cơ số 10 của dữ liệu cho p < 0,01) so với hoạt độ của cá được lấy mẫu từ địa điểm ít bị ô nhiễm (tỷ lệ cảm ứng giữa hai lô là 358/39 = 9,2).
Thư mục tài liệu tham khảo
[1] BELIAEFF, B., BURGEOT, T. Sampling design optimization for EROD measurement in fish. Mar. Ecol. Prog. Ser., 1997, 153, pp. 239-46
[2] Bradford, M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem., 1976, 72, pp. 248-54
[3] BUCHELI, T.D., FENT, K. Induction of cytochrome P450 as a biomarker for environmental contamination in aquatic ecosystems. Crit. Rev. Environ. Sci. Technol., 1995, 25, pp. 201-68
[4] BURGEOT, T. L'ethoxyresorufine-O-deethylase, les adduits à I'ADN et les micronuclei dans les organismes marins: Application à la surveillance des effets biologiques sur les côtes franpaises [Ethoxyresorufin-O-deethylase, DNA adducts and micronuclei in marine organisms: Application to biological effects monitoring along French coasts]. Doctoral Thesis, Nantes University, 1994, 253 p.
[5] BURGEOT, T., BOCQUENÉ, G., Truquet, P., LE DÉAN, F., GALGANI, F. Induction of EROD activity in red mullet (Mullus barbatus) along the French Mediterranean coasts. Sci. Total Environ., 1994, 142, pp. 213-20
[6] BURGEOT, T., BOCQUENÉ, G., PINGRAY, G., GODEFROY, D., LEGRAND, J., DIMEET, J., MARCO, F., VINCENT, F., HENOCQUE, Y., OGER, J.H., GALGANI, F. Monitoring biological effects of contamination in marine fish along French coasts by measurement of ethoxyresorufin-O-deethylase activity. Ecotoxicol. Environ. Saf., 1994, 29, pp. 131-47
[7] BURGEOT, T., BOCQUENÉ, G., TRUQUET, P., LE DÉAN, F., POULARD, J.C., DOREL, D., SOUPLET, A., GALGANI, F. The dragonet Callionymus lyra, a target species used for evaluation of biological effects of chemical contaminants on French coasts. Mar. Ecol. Prog. Ser., 1993, 97, pp. 309-16
[8] BURGEOT, T., MÉNARD, D., Mesure de I'activité enzymatique: Ethoxyrésoruíine-O-dééthylase (EROD) Chez les poissons marins [Measurement of enzyme activity: Ethoxyresorufine-O- deethylase (EROD) in marine fish]. Editions Ifremer, Plouzane, France, 2004. 28 p. (Méthodes d'analyse en milieu marin, No. 7.)
[9] BURKE, M.D., MAYER, R.T. Ethoxyresorufin: Direct fluorimetric assay of a microsomal O-dealkylation which is preferentially inducible by 3-methylcholanthrene. Drug Metab. Dispos., 1974, 2, pp. 583-8
[10] DAVIES, J.M., BELL, J.S., HOUGHTON, C. A comparison of the levels of hepatic aryl hydrocarbon hydroxylase in fish caught close to distant from North sea oil fields. Mar. Environ. Res., 1984,14, pp. 23-45
[11] FLAMMARION, P. Mesure in situ de I'induction du cytochrome P450 1A Chez des cyprinidés d’eau douce: Optimisation de I'interprétation [In situ induction of cytochrome P450 1A in freshwater cyprinids: Assessment optimisation]. Thesis, Metz University, 1997, 107 p.
[12] FLAMMARION, P., GARRIC, J. A statistical approach for classifying the extent of EROD induction of fish sampled in clean and contaminated waters. Water Res., 1999, 33, pp. 2683-9
[13] FLAMMARION, P., GARRIC, J., MONOD, G. Utilisation de I'activite enzymatique EROD Chez les poissons des hydrosystèmes continentaux [EROD enzyme activity use in fish from continental hydrosystems]. In: Lagadic, L, Caquet, T., Amiard, J.C., Ramade, F., editors. Utilisation de biomarqueurs pour la surveillance de la qualité de I'environnement [Biomarker use for environmental quality monitoring], pp. 57-75. Lavoisier Tec & Doc, Paris, 1998
[14] FLAMMARION, P., MIGEON, B., GARRIC, J. Statistical analysis of cyprinids: EROD data in a large French watershed. Ecotoxicol. Environ. Saf. Sec. B: Environ. Res., 1998, 40, pp. 144-53
[15] GALGANI, F., BOCQUENÉ, G., LUCON, M., Grzebyk, D., Letrouit, F., Claisse, D. EROD measurements in fish from the Northwest part of France. Mar. Pollut. Bull., 1991, 22, pp. 494-500
[16] GALGANI, F., PAYNE, J.F. Biological effects of contaminants: Microplate method for measurement of EROD activity in fish. International Council for Exploration of the Sea, Copenhagen, 1991, 11 p. (ICES Techniques in Marine Environmental Sciences, No. 13.)
[17] GOKSØYR, A., FÖrlin, L. The cytochrome P-450 system in fish, aquatic toxicology and environmental monitoring. Aquat. Toxicol., 1992, 22, pp. 287-312
[18] HODSON, P.V., KLOEPPER-SAMS, P.J., MUNKITTRICK, K.R, Lockhart, W.L., Metner, D.A., LUXON, P.L,
LUXON, P.L., SMITH, I.R., GAGNON, M.M., SERVOS, M., PAYNE, J.F. Protocols for measuring mixed function oxygenases of fish liver. Mont-Joli, Québec: Fisheries and Oceans Canada, 1991. 49 p. (Canadian Technical Report of Fisheries and Aquatic Sciences, 1829.) Also available (2007-10-30) at: www.dfo-mpo.gc.ca/Library/125000.pdf. ©1991 Minister of Supply and Services Canada
[19] Klotz, A.V., Stegeman, J.J., Walsch, C. An aryl hydrocarbon hydroxylating hepatic cytochrome P-450 from the marine fish Stenotomus chrysops. Arch. Biochem. Biophys., 1983, 226, pp. 578-92
[20] LAFAURIE, M., GIUDICELLI, J, CARRIERE, S, LEMAIRE, P, MATHIEU, A., NÈGRE, Y. Pollutant biotransformation in marine teleost fish: Use in environmental health evaluation. In: Advances in applied biotechnology, Vol. 5: Impacts on human health and the environment, pp. 141-52. Gulf, Houston, TX, 1989
[21] LINDSTROM-SEPPA, P., OIKARI, A. Hepatic xenobiotic bio-transformation in fishes exposed to pulpmill effluents. Water Sci. Technol., 1988, 20, pp. 167-70
[22] LOWRY, O.H., ROSEBROUGH, N.J., FARR, A.L., RANDALL, R.J. Protein measurement with the Folin phenol reagent. J. Biol. Chem., 1951, 193, pp. 265-75
[23] MINCHIN, A., MCINTOSH, A.D., Davies, I.M. Bequalm workshop on P4501A1 activity in fish: Report on the training workshop. FRS MLA Report N° 03/02, Fisheries Research Services, Aberdeen, 2002
[24] Monod, G. Les biomarqueurs d'exposition. In: Les variables biologiques: Des indicateurs de I'etat de santé des écosystèmes aquatiques [Biological variables: Some indicators of the state of health of aquatic ecosystems], pp. 145-8. Ministère de I’Environnement, Paris, 1997
[25] Monod, G., Devaux, a., Riviere, J.L. Effects of chemical pollution on the activities of hepatic xenobiotic metabolizing enzymes in fish from the river Rhône. Sci. Total Environ., 1988, 73, pp. 189-201
[26] Narbonne, J.F., Garrigues, P., Ribera, D., Raoux, C., Mathieu, A., Lemaire, P., Salaun, J.P., Lafaurie, M. Mixed-function oxygenase enzymes as tools for pollution monitoring: Field studies on the French coast of the Mediterranean Sea. Comp. Biochem. Physiol, C, 1991,100, pp. 37-42
[27] PAYNE, J.F., FANCEY, L.L., RAHIMTULA, A.D., PORTER, E.L. Review and perspective on the use of mixed-function oxygenase enzymes in biological monitoring. Comp. Biochem. Physiol, C, 1987, 86, pp. 233-45
[28] Payne, J.F., Penrose, W.R. Induction of aryl hydrocarbon (benzo[a]pyrene) hydroxylase in fish by petroleum. Bull. Environ. Contam. Toxicol., 1975,14, p. 1126
[29] PLUTA, H.-J. International intercalibration and preliminary ICES standard protocol for measuring EROD activity in fish liver, Z. Angew. Zool., 1995, 81, pp. 85-111
[30] POHL, R.J., FOUTS, J.R. A rapid method for assaying the metabolism of 7-ethoxyresorufin by microsomal subcellular fractions. Anal. Biochem., 1980,107, pp. 150-5
[31] STAGG, R.M., ADDISON, R.F. An inter-laboratory comparison of measurements of ethoxyresorufin-O-deethylase activity in dab (Limanda limanda) liver. Mar. Environ. Res., 1995, 40, pp. 93-108
[32] STAGG, R., MCINTOSH, A. Biological effects of contaminants: Determination of CYP1 A-dependent mono-oxygenase activity in dab by fluorimetric measurement of EROD activity. International Council for Exploration of the Sea, Copenhagen, 1998, 16 p. (ICES Techniques in Marine Environmental Sciences, No. 23.)
[33] STEGEMAN, J.J., HAHN, M.E. Biochemistry and molecular biology of monooxygenases: Current perspectives on forms, functions, and regulation of cytochrome P450 in aquatic species. In: Malins, D.C., Ostrander, G.K. editors. Aquatic toxicology: Molecular, biochemical and cellular perspectives, pp. 87-206. Lewis, Boca Raton, FL, 1994
[34] STEGEMAN, J.J., TENG, F.Y., SNOWBERGER, E.A. Induced cytochrome P450 in winter flounder (Pseudopleuronectes americanus) from coastal Massachusetts evaluated by catalytic assay and monoclonal antibody probes. Can. J. Fish. Aquat. Sci., 1987, 44, pp. 1270-7
[35] STEGEMAN, J.J., BROUWER, M., DI GIULIO, R.T., FORLIN, L, FOWLER, B.A., SANDERS, B.M., VAN VELD, P.A. Molecular responses to environmental contamination: Enzyme and protein systems as indicators of contaminant exposure and effect. In: Huggett, R.J., Kimerle, R.A., Mehrle, P.M., BERGMAN, H.L., editors. Biomarkers: Biochemical, physiological, and histological markers of anthropogenic stress, pp. 35-335. Lewis, Boca Raton, FL, 1992
[36] VAN DEN HEUVEL, M.R., MUNKITTRICK, K.R., STEGEMAN, J.J., DIXON, D.G. Second-round interlaboratory comparison of hepatic ethoxyresorufin-O-deethylase activity in white sucker (Catostomus commersoni) exposed to bleached-kraft pulp mill effluent. Environ. Toxicol. Chem., 1995, 14, pp. 1513-120
[37] VIARENGO, A., LAFAURIE, M., GABRIELIDES, G.P., Fabbri, R., MARRO, A., ROMÉO, M. Critical evaluation of an intercalibration exercise undertaken in the framework of the MED POL biomonitoring program. Mar. Environ. Res., 2000, 49, pp. 1-18
[38] VINDIMIAN, E., GARRIC, J. Bio-essais et bio-indicateurs de toxicité dans le milieu naturel [Bioassays and toxicity bioindicators in the natural medium], Ministère de I'Environnement, Paris, 1993, 53 p. (Étude inter-agences, No. 17.)
[39] VINDIMIAN, E., NAMOUR, P., MIGEON, P., GARRIC, J. In situ pollution induced cytochrome P450 activity of freshwater fish: Barbel (Barbus barbus), chub (Leuciscus cephalus) and nase (Chondrostoma nasus). Aquat. Toxicol., 1991,21, pp. 255-66
[40] MONOD, G. L'induction du cytochrome P4501A Chez les poissons. In: Lagadie, L., Caquet, T., Amiard, J.-C., Ramade, F., editors. Biomarqueurs en écotoxicologie: Aspects fondamentaux [Biomarkers in ecotoxicology: Fundamentals], pp. 33-54. Masson, Paris, 1997
[41] STIEN, X., RISSO, C., GNASSIA-BARELLI, M., ROMÉO, M., Lafaurie, M. Effect of copper chloride in vitro and in vivo on the hepatic EROD activity in the fish Dicentrarchus labrax. Environ. Toxicol. Chem., 1997, 16, pp. 214-9


 Tiếng Anh
Tiếng Anh Pháp lý doanh nghiệp
Pháp lý doanh nghiệp 
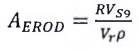
 Tiêu chuẩn Việt Nam TCVN 13915-2:2023 PDF
Tiêu chuẩn Việt Nam TCVN 13915-2:2023 PDF Tiêu chuẩn Việt Nam TCVN 13915-2:2023 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 13915-2:2023 DOC (Bản Word)
