- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 8026-7:2021 ISO 13408-7:2012 Quá trình vô khuẩn sản phẩm chăm sóc sức khỏe - Phần 7: Quá trình thay thế cho thiết bị y tế và các sản phẩm kết hợp
| Số hiệu: | TCVN 8026-7:2021 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Y tế-Sức khỏe |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
31/12/2021 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 8026-7:2021
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 8026-7:2021
TIÊU CHUẨN QUỐC GIA
TCVN 8026-7:2021
ISO 13408-7:2012
QUÁ TRÌNH VÔ KHUẨN SẢN PHẨM CHĂM SÓC SỨC KHỎE -
PHẦN 7: QUÁ TRÌNH THAY THẾ CHO THIẾT BỊ Y TẾ
VÀ CÁC SẢN PHẨM KẾT HỢP
Aseptic processing of health care products -
Part 7: Alternative proceses for medical devices and combination products
Mục lục
Lời nói đầu
Lời giới thiệu
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Thuật ngữ và định nghĩa
4 Các yếu tố chất lượng hệ thống
5 Định nghĩa quá trình vô khuẩn
6 Môi trường sản xuất
7 Thiết bị
8 Nhân viên
9 Sản xuất các sản phẩm
10 Mô phỏng quá trình
11 Kiểm tra vô khuẩn
Phụ lục A (tham khảo) - Đánh giá rủi ro quá trình vô khuẩn - Phương pháp quản lý rủi ro chất lượng
Thư mục tài liệu tham khảo
Lời nói đầu
TCVN 8026-7:2021 hoàn toàn tương đương với ISO 13408-7:2012.
TCVN 8026-7:2021 do Viện Trang thiết bị và Công trình y tế biên soạn, Bộ Y tế đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ tiêu chuẩn TCVN 8026 (ISO 13408) Quá trình vô khuẩn sản phẩm chăm sóc sức khỏe, gồm các tiêu chuẩn sau:
- TCVN 8026-1:2010 (ISO 13408-1:2008) Phần 1: Yêu cầu chung
- TCVN 8026-2:2013 (ISO 13408-2:2003) Phần 2: Sự lọc
- TCVN 8026-3:2009 (ISO 13408-3:2006) Phần 3: Sự đông khô
- TCVN 8026-4:2009 (ISO 13408-4:2005) Phần 4: Công nghệ làm sạch tại chỗ
- TCVN 8026-5:2009 (ISO 13408-5:2006) Phần 5: Tiệt khuẩn tại chỗ
- TCVN 8026-6:2013 (ISO 13408-6:2005) Phần 6: Hệ thống phân tách.
- TCVN 8026-7:2021 (ISO 13408-7:2012) Phần 7: Quá trình thay thế cho thiết bị y tế và các sân phẩm kết hợp.
Lời giới thiệu
TCVN 8026 (ISO 13408) là các tiêu chuẩn được công bố ở một loạt các phần cho việc xử lý vô khuẩn sản phẩm chăm sóc sức khỏe. Trong lịch sử, các sản phẩm chăm sóc sức khỏe vô khuẩn được sản xuất vô khuẩn thường là các chất lỏng, bột hoặc dịch treo mà không thể tiệt khuẩn lần cuối. Gần đây hơn, các thiết bị y tế và các sản phẩm chăm sóc sức khỏe đã được phát triển kết hợp với các sản phẩm thuốc, bao gồm cả các tế bào sinh học và tế bào sống mà không thể được tiệt khuẩn lần cuối.
Việc áp dụng các TCVN 8026-1 (ISO 13408-1) cho các thiết bị y tế và các sản phẩm kết hợp có thể đòi hỏi sự phát triển của các phương cách xử lý mô phỏng. Tiêu chuẩn này nêu rõ yêu cầu và cung cấp hướng dẫn cho việc phát triển các phương pháp thay thế như vậy đối với tiêu chuẩn của các quá trình vô khuẩn thông qua quá trình mô phỏng thiết bị y tế và các sản phẩm kết hợp đáp ứng các yêu cầu của TCVN 8026-1 (ISO 13408-1).
TCVN 8026-1 (ISO 13408-1), 10.1.2 cho phép sử dụng phương pháp mô phỏng quá trình thay thế, dựa trên các thiết bị y tế đặc biệt hoặc các sản phẩm kết hợp, nơi mà sự thay thế đầy đủ với môi trường lỏng vô khuẩn có thể không khả thi.
Thiết bị y tế và các sản phẩm kết hợp thông thường cần xử lý vô khuẩn có thể bao gồm, ví dụ, sau đây.
a) thiết bị y tế không thể tiệt khuẩn lần cuối nơi mà các phương pháp mô phỏng quá trình theo tiêu chuẩn TCVN 8026-1 (ISO 13408-1) không thể áp dụng:
- vật cấy ghép có nguồn gốc sinh học (ví dụ: van tim, vật cấy ghép mạch máu);
- vật cấy ghép có phân hủy sinh học (ví dụ: lưới thoát vị);
- vật liệu nền sinh học nhân tạo và/hoặc không có khả năng sống;
- thiết bị xử lý ngoài cơ thể (ví dụ thiết bị hấp phụ miễn dịch);
- bơm thẫm tháu có thể cấy ghép;
- các thiết bị điện cơ kín toàn phần và các thiết bị điện tử kín từng phần (ví dụ các thiết bị chẩn đoán xâm lấn và không xâm lấn).
b) các sản phẩm kết hợp (bao gồm các sản phẩm kết hợp dựa trên tế bào sống):
- các thiết bị cấy ghép được phủ thuốc và/hoặc các vật liệu có nguồn gốc sinh học (ví dụ stent phủ thuốc, vật liệu mang có protein, vật liệu ghép xương có yếu tố tăng trưởng, stent phủ thuốc có thể phân hủy sinh học);
- băng gạc vết thương (ví dụ: băng vết thương bằng chất cầm máu, chất bịt kín mô, hoặc chất sinh học);
- hệ thống phân phối bằng cách thẩm thấu qua da hoặc tiêm (ví dụ miếng dán kẽ mô sinh học hoặc phủ thuốc);
- dụng cụ có chứa thành phần sinh học hoặc thuốc (ví dụ: chất nền xương đã được khử khoáng).
Đối với các sản phẩm như vậy, một chiến lược quản lý rủi ro và phương pháp có thể được sử dụng cho việc xác định, đánh giá và định lượng (ước tính) của nguy cơ ô nhiễm trong suốt toàn bộ vòng đời sản phẩm/quy trình. Giám sát môi trường và nghiên cứu vi sinh vật có thể được thực hiện trên từng bước riêng của quá trình để đánh giá hiệu quả của kiểm soát ô nhiễm và giảm thiểu tác động rủi ro. Các thiết kế của mô phỏng quá trình sau đó có thể được điều khiển bởi các kết quả phân tích rủi ro. Nếu kết quả của các mô phỏng quá trình là chấp nhận được, điều này cung cấp bằng chứng cho thấy quá trình vô khuẩn trong tình trạng kiểm soát ô nhiễm (tức là không có nhiễm khuẩn / vi sinh vật bên ngoài đã được giới thiệu trong quá trình vô trùng).
Tiêu chuẩn này cần được đọc đồng thời với TCVN 8026-1 (ISO 13408-1).
Trong tiêu chuẩn này, TCVN 8026-1 (ISO 13408-1) cung cấp các yêu cầu bổ sung hoặc hướng dẫn được xác định bởi các tiền tố “Bổ sung”.
QUÁ TRÌNH VÔ KHUẨN SẢN PHẨM CHĂM SÓC SỨC KHỎE -
PHẦN 7: QUÁ TRÌNH THAY THẾ CHO THIẾT BỊ Y TẾ
VÀ CÁC SẢN PHẨM KẾT HỢP
Aseptic processing of health care products -
Part 7: Alternative proceses for medical devices and combination products
1 Phạm vi áp dụng
Tiêu chuẩn này quy định các yêu cầu và cung cấp hướng dẫn về các phương pháp tiếp cận thay thế để mô phỏng quá trình nhằm đánh giá chất lượng của quá trình vô khuẩn đối với thiết bị y tế và các sản phẩm kết hợp không thể được tiệt khuẩn lần cuối và không thể áp dụng phương pháp tiếp cận mô phỏng quá trình theo TCVN 8026-1 (ISO 13408-1).
Tiêu chuẩn này mô tả cách thức đánh giá rủi ro có thể được sử dụng trong quá trình phát triển của một quá trình vô khuẩn để thiết kế một nghiên cứu quá trình mô phỏng cho các thiết bị y tế và các sản phẩm kết hợp trong trường hợp thay thế đơn giản của phương tiện trung gian cho sản phẩm trong quá trình vô khuẩn là không khả thi hoặc sẽ không mô phỏng được các quá trình vô khuẩn thực tế.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 8026-1:2010 (ISO 13408-1:2008) Quá trình vô khuẩn sản phẩm chăm sóc sức khỏe - Phần 1: Yêu cầu chung.
3 Thuật ngữ và định nghĩa
Tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa trong TCVN 8026-1 (ISO 13408-1) và các thuật ngữ, định nghĩa sau:
3.1
Nhiễm bẩn bên ngoài (extrinsic contamination)
Sự xâm nhập của vật liệu có nguồn gốc bên ngoài trong quá trình sản xuất
CHÚ THÍCH: Trọng tâm của nhiễm bẩn bên ngoài trong tiêu chuẩn này là các tác nhân sinh học, ví dụ: vi khuẩn, nấm mốc, nấm men.
3.2
Mô phỏng quá trình (process simulation)
Thực hiện việc mô phỏng quá trình sản xuất hoặc các phần của quá trình này để chứng minh khả năng của quá trình vô trùng trong việc ngăn ngừa ô nhiễm sinh học
3.3
Quản lý rủi ro (risk management)
Ứng dụng hệ thống các chính sách quản lý chất lượng, các thủ tục và thực hành với nhiệm vụ phân tích, đánh giá, kiểm soát và giám sát rủi ro
3.4
Sản phẩm thay thế (surrogate product)
Sản phẩm được thiết kế để mô tả cho sản phẩm trong các mô phỏng quá trình và được so sánh với các sản phẩm thực tế
4 Các yếu tố chất lượng hệ thống
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 4.
5 Định nghĩa quá trình vô khuẩn
5.1 Quy định chung
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 5.1.
5.2 Quản lý rủi ro
5.2.1 Quy định chung
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 5.2.1 với các yêu cầu bổ sung sau:
a) Đánh giá rủi ro sẽ xem xét tất cả các bước của quá trình vô khuẩn và xác định quá trình vô khuẩn được mô phỏng trong một quá trình liên tục hay chia thành các quy trình con cho các mục đích của mô phỏng quá trình.
Đánh giá rủi ro sẽ không được sử dụng để xác minh cho việc mô phỏng một vài quá trình nhưng cũng không phải cho tất cả các quá trình của một quá trình vô khuẩn.
CHÚ THÍCH 1 Mô phỏng quá trình thành công cung cấp bằng chứng về khả năng của quá trình vô khuẩn để tạo ra rủi ro ô nhiễm vi sinh vật/vi khuẩn còn lại tổng thể có thể chấp nhận được.
CHÚ THÍCH 2 Phương pháp đánh giá rủi ro được lựa chọn nên phù hợp với các giai đoạn phát triển của quá trình vô khuẩn.
b) Quá trình đánh giá rủi ro toàn diện có thể không được yêu cầu cho việc thiết kế mô phỏng quá trình trong trường hợp mà phương pháp này có thể dễ dàng nhận thấy. Những lý do căn bản để đưa ra quyết định sẽ được dẫn chứng bằng tư liệu.
5.2.2 Xác định các nguy cơ ô nhiễm vi sinh
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 5.2.2.
5.2.3 Đánh giá nguy cơ ô nhiễm
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 5.2.3.
5.2.4 Giám sát và phát hiện ô nhiễm
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 5.2.4.
5.2.5 Phòng chống ô nhiễm
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 5.2.5.
Áp dụng các yêu cầu bổ sung sau đây liên quan đến quản lý rủi ro cho TCVN 8026-1 (ISO 13408-1), 5.2.
5.2.6 Sử dụng đánh giá rủi ro trong quá trình phát triển và đánh giá năng lực ban đầu của quá trình vô khuẩn trước khi sản xuất thương mại
5.2.6.1 Mức độ rủi ro ô nhiễm có thể chấp nhận sẽ được định rõ. Đánh giá rủi ro được thực hiện trong sự phát triển của quá trình vô khuẩn. Các biện pháp kiểm soát rủi ro để ngăn chặn nhiễm vi sinh/nhiễm khuẩn cho mỗi bước trong quá trình vô khuẩn sẽ được xác định.
5.2.6.2 Ước tính rủi ro ô nhiễm bằng phương pháp định lượng và việc xác minh tính hiệu quả của các phương pháp giảm thiểu rủi ro được xác định. Các phương pháp như giám sát vi sinh vật và các hạt của sản phẩm, giám sát nhân viên và môi trường có thể được sử dụng.
CHÚ THÍCH: Mô hình rủi ro định lượng cũng có thể được áp dụng.
5.2.6.3 Kết quả của việc đánh giá rủi ro được sử dụng trong các thiết kế của nghiên cứu quá trình mô phỏng.
5.2.6.4 Quản lý rủi ro được áp dụng lặp đi lặp lại. Đánh giá rủi ro sẽ được cập nhật cũng cần thiết như quá trình vô khuẩn phát triển và thay đổi trong quá trình phát triển.
5.2.7 Sử dụng đánh giá rủi ro đối với mô phỏng quá trình vô khuẩn để xác nhận quá trình sản xuất thương mại.
Đánh giá rủi ro được sử dụng để thiết kế mô phỏng quá trình để xác nhận quá trình vô khuẩn thương mại. Đánh giá rủi ro xác định những hành động được bao gồm trong mô phỏng quá trình và sự phù hợp của chúng.
CHÚ THÍCH: Phụ lục A cung cấp một ứng dụng thực tế của quản lý rủi ro trong việc thiết kế một mô phỏng quá trình cho sự kết hợp thuốc/thiết bị.
6 Môi trường sản xuất
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 6.
7 Thiết bị
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 7.
8 Nhân viên
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 8.
9 Sản xuất các sản phẩm
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 9.
10 Mô phỏng quá trình
10.1 Quy định chung
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 10.1.
10.2 Lựa chọn môi trường và hỗ trợ tăng trưởng
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 10.2.
10.3 Quy trình mô phỏng
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 10.3.1 với các yêu cầu bổ sung sau:
a) Cân nhắc chung
Cách tiếp cận mô phỏng quá trình cho một thiết bị y tế hoặc sản phẩm kết hợp dựa trên kiến thức chi tiết của toàn bộ định nghĩa quá trình vô khuẩn bao gồm các bước quá trình riêng biệt và các can thiệp cũng như việc sử dụng các công cụ đánh giá rủi ro thích hợp (xem 5.2.6 và 5.2.7). Cách tiếp cận mô phỏng quá trình sẽ được bao gồm trong việc xem xét thiết kế/quá trình cho việc sản xuất các sản phẩm.
b) Sự phát triển của chiến lược mô phỏng quá trình:
1) Chiến lược mô phỏng quá trình được ghi nhận cho một quá trình không thể được xác nhận sử dụng cách tiếp cận mô phỏng quá trình thông thường theo TCVN 8026-1 (ISO 13408-1). CHÚ THÍCH Xem Hình 1 ví dụ về sự phát triển của một nghiên cứu mô phỏng quá trình.
2) Nếu cách tiếp cận quá trình mô phỏng được nêu trong TCVN 8026-1 (ISO 13408-1) không thực tế, lý do căn bản được ghi nhận bao gồm bằng chứng cho thấy việc xem xét được đưa ra trong suốt sự phát triển sản phẩm và quá trình để:
- sử dụng môi trường chất lỏng vô trùng như là một thay thế cho sản phẩm trong mô phỏng quá trình, hoặc
- tiếp xúc môi trường trực tiếp vào cuối quá trình, nghĩa là vào hệ thống rào cản vô trùng trước khi đóng cửa cuối cùng.
3) Toàn bộ định nghĩa quá trình vô khuẩn phải được bao gồm trong chiến lược mô phỏng quá trình. Nếu quá trình vô khuẩn được chia thành các quá trình con cho các mục đích của mô phỏng quá trình, mô phỏng quá trình cho mỗi quá trình con trong tổng thể bao gồm tất cả các bước trong quá trình vô khuẩn.
4) Đánh giá rủi ro sẽ là một phần trong chu kỳ quá trình vô khuẩn và được sử dụng để xác định chiến lược mô phỏng quá trình trong suốt vòng đời của sản phẩm hoặc chu kỳ của quá trình.
5) Tùy chọn mô phỏng sẽ được lựa chọn và chiến lược mô phỏng quá trình cho toàn bộ quá trình sẽ được ghi lại.
c) Quy trình mô phỏng trong suốt vòng đời sản phẩm:
1) Phương pháp mô phỏng quá trình ban đầu sẽ được thành lập trong suốt sự phát triển của quá trình vô khuẩn và mô phỏng quá trình đầu tiên sẽ được thực hiện trước khi sản xuất các sản phẩm lâm sàng đầu tiên trong con người để xác định các điều kiện xử lý vô khuẩn có thể chấp nhận.
2) Khi quá trình vô khuẩn được mở rộng và nâng cao cho các giai đoạn sau của sản xuất lâm sàng, phương pháp mô phỏng quá trình phải được sửa đổi để giải quyết các quá trình vô khuẩn thay đổi.
CHÚ THÍCH: Quá trình vô khuẩn dùng cho sản xuất lâm sàng sớm thường là thủ công và/hoặc không được tối ưu hóa hoặc mở rộng quy mô sản xuất thương mại.
3) Đối với sản xuất thương mại, nghiên cứu mô phỏng quá trình được thiết kế và thực hiện như một phần của quá trình hợp thức hóa.
4) Bất kỳ thay đổi nào với quá trình vô khuẩn mà có thể đưa thêm rủi ro sẽ phát sinh đánh giá rủi ro bổ sung và giảm thiểu và một tái đánh giá chiến lược mô phỏng quá trình. Điều này sẽ bao gồm một đánh giá lại các đánh giá rủi ro quá trình.
d) Lựa chọn mẫu để thử nghiệm nhiễm khuẩn:
1) Sản phẩm:
Bất cứ khi nào có thể, sản phẩm phải được kiểm tra về ô nhiễm vi sinh. Kiểm tra sản phẩm có thể có nhiều hình thức. Xem Phụ lục B để biết thêm thông tin.
Nếu các sản phẩm như thiết kế không thể được kiểm tra thì trước khi xem xét việc sử dụng một sản phẩm thay thế, khả năng thiết kế lại sản phẩm hoặc quy trình mà sản phẩm thực tế được thử nghiệm cần được đánh giá.
2) Sản phẩm thay thế:
Một sản phẩm thay thế chỉ là đại diện cho sản phẩm thực tế nếu nó tạo thành một thách thức tương đương hoặc lớn hơn để duy trì sự vô khuẩn so với sản phẩm thực tế. Lý do tại sao sản phẩm thực tế là không phù hợp để thử nghiệm phải được ghi chép lại và lý do cho việc lựa chọn các mẫu kiểm nghiệm sản phẩm thay thế được đưa ra.
Sản phẩm thay thế có thể được sử dụng để thử nghiệm vi sinh nơi mà các thuộc tính sản phẩm loại trừ việc sử dụng các sản phẩm thực tế để thử nghiệm. Ví dụ về các thuộc tính sản phẩm bao gồm:
- có hình dạng quá lớn hoặc bất thường (ví dụ: bơm thẩm thấu);
- có các đặc tính kháng khuẩn (ví dụ: stent kháng sinh);
- hiếm và khan hiếm (ví dụ: tế bào sụn tự thân);
- gây ra các trở ngại vật lý với phương pháp thử nghiệm (ví dụ: sản phẩm bị hỏng trong môi trường phát triển tạo hạt có thể bị nhầm lẫn với sự tăng trưởng của vi sinh vật).
Lựa chọn và thiết kế các sản phẩm thay thế phải phản ánh càng nhiều càng tốt thiết kế của sản phẩm thực tế. Quy trình sản phẩm thay thế sẽ bao gồm tất cả các bước xử lý vô khuẩn và sự can thiệp áp dụng trong sản xuất các sản phẩm thực tế. Xem hướng dẫn ở Phụ lục B
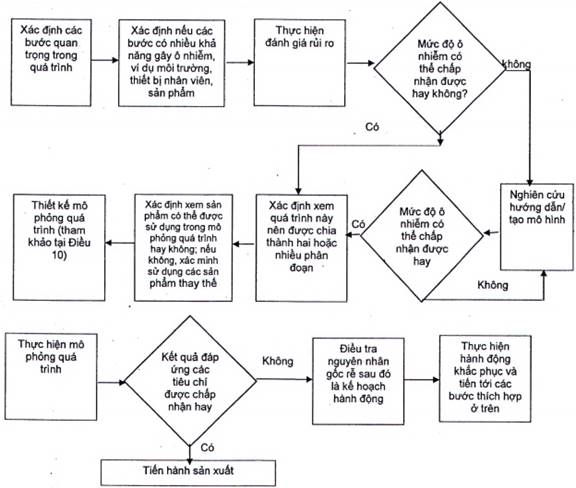
Hình 1- Biểu đồ dòng của quá trình đánh giá rủi ro
e) Các phương pháp thử nghiệm mô phỏng quá trình:
Nguy cơ ô nhiễm do sự can thiệp của con người tồn tại ở tất cả thử nghiệm ô nhiễm vi sinh vật. Việc lựa chọn các phương pháp thử nghiệm xem xét cả tính nhạy của các thử nghiệm cũng như số lượng các can thiệp hoặc thao tác. Đánh giá rủi ro thực hiện trong quá trình thiết kế nghiên cứu mô phỏng quá trình (5.2.6.3) sẽ hướng đến những rủi ro của việc giới thiệu ô nhiễm trong quá trình thử nghiệm và xác định các bước làm giảm khả năng nhiễm bẩn bên ngoài.
Phương pháp thử nghiệm được thiết kế hoặc lựa chọn dựa trên sản phẩm được thử nghiệm (sản phẩm thực tế hoặc sản phẩm thay thế). Sự phát triển phương pháp thử nghiệm bao gồm việc xem xét các tùy chọn kiểm tra phù hợp (xem Phụ lục C). Phương pháp thử nghiệm cần được phê chuẩn.
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 10.3.2 đến 10.3.6.
10.4 Sự bảo quản và kiểm tra các đơn vị mô phỏng quá trình
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 10.4.
10.5 Đánh giá hiệu suất ban đầu
10.5.1 Yêu cầu chung
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 10.5.1.
10.5.2 Số lượng được thực hiện
Áp dụng TCVN 8026 1 (ISO 13408-1), Điều 10.5.2.1 với các yêu cầu bổ sung sau:
a) Đối với các hoạt động sản xuất theo lô ít hơn 5000 đơn vị, số lượng các đơn vị mô phỏng quá trình được sản xuất phải ít nhất bằng kích thước theo lô tối đa.
b) Tất cả các đơn vị sản xuất cho mô phỏng quá trình sẽ được kiểm tra nhiễm khuẩn (xem TCVN 8026-1 (ISO 13408-1), Điều 10.4.2).
c) Nếu mô phỏng quá trình được chia thành các tập hợp con thì số lượng các đơn vị được kiểm tra trong mỗi tập hợp con sẽ được xác minh. Ít nhất ba mô phỏng thành công liên tiếp sẽ được thực hiện cho mỗi tập con riêng biệt của quá trình vô khuẩn. Tất cả các đơn vị được thực hiện từ mỗi tập con sẽ được kiểm tra có ô nhiễm vi sinh vật hay không.
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 10.5.2.2.
10.5.3 Tiêu chí được chấp nhận
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 10.5.3.1.
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 10.5.3.2 với các yêu cầu bổ sung sau đây:
Khi mô phỏng quá trình vô khuẩn được chia thành các tập con, tất cả các tập con có các đơn vị không ô nhiễm cho các mô phỏng quá trình được phê duyệt. Nếu một quá trình con đơn của mô phỏng thất bại, một cuộc điều tra đưa ra các dẫn chứng được thực hiện để xác định nguyên nhân gốc rễ của sự thất bại. Nếu nguyên nhân gốc rễ cho sự thất bại có thể được xác định thì nguyên nhân đó phải được sửa chữa trước khi đánh giá lại khả năng. Trong trường hợp một nguyên nhân gốc rễ rõ ràng không thể được xác định thì việc xem xét lại quá trình và thiết kế của mô phỏng quá trình và các thay đổi được thực hiện. Sau khi thực hiện việc sửa chữa khắc phục, ba bài thử nghiệm mô phỏng liên tiếp của tập hợp con đó phải được thực hiện mà có các đơn vị không ô nhiễm cho mô phỏng để được chấp thuận.
10.6 Đánh giá lại hiệu suất định kỳ
10.6.1 Các yêu cầu lập danh mục
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 10.6.1.
10.6.2 Số lượng được thực hiện
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 10.6.2 với các yêu cầu bổ sung sau đây:
Đối với các hoạt động sản xuất theo lô ít hơn 5000 đơn vị, số lượng các đơn vị mô phỏng quá trình được sản xuất phải ít nhất bằng kích thước theo lô tối đa.
10.6.3 Tiêu chí được chấp nhận
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 10.6.3.
10.7 Lặp lại đánh giá hiệu suất ban đầu
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 10.7.
10.8 Tài liệu về mô phỏng quá trình
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 10.8.
10.9 Sắp xếp sản phẩm được thực hiện
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 10.9.
11 Kiểm tra vô khuẩn
Đối với sản phẩm mà một thử nghiệm vô khuẩn theo Dược điển châu Âu, Mỹ và Nhật Bản không được áp dụng, một chế độ kiểm tra thay thế sẽ được thành lập và xác minh. Tham khảo Phụ lục B để được hướng dẫn thêm.
11.1 Quy định chung
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 11.1 với các yêu cầu bổ sung sau đây:
Trường hợp sản phẩm có chứa tế bào sống được hiển thị để can thiệp vào thử nghiệm nhiễm khuẩn thì một phương pháp thử nghiệm thay thế phù hợp để kiểm soát vi sinh của sản phẩm hoàn thành sẽ được phát triển. Phương pháp thử nghiệm này sẽ được chứng minh ít nhất tương đương với thử nghiệm nhiễm khuẩn về độ nhạy và khả năng phát hiện các vi sinh vật ở phạm vi rộng hơn.
CHÚ THÍCH Các phương pháp thử nghiệm thay thế bao gồm các phương pháp vi sinh nhanh và phương pháp kiểm tra dựa trên sự không phát triển .Ví dụ về dược điển bao gồm Ph.Eur[10], JP[11], và USP[12]
11.2 Nghiên cứu các đơn vị tích cực từ các kiểm tra vô khuẩn
Áp dụng TCVN 8026-1 (ISO 13408-1), Điều 11.2.
Phụ lục A
(tham khảo)
Đánh giá rủi ro quá trình vô khuẩn - Phương pháp quản lý rủi ro chất lượng
A.1 Yêu cầu chung
Phụ lục này cung cấp một ứng dụng thực tế của các khái niệm trình bày TCVN 8026 (ISO 13408). Phân tích tác động và hình thức sai lỗi (FMEA) được chọn làm cơ sở cho phương pháp này bởi vì nó là một trong những phương pháp hoạt động tốt với đánh giá và ra quyết định cần thiết cho quá trình vô khuẩn.
Ví dụ sau đây sử dụng phương pháp FMEA [với hệ số rủi ro theo thứ tự ưu tiên (RPN)] có chứa nội dung được lựa chọn để minh họa các khái niệm được giới thiệu trước đây. Đây là một tình huống giả định. Việc xếp hạng rủi ro và tính điểm RPN chỉ được trình bày là ví dụ. Để biết thêm chi tiết xem TCVN 8023 (ISO 14971).
A.2 Cơ sở
Nghiên cứu trường hợp này tập trung vào việc sản xuất vô khuẩn theo quy chuẩn của một thiết bị được phủ kháng sinh mà sau đó được đóng gói đầu tiên. Trong thiết kế ban đầu của quá trình của sản phẩm cho các nghiên cứu lâm sàng, các thao tác được thực hiện bằng tay, dẫn đến rất nhiều sự xâm nhập vào môi trường phòng sạch (xem Hình A.1). Số lượng các can thiệp càng lớn, thì nguy cơ ô nhiễm nguồn càng lớn.
Với việc tối ưu hóa các quá trình sản xuất vô khuẩn trong sản xuất thương mại, quá trình FMEA được xem xét lại để xác minh rằng giảm thiểu tác động dẫn đến giảm nguy cơ ô nhiễm đến mức chấp nhận được (xem Hình A.2 và Bảng A.1).
A.3 Xác định hệ số rủi ro theo thứ tự ưu tiên
Cách tiếp cận bán định lượng được sử dụng để đánh giá nguy cơ ô nhiễm bằng cách xếp hạng mức độ nghiêm trọng, số lần xuất hiện và sự phát hiện trên thang điểm số từ 1 đến 10. RPN được tính bằng cách nhân mức độ nghiêm trọng x số lần xuất hiện x sự phát hiện. Các sự kiện không mong muốn là sự ô nhiễm của sản phẩm.
Trong ví dụ này, mức độ nghiêm trọng đã được gán một giá trị là 10. số lần xuất hiện rất khó để định lượng các can thiệp. Tuy nhiên, phương pháp này đòi hỏi dữ liệu đề xác minh số lần xuất hiện (1 là một khả năng ô nhiễm thấp, và 10 là khả năng ô nhiễm cao nhất). Trong phương pháp này khả năng không phát hiện được nhiễm khuẩn là rất cao; sự phát hiện được gán giá trị là 8 đến 10 (giả định giám sát môi trường và kiểm tra ô nhiễm vi sinh vật bên ngoài cung cấp một số mức độ phát hiện).
A.4 Đánh giá rủi ro
Đánh giá ban đầu cho thấy rằng việc sử dụng quá trình bọc phủ và đóng gói thủ công đòi hỏi nhiều can thiệp của con người và đặt ra một nguy cơ ô nhiễm vốn đã cao (xem hình A.1).
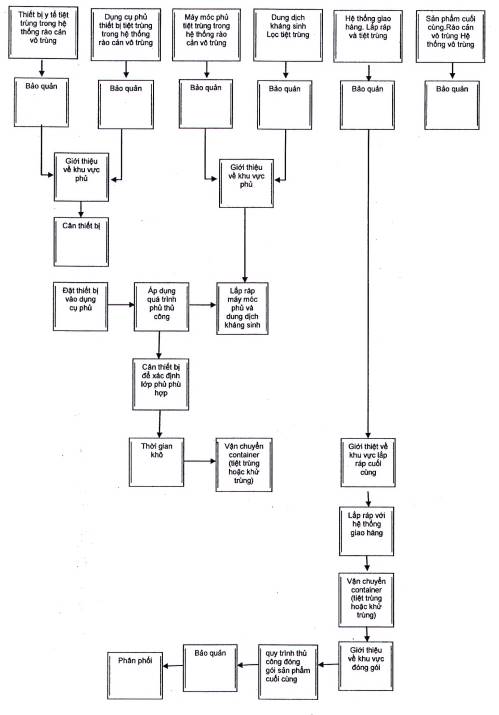
Từ khóa:
![]() Hộp biểu thị sự tương tác của con người và môi trường với các sản phẩm / thành phần có thể tác động tiêu cực đến sản phẩm.
Hộp biểu thị sự tương tác của con người và môi trường với các sản phẩm / thành phần có thể tác động tiêu cực đến sản phẩm.
![]() Hộp biểu thị sự tương tác môi trường với sản phẩm / thành phần có thể tác động tiêu cực đến sản phẩm
Hộp biểu thị sự tương tác môi trường với sản phẩm / thành phần có thể tác động tiêu cực đến sản phẩm
![]() Hộp biểu thị các bước mà có rất ít hoặc không có tác động tiêu cực lên sản phẩm
Hộp biểu thị các bước mà có rất ít hoặc không có tác động tiêu cực lên sản phẩm
Hình A.1 Biểu đồ quá trình ban đầu
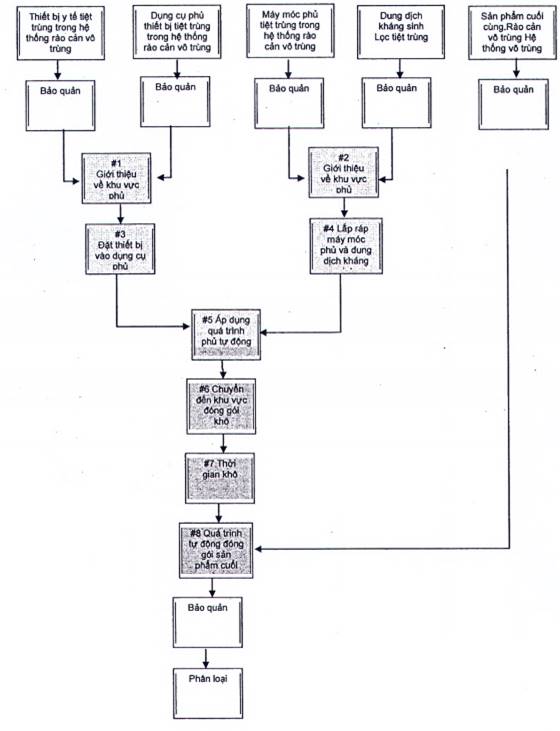
![]() Hộp biểu thị các bước trong FMEA
Hộp biểu thị các bước trong FMEA
![]() Hộp biểu thị sự tương tác của con người và môi trường với các sản phẩm / thành phần có thể tác động tiêu cực đến sản phẩm.
Hộp biểu thị sự tương tác của con người và môi trường với các sản phẩm / thành phần có thể tác động tiêu cực đến sản phẩm.
![]() Hộp biểu thị sự tương tác môi trường với sản phẩm / thành phần có thể tác động tiêu cực đến sản phẩm
Hộp biểu thị sự tương tác môi trường với sản phẩm / thành phần có thể tác động tiêu cực đến sản phẩm
![]() Hộp biểu thị các bước mà có rất ít hoặc không có tác động tiêu cực lên sản phẩm
Hộp biểu thị các bước mà có rất ít hoặc không có tác động tiêu cực lên sản phẩm
Hình A.2 - Biểu đồ dòng quá trình theo sau quá trình tối ưu
Bảng A.1 Bảng dự án - Phân tích tác động và hình thức sai lỗi
| Bước quá trình (quá trình ban đầu) | Hình thức sai lỗi | SEV | Nguyên nhân tiềm tàng/ cơ chế sai lỗi | OCC | Kiểm soát quá trình hiện tại (quá trình tối ưu hóa) | DET | RPN | Hoạt động nên làm | Ngày có trách nhiệm và hoàn thành | Kết quả hoạt động và xác minh tính hiệu quả | SEV | OCC | DET | RPN |
| Các bước quá trình từ biểu đồ dòng chảy quá trình ban đầu (thủ công) (xem Hình A.1) | Bằng cách nào quá trình thất bại trong việc đáp ứng yêu cầu của quá trình và/ hoặc mục đích thiết kế | Mức độ ảnh hưởng nghiêm trọng như thế nào đối với khách hàng? | Sai lỗi xảy ra như thế nào? Mô tả cái mà có thể sửa chữa hoặc kiểm soát. Phải thật cụ thể. Cố gắng tìm ra nguyên nhân gây ảnh hưởng trực tiếp đến hình thức sai lỗi, tức là nguyên nhân gốc rễ | Tần suất nguyên nhân hoặc hình thức sai lỗi xảy ra? | Các kiểm soát và thủ tục hiện tại (điều tra và thử nghiệm) có thể ngăn chặn hình thức sai lỗi xảy ra hoặc phat hiện hình thức sai lỗi là gì? Nên bao gồm số SOP | Khả năng có thể phát hiện nguyên nhân hoặc hình thức sai lỗi như thế nào? | SEV x OCC x DET | Hoạt động nào để giảm thiểu sự xảy ra hoặc cải thiện khả năng phát hiện hoặc nhận biết nguyên nhân gốc rễ? Các hoạt động có nên chỉ có RPN cao hoặc dễ dàng thay đổi không? | Ai chịu trách nhiệm cho các hoạt động được thực hiện? | Liệt kê các hoạt động đã hoàn thành bao gồm trong việc tính toán lại RPN. Ghi lại ngày thực hiện hoạt động với bất kỳ thay đổi nào | Tính nghiêm trọng mới là gì? | Khả năng quá trình mới là gì? | Hạn chế về sự phát hiện đã được cải thiện hay chứa? | Tính toán lại RPN sau khi hoàn thành các hoạt động |
| Chuyển vật liệu sang khu vực quá trình vô khuẩn | Sản phẩm nhiễm khuẩn | 10 | Người vận hành hoặc ô nhiễm bề mặt | 1 |
| 10 | 100 | Điểm A, bọc 3 lần, đào tạo |
|
|
|
|
|
|
| Di chuyển thiết bị y tế 1 lần từ khay và đặt vào cột trụ cá nhân(10) | Sản phẩm nhiễm khuẩn | 10 | Người vận hành làm nhiễm khuẩn một hoặc nhiều thiết bị y tế trong quá trình di chuyển nắp khay | 1 |
| 10 | 100 | Môi trường loại A và sử dụng kẹp tiệt trùng và khay cầm tay để di chuyển khay; đào tạo; dữ liệu EM thể hiện không có nhiễm khuẩn ở bề mặt khay hoặc thiết bị |
|
|
|
|
|
|
| Di chuyển thiết bị y tế 1 lần từ khay và đặt vào cột trụ cá nhân(10) | Sản phẩm nhiễm khuẩn | 10 | Người vận hành làm nhiễm khuẩn một hoặc nhiều thiết bị y tế trong quá trình di chuyển 10 thiết bị từ khay đến cột trụ | 5 | Đào tạo và xác định vị trí thiết bị trong tủ tiệt trùng | 10 | 500 | Môi trường loại A và sử dụng kẹp tiệt trùng và khay cầm tay để di chuyển khay; đào tạo |
| tiến hành nghiên cứu mô phỏng vi sinh để xác minh quy trình không gây ô nhiễm; Làm cho tất cả những người vận hành có đủ chuyên môn | 10 | 1 | 10 | 100 |
| Lắp ráp máy phủ và gắn vào bồn chứa kháng sinh | Sản phẩm nhiễm khuẩn | 10 | Người vận hành làm nhiễm khuẩn bề mặt nghiêm trọng trong khu vực phủ | 3 | Đào tạo và xác định vị trí thiết bị trong tủ tiệt trùng | 10 | 300 | Môi trường loại A và sử dụng dụng cụ tiệt trùng và găng tay; đào tạo |
| tiến hành nghiên cứu mô phỏng vi sinh để xác minh quy trình không gây ô nhiễm; Làm cho tất cả những người vận hành có đủ chuyên môn | 10 | 1 | 10 | 100 |
| Lắp ráp máy phủ và gắn vào bồn chứa kháng sinh | Sản phẩm nhiễm khuẩn | 10 | Người vận hành làm nhiễm khuẩn bề mặt nghiêm trọng trong khu vực phủ | 7 | Đào tạo và xác định vị trí thiết bị trong tủ tiệt trùng | 10 | 700 | Môi trường loại A vả sử dụng dụng cụ tiệt trùng và găng tay; đào tạo |
| tiến hành nghiên cứu mô phỏng vi sinh để xác minh quy trình không gây ô nhiễm; Làm cho tất cả những người vận hành có đủ chuyên môn | 10 | 1 | 10 | 100 |
| Phủ từng thiết bị trên cột trụ (quá trình tự động sử dụng vòi phun và cột trụ quay) | Sản phẩm nhiễm khuẩn | 10 | ô nhiễm mới trường | 1 |
| 10 | 100 | Môi trường loại A; quá trình tự động |
|
|
|
|
| 0 |
| Chuyển đến đơn vị RBS đóng gói khô liền kề bằng băng chuyền | Sản phẩm nhiễm khuẩn | 10 | Người vận hành làm nhiễm khuẩn sản phẩm | 1 |
| 10 | 100 | Chuyển vào môi trường loại A, sử dụng hệ thống băng chuyền vào đơn vị RABS |
|
|
|
|
| 0 |
| Cho phép 30 phút khô không khí | Sản phẩm nhiễm khuẩn | 10 | Ô nhiễm môi trường | 1 |
| 10 | 100 | Đơn vị RABS |
|
|
|
|
| 0 |
| sử dụng thiết bị cơ khí, di chuyển thiết bị từ cột trụ và đặt vào túi trước khi tiệt trùng và đóng kín | Sản phẩm nhiễm khuẩn | 10 | ô nhiễm môi trường | 1 |
| 10 | 100 | Đơn vị RABS, kiểm soát máy móc |
|
|
|
|
| 0 |
|
|
|
|
|
|
|
| 0 |
|
|
|
|
|
| 0 |
| Tổng hệ số rủi ro theo thứ tự ưu tiên= | 100-700 |
| “Sau” hệ số rủi ro theo thứ tự ưu tiên= | 100 | ||||||||||
A.5 Chấp nhận rủi ro
Đối với các mục đích của việc đánh giá này, sự chấp nhận rủi ro ban đầu với RPN là 100 được đặt ra là giá trị chấp nhận rủi ro mục tiêu. Một giá trị RPN lớn hơn 100 sẽ kích hoạt một hành động phòng ngừa (giảm thiểu) để giảm RPN đến 100 hoặc thấp hơn. Giá trị chấp nhận này được đánh giá lại định kỳ để tiếp tục làm giảm nguy cơ nhiễm khuẩn/vi sinh vật trong quá trình vô khuẩn.
A.6 Giảm thiểu rủi ro
Các phương tiện có thể giảm thiểu rủi ro được xác định. Điều này bao gồm quá trình phủ tự động, định vị các quá trình đóng gói và sấy khô trong hệ thống rào cản bị giới hạn truy cập (RABS), vv
CHÚ THÍCH: Có rất nhiều lựa chọn để giải quyết vấn đề ô nhiễm. Các tùy chọn này được chọn để minh họa việc sử dụng các phương pháp một cách đơn giản.
Một đánh giá các rủi ro liên quan đến quá trình vô khuẩn ban đầu (Hình A.1) và quá trình tối ưu hóa (Hình A.2) được trình bày trong Bảng A.1. Các tác động của từng giảm nhẹ trong quá trình tối ưu hóa được đánh giá thông qua giám sát vi sinh vật và các nghiên cứu về ô nhiễm, mà kết quả là RPN chấp nhận được bằng 100 hoặc nhỏ hơn.
A.7 Xác nhận khả năng chấp nhận của rủi ro còn lại tổng thể
Một giao thức nghiên cứu mô phỏng quá trình được thiết kế để kết hợp những yếu tố nguy cơ gây ô nhiễm (nguyên nhân thất bại tiềm tàng) mô tả trong quá trình FMEA (Bảng A.1) và toàn bộ quá trình vô khuẩn để xác minh rằng rủi ro còn lại tổng thể là chấp nhận được (không có sản phẩm bị ô nhiễm).
A.8 Các thông số quá trình quan trọng
Sau đây là các thông số quá trình quan trọng cho ví dụ này của sản phẩm kết hợp/thiết bị y tế kết hợp:
a) Quá trình sản xuất đã được thiết kế để sản xuất vô khuẩn tối đa 300 đơn vị sản phẩm hoàn thành (30 khay của 10 thiết bị và kháng sinh đủ để phủ 300 đơn vị theo thông số kỹ thuật);
b) Tổng thời gian quá trình là khoảng 3 đến 4 h (một ca);
c) Giám sát môi trường thực hiện trong quá trình nghiên cứu mô phỏng quá trình dựa một phần vào FMEA, nghĩa là tất cả các khu vực có nguy cơ cao được theo dõi liên tục trong suốt quá trình vô khuẩn. Những người điều hành quá trình vô khuẩn thực hiện giám sát môi trường và nhân viên;
d) Tối đa bốn người điều hành quá trình võ khuẩn được phép ở trong khu vực xử lý vô khuẩn (APA) cùng một lúc (thường là, hai người điều hành trong APA). Một người điều hành thực hiện xử lý vô khuẩn từ bước 1-5, và người điều hành thứ hai thực hiện xử lý vô khuẩn từ bước 6-8 (sau Hình A.2). Tổng cộng có bốn người điều hành đủ điều kiện để thực hiện tất cả các bước xử lý vô khuẩn.
A.9 Thiết kế mô phỏng quá trình
A.9.1 Mô phỏng quá trình của quá trình vô khuẩn ban đầu (phương pháp thủ công)
A.9.1.1 Kích thước sản xuất tối đa đối với sản xuất ban đầu cho các nghiên cứu lâm sàng là 20 đơn vị. Do đó mô phỏng quá trình ban đầu được thiết kế gồm một loạt 20 đơn vị của một sản phẩm thay thế (các thiết bị từ chối và giải pháp kháng sinh giả dược). Các đơn vị được kiểm tra nhiễm vi sinh vật bằng cách ngâm trực tiếp vào môi trường phát triển vi sinh.
CHÚ THÍCH: Giải pháp kháng sinh giả dược được sử dụng như một sản phẩm thay thế để mà thử nghiệm ô nhiễm vi sinh của sản phẩm cuối cùng bằng cách ngâm trực tiếp có thể được sử dụng (xem thêm B.2.3). A.9.1.2 Mỗi bước xử lý và can thiệp của chúng được thực hiện vào mô phỏng này. Trong ví dụ này, các mô phỏng quá trình bao gồm tất cả các can thiệp quá trình được xác định trong quá trình FMEA.
A.9.2 Mô phỏng quá trình cho quá trình vô khuẩn tối ưu hóa
A.9.2.1 Mô phỏng quá trình được thiết kế gồm ba loại của 300 đơn vị của một sản phẩm thay thế (các thiết bị chối từ và giải pháp kháng sinh giả dược). Mỗi bước xử lý và can thiệp của chúng được thực hiện vào mô phỏng này. Trong ví dụ này mô phỏng quá trình bao gồm các yếu tố sau:
a) bốn người điều hành quá trình vô khuẩn trong APA;
b) thay đổi 1 người ở giữa quá trình vô khuẩn;
c) quá trình 4 h;
d) tất cả các can thiệp quá trình được xác định trong quá trình FMEA.
A.9.2.2 Các đơn vị được kiểm tra nhiễm vi sinh vật bằng cách ngâm trực tiếp vào môi trường phát triển vi sinh
A.10 Tiêu chí chấp nhận
Mô phỏng quá trình được xem xét là chấp nhận được khi có những đơn vị không bị ô nhiễm từ các thử nghiệm nhiễm khuẩn.
Phụ lục B
(tham khảo)
Lựa chọn mẫu để thử nghiệm nhiễm khuẩn
B.1 Sản phẩm thực tế
Thử nghiệm các sản phẩm thực tế có thể gồm các hình thức sau đây.
a) Toàn bộ sản phẩm: Toàn bộ sản phẩm được thử nghiệm sự ô nhiễm vi sinh/vi khuẩn;
b) Một phần hoặc tiểu bộ sản phẩm (phần hàng mẫu): nếu sản phẩm quá lớn hoặc hình dạng bất thường, nó có thể được cắt thành miếng hoặc tháo rời cho mục đích thử nghiệm;
c) Đường dẫn chất lỏng: nếu chỉ đường dẫn chất lỏng là không bị nhiễm khuẩn thì kiểm tra đường dẫn chất lỏng là thích hợp;
d) Mặt ngoài: dùng cho các sản phẩm hàn kín, ví dụ như các thiết bị y tế nơi bề mặt tiếp xúc của thiết bị được khẳng định là vô khuẩn, chỉ xét nghiệm bề mặt bên ngoài là thích hợp.
B.2 Sản phẩm thay thế
B.2.1 Một sản phẩm thay thế có thể là:
a) đại diện của sản phẩm thực tế về vật liệu và kích thước;
b) một thành phần hoặc sự kết hợp của các thành phần từ sản phẩm thực tế.
B.2.2 Đối với sản phẩm quá lớn hoặc hình dạng bất thường để ngâm, sản phẩm có thể được chia thành các bộ phận hoặc tháo rời. Nếu quá trình chia nhỏ bộ phận hoặc tháo rời các sân phẩm có thể mang lại rủi ro ô nhiễm không ở mức chấp nhận được thì cần xem xét sử dụng một sản phẩm thay thế. Ngoài ra, có thể xử lý vô khuẩn các sản phẩm thay thế mà không cần kết nối đầy đủ hoặc gắn các phần lại với nhau để các sản phẩm chưa được lắp ráp có thể được kiểm tra mà không cần thao tác.
B.2.3 Đối với các sản phẩm có đặc tính kháng khuẩn, xác định xem nó có thể khắc phục các đặc tính kháng khuẩn hay không (ví dụ trung hòa, tăng phương tiện trung gian với tỷ lệ sản phẩm, lọc). Nếu các đặc tính kháng khuẩn không thể khắc phục, cần xem xét việc sử dụng một sản phẩm thay thế mà không chứa tác nhân kháng khuẩn (ví dụ như giả dược hoặc vật liệu trơ).
B.2.4 Đối với sản phẩm gây trở ngại với các thử nghiệm vi sinh, cần xác định xem phương pháp thử nghiệm được thiết kế có khắc phục được trở ngại đó hay không. Ví dụ, nếu ma trận sản phẩm làm cho môi trường phát triển bị đục, sự nuôi cấy cấp 2 có thể được thực hiện (xem dược điển hoặc ISO 11737-2 để được hướng dẫn).
B.2.5 Đối với các sản phẩm có chứa các tế bào sống mà có thể gây cản trở thử nghiệm nhiễm khuẩn/vi sinh vật, cần xác định xem liệu các tế bào sống có thể phát triển trong môi trường thử nghiệm hay không. Nếu các tế bào sống tạo nên sự đục tương tự như nhiễm khuẩn, thì một sản phẩm thay thế phù hợp không chứa các tế bào sống có thể được sử dụng. Ví dụ về các sản phẩm thay thế bao gồm các tế bào chết hoặc mô, hoặc một thực thể khác được xử lý một cách giống với các sản phẩm có chứa tế bào sống.
Phụ lục C
(tham khảo)
Tùy chọn kiểm tra cho mô phỏng quá trình
C.1 Các cân nhắc tùy chọn kiểm tra
C.1.1 Rủi ro ô nhiễm do sự can thiệp của con người tồn tại ở tất cả các thử nghiệm ô nhiễm khuẩn. Việc lựa chọn phương pháp kiểm tra cần xem xét cả tính nhạy của các thử nghiệm cũng như số lượng các can thiệp hoặc các thao tác cần thiết để thực hiện các thử nghiệm. Các thử nghiệm nhạy nhất với thao tác ít nhất sẽ được chọn khi có thể.
C.1.2 Đánh giá rủi ro của việc giới thiệu nhiễm khuẩn trong phương pháp thử nghiệm được sử dụng để đánh giá mô phỏng quá trình. Bởi vì sự sự can thiệp của con người là nguồn chính gây nhiễm bẩn trong các thao tác thử nghiệm, nên khi có thể, thực hiện thử nghiệm ở bộ cách ly hoặc hệ thống rào cản bị giới hạn truy cập (RABS). Nếu bộ cách ly hoặc hệ thống rào cản khác không khả dụng, thử nghiệm nên được thực hiện trong một môi trường tốt hoặc tốt hơn môi trường được sử dụng cho sản xuất. Nguồn gây ô nhiễm vi sinh / vi khuẩn trong một thử nghiệm có thể bao gồm:
a) Sự làm sạch và khử nhiễm môi trường thử nghiệm, bề mặt làm việc và các chất liệu được đặt vào khu vực thử nghiệm chưa đầy đủ;
b) khử trùng không đầy đủ các thiết bị thử nghiệm, phương tiện trung gian và các công cụ di chuyển;
c) nhân viên không đeo găng tay và mặc áo choàng đầy đủ;
d) nhân viên chưa được đào tạo thử nghiệm đầy đủ;
e) nhiễm khuẩn xảy ra trong quá trình chuẩn bị vận chuyển mẫu đến các khu vực thử nghiệm do các container vận chuyển hoặc đóng gói;
f) nhiễm khuẩn trong việc mở bao bì vận chuyển hoặc container do sự tạo hạt;
g) nhiễm khuẩn trên container chứa phương tiện trung gian;
h) kỹ thuật vô khuẩn kém trong quá trình vận chuyển mẫu, cắt hoặc lựa chọn, hoặc lấy mẫu bề mặt;
i) kỹ thuật vô khuẩn kém khi thử nghiệm bằng cách dội nước hoặc nuôi cấy tại chỗ.
C.1.3 Khoảng thời gian giữa việc thu thập mẫu và thực hiện các thử nghiệm nên càng ngắn càng tốt
C.1.4 Nếu sản phẩm hoặc sản phẩm thay thế gây ra sự đục trong môi trường nuôi cấy thì một phương pháp để phân biệt sự đục này từ sự đục tạo ra từ kết quả của sự phát triển vi sinh vật trong môi trường cần được thiết lập. Xem ISO 11737-2 đề được hướng dẫn về việc xác định sự phát triển của vi sinh vật trong một thử nghiệm nhiễm vi sinh vật.
C.1.5 Khi mẫu thử và phương pháp thử nghiệm được xác định, phương pháp thử nghiệm phải được duyệt để xác nhận rằng nó phù hợp cho việc phục hồi số lượng thấp các vi sinh vật trong sự hiện diện của sản phẩm được kiểm tra. Xem ISO 11737-2 và dược điển để được hướng dẫn về kiểm tra sự phù hợp của phương pháp thử nghiệm đối với sự phục hồi của các vi sinh vật trong sự hiện diện của sản phẩm.
C.2 Phương pháp thử nghiệm
C.2.1 Tiếp xúc trực tiếp môi trường với sản phẩm.
C.2.1.1 Cân nhắc chung
Việc ngâm sản phẩm hoặc sản phẩm thay thế là phương pháp được ưu tiên trong thử nghiệm. Phương pháp này cho phép tiếp xúc trực tiếp môi trường với sản phẩm và cũng giải quyết nguy cơ vấy nhiễm cho tất cả các bước quy trình và các can thiệp được sử dụng để tạo ra sản phẩm.
C.2.1.2 Phương pháp ngâm trực tiếp
Nếu sản phẩm hoặc sản phẩm thay thế có thể vừa vào bình chứa môi trường tăng trưởng chất lỏng vô trùng, thì sản phẩm sẽ được ngâm và nuôi cấy hoàn toàn trong môi trường này. Thao tác của sản phẩm hoặc sản phẩm thay thế có thể là cần thiết để đảm bảo rằng tất cả các bề mặt tiếp xúc với môi trường tăng trưởng trong suốt giai đoạn nuôi cấy, ví dụ cắt hoặc tháo dỡ sản phẩm. Nếu kích thước sản phẩm hoặc cấu hình mà không thể được ngâm trong môi trường chất lỏng vô trùng thì sản phẩm có thể được chia thành từng phần nhỏ hoặc tháo rời để thử nghiệm. Nếu sản phẩm được tạo thành từ nhiều thành phần thì có thể mô phỏng quá trình vô khuẩn mà không thực sự phải kết nối các bộ phận lại với nhau. Điều này có thể làm giảm nguy cơ nhiễm khuẩn phát sinh trong thời gian thử nghiệm.
C.2.1.3 Tiếp xúc trực tiếp tại chỗ của môi trường với các bề mặt tiếp xúc bệnh nhân
Nếu sản phẩm chỉ là đường chất lỏng vô trùng, môi trường chất lỏng có thể được thêm vào đường chất lỏng của sản phẩm và nuôi cấy tại chỗ. Trong phương pháp này, sản phẩm và phương tiện trung gian tiếp xúc trực tiếp với sản phẩm đóng vai trò như là Container phương tiện trung gian.
Một ví dụ của một kiểm tra tại chỗ sẽ là sự bổ sung môi trường phát triển chất lỏng vô trùng cho sản phẩm, ví dụ túi nuôi cấy tế bào, niêm phong của túi nuôi cấy tế bào và sự nuôi cấy túi niêm phong. Sau khi nuôi cấy, môi trường tăng trưởng được kiểm tra dấu hiệu sự phát triển của vi sinh vật. Nếu các container không rõ ràng, sẽ là cần thiết để dẫn lưu môi trường phát triển thành vô khuẩn thứ hai, container rõ ràng để kiểm tra.
C.2.2 Các phương pháp rửa giải/ tách bỏ
Đối với những sản phẩm và các bộ phận mà việc ngâm trực tiếp hoặc kiểm tra tại chỗ là không khả thi thì phương pháp rửa giải/loại bỏ có thể là lựa chọn duy nhất.
Xối nước hoặc rửa; nếu các sản phẩm chỉ có thể được xối nước hoặc rửa sạch, sự rửa giải có thể được thu thập trong một thùng chứa để nuôi cấy hoặc rửa giải có thể được lọc sau đó ngâm và nuôi cấy của bộ lọc. ISO 11737-2 bao gồm hướng dẫn về các phương pháp này. Sự phù hợp của phương pháp này để loại bỏ và phục hồi nhiễm khuẩn vi sinh vật từ sản phẩm cần được xác định.
So sánh các phương pháp: phương pháp kiểm tra phù hợp nhất sẽ được lựa chọn và lý do cho sự lựa chọn cần được chứng minh bằng tài liệu. Những lợi ích và hạn chế của từng phương pháp được trình bày trong Bảng C.1.
Bảng C1 - Tóm tắt các lựa chọn thử nghiệm
| Loại | Phương pháp | Độ nhạy | Lợi ích | Hạn chế |
| Kết nối trung gian trực tiếp | Ngâm môi trường chất lỏng của sản phẩm thực tế hoặc sản phẩm thay thế | Cao | Độ nhạy vượt trội Phương pháp xác nhận trích yếu được xuất bản Chấp nhận quy định | Không khả thi cho những sản phẩm kích cỡ lớn Phù hợp với các container cỡ trung bình |
|
| Thử thách trung gian tại chỗ | Cao | Độ nhạy vượt trội Phương pháp xác nhận trích yếu được xuất bản Chấp nhận quy định | Hạn chế với nhiễm khuẩn vi sinh vật đường chất lỏng Có thể yêu cầu chế tạo và lắp ráp kết nối đặc biệt Đối với sản phẩm không rõ ràng, việc phát hiện sớm các mẫu xét nghiệm dương tính có thể là không khả thi |
| Các phương pháp rửa giải và tách bỏ | Xối nước hoặc rửa sạch | Có thể thay đổi | Loại bỏ những ràng buộc thùng chứa trung gian | Yêu cầu xác nhận tính hiệu quả của sự hồi phục Đảm bảo bị hạn chế về việc loại bỏ các vi sinh vật ra khỏi tất cả các bề mặt sản phẩm Nếu bên trong và bên ngoài vô trùng, các thủ tục và xác nhận có thể rất phức tạp Yêu cầu lý do để chấp nhận quy định |
Thư mục tài liệu tham khảo
[1] TCVN 7393-2 (ISO 11137-2), Tiệt khuẩn sản phẩm chăm sóc sức khỏe - Bức xạ- Phần 2: Thiết lập liều tiệt khuẩn
[2] ISO 11737-2, Sterilization of medical devices - Microbiological methods - Part 2: Tests of sterility performed in the definition, validation and maintenance of a sterilization process (Tiệt khuẩn thiết bị y tế - Phương pháp vi sinh vật- Phần 2: Thử nghiệm vô trùng trong định nghĩa, phê chuẩn và duy trì quá trình khử trùng)
[3] TCVN ISO 13485 (ISO 13485), Thiết bị y tế - Hệ thống quản lý chất lượng - Yêu cầu riêng cho các mục đích chế định
[4] TCVN 8644 (ISO 14644) (tất cả các phần), Phòng sạch và môi trường kiểm soát liên quan
[5] ISO 14698 (all parts), Cleanrooms and associated controlled environments - Biocontamination control (Phòng sạch và môi trường kiểm soát liên quan - Kiểm soát ô nhiễm sinh học)
[6] TCVN 8023:2009 (ISO 14971: 2007), Thiết bị y tế - Áp dụng quản lý rủi ro đối với thiết bị y tế
[7] Commission Directive 2004/23/EC, Standards of quality and safety for the donation, procurement, testing, processing, preservation, storage and distribution of human tissues and cells (Chỉ thị 2004/23 / EC của Ủy ban Châu Âu, Tiêu chuẩn chất lượng và an toàn cho việc hiến tặng, thu mua, kiểm tra, xử lý, bảo quản, lưu trữ và phân phối các mô và tế bào của con người)
[8] Commission Directive 2005/17/EC, Plant passports (Chỉ thị 2005/17 / EC của Ủy ban Châu Âu, Hộ chiếu nhà máy)
[9] EU Good Manufacturing Practice Directive, Annex 1, Manufacture of Sterile Medicinal Products (Chỉ thị của Ủy ban Châu Âu về Tiêu chuẩn thực hành sản xuất tốt, Phụ lục 1, Sản xuất vô trùng dược phẩm)
[10] European Pharmacopoeia (Dược điển Châu Âu)
[11] US Pharmacopoeia (Dược điển Mỹ)
[12] JP Pharmacopoeia (Dược điển Nhật Bản)
[13] EMEA/CHMP/410869/2006, Guideline on Human Cell-Based Medicinal Products (Hướng dẫn về dược phẩm dựa trên tế bào con người)
[14] Global Harmonization Task Force SG3/N15R8/2005, Implementation of risk management principles and activities within a Quality Management System (Tổ chức tiêu chuẩn hóa quốc tế SG3 / N15R8 / 2005, thực hiện các nguyên tắc và hoạt động quản lý rủi ro trong Hệ thống quản lý chất lượng)
[15] Global Harmonization Task Force SG3/N99-10, Quality Management Systems - Process Validation Guidance (Tổ chức tiêu chuẩn hóa quốc tế SG3 / N99-10, Các hệ thống quản lý chất lượng- Hướng dẫn về quy trình xác nhận)
[16] ICH Guidance for Industry - Q9 Quality Risk Management, www.ich.org (ICH Hướng dẫn cho công nghiệp- Q9 Quản lý rủi ro chất lượng, www.ich.org)
[17] PDA Technical Report 22 (TR22), Process Simulation Testing for Aseptically Filled Products (PDA Báo cáo kỹ thuật 22 (TR22), Thử nghiệm mô phỏng quá trình cho các sản phẩm vô khuẩn)
[18] PDA Technical Report 44 (TR44), Quality Risk Management for Aseptic Processes (Báo cáo kỹ thuật PDA 44 (TR 44), Quản lý rủi ro chất lượng cho quá trình vô trùng)
[19] PDA Technical Report 34 (TR34), Design and Validation of Isolator Systems for the Manufacturing and Testing of Health Care Products (Báo cáo kỹ thuật PDA 34 (TR34), Thiết kế và Phê chuẩn hệ thống cách ly cho Sản xuất và Thử nghiệm các sản phẩm chăm sóc sức khỏe)
[20] TIDSWELL , E DWARD C. and M C G ARVEY , B ERNARD , Quantitative risk modeling assists parenteral batch disposition. European Journal of Parenteral and Pharmaceutical Sciences, 2007; 12(2):3-7 (Mô hình rủi ro định lượng hỗ trợ tiêm tĩnh mạch. Tạp chí Châu Âu về ngoài ruột và Khoa học dược phẩm, năm 2007; 12 (2): 3-7)
[21] TIDSWELL , E DWARD C. and M C G ARVEY , B ERNARD , Quantitative risk modeling in aseptic manufacture. PDA Journal of Pharmaceutical Science and Technology, Vol. 60, No.5 (Mô hình rủi ro định lượng trong sản xuất vô trùng. Tạp chí Khoa học và Công nghệ dược phẩm PDA, Vo 1.60, số 5).
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 8026-7:2021 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 8026-7:2021 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 8026-7:2021 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 8026-7:2021 DOC (Bản Word)