- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 13376-3:2021 ISO 8637-3:2018 Hệ thống ngoài cơ thể cho lọc máu - Phần 3: Thiết bị lọc huyết tương
| Số hiệu: | TCVN 13376-3:2021 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Y tế-Sức khỏe |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
28/12/2021 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 13376-3:2021
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 13376-3:2021
TIÊU CHUẨN QUỐC GIA
TCVN 13376-3:2021
ISO 8637-3:2018
HỆ THỐNG NGOÀI CƠ THỂ CHO LỌC MÁU - PHẦN 3: THIẾT BỊ LỌC HUYẾT TƯƠNG
Extracorporeal systems for blood purification - Part 3: Plasmafilters
Lời nói đầu
TCVN 13376-3:2021 hoàn toàn tương đương với ISO 8637-3:2018;
TCVN 13376-3:2021 do Viện Trang thiết bị và Công trình y tế biên soạn, Bộ Y tế đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ tiêu chuẩn TCVN 13376:2021 (ISO 8637) Hệ thống ngoài cơ thể cho lọc máu gồm các phần sau:
- TCVN 13376-1:2021 (ISO 8637-1:2017) Phần 1: Thiết bị thẩm tách máu, thẩm lọc máu, lọc máu và cô máu.
- TCVN 13376-2:2021 (ISO 8637-2:2018) Phần 2: Tuần hoàn máu ngoài cơ thể dùng cho thiết bị thẩm tách máu, thẩm lọc máu và lọc máu.
- TCVN 13376-3:2021 (ISO 8637-3:2018) Phần 3: Thiết bị lọc huyết tương
Lời giới thiệu
Tiêu chuẩn này trong thực tế không dùng để chỉ định vật liệu của thiết bị lọc huyết tương. Do đó, tiêu chuẩn này chỉ yêu cầu rằng các vật liệu được sử dụng đã được thử nghiệm và các phương pháp thử nghiệm cũng như kết quả của nó phải được cung cấp theo yêu cầu. Tiêu chuẩn này cũng không có ý định chỉ định hoặc đặt giới hạn về các đặc tính công dụng của thiết bị vì những hạn chế đó là không cần thiết đối với người dùng đủ điều kiện và điều này sẽ hạn chế các lựa chọn thay thế có sẵn khi chọn thiết bị cho một yêu cầu cụ thể.
Nếu thiết bị lọc huyết tương được sử dụng với mạch máu ngoài cơ thể, thì kích thước của cổng máu và cổng dịch lọc đã được chỉ định để đảm bảo tính tương thích của thiết bị với mạch máu ngoài cơ thể được quy định ở TCVN 13376-2 (ISO 8637-2). Thiết kế và kích thước đã được lựa chọn để giảm thiểu nguy cơ rò rỉ máu và không khí xâm nhập.
Tiêu chuẩn này phản ánh sự đồng thuận của các bác sĩ, nhà sản xuất và các bên quan tâm khác đối với các thiết bị được chấp thuận sử dụng trong lâm sàng.
HỆ THỐNG NGOÀI CƠ THỂ CHO LỌC MÁU - PHẦN 3: THIẾT BỊ LỌC HUYẾT TƯƠNG
Extracorporeal systems for blood purification - Part 3: Plasmafilters
1 Phạm vi áp dụng
Tiêu chuẩn này quy định các yêu cầu và tiêu chí chấp nhận (bao gồm cả các phương pháp thử) đối với các thông số liên quan đến an toàn đối với thiết bị lọc huyết tương. Chỉ những yêu cầu cụ thể đối với thiết bị lọc huyết tương mới được đưa vào.
Tiêu chuẩn này quy định các yêu cầu đối với thiết bị lọc huyết tương vô khuẩn, sử dụng một lần và dự định sử dụng ở người.
Tiêu chuẩn này không đề cập đến các vấn đề liên quan đến độc tính. Các vấn đề như vậy được đề cập trong các phần liên quan của TCVN 7391 (ISO 10993).
Tiêu chuẩn này không áp dụng cho tuần hoàn máu ngoài cơ thể sử dụng cho điện di huyết tương, thiết bị tạo oxy hay các thiết bị y tế hoạt động. Tiêu chuẩn này không đề cập đến dịch thay thế.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau đây là cần thiết để áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 7391-1 (ISO 10993-1), Đánh giá sinh học trang thiết bị y tế - Phần 1: Đánh giá và thử nghiệm.
TCVN 7391-4 (ISO 10993-4), Đánh giá sinh học trang thiết bị y tế - Phần 4: Chọn phép thử tương tác với máu.
TCVN 7391-7 (ISO 10993-7), Đánh giá sinh học trang thiết bị y tế - Phần 7: Các chất tồn dư tiệt khuẩn ethylen oxit.
TCVN 7391-11 (ISO 10993 11), Đánh giá sinh học các thiết bị y tế - Phần 11: Các thử nghiệm độc tính hệ thống.
ISO 8637-1, Extracorporeal systems for blood purification - Part 1: Haemodialysers, haemodiafilters, haemofilters and haemoconcentrators (Các hệ thống ngoài cơ thể cho lọc máu - Phần 1: Thiết bị thẩm tách máu, thẩm lọc máu, lọc máu và thiết bị cô máu).
ISO 80369-7, Small-bore connectors for liquids and gases in healthcare applications - Part 7: Connectors for intravascular or hypodermic applications (Đầu nối nòng nhỏ cho chất lỏng và khí trong các ứng dụng chăm sóc sức khỏe - Phần 7: Đầu nối cho các ứng dụng nội mạch hoặc dưới da)
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này, áp dụng các thuật ngữ và định nghĩa sau:
3.1
Khoang máu (blood compartment)
Phần của thiết bị lọc huyết tương dự định cho máu chảy qua
3.2
Khoang chứa chất lọc (filtrate compartment)
Phần của thiết bị lọc huyết tương dự định cho chất lọc chảy qua
3.3
Tốc độ lọc (filtration rate)
Tốc độ dịch được loại khỏi khoang máu (3.1) qua màng bán thấm vào trong khoang chứa chất lọc (3.2) của thiết bị lọc huyết tương
3.4
Tách huyết tương (plasmapheresis)/tách huyết tương (plasma separation)
Tách một phần của toàn bộ huyết tương khỏi các phần tử định hình (formed elements) của máu bằng một màng bán thấm
CHÚ THÍCH 1: Tách huyết tương cũng có thể thực hiện bằng cách sử dụng quay ly tâm phân tốc, nhưng phương pháp này không đề cập trong tiêu chuẩn này.
3.5
Thiết bị lọc huyết tương (plasmafilter)
Thiết bị sử dụng để thực hiện tách huyết tương qua màng (3.4)
3.6
Hệ số sàng lọc (sieving coefficient)
Tỷ lệ nồng độ chất tan trong chất lọc với nồng độ đồng thời của chính chất tan đó trong máu.
3.7
Áp suất qua màng (transmembrane pressure - TMP), PTM
Áp suất trung bình qua màng bán thấm
CHÚ THÍCH 1: Áp suất qua màng được tính theo phương trình sau:
![]()
Trong đó:
PBI là áp suất tại đầu vào khoang máu;
PBO là áp suất tại đầu ra khoang máu;
PI là áp suất tại đầu ra của khoang chứa chất lọc.
4 Yêu cầu
4.1 An toàn sinh học
Những phần của thiết bị lọc huyết tương sẽ tiếp xúc trực tiếp hay gián tiếp với máu trong khi sử dụng lâm sàng bình thường cần phải tương thích sinh học với mục đích sử dụng lâm sàng của chúng
Những phần của thiết bị lọc huyết tương dự định tiếp xúc trực tiếp hoặc gián tiếp với máu phải được đánh giá về mức độ không bị nguy hiểm sinh học, phù hợp với 5.2.
Cần chú ý đến sự cần thiết phải thiết lập các quy định quốc gia hoặc tiêu chuẩn quốc gia về kiểm tra độ độc và tính tương thích sinh học có tồn tại ở quốc gia nơi thiết bị được sản xuất hay không và nếu có, ở các quốc gia mà thiết bị sẽ được bán trên thị trường.
Kiểm tra sự phù hợp theo 5.2.
4.2 Tính vô trùng
Đường dẫn máu và dịch lọc của thiết bị phải vô trùng. Kiểm tra sự phù hợp theo 5.3.
4.3 Tính không gây sốt
Đường dẫn máu và dịch lọc của thiết bị phải không gây sốt. Kiểm tra sự phù hợp theo 5.4.
4.4 Đặc tính cơ học
4.4.1 Tính toàn vẹn cấu trúc
Khi thử nghiệm theo Điều 5.5.1, thiết bị lọc huyết tương không được rò rỉ.
CHÚ THÍCH: Yêu cầu này liên quan đến tính toàn vẹn bên ngoài của thiết bị.
4.4.2 Sự toàn vẹn của khoang chứa máu
Khi thử nghiệm theo Điều 5.5.2, khoang chứa máu phải không được rò rỉ.
4.4.3 Các đầu nối và cửa
4.4.3.1 Các kết nối với khoang chứa máu
Ngoại trừ khi thiết bị lọc huyết tương và các tuần hoàn máu ngoài cơ thể được thiết kế là một hệ thống tích hợp, các kích thước của cửa máu phải được đưa ra trong Hình 1. Sự phù hợp cho yêu cầu này cần được xác nhận theo 5.5.3.
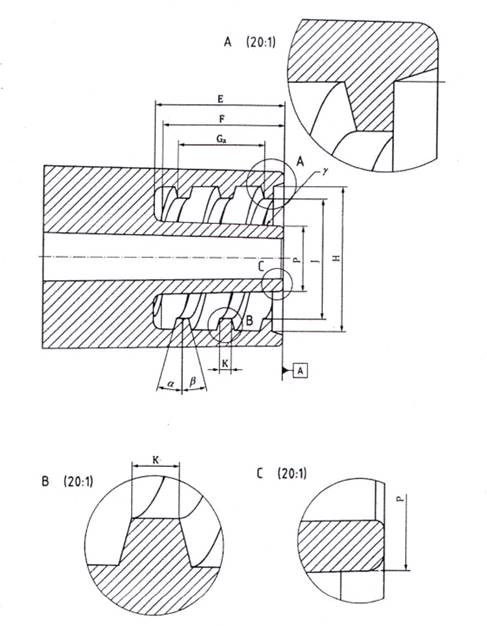
CHÚ DẪN
| Biểu tượng | Ký hiệu | Kích thước tính bằng mm | Chú thích |
| α | Góc ren | 15° | - |
| β | Góc ren | 15° | - |
| γ | Kích thước tỉ lệ côn | 6:100 | - |
| E | Độ dài ren | 10 hoặc hơn | - |
| F | Độ dài của vùng côn | 9 hoặc hơn | - |
| Ga | Bước ren | 8 | Chỉ số trên “a” của Ga có nghĩa là ren kép. |
| H | Đường kính trong | 13 hoặc hơn | - |
| J | Đường kính đỉnh | 11 +0,3 -0,2 | Đã thay đổi dung sai trên để phù hợp với các thành phần và vật liệu khác nhau. |
| K | Chiều rộng đỉnh ren | 1,1 ±0,25 | Kích thước và dung sai được sửa đổi dựa trên thực tế sản xuất hiện có. |
| P | đường kính nón đực mặt phẳng tham chiếu "A square" | 6 ±0,03 | Kích thước này được đo dưới dạng hình chiếu trên mặt trước. Xem Hình 1 (C) |
Hình 1 - Kích thước lắp chính của cửa vào và ra của máu
4.4.3.2 Sự kết nối với khoang chứa chất lọc huyết tương
Các cửa lọc của thiết bị lọc huyết tương phải cho phép kết nối an toàn với ống được sử dụng với thiết bị, ngoại trừ khi thiết bị lọc huyết tương và các tuần hoàn máu ngoài cơ thể được thiết kế là một hệ thống tích hợp.
Kích thước của các cửa khoang chứa chất lọc phải là đầu nối đực có khóa với độ côn 6 % (Luer) phù hợp với ISO 80369-7 hoặc cửa ra và cửa vào của dịch thẩm tách phù hợp với ISO 8637-1.
Sự phù hợp với yêu cầu này phải được xác minh theo 5.6.
Các đầu nối làm bằng vật liệu bán cứng không được tách rời dưới tác động của một lực dọc trục 15 N trong vòng 15 s.
4.4.4 Thể tích của khoang chứa máu
Khi đo theo 5.5.4, thể tích của khoang chứa máu của thiết bị lọc huyết tương cần nằm trong giới hạn các giá trị đã công bố bởi nhà sản xuất (xem 6.2.h).
4.4.5 Độ giảm áp suất của khoang chứa máu
Khi đo theo 5.7.2, độ giảm áp suất qua khoang chứa máu của thiết bị lọc huyết tương cần nằm trong phạm vi các giá trị đã công bố bởi nhà sản xuất (xem 6.2.h).
4.5 Các đặc điểm tính năng
4.5.1 Tốc độ lọc
Khi đo theo 5.8.1.2, tốc độ lọc cần nằm trong phạm vi các giá trị đã công bố bởi nhà sản xuất (xem 6.4 i).
4.5.2 Hệ số sàng lọc
Khi đo theo 5.8.2.2, hệ số sàng lọc đối với albumin, immunoglobulin M (IgM) và β-Iipoprotein hay các chỉ số tương đương phải nằm trong phạm vi các giá trị đã công bố bởi nhà sản xuất (xem 6.4 i).
4.5.3 Các đặc điểm gây tan máu
Khi thử nghiệm ở các điều kiện vận hành tối đa quy định, thiết bị không được gây ra tan máu có thể đem đến rủi ro an toàn cho bệnh nhân. Thử nghiệm cần được thực hiện theo 5.8.3.2.
4.6 Thời hạn sử dụng
Tính an toàn sinh học, độ vô trùng, dữ liệu hiệu suất và tính toàn vẹn cơ học của thiết bị phải được chứng minh sau khi bảo quản trong thời gian tương ứng với thời hạn sử dụng. Kiểm tra sự phù hợp theo 5.9.
5 Phương pháp thử nghiệm
5.1 Yêu cầu chung
Các đặc điểm tính năng quy định trong 4.3 phải được xác định trước khi tiếp thị một loại thiết bị mới và phải được đánh giá lại sau những thay đổi trong thiết bị có thể làm thay đổi hiệu năng của nó.
Mẫu thiết bị phải được lấy ngẫu nhiên từ quá trình sản xuất của nhà sản xuất và phải vượt qua tất cả các bước kiểm tra chất lượng áp dụng cũng như tiệt trùng. Chúng phải được chuẩn bị theo khuyến nghị của nhà sản xuất như thể chúng được sử dụng cho một quy trình lâm sàng.
Các phép đo phải được thực hiện trong ống nghiệm ở (37 ± 1) °C. Nếu sự liên quan giữa các biến số không tuyến tính, thực hiện đủ các xác định cho phép nội suy hợp lệ giữa các điểm dữ liệu.
Các kỹ thuật đo lường được đưa ra trong tiêu chuẩn này là các phép thử tham khảo. Có thể sử dụng các phương pháp thử nghiệm khác, miễn là chúng được chứng tỏ có độ chuẩn xác và tính tái lập tương tự.
Các hệ thống thử nghiệm đã nêu không chỉ báo tất cả các chi tiết cần thiết của dụng cụ thử nghiệm áp dụng. Thiết kế và cấu trúc của các hệ thống thử nghiệm thực tế và thiết lập các hệ thống thử nghiệm thực tế cũng cần giải quyết nhiều yếu tố đóng góp vào sai số đo, bao gồm (nhưng không giới hạn) các sai số đo áp suất do ảnh hưởng của các cột áp tĩnh và độ giảm áp suất động; thời gian ổn định các thông số; sự dao động nhiệt độ không kiểm soát được ở các lưu lượng không ổn định; pH; sự phân hủy các chất thử nghiệm do nhiệt, ánh sáng và thời gian; khử khí của dịch thử nghiệm; không khí tồn dư (bị mắc kẹt) và nhiễm hệ thống bởi vật ngoại lai, tảo và vi khuẩn.
Các phương pháp thử dưới đây là những phương pháp tham khảo. Có thể sử dụng các phương pháp khác, miễn là chúng được chứng tỏ có độ chuẩn xác và tính tái lập tương tự.
CHÚ THÍCH: Điều 5 bao gồm các thử nghiệm có tính chất thử nghiệm điển hình, được thực hiện trước khi tiếp thị thiết bị mới hoặc khi thực hiện các thay đổi đối với thiết bị hoặc các quy trình sản xuất của thiết bị đó (xem 5.8).
Các biện pháp khác có tính chất kiểm soát chất lượng, được lặp lại thường xuyên đề đảm bảo rằng thiết bị đáp ứng các yêu cầu (xem 5.2, 5.3, 5.4, 5.5.1, 5.5.2)
5.2 An toàn sinh học
Tính an toàn sinh học của thiết bị lọc huyết tương phải được đánh giá trên các mẫu của từng loại thiết bị mới trước khi đưa ra thị trường, hoặc sau bất kỳ thay đổi nào về vật liệu cấu tạo của loại thiết bị đó, hoặc sau bất kỳ thay đổi nào trong phương pháp khử trùng. Thử nghiệm phải được thực hiện theo TCVN 7391-1 (ISO 10993-1), TCVN 7391-4 (ISO 10993-4) và TCVN 7391-7 (ISO 10993-7) hoặc TCVN 7391-11 (ISO 10993-11), nếu có liên quan.
5.3 Tính vô khuẩn
Sự phù hợp với 4.2 phải được xác minh bằng cách kiểm tra hồ sơ để chứng tỏ rằng thiết bị đã được tiếp xúc với quá trình tiệt khuẩn đã xác thực.
5.4 Tính không gây sốt
Sự phù hợp với 4.3 phải được xác minh theo TCVN 7391-11 (ISO 10993-11).
5.5 Đặc tính cơ học
5.5.1 Sự toàn vẹn cấu trúc
Thiết bị phải có khả năng chịu được áp suất dương gấp 1,5 lần áp suất tối đa được khuyến nghị của nhà sản xuất trên áp suất khí quyển và áp suất âm không vượt quá 700 mmHg (93,3 kPa thấp hơn áp suất khí quyển) hoặc áp suất âm cao nhất có thể đạt được nếu ở độ cao lớn , khi được thử nghiệm theo 5.5.2.
CHÚ THÍCH: Yêu cầu này đề cập đến tính toàn vẹn của vỏ bên ngoài của thiết bị.
Làm đầy nước vào thiết bị và nâng áp suất lên tới 1,5 lần áp suất tối đa công bố bởi nhà sản xuất. Duy trì áp suất này trong khoảng 10 min và sau đó kiểm tra thiết bị bằng mắt tìm sự xuất hiện nước.
5.5.2 Sự toàn vẹn của khoang chứa máu
Đặt thiết bị lọc ở tư thế thẳng đứng. Đóng các cửa đáy của khoang chứa máu và chất lọc. Làm ướt màng lọc bằng nước và làm đầy khoang chứa chất lọc, nếu thích hợp. Nén áp suất vào khoang chứa máu tới 1,5 lần áp suất qua màng tối đa quy định bởi nhà sản xuất trong vòng 10 min. Nếu không thấy bọt khí thoát khỏi khoang chứa chất lọc qua cửa khoang chứa chất lọc để mở, khoang chứa máu còn nguyên vẹn.
5.5.3 Các cửa khoang chứa máu
Sự phù hợp với 4.4.3.1 phải được xác định bằng cách kiểm tra. Nếu sử dụng đầu nối không khóa, đầu nối không được tách ra dưới tác dụng của lực dọc trục là 15 N trong 15 s.
5.5.4 Thể tích khoang chứa máu
Thể tích của khoang chứa máu cần được tính toán từ dữ liệu hình học (thể tích các đầu, kích cỡ sợi và số lượng sợi). Kiểm tra sự phù hợp bằng cách kiểm tra tài liệu của nhà sản xuất.
CHÚ THÍCH: Thể tích được tính toán như mô tả trên vì khó có thể tìm được một chất dịch không bị lọc qua màng của thiết bị lọc huyết tương.
5.6 Cửa lọc huyết tương
Sự phù hợp với 4.4.3.2 phải được xác định bằng cách kiểm tra bằng mắt thường.
5.7 Độ giảm áp suất
5.7.1 Dịch thử nghiệm
Dịch thử nghiệm phải là máu bò hay người có chất kháng đông với các giá trị duy trì của hematocrit (32 ± 3) % và lượng protein (60 ± 5) g/l và duy trì trong quá trình thử nghiệm.
5.7.2 Quy trình thử nghiệm độ giảm áp suất
Làm đầy nước muối hay huyết tương vào khoang chứa chất lọc và dịch thử nghiệm vào khoang chứa máu. Đo độ giảm áp suất qua khoang chứa máu trong phạm vi lưu lượng máu công bố bởi nhà sản xuất.
5.8 Đặc điểm tính năng
5.8.1 Tốc độ lọc
5.8.1.1 Dịch thử nghiệm
Dịch thử nghiệm phải là máu bò hay người có chất chống đông, với các giá trị duy trì của hematocrit là (32 ± 3) % và lượng protein là (60 ± 5) g/l và duy trì trong quá trình thử nghiệm.
5.8.1.2 Quy trình thử nghiệm tốc độ lọc
Thiết lập tuần hoàn thử nghiệm như trong Hình 2. Không được để cho áp suất mồi vượt quá áp suất qua màng tối đa công bố bởi nhà sản xuất (xem 6.1.h). Tiến hành đo các lưu lượng huyết tương bằng dịch thử nghiệm tuần hoàn qua khoang máu của thiết bị cần thử nghiệm và theo trình tự đo từ áp suất qua màng tối thiểu đến mức tối đa ở mỗi lưu lượng máu công bố bởi nhà sản xuất (xem 6.4.d)1)).
5.8.2 Hệ số sàng lọc
5.8.2.1 Dịch thử nghiệm
Dịch thử nghiệm phải là huyết tương bò hay người với lượng protein (60 ± 5) g/l và chứa một hay nhiều các chất sau đây hoặc các chất chỉ thị tương đương:
a) albumin (albumin huyết tương);
b) immunoglobulin M (IgM);
c) β-lipoprotein.
CHÚ THÍCH: Có thể sử dụng thêm các chất/chỉ thị hoặc máu toàn phần.
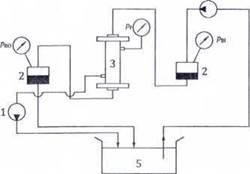
CHÚ DẪN:
1. Bơm huyết tương
2. Buồng chứa
3. Thiết bị cần thử nghiệm
4. Bơm máu
5. Dịch thử nghiệm ở (37 ± 1) °C.
PBI là áp suất máu ở lối vào của thiết bị cần thử nghiệm
PBO là áp suất máu ở lối ra của thiết bị cần thử nghiệm
Pf là áp suất của chất lọc tại lối ra của thiết bị cần thử nghiệm
Hình 2 - Sơ đồ tuần hoàn thử nghiệm để xác định tốc độ lọc và hệ số sàng lọc
5.8.2.2 Quy trình thử nghiệm hệ số sàng lọc
Thiết lập tuần hoàn như trong Hình 2.
Thiết lập các điều kiện ổn định (nhiệt độ, lưu lượng và áp suất) và đảm bảo rằng tất cả không khí đã được loại bỏ khỏi đường dẫn máu. Đo lượng protein của dịch thử nghiệm và ghi lại giá trị này. Đặt lưu lượng dịch thử nghiệm tới lưu lượng máu tối đa công bố bởi nhà sản xuất (xem 6.4.d)2) và tốc độ lọc tới ít nhất 20 % lưu lượng dịch thử nghiệm. Nếu vì những lý do liên quan tới thiết bị, không thể đạt được lưu lượng dịch thử nghiệm đã công bố, sử dụng lưu lượng tối đa có thể và ghi lại lưu lượng đã sử dụng.
Thu thập các mẫu thử nghiệm sau khi đã đạt được trạng thái sẵn sàng (thường sau 30 min tiếp xúc máu). Đo nồng độ protein trong chất lọc. Nên lặp lại các phép đo ở thời điểm thời gian thứ hai (thường sau 90 min tiếp xúc máu) để đánh giá sự tích tụ cặn ở màng.
Tính toán hệ số sàng lọc, S, bằng phương trình (2) sau:
![]()
Trong đó: cF là nồng độ của chất tan trong chất lọc
cBI là nồng độ của chất tan ở lối vào thiết bị cần thử nghiệm
5.8.3 Các đặc điểm gây tan máu
5.8.3.1 Dịch thử nghiệm
Dịch thử nghiệm phải là máu bò hoặc máu người có chất chống đông, với các giá trị duy trì của hematocrit là (32 ± 2) % và lượng protein là (60 ± 5) g/l và duy trì trong quá trình thử nghiệm.
5.8.3.2 Quy trình thử nghiệm các đặc điểm gây tan máu
Cho dịch thử nghiệm tuần hoàn trong vòng 30 min, sử dụng các giá trị tối đa của áp suất qua màng và lưu lượng máu theo quy định của nhà sản xuất.
Trong giai đoạn này, kiểm tra chất lọc bằng mắt tìm sự hiện diện của máu. Đo haemoglobin tự do trong máu và trong chất lọc khi bắt đầu và khi kết thúc quy trình. Sự thay đổi mức độ cần ở trong phạm vi đặc tính kỹ thuật của nhà sản xuất.
CHÚ THÍCH: Các điều kiện nêu trên thể hiện các điều kiện tối đa mà thiết bị được vận hành.
5.9 Thời hạn sử dụng
Sự phù hợp với 4.6 có thể được đáp ứng bằng thử nghiệm gia tốc hoặc thời gian thực về độ an toàn sinh học, độ vô trùng và tính toàn vẹn cơ học của thiết bị sau khi bảo quản trong khoảng thời gian tương ứng với thời hạn sử dụng.
6 Ghi nhãn
6.1 Ghi nhãn trên thiết bị
Nhãn thiết bị cần chứa thông tin sau đây:
a) tên của nhà sản xuất;
b) tên riêng của thiết bị;
c) mã nhận dạng của nhà sản xuất (chẳng hạn như danh mục hoặc số kiểu máy) cho thiết bị;
d) số sêri, hay số lô /mẻ;
e) hướng của dòng máu, và dòng chảy của dịch lọc, nếu có (mã màu có thể được sử dụng để phân biệt giữa đầu vào thiết bị và đầu ra từ thiết bị);
f) áp suất qua màng tối đa;
g) hạn sử dụng, thể hiện như tháng/năm, năm/tháng hoặc năm-tháng-ngày;
h) phương pháp tiệt khuẩn;
i) một công bố sử dụng một lần, nếu thích hợp;
j) một cảnh báo rằng thiết bị chỉ dự định sử dụng trong tách huyết tương.
Khi các ký hiệu tồn tại như thể hiện trong ISO 7000 và / hoặc TCVN 6916-1 (ISO 15223-1), chúng có thể được sử dụng như một sự thay thế.
6.2 Ghi nhãn trên thùng chứa đơn vị
Ít nhất thông tin sau phải hiển thị trên hoặc qua hộp chứa đơn vị:
a) tên và địa chỉ của nhà sản xuất;
b) tên riêng của thiết bị;
c) mã nhận dạng của nhà sản xuất (chẳng hạn như danh mục hoặc số kiểu máy) cho thiết bị;
d) ký hiệu lô, lô hoặc số sê-ri;
e) hạn sử dụng, thể hiện như tháng/năm, năm/tháng hoặc năm-tháng-ngày;
f) phương pháp tiệt khuẩn;
g) một công bố sử dụng một lần;
h) một công bố về tính vô khuẩn và tính không gây sốt; có hai khả năng:
1) toàn bộ nội dung của gói là vô trùng;
2) đường dẫn chất lỏng (máu và dịch lọc) là vô trùng;
i) một công bố “Đọc hướng dẫn trước khi sử dụng”;
Hướng dẫn sử dụng phải bao gồm công bố hoặc biểu tượng “Không sử dụng thiết bị nếu gói bị hư hỏng”. Nếu nắp bảo vệ cuối được sử dụng để sản xuất vô trùng, thì công bố “Không sử dụng thiết bị nếu nắp bảo vệ không đúng vị trí”.
j) công bố rằng thiết bị sẽ được sử dụng với máy được chỉ định để lọc huyết tương.
Khi các ký hiệu tồn tại như thể hiện trong ISO 7000 và / hoặc TCVN 6916-1 (ISO 15223-1), chúng có thể được sử dụng như một sự thay thế.
6.3 Ghi nhãn trên thùng chứa bên ngoài
Ít nhất thông tin sau phải xuất hiện trên thùng chứa bên ngoài thường chứa một số thiết bị:
a) tên và địa của của nhà sản xuất;
b) tên và địa chỉ của nhà phân phối, nếu khác với thông tin được cung cấp trong phần a), nếu áp dụng và phù hợp với các yêu cầu quốc gia;
c) tên riêng của thiết bị, mô tả nội dung và số lượng thiết bị chứa trong thùng;
d) mã nhận dạng của nhà sản xuất (chẳng hạn như danh mục hoặc số kiểu máy) cho thiết bị;
e) ký hiệu lô, lô hoặc số sê-ri;
f) một công bố về tính vô khuẩn và tính không gây sốt;
g) hướng dẫn và cảnh báo liên quan đến việc xử lý và bảo quản;
h) hạn sử dụng, thể hiện như tháng/năm, năm/tháng hoặc năm-tháng-ngày;
i) công bố “Nếu thùng carton bị hư hỏng, hãy kiểm tra cẩn thận các sản phẩm được chứa trong đó, không sử dụng nếu hộp đựng sản phẩm bị hư hỏng hoặc nếu nắp bảo vệ không đúng vị trí”.
Khi các ký hiệu tồn tại như thể hiện trong ISO 7000 và / hoặc TCVN 6916-1 (ISO 15223-1), chúng có thể được sử dụng như một sự thay thế.
6.4 Thông tin được cung cấp trong tài liệu kèm theo
Tài liệu kèm theo phải được đặt trong thùng đựng bên ngoài mà các thiết bị được vận chuyển. Nó phải bao gồm đặc điểm kỹ thuật sản phẩm và Hướng dẫn sử dụng dưới dạng một cuốn sách nhỏ hoặc tờ rơi. Ít nhất một tập sách hoặc tờ rơi như vậy phải được đặt trong mỗi thùng đựng bên ngoài.
Ít nhất các thông tin sau cần được cung cấp:
a) tên và địa của của nhà sản xuất;
b) tên riêng của thiết bị;
c) hướng sử dụng:
1) công bố tuân theo hướng dẫn của nhà sản xuất về hướng của thiết bị trong quá trình chuẩn bị và sử dụng;
2) vị trí của kết nối tuần hoàn ngoài cơ thể;
3) các quy trình mồi, rửa sạch và kết thúc được khuyến nghị;
4) hướng của dòng máu, nếu có;
5) một sơ đồ tuần hoàn điển hình;
6) nhu cầu chống đông máu và tuyên bố tuân theo đơn thuốc của bác sĩ;
7) chi tiết của bất kỳ thiết bị phụ trợ nào được yêu cầu;
d) thận trọng và cảnh báo:
1) giới hạn áp suất, nếu có;
2) giới hạn tốc độ dòng máu, nếu có;
3) hướng dẫn rửa sạch và mồi thiết bị theo khuyến cáo trước khi sử dụng;
4) nhu cầu về bất kỳ thiết bị đặc biệt nào;
5) danh sách các phản ứng bất lợi đã biết;
6) danh sách các chống chỉ định chung và cụ thể, ví dụ “Không khuyến khích sử dụng cho trẻ em”;
7) các cảnh báo thích hợp và các chỉ dẫn về việc giảm hiệu suất nếu thiết bị được sử dụng dưới tốc độ dòng chảy nhất định, dưới một áp suất nhất định hoặc theo các hướng cụ thể (ngang, dọc);
8) cảnh báo "Không sử dụng thiết bị nếu gói bị hư hỏng." Nếu các nắp bảo vệ cuối được sử dụng để bảo vệ vô trùng, thì công bố “Không sử dụng thiết bị nếu các nắp cuối bảo vệ không đúng vị trí”;
e) mã nhận dạng của nhà sản xuất (chẳng hạn như số danh mục hoặc số kiểu máy) cho thiết bị;
f) một công bố về tính vô khuẩn và tính không gây sốt; có hai khả năng:
1) toàn bộ nội dung của gói là vô khuẩn;
2) đường dẫn chất lỏng (máu và dịch lọc) là vô khuẩn;
g) phương pháp tiệt khuẩn
h) một công bố về sử dụng một lần;
i) dữ liệu hiệu suất của thiết bị phải được bao gồm hoặc tham chiếu đến. Dữ liệu hiệu suất cho thiết bị phải bao gồm diện tích bề mặt màng, đặc tính lọc, hệ số sàng lọc [một hoặc nhiều albumin, immunoglobulin M (IgM) và β-lipoprotein], giảm huyết áp bên cạnh và thể tích ngăn chứa máu cho thiết bị;
Dữ liệu hiệu suất phải bao gồm hoặc tham chiếu đến:
- một công bố, nếu thích hợp, rằng các kết quả in vitro có khả năng khác với các kết quả in vivo, với ước tính về mức độ của sự khác biệt, nếu biết;
- một công bố, nếu thích hợp, rằng kết quả hoạt động có thể thay đổi theo thời gian quan sát;
- các phương pháp thử nghiệm được sử dụng để xác định các đặc tính hoạt động.
j) tên chung và, nếu có, tên thương hiệu của màng;
CHÚ THÍCH: Tên chung của màng dự định bao gồm tên hóa học đầy đủ của vật liệu màng.
k) mô tả chung về thiết bị;
l) các đầu nối được khuyến nghị cho các cửa chất lỏng lọc và / hoặc cửa lọc;
m) nếu các đầu nối ngăn chứa máu không như trong Hình 1, các đầu nối ống dẫn máu tương thích với thiết bị phải được chỉ định;
n) tên chung của vật liệu cấu tạo thiết bị dùng để tiếp xúc trực tiếp hoặc gián tiếp với máu.
Khi các ký hiệu tồn tại như quy định trong ISO 7000 và / hoặc TCVN 6916-1 (ISO 15223-1), có thể được sử dụng như một sự thay thế.
Thư mục tài liệu tham khảo
[1] ISO 7000, Graphical symbols for use on equipment - Index and synopsis. (Các ký hiệu đồ họa sử dụng trên thiết bị - Danh mục và tóm tắt)
[2] ISO 8637-1, Extracorporeal systems for blood purification - Part 1: Haemodialysers, haemodiafilters, haemofilters and haemoconcentrators (Các hệ thống ngoài cơ thể cho lọc máu - Phần 1: Thiết bị thẩm tách máu, thẩm lọc máu, lọc máu và thiết bị cô máu)
[3] TCVN 7392-1 (ISO 11135-1), Tiệt khuẩn sản phẩm chăm sóc sức khỏe - Etylen oxit - Phần 1: Yêu cầu triển khai, đánh giá xác nhận và kiểm soát thường quy quá trình tiệt khuẩn đối với thiết bị y tế
[4] TCVN 7392-2 (ISO/TS 11135-2), Tiệt khuẩn sản phẩm chăm sóc sức khỏe - Etylen oxit - Phần 2: Hướng dẫn áp dụng TCVN 7392-1 (ISO 11135-1).
[5] TCVN 7393-1 (ISO 11137-1), Tiệt khuẩn sản phẩm chăm sóc sức khỏe - Bức xạ - Phần 1: Yêu cầu triển khai, đánh giá xác nhận và kiểm soát thường quy quá trình tiệt khuẩn đối với thiết bị y tế
[6] TCVN 7393-2 (ISO 11137-2), Tiệt khuẩn sản phẩm chăm sóc sức khỏe - Bức xạ- Phần 2: Thiết lập liều tiệt khuẩn
[7] TCVN 7393-3 (ISO 11137-3), Tiệt khuẩn sản phẩm chăm sóc sức khỏe - Bức xạ - Phần 3: Hướng dẫn các vấn đề về đo liều
[8] TCVN ISO 13485, Trang thiết bị y tế - Hệ thống quản lý chất lượng - Yêu cầu đối với mục đích chế định)
[9] TCVN 8582 (ISO 14937), Tiệt khuẩn sản phẩm chăm sóc sức khỏe - Yêu cầu chung đối với đặc tính của tác nhân tiệt khuẩn, triển khai, đánh giá xác nhận và kiểm soát thường quy quá trình tiệt khuẩn thiết bị y tế
[10] TCVN 6916-1 (ISO 15223-1) Trang thiết bị y tế - Ký hiệu sử dụng với nhãn trang thiết bị y tế, ghi nhãn và cung cấp thông tin - Phần 1: Yêu cầu chung.
[11] ISO 15223-2, Medical devices - Symbols to be used with medical device labels, labelling, and information to be supplied - Part 2: Symbol development, selection and validation (Trang thiết bị y tế - Ký hiệu sử dụng với nhãn trang thiết bị y tế, ghi nhãn và cung cấp thông tin - Phần 2: Phát triển, lựa chọn và xác nhận ký hiệu)
[12] ISO 17665-1, Sterilization of health care products - Moist heat - Part 1: Requirements for the development, validation and routine control of a sterilization process for medical devices (Tiệt khuẩn sản phẩm chăm sóc sức khỏe - Nhiệt ẩm - Phần 1: Yêu cầu đối với việc phát triển, xác nhận và kiểm soát thường quy quy trình tiệt khuẩn đối với thiết bị y tế)
[13] ISO/TS 17665-2, Sterilization of health care products - Moist heat - Part 2: Guidance on the application of ISO 17665-1 (Tiệt khuẩn sản phẩm chăm sóc sức khỏe - Nhiệt ẩm - Phần 2: Hướng dẫn áp dụng ISO 17665-1)
Mục lục
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Thuật ngữ và định nghĩa
4 Yêu cầu
5 Phương pháp thử nghiệm
6 Ghi nhãn
Thư mục tài liệu tham khảo
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 13376-3:2021 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 13376-3:2021 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 13376-3:2021 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 13376-3:2021 DOC (Bản Word)