- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 7391-9:2023 Đánh giá sinh học trang thiết bị y tế - Phần 9
| Số hiệu: | TCVN 7391-9:2023 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Y tế-Sức khỏe |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
03/03/2023 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 7391-9:2023
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 7391-9:2023
TIÊU CHUẨN QUỐC GIA
TCVN 7391-9:2023
ISO 10993-9:2019
ĐÁNH GIÁ SINH HỌC TRANG THIẾT BỊ Y TẾ - PHẦN 9: KHUNG NHẬN DẠNG VÀ ĐỊNH LƯỢNG SẢN PHẨM PHÂN HỦY TIỀM ẨN
Biological evaluation of medical devices - Part 9: Framework for identification and quantification of potential degradation products
Lời nói đầu
TCVN 7391-9:2023 hoàn toàn tương đương với ISO 10993-9:2019.
TCVN 7391-9:2023 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC194 Đánh giá sinh học và lâm sàng trang thiết bị y tế biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
Bộ TCVN 7391 (ISO 10993), Đánh giá sinh học trang thiết bị y tế, gồm các tiêu chuẩn sau:
- TCVN 7391-1:2023 (ISO 10993-1:2018), Phần 1: Đánh giá và thử nghiệm trong phạm vi một quá trình quản lý rủi ro
- TCVN 7391-2:2020 (ISO 10993-2:2006), Phần 2: Yêu cầu sử dụng động vật
- TCVN 7391-3:2020 (ISO 10993-3:2014), Phần 3: Phép thử độc tính di truyền, khả năng gây ung thư và độc tính sinh sản
- TCVN 7391-4:2020 (ISO 10993-4:2017), Phần 4: Lựa chọn phép thử tương tác với máu
- TCVN 7391-5:2020 (ISO 10993-5:2009), Phần 5: Phép thử độc tính tế bào in vitro
- TCVN 7391-6:2020 (ISO 10993-6:2016), Phần 6: Phép thử hiệu ứng tại chỗ sau cấy ghép
- TCVN 7391-7:2004 (ISO 10993-7:1995), Phần 7: Dư lượng sau tiệt trùng bằng etylen oxit
- TCVN 7391-9:2023 (ISO 10993-9:2019), Phần 9: Khung nhận dạng và định lượng sản phẩm phân hủy tiềm ẩn
- TCVN 7391-10:2002 (ISO 10993-10:2007), Phần 10: Phép thử kích thích và quá mẫn muộn
- TCVN 7391-11:2020 (ISO 10993-11:2017), Phần 11: Phép thử độc tính toàn thân
- TCVN 7391-12:2023 (ISO 10993-12:2021), Phần 12: Chuẩn bị mẫu và mẫu chuẩn
- TCVN 7391-13:2023 (ISO 10993-13:2010), Phần 13: Nhận dạng và định lượng sản phẩm phân hủy từ trang thiết bị y tế polyme
- TCVN 7391-14:2007 (ISO 10993-14:2001), Phần 14: Nhận dạng và định lượng sản phẩm phân hủy từ gốm sứ
- TCVN 7391-15:2023 (ISO 10993-15:2019), Phần 15: Nhận dạng và định lượng sản phẩm phân hủy từ kim loại và hợp kim
- TCVN 7391-16:2020 (ISO 10993-16:2017), Phần 16: Thiết kế nghiên cứu độc lực cho sản phẩm phân hủy và ngâm chiết
- TCVN 7391-17:2007 (ISO 10993-17:2002), Phần 17: Thiết lập giới hạn cho phép của chất ngâm chiết
- TCVN 7391-18:2023 (ISO 10993-18:2020), Phần 18: Đặc trưng hóa học của vật liệu trang thiết bị y tế trong phạm vi một quá trình quản lý rủi ro
- TCVN 7391-19:2023 (ISO/TS 10993-19:2020), Phần 19: Đặc trưng hóa-lý, hình thái cấu trúc và hình thái bề mặt của vật liệu
Bộ ISO 10993 còn các tiêu chuẩn sau:
- ISO/TS 10993-20:2006, Biological evaluation of medical devices - Part 20: Principles and methods for immunotoxicology testing of medical devices
- ISO/TR 10993-22:2017, Biological evaluation of medical devices - Part 22: Guidance on nanomaterials
- ISO/TR 10993-23:2021, Biological evaluation of medical devices - Part 23: Tests for irritation
- ISO/TR 10993-33:2015, Biological evaluation of medical devices - Part 33: Guidance on tests to evaluate genotoxicity - Supplement to ISO 10993-3
Lời giới thiệu
Tiêu chuẩn này nhằm đưa ra các nguyên tắc chung dựa trên việc điều tra vật liệu cụ thể để nhận dạng và định lượng các sản phẩm phân hủy được mô tả trong TCVN 7391-13 (ISO 10993-13) (polyme), TCVN 7391-14 (ISO 10993-14) (gốm) và TCVN 7391-15 (ISO 10993-15) (kim loại và hợp kim).
Thông tin thu được từ các nghiên cứu này nhằm mục đích sử dụng trong các đánh giá sinh học được mô tả trong các phần còn lại của Bộ TCVN 7391 (ISO 10993).
Các vật liệu được sử dụng để cấu tạo các trang thiết bị y tế có thể tạo thành các sản phẩm phân hủy khi phơi nhiễm với môi trường sinh học và trong cơ thể các sản phẩm này có thể hoạt động khác với vật liệu dạng rời.
Tiêu chuẩn này không áp dụng đối với sự mài mòn cơ học, gây ra chủ yếu là do các mảnh vụn dạng hạt, trong khi sự phân hủy không cơ học có thể dẫn đến việc thôi ra các ion tự do hoặc các loại sản phẩm phản ứng khác nhau ở dạng các hợp chất hữu cơ hoặc vô cơ.
Các sản phẩm phân hủy có thể phản ứng hoặc ổn định và không có phản ứng sinh hóa với môi trường của chúng. Việc tích lũy một lượng đáng kể các sản phẩm phân hủy ổn định có thể gây ra các tác động vật lý lên các mô xung quanh. Các sản phẩm phân hủy có thể vẫn ở vị trí tạo ra chúng hoặc có thể được vận chuyển trong môi trường sinh học bằng nhiều cơ chế khác nhau.
Mức độ dung nạp sinh học của các sản phẩm phân hủy phụ thuộc vào bản chất và nồng độ của chúng và cần được đánh giá chủ yếu thông qua kinh nghiệm lâm sàng và các nghiên cứu tập trung. Đối với các sản phẩm phân hủy có thể có về mặt lý thuyết, mới và/hoặc không rõ, thực hiện thử nghiệm liên quan là cần thiết. Đối với các sản phẩm phân hủy được mô tả tốt và được chấp nhận về mặt lâm sàng, có thể không cần điều tra thêm.
Lưu ý tính an toàn và hiệu quả của trang thiết bị y tế có thể bị ảnh hưởng do sự phân hủy sớm hoặc không biết trước, điều này cần được xem xét trong quản lý rủi ro của thiết bị.
Tiêu chuẩn này có thể áp dụng cho sự phân hủy của vật liệu được sử dụng trong các loại sản phẩm thuộc phạm vi định nghĩa “trang thiết bị y tế” trong TCVN 7391-1 (ISO 10993-1), ngay cả khi các sản phẩm đó phải tuân theo các quy định khác với các quy định áp dụng cho trang thiết bị y tế, ví dụ: giá đỡ trong một sản phẩm y tế được thiết kế mô, hoặc một chất nền để phân phối thuốc hoặc sinh học.
ĐÁNH GIÁ SINH HỌC TRANG THIẾT BỊ Y TẾ - PHẦN 9: KHUNG NHẬN DẠNG VÀ ĐỊNH LƯỢNG SẢN PHẨM PHÂN HỦY TIỀM ẨN
Biological evaluation of medical devices - Part 9: Framework for identification and quantification of potential degradation products
1 Phạm vi áp dụng
Tiêu chuẩn này đưa ra các nguyên tắc chung để đánh giá một cách có hệ thống sự phân hủy tiềm ẩn và quan sát được của các trang thiết bị y tế thông qua việc thiết kế và thực hiện các nghiên cứu phân hủy in vitro. Thông tin thu được từ các nghiên cứu này có thể được sử dụng trong đánh giá sinh học được mô tả trong Bộ TCVN 7391 (ISO 10993).
Tiêu chuẩn này có thể áp dụng cho cả vật liệu được thiết kế để phân hủy trong cơ thể cũng như vật liệu không nhằm mục đích phân hủy.
Tiêu chuẩn này không áp dụng cho:
a) đánh giá sự phân hủy xảy ra bởi các quá trình cơ học thuần túy; các phương pháp luận để sản xuất loại sản phẩm phân hủy này được mô tả trong các tiêu chuẩn sản phẩm cụ thể, nếu có;
CHÚ THÍCH: Sự phân hủy hoàn toàn về cơ học chủ yếu là vật chất dạng hạt. Mặc dù điều này được loại trừ khỏi phạm vi của tiêu chuẩn này, nhưng các sản phẩm phân hủy như vậy có thể tạo ra phản ứng sinh học và có thể trải qua quá trình đánh giá sinh học như được mô tả trong các phần khác của Bộ TCVN 7391 (ISO 10993).
b) các thành phần chất ngâm chiết không phải là sản phẩm phân hủy;
c) các trang thiết bị y tế hoặc các thành phần của trang thiết bị y tế không tiếp xúc trực tiếp hoặc gián tiếp với cơ thể bệnh nhân.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau đây là cần thiết để áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 7391-1 (ISO 10993-1), Đánh giá sinh học trang thiết bị y tế - Phần 1: Đánh giá và thử nghiệm trong phạm vi một quá trình quản lý rủi ro
TCVN 7391-2 (ISO 10993-2), Đánh giá sinh học trang thiết bị y tế - Phần 2: Yêu cầu sử dụng động vật
TCVN 7391-13 (ISO 10993-13), Đánh giá sinh học trang thiết bị y tế - Phần 13: Nhận dạng và định lượng sản phẩm phân hủy từ trang thiết bị y tế polyme
TCVN 7391-14 (ISO 10993-14), Đánh giá sinh học trang thiết bị y tế - Phần 14: Nhận dạng và định lượng sản phẩm phân hủy từ gốm sứ
TCVN 7391-15 (ISO 10993-15), Đánh giá sinh học trang thiết bị y tế - Phần 15: Nhận dạng và định lượng sản phẩm phân hủy từ kim loại và hợp kim
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này, áp dụng các thuật ngữ, định nghĩa sau:
3.1
Phân hủy (degradation)
Sự tan rã của một vật liệu.
3.2
Hấp thụ (absorb)
Hoạt động của một vật liệu hoặc chất không nội sinh (ngoại lai) đi qua hoặc được đồng hóa bởi tế bào và/hoặc mô theo thời gian.
3.3
Chất ngâm chiết (leachable)
Các chất có thể bị thôi ra khỏi trang thiết bị y tế hoặc vật liệu trong quá trình sử dụng lâm sàng.
3.4
Ăn mòn (corrosion)
Sự tác động vào vật liệu kim loại bằng phản ứng hóa học hoặc điện hóa.
CHÚ THÍCH 1: Thuật ngữ này đôi khi được sử dụng theo nghĩa chung để chỉ sự hư hỏng của các vật liệu khác nhưng trong tiêu chuẩn này dành riêng cho các vật liệu kim loại.
3.5
Chất (substance)
Nguyên tố hóa học đơn lẻ hoặc hợp chất, hoặc một cấu trúc phức tạp của các hợp chất.
3.6
Thành phần (component)
Một trong những phần khác nhau cấu tạo nên một thiết bị.
3.7
Sản phẩm phân hủy (degradation product)
Hạt hoặc hợp chất hóa học có nguồn gốc từ sự phân hủy hóa học của vật liệu ban đầu.
3.8
Môi trường sử dụng (service environment)
Vị trí giải phẫu cho mục đích sử dụng của thiết bị bao gồm chất lỏng, mô và phân tử sinh học xung quanh.
4 Nguyên tắc thiết kế các nghiên cứu phân hủy
4.1 Yêu cầu chung
Cách tiếp cận để đánh giá sự phân hủy thay đổi theo bản chất của vật liệu được khảo sát, trang thiết bị y tế và vị trí giải phẫu của thiết bị cụ thể. Các mô hình phân hủy in vitro được chọn để đánh giá phải đại diện cho các yếu tố này. Các nghiên cứu sẽ được thực hiện không yêu cầu một môi trường sinh học, nhưng yêu cầu một môi trường mô phỏng các điều kiện của mục đích sử dụng lâm sàng.
Kinh nghiệm cho thấy một số mô hình in vitro không phản ánh tất cả các khía cạnh của môi trường sử dụng (ví dụ: các quá trình cơ học) có thể ảnh hưởng đến quá trình phân hủy. Tất cả các yếu tố như vậy cần được tính đến khi lập mô hình môi trường sử dụng in vitro.
Kinh nghiệm cũng cho thấy những thay đổi thuộc tính vật liệu trong quá trình phân hủy có thể dẫn đến các phản ứng sinh học khác nhau. Người sử dụng được khuyến khích nhận thức về những thay đổi thuộc tính đó và áp dụng các tiêu chuẩn liên quan dành riêng cho vật liệu (ví dụ: sự kết tinh của polyme).
Các tiêu chuẩn phân hủy dành riêng cho vật liệu hoặc sản phẩm cụ thể nhằm nhận dạng và định lượng các sản phẩm phân hủy cần được xem xét khi thiết kế các nghiên cứu về sự phân hủy. TCVN 7391-13 (ISO 10993-13) (đối với polyme), TCVN 7391-14 (ISO 10993-14) (đối với gốm sứ) hoặc TCVN 7391-15 (ISO 10993-15) (đối với kim loại và hợp kim) sẽ được áp dụng nếu không có tiêu chuẩn cụ thể về vật liệu phù hợp. Các thiết bị được cấu tạo từ hai hoặc nhiều loại vật liệu nên xem xét tất cả các tiêu chuẩn phân hủy có liên quan.
TCVN 7391-13 (ISO 10993-13), TCVN 7391-14 (ISO 10993-14) và TCVN 7391-15 (ISO 10993-15) chỉ xem xét những sản phẩm phân hủy được tạo ra bởi sự thay đổi hóa học của thiết bị thành phẩm. Các tiêu chuẩn này không áp dụng cho sự phân hủy của thiết bị do ứng suất cơ học, mài mòn hoặc bức xạ điện từ gây ra trong quá trình sử dụng dự kiến. Đối với sự phân hủy như vậy các phương pháp khác nên được xem xét.
4.2 Xem xét sơ bộ
Việc xem xét cẩn thận khả năng phân hủy dự kiến hoặc ngoài ý muốn của vật liệu là điều cần thiết để đánh giá tính an toàn sinh học của thiết bị. Một phần của việc xem xét này là đánh giá các đặc trưng hóa học và các cơ chế phân hủy đã biết, sau đó là đánh giá sự cần thiết và thiết kế các nghiên cứu về sự phân hủy trong thực nghiệm.
Việc tiến hành các nghiên cứu về sự phân hủy đối với tất cả các trang thiết bị y tế là không cần thiết và cũng không thực tế. Tham khảo Phụ lục A để xác định thời điểm cần xem xét các nghiên cứu về sự phân hủy. Đánh giá nhu cầu đối với các nghiên cứu phân hủy thực nghiệm phải bao gồm việc xem xét các tài liệu và/hoặc kinh nghiệm lâm sàng được ghi lại. Hướng dẫn về việc xem xét tài liệu một cách thích hợp xem trong TCVN 7391-1 (ISO 10993-1). Việc đánh giá như vậy có thể dẫn đến kết luận không cần thử nghiệm thêm.
Hướng dẫn về đánh giá sinh học của chất ngâm chiết bao gồm cả các sản phẩm phân hủy được nêu trong TCVN 7391-1 (ISO 10993-1), TCVN 7391-16 (ISO 10993-16) và TCVN 7391-17 (ISO 10993-17). Xem TCVN 7391-18 (ISO 10993-18) để biết hướng dẫn về đặc trưng hóa học của vật liệu và chất ngâm chiết của chúng được sử dụng trong các trang thiết bị y tế. Xem TCVN 7391-19 (ISO/TS 10993-19) để biết hướng dẫn về đặc trưng lý hóa, hình thái cấu trúc và hình thái bề mặt của vật liệu. Việc xem xét các tiêu chuẩn này trước khi tiến hành các nghiên cứu phân hủy có thể hữu ích trong việc phân biệt các sản phẩm phân hủy với các chất ngâm chiết khác.
CHÚ THÍCH: Mặc dù có sự khác biệt giữa các sản phẩm phân hủy và các chất ngâm chiết khác, nhưng có thể kết hợp nghiên cứu về các sản phẩm phân hủy với nghiên cứu về các thành phần chất ngâm chiết khác. Việc phân biệt giữa các sản phẩm phân hủy và các loại chất ngâm chiết khác có thể không cần thiết cho các nghiên cứu đánh giá sinh học tiếp theo. Tuy nhiên, khi việc giảm mức độ các thành phần chất ngâm chiết được coi là cần thiết để kiểm soát rủi ro, thì việc phân biệt này rất quan trọng. Ngoài ra, một số sản phẩm phân hủy không thể ngâm chiết khỏi thiết bị nhưng vẫn có thể tác động đến các thuộc tính của thiết bị.
4.3 Thiết kế nghiên cứu
Một kế hoạch nghiên cứu phân hủy hoàn chỉnh với mục đích của nghiên cứu phải được thiết kế và lập thành văn bản để giải quyết các vấn đề được xác định trong 4.1. Kế hoạch nghiên cứu đã được phê duyệt phải xác định các phương pháp phân tích để khảo sát các đặc trưng sau của sản phẩm phân hủy:
a) các đặc tính hóa học;
b) các đặc tính hóa lý;
c) hình thái vật lý (nếu có).
Kế hoạch nghiên cứu đã được phê duyệt cũng phải mô tả các phương pháp được sử dụng để tạo ra các sản phẩm phân hủy. Các phương pháp tạo ra các sản phẩm phân hủy phải được tối ưu hóa và chứng minh một cách khoa học. Các sản phẩm phân hủy phải được xác định và định lượng bằng cách sử dụng các phương pháp được mô tả trong TCVN 7391-18 (ISO 10993-18).
Kế hoạch nghiên cứu đã được phê duyệt cho các thiết bị nhiều thành phần phải tính đến từng thành phần/vật liệu riêng lẻ và phải xem xét các tác động tổng hợp lên sự phân hủy của các thành phần khác nhau cũng như khả năng xảy ra phản ứng thứ cấp giữa/trong số các sản phẩm phân hủy.
CHÚ THÍCH: Trong hầu hết các trường hợp, sự phân hủy có thể được mô hình hóa bằng các thử nghiệm in vitro. Trong quá trình phân hủy, pH cần được kiểm soát đến một phạm vi phù hợp về mặt lâm sàng, đặc biệt nếu pH có thể ảnh hưởng đến thành phần sản phẩm phân hủy. Người sử dụng cần lưu ý cả tốc độ phân hủy và lượng sản phẩm phụ được tạo ra đều có thể bị ảnh hưởng nếu độ pH cần được kiểm soát trong một phạm vi phù hợp về mặt lâm sàng.
4.4 Đặc trưng của sản phẩm phân hủy từ trang thiết bị y tế
Các sản phẩm phân hủy được tạo ra trong nghiên cứu có thể là các hợp chất hoặc ion dạng hạt hoặc hòa tan. Các phương pháp phân tích thích hợp để đặc trưng cho các sản phẩm này phải được sử dụng và báo cáo trong báo cáo nghiên cứu. Các phương pháp này phải đủ tiêu chuẩn cho mục đích dự kiến của chúng. Nếu các hạt được tạo ra, chúng phải được đặc trưng về kích thước, hình dạng, diện tích bề mặt và các đặc điểm liên quan khác.
Vì các đặc tính vật lý và hóa học của vật liệu dạng hạt có thể thay đổi ở kích thước nano (khoảng 1 nm đến 100 nm), điều này có thể ảnh hưởng đến các đặc tính độc tính của chúng. Đối với những trang thiết bị y tế được cấu tạo từ hoặc chứa vật liệu có kích thước nano, người dùng được tham khảo ISO/TR 10993-22 để xem xét kỹ lưỡng về tác động đối với việc đánh giá rủi ro của các sản phẩm có kích thước nano.
Nếu cần đánh giá sinh học đối với các sản phẩm phân hủy, thì phải cẩn thận trong quá trình thiết kế nghiên cứu phân hủy để đảm bảo không gây trở ngại cho quá trình xét nghiệm sinh học.
Các xem xét đối với nghiên cứu phân hủy được cung cấp trong Phụ lục B. Thủ tục này phải bao gồm:
a) nhận dạng và đặc trưng của thiết bị và/hoặc vật liệu và mục đích sử dụng,
b) nhận dạng và đặc trưng của cơ chế phân hủy có thể xảy ra,
c) nhận dạng và đặc trưng của các sản phẩm phân hủy đã biết, có thể xảy ra và tiềm ẩn, và
d) các phương pháp luận của thử nghiệm.
Mức độ và tốc độ thôi ra các sản phẩm phân hủy phụ thuộc vào các biến số như quy trình sản xuất làm thay đổi thành phần và cấu trúc bề mặt; di chuyển đến bề mặt từ bên trong vật liệu; độ hòa tan và thành phần hóa học, môi trường sinh lý; v.v...
5 Báo cáo nghiên cứu
Báo cáo nghiên cứu phải bao gồm các thông tin sau, nếu có liên quan:
a) mô tả các vật liệu hoặc thiết bị (xem B.2), bao gồm mục đích sử dụng và bản chất của tiếp xúc với cơ thể;
b) mô tả các cơ chế phân hủy được đề xuất (ví dụ: thủy phân, enzym, oxy hóa, v.v...), và cách nghiên cứu phân hủy được thiết kế thích hợp để đánh giá các cơ chế được đề xuất;
c) mô tả các quy trình nghiên cứu sự phân hủy (ví dụ: vật phẩm thử nghiệm, cỡ mẫu, môi trường phân hủy, tỷ lệ vật phẩm thử nghiệm so với vật liệu phân hủy, điều kiện nghiên cứu, các bước và thông số thử nghiệm, chiến lược lấy mẫu, giám sát và quan sát, v.v...);
d) mô tả các phương pháp phân tích, bao gồm các giới hạn định lượng và các đối chứng;
e) tuyên bố về sự tuân thủ các thực hành tốt phòng thí nghiệm phù hợp và/hoặc hệ thống quản lý chất lượng cho các phòng thử nghiệm (ví dụ: TCVN ISO/IEC 17025);
f) nhận dạng và định lượng các sản phẩm phân hủy (ví dụ: định dạng và tình trạng của các sản phẩm phân hủy, độ ổn định và đối chứng được sử dụng);
g) tóm tắt kết quả;
h) diễn giải và thảo luận về kết quả.
Phụ lục A
(quy định)
Xem xét sự cần thiết của các nghiên cứu phân hủy
Các nghiên cứu về sự phân hủy phải được xem xét nếu:
a) thiết bị được thiết kế để cơ thể hấp thụ hoặc
b) thiết bị dự định sẽ được cấy ghép lâu hơn ba mươi ngày hoặc
c) việc xem xét kỹ các hệ thống vật liệu chỉ ra các sản phẩm phân hủy độc hại có thể bị thôi ra khi tiếp xúc với cơ thể.
Tuy nhiên, có thể không cần nghiên cứu sự phân hủy nếu có đủ công thức vật liệu và thông tin về quy trình sản xuất và đã có dữ liệu về sự phân hủy liên quan đến các sản phẩm phân hủy với mục đích sử dụng dự kiến.
CHÚ THÍCH: Dữ liệu phân hủy liên quan có thể bao gồm thông tin về cơ chế phân hủy, tốc độ phân hủy, nhận dạng và định lượng sản phẩm phân hủy, hình dạng/kích thước và sự phân bố của hạt.
Sự cần thiết của các nghiên cứu in vivo phải được xem xét dựa trên kết quả của các nghiên cứu in vitro.
Khi thích hợp, các thí nghiệm in vitro phải được xem xét để khảo sát các quá trình phân hủy có thể xảy ra về mặt lý thuyết. Các nghiên cứu in vivo phải xem xét TCVN 7391-2 (ISO 10993-2). Các nghiên cứu in vivo và in vitro cũng phải được xem xét để xác định xác suất xảy ra sự phân hủy và nhận dạng các sản phẩm phân hủy có thể xảy ra và tốc độ phân hủy.
Lưu đồ trong Hình A.1 minh họa logic áp dụng cho những xem xét này. Đối với các polyme được dùng để phân hủy do thủy phân, ví dụ: polylactide, người sử dụng tham khảo ISO 13781.
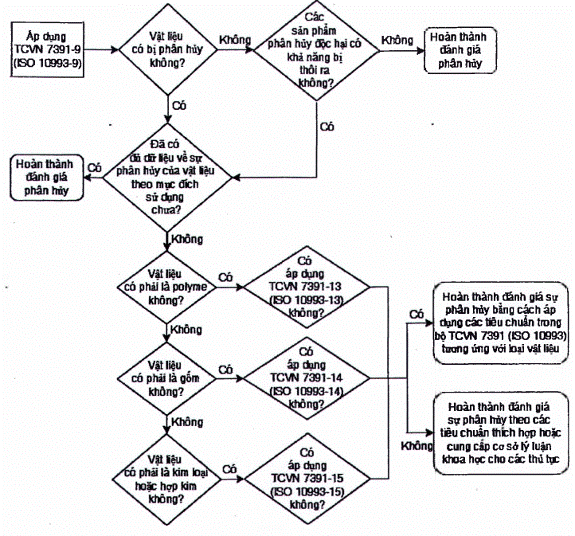
Hình A.1 - Lưu đồ minh họa việc xem xét nhu cầu nghiên cứu phân hủy
Phụ lục B
(tham khảo)
Xem xét nghiên cứu phân hủy
B.1 Yêu cầu chung
Phụ lục này bao gồm các khía cạnh cần được xem xét khi đánh giá khả năng phân hủy.
Các nghiên cứu thực tế thích hợp cần được xem xét trong trường hợp thiếu thông tin thiết yếu về sự phân hủy của thiết bị hoặc vật liệu và các tác động sinh học của các sản phẩm có khả năng phân hủy.
B.2 Mô tả thiết bị và/hoặc vật liệu y tế
Những điều sau đây cần được xem xét khi mô tả thiết bị hoặc vật liệu đang nghiên cứu:
a) tên của thiết bị và/hoặc vật liệu y tế;
b) chức năng của trang thiết bị y tế;
c) mục đích sử dụng;
d) môi trường sinh học dự kiến;
e) thành phần của vật liệu;
f) ổn định vật liệu (ví dụ, chế biến, khử trùng);
g) tình trạng bề mặt;
h) kích thước;
i) kết cấu của thiết bị hoặc vật liệu đang được nghiên cứu (ví dụ: đơn thành phần, đơn thành phần duy nhất được sử dụng với những yếu tố khác và bản chất của sự tương tác của chúng, hoặc thiết bị đa thành phần - đánh giá được thực hiện đối với từng vật liệu thành phần);
j) thời gian tiếp xúc;
k) thời hạn sử dụng;
CHÚ THÍCH: Đối với một số sản phẩm, việc bảo quản có thể ảnh hưởng đến sự phân hủy và do đó các nghiên cứu về sự phân hủy để hỗ trợ thời hạn sử dụng được dán nhãn có thể rất quan trọng.
l) các đặc trưng liên quan khác.
B.3 Đánh giá các sản phẩm phân hủy tiềm ẩn và đã biết
B.3.1 Yêu cầu chung
Sự phân hủy của vật liệu có thể xảy ra trong phạm vi vật liệu dạng rời hoặc phần lớn vật liệu. Sự phân hủy cũng có thể xảy ra ở bề mặt vật liệu. Cả sự phân hủy dạng rời và bề mặt đều có thể xảy ra đồng thời và có thể ảnh hưởng lẫn nhau.
B.3.2 Thay đổi vật liệu dạng rời
Những thay đổi có chủ định hoặc ngoài ý muốn đối với vật liệu dạng rời có thể dẫn đến các sản phẩm phân hủy dạng hạt và có thể ảnh hưởng đến sự ổn định của bề mặt. Ví dụ: thay đổi vật liệu dạng rời có thể xảy ra như sau:
- trong quá trình chế tạo;
- trong quá trình khử trùng;
- trong quá trình bảo quản và do không ổn định;
- trong khi cấy ghép và khi đã được cấy ghép;
- trong quá trình thay đổi trạng thái vật lý (trương nở, chuyển pha, v.v...);
- bằng cách phân hủy in vivo dự định.
B.3.3 Sự thôi ra các chất khỏi bề mặt
Sự thôi ra các chất khỏi bề mặt có thể được tạo ra bởi các quá trình như sau:
- phản ứng hóa học (ví dụ: khử trùng hợp);
- ngâm chiết;
- khuếch tán;
- bong tróc, tróc vảy.
B.3.4 Thiết bị hoặc thiết bị đa thành phần được sử dụng với các thành phần khác
Ngoài những xem xét đối với hệ thống đơn thành phần, cần phải giải quyết các mục như sau:
- sự cố kết cấu;
- sự tách lớp;
- sự di chuyển của các chất từ thành phần này sang thành phần khác;
- khả năng xảy ra phản ứng giữa/trong số các sản phẩm phân hủy.
Thư mục tài liệu tham khảo
[1] ISO 10271, Dentistry - Corrosion test methods for metallic materials (Nha khoa - Phương pháp thử ăn mòn đối với vật liệu kim loại)
[2] TCVN 7391-16 (ISO 10993-16), Đánh giá sinh học trang thiết bị y tế - Phần 16: Thiết kế, nghiên cứu độc lực cho sản phẩm phân hủy và ngâm chiết
[3] TCVN 7391-17 (ISO 10993-17), Đánh giá sinh học trang thiết bị y tế - Phần 17: Thiết lập giới hạn cho phép của chất ngâm chiết
[4] TCVN 7391-18 (ISO 10993-18), Đánh giá sinh học trang thiết bị y tế - Phần 18: Đặc trưng hóa học của vật liệu trang thiết bị y tế trong phạm vi một quá trình quản lý rủi ro
[5] TCVN 7391-19 (ISO/TS 10993-19), Đánh giá sinh học trang thiết bị y tế - Phần 19: Đặc trưng hóa-lý, hình thái cấu trúc và hình thái bề mặt của vật liệu
[6] ISO/TR 10993-22, Biological evaluation of medical devices - Part 22: Guidance on nanomaterials (Đánh giá sinh học trang thiết bị y tế - Phần 22: Hướng dẫn về vật liệu nano)
[7] ISO 13781, Implants for surgery - Homopolymers, copolymers and blends on poly(lactide) - In vitro degradation testing (Cấy ghép trong phẫu thuật - Chất đồng phân, chất đồng trùng hợp và chất pha trộn poly(lactide) - Thử nghiệm phân hủy in vitro)
[8] TCVN ISO/IEC 17025, Yêu cầu chung về năng lực của phòng thử nghiệm và hiệu chuẩn
MỤC LỤC
Lời nói đầu
Lời giới thiệu
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Thuật ngữ và định nghĩa
4 Nguyên tắc thiết kế các nghiên cứu phân hủy
4.1 Yêu cầu chung
4.2 Xem xét sơ bộ
4.3 Thiết kế nghiên cứu
4.4 Đặc trưng của sản phẩm phân hủy từ trang thiết bị y tế
5 Báo cáo nghiên cứu
Phụ lục A (quy định) Xem xét sự cần thiết của các nghiên cứu phân hủy
Phụ lục B (tham khảo) Xem xét nghiên cứu về sự phân hủy
Thư mục tài liệu tham khảo
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 7391-9:2023 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 7391-9:2023 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 7391-9:2023 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 7391-9:2023 DOC (Bản Word)