- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 7391-1:2023 Đánh giá sinh học trang thiết bị y tế - Phần 1
| Số hiệu: | TCVN 7391-1:2023 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Y tế-Sức khỏe |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
03/03/2023 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 7391-1:2023
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 7391-1:2023
TIÊU CHUẨN QUỐC GIA
TCVN 7391-1:2023
ISO 10993-1:2018
ĐÁNH GIÁ SINH HỌC TRANG THIẾT BỊ Y TẾ - PHẦN 1: ĐÁNH GIÁ VÀ THỬ NGHIỆM TRONG PHẠM VI MỘT QUÁ TRÌNH QUẢN LÝ RỦI RO
Biological evaluation of medical devices - Part 1: Evaluation and testing within a risk management process
Lời nói đầu
TCVN 7391-1:2023 thay thế TCVN 7391-1:2004.
TCVN 7391-1:2023 hoàn toàn tương đương với ISO 10993-1:2018.
TCVN 7391-1:2023 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC194 Đánh giá sinh học và lâm sàng trang thiết bị y tế biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
Bộ TCVN 7391 (ISO 10993), Đánh giá sinh học trang thiết bị y tế, gồm các tiêu chuẩn sau:
- TCVN 7391-1:2023 (ISO 10993-1:2018), Phần 1: Đánh giá và thử nghiệm trong phạm vi một quá trình quản lý rủi ro
- TCVN 7391-2:2020 (ISO 10993-2:2006), Phần 2: Yêu cầu sử dụng động vật
- TCVN 7391-3:2020 (ISO 10993-3:2014), Phần 3: Phép thử độc tính di truyền, khả năng gây ung thư và độc tính sinh sản
- TCVN 7391-4:2020 (ISO 10993-4:2017), Phần 4: Lựa chọn phép thử tương tác với máu
- TCVN 7391 -5:2020 (ISO 10993-5:2009), Phần 5: Phép thử độc tính tế bào in vitro
- TCVN 7391-6:2020 (ISO 10993-6:2016), Phần 6: Phép thử hiệu ứng tại chỗ sau cấy ghép
- TCVN 7391-7:2004 (ISO 10993-7:1995), Phần 7: Dư lượng sau tiệt trùng bằng etylen oxit
- TCVN 7391-9:2023 (ISO 10993-9:2019), Phần 9: Khung nhận dạng và định lượng sản phẩm phân hủy tiềm ẩn
- TCVN 7391-10:2002 (ISO 10993-10:2007), Phần 10: Phép thử kích thích và quá mẫn muộn
- TCVN 7391-11:2020 (ISO 10993-11:2017), Phần 11: Phép thử độc tính toàn thân
- TCVN 7391-12:2023 (ISO 10993-12:2021), Phần 12: Chuẩn bị mẫu và mẫu chuẩn
- TCVN 7391-13:2023 (ISO 10993-13:2010), Phần 13: Nhận dạng và định lượng sản phẩm phân hủy từ trang thiết bị y tế polyme
- TCVN 7391-14:2007 (ISO 10993-14:2001), Phần 14: Nhận dạng và định lượng sản phẩm phân hủy từ gốm sứ
- TCVN 7391-15:2023 (ISO 10993-15:2019), Phần 15: Nhận dạng và định lượng sản phẩm phân hủy từ kim loại và hợp kim
- TCVN 7391-16:2020 (ISO 10993-16:2017), Phần 16: Thiết kế nghiên cứu độc lực cho sản phầm phân hủy và ngâm chiết
- TCVN 7391-17:2007 (ISO 10993-17:2002), Phần 17: Thiết lập giới hạn cho phép của chất ngâm chiết
- TCVN 7391-18:2023 (ISO 10993-18:2020), Phần 18: Đặc trưng hoá học của vật liệu trang thiết bị y tế trong phạm vi một quá trình quản lý rủi ro
- TCVN 7391-19:2023 (ISO/TS 10993-19:2020), Phần 19: Đặc trưng hóa-lý, hình thái cấu trúc và hình thái bề mặt của vật liệu
Bộ ISO 10993 còn các tiêu chuẩn sau:
- ISO/TS 10993-20:2006, Biological evaluation of medical devices - Part 20: Principles and methods for immunotoxicology testing of medical devices
- ISO/TR 10993-22:2017, Biological evaluation of medical devices - Part 22: Guidance on nanomaterials
- ISO/TR 10993-23:2021, Biological evaluation of medical devices - Part 23: Tests for irritation
- ISO/TR 10993-33:2015, Biological evaluation of medical devices - Part 33: Guidance on tests to evaluate genotoxicity - Supplement to ISO 10993-3
Lời giới thiệu
Mục đích chính của tiêu chuẩn này là bảo vệ con người khỏi các rủi ro sinh học tiềm ẩn phát sinh từ việc sử dụng các trang thiết bị y tế. Tiêu chuẩn này được được xây dựng trên cơ sở chấp nhận ISO 10993-1:2018, được tổng hợp từ nhiều tiêu chuẩn và hướng dẫn quốc tế và quốc gia liên quan đến việc đánh giá sinh học các trang thiết bị y tế. Tiêu chuẩn này nhằm mục đích mô tả việc đánh giá sinh học các trang thiết bị y tế trong một quá trình quản lý rủi ro, như một phần của quá trình đánh giá và phát triển tổng thể của mỗi trang thiết bị y tế. Cách tiếp cận này kết hợp việc xem xét và đánh giá dữ liệu hiện có từ tất cả các nguồn, khi cần thiết, việc lựa chọn và áp dụng các thử nghiệm bổ sung, do đó cho phép đánh giá đầy đủ các đáp ứng sinh học đối với từng trang thiết bị y tế, liên quan đến tính an toàn khi sử dụng. Thuật ngữ “trang thiết bị y tế” có phạm vi rộng và ở một khía cạnh, bao gồm một vật liệu duy nhất, có thể tồn tại ở nhiều dạng vật chất và ở khía cạnh khác, trang thiết bị y tế bao gồm nhiều thành phần được làm từ nhiều vật liệu.
Tiêu chuẩn này đề cập đến việc xác định đáp ứng sinh học đối với trang thiết bị y tế, chủ yếu là theo cách chung, thay vì trong tình huống loại thiết bị cụ thể. Do đó, để đánh giá sinh học toàn diện, tiêu chuẩn này phân loại các trang thiết bị y tế theo bản chất và thời gian tiếp xúc dự kiến của chúng với mô người khi được sử dụng và chỉ ra, trong một ma trận, các điểm cuối sinh học được cho là có liên quan trong việc xem xét từng loại trang thiết bị y tế. Xem 3.14, Chú thích 1.
Phạm vi của các nguy cơ sinh học rất rộng và phức tạp. Không thể xem xét đáp ứng sinh học thuộc một vật liệu cấu thành đơn lẻ tách biệt khỏi thiết kế trang thiết bị y tế tổng thể. Do đó, trong việc thiết kế một trang thiết bị y tế, việc lựa chọn vật liệu tốt nhất liên quan đến tính tương thích sinh học của nó có thể dẫn đến một trang thiết bị y tế kém chức năng hơn, tính tương thích sinh học chỉ là một trong số các đặc điểm cần được xem xét khi đưa ra lựa chọn đó. Trong trường hợp vật liệu được thiết kế để tương tác với mô nhằm thực hiện chức năng của vật liệu, thì việc đánh giá sinh học cần phải giải quyết vấn đề này.
Các đáp ứng sinh học được coi là bất lợi, do vật liệu trong một ứng dụng gây ra, có thể không được coi là như vậy trong một tình huống khác. Thử nghiệm sinh học dựa trên các phương pháp thử in vitro và ex vivo và trên các mô hình động vật, do đó hành vi dự đoán khi một trang thiết bị y tế được sử dụng trên người chỉ có thể được đánh giá một cách thận trọng, vì không thể kết luận rõ đáp ứng sinh học tương tự cũng sẽ xảy ra ở người. Ngoài ra, sự khác biệt trong cách phản ứng với cùng một vật liệu giữa các cá nhân cho thấy một số bệnh nhân có thể có phản ứng bất lợi, ngay cả với các vật liệu đã được thiết kế tốt.
Tiêu chuẩn này có vai trò chính như một khung để lập kế hoạch đánh giá sinh học. Vai trò thứ yếu là sử dụng những tiến bộ khoa học trong hiểu biết của con người về các cơ chế cơ bản, để giảm thiểu số lượng và mức độ phơi nhiễm của động vật thử nghiệm bằng cách ưu tiên các mô hình in vitro và thử nghiệm đặc trưng hóa lý, hình thái cấu trúc và hình thái bề mặt, trong các tình huống mà các phương pháp này mang lại hiệu quả thông tin liên quan tương đương với thông tin thu được từ các mô hình in vivo.
Tiêu chuẩn này không dự kiến đưa ra một tập hợp các phương pháp thử cứng nhắc, bao gồm cả các tiêu chí đạt/không đạt, vì điều này có thể dẫn đến hạn chế không cần thiết đối với việc phát triển và sử dụng các trang thiết bị y tế mới hoặc cảm giác an toàn sai lầm trong việc sử dụng chung các trang thiết bị y tế. Khi một ứng dụng cụ thể đảm bảo điều đó, các chuyên gia về sản phẩm hoặc trong lĩnh vực ứng dụng liên quan có thể chọn thiết lập các thử nghiệm và tiêu chí cụ thể, được mô tả trong tiêu chuẩn dành riêng cho sản phẩm.
Bộ TCVN 7391 (ISO 10993) được thiết kế để sử dụng bởi các chuyên gia, có đủ điều kiện thích hợp được đào tạo và có kinh nghiệm, những người có thể giải thích các yêu cầu của tiêu chuẩn và đánh giá kết quả đánh giá đối với từng trang thiết bị y tế, có xem xét tất cả các yếu tố liên quan đến trang thiết bị y tế, mục đích sử dụng và kiến thức hiện tại về trang thiết bị y tế được cung cấp bằng cách xem xét các tài liệu khoa học và kinh nghiệm lâm sàng trước đó.
Phụ lục A cung cấp thông tin bao gồm một bảng thường hữu ích trong việc nhận dạng các điểm cuối được khuyến nghị trong đánh giá tính tương thích sinh học của trang thiết bị y tế, theo loại tiếp xúc với cơ thể và thời gian phơi nhiễm lâm sàng của chúng. Phụ lục B cung cấp thông tin bao gồm hướng dẫn áp dụng quá trình quản lý rủi ro đối với các trang thiết bị y tế bao gồm đánh giá sinh học.
ĐÁNH GIÁ SINH HỌC TRANG THIẾT BỊ Y TẾ - PHẦN 1: ĐÁNH GIÁ VÀ THỬ NGHIỆM TRONG PHẠM VI MỘT QUÁ TRÌNH QUẢN LÝ RỦI RO
Biological evaluation of medical devices - Part 1: Evaluation and testing within a risk management process
1 Phạm vi áp dụng
Tiêu chuẩn này quy định:
- các nguyên tắc chung điều chỉnh việc đánh giá sinh học các trang thiết bị y tế trong phạm vi một quá trình quản lý rủi ro;
- sự phân loại chung các trang thiết bị y tế dựa trên bản chất và thời gian tiếp xúc với cơ thể;
- đánh giá các dữ liệu liên quan hiện có từ tất cả các nguồn;
- nhận dạng các khoảng trống trong tập dữ liệu sẵn có trên cơ sở phân tích rủi ro;
- nhận dạng các tập dữ liệu bổ sung cần thiết để phân tích tính an toàn sinh học của trang thiết bị y tế;
- đánh giá an toàn sinh học của trang thiết bị y tế.
Tiêu chuẩn này áp dụng để đánh giá các vật liệu và trang thiết bị y tế dự kiến sẽ tiếp xúc trực tiếp hoặc gián tiếp với:
- cơ thể của bệnh nhân trong quá trình sử dụng dự định;
- cơ thể của người dùng, nếu trang thiết bị y tế được sử dụng để bảo vệ (ví dụ: găng tay phẫu thuật, khẩu trang và các loại khác).
Tiêu chuẩn này có thể áp dụng để đánh giá sinh học tất cả các loại trang thiết bị y tế bao gồm trang thiết bị y tế chủ động và không chủ động, cấy ghép và không cấy ghép.
Tiêu chuẩn này cũng đưa ra các hướng dẫn để đánh giá các nguy cơ sinh học phát sinh từ:
- rủi ro, chẳng hạn như những thay đổi đối với trang thiết bị y tế theo thời gian, như một phần của đánh giá an toàn sinh học tổng thể;
- chỗ nứt trang thiết bị y tế hoặc thành phần của trang thiết bị y tế khiến mô cơ thể phơi nhiễm với vật liệu mới hoặc vật liệu mới lạ.
Các phần còn lại của Bộ TCVN 7391 (ISO 10993) bao gồm các khía cạnh cụ thể của các đánh giá sinh học và các thử nghiệm liên quan. Tiêu chuẩn sản phẩm hoặc thiết bị cụ thể đề cập đến việc thử nghiệm cơ học.
Tiêu chuẩn này loại trừ các nguy cơ liên quan đến vi khuẩn, nấm mốc, nấm men, vi rút, tác nhân gây bệnh não xốp truyền nhiễm (TSE) và các tác nhân gây bệnh khác.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau đây là cần thiết để áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 7391-2:2020 (ISO 10993-2:2006), Đánh giá sinh học trang thiết bị y tế - Phần 2: Yêu cầu sử dụng động vật
TCVN 7391-3 (ISO 10993-3), Đánh giá sinh học trang thiết bị y tế - Phần 3: Phép thử độc tính di truyền, khả năng gây ung thư và độc tính sinh sản
TCVN 7391-4 (ISO 10993-4), Đánh giá sinh học trang thiết bị y tế - Phần 4: Lựa chọn phép thử tương tác với máu
TCVN 7391-5 (ISO 10993-5), Đánh giá sinh học trang thiết bị y tế - Phần 5: Phép thử độc tính tế bào in vitro
TCVN 7391-6 (ISO 10993-6), Đánh giá sinh học trang thiết bị y tế - Phần 6: Phép thử hiệu ứng tại chỗ sau cấy ghép
TCVN 7391-7 (ISO 10993-7), Đánh giá sinh học trang thiết bị y tế - Phần 7: Dư lượng sau tiệt trùng bằng etylen oxit
TCVN 7391-9 (ISO 10993-9), Đánh giá sinh học trang thiết bị y tế - Phần 9: Khung nhận dạng và định lượng sản phẩm phân hủy tiềm ẩn
TCVN 7391-10 (ISO 10993-10), Đánh giá sinh học trang thiết bị y tế - Phần 10: Phép thử kích thích và quá mẫn muộn
TCVN 7391-11:2020 (ISO 10993-11:2017), Đánh giá sinh học trang thiết bị y tế - Phần 11: Phép thử độc tính toàn thân
TCVN 7391-12 (ISO 10993-12), Đánh giá sinh học trang thiết bị y tế - Phần 12: Chuẩn bị mẫu và mẫu chuẩn
TCVN 7391-13 (ISO 10993-13), Đánh giá sinh học trang thiết bị y tế - Phần 13: Nhận dạng và định lượng sản phẩm phân hủy từ trang thiết bị y tế polyme
TCVN 7391-14 (ISO 10993-14), Đánh giá sinh học trang thiết bị y tế - Phần 14: Nhận dạng và định lượng sản phẩm phân hủy từ gốm sứ
TCVN 7391-15 (ISO 10993-15), Đánh giá sinh học trang thiết bị y tế - Phần 15: Nhận dạng và định lượng sản phẩm phân hủy từ kim loại và hợp kim
TCVN 7391-16 (ISO 10993-16), Đánh giá sinh học trang thiết bị y tế - Phần 16: Thiết kế nghiên cứu độc lực cho sản phẩm phân hủy và ngâm chiết
TCVN 7391-17 (ISO 10993-17), Đánh giá sinh học trang thiết bị y tế - Phần 17: Thiết lập giới hạn cho phép của chất ngâm chiết
TCVN 7391-18 (ISO 10993-18), Đánh giá sinh học trang thiết bị y tế - Phần 18: Đặc trưng hoá học của vật liệu trang thiết bị y tế trong phạm vi một quá trình quản lý rủi ro
TCVN 8023:2009 (ISO 14971:2007), Trang thiết bị y tế - Áp dụng quản lý rủi ro đối với trang thiết bị y tế
ISO/TS 10993-20, Biological evaluation of medical devices - Part 20: Principles and methods for immunotoxicology testing of medical devices (Đánh giá sinh học trang thiết bị y tế - Nguyên tắc và phương pháp thử nghiệm độc tính miễn dịch đối với trang thiết bị y tế)
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này, áp dụng các thuật ngữ, định nghĩa sau:
3.1
Tính tương thích sinh học (biocompatibility)
Khả năng của trang thiết bị y tế (3.14) hoặc vật liệu (3.12) thực hiện đáp ứng với chủ thể thích hợp trong một ứng dụng cụ thể.
3.2
Rủi ro sinh học (biological, risk)
Sự kết hợp giữa xác suất gây tổn hại cho sức khỏe xảy ra do phản ứng bất lợi liên quan đến tương tác giữa trang thiết bị y tế (3.14) hoặc vật liệu (3.12) và tính nghiêm trọng của tổn hại đó.
3.3
An toàn sinh học (biological safety)
Không gây rủi ro sinh học ở mức không thể chấp nhận được (3.2) khi sử dụng đúng mục đích.
3.4
Thành phần hóa học (chemical constituent)
Bất kỳ chất tổng hợp hoặc tự nhiên nào được sử dụng trong quá trình sản xuất vật liệu (3.12) và/hoặc trang thiết bị y tế (3.14), bao gồm các vật liệu cơ bản, chất phụ gia (chất chống oxy hóa, chất kháng tia cực tím, chất phụ gia màu, thuốc nhuộm, v.v...), và chất hỗ trợ chế biến (dung môi chất bôi trơn, chất chống tạo bọt, v.v...).
3.5
Tập dữ liệu (data set)
Thông tin, chẳng hạn như đặc trưng vật lý và/hoặc hóa học, dữ liệu độc tính, v.v... từ nhiều nguồn khác nhau cần thiết để mô tả đáp ứng sinh học đối với trang thiết bị y tế.
3.6
Tiếp xúc trực tiếp (direct contact)
Trang thiết bị y tế (3.14) hoặc thành phần của trang thiết bị y tế tiếp xúc vật lý với mô cơ thể.
3.7
Trang thiết bị y tế truyền ngoài (externally communicating medical device)
Trang thiết bị y tế (3.14) hoặc bộ phận của trang thiết bị y tế nằm một phần hoặc toàn bộ bên ngoài cơ thể nhưng có tiếp xúc trực tiếp hoặc gián tiếp với chất lỏng bên trong cơ thể và/hoặc các mô.
3.8
Thành phẩm (final product)
Trang thiết bị y tế (3.14) hoặc bộ phận của trang thiết bị y tế đã trải qua tất cả các quá trình sản xuất để tế “được bán trên thị trường” bao gồm cả việc đóng gói và tiệt khuẩn, nếu có.
3.9
Dạng hình học (geometry)
Cấu hình thiết bị (device configuration)
Hình dạng và cách sắp xếp tương đối các bộ phận của trang thiết bị y tế (3.14).
3.10
Cấy ghép (implant)
Trang thiết bị y tế (3.14) được dự định đưa vào cơ thể người hoặc để thay thế mô hoặc biểu mô, bề mặt nhãn cầu (giác mạc) bằng biện pháp can thiệp lâm sàng và được thiết kế để giữ nguyên vị trí sau thủ thuật.
3.11
Tiếp xúc gián tiếp (indirect contact)
Trang thiết bị y tế (3.14) hoặc thành phần của trang thiết bị y tế mà chất lỏng hoặc khí đi qua, trước khi chất lỏng hoặc khí tiếp xúc vật lý với mô cơ thể (trong trường hợp này, trang thiết bị y tế hoặc thành phần trang thiết bị y tế không tự tiếp xúc vật lý với mô cơ thể).
3.12
Vật liệu (material)
Polyme tổng hợp hoặc tự nhiên, kim loại hoặc hợp kim, gốm hoặc composite, kể cả mô không phát triển độc lập, được sử dụng như một trang thiết bị y tế (3.14) hoặc bất kỳ bộ phận nào của chúng.
3.13
Đặc trưng vật liệu (material characterization)
Quá trình rộng và tổng quát thu thập thông tin hiện có về hóa học, cấu trúc và các tính chất khác của vật liệu và nếu thích hợp, dữ liệu mới, để tạo điều kiện thuận lợi cho việc đánh giá các đặc tính này.
3.14
Trang thiết bị y tế (medical device)
Các loại thiết bị, dụng cụ, vật tư cấy ghép, thuốc thử và chất hiệu chuẩn in vitro, phần mềm, vật liệu (3.12) hoặc các sản phẩm tương tự hoặc liên quan khác, được nhà sản xuất dự định sử dụng riêng lẻ hay phối hợp với nhau, để phục vụ cho con người nhằm một hoặc nhiều mục đích y tế cụ thể sau đây:
- chẩn đoán, ngăn ngừa, theo dõi, điều trị hoặc làm giảm nhẹ bệnh tật;
- chẩn đoán, theo dõi, điều trị, giảm nhẹ hoặc bù đắp chấn thương;
- kiểm tra, thay thế, sửa đổi hoặc hỗ trợ giải phẫu hoặc quá trình sinh lý;
- hỗ trợ hoặc duy trì sự sống;
- kiểm soát sự thụ thai;
- khử khuẩn trang thiết bị y tế;
- cung cấp thông tin thông qua biện pháp kiểm tra in vitro các mẫu vật có nguồn gốc từ cơ thể con người;
và không sử dụng cơ chế dược lý, miễn dịch hoặc chuyển hóa trong hoặc trên cơ thể người hoặc nếu có sử dụng các cơ chế này thì chỉ mang tính chất hỗ trợ để đạt mục đích quy định. Các trang thiết bị y tế bao gồm cả các thiết bị nha khoa.
CHÚ THÍCH 1: Các sản phẩm có thể được coi là trang thiết bị y tế ở một số khu vực nhưng không được coi là trang thiết bị y tế ở những khu vực khác bao gồm:
- chất khử khuẩn;
- trợ giúp cho người khuyết tật;
- thiết bị kết hợp mô động vật và/hoặc người;
- thiết bị để thụ tinh in vitro hoặc công nghệ hỗ trợ sinh sản;
[NGUỒN: GHTF/SG1/N071:2012, 5.1 được sửa đổi để làm rõ bao gồm các thiết bị nha khoa]
3.15
Vật liệu nano (nanomaterial)
Vật liệu (3.12) có kích thước bên ngoài ở kích thước nano hoặc có cấu trúc bên trong hoặc cấu trúc bề mặt ở kích thước nano.
[NGUỒN: ISO/TR 10993-22:2017, 3.7, được sửa đổi - Các Chú thích đã bị xóa]
3.16
Không tiếp xúc (non-contacting)
Chỉ ra trang thiết bị y tế (3.14) hoặc thành phần của trang thiết bị y tế không tiếp xúc trực tiếp và gián tiếp với các mô cơ thể.
3.17
Thông tin vật lý và hóa học (physical and chemical information)
Kiến thức về công thức, quá trình sản xuất, các đặc tính hình học và vật lý cũng như loại tiếp xúc với cơ thể và sử dụng trong lâm sàng được sử dụng để xác định xem có cần thêm thử nghiệm đặc trưng sinh học hoặc vật liệu không.
3.18
Phân tích rủi ro (risk analysis)
Sử dụng một cách hệ thống các thông tin sẵn có để nhận biết nguy cơ và ước lượng rủi ro [NGUỒN: TCVN 8023:2009 (ISO 14971:2007), 2.17, được sửa đổi - Chú thích đã bị xóa]
3.19
Đánh giá rủi ro (risk assessment)
Toàn bộ quá trình phân tích rủi ro (3.18) và định lượng rủi ro (3.20).
[NGUỒN: TCVN 8023:2009 (ISO 14971:2007), 2.18]
3.20
Định lượng rủi ro (risk evaluation)
Quá trình so sánh rủi ro đã ước lượng được với tiêu chí rủi ro cho trước để xác định khả năng chấp nhận được của rủi ro đó.
[NGUỒN: TCVN 8023:2009 (ISO 14971:2007), 2.21]
3.21
Quản lý rủi ro (risk management)
Việc áp dụng một cách hệ thống các chính sách, quy trình và thực tiễn quản lý vào việc phân tích, đánh giá, hạn chế và giám sát rủi ro.
[NGUỒN: TCVN 8023:2009 (ISO 14971:2007), 2.22]
3.22
Độc chất/độc hại (toxic)
Có khả năng gây ra đáp ứng sinh học bất lợi.
3.23
Nguy cơ độc tính (toxicological hazard)
Khả năng một chất hóa học hoặc vật liệu (3.12) gây ra đáp ứng sinh học bất lợi, có tính đến bản chất của phản ứng và liều lượng cần thiết để tạo ra phản ứng đó.
3.24
Rủi ro độc tính (toxicological risk)
Xác suất xảy ra phản ứng bất lợi ở một mức độ cụ thể đối với một mức độ phơi nhiễm cụ thể.
3.25
Ngưỡng độc tính (toxicological threshold)
Giới hạn, chẳng hạn như lượng tiêu thụ có thể chấp nhận được (TI), mức phơi nhiễm có thể chấp nhận được (TE), giá trị giới hạn cho phép (AL) hoặc Ngưỡng của mối lo ngại về độc tính (TTC) dưới mức này các tác động có hại được coi là không xảy ra đối với các điểm cuối sinh học liên quan.
3.26
Tiếp xúc tạm thời (transitory contact)
Trang thiết bị y tế (3.14) hoặc thành phần của trang thiết bị y tế có thời gian tiếp xúc rất ngắn với mô cơ thể.
4 Nguyên tắc chung áp dụng để đánh giá sinh học trang thiết bị y tế
4.1 Đánh giá sinh học đối với các vật liệu hoặc trang thiết bị y tế được sử dụng cho người phải là một phần của kế hoạch đánh giá sinh học có cấu trúc trong quá trình quản lý rủi ro phù hợp với Phụ lục I của TCVN 8023:2009 (ISO 14971:2007), như được nêu trong Hình 1 của tiêu chuẩn này. Quá trình quản lý rủi ro này bao gồm việc nhận dạng các nguy cơ sinh học, ước tính các rủi ro sinh học liên quan và xác định khả năng chấp nhận của chúng. Phụ lục B cung cấp hướng dẫn về quá trình này. Việc đánh giá sinh học phải được lập kế hoạch, thực hiện và lập thành văn bản bởi các chuyên gia có kiến thức và kinh nghiệm.
Kế hoạch quản lý rủi ro cần nhận dạng các khía cạnh của đánh giá sinh học đòi hỏi năng lực kỹ thuật cụ thể và phải nhận dạng người chịu trách nhiệm đánh giá sinh học.
Việc đánh giá phải bao gồm việc xem xét bằng văn bản, có đầy đủ thông tin về những thuận lợi/ khó khăn và mức độ phù hợp của:
a) cấu hình trang thiết bị y tế (ví dụ: các đặc tính kích thước, hình dạng, bề mặt) và danh sách các vật liệu cấu tạo của trang thiết bị y tế (định tính) và khi cần thiết, tỷ lệ và lượng (khối lượng) của mỗi vật liệu trong trang thiết bị y tế (định lượng);
b) các đặc tính vật lý và hóa học của các vật liệu kết cấu khác nhau và thành phần của chúng;
CHÚ THÍCH: Khi thông tin này đã được lập thành văn bản trong quản lý rủi ro đối với trang thiết bị y tế, thì thông tin này có thể được đưa vào bằng cách viện dẫn.
c) lịch sử sử dụng lâm sàng hoặc dữ liệu phơi nhiễm của con người;
CHÚ THÍCH: Lịch sử phê duyệt theo quy định trước đây có thể có liên quan.
d) các dữ liệu độc tính hiện có và dữ liệu an toàn sinh học khác về sản phẩm và vật liệu thành phần, các sản phẩm phân hủy và chất chuyển hóa;
e) các quy trình thử nghiệm.
Đánh giá có thể bao gồm cả việc xem xét các dữ liệu tiền lâm sàng và lâm sàng có liên quan và thử nghiệm thực tế. Việc đánh giá như vậy có thể dẫn đến kết luận rằng không cần thử nghiệm nếu vật liệu có lịch sử sử dụng an toàn có thể chứng minh được là có vai trò cụ thể và có dạng vật lý tương đương với trang thiết bị y tế đang được thiết kế. Loại thông tin có thể hữu ích để chứng minh tính tương đương được nêu trong Phụ lục B. Việc thử nghiệm thường không cần thiết khi đã có đủ thông tin để thực hiện đánh giá rủi ro đối với vật liệu và/hoặc trang thiết bị y tế (xem Phụ lục C).
4.2 Khi lựa chọn vật liệu được sử dụng trong sản xuất trang thiết bị y tế, điều đầu tiên phải xem xét là phù hợp với mục đích liên quan đến các đặc điểm và tính chất của vật liệu, bao gồm các tính chất hóa học, độc tính, vật lý, điện, hình thái và cơ học.
4.3 Những điều sau đây phải được xem xét đến mức độ phù hợp của chúng đối với đánh giá sinh học tổng thể của trang thiết bị y tế:
a) vật liệu kết cấu (tức là tất cả các vật liệu tiếp xúc với mô trực tiếp và gián tiếp);
b) các chất phụ gia dự kiến, chất gây ô nhiễm quá trình và dư lượng (ví dụ, thử nghiệm dư lượng tiệt khuẩn bằng etylen oxit phải được thực hiện theo TCVN 7391-7 (ISO 10993-7);
c) vật liệu đóng gói tiếp xúc trực tiếp hoặc gián tiếp với trang thiết bị y tế có thể truyền hóa chất vào trang thiết bị y tế và sau đó gián tiếp đến bệnh nhân hoặc bác sĩ lâm sàng;
d) các chất ngâm chiết (xem TCVN 7391-17 (ISO 10993-17) và TCVN 7391-18 (ISO 10993-18));
e) các sản phẩm phân hủy (xem TCVN 7391-9 (ISO 10993-9) đối với các nguyên tắc chung và TCVN 7391-13 (ISO 10993-13), TCVN 7391-14 (ISO 10993-14) và TCVN 7391-15 (ISO 10993-15) đối với các sản phẩm phân hủy từ polyme, gốm và kim loại, tương ứng);
f) các thành phần khác và sự tương tác của chúng trong thành phẩm;
g) tính năng và đặc tính của thành phẩm;
h) các đặc tính vật lý của thành phẩm, bao gồm nhưng không giới hạn ở độ xốp, kích thước hạt, hình dạng và hình thái bề mặt.
Mô tả các thành phần hóa học của trang thiết bị y tế và xem xét đặc trưng vật liệu bao gồm cả đặc trưng hóa học (xem TCVN 7391-18 (ISO 10993-18)) phải thực hiện trước các thử nghiệm sinh học (xem Hình 1). Đặc trưng hóa học với ngưỡng độc tính thích hợp có thể được sử dụng để xác định xem có cần thử nghiệm thêm hay không (xem Phụ lục B, TCVN 7391-17 (ISO 10993-17) và TCVN 7391-18 (ISO 10993-18)).
Các tác động vật lý của trang thiết bị y tế phải được xem xét nếu chúng ảnh hưởng đến tính tương thích sinh học.
CHÚ THÍCH: Xem ISO/TR 10993-19 để biết thông tin.
Các trang thiết bị y tế có chứa, tạo ra hoặc được cấu tạo từ vật liệu nano có thể gây ra những thách thức cụ thể đối với việc đánh giá sinh học do các đặc tính độc nhất có thể có của chúng (xem ISO/TR 10993-22).
Cả tác động tại chỗ và toàn thân đều phải được xem xét để định lượng rủi ro.
4.4 Việc đánh giá sinh học phải bắt đầu với việc phân loại các trang thiết bị y tế (xem Điều 6). Đánh giá thông tin đã có sau đó cho phép phân tích khoảng trống để tạo điều kiện lựa chọn các thử nghiệm thích hợp. Sự nghiêm ngặt cần thiết trong đánh giá sinh học về cơ bản được xác định bởi bản chất, mức độ, tần suất và thời gian phơi nhiễm cũng như các nguy cơ được nhận dạng đối với trang thiết bị y tế hoặc vật liệu. Việc thử nghiệm thường không cần thiết khi đã có đủ thông tin để thực hiện đánh giá rủi ro đối với vật liệu và/hoặc trang thiết bị y tế (xem Phụ lục C). Ví dụ: thử nghiệm sinh học thường không cần thiết, nếu đặc trưng vật liệu (ví dụ: vật lý và hóa học) chứng tỏ sự tương đương với trang thiết bị y tế hoặc vật liệu đã được đánh giá trước đó với độ an toàn đã được thiết lập (xem TCVN 7391-18 (ISO 10993-18) và TCVN 7391-19 (ISO/TR 10993-19)).
Việc giải thích dữ liệu phải tính đến thành phần hóa học của vật liệu, bao gồm các điều kiện phơi nhiễm cũng như bản chất, mức độ, tần suất và thời gian phơi nhiễm của cơ thể với trang thiết bị y tế hoặc các thành phần của nó.
4.5 Tất cả các nguy cơ sinh học có thể xảy ra đã biết phải được tính đến cho mọi vật liệu và thành phẩm, nhưng điều này không có nghĩa là việc thử nghiệm tất cả các nguy cơ có thể xảy ra là cần thiết hoặc thực tế (xem Điều 5 và Điều 6). Kết quả thử nghiệm không thể đảm bảo không có các nguy cơ sinh học tiềm ẩn, do đó, các cuộc điều tra sinh học phải được thực hiện bằng các quan sát cẩn thận đối với các phản ứng hoặc sự kiện bất lợi không mong muốn ở người trong quá trình sử dụng trang thiết bị y tế trên lâm sàng.
Phạm vi của các nguy cơ sinh học có thể xảy ra rất rộng và có thể bao gồm các tác động ngắn hạn như độc tính cấp tính, kích ứng da, mắt và bề mặt niêm mạc, tan máu và hình thành huyết khối, cũng như các tác động độc hại lâu dài hoặc cụ thể như độc tính cấp tính và trường diễn, gây mẫn cảm dẫn đến dị ứng, độc tính gen, gây ung thư (gây khối u) và tác động đến sinh sản hoặc phát triển, bao gồm cả khả năng gây quái thai.
4.6 Nếu cần thử nghiệm, việc lựa chọn bất kỳ thử nghiệm in vitro hoặc in vivo nào (xem Phụ lục A) phải dựa trên mục đích sử dụng.
Các phương pháp thử in vitro đã được xác nhận một cách thích hợp, khả dụng hợp lý và thực tế, đáng tin cậy và có thể tái lập, các thử nghiệm in vitro phải được xem xét ưu tiên sử dụng hơn các thử nghiệm in vivo (xem TCVN 7391-2 (ISO 10993-2)). Bất cứ khi nào các thử nghiệm in vivo được chỉ ra bởi các phát hiện của đánh giá rủi ro ban đầu, việc sử dụng sàng lọc in vitro thích hợp, nếu có, phải được xem xét trước khi bắt đầu các thử nghiệm in vivo. Phải cung cấp cơ sở lý luận cho chiến lược thử nghiệm, cũng như cho việc lựa chọn thử nghiệm. Dữ liệu thử nghiệm, hoàn chỉnh đến mức có thể thực hiện phân tích độc lập, phải được đánh giá bởi các chuyên gia có năng lực, có hiểu biết và phải được lưu giữ.
Trong một số trường hợp nhất định, chẳng hạn như đối với các trang thiết bị y tế cụ thể, hoặc đánh giá điểm cuối sinh học, nếu thử nghiệm không được chuẩn hóa, không được xác nhận là cần thiết, thì cần cung cấp thông tin bổ sung về cơ sở của thiết kế nghiên cứu và giải thích dữ liệu.
4.7 Tính an toàn sinh học của trang thiết bị y tế phải được nhà sản xuất đánh giá trong toàn bộ vòng đời của trang thiết bị y tế.
4.8 Đối với các trang thiết bị y tế có thể tái sử dụng, nhà sản xuất phải đánh giá độ an toàn sinh học đối với số chu kỳ xử lý đã được xác nhận tối đa.
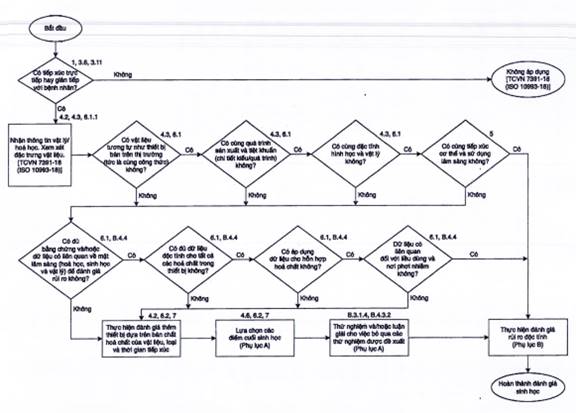
Hình 1 - Tóm tắt cách tiếp cận có hệ thống để đánh giá sinh học các trang thiết bị y tế như một phần của quá trình quản lý rủi ro
4.9 Việc đánh giá rủi ro sinh học của vật liệu hoặc thành phẩm phải được đánh giá lại nếu xảy ra bất kỳ điều nào sau đây:
a) bất kỳ sự thay đổi nào về nguồn gốc hoặc quy định kỹ thuật của vật liệu được sử dụng để sản xuất sản phẩm;
b) bất kỳ thay đổi nào trong công thức, chế biến, đóng gói chính hoặc tiệt khuẩn sản phẩm;
c) bất kỳ thay đổi nào trong hướng dẫn hoặc kỳ vọng của nhà sản xuất liên quan đến việc bảo quản, ví dụ: thay đổi về thời hạn sử dụng và/hoặc vận chuyển;
d) bất kỳ thay đổi nào trong mục đích sử dụng của sản phẩm;
e) bất kỳ bằng chứng nào cho thấy sản phẩm có thể tạo ra các tác động sinh học bất lợi khi sử dụng cho người.
4.10 Đánh giá sinh học phải tính đến các thử nghiệm tiền lâm sàng, điều tra lâm sàng, kinh nghiệm sau khi đưa ra thị trường từ các trang thiết bị y tế hoặc vật liệu tương tự, và các thông tin liên quan khác (xem Phụ lục B).
4.11 Không được sử dụng tiêu chuẩn này để bắt buộc thử nghiệm lại các sản phẩm có lịch sử đã được đánh giá trước đó bằng cách sử dụng phiên bản thích hợp của ISO 10993-1 tại thời điểm đánh giá. Tuy nhiên, sự phù hợp đối với tiêu chuẩn này phải được thể hiện bằng cách đưa ra lý do cho việc bỏ qua thử nghiệm bổ sung. Trong trường hợp các khuyến nghị về đánh giá điểm cuối theo Phụ lục A khác với các phiên bản trước của ISO 10993-1, thì có thể dùng lịch sử sử dụng lâm sàng an toàn để ghi lại lý do tại sao không cần thử nghiệm bổ sung trên một trang thiết bị y tế bán trên thị trường. Tuy nhiên, nếu có bất kỳ thay đổi nào được mô tả trong Điều 4.9 xảy ra, thì việc đánh giá các rủi ro sinh học liên quan đến thay đổi phải được thực hiện bằng cách sử dụng tiêu chuẩn này.
5 Phân loại trang thiết bị y tế
5.1 Yêu cầu chung
Các trang thiết bị y tế phải được phân loại theo tính chất và thời gian tiếp xúc với cơ thể như quy định trong 5.2 và 5.3. Việc phân loại các trang thiết bị y tế tạo điều kiện thuận lợi cho việc lựa chọn các tập dữ liệu thích hợp (xem Phụ lục A).
Việc đánh giá trang thiết bị y tế không thuộc một trong các loại được quy định phải tuân theo các nguyên tắc chung trong tiêu chuẩn này. Một số trang thiết bị y tế nhất định có thể có nhiều hơn một loại tiếp xúc với cơ thể hoặc nhiều hơn một loại thời hạn, trong trường hợp đó, phải thực hiện việc đánh giá phù hợp với từng loại.
VÍ DỤ: Đối với trang thiết bị y tế bao gồm cả bộ phận được cấy ghép và hệ thống vận chuyển chỉ được sử dụng trong quy trình phẫu thuật để đặt trang thiết bị y tế, bộ phận cấy ghép phải được đánh giá riêng biệt với hệ thống vận chuyển.
VÍ DỤ: Đối với các bộ phận dẫn khí của thiết bị mà chỉ tiếp xúc gián tiếp, nên sử dụng các tiêu chuẩn cụ thể của thiết bị để xác định loại đánh giá tính tương thích sinh học liên quan [xem ISO 18562 (tất cả các phần)].
5.2 Phân loại theo bản chất tiếp xúc với cơ thể
5.2.1 Trang thiết bị y tế không tiếp xúc
Bao gồm các trang thiết bị y tế (hoặc các thành phần) đều không tiếp xúc trực tiếp hoặc gián tiếp với cơ thể và khi đó thông tin về tính tương thích sinh học sẽ không cần thiết. Phần mềm chẩn đoán, thiết bị chẩn đoán in vitro và ống lấy máu là những ví dụ về thiết bị không tiếp xúc.
5.2.2 Trang thiết bị y tế tiếp xúc bề mặt
Bao gồm các trang thiết bị y tế tiếp xúc với các bề mặt sau đây:
a) Da
- Các trang thiết bị y tế chỉ tiếp xúc với bề mặt da không bị tổn thương.
VÍ DỤ: Điện cực, bộ phận giả bên ngoài, băng cố định, băng độn và các loại thiết bị theo dõi.
CHÚ THÍCH: Một số trang thiết bị y tế được sử dụng trong môi trường vô khuẩn hoặc không vô khuẩn bao gồm các thành phần có thể tiếp xúc với bàn tay không đeo găng của người dùng như giao diện của con người đối với thiết bị điện tử (ví dụ: bàn phím máy tính, mặt số hoặc nút bấm, màn hình cảm ứng, thẻ SD, thanh USB); vỏ cho thiết bị theo dõi điện tử hoặc bộ lập trình có thể tiếp xúc với bất kỳ phần da nào còn nguyên vẹn (ví dụ: thiết bị điện tử như điện thoại di động, máy tính bảng); hoặc các thành phần có thể tiếp xúc với bàn tay đeo găng của người dùng (ví dụ: tay cầm ống thông (catheter)). Nếu các loại thành phần này có thể được làm từ vật liệu được sử dụng phổ biến cho các sản phẩm tiêu dùng khác có tính chất tiếp xúc tương tự, thì không cần đánh giá thêm về mặt sinh học.
b) Niêm mạc
- Các trang thiết bị y tế tiếp xúc với niêm mạc còn nguyên vẹn.
VÍ DỤ: Kính áp tròng, ống thông tiểu, dụng cụ trong âm đạo và trong ruột (ống dạ dày, ống soi đại tràng, ống soi ruột kết, ống soi dạ dày), ống nội khí quản, ống soi phế quản, một số bộ phận giả nha khoa và dụng cụ chỉnh nha.
c) Bề mặt bị xuyên qua hoặc bị tổn thương
- Các trang thiết bị y tế tiếp xúc với bề mặt cơ thể bị xuyên qua hoặc bị tổn thương.
VÍ DỤ: Trang thiết bị băng bó hoặc chữa lành vết thương và các miếng băng hút che vết loét, bỏng và tạo hạt.
5.2.3 Trang thiết bị y tế truyền ngoài
Các trang thiết bị y tế truyền ngoài phải được phân loại theo sự tiếp xúc của chúng với các vị trí ứng dụng sau:
a) Đường huyết, gián tiếp
Các trang thiết bị y tế hoặc thành phần không nhất thiết phải tiếp xúc trực tiếp với đường huyết nhưng đóng vai trò là ống dẫn để đưa chất lỏng vào hệ thống mạch máu.
VÍ DỤ: Bộ truyền dịch, bộ kéo dài, bộ chuyển và bộ truyền máu.
b) Mô/xương/men răng
- Các trang thiết bị y tế tiếp xúc với mô, hệ thống xương hoặc tủy/men răng.
VÍ DỤ: Trang thiết bị để nội soi ổ bụng, nội soi khớp, hệ thống ống dẫn lưu, vật liệu hàn răng và kim bấm khâu da.
- Các thành phần hoặc trang thiết bị y tế không nhất thiết phải tiếp xúc trực tiếp với mô hoặc xương nhưng đóng vai trò là đường dẫn chất lỏng đưa chất lỏng đến mô hoặc xương.
VÍ DỤ: Ống được sử dụng để phun rửa và các bộ phận của trang thiết bị y tế tiếp xúc với chất lòng cũng có thể tiếp xúc với bệnh nhân.
c) Máu tuần hoàn
- Các trang thiết bị y tế tiếp xúc với máu tuần hoàn.
VÍ DỤ: Ống thông tĩnh mạch, điện cực tạo nhịp tim tạm thời, máy tạo oxy, ống và phụ kiện phổi nhân tạo trao đổi oxy qua màng ngoài cơ thể, máy thẩm tách máu, ống và các phụ kiện thẩm tách máu, chất hấp phụ máu và chất hấp phụ miễn dịch.
5.2.4 Trang thiết bị y tế cấy ghép
Các trang thiết bị y tế cấy ghép phải được phân loại theo sự tiếp xúc của chúng với các vị trí ứng dụng sau đây:
a) Mô/xương
- Các trang thiết bị y tế chủ yếu tiếp xúc với xương.
VÍ DỤ: Chốt chỉnh hình, tấm, khớp thay thế, bộ phận già bằng xương, xi măng xương và các thiết bị đặt truyền trong xương.
- Các trang thiết bị y tế tiếp xúc chủ yếu với mô và dịch mô.
VÍ DỤ: Máy tạo nhịp tim, thiết bị cung cấp thuốc, cảm biến và mô phỏng thần kinh cơ, dây chằng thay thế, vật liệu cấy ghép ngực, thanh quản nhân tạo, mô cấy ghép dưới sụn, kẹp thắt và dụng cụ tử cung không đạt được chức năng chính của chúng bằng hoạt tính hóa học.
b) Máu
- Các trang thiết bị y tế chủ yếu tiếp xúc với máu tuần hoàn trong hệ tim mạch.
VÍ DỤ: Điện cực máy tạo nhịp tim, lỗ rò động mạch nhân tạo, van tim, mảnh ghép mạch máu, ống thông (catherter) phủ thuốc bên trong và thiết bị hỗ trợ tâm thất.
CHÚ THÍCH: Hầu hết các mô đều chứa máu tuần hoàn; tuy nhiên, phân loại này không nhằm mục đích bao gồm các thiết bị được cấy ghép vào mô có chứa máu thôi ra tạm thời (ví dụ: tấm ghép điều trị thoát vị).
5.3 Phân loại theo thời gian tiếp xúc
5.3.1 Các loại thời gian tiếp xúc
Các trang thiết bị y tế phải được phân loại theo thời gian tiếp xúc dự kiến như sau:
a) Phơi nhiễm giới hạn (A) - trang thiết bị y tế có tổng thời gian tiếp xúc tích lũy một lần, nhiều lần hoặc lặp lại lên đến 24 h.
b) Phơi nhiễm kéo dài (B) - trang thiết bị y tế có tổng thời gian tiếp xúc tích lũy một lần, nhiều lần hoặc lặp lại có khả năng vượt quá 24 h nhưng không quá 30 ngày.
c) Phơi nhiễm lâu dài (C) - trang thiết bị y tế có tổng thời gian tiếp xúc tích lũy một lần, nhiều lần hoặc lặp lại vượt quá 30 ngày.
5.3.2 Trang thiết bị y tế tiếp xúc tạm thời
Một số trang thiết bị y tế có mức phơi nhiễm giới hạn (A) có sự tiếp xúc rất ngắn/tạm thời với cơ thể (ví dụ: dao mổ, kim tiêm dưới da, ống mao dẫn được sử dụng dưới một phút). Các trang thiết bị y tế này thường không cần thử nghiệm để giải quyết tính tương thích sinh học. Tuy nhiên, đối với các sản phẩm được làm bằng các vật liệu như lớp phủ hoặc chất bôi trơn có thể tiếp xúc với các mô cơ thể sau khi trang thiết bị y tế được tháo ra, có thể cần phải đánh giá tính tương thích sinh học chi tiết hơn. Việc sử dụng tích lũy cũng nên được xem xét.
5.3.3 Trang thiết bị y tế có nhiều loại thời gian tiếp xúc
Nếu một vật liệu hoặc trang thiết bị y tế có thể được đặt trong nhiều hơn một loại thời hạn, thì phải áp dụng các xem xét thử nghiệm và/hoặc đánh giá nghiêm ngặt hơn. Với nhiều lần phơi nhiễm dự kiến hoặc dự định với một thiết bị, quyết định xếp loại trang thiết bị y tế vào loại nào phải tính đến hiệu ứng tích lũy tiềm năng, lưu ý đến khoảng thời gian mà những phơi nhiễm này xảy ra. Nếu một trang thiết bị y tế được dự định thay đổi trong suốt thời gian tồn tại của nó, chẳng hạn như những thiết bị được polyme hóa và/hoặc phân hủy in situ, thì việc đánh giá phải xem xét tất cả các trạng thái khác nhau của thiết bị. Ví dụ: đối với một loại keo có khả năng hấp thụ được nhằm mục đích polyme hóa in situ, các trạng thái thiết bị khác nhau sẽ bao gồm các thành phần ban đầu, sản phẩm phản ứng trung gian, vật liệu được polyme hóa hoàn toàn và các sản phầm phân hủy.
6 Quá trình đánh giá sinh học
6.1 Thông tin vật lý và hóa học để phân tích rủi ro sinh học
Hình 1 chỉ ra các bước chung trong quá trình đặc trưng vật lý và/hoặc hóa học liên kết với các điểm quyết định đánh giá sinh học tổng thể.
Thu thập thông tin vật lý và hóa học về trang thiết bị y tế hoặc thành phần là bước đầu tiên quan trọng trong quá trình đánh giá sinh học và quá trình đặc trưng vật liệu liên quan của nó. Những dữ liệu này phải đủ để trả lời hai hàng câu hỏi đầu tiên trong lưu đồ Hình 1. Mức độ yêu cầu của đặc trưng vật lý và/hoặc hóa học phụ thuộc vào những gì đã biết về công thức vật liệu, dữ liệu về độc tính và an toàn phi lâm sàng và lâm sàng tồn tại, cũng như bản chất và thời gian tiếp xúc của cơ thể với trang thiết bị y tế. Ở mức tối thiểu, đặc trưng phải đề cập đến các hóa chất cấu thành trang thiết bị y tế và các chất phụ gia hoặc chất hỗ trợ quá trình còn sót lại được sử dụng trong quá trình sản xuất thiết bị đó. Ngoài ra, có thể một số thông tin đặc trưng vật lý sẽ cần thiết cho các trang thiết bị y tế cấy ghép hoặc trang thiết bị y tế tiếp xúc với máu. Việc đặc trưng vật liệu, nếu được thực hiện, phải được tiến hành theo TCVN 7391-18 (ISO 10993-18). Đối với vật liệu nano, xem ISO/TR 10993-22.
Nếu sự kết hợp của tất cả các vật liệu, hóa chất và quá trình đều có lịch sử sử dụng an toàn trong ứng dụng dự kiến và các đặc tính vật lý không thay đổi, thì có thể mô tả thêm và tập hợp dữ liệu bổ sung (ví dụ: phân tích hóa học các dịch chiết hoặc thử nghiệm sinh học) sẽ không cần thiết. Trong trường hợp này, cơ sở lý luận phải được lập thành văn bản.
Cần thiết lập, đo lường sự nhận dạng và định lượng các vật liệu mới và các hóa chất hiện có.
Đối với các chất chiết và chất ngâm chiết từ thiết bị có đủ dữ liệu độc tính liên quan đến mức phơi nhiễm dự kiến (số lượng, đường dẫn và tần suất), không cần thử nghiệm thêm. Đối với các trang thiết bị y tế có hỗn hợp hóa chất ngâm chiết đã biết, cần xem xét các tương tác tiềm ẩn giữa các chất ngâm chiết.
Khi có khả năng bị phân hủy trong các điều kiện sản xuất, tiệt khuẩn, vận chuyển, bảo quản và sử dụng trang thiết bị y tế, thì sự hiện diện và bản chất của các sản phẩm phân hủy phải được đặc trưng theo TCVN 7391-9 (ISO 10993-9), TCVN 7391-13 (ISO 10993-13), TCVN 7391-14 (ISO 10993-14) và TCVN 7391-15 (ISO 10993-15), nếu có.
Đối với các vật liệu và/hoặc trang thiết bị y tế có thể thôi ra các hạt mài mòn, khả năng thôi ra các hạt nano cần được xem xét như mô tả trong ISO/TR 10993-22.
6.2 Phân tích khoảng trống và lựa chọn các điểm cuối sinh học để đánh giá
Đánh giá thông tin sẵn có và so sánh với các tập dữ liệu cần thiết để đánh giá tính an toàn sinh học của trang thiết bị y tế (xem Điều 4, Phụ lục A và Phụ lục C). Nhận dạng dữ liệu hoặc thử nghiệm bổ sung nhận được một cách hợp lý và thực tế cần thiết để hoàn thành bộ dữ liệu nhằm thực hiện đánh giá rủi ro.
Đặc trưng cho khoảng trống dữ liệu và xác định tầm quan trọng của nỏ đối với việc đánh giá điềm cuối sinh học (Phụ lục A) và đối với đánh giá rủi ro sinh học tổng thể. Nhận dạng các tùy chọn cho tập dữ liệu phải giải quyết khoảng trống dữ liệu.
Ví dụ, thử nghiệm chất dẻo theo dược điển thường được tiến hành trên nguyên liệu thô, trong khi TCVN 7391 (ISO 10993) đánh giá trang thiết bị y tế trong giai đoạn cuối cùng. Do đó, dữ liệu từ thử nghiệm theo dược điển như vậy không đủ cho trang thiết bị y tế thành phẩm nếu không có sự biện minh thích hợp.
Kết quả phân tích rủi ro của các hóa chất được nhận dạng có thể dẫn đến kết luận rằng cần phải bổ sung đặc trưng vật liệu. Thử nghiệm chiết thích hợp, có thể được sử dụng để ước tính mức độ phơi nhiễm lâm sàng với thành phần hóa học (xem TCVN 7391-18 (ISO 10993-18)). Khả năng chấp nhận của mức độ chất ngâm chiết ước tính phải được thiết lập bằng cách so sánh lượng của mỗi hợp chất chiết được từ trang thiết bị y tế với ngưỡng độc tính tương ứng của nó như được xây dựng theo TCVN 7391-17 (ISO 10993-17).
CHÚ THÍCH: Ví dụ, khi giới hạn an toàn không được coi là đủ nếu toàn bộ lượng hóa chất cụ thể bị ngâm chiết ra ngoài trong quá trình sử dụng, thì có thể sử dụng thử nghiệm chiết thích hợp.
Bảo vệ con người là mục tiêu chính của tiêu chuẩn này; mục tiêu thứ yếu là đảm bảo phúc lợi động vật và giảm thiểu số lượng cũng như mức độ phơi nhiễm của động vật thử nghiệm. TCVN 7391-2 (ISO 10993-2) áp dụng cho các thử nghiệm in vivo đang được xem xét. Thử nghiệm in vivo bổ sung không được thực hiện khi:
1) kết quả có sẵn từ các nghiên cứu liên quan đã được thực hiện trước đây, hoặc
2) dữ liệu lâm sàng và phi lâm sàng hiện có, bao gồm cả lịch sử sử dụng an toàn, đáp ứng các yêu cầu của đánh giá sinh học và do đó việc thử nghiệm thêm trên động vật sẽ là phi đạo đức. Khi đánh giá mức độ liên quan của dữ liệu về việc sử dụng trước một vật liệu với đánh giá sinh học, mức độ tin cậy của dữ liệu lịch sử cần được tính đến. TCVN 7391-18:2007 (ISO 10993-18:2005), Phụ lục C, đưa ra một số nguyên tắc thông tin để đánh giá sự tương đương của hóa chất.
6.3 Thử nghiệm sinh học
6.3.1 Yêu cầu chung
Ngoài các nguyên tắc chung được đưa ra trong Điều 4, các nguyên tắc sau phải được áp dụng khi thử nghiệm sinh học đối với trang thiết bị y tế được coi là cần thiết như một phần của quá trình quản lý rủi ro tổng thể.
a) Thử nghiệm phải được thực hiện trên trang thiết bị y tế thành phẩm, hoặc các mẫu đại diện từ thiết bị thành phẩm hoặc các vật liệu được xử lý theo cách tương tự như trang thiết bị y tế thành phẩm (bao gồm cả tiệt khuẩn, nếu cần).
b) Việc lựa chọn các quy trình thử nghiệm phải tính đến:
1) bản chất, mức độ, thời gian, tần suất và điều kiện phơi nhiễm hoặc tiếp xúc của con người với trang thiết bị y tế trong mục đích sử dụng bình thường;
2) bản chất hóa học và vật lý của trang thiết bị y tế thành phẩm;
3) hoạt tính độc học của các hóa chất trong công thức của trang thiết bị y tế thành phẩm;
4) các thử nghiệm sinh học nhất định (tức là các thử nghiệm được thiết kế để đánh giá tác động toàn thân) là không thể biện minh được khi loại trừ sự có mặt của các hóa chất ngâm chiết (phù hợp với TCVN 7391-18 (ISO 10993-18)), hoặc khi các hóa chất có hồ sơ độc tính đã biết và chấp nhận được, cho phép sử dụng an toàn bằng cách đánh giá theo TCVN 7391-17 (ISO 10993-17) và đánh giá rủi ro theo TCVN 8023:2009 (ISO 14971:2007);
5) tỷ lệ giữa diện tích bề mặt thiết bị với kích thước và khối lượng cơ thể người nhận (ví dụ: thu nhỏ thiết bị để thử nghiệm cấy ghép trong mô hình động vật);
6) thông tin hiện có dựa trên tài liệu, kinh nghiệm trước đó và các thử nghiệm phi lâm sàng;
7) độ nhạy cảm và độ đặc hiệu của thử nghiệm đang được xem xét liên quan đến tác động của bộ dữ liệu kết quả đối với đánh giá sinh học;
8) Điều 4.4 của TCVN 7391-2:2020 (ISO 10993-2:2006), yêu cầu phải giảm thiểu mọi sự đau đớn, đau khổ, khó khăn hoặc tổn hại lâu dài đối với động vật được sử dụng.
c) Nếu các dịch chiết từ các trang thiết bị y tế được chuẩn bị, dung môi và điều kiện chiết được sử dụng phải phù hợp với bản chất và công dụng của thành phẩm, cũng như khả năng dự đoán (chẳng hạn như mục đích thử nghiệm, cơ sở lý luận, độ nhạy cảm, độ đặc hiệu, v.v...) của phương pháp thử và phải được chuẩn bị theo TCVN 7391-12 (ISO 10993-12). Bất cứ khi nào có thể, các điều kiện chiết được chọn phải thể hiện ở mức tối thiểu, quá mức của các điều kiện sử dụng.
d) Các đối chứng dương và đối chứng âm nên được sử dụng khi thích hợp.
Các phương pháp thử được sử dụng trong các thử nghiệm đánh giá sinh học phải có độ nhạy cảm, độ chụm và độ chính xác. Khi tiến hành thử nghiệm sinh học, phải thực hiện theo thực hành tốt trong phòng thử nghiệm.
CHÚ THÍCH: TCVN ISO/IEC 17025 (ISO/IEC 17025) hoặc tương đương.
Các phương pháp thử cần có khả năng tái lập (trong phòng thử nghiệm) cũng như có khả năng lặp lại (liên phòng thử nghiệm) và có khả năng thực hiện hiệu quả.
6.3.2 Thử nghiệm để đánh giá
Thử nghiệm đối với các đánh giá quy định từ 6.3.2.1 đến 6.3.2.15 phải được xem xét và thực hiện khi cần để hoàn thành bộ dữ liệu cần thiết cho việc đánh giá sinh học của trang thiết bị y tế cụ thể. Khi dữ liệu hiện có đầy đủ, không cần thử nghiệm bổ sung (xem Phụ lục A và Phụ lục C).
Do sự đa dạng của các trang thiết bị y tế, thừa nhận rằng việc thử nghiệm sẽ không cần thiết hoặc không thể thực hiện được đối với tất cả các điểm cuối được nhận dạng trong một danh mục (xem TCVN 8023 (ISO 14971)) đối với một trang thiết bị y tế nhất định. Không thể thiếu các đánh giá mà mỗi trang thiết bị y tế được xem xét dựa trên giá trị riêng của nó. Vật liệu nano có thể đặt ra những thách thức cụ thể (ví dụ như nhiễu thử nghiệm) khi áp dụng các hệ thống thử nghiệm thường được sử dụng để đánh giá trang thiết bị y tế và khi giải thích kết quả thử nghiệm (xem ISO/TR 10993-22).
Các điểm cuối bổ sung không được chỉ ra trong bảng có thể là cần thiết (ví dụ: độc tính sinh sản, độc tính phát triển, phân hủy và độc lực).
6.3.2.1 Độc tính tế bào
Các thử nghiệm độc tính tế bào sử dụng kỹ thuật nuôi cấy tế bào có thể được sử dụng để xác định sự chết của tế bào (ví dụ: ly giải tế bào), sự ức chế sự phát triển của tế bào, hình thành khuẩn lạc và các tác động khác lên tế bào do trang thiết bị y tế, vật liệu và/hoặc dịch chiết của chúng gây ra. Nếu thử nghiệm được thực hiện, phải tiến hành theo TCVN 7391-5 (ISO 10993-5).
6.3.2.2 Độ nhạy cảm
Các thử nghiệm về độ nhạy cảm (ví dụ: quá mẫn muộn) có thể được sử dụng để ước tính độ nhạy cảm khi tiếp xúc bởi các trang thiết bị y tế, vật liệu và/hoặc dịch chiết của chúng, bằng cách sử dụng một mô hình thích hợp. Nếu thử nghiệm được thực hiện thì phải tiến hành theo TCVN 7391-10 (ISO 10993-10).
Các thử nghiệm này rất quan trọng vì nếu phơi nhiễm nhiều lần hoặc tiếp xúc với một lượng rất nhỏ các chất ngâm chiết tiềm ẩn có thể dẫn đến mẫn cảm, có thể dẫn đến phản ứng dị ứng.
6.3.2.3 Kích ứng (bao gồm cả phản ứng trong da)
Các thử nghiệm kích ứng có thể được sử dụng để ước tính khả năng gây kích ứng của các trang thiết bị y tế, vật liệu và/hoặc dịch chiết của chúng, sử dụng vị trí thích hợp để ứng dụng như da, mắt và màng nhầy trong một mô hình phù hợp. Các phép thử được thực hiện phải phù hợp với đường dẫn (da, mắt, niêm mạc) và thời gian phơi nhiễm hoặc tiếp xúc, và phải được tiến hành theo TCVN 7391-10 (ISO 10993-10).
Thử nghiệm phản ứng trong da có thể được sử dụng để đánh giá phản ứng tại chỗ của mô với các dịch chiết từ trang thiết bị y tế. Thử nghiệm này có thể áp dụng khi việc xác định kích ứng bằng các thử nghiệm trên da hoặc niêm mạc là không phù hợp (ví dụ: khi các trang thiết bị y tế được cấy ghép hoặc tiếp xúc với máu). Thử nghiệm này cũng có thể hữu ích khi các chất chiết kỵ nước (xem TCVN 7391-10 (ISO 10993-10)).
6.3.2.4 Tính tương thích với máu
Các thử nghiệm tính tương thích với máu có thể được sử dụng để đánh giá, sử dụng một mô hình hoặc hệ thống thích hợp, ảnh hưởng của các trang thiết bị y tế hoặc vật liệu tiếp xúc với máu đối với máu hoặc các thành phần của máu.
Một thử nghiệm về tính tương thích với máu, sự tan máu, xác định mức độ ly giải tế bào hồng cầu và sự giải phóng hemoglobin do các trang thiết bị y tế, vật liệu và/hoặc dịch chiết in vitro của chúng gây ra.
Các thử nghiệm tính tương thích với máu cụ thể khác cũng có thể được thiết kế để mô phỏng dạng hình học, điều kiện tiếp xúc và động lực dòng chảy của trang thiết bị y tế hoặc vật liệu trong các ứng dụng lâm sàng và xác định tương tác với máu/vật liệu/thiết bị.
Mọi thử nghiệm phải được thực hiện theo TCVN 7391-4 (ISO 10993-4).
6.3.2.5 Khả năng gây sốt qua trung gian vật liệu
Các thử nghiệm chất gây sốt như một phần của đánh giá sinh học nhằm phát hiện các phản ứng gây sốt qua trung gian vật liệu của các dịch chiết từ các trang thiết bị y tế hoặc vật liệu. Không có phép thử đơn lẻ nào có thể phân biệt được phản ứng gây sốt do vật liệu gây ra với phản ứng do nhiễm nội độc tố (xem Phụ lục G). Hiếm khi xảy ra phản ứng gây sốt qua trung gian vật liệu. Điều này được quan sát trong các trang thiết bị y tế có chứa các vật liệu có nguồn gốc sinh học.
6.3.2.6 Độc tính toàn thân cấp tính
Các thử nghiệm độc tính toàn thân cấp tính có thể được sử dụng khi sự tiếp xúc cho phép sự hấp thụ tiềm ẩn của các chất ngâm chiết độc hại và các sản phẩm phân hủy, để ước tính các tác động có hại tiềm ẩn của một lần hoặc nhiều lần phơi nhiễm, trong khoảng thời gian dưới 24 h, đối với các trang thiết bị y tế, vật liệu và/hoặc dịch chiết của chúng trong một mô hình động vật. Các thử nghiệm này phải phù hợp với đường phơi nhiễm và mọi thử nghiệm được thực hiện phải được thực hiện theo TCVN 7391-11 (ISO 10993-11).
Nếu khả thi, các thử nghiệm độc tính toàn thân cấp tính có thể được kết hợp với các thủ tục thử nghiệm cấy ghép và nhiễm độc bán cấp tính và bán trường diễn.
Khi đánh giá độc tính toàn thân được quy định trong Bảng A.1, thử nghiệm sinh học hoặc đánh giá rủi ro phải bao gồm đánh giá khả năng đáp ứng sinh học trong các mô khắp cơ thể (ví dụ: theo TCVN 7391-11:2020 (ISO 10993-11:2017), Phụ lục E), bao gồm hệ thống cơ quan liên quan đến việc sử dụng trang thiết bị y tế trong lâm sàng.
6.3.2.7 Độc tính bán cấp tính và bán trường diễn
Các thử nghiệm độc tính bán cấp tính và bán trường diễn có thể được thực hiện để xác định ảnh hưởng của việc phơi nhiễm một lần hoặc nhiều lần hoặc phơi nhiễm với trang thiết bị y tế, vật liệu và/hoặc dịch chiết của chúng trong thời gian không dưới 24 h đến khoảng thời gian không lớn hơn 10 % tổng số tuổi thọ của động vật thử nghiệm (ví dụ: lên đến 13 tuần ở chuột).
Các phép thử này phải được miễn nếu dữ liệu sẵn có về độc tính trường diễn của các vật liệu liên quan là đủ để cho phép đánh giá độc tính bán cấp tính và bán trường diễn. Lý do từ bỏ các thử nghiệm phải được đưa vào báo cáo đánh giá sinh học tổng thể. Các thử nghiệm này phải phù hợp với đường tiếp xúc và thời gian tiếp xúc.
Các phép thử độc tính bán cấp tính và bán trường diễn, nếu được thực hiện, phải được tiến hành theo TCVN 7391-11 (ISO 10993-11).
Nếu khả thi, các thủ tục thử nghiệm độc tính toàn thân bán cấp tính và bán trường diễn có thể được mở rộng để bao gồm các thủ tục thử nghiệm cấy ghép để đánh giá các tác động toàn thân và tại chỗ bán cấp tính và bán trường diễn.
6.3.2.8 Độc tính trường diễn
Các thử nghiệm độc tính trường diễn có thể được sử dụng để xác định ảnh hưởng của việc phơi nhiễm một lần hoặc nhiều lần với các trang thiết bị y tế, vật liệu và/hoặc dịch chiết của chúng trong một giai đoạn chính của vòng đời của động vật thử nghiệm (ví dụ: thường là 6 tháng ở chuột). Các thử nghiệm này phải phù hợp với đường dẫn và thời gian phơi nhiễm hoặc tiếp xúc, và nếu được thực hiện, phải được tiến hành theo TCVN 7391-11 (ISO 10993-11).
Nếu khả thi, thủ tục thử nghiệm độc tính toàn thân trường diễn có thể được mở rộng để bao gồm cả thủ tục thử nghiệm cấy ghép để đánh giá cả tác động toàn thân trường diễn và tại chỗ.
6.3.2.9 Hiệu ứng cấy ghép
Các thử nghiệm cấy ghép có thể được sử dụng để đánh giá các tác động bệnh lý tại chỗ trên mô sống, ở cả cấp độ đại thể và cấp độ vi thể, của một mẫu vật liệu hoặc thành phẩm được cấy ghép bằng phẫu thuật hoặc đặt vào vị trí cấy ghép hoặc mô phù hợp với ứng dụng dự định (ví dụ: các thử nghiệm sử dụng nha khoa đặc biệt). Các thử nghiệm này phải phù hợp với đường tiếp xúc và thời gian tiếp xúc, và nếu được thực hiện, phải được tiến hành theo TCVN 7391-6 (ISO 10993-6).
Nếu khả thi, các thủ tục thử nghiệm cấy ghép có thể được mở rộng để đánh giá cả tác động tại chỗ và toàn thân nhằm đáp ứng các yêu cầu thử nghiệm độc tính cấp, bán cấp tính, bán trường diễn và trường diễn (xem TCVN 7391-6 (ISO 10993-6)). Nếu có thể áp dụng và khả thi, có thể đưa vào đánh giá các khía cạnh về tính tương thích với máu (xem TCVN 7391-4 (ISO 10993-4)).
Khi các nghiên cứu sử dụng mô phỏng trên động vật được thiết kế phù hợp được lập kế hoạch, dự kiến các nghiên cứu này sẽ được sử dụng để giải quyết một loạt các điểm cuối bao gồm cả rủi ro vật lý và sinh học (tức là nguy cơ độc tính và/hoặc rủi ro độc tính). Ví dụ: các điểm cuối nhiễm độc toàn thân trường diễn/bán trường diễn/bán cấp tính và cấp tính có thể được xây dựng thành một nghiên cứu duy nhất. Có thể xem xét một thiết kế thử nghiệm trong đó một lượng vật liệu có liên quan về mặt lâm sàng được cấy vào cơ quan hoặc mô liên quan để đánh giá các tác động tại chỗ và sự quá mức của liều lượng/phơi nhiễm dự đoán trên lâm sàng có thể được cấy ghép ở một vị trí xa để sự phơi nhiễm toàn thân cung cấp một phép đo quá mức phù hợp.
6.3.2.10 Độc tính gen
Các thử nghiệm độc tính gen có thể được sử dụng để đánh giá khả năng đột biến gen, thay đổi cấu trúc và số lượng nhiễm sắc thể cũng như các độc tính đối với DNA hoặc gen khác do trang thiết bị y tế, vật liệu và/hoặc dịch chiết của chúng gây ra. Một loạt thử nghiệm in vitro được sử dụng ban đầu. Nếu thử nghiệm được thực hiện, phải tiến hành theo TCVN 7391-3 (ISO 10993-3).
CHÚ THÍCH: Thông tin bổ sung được nêu trong ISO/TR 10993-33.
Nếu các thử nghiệm in vitro cho kết quả dương tính, việc theo dõi có thể bao gồm nhận dạng tạp chất bằng hóa chất, hóa chất chiết hoặc ngâm chiết hoặc thử nghiệm độc tính gen bổ sung. Việc chấp nhận rủi ro độc tính gen phải dựa trên kết quả đánh giá rủi ro, bao gồm, ví dụ như phơi nhiễm với bệnh nhân, thông tin về trọng lượng bằng chứng (WOE) và phương thức hành động (MOA), nếu có.
6.3.2.11 Khả năng gây ung thư
TCVN 7391-3 (ISO 10993-3) thảo luận về chiến lược đánh giá khả năng gây ung thư của trang thiết bị y tế, vật liệu và/hoặc dịch chiết của chúng trong phần lớn thời gian tuổi thọ của động vật thử nghiệm. Khả năng gây ung thư có thể được giải quyết bằng cách đánh giá rủi ro bao gồm nhận dạng hóa học của các tạp chất, hóa chất chiết hoặc ngâm chiết, sự phơi nhiễm của bệnh nhân với các hóa chất này, trọng lượng bằng chứng (WOE) và thông tin về phương thức hành động (MOA), nếu có. Thông tin về khả năng gây ung thư phải phù hợp với đường dẫn và thời gian phơi nhiễm hoặc tiếp xúc, và có thể được cung cấp từ các tài liệu về độc tính. Trong trường hợp không có bất kỳ rủi ro ung thư đáng kể nào, rất hiếm khi các thử nghiệm về khả năng gây ung thư được coi là thích hợp cho các trang thiết bị y tế. Tuy nhiên, nếu xác định cần thử nghiệm khả năng gây ung thư của trang thiết bị y tế thành phẩm, thì có thể các nghiên cứu suốt đời hoặc mô hình chuyển gen sẽ phù hợp. Cũng có thể những thử nghiệm này có thể được thiết kế để thử nghiệm cả độc tính trường diễn và khả năng sinh khối u trong một nghiên cứu thử nghiệm duy nhất, như được mô tả trong Hướng dẫn 453 của OECD.
6.3.2.12 Độc tính sinh sản và phát triển
Các thử nghiệm độc tính sinh sản và phát triển được đề cập trong TCVN 7391-3 (ISO 10993-3) có thể được sử dụng để đánh giá tác động tiềm ẩn của các trang thiết bị y tế, vật liệu và/hoặc dịch chiết của chúng đối với chức năng sinh sản, sự phát triển của phôi thai (gây quái thai), và sự phát triển trước và sau khi sinh. Các điểm cuối này có thể được giải quyết bằng đánh giá rủi ro bao gồm nhận dạng hóa học của các tạp chất, hóa chất chiết hoặc ngâm chiết, sự phơi nhiễm của bệnh nhân với các hóa chất này, trọng lượng của bằng chứng (WOE) và thông tin về phương thức hành động (MOA), nếu có. Việc đánh giá độc tính sinh sản chỉ được tiến hành khi trang thiết bị y tế có khả năng ảnh hưởng đến khả năng sinh sản của đối tượng. Ngoài ra, đánh giá độc tính phát triển nên được xem xét đối với các trang thiết bị y tế hoặc vật liệu của chúng được sử dụng trong thời kỳ mang thai.
Độc tính sinh sản và phát triển cần được giải quyết đối với các vật liệu mới, vật liệu có độc tính sinh sản hoặc phát triển đã biết, trang thiết bị y tế có quần thể mục tiêu liên quan (ví dụ: phụ nữ mang thai), và/hoặc trang thiết bị y tế có khả năng có vật liệu trang thiết bị y tế tại chỗ trong các cơ quan sinh sản.
6.3.2.13 Sự phân hủy
Thông tin về sự phân hủy phải được cung cấp đối với các trang thiết bị y tế, các thành phần trang thiết bị y tế hoặc vật liệu còn lại trong mô, có khả năng bị phân hủy trong cơ thể con người.
Các thử nghiệm phân hủy phải được xem xét nếu:
a) trang thiết bị y tế được thiết kế để có khả năng hấp thụ được, hoặc
b) việc xem xét đầy đủ thành phần của trang thiết bị y tế đã hoàn thành cho thấy các sản phẩm phân hủy độc hại có thể được thôi ra khi tiếp xúc với cơ thể.
Các thông số ảnh hưởng đến tốc độ và mức độ phân hủy phải được mô tả và lập thành văn bản.
Các cơ chế của sự phân hủy cần được mô tả. Các cơ chế này nên được mô phỏng in vitro để xác định tốc độ phân hủy và thôi ra các hóa chất độc hại tiềm ẩn để ước tính mức độ phơi nhiễm. Cũng có thể là các thử nghiệm in vivo sẽ được yêu cầu để đánh giá sự phân hủy của vật liệu.
Các thử nghiệm phân hủy in vivo có thể không cần thiết nếu so sánh in vitro/in vivo đối với trang thiết bị y tế có khả năng hấp thụ đã được chứng minh trước đó và các nghiên cứu về phân hủy in vitro cho thấy chỉ có các sản phẩm có khả năng được phân hủy với số lượng dự đoán và được sản xuất với tốc độ tương tự với những thuốc đã có lịch sử sử dụng thuốc an toàn trên lâm sàng. Khi các sản phẩm phân hủy dạng hạt được tạo ra, các thử nghiệm có thể không cần thiết nếu chúng ở trạng thái vật lý, tức là phân bố kích thước và hình dạng, tương tự như các sản phẩm có lịch sử sử dụng lâm sàng an toàn hoặc đã có đủ dữ liệu phân hủy liên quan đến các chất và sản phẩm phân hủy được tạo ra với mục đích sử dụng dự kiến.
Khung chung cho các thử nghiệm phân hủy được nêu trong TCVN 7391-9 (ISO 10993-9).
Các phép thử phân hủy in vitro cụ thể đối với polyme, gốm sứ và kim loại được mô tả trong TCVN 7391-13 (ISO 10993-13), TCVN 7391-14 (ISO 10993-14) và TCVN 7391-15 (ISO 10993-15) tương ứng.
Khi các sản phẩm phân hủy dạng hạt có mặt ở dạng vật liệu nano, các thử nghiệm nên được thiết kế theo ISO/TR 10993-22.
6.3.2.14 Nghiên cứu độc lực
Mục đích của việc thực hiện các nghiên cứu về độc lực là để đánh giá sự hấp thụ, phân phối, chuyển hóa và bài tiết (ADME) của một chất hóa học.
Cần xem xét sự cần thiết của các nghiên cứu độc lực in vivo, để xác định các quá trình hấp thụ, phân phối, chuyển hóa và loại bỏ các chất ngâm chiết và sản phẩm phân hủy của trang thiết bị y tế, vật liệu và/hoặc dịch chiết của chúng (xem 6.3.2.13 và TCVN 7391-16 (ISO 10993-16)) phải được xem xét dựa trên kết quả từ các nghiên cứu phân hủy in vitro.
Khi quyết định có hay không tiến hành các nghiên cứu độc lực như một phần của quá trình đánh giá sinh học của một trang thiết bị y tế, thành phẩm và các thành phần hóa học của nó, bao gồm các sản phẩm phân hủy tiềm ẩn, được thiết kế và chất ngâm chiết kết hợp với mục đích sử dụng của trang thiết bị y tế, tất cả phải được tính đến (xem 6.3.2.13).
Khi thích hợp, các quá trình phân hủy lý thuyết phải được khảo sát trước khi nghiên cứu độc lực bằng các thí nghiệm in vitro (ví dụ: mô, chất đồng nhất hoặc tế bào), không chỉ vì lý do phúc lợi động vật như đã nêu trong TCVN 7391-2 (ISO 10993-2), mà còn để xác định các sản phẩm có thể xảy ra hơn là các sản phẩm phân hủy.
Các nghiên cứu về độc lực phải được xem xét nếu:
a) trang thiết bị y tế được thiết kế để có khả năng hấp thụ được, hoặc
b) trang thiết bị y tế là bộ phận cấy ghép tiếp xúc lâu dài và đã biết hoặc có khả năng bị phân hủy hoặc ăn mòn đáng kể, và/hoặc xuất hiện sự di chuyển của chất ngâm chiết từ trang thiết bị y tế, hoặc
c) trang thiết bị y tế có khả năng hoặc được biết là thôi ra một lượng đáng kể các sản phẩm phân hủy phản ứng hoặc độc hại tiềm ẩn và chất ngâm chiết vào cơ thể trong quá trình sử dụng lâm sàng, hoặc
d) một lượng đáng kể các vật thể nano có khả năng được thôi ra từ một trang thiết bị y tế vào cơ thể trong quá trình sử dụng lâm sàng, hoặc
e) các sản phẩm kết hợp thuốc và thiết bị.
Các nghiên cứu về độc lực không bắt buộc nếu tốc độ đạt được hoặc dự kiến của việc thôi ra các sản phẩm phân hủy và chất ngâm chiết từ một trang thiết bị y tế hoặc vật liệu cụ thể đã được đánh giá là cung cấp mức độ phơi nhiễm lâm sàng an toàn với kinh nghiệm lịch sử, hoặc nếu có đủ dữ liệu độc tính hoặc dữ liệu độc lực liên quan đến các sản phẩm phân hủy và chất ngâm chiết đã tồn tại.
Việc thôi ra các chất ngâm chiết và các sản phẩm phân hủy từ kim loại, hợp kim và gốm sứ thường quá thấp để luận giải cho các nghiên cứu độc lực, trừ khi vật liệu được thiết kế để phân hủy.
Các nghiên cứu về độc lực đối với các sản phẩm phân hủy và chất chiết /ngâm chiết, nếu được thực hiện, phải được tiến hành theo TCVN 7391-16 (ISO 10993-16).
Các xem xét cụ thể đối với các nghiên cứu về độc lực với vật liệu nano được nêu trong ISO/TR 10993-22.
6.3.2.15 Độc tính miễn dịch
Mặc dù không được đề cập cụ thể trong Phụ lục A, ISO/TS 10993-20 cung cấp tổng quan về độc tính miễn dịch với tham chiếu cụ thể đến khả năng gây độc tính miễn dịch của các trang thiết bị y tế. Thử nghiệm độc tính miễn dịch phải được xem xét dựa trên bản chất hóa học của vật liệu sản xuất và dữ liệu từ các nguồn gợi ý về tác dụng độc tính miễn dịch hoặc nếu khả năng sinh miễn dịch của các hóa chất là không xác định. Nếu thử nghiệm độc tính miễn dịch được thực hiện, phải tiến hành theo ISO/TS 10993-20.
Các xem xét cụ thể đối với thử nghiệm độc tính miễn dịch của vật liệu nano được quy định trong ISO/TR 10993-22.
7 Diễn giải dữ liệu đánh giá sinh học và đánh giá rủi ro sinh học tổng thể
Các chuyên gia đánh giá có kiến thức và kinh nghiệm cần thiết phải xác định và lập thành văn bản:
a) chiến lược và nội dung dự kiến để đánh giá sinh học của trang thiết bị y tế;
b) các tiêu chí để xác định khả năng chấp nhận của vật liệu đối với mục đích đã định, phù hợp với kế hoạch quản lý rủi ro;
c) tính đầy đủ của đặc trưng vật liệu;
d) lý do để lựa chọn và/hoặc từ bỏ các thử nghiệm;
e) việc giải thích dữ liệu hiện có và kết quả thử nghiệm;
f) nhu cầu về các dữ liệu bổ sung để hoàn thành việc đánh giá sinh học;
g) các kết luận về an toàn sinh học tổng thể đối với trang thiết bị y tế.
Phụ lục A cung cấp thông tin các điểm cuối chung cần được xem xét đối với từng loại tiếp xúc thiết bị và loại thời gian trong đánh giá rủi ro sinh học.
Phụ lục A
(tham khảo)
Các điểm cuối cần giải quyết trong đánh giá rủi ro sinh học
A.1 Yêu cầu chung
Sau đây là khung để phát triển đánh giá tính tương thích sinh học và không phải là danh mục thử nghiệm. Trong trường hợp Bảng A.1 cho thấy một điểm cuối phù hợp để đánh giá, thì các bộ dữ liệu hiện có liên quan đến điểm cuối đó phải được đánh giá để xác định xem có cần thêm bộ dữ liệu nào không. Đối với các trang thiết bị y tế cụ thể, có khả năng là thích hợp để bao gồm các điểm cuối bổ sung hoặc ít hơn so với chỉ định.
Trong Bảng A.1: X có nghĩa là thông tin tiên quyết cần thiết để đánh giá rủi ro; E có nghĩa là các điểm cuối được đánh giá trong đánh giá rủi ro (thông qua việc sử dụng dữ liệu hiện có, thử nghiệm bổ sung cho điểm cuối cụ thể hoặc lý do tại sao việc đánh giá điểm cuối không yêu cầu đánh giá bộ dữ liệu bổ sung).
Bất kỳ sự thay đổi nào cũng cần được chứng minh trong đánh giá rủi ro sinh học. Nếu có các tiêu chuẩn dành riêng cho thiết bị bao gồm các khuyến nghị cụ thể liên quan đến tính tương thích sinh học, thì những tiêu chuẩn này cần được xem xét.
Bảng A.1 - Các điểm cuối cần giải quyết trong đánh giá rủi ro sinh học
| Cách phân loại trang thiết bị y tế theo | Điểm cuối đánh giá sinh học | ||||||||||||||||
| Bản chất tiếp xúc với cơ thể | Thời gian tiếp xúc | Thông tin vật lý và/ hoặc hóa học | Độc tính tế bào | Độ nhạy cảm | Kích ứng hoặc phản ứng trong da | Phản ứng gây sốt qua trung gian vật liệua | Độc tính cấp tínhb | Độc tính bán cấp tínhb | Độc tính bán trường diễnb | Độc tính trường diễnb | Hiệu ứng cấy ghép b,c | Tính tương thích với máu | Độc tính gend | Khả năng gây ung thưd | Độc tính sinh sản / phát triển d,e | Phân hủyf | |
| Phân loại | Tiếp xúc | A-giới hạn (≤ 24 h) B-kéo dài (> 24 h đến 30 ngày) C-lâu dài (> 30 ngày) | |||||||||||||||
| Trang thiết bị y tế bề mặt | Da nguyên vẹn | A | Xg | Eh | E | E |
|
|
|
|
|
|
|
|
|
|
|
| B | X | E | E | E |
|
|
|
|
|
|
|
|
|
|
| ||
| C | X | E | E | E |
|
|
|
|
|
|
|
|
|
|
| ||
| Niêm mạc | A | X | E | E | E |
|
|
|
|
|
|
|
|
|
|
| |
| B | X | E | E | E |
| E | E |
|
| E |
|
|
|
|
| ||
| C | X | E | E | E |
| E | E | E | E | E |
| E |
|
|
| ||
| Bề mặt bị xuyên qua hoặc bị tổn thương | A | X | E | E | E | E | E |
|
|
|
|
|
|
|
|
| |
| B | X | E | E | E | E | E | E |
|
| E |
|
|
|
|
| ||
| C | X | E | E | E | E | E | E | E | E | E |
| E | E |
|
| ||
| Trang thiết bị y tế truyền ngoài | Đường huyết, gián tiếp | A | X | E | E | E | E | E |
|
|
|
| E |
|
|
|
|
| B | X | E | E | E | E | E | E |
|
|
| E |
|
|
|
| ||
| C | X | E | E | E | E | E | E | E | E | E | E | E | E |
|
| ||
| Mô/ xương /menl | A | X | E | E | E | E | E |
|
|
|
|
|
|
|
|
| |
| B | X | E | E | E | E | E | E |
|
| E |
| E |
|
|
| ||
| C | X | E | E | E | E | E | E | E | E | E |
| E | E |
|
| ||
| Máu tuần hoàn | A | X | E | E | E | E | E |
|
|
|
| E | E |
|
|
| |
| B | X | E | E | E | E | E | E |
|
| E | E | E |
|
|
| ||
| C | X | E | E | E | E | E | E | E | E | E | E | E | E |
|
| ||
| Trang thiết bị y tế cấy ghép | Mô/ xương | A | X | E | E | E | E | E |
|
|
|
|
|
|
|
|
|
| B | X | E | E | E | E | E | E |
|
| E |
| E |
|
|
| ||
| C | X | E | E | E | E | E | E | E | E | E |
| E | E |
|
| ||
| Máu | A | X | E | E | E | E | E |
|
|
| E | E | E |
|
|
| |
| B | X | E | E | E | E | E | E |
|
| E | E | E |
|
|
| ||
| C | X | E | E | E | E | E | E | E | E | E | E | E | E |
|
| ||
| a Tham khảo Phụ lục F. b Thông tin thu được từ các đánh giá toàn diện về cấy ghép bao gồm độc tính toàn thân cấp tính, độc tính bán cấp tính, độc tính bán trường diễn và/hoặc độc tính trường diễn có thể phù hợp nếu đưa vào và đánh giá đủ số lượng động vật và mốc thời gian. Không phải lúc nào cũng cần thực hiện các nghiên cứu riêng biệt đối với độc tính cấp tỉnh, bán cấp tính, bán trường diễn và trường diễn. c Các vị trí cấy ghép có liên quan cần được xem xét. Ví dụ: các trang thiết bị y tế tiếp xúc với niêm mạc còn nguyên vẹn, lý tưởng nên được nghiên cứu/xem xét có tiếp xúc với niêm mạc còn nguyên vẹn hay không. d Nếu trang thiết bị y tế có thể chứa các chất được biết là gây ung thư, gây đột biến và/hoặc độc hại đối với sinh sản, điều này cần được xem xét trong đánh giá rủi ro. e Độc tính sinh sản và phát triển cần được giải quyết đối với các vật liệu mới, vật liệu có độc tính sinh sản hoặc phát triển đã biết, trang thiết bị y tế có quần thể mục tiêu liên quan (ví dụ: phụ nữ mang thai), và/hoặc trang thiết bị y tế có khả năng có vật liệu thiết bị y tế tại chỗ trong các cơ quan sinh sản. f Thông tin về sự phân hủy phải được cung cấp cho các trang thiết bị y tế, các thành phần trang thiết bị y tế hoặc vật liệu còn lại trong bệnh nhân, có khả năng bị phân hủy. g X là thông tin tiên quyết cần thiết để đánh giá rủi ro. h E có nghĩa là các điểm cuối được đánh giá trong đánh giá rủi ro (thông qua việc sử dụng dữ liệu hiện có, thử nghiệm bổ sung cho điểm cuối cụ thể hoặc lý do tại sao việc đánh giá điểm cuối không yêu cầu một bộ dữ liệu bổ sung). Nếu một trang thiết bị y tế được sản xuất từ các vật liệu mới, trước đây chưa được sử dụng trong các ứng dụng trang thiết bị y tế và không có dữ liệu về chất độc trong tài liệu, thì các điểm cuối bổ sung ngoài những điểm được đánh dấu “E” trong bảng này cần được xem xét. Đối với các trang thiết bị y tế cụ thể, có khả năng là thích hợp để bao gồm các điểm cuối bổ sung hoặc ít hơn so với chỉ định. l Mô bao gồm dịch mô và khoảng dưới da. Đối với các thiết bị hoặc bộ phận dẫn khí chỉ tiếp xúc với mô gián tiếp, hãy xem các tiêu chuẩn cụ thể của thiết bị để biết thông tin về tính tương thích sinh học liên quan đến các trang thiết bị y tế này. j Đối với tất cả các trang thiết bị y tế được sử dụng trong mạch ngoài cơ thể. | |||||||||||||||||
A.2 Cơ sở lý luận cho các điểm cuối trong Bảng A.1
Các điểm cuối sau đây không có trong lần xuất bản trước của tiêu chuẩn này. Cơ sở lý luận của việc đưa từng điểm cuối vào bản sửa đổi này được đề cập dưới đây.
- Thông tin vật lý và/hoặc hóa học (tất cả các loại trang thiết bị y tế, với tất cả các loại tiếp xúc và tất cả các thời gian tiếp xúc).
Thông tin này được sử dụng cho tất cả các loại trang thiết bị y tế để xác định xem có cần thử nghiệm sinh học thêm hay không.
- Kích ứng hoặc phản ứng trong da (trang thiết bị y tế truyền ngoài, tiếp xúc gián tiếp qua đường huyết và thời gian tiếp xúc lâu dài).
Các thành phần tiếp xúc lâu dài gián tiếp với máu (ví dụ như hệ thống truyền dịch) có thể đưa các chất gây kích ứng vào dòng máu can được đề cập như một phần của đánh giá rủi ro sinh học.
- Độc tính toàn thân cấp tính qua trung gian vật liệu (trang thiết bị y tế có tiếp xúc bề mặt bị xuyên qua hoặc bị tổn thương và tất cả các thời gian tiếp xúc).
Các chất chiết/ngâm chiết có thể được đưa vào hệ tuần hoàn thông qua các bề mặt bị xuyên qua hoặc bị tổn thương, và do đó cần xem xét cả khả năng gây sốt qua trung gian vật liệu và độc tính toàn thân cấp tính.
- Khả năng gây sốt qua trung gian vật liệu (trang thiết bị y tế truyền ngoài và trang thiết bị y tế cấy ghép với tất cả các loại tiếp xúc, và tất cả các thời gian tiếp xúc).
Các chất chiết/ngâm chiết có thể được đưa vào hệ tuần hoàn hệ thống, hệ bạch huyết và/hoặc dịch não tùy, và do đó cần xem xét khả năng gây sốt qua trung gian vật liệu.
- Độc tính toàn thân cấp tính (trang thiết bị y tế có bề mặt tiếp xúc với niêm mạc và tiếp xúc kéo dài hoặc lâu dài; và trang thiết bị y tế truyền ngoài có tiếp xúc với mô/xương/ men răng trong một thời gian giới hạn; và cấy ghép các trang thiết bị y tế có tiếp xúc với mô/xương trong một thời gian giới hạn).
Các chất chiết/ngâm chiết có thể được đưa vào qua niêm mạc và đến hệ tuần hoàn toàn thân, hệ bạch huyết và/hoặc dịch não tủy, và do đó cần phải xem xét đến độc tính toàn thân cấp tính.
- Độc tính bán cấp (tất cả các loại trang thiết bị y tế tiếp xúc kéo dài và tiếp xúc lâu dài).
Đối với các trang thiết bị y tế/thành phần có thời gian sử dụng hơn 24 h, các chất chiết/ngâm chiết có thể được đưa vào hệ tuần hoàn toàn thân, hệ bạch huyết và/hoặc dịch não tủy, và do đó cần xem xét độc tính bán cấp.
- Độc tính bán trường diễn và trường diễn (tất cả các loại trang thiết bị y tế tiếp xúc lâu dài).
Đối với các trang thiết bị y tế/thành phần có thời gian sử dụng ít nhất 30 ngày, các chất chiết/ngâm chiết có thể được đưa vào hệ tuần hoàn toàn thân, hệ bạch huyết và/hoặc dịch não tủy, và do đó cần xem xét độc tính bán trường diễn và/hoặc trường diễn.
- Hiệu ứng cấy ghép (trang thiết bị y tế có bề mặt tiếp xúc với niêm mạc và tiếp xúc kéo dài hoặc lâu dài; và trang thiết bị y tế bề mặt có tiếp xúc bề mặt bị xuyên qua hoặc bị tổn thương và tiếp xúc kéo dài hoặc lâu dài).
Đối với các trang thiết bị y tế/thành phần có loại tiếp xúc này, cần xem xét các ảnh hưởng tại chỗ và toàn thân do cấy ghép. Đối với các trang thiết bị y tế/thành phần mà việc sử dụng lặp lại có thể thay đổi phân loại theo thời gian tiếp xúc từ thời gian giới hạn sang thời gian kéo dài hoặc lâu dài, thông tin về khả năng tích tụ hóa chất trong mô có thể được sử dụng để thông báo liệu có nên xem xét thử nghiệm cấy ghép hay không.
- Hiệu ứng cấy ghép (trang thiết bị y tế truyền ngoài, tiếp xúc gián tiếp qua đường huyết và thời gian lâu dài).
Các thành phần có tiếp xúc gián tiếp lâu dài với máu (ví dụ: hệ thống truyền dịch) có thể đưa chất chiết/ngâm chiết vào dòng máu có thể tác động đến phản ứng viêm đối với các thành phần tiếp xúc trực tiếp của trang thiết bị y tế (nếu có). Nếu tài liệu có sẵn đề cập đến độc tính toàn thân của tất cả các chất chiết /ngâm chiết, và không có thành phần tiếp xúc trực tiếp, thì có thể không cần đánh giá cấy ghép đối với loại này.
- Độc tính gen (các trang thiết bị y tế truyền ngoài, tiếp xúc với máu tuần hoàn trong một thời gian giới hạn).
Đối với các trang thiết bị y tế/thành phần được sử dụng trong mạch ngoài cơ thể, các chất chiết/ngâm chiết có thể được đưa vào dòng máu và vẫn tồn tại sau khi trang thiết bị y tế được lấy ra, và do đó cần xem xét đến độc tính gen.
- Độc tính gen (cấy ghép các trang thiết bị y tế, tiếp xúc với máu trong thời gian giới hạn).
Các chất chiết/ngâm chiết có thể được đưa vào dòng máu và vẫn tồn tại sau khi trang thiết bị y tế được lấy ra, và do đó cần xem xét đến độc tính gen.
- Khả năng gây ung thư (trang thiết bị y tế bề mặt có tiếp xúc bề mặt bị xuyên qua hoặc bị tổn thương trong thời gian lâu dài; và tất cả các trang thiết bị y tế truyền ngoài và trang thiết bị y tế cấy ghép có thời gian lâu dài).
Các chất chiết/ngâm chiết có thể được đưa vào hệ tuần hoàn toàn thân, hệ bạch huyết và/hoặc dịch não tủy, và do đó khả năng gây ung thư phải được xem xét như một phần của đánh giá rủi ro sinh học.
Phụ lục B
(tham khảo)
Hướng dẫn thực hiện đánh giá sinh học trong quá trình quản lý rủi ro
B.1 Thông tin cơ bản
B.1.1 Yêu cầu chung
Phụ lục này cung cấp hướng dẫn về việc tiến hành đánh giá sinh học các trang thiết bị y tế theo các yêu cầu của tiêu chuẩn này. Mặc dù tiêu chuẩn này cung cấp một khung chung để đánh giá sinh học các trang thiết bị y tế, hướng dẫn chi tiết hơn có thể hữu ích trong việc áp dụng thực tế của tiêu chuẩn này. Do đó, Phụ lục này được phát triển để cung cấp hướng dẫn như vậy cho người sử dụng. Hướng dẫn này có thể được sử dụng để hiểu rõ hơn các yêu cầu của tiêu chuẩn này và để minh họa một số phương pháp và cách tiếp cận khác nhau có sẵn nhằm đáp ứng các yêu cầu.
Đánh giá sinh học là một hoạt động thẩm định thiết kế được đặt trong bối cảnh của các quá trình quản lý rủi ro rộng lớn hơn. Do đó, phụ lục này bao gồm hướng dẫn về việc áp dụng tiêu chuẩn này trong bối cảnh các quá trình quản lý rủi ro được tiến hành theo các yêu cầu của TCVN 8023 (ISO 14971). Phụ lục này mô tả các khái niệm và phương pháp có thể được xem xét trong việc thiết lập và duy trì quá trình quản lý rủi ro để đánh giá sinh học như một phần đánh giá tổng thể và phát triển một trang thiết bị y tế.
Khi kiến thức khoa học nâng cao hiểu biết của con người về các cơ chế cơ bản của phản ứng mô, cách thức đánh giá sinh học được thực hiện cũng có thể thay đổi, tiến tới đánh giá dựa trên việc xem xét các dữ liệu khoa học có liên quan và dựa trên đặc trưng vật lý, hóa học và thử nghiệm in vitro, với thử nghiệm in vivo chỉ được thực hiện khi được yêu cầu để lấp đầy những khoảng trống trong hiểu biết của con người. Tiêu chuẩn này quy định một khung để lập kế hoạch đánh giá sinh học nhằm giảm thiểu số lượng và mức độ phơi nhiễm của động vật thử nghiệm bằng cách ưu tiên nhận dạng thử nghiệm thành phần hóa học và mô hình in vitro trong các tình huống mà các phương pháp này cung cấp thông tin liên quan tương đương với thông tin thu được từ mô hình in vivo. Việc lựa chọn cách tiếp cận nào có thể áp dụng cho một trang thiết bị y tế cụ thể sẽ phụ thuộc vào bản chất của trang thiết bị y tế, mức độ dữ liệu khoa học liên quan sẵn có và khi đánh giá rủi ro.
Khi đánh giá khả năng áp dụng của hướng dẫn trong phụ lục này, cần xem xét các yêu cầu và hướng dẫn theo quy định hiện hành.
Một tổ chức có thể tự nguyện kết hợp toàn bộ hoặc một phần hướng dẫn từ phụ lục này vào quá trình quản lý rủi ro của mình.
Hướng dẫn trong phụ lục này là thông tin cơ bản đối với những người đại diện cho các chuyên gia đánh giá quá trình quản lý rủi ro, các tổ chức đánh giá sự phù hợp và các cơ quan có thẩm quyền.
B.1.2 Mối quan hệ với các tiêu chuẩn, tài liệu hướng dẫn và các yêu cầu quy định khác
Mối quan hệ giữa tiêu chuẩn này, phụ lục này và các tiêu chuẩn đánh giá sinh học các trang thiết bị y tế và quản lý rủi ro chung được tóm tắt như sau:
- phụ lục này cung cấp hướng dẫn về việc áp dụng tiêu chuẩn này;
- đánh giá sinh học là một thành phần của quản lý rủi ro và Phụ lục này bao gồm hướng dẫn về việc áp dụng TCVN 8023 (ISO 14971) để tiến hành đánh giá sinh học.
Phụ lục này không bổ sung hoặc thay đổi các yêu cầu của tiêu chuẩn này. Phụ lục này không bao gồm các yêu cầu được sử dụng làm cơ sở của các hoạt động đánh giá chứng nhận hoặc kiểm tra theo quy định.
B.2 Đánh giá sinh học như một thực hành quản lý rủi ro
B.2.1 Yêu cầu chung
B.2 và B.3 mô tả một quá trình liên tục trong đó nhà sản xuất có thể nhận dạng các nguy cơ sinh học liên quan đến trang thiết bị y tế, ước tính và đánh giá các rủi ro, kiểm soát các rủi ro này và theo dõi hiệu quả của việc kiểm soát, cần đạt được sự bảo vệ thích hợp cho bệnh nhân bằng cách thực hiện một kế hoạch đánh giá sinh học, trong đó bao gồm việc xem xét các rủi ro và lợi ích của các trang thiết bị y tế như một yếu tố cần thiết. Lợi ích cho bệnh nhân từ việc sử dụng các trang thiết bị y tế đồng nghĩa với việc chấp nhận những rủi ro tiềm ẩn. Những rủi ro này sẽ khác nhau tùy thuộc vào bản chất và mục đích sử dụng của trang thiết bị y tế cụ thể. Mức độ rủi ro có thể chấp nhận được đối với một trang thiết bị y tế cụ thể sẽ phụ thuộc vào lợi ích mong đợi do việc sử dụng thiết bị đó mang lại.
Việc xem xét rủi ro sinh học chỉ là một khía cạnh của việc đánh giá rủi ro của một trang thiết bị y tế, cần xem xét tất cả các khía cạnh của rủi ro. Trong một số trường hợp, có thể đặc biệt cần thiết phải xem xét các lợi ích tương đối của các vật liệu có cấu hình an toàn sinh học khác nhau trong bối cảnh của một số đặc trưng khác. Ví dụ: có thể vật liệu an toàn sinh học nhất hiện có có thể có độ bền cơ học không thể chấp nhận được, trong trường hợp đó, cần phải xem xét liệu vật liệu thay thế mạnh hơn có an toàn sinh học được chấp nhận hay không. Điều cơ bản đối với việc tiến hành đánh giá sinh học là được thực hiện như một phần của quá trình quản lý rủi ro tổng thể cần thiết trong thiết kế và phát triển trang thiết bị y tế.
Lựa chọn vật liệu và phân tích rủi ro là những thành phần không thể thiếu trong quá trình thiết kế các trang thiết bị y tế. Việc lựa chọn vật liệu đóng một vai trò quan trọng trong việc đánh giá an toàn sinh học và khi được tiếp cận một cách có hệ thống, sẽ cho phép thu thập các dữ liệu liên quan. Các tiêu chí để xác định rủi ro sinh học có thể chấp nhận được, phù hợp với TCVN ISO 13485 (ISO 13485) và TCVN 8023 (ISO 14971), phải được thiết lập khi bắt đầu quá trình thiết kế. Bởi vì các biến thể về nguyên liệu ban đầu, công thức và chế biến bao gồm đóng gói, vận chuyển và già hóa có thể ảnh hưởng đến tính tương thích sinh học của thành phẩm; những xem xét này cũng cần được đưa vào đánh giá rủi ro. Đánh giá sinh học phải được thiết kế và thực hiện để chứng minh việc đạt được các tiêu chí cụ thể về an toàn dựa trên kết quả đầu ra của phân tích rủi ro và/hoặc lịch sử sử dụng cùng một loại vật liệu. Đánh giá này là một thành phần của kế hoạch quản lý rủi ro bao gồm việc nhận dạng tất cả các nguy cơ và ước tính các rủi ro liên quan. Đánh giá rủi ro đầy đủ yêu cầu đặc trưng của các nguy cơ và sự phơi nhiễm độc tính, cũng như các đáp ứng sinh học tiềm ẩn khác đối với các trang thiết bị y tế.
Một thành phần chính trong nhận dạng nguy cơ là đặc trưng vật liệu (xem TCVN 7391-18 (ISO 10993-18) và TCVN 7391-19 (ISO/TR 10993-19)). Các bước sau có thể được nhận dạng:
- xác định và đặc trưng của từng vật liệu, bao gồm cả các vật liệu thay thế thích hợp;
- nhận dạng các nguy cơ trong vật liệu, phụ gia, chất hỗ trợ chế biến, v.v...;
- nhận dạng tác động tiềm ẩn của quá trình xử lý sản phẩm đầu ra (ví dụ: tương tác hóa học giữa các thành phần vật liệu hoặc quá trình tiệt khuẩn thành phẩm) đối với các hóa chất có trong thành phẩm;
- nhận dạng các hóa chất có thể bị thôi ra trong quá trình sử dụng sản phẩm (ví dụ: các sản phẩm phân hủy trung gian hoặc thành phẩm từ thiết bị cấy ghép có thể bị phân hủy);
- ước tính mức độ phơi nhiễm (tổng số hoặc lượng có sẵn trên lâm sàng);
- xem xét độc tính và các dữ liệu an toàn sinh học khác (đã xuất bản/có sẵn).
Thông tin về an toàn sinh học cần được xem xét có thể bao gồm:
- dữ liệu độc tính về các vật liệu/hợp chất thành phần có liên quan;
- thông tin về việc sử dụng trước các vật liệu/hợp chất thành phần có liên quan;
- dữ liệu từ các thử nghiệm sinh học.
Sau đó cần đánh giá các rủi ro do các nguy cơ đã nhận dạng, ở giai đoạn này, có thể xác định liệu có rủi ro độc tính quá mức từ vật liệu hay không.
Nếu có thể kết luận từ dữ liệu hiện có rằng rủi ro có thể chấp nhận được thì không cần thử nghiệm bổ sung để hỗ trợ an toàn sinh học. Không nên tiến hành thử nghiệm nếu các rủi ro được phát hiện là không thể chấp nhận được. Khi dữ liệu hiện có không đủ, cần thu thập thêm thông tin. Mục đích của thử nghiệm là để có thêm dữ liệu có thể giúp đưa ra kết luận. Do đó, cơ sở lý luận cho việc thử nghiệm phải dựa trên phân tích các rủi ro liên quan được chỉ ra từ dữ liệu hiện có.
Kết quả của các thử nghiệm cần được đánh giá. Báo cáo thử nghiệm phải bao gồm bằng chứng mô tả, đánh giá các phát hiện và đánh giá định tính về khả năng chấp nhận của chúng.
Người đánh giá cần xác định xem thông tin sẵn có có đủ để đáp ứng mục đích của việc đánh giá an toàn sinh học hay không và nếu có thì ghi lại kết luận về độ an toàn bao gồm cơ sở lý luận cho các quyết định, tác động của kết quả thử nghiệm và các thông tin khác về đánh giá.
Việc đánh giá phải được lập thành văn bản trong một báo cáo chỉ rõ danh tính và tầm quan trọng của tất cả các bằng chứng liên quan và nêu bật cơ sở khoa học của các kết luận tổng thể một cách chính xác, rõ ràng và minh bạch. Điều rất quan trọng là các yếu tố dẫn đến kết luận phải được thảo luận đầy đủ với những lý do ngắn gọn và chính xác cho mỗi phán đoán, đồng thời nhận dạng và thảo luận về mọi sự không chắc chắn nằm trong mỗi quyết định.
Các thành phần của quản lý rủi ro được tóm tắt trong Hình B.1 (lấy từ TCVN 8023 (ISO 14971)). Các yếu tố khác nhau của quá trình đánh giá sinh học có thể được xem xét dưới góc độ các yếu tố của quá trình quản lý rủi ro tổng thể.
Tóm lại, đánh giá sinh học nên được coi là một yếu tố của thực hành quản lý rủi ro và do đó việc tiến hành đánh giá sinh học đối với trang thiết bị y tế phải nhằm đáp ứng cả các yêu cầu của tiêu chuẩn này và TCVN 8023 (ISO 14971).
B.2.2 Kế hoạch đánh giá sinh học
Điều 3.4 của TCVN 8023:2009 (ISO 14971:2007) yêu cầu phải lập kế hoạch trước các hoạt động quản lý rủi ro. Vì đánh giá sinh học là một hoạt động quản lý rủi ro, nên cần có Kế hoạch đánh giá sinh học và điều này là một phần của Kế hoạch quản lý rủi ro. Cần nhấn mạnh rằng chỉ cần lập kế hoạch tiến hành thử nghiệm đối với tất cả các khía cạnh của tính tương thích sinh học được nhận dạng trong Phụ lục A là không đáp ứng các yêu cầu của TCVN 8023 (ISO 14971) hoặc tiêu chuẩn này. Có thể xem ví dụ về cách áp dụng hướng dẫn này cho trang thiết bị y tế trong ISO 18562-1.
Kế hoạch đánh giá sinh học phải được lập bởi một nhóm có kiến thức và kinh nghiệm, bao gồm tối thiểu:
- sắp xếp thu thập thông tin áp dụng từ các tài liệu đã xuất bản (bao gồm các nguồn thông tin và chiến lược tìm kiếm), dữ liệu nội bộ và nhà cung cấp, các nguồn khác để tiến hành phân tích rủi ro;
- các thỏa thuận để tiến hành đánh giá, bao gồm yêu cầu đối với các năng lực kỹ thuật cụ thể liên quan đến ứng dụng trang thiết bị y tế cụ thể;
- sắp xếp để xem xét và phê duyệt kế hoạch như một phần của quá trình kiểm soát thiết kế tổng thể;
- sắp xếp để xem xét các kết luận cuối cùng của việc đánh giá và phê duyệt các thử nghiệm bổ sung được yêu cầu;
- sắp xếp để xem xét và phê duyệt lần cuối các kết quả của đánh giá rủi ro sinh học, bao gồm các biện pháp kiểm soát rủi ro được áp dụng và tài liệu về mọi rủi ro tồn dư và việc công bố các rủi ro tồn dư thông qua các phương tiện như ghi nhãn sản phẩm.

Hình B.1 - Sơ đồ mô tả quá trình quản lý rủi ro (lấy từ TCVN 8023 (ISO 14971))
B.3 Hướng dẫn về quản lý rủi ro
B.3.1 Đánh giá rủi ro
B.3.1.1 Giới thiệu
Đánh giá rủi ro là sự kết hợp của các quá trình phân tích rủi ro trong đó rủi ro được nhận dạng, ước tính và định lượng rủi ro, trong đó rủi ro được đánh giá để nhận dạng những rủi ro cần giảm thiểu (kiểm soát rủi ro).
B.3.1.2 Phân tích rủi ro
Phân tích rủi ro là quá trình nhận dạng các nguy cơ cụ thể và đánh giá tầm quan trọng của chúng. Trong đánh giá sinh học, một điều quan trọng cần xem xét là độc tính tiềm ẩn của các thành phần vật liệu và đường phơi nhiễm của chúng. Một xem xét quan trọng khác là các đặc trưng vật lý có thể ảnh hưởng đến đáp ứng sinh học như thế nào. Việc phân tích rủi ro phải được tiến hành một cách có phương pháp bằng cách ước lượng rủi ro từ từng vật liệu/thành phần đối với từng đường phơi nhiễm và tác động độc hại.
Do đó, phân tích rủi ro bắt đầu bằng việc nhận biết và đặc trưng vật liệu và thành phần tiếp xúc trực tiếp và gián tiếp với mô của trang thiết bị y tế. Việc này phải được thực hiện dựa trên hình thức cuối cùng của trang thiết bị y tế ở trạng thái sản xuất, có tính đến sự có mặt của các chất phụ gia sản xuất, chất hỗ trợ chế biến hoặc các chất gây ô nhiễm tiềm ẩn khác như dư lượng chất tiệt khuẩn. Ảnh hưởng của quá trình xử lý đến thành phần vật liệu và hóa học (bao gồm cả ảnh hưởng đến vật liệu dạng rời và bề mặt) cũng cần được xem xét. Đặc biệt, khi các thành phần phản ứng hoặc độc hại đã được sử dụng hoặc có thể được hình thành từ quá trình sản xuất, chế biến, bảo quản hoặc phân hủy vật liệu, thì khả năng tồn tại dư lượng độc chất cần được xem xét. Cũng cần xem xét khả năng tương tác hoặc đưa các chất gây ô nhiễm từ vật liệu đóng gói vào.
Các đặc trưng vật lý và hóa học có liên quan đến an toàn sinh học và sẽ cần được nhận dạng ở giai đoạn này. Chúng có thể bao gồm một hoặc nhiều điều sau:
- mòn, tải, mỏi, ví dụ: đặc biệt là trong các trang thiết bị y tế chịu lực chẳng hạn như khớp giả toàn phần và việc sản xuất liên quan của các vật liệu dạng hạt (có thể bao gồm vật liệu nano) hoặc sự phân hủy của vật liệu;
- ma sát và kích ứng liên quan, ví dụ: trong các ứng dụng như ống thông;
- tương tác giữa các tổ hợp vật liệu (tương tác hóa học), ví dụ: tính linh hoạt khác nhau, ăn mòn điện, mài mòn;
- nhiệt (ví dụ: sự phân hủy do nhiệt hoặc các thay đổi vật liệu khác do nhiệt gây ra);
- quá trình sản xuất, ví dụ: ứng suất bên trong tạo ra có thể thúc đẩy nứt do ứng suất môi trường (ESC), thay đổi hình thái, hoặc phân hủy;
- các tương tác với môi trường, ví dụ: ống nội soi (axit dạ dày), băng gạc (môi trường bên ngoài), tia cực tím, chất tẩy rửa, quá trình khử nhiễm và tiệt khuẩn;
- điện, ví dụ: ngắn mạch, phân hủy, nóng, kích thích cơ;
- tương tác tiềm ẩn giữa các thành phần;
- ảnh hưởng của dạng vật chất, ví dụ: vật liệu dạng hạt, có thể bao gồm vật liệu nano;
- chế biến;
- sự vận chuyển và già hóa.
Thông tin vật liệu có thể được thu thập thông qua việc xem xét tài liệu, dữ liệu nhà cung cấp, dữ liệu nội bộ hoặc so sánh với các sản phẩm hiện có trên thị trường đã biết về quá trình sản xuất và công thức cũng như trong trang thiết bị y tế đang được đánh giá.
CHÚ THÍCH 1: Phụ lục C cung cấp thông tin hướng dẫn về việc tiến hành xem xét tài liệu.
Sau đó, việc đặc trưng hóa học cần được tiếp theo bằng cách xem xét độc tính của các thành phần vật liệu đã biết. Bản chất cụ thể này của các tác động độc hại và mối quan hệ giữa liều lượng và phản ứng cần được xem xét.
Phạm vi ảnh hưởng của chất độc rất rộng. Điều 5 và Phụ lục A cung cấp thông tin hướng dẫn về các tác động độc hại liên quan đối với các đường phơi nhiễm và thời gian phơi nhiễm khác nhau.
Ngoài việc đặc trưng của các chất chiết và chất ngâm chiết, cần xem xét các đặc trưng vật lý của trang thiết bị y tế có thể tác động xấu đến đáp ứng sinh học đối với trang thiết bị y tế, chẳng hạn như đặc trưng hình học, độ cứng, v.v...
CHÚ THÍCH 2: Đối với việc đặc trưng và thử nghiệm của các vật liệu dạng hạt, vật liệu nano cần có sự chú ý cụ thể, bởi vì vật liệu có thành phần dưới micromet (ví dụ: vật liệu nano), trong một số trường hợp, đã được chứng minh là hoạt động khác với các vật liệu tương tự ở quy mô lớn hơn và phép ngoại suy dữ liệu từ vật liệu có kích thước lớn hơn là không thích hợp.
B.3.1.3 Ước lượng rủi ro
Từ quan điểm độc tính hóa học, ước lượng rủi ro ngoài việc xem xét tính độc hại của các thành phần vật liệu được nhận dạng còn bao gồm việc xem xét mức độ phơi nhiễm dự kiến, ví dụ: tính sẵn có sinh học của các thành phần ngâm chiết hoặc hòa tan được (xem TCVN 7391-17 (ISO 10993-17)). Từ khía cạnh tính chất của vật liệu, ước lượng rủi ro cũng bao gồm cả sự phơi nhiễm có thể được dự đoán trước do việc sử dụng trang thiết bị y tế.
Rủi ro thường được ước tính bằng cách gán các giá trị cho xác suất xảy ra tổn hại và tính nghiêm trọng của tổn hại đó. Theo thuật ngữ độc học chung, khả năng có thể được ước tính từ kiến thức về sự sẵn có thực tế của các thành phần độc hại và phản ứng liều lượng đã biết trong các mô liên quan. Tính nghiêm trọng có thể được đánh giá về bản chất của phản ứng độc hại. Từ khía cạnh tính chất của vật liệu, khả năng xảy ra có thể được ước tính từ thử nghiệm vật lý chẳng hạn như các mảnh vụn mài mòn và tính nghiêm trọng có thể được đánh giá về bản chất của đáp ứng sinh học từ tài liệu hoặc nghiên cứu trên động vật.
Nếu không có đủ thông tin từ các tài liệu đã xuất bản, dữ liệu nội bộ và lịch sử lâm sàng được ghi lại bằng tài liệu của các đối tượng trang thiết bị y tế hoặc vật liệu, thì việc ước lượng rủi ro có thể yêu cầu tiến hành đặc trưng hóa học hoặc vật lý hoặc thử nghiệm sinh học để ước tính hoặc định lượng các nguy cơ không thể xác định thỏa đáng từ kiến thức trước. Các cuộc điều tra như vậy phải được tiến hành theo các phần của TCVN 7391 (ISO 10993).
Việc lựa chọn thử nghiệm cho mục đích ước lượng rủi ro chỉ có thể được xác định sau khi hoàn thành việc xem xét kiến thức hiện có, vì các thử nghiệm phải được lựa chọn cụ thể để giải quyết những khiếm khuyết về kiến thức được nhận dạng trong quá trình xem xét (xem Phụ lục C).
Lượng dữ liệu cần thiết để phân tích rủi ro và độ sâu của phân tích sẽ thay đổi theo mục đích sử dụng và phụ thuộc vào bản chất và thời gian tiếp xúc với mô. Yêu cầu về dữ liệu thường ít nghiêm ngặt hơn đối với các vật liệu tiếp xúc gián tiếp với bệnh nhân, trang thiết bị y tế chỉ tiếp xúc với da nguyên vẹn và bất kỳ thành phần nào của trang thiết bị y tế không tiếp xúc trực tiếp với mô cơ thể, chất lỏng dễ lây nhiễm, màng nhầy hoặc da bị tổn thương.
B.3.1.4 Định lượng rủi ro
Định lượng rủi ro được xây dựng dựa trên phân tích rủi ro, thực hiện bước tiếp theo là đánh giá các rủi ro được xác định trong phân tích rủi ro về tầm quan trọng của chúng và nhận dạng các yêu cầu và cơ hội để giảm thiểu (kiểm soát rủi ro), cần nhận ra rằng để đánh giá đầy đủ, toàn bộ trang thiết bị y tế cần được xem xét bao gồm tất cả các bộ phận.
Tính tương thích sinh học chỉ có thể được chứng minh cho một vật liệu cụ thể liên quan đến một nhóm hoàn cảnh xác định, bao gồm mục đích sử dụng vật liệu và các mô tiếp xúc với vật liệu. Ví dụ: việc xem xét độc tính của các hóa chất chiết/ngâm chiết nên được thực hiện trong bối cảnh các đường phơi nhiễm và thời gian phơi nhiễm cũng như ý nghĩa đối với sự sẵn có thực tế của các chất độc tiềm ẩn. Đặc biệt quan trọng là xem xét bất kỳ lịch sử sử dụng lâm sàng nào hoặc dữ liệu phơi nhiễm của con người từ các ứng dụng tương tự có liên quan. Ví dụ các nghiên cứu lâm sàng cho thấy thành phẩm là chất không gây kích ứng có thể hữu ích trong việc biện minh cho việc bỏ sót các nghiên cứu về kích ứng trên động vật. Tuy nhiên, các nghiên cứu lâm sàng về vật liệu cấy ghép nói chung có thể không đủ để biện minh cho việc bỏ sót nghiên cứu cấy ghép thành phẩm, vì sự kết hợp của các vật liệu có thể dẫn đến tác dụng sinh học bất lợi.
Điều quan trọng đối với tính toàn vẹn của định lượng rủi ro sinh học là phải được tiến hành bởi những người đánh giá với kiến thức và chuyên môn cần thiết để xác định chiến lược thích hợp cho việc đánh giá và khả năng đánh giá chặt chẽ các dữ liệu sẵn có và đưa ra các đánh giá đúng đắn về yêu cầu đối với bất kỳ thử nghiệm bổ sung nào. (Xem Điều 7).
B.3.2 Kiểm soát rủi ro
Kiểm soát rủi ro là quá trình nhận dạng và thực hiện các biện pháp nhằm giảm thiểu rủi ro. Trong bối cảnh an toàn sinh học, điều này có thể liên quan đến các hoạt động như xem xét các lựa chọn thay đổi thiết kế. Ví dụ về các chiến lược khả thi bao gồm:
- thay đổi thiết kế để tránh các đường phơi nhiễm nguy hiểm hơn hoặc giảm thời gian phơi nhiễm;
- thay đổi thiết kế để tối ưu hóa các đặc tính bề mặt hình học nhằm giảm thiểu các khu vực mà lưu lượng máu thấp có thể dẫn đến hình thành huyết khối;
- các thay đổi về thiết kế để tránh các hỏng hóc của trang thiết bị y tế (ví dụ: hạt, hoặc tách lớp phủ) có thể dẫn đến các đáp ứng sinh học bất lợi;
- giảm độc tính bằng cách thay đổi công thức hoặc thay đổi vật liệu;
- các thay đổi đối với quá trình sản xuất để giảm hoặc loại bỏ dư lượng độc hại hoặc các chất phụ gia chế biến.
Rủi ro cũng có thể được kiểm soát bằng cách cung cấp dữ liệu để cho phép ước lượng rủi ro chính xác hơn so với ước lượng rủi ro dựa trên các giả định mặc định trong trường hợp xấu nhất. Việc lựa chọn các thử nghiệm phải dựa trên phân tích rủi ro ban đầu để nhận dạng những độ không đảm bảo cần được giải quyết và cách giải quyết chúng phù hợp nhất. Trong một số trường hợp, rủi ro đã nhận dạng mà có một số không chắc chắn có thể được giảm thiểu bằng các phương pháp khác ngoài thử nghiệm (ví dụ: cảnh báo, chống chỉ định).
Nếu các nguy cơ mới hoặc mức độ rủi ro hiện có cao hơn là kết quả của các biện pháp kiểm soát, thì có thể cần phải tiến hành một số thử nghiệm lại.
Cần nhấn mạnh rằng việc tiến hành thử nghiệm trên động vật để giảm thiểu rủi ro chỉ nên được xem xét sau khi tất cả các hành động thay thế (xem xét kiến thức trước đó, đặc trưng hóa học hoặc vật lý, đánh giá in vitro hoặc các phương pháp giảm thiểu thay thế) đã hết.
B.3.3 Đánh giá khả năng chấp nhận rủi ro tồn dư
Sau khi phân tích và đánh giá rủi ro cũng như việc thực hiện các biện pháp kiểm soát rủi ro, cần phải xem xét các phát hiện của các hoạt động trước đó và ghi lại rủi ro tồn dư và quyết định xem có tiết lộ thêm về các rủi ro tồn dư đó hay không, ví dụ: thông qua ghi nhãn, thận trọng hoặc cảnh báo thích hợp.
B.3.4 Giám sát sau sản xuất
Các quá trình đánh giá rủi ro dựa trên sự đánh giá của con người bằng cách sử dụng thông tin sẵn có, được bổ sung bằng thử nghiệm sinh học nếu được yêu cầu. Đánh giá này cần được cập nhật khi cần thiết với thông tin mới có sẵn từ quá trình giám sát sau thị trường về tính năng và độ an toàn của trang thiết bị y tế trong sử dụng lâm sàng thực tế. Việc giám sát này phải bao gồm cả xu hướng của các sự kiện bất lợi liên quan đến trang thiết bị y tế cụ thể được đề cập, cộng với thông tin mới phát sinh liên quan đến các trang thiết bị y tế hoặc vật liệu tương tự có liên quan khác. Việc giám sát cũng nên bao gồm việc xem xét liên tục các tài liệu khoa học có liên quan.
B.4 Hướng dẫn về các khía cạnh cụ thể của đánh giá sinh học
B.4.1 Đặc trưng vật liệu
B.4.1.1 Đặc trưng hóa học
Từ quan điểm thực tế, dữ liệu đặc trưng hóa học hữu ích nhất trong đánh giá sinh học khi:
- các vấn đề có tính chất độc quyền có thể được giải quyết;
- chỉ một hoặc một số lượng nhỏ các thành phần hóa học bị thay đổi trong trang thiết bị y tế;
- có sẵn dữ liệu về độc tính đối với thành phần hóa học;
- các nghiên cứu hóa học chiết /phân tích được thực hiện dễ dàng.
B.4.1.2 Sử dụng dữ liệu đặc trưng hóa học trong đánh giá sinh học
Có một số điều trong tiêu chuẩn này yêu cầu người dùng tiến hành việc đặc trưng hóa học trang thiết bị y tế đang trải qua quá trình đánh giá sinh học. Ví dụ: Điều 4.3 hướng dẫn người dùng tính đến các chất phụ gia dự kiến, chất gây ô nhiễm trong quá trình, dư lượng và chất ngâm chiết về mức độ phù hợp của chúng với đánh giá sinh học tổng thể của trang thiết bị y tế. Tuy nhiên, thực tế, không có hướng dẫn cụ thể nào được đưa ra về cách tính đến thông tin này khi thực hiện đánh giá sinh học.
Từ quan điểm nhận dạng nguy cơ, thông tin về các hợp chất thôi ra từ trang thiết bị y tế có thể hữu ích trong việc lựa chọn các thử nghiệm đánh giá sinh học thích hợp. Ví dụ: nếu một hợp chất được biết là tạo ra các tác dụng độc thận, thì có thể đặc biệt chú ý đến điểm cuối đó khi tiến hành các thử nghiệm độc tính cấp tính hoặc bán trường diễn như mô tả trong TCVN 7391-11 (ISO 10993-11). Thông tin như vậy có thể được sử dụng để tập trung chiến lược thử nghiệm sinh học nhằm giải quyết các điểm cuối phù hợp nhất về mặt lâm sàng.
Dữ liệu đặc trưng hóa học cũng có thể hữu ích cho việc ước lượng rủi ro. Nếu có sẵn dữ liệu về tốc độ hợp chất thôi ra từ trang thiết bị y tế trong các điều kiện mô phỏng môi trường sử dụng và nếu có đủ dữ liệu để đưa ra ngưỡng độc tính liên quan hoặc giới hạn cụ thể về hóa học (xem TCVN 7391-17 (ISO 10993-17) và TCVN 7391-18 (ISO 10993-18)), sau đó có thể so sánh liều nhận được với ngưỡng hoặc giới hạn liên quan để đánh giá khả năng xảy ra tác dụng ngoại ý.
B.4.1.3 Công thức vật liệu độc quyền
Khi dữ liệu cần thiết (ví dụ: dữ liệu công thức hoàn chỉnh) không có sẵn cho nhà sản xuất vì tính bảo mật của thông tin độc quyền, nên yêu cầu nhà cung cấp vật liệu cung cấp về sự sẵn có của các đánh giá sinh học có thể liên quan đến ứng dụng được đề xuất. Trong một số trường hợp, có thể quản lý tính bảo mật của các công thức độc quyền bằng cách nộp hồ sơ riêng biệt bởi nhà sản xuất dữ liệu đánh giá sinh học với người đánh giá độc lập hoặc cơ quan quản lý (được gọi là “Hồ sơ chính” ở một số khu vực pháp lý). Sau đó, những dữ liệu này có thể được tham chiếu trong bản đệ trình theo quy định của nhà sản xuất trang thiết bị y tế và được cơ quan đánh giá sự phù hợp hoặc cơ quan quản lý có liên quan xem xét một cách bí mật cùng với việc xem xét đệ trình trang thiết bị y tế.
B.4.1.4 Đặc trưng vật lý
Đối với các vật liệu dạng hạt và vật liệu nano (khi được sử dụng trong các trang thiết bị y tế) cần phải đặc trưng vật lý, như được mô tả đối với vật liệu nano trong ISO/TR 10993-22. Ngoài ra, trong một số trường hợp, dạng vật lý (ví dụ: dạng hình học, kích thước hạt, độ xốp, kết cấu bề mặt) có thể có ảnh hưởng đáng kể đến tương tác sinh học với trang thiết bị y tế và có thể ảnh hưởng đến an toàn. Trong những trường hợp như vậy, điều quan trọng là phải coi các khía cạnh đó như một phần của định lượng rủi ro. Nếu không có đủ dữ liệu sẵn có từ tài liệu hoặc các nguồn khác để ước lượng rủi ro, thì có thể cần phải tiến hành các cuộc điều tra thêm bằng cách sử dụng các mô hình chức năng thích hợp hoặc các cuộc điều tra khác về ảnh hưởng của dạng vật chất. Những ví dụ bao gồm:
- đánh giá dạng hình học về lưu lượng máu và tính tương thích với máu;
- đánh giá độ xốp trên sự phát triển của mô;
- đánh giá sự thôi ra các hạt mài mòn trên các phản ứng mô tại chỗ và mô ở xa;
- đánh giá kết cấu bề mặt (hình thái bề mặt) về độ bám dính của tế bào, sự biểu hiện kiểu hình và sự tăng trưởng.
B.4.1.5 Ảnh hưởng của quá trình sản xuất
Điều quan trọng là phải xem xét ảnh hưởng của các điều kiện sản xuất đối với vật liệu cũng như việc sử dụng các chất phụ gia hoặc sự hiện diện của các chất gây ô nhiễm. Nói chung, để có thể hỗ trợ an toàn sinh học, việc thử nghiệm vật liệu phải được thực hiện trên các mẫu thử vật liệu đã được xử lý (bao gồm cả tiệt khuẩn nếu có) theo những cách tương đương với vật liệu có trong trang thiết bị y tế thành phẩm được đề cập. Trong trường hợp có sự khác biệt trong quá trình xử lý vật liệu so với vật liệu được sử dụng để sản xuất các sản phẩm thử nghiệm nhằm tạo ra dữ liệu thử nghiệm, thì cần phải giải thích lý do tại sao sự khác biệt không có ý nghĩa đối với việc xác định an toàn sinh học. Các khía cạnh cụ thể cần được xem xét bao gồm:
- các quá trình có thể gây ra sự thay đổi vật liệu dạng rời hoặc bề mặt trong các tính chất của vật liệu, ví dụ: đúc, xử lý bề mặt, hàn hoặc gia công;
- các chất phụ gia hoặc chất hỗ trợ chế biến dự kiến, chẳng hạn như chất xúc tác, chất chống oxy hóa, chất màu, xử lý bề mặt và các chất khác;
- các chất gây ô nhiễm tiềm ẩn trong quá trình, ví dụ: chất làm sạch/khử khuẩn/tiệt khuẩn, chất ăn mòn, chất tháo khuôn, chất lỏng và hạt cắt, chất gây ô nhiễm máy móc như chất bôi trơn hoặc cặn từ quá trình sản xuất các bộ phận của thiết bị được làm từ các vật liệu khác nhau;
- phân hủy trong quá trình sản xuất và chế biến, sử dụng và bảo quản trong lâm sàng;
- dư lượng hóa chất tiềm ẩn và phụ gia trong quá trình.
B.4.2 Thu thập dữ liệu hiện có
Trước khi tiến hành phân tích khoảng trống dữ liệu, cần xác định mức độ dữ liệu liên quan, bao gồm:
- dữ liệu độc tính về các vật liệu thành phần hoặc thành phần cấu tạo hoặc các hợp chất có liên quan khác (Phụ lục C);
- dữ liệu an toàn sinh học hiện có về các vật liệu hoặc sản phẩm thành phần;
- dữ liệu về lịch sử sử dụng thuốc trong lâm sàng hoặc phơi nhiễm ở người.
B.4.3 Xem xét thử nghiệm thiết bị
B.4.3.1 Các phương pháp tiếp cận theo cấp độ đối với thử nghiệm sinh học
Khi nhận thấy cần thiết phải tiến hành thử nghiệm bổ sung để thu thập thêm dữ liệu nhằm hỗ trợ định lượng rủi ro, thì nên thực hiện phương pháp tiếp cận theo cấp độ. Thử nghiệm nên bắt đầu bằng đặc trưng hóa học, vật lý và sàng lọc in vitro. Kết quả đặc trưng và thử nghiệm in vitro nên được xem xét trước khi tiến hành thử nghiệm trên động vật.
B.4.3.2 Khi nào cần thực hiện thử nghiệm dài hạn (nghiên cứu độc tính trường diễn, độc tính sinh sản, phân hủy và khả năng gây ung thư)
Sự cần thiết phải tiến hành thử nghiệm dài hạn đòi hỏi phải xem xét và xác định cụ thể tùy theo ứng dụng đang được xem xét.
Trong các trường hợp sau đây, việc đánh giá rủi ro được tiến hành một cách chính xác có thể cung cấp lý do cho việc không thực hiện thử nghiệm lâu dài, trong đó bản chất và mức độ phơi nhiễm xác nhận bệnh nhân đang phơi nhiễm với lượng chất rất thấp, dưới ngưỡng độc tính liên quan. Các yếu tố sau đây có thể góp phần biện minh cho việc không thực hiện thử nghiệm dài hạn:
- lượng phơi nhiễm (nghĩa là tổng khối lượng thiết bị/vật liệu trên mỗi bệnh nhân);
- thời gian;
- tính sẵn có sinh học.
Các tình huống sau đây có thể cho thấy nhu cầu thử nghiệm dài hạn:
- lượng vật liệu hiện có và thời gian phơi nhiễm cho thấy có thể liên quan đến các tác động độc tính lâu dài;
- các hợp chất cấu thành được biết là hoặc được coi là độc chất;
- không có đủ dữ liệu trước cho vật liệu có liên quan (hoặc các vật liệu gần giống nhau) trong các ứng dụng dài hạn tương đương;
- có những lý do hóa học cụ thể, ví dụ: cấu trúc phân tử cụ thể cần quan tâm, chỉ ra các mối lo ngại đặc biệt về độc tính trường diễn;
- các sàng lọc ngắn hạn (ví dụ: sàng lọc độc tính gen in vitro), chỉ ra khả năng cần quan tâm;
- có những lo ngại đã biết về khả năng phân hủy sinh học đối với loại vật liệu cụ thể được quan tâm và không có đủ dữ liệu hỗ trợ, ví dụ: dữ liệu thử nghiệm tăng tốc từ một mô hình phù hợp, đã được xác thực cho vật liệu hoặc công thức cụ thể đang được xem xét.
Cần lưu ý có một số lựa chọn thử nghiệm gây tranh luận trong lĩnh vực thử nghiệm dài hạn và một số khác biệt quốc tế về yêu cầu thử nghiệm.
B.4.3.3 Bù pH và thẩm thấu của hệ thống in vitro cho các vật liệu có khả năng hấp thụ
Vật liệu polyme, kim loại hoặc gốm được sử dụng để hấp thụ in vivo sẽ thôi ra các thành phần hòa tan hoặc các sản phẩm phân hủy. Nếu tốc độ vật liệu thôi ra đủ nhanh, nồng độ cao của một hoặc nhiều sản phẩm bị thôi ra có thể làm thay đổi độ pH và/hoặc độ thẩm thấu của hệ thống thử nghiệm in vitro. Vì điều kiện in vivo cung cấp sự hiện diện kết hợp của tưới máu và cân bằng cacbonat, khi đánh giá các vật liệu có khả năng hấp thụ có chủ ý, có thể cần điều chỉnh độ pH và/hoặc độ thẩm thấu của hệ thống thử nghiệm in vitro để duy trì các điều kiện sinh lý phù hợp - do đó cho phép đánh giá cho các nguyên nhân khác và cung cấp lý do khoa học cho việc điều chỉnh và ảnh hưởng đến hệ thống thử nghiệm in vitro, như được thực hiện mà không cần điều chỉnh pH hoặc nồng độ thẩm thấu, được ghi lại trong báo cáo. Các kết quả từ cả thử nghiệm tiêu chuẩn và thử nghiệm đã điều chỉnh phải được so sánh, vì các điều chỉnh có thể không thấy hết những xem xét quan trọng.
B.4.4 Đánh giá an toàn sinh học
B.4.4.1 Sử dụng dữ liệu có liên quan về mặt lâm sàng để đánh giá rủi ro
Nếu trong đánh giá sinh học xác định trang thiết bị y tế không có cùng thành phần hóa học, đặc tính vật lý (ví dụ: các đặc tính hình học và bề mặt) hoặc tiếp xúc với cơ thể như một trang thiết bị y tế hiện có, thì Hình 1 hướng dẫn người dùng xác định xem có đủ biện minh và/hoặc dữ liệu có liên quan về mặt lâm sàng (vật lý, hóa học và sinh học) để đánh giá rủi ro.
Việc đánh giá liệu có đủ dữ liệu liên quan về mặt lâm sàng để đánh giá rủi ro hay không có thể dựa trên một số yếu tố, bao gồm cả việc liệu tất cả các vật liệu được sử dụng trong trang thiết bị y tế có lịch sử sử dụng an toàn lâu dài trong cùng một ứng dụng hay không. Khi các vật liệu trong trang thiết bị y tế thành phẩm giống hệt nhau về mặt hóa học (xem xét cả công thức và sản xuất) với các vật liệu được sử dụng trong các trang thiết bị y tế hiện có, bản chất của sự phơi nhiễm là như nhau và thông tin lâm sàng từ các phân tích mục tiêu có sẵn cho các điểm cuối tính tương thích sinh học liên quan, thì một cách tiếp cận dựa trên đặc trưng vật liệu để đánh giá rủi ro có thể được luận giải để đánh giá an toàn sinh học.
CHÚ THÍCH: Hướng dẫn sử dụng dữ liệu về lịch sử sử dụng an toàn trong các ứng dụng y tế được nêu trong hướng dẫn của ATSDR và Nhật Bản [25] [27].
B.4.4.2 Điều gì tạo nên “đủ dữ liệu về độc tính” bao gồm sự liên quan đến liều lượng và đường dùng
Mặc dù có thể nhận dạng một số hợp chất hóa học bị thôi ra từ trang thiết bị y tế trong sơ đồ đặc trưng hóa học, nhưng có khả năng dữ liệu về độc tính sẽ không có sẵn đối với một số hợp chất theo đường phơi nhiễm có liên quan về mặt lâm sàng.
Mặc dù có sẵn các phương pháp để tiến hành ngoại suy liều lượng giữa các đường dùng khác nhau, bao gồm cả mô hình PBPK như được mô tả trong 6.3.2.14, các phương pháp này nên được sử dụng một cách thận trọng và nên xem xét các tác động của hiệu ứng đầu vào.
Cần thận trọng khi giải thích các hiệu ứng quan sát được trong các thử nghiệm ở mức liều rất cao so với mức phơi nhiễm thực tế trong sử dụng lâm sàng. Tương tự, có thể nồng độ mẫu trong hệ thống thử nghiệm in vitro sẽ cần điều chỉnh để đảm bảo hệ thống thử nghiệm đại diện cho các điều kiện sinh lý, đặc biệt là khi đánh giá các vật liệu có khả năng hấp thụ (xem B.4.3.3 để biết hướng dẫn về bù pH và thẩm thấu cho các vật liệu có khả năng hấp thụ).
Các yếu tố khác nhau cần được xem xét để ngoại suy dữ liệu thí nghiệm động vật với các điều kiện sử dụng lâm sàng được thảo luận trong TCVN 7391-17 (ISO 10993-17).
B.4.4.3 Xác định khả năng chấp nhận của mức chất ngâm chiết (giới hạn cho phép) theo TCVN 7391-17 (ISO 10993-17)
Như đã lưu ý trong TCVN 7391-17 (ISO 10993-17), đặc trưng rủi ro liên quan đến việc so sánh liều lượng của hợp chất mà bệnh nhân hoặc bác sĩ lâm sàng nhận được với liều lượng “an toàn” hoặc giá trị Lượng dung nạp (TI) cho hợp chất đó. Nếu tỷ lệ liều/TI > 1, thì khả năng xảy ra các tác dụng phụ ở bệnh nhân phơi nhiễm sẽ tăng lên. Tuy nhiên, tỷ lệ liều/TI không nên được coi là giá trị “vạch sáng” để xác định mức độ chấp nhận của chất ngâm chiết. Giá trị của tỷ lệ liều/TI càng lớn thì khả năng xảy ra các tác dụng phụ ở bệnh nhân và/hoặc người dùng càng lớn; tuy nhiên, điều quan trọng là cũng phải xem xét các yếu tố như tính nghiêm trọng của các tác dụng phụ được thấy trong nghiên cứu làm cơ sở cho TI, dược động học của hợp chất, các điều kiện được sử dụng để chiết các hợp chất từ trang thiết bị y tế, và liệu các giả định mặc định hay ước lượng đã được sử dụng để lấy TI. TCVN 7391-17 (ISO 10993-17) bao gồm thông tin về việc sử dụng trang thiết bị y tế trên lâm sàng và sự sẵn có của các vật liệu thay thế để tính giới hạn cho phép (AL) và đánh giá xem mức độ hợp chất được ngâm chiết từ trang thiết bị y tế có được chấp nhận hay không.
B.4.4.4 Các ngưỡng quan ngại về độc tính (TTC)
Khi xem xét sự hiện diện trong vật liệu của các thành phần độc hại tiềm ẩn ở nồng độ thấp, và lượng hấp thụ có thể chấp nhận được (TI) không thể được lấy từ các tài liệu, cần xem xét khái niệm “ngưỡng quan tâm về độc tính”. Có thể thiết lập bằng cách tham chiếu đến các tác động độc hại đã biết của chất được đề cập, đặc biệt là liều lượng chất độc, rằng chất hiện diện với lượng đủ thấp để không gây ra rủi ro đáng kể.
B.4.4.5 Hướng dẫn về các hỗn hợp trong đánh giá rủi ro
TCVN 7391-17 (ISO 10993-17) lưu ý bệnh nhân hoặc bác sĩ lâm sàng hiếm khi chỉ phơi nhiễm với một dư lượng tại một thời điểm. Nhiều khả năng xảy ra phơi nhiễm với nhiều hợp chất thôi ra từ trang thiết bị y tế. Việc đồng thời phơi nhiễm với nhiều hợp chất có khả năng làm tăng hoặc giảm độc tính của một thành phần của hỗn hợp nếu hợp chất này được sử dụng một mình.
Hình 1 yêu cầu người dùng xem xét liệu dữ liệu độc tính của các hợp chất riêng lẻ có thể áp dụng được hay không nếu bệnh nhân hoặc bác sĩ lâm sàng phơi nhiễm với hợp chất này như một phần của hỗn hợp hóa học. Dữ liệu hiếm khi có sẵn về ảnh hưởng của một hợp chất như một thành phần của hỗn hợp hóa học và yêu cầu này đặt ra tiêu chuẩn rất cao về việc sử dụng dữ liệu độc tính đối với các hợp chất đơn lẻ để đánh giá sinh học của các trang thiết bị y tế. Nếu các hợp chất giống nhau về cấu trúc, chúng có thể dẫn đến tác dụng gây độc cộng hợp. Đối với các hợp chất không giống nhau về cấu trúc, vẫn chưa biết liệu các hóa chất có thể có tác dụng cộng hợp hoặc ức chế độc tính hay không. Ngoài ra, các hợp chất có thể tương tác hóa học, dẫn đến các hóa chất mới có thể gây ra các loại rủi ro độc tính tương tự hoặc mới. Các phương pháp để đánh giá rủi ro của hỗn hợp được nêu trong Phụ lục B của TCVN 7391-17 (ISO 10993-17).
B.4.5 Hướng dẫn chung
B.4.5.1 Những thay đổi có thể yêu cầu đánh giá lại an toàn sinh học
Thực hành thiết kế trang thiết bị y tế thông thường yêu cầu xem xét lại việc đánh giá rủi ro khi xảy ra thay đổi thiết kế. Nếu thiết kế được sửa đổi, các thay đổi được thực hiện trên trang thiết bị y tế có thể làm thay đổi tính năng sinh học của trang thiết bị y tế. Do đó, điều quan trọng là phải đánh giá tác động của một thay đổi. Các rủi ro sinh học liên quan đến một thay đổi cần được nhận dạng, đánh giá, thẩm định và kiểm soát. Không nên tiến hành thử nghiệm nếu các rủi ro được phát hiện là không thể chấp nhận được. Nếu không, thông tin bổ sung cần được thu thập. Các thử nghiệm chỉ nên được thực hiện nếu chúng được đánh giá là có khả năng giúp đưa ra kết luận. Do đó, cơ sở lý luận cho việc thử nghiệm phải dựa trên việc phân tích các rủi ro liên quan từ dữ liệu hiện có.
Điều quan trọng là phải hiểu rằng mặc dù những thay đổi về vật liệu dẫn đến nhu cầu đánh giá lại, phạm vi đánh giá lại đó phải phù hợp với bản chất của sự thay đổi và nên tập trung vào các vật liệu cụ thể đã được thay đổi, bản chất và việc sử dụng trang thiết bị y tế và các tương tác tiềm năng.
Nếu các thử nghiệm được coi là cần thiết, nên sử dụng phương pháp tiếp cận theo cấp độ như đối với thử nghiệm ban đầu. Thử nghiệm phải được tiến hành theo trình tự sau:
1) đặc trưng vật lý và hóa học;
2) thử nghiệm in vitro;
3) thử nghiệm trên động vật.
Bước thử nghiệm cuối cùng trên động vật chỉ nên được thực hiện nếu các thử nghiệm đặc trưng trước đó và các nghiên cứu in vitro không cung cấp đầy đủ thông tin.
Những thay đổi điển hình có thể làm thay đổi tính năng sinh học của vật liệu hoặc trang thiết bị y tế thành phẩm bao gồm, nhưng không giới hạn đối với:
- xử lý, ví dụ: tiệt khuẩn, làm sạch, xử lý bề mặt, hàn, ép phun, gia công, đóng gói chính;
- nguồn vật liệu, ví dụ: nhà cung cấp mới, cơ sở mới;
- quy định kỹ thuật vật liệu, ví dụ: dung sai rộng hơn, đặc điểm kỹ thuật mới;
- công thức, ví dụ: vật liệu mới, phụ gia mới, thay đổi dung sai;
- điều kiện bảo quản, ví dụ: thời hạn sử dụng dài hơn, dung sai rộng hơn, điều kiện vận chuyển mới;
- môi trường sinh học (nghĩa là thay đổi trong sử dụng lâm sàng).
Các thuộc tính cần xem xét sau khi thay đổi vật liệu bao gồm, nhưng không giới hạn đối với:
- thành phần hóa học, ví dụ: thành phần, độ tinh khiết, hồ sơ chất ngâm chiết;
- các tính chất vật lý, ví dụ: hình thái, cấu trúc;
- các tính chất cơ học, ví dụ: khả năng chống mài mòn, cường độ;
- tính ổn định sinh học, ổn định môi trường và ổn định hóa học;
- hiệu ứng sinh học của các đặc tính điện và EMC.
Dữ liệu đặc trưng hóa học được sử dụng trong đánh giá rủi ro để đánh giá sự tương đương, theo thuật ngữ độc học, của một vật liệu được đề xuất với một vật liệu đã được thiết lập lâm sàng cho cùng một loại phơi nhiễm lâm sàng. Các nguyên tắc để đánh giá sự tương đương về độc tính được mô tả trong Phụ lục C.
B.4.5.2 Thực hành tốt phòng thử nghiệm
Mọi thử nghiệm để hỗ trợ đánh giá sinh học được kỳ vọng là một phần không thể thiếu trong hệ thống quản lý chất lượng của nhà sản xuất và do đó phải tuân theo các yêu cầu tương tự về xác nhận và truy xuất nguồn gốc như bất kỳ thử nghiệm kiểm soát chất lượng nào. Cần có sự đảm bảo các kết luận về an toàn mà các quyết định phát triển và tiếp thị dựa trên đó là có cơ sở. Đánh giá an toàn chỉ tốt khi có dữ liệu hỗ trợ. Do đó, cần phải xác minh tính toàn vẹn về mặt khoa học của tất cả các thành phần của một cuộc đánh giá. Hệ thống kiểm soát chất lượng áp dụng cho thử nghiệm phi lâm sàng được gọi là Thực hành tốt phòng thử nghiệm (GLP). Các nghiên cứu GLP được thực hiện theo các tiêu chuẩn chất lượng xác định trong các phòng thử nghiệm được công nhận phù hợp với một chương trình quốc tế do chính phủ thực hiện. Thông thường, các nghiên cứu phải được tiến hành trong một hệ thống chất lượng trong phòng thử nghiệm phù hợp với TCVN ISO/IEC 17025 (ISO/IEC 17025) hoặc một tiêu chuẩn tương đương.
B.4.5.3 Tài liệu đánh giá tính tương thích sinh học
Tài liệu để đánh giá tính tương thích sinh học nên bao gồm, ở mức độ khả thi và cần thiết:
- bản mô tả hoặc bản vẽ chung của trang thiết bị y tế;
- thông tin định lượng về thành phần/công thức vật liệu và thông tin định lượng hoặc định tính về các đặc tính vật lý đối với tất cả các bộ phận của thiết bị có tiếp xúc trực tiếp hoặc gián tiếp như định nghĩa trong 5.2;
- mô tả các điều kiện chế biến có thể gây ra các chất gây ô nhiễm cho quá trình sản xuất;
- xem xét về độc tính sẵn có và dữ liệu sử dụng trước đây liên quan đến từng bộ phận của trang thiết bị y tế có tiếp xúc trực tiếp hoặc gián tiếp với mô như được định nghĩa trong 5.2;
- báo cáo về các thử nghiệm sinh học;
- đánh giá dữ liệu;
- tuyên bố xác nhận việc phân tích rủi ro và kiểm soát rủi ro đã được hoàn thành.
Thông tin thu thập được phải được đưa vào tài liệu thiết kế trang thiết bị y tế như một phần của quá trình kiểm soát thiết kế (ví dụ: TCVN ISO 13485:2017 (ISO 13485:2016), Điều 7). Nó cũng phải là một phần của hồ sơ quản lý rủi ro (TCVN 8023:2009 (ISO 14971:2007), 2.23). Các nghiên cứu phi lâm sàng và lâm sàng là một khía cạnh của thẩm định và xác nhận thiết kế, (ví dụ: TCVN ISO 13485:2017 (ISO 13485:2016), 7.3.6 và 7.3.7 tương ứng). Hồ sơ thiết kế sản phẩm phù hợp với các biện pháp kiểm soát thiết kế TCVN ISO 13485 (ISO 13485) sẽ bao gồm các yêu cầu đầu vào thiết kế được quy định rõ ràng (bao gồm cả các yêu cầu về an toàn sinh học) và hồ sơ về các thử nghiệm phi lâm sàng, điều tra lâm sàng và đánh giá thiết kế để xác minh trang thiết bị y tế được thiết kế đáp ứng các yêu cầu này.
Phụ lục C
(tham khảo)
Quy trình đề xuất để xem xét tài liệu
C.1 Giới thiệu
Việc xem xét và đánh giá các tài liệu là cần thiết để chứng minh và lập kế hoạch cho các đánh giá sinh học đối với một vật liệu hoặc một trang thiết bị y tế. Mục đích của việc xem xét như vậy là để xác định cơ sở khoa học cho việc đánh giá sinh học. Việc xem xét cũng cung cấp thông tin cần thiết để đánh giá rủi ro/lợi ích và đạt được các hành vi đạo đức của việc đánh giá theo kế hoạch theo yêu cầu của TCVN 7391-2 (ISO 10993-2).
CHÚ THÍCH: Việc xem xét tài liệu như vậy có thể hữu ích để đánh giá xem dữ liệu liên quan có sẵn trong tài liệu có đủ để chứng minh tinh an toàn sinh học của trang thiết bị y tế được đề cập mà không cần tạo thêm dữ liệu từ thử nghiệm thực tế hay không hoặc để kết luận dữ liệu có sẵn là không đủ.
Thực hiện đánh giá tài liệu là một hoạt động khoa học cần được thực hiện một cách nghiêm túc và khách quan, đồng thời phải cho phép bên thứ ba thẩm định.
C.2 Phương pháp luận
C.2.1 Yêu cầu chung
Trước khi thực hiện tổng quan tài liệu, cần thiết lập một kế hoạch để nhận dạng, lựa chọn, đối chiếu và xem xét tất cả các nghiên cứu/dữ liệu có sẵn. Kế hoạch này phải được lập thành văn bản và dựa trên thực tiễn đã được công nhận để xem xét một cách hệ thống các tài liệu khoa học.
C.2.2 Mục tiêu
Các mục tiêu của tổng quan tài liệu cần được xác định rõ ràng. Các loại nghiên cứu có liên quan đến các mục tiêu này cần được quy định, có tính đến mọi kiến thức đã được hình thành rõ ràng về vật liệu hoặc trang thiết bị y tế.
C.2.3 Tiêu chí lựa chọn tài liệu
Các tiêu chí để lựa chọn hoặc loại trừ dữ liệu cần được xác định với cơ sở lý luận thích hợp. Dữ liệu công bố nên được lấy từ các ấn phẩm khoa học đã được công nhận. Có thể ưu tiên GLP hơn dữ liệu không phải GLP. Tất cả các dữ liệu có liên quan chưa được xuất bản có sẵn cũng cần được tính đến để tránh sai lệch khi xuất bản. Tất cả dữ liệu nên được tham chiếu.
Tổng quan tài liệu cần nêu rõ các nguồn tài liệu và dữ liệu, và mức độ tìm kiếm cơ sở dữ liệu hoặc các tổng hợp thông tin khác.
C.2.4 Đánh giá tài liệu
Đánh giá tài liệu cần đánh giá rõ ràng chất lượng của các tài liệu và mức độ liên quan của tài liệu đến các đặc điểm và tính năng cụ thể của vật liệu hoặc trang thiết bị y tế đang được xem xét, có tính đến mục đích sử dụng của trang thiết bị y tế.
Những điều sau đây cần được xem xét:
a) sự tương đồng của vật liệu hoặc trang thiết bị y tế trong các tài liệu đã chọn với trang thiết bị y tế đang được xem xét dựa trên công nghệ, tính năng quan trọng, thiết kế và nguyên tắc hoạt động để có thể đánh giá khả năng áp dụng của tài liệu;
b) mức độ liên quan của các động vật thí nghiệm cụ thể được sử dụng trong các nghiên cứu được lựa chọn để đánh giá sinh học của vật liệu hoặc trang thiết bị y tế đang được xem xét;
c) điều kiện sử dụng của vật liệu hoặc trang thiết bị y tế trong các tài liệu đã chọn và mục đích sử dụng của trang thiết bị y tế được đề cập.
C.2.5 Đánh giá học thuật tài liệu
Tổng quan tài liệu cần đưa ra đánh giá về ý nghĩa và tầm quan trọng của các nghiên cứu về các thiết kế khác nhau và giữa dữ liệu đã được công bố và chưa được công bố. Nếu dữ liệu chưa được công bố đang đưa vào đánh giá, thì tổng quan tài liệu sẽ cần nhận dạng ý nghĩa gắn liền với những dữ liệu này.
Các yếu tố bao gồm:
- các kết luận của tác giả có được chứng minh bằng các dữ liệu sẵn có hay không;
- tài liệu có phản ánh thực hành y tế hiện tại và trạng thái của công nghệ hay không;
- các tài liệu tham khảo có được lấy từ các ấn phẩm khoa học được công nhận hay không và chúng có được báo cáo trên các tạp chí được bình duyệt hay không;
- mức độ mà các tài liệu được xuất bản là kết quả của một nghiên cứu/các nghiên cứu đã tuân theo các nguyên tắc khoa học.
Tổng quan tài liệu nên có một đánh giá học thuật về tài liệu. Sau khi tài liệu được thu thập và đánh giá, các tiêu chí lựa chọn được áp dụng và loại trừ các tài liệu khỏi đánh giá học thuật này cần được biện minh. Sau đó, quá trình đánh giá sẽ được hoàn thành vì có liên quan đến trang thiết bị y tế được đề cập và mục đích sử dụng của nó, và phải viết một báo cáo có cấu trúc về việc đánh giá, bao gồm:
- mô tả ngắn gọn về vật liệu hoặc trang thiết bị y tế bao gồm mục đích sử dụng của nó;
- phân tích tất cả các tài liệu và dữ liệu đã chọn, cả thuận lợi và không thuận lợi;
- đánh giá cẩn trọng về các nguy cơ, rủi ro liên quan và các biện pháp an toàn thích hợp;
- mô tả các phương pháp đánh giá trọng số các bài báo khác nhau; cần đặc biệt chú ý đến các trường hợp có các công bố lặp lại của cùng một tác giả, để tránh xa đà vào nhiều công bố của cùng một thử nghiệm;
- danh sách các ấn phẩm được tham chiếu chéo một cách thích hợp trong quá trình đánh giá;
- kết luận kèm theo giải thích, nêu rõ các mục tiêu của tổng quan tài liệu đã được đáp ứng như thế nào và bất kỳ khoảng trống nào trong bằng chứng cần thiết để bao hàm tất cả các khía cạnh liên quan về an toàn và tính năng đã được nhận dạng;
- chữ ký của người đánh giá và ngày tháng.
Thư mục tài liệu tham khảo
[1] ISO 7405, Dentistry - Evaluation of biocompatibility of medical devices used in dentistry (Nha khoa - Đánh giá tính tương thích sinh học của các trang thiết bị y tế được sử dụng trong nha khoa)
[2] TCVN ISO 9000, Hệ thống quản lý chất lượng - Các nguyên tắc cơ bản và từ vựng
[3] TCVN ISO 9001, Hệ thống quản lý chất lượng - Các yêu cầu
[4] TCVN ISO 9004, Quản lý chất lượng - Chất lượng của một tổ chức - Hướng dẫn để đạt được thành công bền vững
[5] ISO/TR 10993-22, Biological evaluation of medical devices - Part 22: Guidance on nanomaterials (Đánh giá sinh học trang thiết bị y tế- Phần 22: Hướng dẫn về vật liệu nano)
[6] ISO/TR 10993-33, Biological evaluation of medical devices - Part 33: Guidance on tests to evaluate genotoxicity - Supplement to ISO 10993-3 (Đánh giá sinh học trang thiết bị y tế - Phần 33: Hướng dẫn các thử nghiệm đánh giá độc tính gen - Bổ sung cho TCVN 7391-3 (ISO 10993-3))
[7] TCVN ISO 13485:2017 (ISO 13485:2016), Trang thiết bị y tế - Hệ thống quản lý chất lượng - Yêu cầu cho các mục đích chế định
[8] TCVN ISO/IEC 17025 (ISO/IEC 17025), Yêu cầu chung về năng lực của phòng thử nghiệm và hiệu chuẩn
[9] ISO 18562 (all parts), Biocompatibility evaluation of breathing gas pathways in healthcare applications ((tất cả các phần), Đánh giá tính tương thích sinh học của đường dẫn khí thở trong các ứng dụng chăm sóc sức khỏe)
[10] Previews B.I.O.S.I.S., Ovid Technologies, Inc, available at: https://www.ovid.com/
[11] Guideline on the limits of genotoxic impurities, European Medicines Agency Evaluation of Medicines for Human Use (EMEA), available at:
http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500002903.pdf
[12] Black, J., Biological Performance of Materials: Fundamentals of Biocompatibility, CRC Press, 2006
[13] Boutrand J., ed. Biocompatibility and Performance of Medical Devices. Woodhead Publishing, 2012
[14] Bush R.B., A Bibliography of Monographic Works on Biomaterials and Biocompatibility: Update II. J. Biomed. Mater. Res. 1999, 48 pp. 335-341 [Appl Biomater]
[15] Tinkler J.J.B., Biological Safety and European Medical Device Regulations. Quality First International Press, London, 2000
[16] Williams D.F. , Fundamental aspects of biocompatibility. Biocompatibility. 1 CRC. 1980
[17] Williams D.F. , Definitions in Biomaterials. Progress in Biomedical Engineering. 1987, 4 pp. .1-72
[18] EMBASE, Elsevier B.V., available at: https://www.embase.com/
[19] IPCS, World Health Organization, available at: https://www.who.int/ipcs/en/
[20] IRIS, U.S. Environmental Protection Agency, available at: https://www.epa.gov/IRIS/
[21] PubMed. U.S. National Library of Medicine, available at: ttps://www.ncbi.nlm.nih.gov/pubmed
[22] SciFinder, American Chemical Society, available at: https://www.cas.org/SCIFINDER/SCHOLAR/index.html
[23] SciSearch® - A Cited Reference Science Database, Dialog, LLC, available at: https://library.dialog.com/bluesheets/html/bl0034.html
[24] Toxnet. U.S. National Library of Medicine, available at: https://toxnet.nlm.nih.gov
[25] ToxGuides. Agency for Toxic Substances & Disease Registry (ATSDR), available at: https://www.atsdr.cdc.gov/toxguides/index.asp
[26] OECD Guidelines for the Testing of Chemicals - Section 4: Health Effects
[27] Japan, Good Laboratory Practice for Preclinical Biological Tests of Medical devices; MHLW Ordinance No. 37 and No. 115 (03-23-2005 and 06-13-2008, respectively)
[28] Japan (bilingual in Japanese and English): Basic Principles of Biological Safety Evaluation Required for Application for Approval to Market Medical Devices, YAKUJI NIPPO, Ltd. Tokyo, 2012
[29] USA, Code of Federal Regulations Title 21 Part 58 Good Laboratory Practice for Nonclinical Laboratory Studies
[30] Use of International standard. ISO 10993- 1, “Biological evaluation of medical devices — Part 1: Evaluation and testing within a risk management process — Guidance for Industry and Food and Drug Administration staff, June 16, 2016, available at: https://www.fda.gov/downloads/medicaldevices/deviceregulationandguidance/guidancedocuments/ucm348890.pdf
[31] ICH Q3A Impurities in New Drug Substances, available at: https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q3A_R2/Step4/Q3A_R2_Guideline.pdf
[32] ICH Q3B Impurities in New Drug Products, available at: https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q3B_R2/Step4/Q3B_R2_Guideline.pdf
[33] ICH Q3C Impurities: Guideline for Residual Solvents, available at: https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q3C/Q3C_R6_Step_4.pdf
[34] ICH Q3D Impurities: Guidelines for Elemental Impurities, available at: https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q3D/Q3D_Step_4.pdf
[35] ICH M7 ASSESSMENT AND CONTROL OF DNA REACTIVE (MUTAGENIC) IMPURITIES IN PHARMACEUTICALS TO LIMIT POTENTIAL CARCINOGENIC RISK, available at: https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Multidisciplinary/M7/M7_Step_4.Pdf
[36] TCVN 7931-19 (ISO/TR 10993-19), Đánh giá sinh học trang thiết bị y tế - Phần 19: Đặc tính hóa-lý, hình thái cấu trúc và hình thái bề mặt của vật liệu
Mục lục
Lời nói đầu
Lời giới thiệu
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Thuật ngữ và định nghĩa
4 Nguyên tắc chung áp dụng để đánh giá sinh học trang thiết bị y tế
5 Phân loại trang thiết bị y tế
5.1 Yêu cầu chung
5.2 Phân loại theo bản chất tiếp xúc với cơ thể
5.3 Phân loại theo thời gian tiếp xúc
6 Quá trình đánh giá sinh học
6.1 Thông tin vật lý và hóa học để phân tích rủi ro sinh học
6.2 Phân tích khoảng trống và lựa chọn các điểm cuối sinh học để đánh giá
6.3 Thử nghiệm sinh học
7 Giải thích dữ liệu đánh giá sinh học và đánh giá rủi ro sinh học tổng thể
Phụ lục A (tham khảo) Các điểm cuối cần giải quyết trong đánh giá rủi ro sinh học
Phụ lục B (tham khảo) Hướng dẫn thực hiện đánh giá sinh học trong quá trình quản lý rủi ro
Phụ lục C (tham khảo) Quy trình đề xuất để xem xét tài liệu
Thư mục tài liệu tham khảo
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 7391-1:2023 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 7391-1:2023 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 7391-1:2023 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 7391-1:2023 DOC (Bản Word)