- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 12077:2017 Phát hiện thực phẩm chiếu xạ bằng kỹ thuật sàng lọc vi sinh vật
| Số hiệu: | TCVN 12077:2017 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Y tế-Sức khỏe , Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2017 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 12077:2017
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 12077:2017
TIÊU CHUẨN QUỐC GIA
TCVN 12077:2017
EN 14569:2004
THỰC PHẨM - PHÁT HIỆN THỰC PHẨM CHIẾU XẠ BẰNG KỸ THUẬT SÀNG LỌC VI SINH VẬT SỬ DỤNG CÁC QUY TRÌNH XÁC ĐỊNH NỒNG ĐỘ NỘI ĐỘC TỐ/ĐỊNH LƯỢNG TỔNG VI KHUẨN GRAM ÂM (LAL/GNB)
Foodstuffs - Microbiological screening for irradiated food using LAL/GNB procedures
Lời nói đầu
TCVN 12077:2017 hoàn toàn tương đương với EN 14569:2004;
TCVN 12077:2017 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F5 Vệ sinh thực phẩm và chiếu xạ biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
THỰC PHẨM - PHÁT HIỆN THỰC PHẨM CHIẾU XẠ BẰNG KỸ THUẬT SÀNG LỌC VI SINH VẬT SỬ DỤNG CÁC QUY TRÌNH XÁC ĐỊNH NỒNG ĐỘ NỘI ĐỘC TỐ/ĐỊNH LƯỢNG TỔNG VI KHUẨN GRAM ÂM (LAL/GNB)
Foodstuffs - Microbiological screening for irradiated food using LAL/GNB procedures
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp sàng lọc vi sinh vật gồm hai quy trình, được thực hiện song song. Phương pháp này cho phép xác định sự bất thường của vi sinh vật trong thịt gia cầm. Sự có mặt một lượng lớn quần thể các vi sinh vật đã chết trong một số trường hợp nhất định, có thể giả định do xử lý chiếu xạ, nghĩa là các kết quả của quy trình xác định nồng độ nội độc tố (endotoxin) có trong mẫu thử bằng thử nghiệm dùng chất phân giải tế bào máu con sam biển [Limulus amoebocyte lysate (LAL) test] và các kết quả của quy trình định lượng tổng vi khuẩn Gram âm (GNB) có trong mẫu thử là không đặc trưng cho chiếu xạ. Do đó, cần khẳng định kết quả là dương tính sử dụng phương pháp chuẩn để phát hiện thực phẩm chiếu xạ, ví dụ: TCVN 7408 (EN 1784) [1], TCVN 7409 EN 1785 [2] hoặc TCVN 7410 (EN 1786) [3].
Phương pháp sàng lọc này đã được thử nghiệm thành công trong các thử nghiệm liên phòng [4], [5], [6] và quy trình này thường áp dụng cho toàn bộ hoặc một số bộ phận của gia cầm, ví dụ: ức, chân, cánh tươi, thân thịt ướp lạnh hoặc đông lạnh có hoặc không da.
Phương pháp này cũng có thể cung cấp thông tin về chất lượng vi sinh vật của một sản phẩm trước khi chiếu xạ.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 6404 (ISO 7218) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Yêu cầu chung và hướng dẫn kiểm tra vi sinh vật.
TCVN 8128-1 (ISO/TS 11133-1)*) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Hướng dẫn chuẩn bị và sản xuất môi trường nuôi cấy - Phần 1: Hướng dẫn chung về đảm bảo chất lượng đối với việc chuẩn bị môi trường nuôi cấy trong phòng thử nghiệm.
3 Nguyên tắc
Phương pháp này xác định số lượng vi khuẩn Gram âm còn sống có mặt trong mẫu thử và nồng độ nội độc tố có trên bề mặt vi khuẩn Gram âm như các lipopolysaccharid (LPS), dùng làm phép đo để ước lượng số lượng tổng vi khuẩn Gram âm, gồm cả vi khuẩn còn sống và đã chết (Hình C.1). Nếu chênh lệch giữa các kết quả là cao thì giả định rằng mẫu đã được xử lý bằng phương pháp bảo quản, có thể đã xử lý bằng bức xạ ion hoá.
4 Quy trình
Cần tiến hành hai quy trình sau:
Quy trình 1: Định lượng tổng vi khuẩn Gram âm (GNB) có trong mẫu thử (theo Phụ lục A)
Quy trình 2: Xác định nồng độ nội độc tố có trong mẫu thử bằng thử nghiệm Limulus amoebocyte lysate (LAL) (theo Phụ lục B).
Các mẫu phải được phân tích ngay khi nhận được (bằng cả GNB và LAL) để giảm sự gia tăng của vi khuẩn. Nếu không thể, thì mẫu phải được bảo quản ở nhiệt độ - 20 °C cho đến khi kiểm tra và phải được tiến hành kiểm tra càng sớm càng tốt.
5 Đánh giá
Theo các phương pháp đã quy định tại Phụ lục A và Phụ lục B, số lượng đơn vị hình thành GNB phải được biểu thị theo log10 đơn vị hình thành khuẩn lạc (cfu) GNB trên gam và nồng độ nội độc tố được tính theo log10 đơn vị Nội độc tố (EU) trên gam.
Sự chênh lệch giữa các kết quả của GNB và nội độc tố được tính bằng (log10 EU/g - log10 cfu GNB/g).
Các mẫu được xác định là có mức nội độc tố cao nhưng mức GBN thấp hoặc không phát hiện GNB cho thấy hình thái vi sinh vật bất thường. Do đó, khi log10 EU/g - log10 cfu GNB/g lớn hơn 0 thì nghi ngờ mẫu đã chiếu xạ và phải được thử nghiệm tiếp về xử lý bằng bức xạ.
Các mẫu được xác định là có nồng độ nội độc tố cao và số đếm vi khuẩn Gram âm cao tương tự cho thấy có hình thái vi sinh vật bình thường. Do đó, khi log10 EU/g - log10 cfu GNB/g thấp hơn hoặc bằng 0, thì mẫu không bị nghi ngờ đã được chiếu xạ.
Các mẫu được xác định là có các độ chuẩn nội độc tố log10 EU/g nhỏ hơn 2,0 và nồng độ GNB thấp, nghĩa là log10 cfu GNB/g nhỏ hơn 2,0 được coi là không xác định và phải được thử nghiệm tiếp về xử lý bằng bức xạ.
6 Hạn chế
Phương pháp này chỉ đưa ra việc nhận biết biện pháp xử lý bằng bức xạ ion hoá. Một lượng lớn vi sinh vật đã chết so với các vi sinh vật còn sống có thể do một vài nguyên nhân khác. Do đó, cần phải khẳng định tiếp bằng phương pháp chuẩn để phát hiện các loại thực phẩm chiếu xạ bằng bức xạ ion hóa. Phương pháp này được sử dụng cho các phòng thử nghiệm vi sinh thông thường tham gia vào việc kiểm tra thực phẩm.
Cần lưu ý rằng, việc đông lạnh sau khi chiếu xạ có thể ảnh hưởng đến tỷ lệ giữa GNB và EU, do vi sinh vật mất khả năng sống. Ngược lại, sự tái phát triển của hệ vi khuẩn có thể xảy ra trong các mẫu đã chiếu xạ khi không được bảo quản đông lạnh.
7 Đánh giá xác nhận
Phương pháp này được Bộ Nông nghiệp, Thủy sản và Thực phẩm, Phòng thí nghiệm Khoa học Thực phẩm, Norwich (FSL) của Vương quốc Anh xây dựng và được đánh giá xác nhận bởi các thử nghiệm cộng tác [4], [5], [6]. 20 phòng thử nghiệm của Vương quốc Anh đã tham gia vào thử nghiệm (16 phòng thử nghiệm phân tích cộng đồng, 3 phòng thử nghiệm sức khỏe cộng đồng và FSL). Một cơ sở chế biến gia cầm thương mại cung cấp một mẻ ức gà rút xương có da và một mẻ các miếng phi lê ức gà rút xương. Trong vòng 24h giết mổ, cả hai mẻ ức gà được vận chuyển từ cơ sở chế biến đến cơ sở chiếu xạ thương mại trong điều kiện làm lạnh (< 5 °C). Các mẻ ức gà được chia nhỏ ra; một phần ba mẻ được giữ lại làm các mẫu kiểm soát (chưa chiếu xạ); một phần ba mẻ được chiếu xạ ở liều trung bình 2,5 kGy và phần còn lại được chiếu xạ ở liều 5 kGy. Các miếng phi lê ức gà không da được chia thành hai phần. Một nửa được giữ lại làm các mẫu kiểm soát và nửa còn lại được chiếu xạ ở liều 2,5 kGy. Các mẫu được chiếu xạ bằng nguồn Cobalt 60. Liều kế bằng chất dẻo perspex tối màu1) được sử dụng để đánh giá liều nhận được bằng cách đo quang phổ sự thay đổi độ hấp thụ ở bước sóng 530 nm. Tất cả các miếng thịt gà được gắn mã ngẫu nhiên và bao gói trong các thùng chứa cách nhiệt trong điều kiện làm lạnh. Các mẫu sau đó được vận chuyển qua đêm đến các phòng thử nghiệm vào sáng hôm sau. Các phòng thử nghiệm được hướng dẫn để bắt đầu phân tích ngay khi nhận được mẫu. Mỗi phòng thử nghiệm nhận được 10 mẫu để phân tích, bao gồm các mẫu kiểm soát ức gà có và không có da; ức gà có da được chiếu xạ ở liều 2,5 kGy và 5 kGy và ức gà không có da được chiếu xạ ở liều 2,5 kGy. Tất cả các mẫu được gửi ngẫu nhiên là “các cặp” mẫu mù. Các phòng thử nghiệm được yêu cầu kiểm tra mỗi mẫu chỉ một lần và báo cáo các kết quả thu được từ thử nghiệm LAL và định lượng GNB.
Sử dụng các tiêu chí đánh giá chi tiết nêu trong Điều 5, đã xác định chính xác 100 % tất cả các mẫu chưa chiếu xạ, 97 % các mẫu ức gà có da được chiếu xạ ở liều 2,5 kGy, 82 % các mẫu ức gà có da được chiếu xạ ở liều 5 kGy và 88 % các mẫu phi lê không da được chiếu xạ ở liều 2,5 kGy. Tất cả các mẫu khác được báo cáo là "không xác định" do có độ chuẩn EU rất thấp.
8 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm ít nhất:
a) mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
b) viện dẫn đến tiêu chuẩn này;
c) ngày lấy mẫu và quy trình lấy mẫu (nếu biết);
d) ngày nhận mẫu và tình trạng nhiệt của mẫu khi nhận được;
đ) ngày thử nghiệm;
f) các điều kiện bảo quản mẫu thử trong phòng thử nghiệm sau khi nhận;
g) kết quả thu được;
h) các điểm cụ thể quan sát được trong quá trình thử nghiệm;
I) mọi thao tác không được quy định trong tiêu chuẩn này hoặc được coi là tùy chọn có thể ảnh hưởng đến kết quả
Phụ lục A
(Quy định)
Định lượng tổng vi khuẩn Gram âm (GNB) còn sống
A.1 Nguyên tắc
Định lượng GNB tạo thành từ các khuẩn lạc được ủ hiếu khí ở nhiệt độ 21 °C ± 1 °C trong 24 h ± 1 h trên môi trường chọn lọc có chứa nisin, penicillin-G và tím tinh thể được thực hiện trong bốn giai đoạn liên tiếp.
- Chuẩn bị huyền phù mẫu thử ban đầu trong nước không chứa nội độc tố;
- Nuôi cấy bề mặt môi trường thạch dinh dưỡng đặc không chọn lọc để phục hồi các tế bào bị ức chế; lặp lại việc ủ ở nhiệt độ môi trường trong 90 min;
- Phủ môi trường không chọn lọc sau thời gian phục hồi bằng môi trường thạch chọn lọc có chứa nisin, penicillin-G và tím tinh thể và ủ ở 21 °C ± 1 °C trong 24 h ± 1 h;
- Đếm.
A.2 Dung dịch pha loãng, môi trường nuôi cấy và thuốc thử
A.2.1 Yêu cầu chung
Để thống nhất các kết quả, cần sử dụng môi trường được chuẩn bị từ các chế phẩm khô có bán sẵn, nếu có thể. Tất cả các hóa chất dùng để chuẩn bị môi trường nuôi cấy phải có chất lượng phân tích. Nước phải là nước cất hoặc đã khử ion hóa và không chứa các chất ức chế. Cần lưu ý các quy định thích hợp nêu trong TCVN 6404 (ISO 7218).
A.2.2 Nước không chứa nội độc tố2)
A.2.3 Dung dịch muối pepton
| Muối natri clorua | 8,5 g |
| Sản phẩm thủy phân casein bằng enzym | 1,0 g |
| Nước | 1 000 ml |
Hoà tan các thành phần trên trong nước. Trộn đều và chỉnh pH sao cho sau khi khử trùng pH là 7,0 ± 0,2 ở 25 °C, nếu cần. Khử trùng bằng nồi hấp áp lực ở 121 °C ± 1 °C trong 15 min. Dịch pha loãng có thể được bảo quản ở nhiệt độ 4 °C ± 1 °C, tối đa hai tuần
A.2.4 Môi trường thạch dinh dưỡng (NA) (không chọn lọc)
| Sản phẩm thủy phân casein bằng enzym | 5,0 g |
| Muối natri clorua | 5,0 g |
| Chất chiết nấm men | 2,0 g |
| Chất chiết thịt | 1,0 g |
| Thạch | Từ 9 g đến 18 ga |
| Nước | 1 000 ml |
| a Phụ thuộc vào sức đông của thạch | |
Hoà tan các thành phần trên trong nước bằng cách đun sôi. Chỉnh pH sao cho sau khi khử trùng pH là 7,4 ± 0,2 ở 20 °C đến 25 °C. Khử trùng bằng nồi hấp áp lực ở 121 °C ± 1 °C trong 15 min. Để nguội đến nhiệt độ từ 45 °C đến 50 °C và phân phối các lượng khoảng 10 ml môi trường vào các đĩa Petri vô trùng.
A.2.5 Môi trường thạch chọn lọc gram âm
A.2.5.1 Môi trường cơ bản
| Thạch sữa (ví dụ: Oxoid CM213)) | 24,0 g |
|
| Nisin | 40,0 mga | (40 000 đơn vị quốc tế/lít) |
| Nước | 997 ml |
|
| a Có thể cần để điều chỉnh phù hợp với hoạt độ của chất chuẩn nisin có sẵn. | ||
Hoà tan các thành phần trên trong nước bằng cách đun sôi. Chỉnh pH sao cho sau khi khử trùng pH là 7,1 ± 0,2 ở 20 °C đến 25 °C. Phân phối vào vật chứa cuối cùng. Khử trùng ở 121 °C ± 1 °C trong 15 min. Để nguội đến nhiệt độ từ 45 °C đến 50 °C.
A.2.5.2 Dung dịch tím tinh thể
| Tím tinh thể | 10 mg |
| Nước | 10 ml |
Hòa tan tím tinh thể trong nước. Lọc để khử trùng dung dịch qua màng lọc cỡ lỗ 0,22 µm. Dung dịch tím tinh thể có thể được bảo quản ở nhiệt độ từ 4 oC đến 6 oC, đến hai tuần
A.2.5.3 Dung dịch Penicillin-G
| Penicilin G | 100 mga | (20 000 đơn vị quốc tế/lít) |
| Nước | 10 ml |
|
| a Có thể cần để điều chỉnh phù hợp với hoạt độ của chất chuẩn penicillin có sẵn. | ||
Hoà tan penicillin-G trong nước. Lọc để khử trùng qua bộ lọc cỡ lỗ 0,22 µm. Dung dịch penicillin-G có thể được bảo quản ở nhiệt độ từ 4 °C đến 6 °C, không quá một tuần.
A.2.5.4 Môi trường chọn lọc gram âm hoàn chỉnh
| Dung dịch Penicilin-G | 1,2 mla |
| Dung dịch tím tinh thể | 2 ml |
| Môi trường cơ bản | 997 ml |
| a Có thể cần đề điều chỉnh phù hợp với hoạt độ của chất chuẩn penicillin có sẵn. | |
Bằng kỹ thuật vô trùng cho các dung dịch tím tinh thể và penicillin-G vào môi trường cơ bản nóng chảy đã làm nguội đến nhiệt độ 45 °C ± 1 °C. Trộn đều và phân phối theo yêu cầu.
A.3 Thiết bị
A.3.1 Sử dụng các thiết bị, dụng cụ phòng thử nghiệm vi sinh thông thường và cụ thể như sau:
A.3.2 Dụng cụ thủy tinh không chứa nội độc tố
Để dụng cụ thủy tinh không còn chứa nội độc tố, cần gia nhiệt dụng cụ ở 180 °C ± 2 °C trong 4 h. Ngoài ra, dụng cụ bằng chất dẻo vô trùng thường không chứa nội độc tố có thể được sử dụng thay cho dụng cụ thủy tinh.
A.3.3 Túi trộn nhu động và túi chất dẻo
A.3.4 Lọ đa năng bằng chất dẻo vô trùng (khoảng 30 ml)
A.3.5 Tủ ấm, có khả năng duy trì nhiệt độ 21 °C ± 1 °C.
A.3.6 Tủ sấy phòng thử nghiệm, có khả năng duy trì nhiệt độ 180 °C ± 2 °C.
A.4 Cách tiến hành
A.4.1 Chuẩn bị mẫu thử và huyền phù ban đầu
Bằng kỹ thuật vô trùng lấy bốn phần da khác nhau, mỗi phần khoáng 2,5 g để tạo thành 10 g mẫu da hỗn hợp. Đối với toàn bộ thân thịt lấy các phần cổ, hậu môn và dưới nách, mỗi phần 2,5 g. Đối với các phần thịt gà lấy các mẫu da từ các vùng khác nhau. Nếu kiểm tra các miếng thịt gà không da thì sử dụng 10 g thịt đã được cắt bằng kỹ thuật vô trùng. Đặt da hoặc các phần thịt trong túi chất dẻo và thêm 90 ml nước không chứa nội độc tố (A.2.2). Đồng hóa trong túi trộn nhu động (A.3.3) từ 1 min đến 2 min. Bằng kỹ thuật vô trùng chuyển một lượng thích hợp (ví dụ: 30 ml) huyền phù ban đầu vào lọ vô trùng (A.3.4) và giữ chai ở nhiệt độ từ 1 °C đến 4 °C để thực hiện các quy trình dưới đây (quy trình GNB cần 1 ml và quy trình LAL cần 30 µl). Quy trình LAL phải được thực hiện trong vòng 2 h. Huyền phù ban đầu này tương đương với dung dịch pha loãng 10-1 của mẫu ban đầu.
A.4.2 Chuẩn bị dung dịch pha loãng
Tốt nhất là, số đếm trên mỗi đĩa phải nằm trong dải từ 15 đến 300 đơn vị hình thành khuẩn lạc (cfu). Chuẩn bị các dung dịch pha loãng thập phân tiếp theo cho các lần đếm bằng cách cho 1 ml huyền phù ban đầu (A.4.1) vào 9 ml dung dịch muối pepton (A.2.3) để thu được dung dịch pha loãng 10-2 và lặp lại cho đến khi mẫu được pha loãng đủ (thường là ít nhất 10-5). Thời gian giữa việc chuẩn bị các dung dịch pha loãng và trải đĩa không được quá 15 min.
A.4.3 Đổ đĩa
Dàn đều hai lần trên hai đĩa thạch dinh dưỡng, đã làm khô (A.2.4), mỗi đĩa 0,1 ml các dung dịch. Để yên ở nhiệt độ môi trường (từ 20 °C đến 25 °C) trong 90 min, sau đó phủ lên khoảng 10 ml thạch chọn lọc GNB (A.2.5.4) ở nhiệt độ 45 °C ± 1 °C. Tiến hành cẩn thận để tránh rót lớp phủ quá dày. Để yên và ủ đĩa ở tư thế lật ngược ở 21 °C ± 1 °C trong 24 h ± 1 h.
A.4.4 Đếm GNB/g
Đếm các khuẩn lạc trong từng đĩa có chứa ít hơn 300 khuẩn lạc. Để kết quả có giá trị, cần đếm các khuẩn lạc trên ít nhất một đĩa có chứa tối thiểu 15 khuẩn lạc. Tính số N của GNB có trong mẫu thử theo giá trị xác định được từ hai dung dịch pha loãng liên tiếp, sử dụng Công thức (A.1).
| N = | Σc | (A.1) |
| V x [n1 + (0,1 x n2) x d] |
Trong đó:
Σc là tổng số các khuẩn lạc đếm được trên tất cả các đĩa được giữ lại từ hai dung dịch pha loãng liên tiếp và trong đó ít nhất có một đĩa chứa tối thiểu 15 khuẩn lạc;
V là thể tích dịch cấy được cấy vào mỗi đĩa, tính bằng mililit (ở đây là 0,1 ml);
n1 là số lượng đĩa được giữ lại ở độ pha loãng thứ nhất;
n2 là số lượng đĩa được giữ lại ở độ pha loãng thứ hai;
d là hệ số pha loãng tương ứng với độ pha loãng đầu tiên được giữ lại.
Ví dụ:
| Độ pha loãng | Số khuẩn lạc trên đĩa đếm lặp lại hai lần | |
| 10-3 | 271 | 240 |
| 10-4 | 30 | 32 |
| N = | 573 | =2,6x106cfu GNB / g |
| 0,1x(2+0,2)x10-3 |
A.5 Biểu thị kết quả
Ghi lại số lượng đơn vị khuẩn lạc hình thành GNB/g da hoặc thịt tính được trong A.4.4. Biểu diễn kết quả theo log10 cfu GNB/g. Nếu có ít hơn 15 khuẩn lạc có trong độ pha loãng thấp nhất 10-1 thì báo cáo kết quả là số khuẩn lạc ước lượng được (E). Nếu không có khuẩn lạc GNB nào có mặt trong độ pha loãng thấp nhất 10-1 thì báo cáo kết quả là "GNB không phát hiện được".
A.6 Quy trình kiểm soát chất lượng
Tất cả các môi trường nuôi cấy phải được thử nghiệm sử dụng các chủng so sánh kiểm soát dương tính và âm tính thích hợp bằng các quy trình nêu trong TCVN 8128-1 (ISO/TS 11133-1).
Phụ lục B
(Quy định)
Xác định nồng độ nội độc tố bằng thử nghiệm Limulus amoebocyte lysate (LAL)
B.1 Nguyên tắc
Thử nghiệm Limulus amoebocyte lysate (LAL) là phương pháp phân tích bán định lượng sử dụng các đĩa vi giếng có chứa các tế bào amit dạng đông khô được lấy từ máu con sam biển, trong đó có phản ứng tạo gel với sự có mặt của nội độc tố (còn gọi là lipopolysaccharid) được lấy từ các thành tế bào vi khuẩn Gram âm còn sống hoặc đã chết [7].
Việc xác định nồng độ nội độc tố có trong mẫu thử được tiến hành theo ba giai đoạn liên tiếp:
- Chuẩn bị các dung dịch pha loãng trong các đĩa vi giếng LAL, sử dụng huyền phù mẫu thử ban đầu đã được chuẩn bị trong A.4.1.
- Ủ các đĩa vi giếng LAL ở 37 °C trong 1 h.
- Quan sát các khối gel hình thành và tính nồng độ nội độc tố.
B.2 Thuốc thử
B.2.1 Nước không chứa nội độc tố4) (xem A.2.2)
B.2.2 Chất chuẩn đối chứng dạng đông khô (LPS)5) khoảng 500 đơn vị nội độc tố (EU).
B.2.3 Thuốc nhuộm tế bào xanh toluidin
| Polysorbat 20 (ví dụ: Tween 20®)6) | 1,0 g |
| Xanh toluidin | 0,2 g |
| Nước | 100 ml |
Hòa tan các thành phần trên trong nước và trộn kỹ
B.3 Thiết bị
B.3.1 Sử dụng các thiết bị, dụng cụ thông thường của phòng thử nghiệm vi sinh và cụ thể như sau:
B.3.2 Nồi cách thủy không tuần hoàn nước
Nồi cách thủy tĩnh có khả năng duy trì nhiệt độ 37 °C ± 0,5 °C.
B.3.3 Các đĩa vi giếng dùng cho thử nghiệm LAL7) (có độ nhạy từ 1 EU đến 2 EU)
Sử dụng các đĩa 96 giếng chuẩn (12 cột x 8 hàng) có các cột giếng dung dịch pha loãng rỗng và các cột giếng mẫu thử hấp phụ lysat xen kẽ nhau (Hình C.2). Các đĩa vi giếng phải được xử lý cẩn thận vì chuyển động quá mức có thể gây nhiễu lysat được hấp phụ và gây ra kết quả âm tính giả.
B.3.4 Pipet tự động, có khả năng phân phối các lượng 65 µl và 30 µl.
B.3.5 Giấy Parafilm®7)
B.3.6 Bơm hút (nước hoặc cơ học)
B.3.7 Bộ đồng hóa cô quay
B.4 Cách tiến hành
B.4.1 Yêu cầu chung
Sử dụng huyền phù ban đầu được chuẩn bị trong A.4.1 để đo nồng độ nội độc tố.
B.4.2 Dung dịch pha loãng mẫu trong đĩa vi giếng dùng cho thử nghiệm LAL (xem Hình C.3).
Cho 65 µl nước (B.3.4) không chứa nội độc tố (A.2.2) vào từng giếng dung dịch pha loãng của đĩa vi giếng (B.3.3). Thêm 30 µl huyền phù mẫu thử ban đầu (A.4.1) vào giếng dung dịch pha loãng thứ nhất chứa 65 µl nước không chứa nội độc tố (hỗn hợp này có độ pha loãng của huyền phù ban đầu là 10-0,5) và trộn kỹ các lượng chứa trong giếng bằng cách rót đầy và xả đầu tip pipet cẩn thận không để các bọt khí lọt vào trong vi giếng.
Sử dụng đầu tip pipet sạch, chuyển 30 µl từ giếng dung dịch pha loãng thứ nhất vào giếng mẫu thử thứ nhất (giếng có lysat được hấp phụ ở đáy) và 30 µl khác từ giếng dung dịch pha loãng thứ nhất vào giếng dung dịch pha loãng thứ hai (hỗn hợp này có độ pha loãng của huyền phù ban đầu là 10-1). Sử dụng đầu tip pipet sạch, trộn kỹ các lượng chứa của giếng dung dịch pha loãng thứ hai.
Chuyển 30 µl từ giếng dung dịch pha loãng thứ hai sang giếng mẫu thử thứ hai và 30 µl khác từ giếng dung dịch pha loãng thứ hai sang giếng mẫu thử thứ ba (hỗn hợp này có độ pha loãng của huyền phù ban đầu là 10-1,5). Sử dụng đầu tip pipet sạch, trộn kỹ.
Tiếp tục pha loãng các vật liệu thử trong đĩa vi giếng như trên cho đến khi tất cả tám giếng mẫu thử theo hàng dọc được rót đầy mẫu.
Bốn mẫu có thể được kiểm tra trên một đĩa cùng với các mẫu kiểm soát (B.4.3)
B.4.3 Kiểm soát dương tính và âm tính
B.4.3.1 Yêu cầu chung
Ngoài các mẫu thử, các mẫu kiểm soát dương tính và âm tính cũng phải được kết hợp trên mỗi đĩa.
B.4.3.2 Mẫu kiểm soát dương tính
Huyền phù lại chất chuẩn đối chứng dạng đông khô (B.2.2) trong nước không chứa nội độc tố để chuẩn bị dung dịch nồng độ 50 EU/ml. Đồng hóa trong 2 min. Kiểm tra các mẫu thử như mô tả trong B.4.2.
B.4.3.3 Mẫu kiểm soát âm tính
Thêm 30 µl nước không chứa nội độc tố (B.2.1) vào hai giếng mẫu thử thay thế trong đĩa vi giếng.
B.4.4 Nuôi cấy chất thử LAL
Phủ giấy Parafilm® (B.3.5) lên các đĩa vi giếng ngay sau khi chuẩn bị và để nổi trên nồi cách thủy ở 37 °C ± 0,5 °C trong 1 h.
B.4.5 Sự hình thành của các khối gel
Sau giai đoạn ủ, lấy đĩa ra khỏi nồi cách thủy và cẩn thận làm khô vết nước. Tháo giấy Parafilm® ra và thêm 1 giọt thuốc nhuộm xanh toluidin (B.2.3) vào từng giếng dung dịch thử. Đề phát hiện sự hình thành gel, hút nhả từng giếng dung dịch thử sử dụng pipet Pasteur được gắn với một bơm hút nhẹ (B.3.6). Cắm nhẹ đầu tip pipet xuống đáy giếng và hút (cẩn thận để không quét pipet Pasteur qua đáy giếng vì sẽ làm vỡ khối gen bất kỳ đã được hình thành khi rút pipet ra). Ghi lại phản ứng dương tính (+) khi gel hình thành trong giếng (khi một lỗ nhỏ trong gel hình thành, nơi có thể nhìn thấy pipet Pasteur chạm vào). Ghi lại phản ứng âm tính (-) nếu lượng chứa trong giếng được hút hết. Ghi lại phản ứng từng phần (+/-) khi có bằng chứng hình thành gel nhẹ ở đáy giếng, nghĩa là các giếng không rỗng hoàn toàn.
B.5 Tính hàm lượng nội độc tố của mẫu thử
Hàm lượng nội độc tố của mẫu thử được báo cáo là EU trên gam mẫu. Xác định độ chuẩn của giếng dương tính cuối cùng trong dãy các giếng dung dịch pha loãng.
Ví dụ để xác định độ chuẩn:
VÍ DỤ 1:
| Giếng thử | Phản ứng LAL | Độ pha loãng |
| 1 | + | 10-0,5 |
| 2 | + | 10-1,0 |
| 3 | + | 10-1,5 |
| 4 | - | 10-2,0 |
| Độ chuẩn = 1,5 |
|
|
VÍ DỤ 2:
| Giếng thử | Phản ứng LAL | Độ pha loãng |
| 1 | + | 10-0,5 |
| 2 | + | 10-1,0 |
| 3 | +/- ở đây là tạo gel một phần | 10-1,5 |
| 4 | - | 10-2,0 |
| 5 | - | 10-2,5 |
| Độ chuẩn = 1,25 | ||
Tính số EU trên gam mẫu thử sử dụng Công thức (B.1) và (B.2):
EU/ml = 10(độ chuẩn) x độ nhạy của lysat (được cho bởi nhà sản xuất đĩa vi giếng) (B.1)
EU/g = EU/ml x 10 (B.2)
B.6 Biểu thị kết quả
Biểu thị kết quả theo log10 EU/g.
B.7 Quy trình kiểm soát chất lượng
Các mẫu kiểm soát nội độc tố dương tính (B.4.3.2) và âm tính (B.4.3.3) được đưa vào từng đĩa vi giếng. Nếu kiểm soát âm tính cho thấy dương tính thì tất cả phép thử phải được lặp lại với một mẻ nước không chứa nội độc tố mới. Nếu kiểm soát dương tính khác nhau quá 0,25 độ chuẩn của độ chuẩn đối chứng được cho bởi nhà sản xuất (B.2.2) thì mẫu phải được thử nghiệm lại sử dụng đĩa vi giếng khác.
Phụ lục C
(Tham khảo)
Sơ đồ
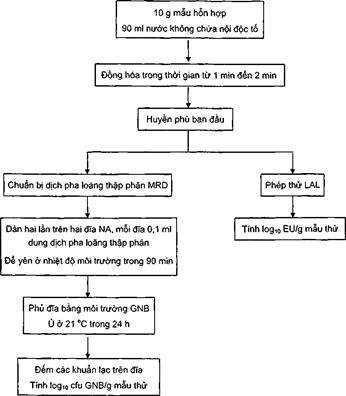
Hình C.1 - Sơ đồ mô tả phương pháp LAL/GNB
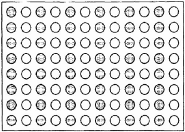
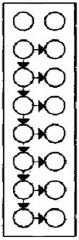
Hình C.2 - Sơ đồ mô tả đĩa vi giếng LAL hoàn chỉnh8) (xem B.3.3)
![]() Giếng dung dịch pha loãng
Giếng dung dịch pha loãng
![]() Giếng mẫu thử lysat
Giếng mẫu thử lysat
|
|
|
|
| Bước 1 | Bước 2 | Bước 3 |
| Cho 65 µl nước không chứa nội độc tố vào từng giếng dung dịch pha loãng (bên trái các dãy) | Thêm 30 µl mẫu ban đầu đồng nhất vào giếng dung dịch pha loãng thứ nhất trong các dãy | Trộn kỹ lượng chứa trong giếng dung dịch pha loãng |
|
|
|
|
| Bước 4 | Bước 5 | Bước 6 |
| Sử dụng đầu tip pipet sạch, chuyển 30 µl dung dịch từ giếng dung dịch pha loãng vào giếng mẫu thử bên cạnh (bên phải các dãy được phân biệt bằng lysat được hấp thụ vào đáy giếng | Chuyển 30 µl từ giếng dung dịch thử vào giếng dung dịch pha loãng tiếp theo (bên dưới) trong các dãy. Tháo đầu tip | Lặp lại các bước 3,4 và 5 cho đến khi hết các dãy |
Hình C.3 - Sơ đồ mô tả các dãy giếng dung dịch pha loãng và mẫu thử trong một đĩa vi giếng 96 giếng có LAL (xem B.4.2)
Thư mục tài liệu tham khảo
[1] TCVN 7408 (EN 1784) Thực phẩm - Phát hiện thực phẩm chiếu xạ đối với loại thực phẩm có chứa chất béo - Phân tích hydrocacbon bằng sắc kí khí.
[2] TCVN 7409 (EN 1785) Thực phẩm - Phát hiện thực phẩm chiếu xạ có chứa chất béo - Phân tích 2-alkylcyclobutanon bằng phương pháp sắc kí khí/phổ khối lượng.
[3] TCVN 7410 (EN 1786) Thực phẩm - Phát hiện thực phẩm chiếu xạ đối với loại thực phẩm có chứa xương - Phương pháp quang phổ ESR.
[4] Scotter, S.L., Holley, P., and Wood, R., 1990, Co-operative trial of methods of analysis to detect irradiation treatment of chicken samples: initial trial, Int. J. Food Sci. Technol., 25, 512-518.
[5] Scotter, S.L. Wood, R., and McWeeny, D., 1990, Evaluation of the Limulus amoebocyte lysate test in conjunction with a Gram negative bacterial count for detecting irradiation of chicken. Radiat. Phys. Chem., 36, 629-638.
[6] Scotter, S.L, Beardwood, K., and Wood, R., 1995, Detection of irradiation of poultry meat using the Limulus amoebocyte lysate test in conjunction with a Gram negative bacteria Count: Collaborative Trial. J. Assoc. Publ. Analysts. 31 (4), 163-178.
[7] Sudi, J., Suhren, G., Heeschen, W. and Tolle, A., 1981, Entwicklung eines miniaturisierten Limulus-Tests im Mikrotitier-System zum quantitativen Nachweis gram-negativer Bakterien in Milch und Milchprodukten (Development of a miniaturised Limulus assay using the microtitre system for the quantitative determination of Gram negative bacteria in milk and milk products). Milchwissenschaft, 36 (4), 193.
*) TCVN 8128-1:2009 (ISO/TS 11133-1:2000) hiện nay đã hủy và được thay thế bằng TCVN 8128:2015 (ISO 11133:2014), Vi sinh vật trong thực phẩm, thức ăn chăn nuôi và nước - Chuẩn bị, sản xuất, bảo quản và thử hiệu năng của môi trường nuôi cấy.
1) Liều kế bằng chất dẻo persex tối màu là ví dụ về sản phẩm thích hợp có được từ Harwell, Vương quốc Anh đã được sử dụng cho thử nghiệm liên phòng. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm này. Các sản phẩm tương tự có thể được sử dụng nếu cho các kết quả tương đương.
2) Nước không chứa nội độc tố (pyrogen) thường có thể có được từ các nhà sản xuất cung cấp cho ngành dược phẩm.
3) Oxoid CM21 là ví dụ về sản phẩm thích hợp có bán sẵn trên thị trường. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm này. Các sản phẩm tương tự có thể được sử dụng nếu cho các kết quả tương đương.
4) Nước không chứa nội độc tố (pyrogen) thường có thể có được từ các nhà sản xuất cung cấp cho ngành dược phẩm.
5) Chất chuẩn đối chứng LPS là ví dụ về sản phẩm thích hợp có bán sẵn trên thị trường. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm này. Các phương pháp khác để xác định nồng độ LPS là có sẵn và có thể được thay thế nếu được chứng minh là cho các kết quả tương đương với kết quả phép phân tích vi lượng.
6) Tween 20® là ví dụ về sản phẩm thích hợp có bán sẵn trên thị trường. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm này.
7) Đĩa vi giếng LAL và giấy Paraflim® là ví dụ về các sản phẩm thích hợp có bán sẵn trên thị trường. Thông tin này đưa ra ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng các sản phẩm này.
8) Đĩa vi giếng LAL là ví dụ về các sản phẩm thích hợp có bán sẵn trên thị trường. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng các sản phẩm này.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 12077:2017 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 12077:2017 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 12077:2017 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 12077:2017 DOC (Bản Word)