- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 7391-10:2007 Đánh giá sinh học trang thiết bị y tế - Phép thử kích thích và quá mẫn muộn
| Số hiệu: | TCVN 7391-10:2007 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Y tế-Sức khỏe |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
31/12/2007 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 7391-10:2007
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 7391-10:2007
TIÊU CHUẨN QUỐC GIA
TCVN 7391-10:2007
ISO 10993-10:2002
WITH AMENDMENT 1:2006
ĐÁNH GIÁ SINH HỌC ĐỐI VỚI TRANG THIẾT BỊ Y TẾ - PHẦN 10: PHÉP THỬ KÍCH THÍCH VÀ QUÁ MẪN MUỘN
Biological evaluation of medical devices - Part 10: Tests for irritation and delayed-type hypersensitivity
Lời nói đầu
TCVN 7391-10:2007 hoàn toàn tương đương với ISO 10993-10:2002 và Sửa đổi 1:2006.
TCVN 7391-10:2007 do Tiểu ban Kỹ thuật Tiêu chuẩn TCVN/TC210/SC2 Trang thiết bị y tế hoàn thiện trên cơ sở dự thảo đề nghị của Viện Trang thiết bị và Công trình y tế - Bộ Y tế, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
Bộ tiêu chuẩn TCVN 7391 (ISO 10993) với tên chung Đánh giá sinh học đối với trang thiết bị y tế, gồm các phần sau:
- TCVN 7391-1:2004 (ISO 10993-1:2003) Phần 1: Đánh giá và thử nghiệm
- TCVN 7391-2:2005 (ISO 10993-2:1992) Phần 2: Yêu cầu sử dụng động vật
- TCVN 7391-3:2005 (ISO 10993-3:2003) Phần 3: Phép thử độc tính di truyền, khả năng gây ung thư và độc tính sinh sản
- TCVN 7391-4:2005 (ISO 10993-4:2002) Phần 4: Chọn phép thử tương tác với máu
- TCVN 7391-5:2005 (ISO 10993-5:1999) Phần 5: Phép thử độc tính tế bào in vitro
- TCVN 7391-6:2007 (ISO 10993-6:1994) Phần 6: Phép thử hiệu ứng tại chỗ sau cấy ghép
- TCVN 7391-7:2004 (ISO 10993-7:1995) Phần 7: DƯ lượng sau tiệt trùng bằng etylen oxit
- TCVN 7391-10:2007 (ISO 10993-10:2002) Phần 10: Phép thử kích thích và quá mẫn muộn
- TCVN 7391-11:2007 (ISO 10993-11:2006) Phần 11: Phép thử độc tính toàn thân
- TCVN 7391-12:2007 (ISO 10993-12:2002) Phần 12: Chuẩn bị mẫu và vật liệu chuẩn
- TCVN 7391-14:2007 (ISO 10993-14:2001) Phần 14: Nhận dạng và định lượng sản phẩm phân hủy từ gốm sứ
- TCVN 7391-15:2007 (ISO 10993-15:2000) Phần 15: Nhận dạng và định lượng sản phẩm phân hủy từ kim loại và hợp kim
- TCVN 7391-16:2007 (ISO 10993-16:1997) Phần 16: Thiết kế nghiên cứu độc lực cho sản phẩm phân hủy và ngâm chiết
- TCVN 7391-17:2007 (ISO 10993-17:2002) Phần 17: Thiết lập giới hạn cho phép của chất ngâm chiết
- TCVN 7391-18:2007 (ISO 10993-18:2005) Phần 18: Đặc trưng hóa học của vật liệu
Bộ tiêu chuẩn ISO 10993 với tên chung Biological evaluation of devices, còn có các phần sau:
- Part 9: Framework for identification and quantification of potential degradation products
- Part 13: Identification and quantification of degradation products from polymeric medical devices
- Part 19: Physico-chemical, morphological and topographical characterization
- Part 20: Principles and methods for immunotoxicology testing of medical devices
Lời giới thiệu
Tiêu chuẩn này đánh giá sự nguy hại có thể xảy ra do tiếp xúc với các chất hóa học giải phóng từ các trang thiết bị y tế mà có thể gây kích thích da và niêm mạc, kích thích mắt và tiếp xúc quá mẫn muộn.
Một số vật liệu trong các trang thiết bị y tế đã được thử gây sự kích thích da và niêm mạc hoặc tiềm năng gây mẫn cảm đã được trình bày thành tài liệu. Các vật liệu và các thành phần hóa học của chúng không được thử và có thể gây ra các tác động có hại khi tiếp xúc với cơ thể người. Chính vì vậy, nhà sản xuất bắt buộc phải đánh giá các tác động có hại tiềm ẩn của mỗi trang thiết bị trước khi đưa ra thị trường.
Trước đây, các phép thử trên động vật nhỏ được tiến hành trước khi thử nghiệm trên người để giúp dự đoán phản ứng trên người. Gần đây hơn các phép thử in vitro cũng như các phép thử trên người được thêm vào như các phép thử thay thế. Mặc dù tiến bộ và nỗ lực đáng kể trong hướng này, nhưng tổng kết các kết quả nghiên cứu cho thấy không có phép thử in vitro nào được đưa ra để loại bỏ yêu cầu tiến hành phép thử in vivo. Khi thích hợp, khuyến khích áp dụng sơ bộ các phương pháp in vitro cho mục,đích sàng lọc trước khi tiến hành phép thử trên động vật. Để giảm số lượng động vật sử dụng, phần này của TCVN 7391 (ISO 10993) trình bày một phương pháp tiếp cận với xem xét và phân tích các kết quả thử ở mỗi giai đoạn. Một phép thử trên động vật thường cần thiết trước khi tiến hành phép thử trên người.
Người ta dự định rằng các nghiên cứu này được tiến hành bằng kỹ thuật phòng thí nghiệm chuẩn và tuân theo các quy định liên quan đến sử dụng động vật. Phân tích thống kê số liệu được khuyến cáo và sử dụng bất kỳ khi nào thích hợp.
Các phép thử trong tiêu chuẩn này là công cụ quan trọng để phát triển các sản phẩm an toàn khi được thực hiện và giải thích bởi những nhân viên được đào tạo.
ĐÁNH GIÁ SINH HỌC ĐỐI VỚI TRANG THIẾT BỊ Y TẾ - PHẦN 10: PHÉP THỬ KÍCH THÍCH VÀ QUÁ MẪN MUỘN
Biological evaluation of medical devices - Part 10: Tests for irritation and delayed-type hypersensitivity
1. Phạm vi áp dụng
Tiêu chuẩn này mô tả quy trình đánh giá trang thiết bị y tế và vật liệu cấu thành về tiềm năng gây ra kích thích và phản ứng quá mẫn muộn.
Tiêu chuẩn này gồm:
a) xem xét trước khi thử;
b) chi tiết của các quy trình thử, và
c) các yếu tố cơ bản để giải thích kết quả.
Các chỉ dẫn nêu trong Phụ lục A để chuẩn bị vật liệu cụ thể liên quan đến các phép thử nêu trên.
Các phép thử bổ sung được yêu cầu cụ thể cho các trang thiết bị dùng dưới da và trong mắt, miệng, trực tràng, dương vật và âm đạo được nêu trong Phụ lục B.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi (nếu có).
TCVN 7391-1:2004 (ISO 10993-1:2003) Đánh giá sinh học đối với trang thiết bị y tế - Phần 1: Đánh giá và thử nghiệm
TCVN 7391-2 (ISO 10993-2) Đánh giá sinh học đối với trang thiết bị y tế - Phần 2: Yêu cầu sử dụng động vật
TCVN 7391-12 (ISO 10993-12) Đánh giá sinh học đối với trang thiết bị y tế - Phần 12: Chuẩn bị mẫu và vật liệu chuẩn
TCVN 7391-14 (ISO 10993-14) Đánh giá sinh học đối với trang thiết bị y tế - Phần 14: Nhận dạng và định lượng sản phẩm phân hủy từ gốm sứ
TCVN 7391-15 (ISO 10993-15) Đánh giá sinh học đối với trang thiết bị y tế - Phần 15: Nhận dạng và định lượng sản phẩm phân hủy từ kim loại và hợp kim
TCVN 7391-18 (ISO 10993-18) Đánh giá sinh học đối với trang thiết bị y tế - Phần 18: Đặc trưng hóa học của vật liệu
TCVN 7740-1 (ISO 14155-1) Thử lâm sàng trang thiết bị y tế đối với con người - Phần 1: Yêu cầu chung
TCVN 7740-2 (ISO 14155-2) Thử lâm sàng trang thiết bị y tế đối với con người - Phần 2: Kế hoạch thử lâm sàng
ISO 10993-9 Biological evaluation of devices z Part 9: Framework for identification and quantification of potential degradation products (Đánh giá sinh học đối với trang thiết bị y tế - Phần 9: Cơ cấu để nhận dạng và định lượng sản phẩm phân hủy tiềm ẩn)
ISO 10993-13 Biological evaluation of devices z Part 13: Identification and quantification of degradation products from polymeric medical devices (Đánh giá sinh học đối với trang thiết bị y tế - Phần 13: Nhận dạng và định lượng sản phẩm phân hủy từ các trang thiết bị y tế polyme)
3. Thuật ngữ và định nghĩa
Tiêu chuẩn này áp dụng các thuật ngữ và định nghĩa nêu trong TCVN 7391-1 (ISO 10993-1) và các thuật ngữ và định nghĩa sau:
3.1. Chất gây dị ứng (allergen)
Chất gây mẫn cảm (sensitizer)
Chất/vật liệu có thể gây ra quá mẫn đặc hiệu, chẳng hạn sau khi tiếp xúc với cùng một chất/vật liệu mà bị dị ứng.
3.2. Dịch trắng (blank liquid)
Phần dung môi đã xử lý theo cách giống như dung môi dùng để chuẩn bị mẫu thử nhưng không chứa vật liệu thử, và dùng để xác định phản ứng của dung môi.
3.3. Thử thách (challenge)
Khêu gợi (elicitation)
Quá trình sau pha cảm ứng, trong đó các tác động miễn dịch của các lần tiếp xúc sau trong một cá thể với vật liệu cảm ứng được kiểm tra.
3.4. Ăn mòn (corrosion)
Phá hủy từ từ kết cấu hoặc vật liệu của mô.
VÍ DỤ Tác động của chất kích thích mạnh.
3.5. Quá mẫn muộn (delayed-type hypersensitization)
Cảm ứng của bộ nhớ miễn dịch trung gian tế bào T đặc hiệu đối với một chất gây dị ứng mà một cá thể đã tiếp xúc, gây ra phản ứng chậm sau khi tiếp xúc lần hai với chất gây dị ứng.
3.6. Liều (dose)
Lượng cấp cho hệ thống thử trong một lần.
3.7. Ban đỏ (erythema)
Làm đỏ da hoặc niêm mạc.
3.8. Vảy (eschar)
Vảy hoặc đám vảy mất màu của da.
3.9. Cảm ứng (induction)
Quá trình dẫn đến hình thành de novo của trạng thái phản ứng miễn dịch bị thay đổi trong một cá thể với một vật liệu cụ thể.
3.10. Chất kích thích (irritant)
Tác nhân gây ra kích thích.
3.11. Sự kích thích (irritation)
Phản ứng viêm không đặc hiệu cục bộ khi dùng một lần, lặp lại hoặc liên tục của một chất/vật liệu.
3.12. Hoại tử (necrosis)
Sự chết của một hoặc nhiều tế bào, hoặc phần mô hoặc cơ quan do hư hại không thể phục hồi được.
3.13. Đối chứng âm tính (negative control)
Vật liệu hoặc chất mà khi được thử theo quy trình đã mô tả, chứng minh được sự phù hợp của quy trình để tạo ra phản ứng có thể tái lập, âm tính phù hợp, không phản ứng hoặc đáp ứng cơ bản trong hệ thống thử.
3.14. Phù, nề (oedema)
Sưng tấy do sự xâm nhập bất thường của dịch lỏng vào mô.
3.15. Đối chứng dương tính (positive control)
Vật liệu hoặc chất mà khi được thử theo quy trình đã mô tả, chứng minh được sự phù hợp của quy trình này để tạo ra phản ứng có thể tái lập, dương tính phù hợp hoặc phản ứng trong hệ thống thử.
3.16. Dung môi (solvent)
Vật liệu hoặc chất dùng để làm ẩm, hòa loãng, ngâm chiết, làm lơ lửng hoặc hòa tan chất/vật liệu thử.
VÍ DỤ Hóa chất, tá dược lỏng, môi trường, v.v…
3.17. Vật liệu thử (test material)
Vật liệu, dụng cụ, bộ phận hoặc thành phần của dụng cụ được lấy mẫu để thử nghiệm sinh học hoặc hóa học.
3.18. Mẫu thử (test sample)
Chất ngâm chiết hoặc phần của vật liệu thử dùng cho thử nghiệm sinh học hoặc hóa học.
3.19. Loét (ulceration)
Vết thương mở do mất mô bề mặt.
4. Nguyên tắc chung - Các bước tiếp cận
Các phương pháp sẵn có để thử nghiệm sự kích thích và gây mẫn cảm được phát triển một cách cụ thể để phát hiện kích thích da và tiềm năng gây mẫn cảm. Phép thử này nhìn chung không tiên đoán được các tác động có hại khác.
Tiêu chuẩn này yêu cầu phương pháp bước tiếp cận bao gồm một hoặc nhiều yếu tố sau đây:
a) đặc trưng vật liệu thử liên quan đến đặc trưng hóa học và phân tích mẫu thử theo các nguyên tắc chung mô tả trong ISO 10993-9, ISO 10993-13, TCVN 7391-14 (ISO 10993-14), TCVN 7391-15 (ISO 10993-15) và TCVN 7391-18 (ISO 10993-18);
b) xem xét tài liệu bao gồm đánh giá các đặc điểm lý hóa và thông tin về tiềm năng gây kích thích và quá mẫn của bất kỳ thành phần sản phẩm cũng như hóa chất và vật liệu nào liên quan đến cấu trúc;
c) ưu tiên xem xét các phép thử in vitro hơn là các phép thử in vivo, và thay thế các phép thử in vivo bằng các phương pháp in vitro mới có sẵn và đã được công nhận là có giá trị. Tại thời điểm hiện tại không có các phép thử in vitro nào có sẵn được công nhận là có giá trị (ngoài các quá trình sàng lọc đơn giản) để phát hiện các chất kích thích hoặc chất gây mẫn cảm.
d) các phép thử in vivo trên động vật;
CHÚ THÍCH Các nghiên cứu in vivo cấp tính trên động vật được tiến hành để thử vật liệu ở bước a) và b) chưa được phân loại là chất kích thích mạnh hoặc chất gây mẫn cảm mạnh. Vật liệu mà không biểu hiện kích thích da cấp tính khi tiếp xúc một lần thì sau đó có thể được đánh giá thêm với tiếp xúc lặp lại.
Phép thử gây mẫn cảm cho da [7] của chất đối chứng dương tính phải được tiến hành tối thiểu với mười động vật thử và năm động vật đối chứng ít nhất sáu tháng một lần tại phòng thí nghiệm để thẩm định hệ thống thử và chứng minh được phản ứng dương tính.
CHÚ THÍCH Một số động vật có thể được sử dụng khi một thí nghiệm gây mẫn cảm dương tính được thực hiện với tần số nhiều hơn sáu tháng một lần. Nên sử dụng tối thiểu năm động vật thử gây mẫn cảm và năm động vật đối chứng.
e) Các phép thử không xâm nhập trên người/các phép thử lâm sàng
Nếu vật liệu đã chứng minh không phải là chất kích thích, chất gây mẫn cảm hoặc chất độc cho động vật thì sau đó có thể xem xét các nghiên cứu kích thích trên da người.
5. Xem xét trước khi thử
5.1. Quy định chung
Điều quan trọng phải nhấn mạnh là các xem xét trước khi thử có thể đưa ra kết luận rằng thử nghiệm kích thích và/hoặc gây mẫn cảm có thể là không cần thiết.
Áp dụng các yêu cầu nêu trong điều 5 của TCVN 7391-1:2004 (ISO 10993-1:2003) và trong các điều dưới đây.
5.2. Loại vật liệu
5.2.1. Xem xét ban đầu
Khi chế tạo và lắp đặt các trang thiết bị y tế, cần chú ý đến các thành phần hóa học bổ sung có thể đã dùng để hỗ trợ quá trình chế tạo, ví dụ các chất bôi trơn hoặc các tác nhân khử nấm mốc. Ngoài các thành phần hóa học của vật liệu khởi đầu và các chất hỗ trợ quá trình chế tạo ra, các dư lượng dính kết/dung môi trong quá trình lắp ráp và các dư lượng của quá trình tiệt trùng hoặc các sản phẩm phản ứng do quá trình tiệt trùng có thể có mặt trong sản phẩm thành phẩm. Những hợp chất này có gây ra nguy hại/rủi ro cho sức khỏe hay không còn phụ thuộc vào đặc tính rò rỉ hoặc phân hủy của các sản phẩm thành phẩm.
5.2.2. Sứ, kim loại và hợp kim
Các vật liệu này thường ít phức tạp hơn polyme và các vật liệu có nguồn gốc sinh học về mặt số lượng thành phần hóa học.
5.2.3. Polyme
Vật liệu này thường có thành phần cấu tạo hóa học phức tạp hơn so với các vật liệu trong 5.2.1. Một số phụ gia có thể có mặt và sự hoàn thành quá trình polyme hóa có thể thay đổi.
5.2.4. Vật liệu có nguồn gốc sinh học
Các vật liệu này vốn đã phức tạp về thành phần cấu tạo. Chúng thường chứa các dư lượng của quá trình, ví dụ như các chất liên kết chéo và các tác nhân kháng khuẩn. Các vật liệu sinh học có thể không nhất quán giữa các mẫu.
Các phương pháp trong tiêu chuẩn này không được thiết kế để thử các vật liệu có nguồn gốc sinh học, và do vậy không phù hợp. Ví dụ như, các phép thử trong tiêu chuẩn này không xem xét quá trình gây mẫn cảm chéo giữa các loài.
5.3. Thông tin về thành phần hóa học
5.3.1. Quy định chung
Số liệu định tính đầy đủ về thành phần hóa học của vật liệu phải được thiết lập. Khi nào liên quan đến an toàn sinh học thì phải có số liệu định lượng. Nếu không có số liệu định lượng thì phải có văn bản nêu rõ lý do và giải thích rõ ràng.
5.3.2. Nguồn dữ liệu hiện có
Thông tin định tính và định lượng về thành phần cấu tạo phải nhận được từ nhà cung cấp vật liệu ban đầu.
Đối với các polymer, các yêu cầu này thường phải truy cập thông tin độc quyền; nên có các điều khoản về chuyển giao và sử dụng thông tin bí mật đó.
Thông tin định tính về bất kỳ phụ gia xử lý bổ sung (ví dụ, tác nhân chống mốc) cũng phải nhận được từ các thành viên thích hợp của tập đoàn chế tạo bao gồm nhà sáng chế và nhà sản xuất cổ phần.
Khi không có bất kỳ số liệu nào về thành phần, một nghiên cứu tài liệu tham khảo để thiết lập bản chất có thể của vật liệu ban đầu và bất kỳ phụ gia nào được đề nghị để trợ giúp cho việc lựa chọn các phương pháp phân tích phù hợp nhất cho vật liệu liên quan.
CHÚ THÍCH Thành phần sứ, kim loại và hợp kim có thể theo tiêu chuẩn của ISO hoặc Hiệp hội Thử nghiệm vật liệu Hoa Kỳ (ASTM) và/hoặc người sử dụng quy định. Tuy nhiên, để nhận được đầy đủ chi tiết định tính và định lượng về thành phần, cần thiết yêu cầu thông tin này từ nhà cung cấp hoặc nhà chế tạo vật liệu ban đầu và cũng từ nhà chế tạo thành viên để đảm bảo rằng các chất hỗ trợ xử lý cũng được xác định. Các hồ sơ gốc về vật liệu do cơ quan có thẩm quyền lưu giữ nếu có thể tiếp cận được cũng là một nguồn dữ liệu khác.
5.4. Đặc trưng vật liệu
Khi không có sẵn các chi tiết của thành phần, hoặc chỉ có thông tin định tính hoặc các chất mới hoặc chưa được biết rõ cần được nghiên cứu trong quá trình chế tạo, thì phải tiến hành phân tích vật liệu.
Phải sử dụng các phương pháp phân tích phù hợp với vật liệu nghiên cứu. Tất cả các kỹ thuật phân tích phải được lập luận và giải thích, đánh giá và báo cáo, nếu chưa biết, độ pH của vật liệu (dung dịch hóa học) phải được đo trước bất kỳ thử nghiệm in vitro hoặc in vivo khi nào có thể. Phân tích hóa học (định tính cũng như định lượng) chất ngâm chiết có thể cung cấp thông tin hữu ích. Trong trường hợp này, cũng phải nhấn mạnh rằng phân tích hóa học chất ngâm chiết có thể cho kết quả khiến cho việc thử nghiệm kích thích và gây mẫn cảm là không cần thiết, vì thông tin về khả năng kích thích và gây mẫn cảm của các hợp chất có mặt trong dung dịch ngâm chiết đã sẵn có.
6. Phép thử kích thích
6.1. Phép thử kích thích in vitro
Hai phương pháp in vitro, phép thử kháng điện qua da (TER) của da chuột và phép thử EPISKIN đã được đánh giá trên trường quốc tế như các phép thử thay thế để đánh giá sự ăn mòn da của các chất hóa học. Tuy nhiên, vẫn chưa có phương pháp hiệu lực nào để đánh giá khả năng kích thích da.
Các tổ chức quốc gia và quốc tế tiếp tục làm việc để nghiên cứu và đánh giá hiệu lực các phép thử kích thích da in vitro cùng với việc tìm kiếm các phương pháp thay thế; các tổ chức khác đang nghiên cứu các phương pháp định lượng phản ứng của động vật và người để xác định tốt hơn các điểm cuối bằng các kỹ thuật không xâm nhập. Xem C.1.
6.2. Yếu tố được xem xét khi thiết kế và lựa chọn các phép thử in vivo
Thử nghiệm khả năng kích thích của các trang thiết bị y tế có thể tiến hành với sản phẩm thành phẩm và/hoặc chất ngâm chiết của chúng.
Các yếu tố tác động đến kết quả nghiên cứu kích thích bao gồm:
a) bản chất trang thiết bị dùng trong một miếng gạc thử;
b) liều của vật liệu thử;
c) phương pháp ứng dụng vật liệu thử;
d) mức độ tắc;
e) vị trí ứng dụng;
f) khoảng thời gian và số lần tiếp xúc;
g) kỹ thuật dùng đánh giá phép thử.
Thông tin cơ sở bổ sung được cung cấp trong Phụ lục C.
Trong khi độ linh hoạt cho phép các nhà nghiên cứu tăng độ nhạy của phép thử sao cho phù hợp với các điều kiện sử dụng và tiếp xúc của quần thể thì sự nhất quán trong quy trình góp phần vào khả năng so sánh của các kết quả thử với các vật liệu khác nhau và từ các phòng thí nghiệm khác nhau.
Các điều khoản trong quy trình thử để đánh giá trang thiết bị và vật liệu tiếp xúc lặp lại và/hoặc kéo dài. Nghiên cứu phải được thiết kế để tăng sự tiếp xúc được dự đoán trước (thời gian và/hoặc nồng độ) trong điều kiện lâm sàng. Điều này phải được lưu ý khi giải thích kết quả.
Nếu pH của mẫu thử nhỏ hơn hoặc bằng 2 hay bằng hoặc lớn hơn 11,5 thì phải thông báo vật liệu là một chất kích thích và không cần bất kỳ thử nghiệm nào nữa. Tuy nhiên, theo thực nghiệm cho thấy độ axit và kiềm của vật liệu thử không phải là nhân tố duy nhất được xem xét liên quan đến khả năng của vật liệu gây ra tổn thương nghiêm trọng. Nồng độ của vật liệu thử, thời gian tiếp xúc và nhiều các đặc điểm lý hóa khác cũng là quan trọng.
CHÚ THÍCH Đối với các sản phẩm dự định dùng nhiều trên da bình thường và da bị tổn thương, không một rủi ro đáng kể nào được chấp nhận; tuy nhiên, nhiều sản phẩm mặc dù có khả năng kích thích vẫn có thể được chấp nhận hoàn toàn vì lợi ích vốn có hoặc hoạt tính sinh học của chúng.
6.3. Phép thử kích thích da động vật
6.3.1. Nguyên tắc
Phải đánh giá tiềm năng của vật liệu đưa thử gây ra kích thích da trong mô hình động vật tương ứng.
Thỏ là động vật thử được ưu tiên sử dụng.
6.3.2. Vật liệu thử
Nếu vật liệu thử dạng rắn hoặc dạng lỏng thì vật liệu phải được chuẩn bị như quy định trong Phụ lục A.
Để chứng minh độ nhạy của phương pháp thì nên bổ sung một đối chứng dương tính trên mỗi động vật ngoài đối chứng âm tính. Vì có hai vị trí thử và hai vị trí đối chứng trên mỗi động vật, nên tối đa là hai vật liệu thử có thể được áp dụng cùng với vật liệu đối chứng, miễn là sử dụng cùng tá dược lỏng.
6.3.3. Động vật và nuôi dưỡng
Phải sử dụng thỏ bạch trưởng thành, khỏe, không phân biệt giới tính, đơn chủng và cân nặng không quá 2 kg.
Các động vật phải được làm thích nghi và chăm sóc như quy định trong TCVN 7391-2 (ISO 10993-2).
Nếu dự đoán được phản ứng kích thích, trước tiên phải xem xét để thử nghiệm trong một động vật. Nếu không quan sát thấy phản ứng dương tính rõ ràng [chỉ số lớn hơn 2 đối với ban đỏ hoặc phù nề (xem Bảng 1)] thì tối thiểu phải sử dụng tiếp hai động vật nữa. Nếu không có phản ứng mong đợi thì thử nghiệm ban đầu có thể tiến hành với ba động vật. Nếu phản ứng trong phép thử dùng tối thiểu ba động vật mà vẫn không rõ, phải xem xét thử nghiệm tiếp.
6.3.4. Quy trình thử
6.3.4.1. Chuẩn bị động vật
Điều kiện của da là một nhân tố quan trọng. Chỉ sử dụng động vật còn nguyên da và khỏe mạnh. Thường cạo lông trên lưng của động vật một khoảng cách đủ trên cả hai phía của xương sống để ứng dụng và quan sát tất cả các vị trí thử (khoảng 10 cm x 15 cm) trong vòng 24 h đến 4 h của cuộc thử. Lông có thể bị cạo lại để dễ quan sát và/hoặc giúp cho việc tiếp xúc lặp lại. Có thể sử dụng thuốc làm rụng lông do các kỹ thuật viên được đào tạo tiến hành, nếu quá trình này được đánh giá thuận lợi cho phép thử. Nếu cần tiếp xúc lặp lại tiến hành theo quy trình trong 6.3.4.2, 6.3.4.3 hoặc 6.3.4.4, lặp lại trong tối đa 21 ngày.
6.3.4.2. Sử dụng mẫu dạng bột hoặc dạng lỏng
Đặt 0,5 g hoặc 0,5 ml vật liệu thử trực tiếp vào mỗi vị trí thử trên da như trong Hình 1. Đối với các vật liệu dạng rắn và không -a nước thì không cần làm ẩm. Nếu vật liệu là bột nên làm ẩm nhẹ bằng nước hoặc dung môi thích hợp khác trước khi đặt (xem Phụ lục A).
Phủ vị trí ứng dụng bằng mảnh băng không hút 2,5 cm x 2,5 cm (ví dụ như một miếng gạc thấm hút) và sau đó bọc vị trí ứng dụng bằng băng (bán hút hay hút) trong vòng tối thiểu 4 h. Cuối thời gian tiếp xúc, loại bỏ mảnh băng phủ và đánh dấu vị trí bằng mực không trôi. Loại bỏ dư lượng vật liệu thử bằng các phương tiện thích hợp, chẳng hạn như rửa bằng nước ấm hoặc dung môi không gây kích thích phù hợp và làm khô cẩn thận.
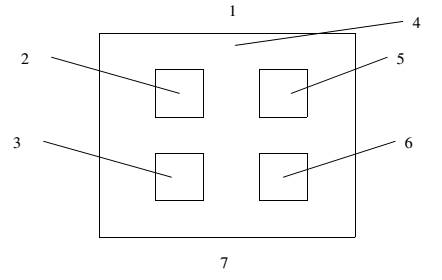
CHÚ DẪN
1 Điểm cùng sọ 5 Vị trí đối chứng
2 Vị trí thử 6 Vị trí thử
3 Vị trí đối chứng 7 Điểm cùng đuôi
4 Vùng lưng bị cạo
Hình 1 - Định vị các vị trí ứng dụng trên da
6.3.4.3. Sử dụng chất ngâm chiết và tá dược lỏng ngâm chiết
Đặt chất ngâm chiết phù hợp vào miếng gạc thấm hút 2,5 cm x 2,5 cm. Dùng một thể tích chất ngâm chiết đủ để thấm đều gạc; thường là 0,5 ml/miếng gạc. Đặt một miếng gạc trên mỗi phía của động vật như trong Hình 1. Đặt một miếng gạc đối chứng làm ẩm bằng tá dược lỏng ngâm chiết như chỉ dẫn trong Hình 1.
Phủ vị trí ứng dụng bằng băng (bán hút hay hút) tối thiểu là 4 h. Cuối thời gian tiếp xúc loại bỏ mảnh băng phủ và đánh dấu vị trí bằng mực không trôi. Loại bỏ dư lượng vật liệu thử bằng các phương tiện thích hợp, chẳng hạn như rửa bằng nước ấm hoặc dung môi không gây kích thích phù hợp và làm khô cẩn thận.
6.3.4.4. Sử dụng mẫu dạng rắn
Đặt các mẫu vật liệu thử trực tiếp vào da trên mỗi phía của mỗi con thỏ như chỉ dẫn trong Hình 1. Tương tự, đặt mẫu đối chứng lên mỗi con thỏ. Khi thử nghiệm các chất rắn (có thể tán thành bột nếu thấy cần thiết), vật liệu thử phải được làm đủ ẩm với nước, hoặc khi cần, bằng một dung môi thay thế để đảm bảo tiếp xúc tốt với da (xem Phụ lục A). Khi dùng dung môi, phải tính đến ảnh hưởng của dung môi đến kích thích của da bởi vật liệu thử.
Phủ vị trí ứng dụng bằng mảnh băng không thấm hút 2,5 cm x 2,5 cm (ví dụ như miếng gạc) và sau đó bọc vị trí ứng dụng bằng băng (bán thấm hoặc thấm) tối thiểu là 4 h. Cuối thời gian tiếp xúc, loại bỏ mảnh băng phủ và đánh dấu vị trí bằng mực không trôi. Loại bỏ dư lượng vật liệu thử bằng các phương tiện thích hợp, chẳng hạn như rửa bằng nước ấm hoặc dung môi không gây kích thích phù hợp và làm khô cẩn thận.
6.3.5. Quan sát động vật
6.3.5.1. Quy định chung
Khuyến cáo dùng ánh sáng tự nhiên hoặc đủ phổ để quan sát phản ứng của da. Mô tả và ghi mức độ phản ứng của da với các hiện tượng ban đỏ và phù nề theo hệ thống điểm số nêu trong Bảng 1 đối với mỗi vị trí ứng dụng tại mỗi thời điểm và ghi kết quả để báo cáo thử.
CHÚ THÍCH Các kỹ thuật mô học hoặc không xâm nhập để đánh giá phản ứng của da có thể trợ giúp trong các trường hợp nhất định.
Bảng 1 - Hệ thống điểm số cho phản ứng da
| Phản ứng | Điểm số kích thích cơ bản |
| Ban đỏ và hình thành vảy |
|
| Không ban đỏ | 0 |
| Ban đỏ rất nhẹ (vừa đủ cảm nhận) | 1 |
| Ban đỏ rất rõ | 2 |
| Ban đỏ vừa phải | 3 |
| Ban đỏ nghiêm trọng (như củ cải đỏ) đến đóng vảy cản trở sự phân loại ban đỏ | 4 |
| Hình thành Phù nề |
|
| Không phù nề | 0 |
| Phù nề rất nhẹ (vừa đủ cảm nhận) | 1 |
| Phù nề rõ (bờ của vùng nổi lên rõ) | 2 |
| Phù nề vừa phải (nhô lên xấp xỉ 1 mm) | 3 |
| Phù nề nghiêm trọng (nhô lên hơn 1 mm và phát triển ra xa vùng tiếp cận) | 4 |
| Tổng điểm số kích thích có thể | 8 |
| Các thay đổi có hại khác tại vị trí trên da phải được ghi lại và báo cáo. | |
6.3.5.2. Phép thử tiếp xúc một lần
Đối với phép thử tiếp xúc một lần ghi lại biểu hiện của vị trí ứng dụng tại 1 h, 24 h, 48 h và 72 h sau khi tháo băng. Có thể cần quan sát thêm nếu có vết thương dai dẳng để đánh giá khả năng hồi phục hoặc không thể hồi phục của vết thương. Quá trình này không quá 14 ngày.
6.3.5.3. Phép thử tiếp xúc lặp lại
Chỉ tiến hành tiếp xúc lặp lại sau khi hoàn thành phép thử tiếp xúc cấp một lần (sau khi quan sát ít nhất 72 h).
Đối với các phép thử tiếp xúc lặp lại ghi lại biểu hiện của vị trí ứng dụng tại 1 h sau khi tháo băng và ngay trước lần ứng dụng tiếp theo. Số lần tiếp xúc có thể thay đổi.
Sau lần tiếp xúc cuối cùng, chú ý biểu hiện của mỗi vị trí ứng dụng tại 1 h, 24 h, 48 h và 72 h sau khi tháo băng. Có thể cần quan sát thêm nếu có vết thương dai dẳng để đánh giá khả năng hồi phục hay không thể hồi phục của vết thương. Quá trình này không quá 14 ngày.
6.3.6. Đánh giá kết quả
Đối với các phép thử tiếp xúc một lần xác định chỉ số kích thích cơ bản (PII) như sau.
Chỉ dùng các quan sát 24 h, 48 h và 72 h để tính toán. Các quan sát trước khi cho liều hoặc sau 72 h để điều khiển sự hồi phục không được sử dụng để xác định chỉ số.
Đối với mỗi động vật, tính tổng các điểm số kích thích cơ bản cho vật liệu thử gây ban đỏ và phù nề tại mỗi thời điểm và chia cho tổng số lần quan sát. (Một quan sát trong tình huống này bao gồm cả ban đỏ và phù nề tại mỗi vị trí thử). Khi dùng dung dịch trắng hoặc đối chứng âm tính, tính điểm số kích thích cơ bản cho đối chứng rồi trừ đi điểm số dùng vật liệu thử để nhận được điểm số kích thích cơ bản. Cộng các điểm số cho mỗi động vật rồi chia tổng này cho số lượng động vật. Giá trị này chính là chỉ số kích thích cơ bản.
Đối với tiếp xúc lặp lại, xác định chỉ số kích thích lũy tích như sau.
Đối với mỗi động vật cộng các điểm số kích thích cơ bản cho cả phù nề và ban đỏ tại mỗi thời điểm quy định. Chia tổng này cho tổng số lần quan sát để nhận được điểm số kích thích trên mỗi động vật.
Cộng tổng các điểm số kích thích của tất cả các động vật và chia cho tổng số động vật. Giá trị này là chỉ số kích thích lũy tích.
Chỉ số kích thích lũy tích được so sánh với các loại phản ứng kích thích quy định trong Bảng 2 và loại phản ứng thích hợp ghi trong báo cáo.
CHÚ THÍCH Các loại chỉ số kích thích lũy tích dựa trên số liệu liên quan đến chỉ số kích thích cơ bản (PII) đối với các hóa chất của thỏ với phản ứng kích thích cơ bản ở người đối với một số hóa chất đã được thử ở cả hai loài.
Đối với bất kỳ phản ứng nào, ghi lại điểm số kích thích cơ bản cực đại từ Bảng 1 cho mỗi động vật, thời điểm bắt đầu phản ứng và thời điểm phản ứng cực đại.
Chỉ số kích thích cơ bản hoặc lũy tích được đặc trưng bằng số (điểm số) và mô tả (loại phản ứng) trong Bảng 2. Trong trường hợp thử các chất ngâm chiết khác nhau, loại phản ứng xác định theo chất có PII cao nhất.
Bảng 2 - Loại phản ứng kích thích ở thỏ
| Điểm số trung bình | Loại phản ứng |
| 0 đến 0,4 | Không đáng kể |
| 0,5 đến 1,9 | Nhẹ |
| 2 đến 4,9 | Vừa phải |
| 5 đến 8 | Mạnh |
6.3.7. Báo cáo thử nghiệm
Báo cáo thử nghiệm bao gồm:
a) mô tả dụng cụ hoặc vật liệu thử,
b) mục đích sử dụng/ứng dụng của vật liệu hoặc dụng cụ thử,
c) mô tả chi tiết phương pháp dùng để chuẩn bị mẫu thử hoặc vật liệu thử,
d) mô tả động vật thử,
e) phương pháp đặt vào vị trí thử và loại vật liệu băng (bán thấm hay thấm),
f) vị trí được đánh dấu và tiến hành đọc kết quả như thế nào,
g) ghi lại quan sát,
h) số lần tiếp xúc và thời gian giữa các lần khi tiến hành tiếp xúc lặp lại,
i) đánh giá kết quả.
6.4. Phép thử kích thích da người
6.4.1. Giới thiệu
Hiện tại, tiên đoán kích thích da người cho mục đích xác định nguy hại dựa chủ yếu vào sử dụng động vật thực nghiệm (xem Phụ lục C). Tuy nhiên, có những vấn đề trong việc ngoại suy từ động vật cho người. Đối với các hóa chất mà con người tiếp xúc nhiều (ví dụ như mỹ phẩm và chất tẩy rửa) thì việc đánh giá rủi ro được tiến hành thường xuyên bằng cách sử dụng các phép thử băng dán da người.
Các nghiên cứu trên người có thể phục vụ cho một số mục đích sau:
a) xác định trực tiếp độc hại đối với con người bằng cách thử nghiệm các hóa chất trên người hơn là các động vật thí nghiệm;
b) đánh giá nguy cơ các hóa chất nhất định mà con người tiếp xúc nhiều;
c) tạo điều kiện thuận lợi ngoại suy đến con người bằng số liệu nhận được trước đây từ các nghiên cứu trên động vật thí nghiệm.
Tiêu chuẩn này cho phép nhận được số liệu kích thích da trực tiếp từ con người để xác định độc hại. Mục đích là để xác định liệu một vật liệu có gây ra kích thích da đáng kể sau khi tiếp xúc cấp tính hay không.
Các phép thử lâm sàng được tiến hành theo TCVN 7740-1 (ISO 14155-1) và TCVN 7740-2 (ISO 14155-2).
CHÚ THÍCH C.1 đưa ra thông tin cụ thể hơn về các phép thử kích thích.
6.4.2. Xem xét ban đầu
Thông tin thích hợp về dữ liệu độc tính của vật liệu và (khi có liên quan) cả các thành phần hóa học của vật liệu, bao gồm dữ liệu hấp thụ dưới da, phải sẵn có để chỉ ra rằng nghiên cứu không cho thấy bất kỳ rủi ro nghiêm trọng nào cho sức khỏe.
Vật liệu không được thử ở người nếu
a) gây kích thích trong một phép thử dự đoán trước, hoặc in vitro hoặc in vivo,
b) ăn mòn trong một phép thử dự đoán trước, hoặc in vitro hoặc in vivo,
c) sự ăn mòn tiềm ẩn da người có thể tiên đoán được trên cơ sở quan hệ của cấu trúc/hoạt tính và/hoặc các đặc điểm hóa lý, ví dụ dự trữ axit mạnh hoặc kiềm mạnh,
d) gây ra rủi ro quá mẫn da hoặc đường hô hấp,
e) gây ra nguy cơ độc cấp tính trong điều kiện thử, và/hoặc
f) gây ra bất kỳ nguy cơ độc di truyền, khả năng sinh sản hoặc ung thư.
Hướng dẫn cụ thể hơn về lựa chọn các tình nguyện viên có thể được tìm thấy trong 6.4.5.1 và C.1.
6.4.3. Nguyên tắc
Một liều đơn của vật liệu thử được đặt bịt chặt vào da của tình nguyện viên. Kích thích được giữ thấp nhất bằng cách đặt vật liệu thử trong thời gian ngắn. Thời gian tiếp xúc lâu hơn cũng có thể phù hợp trong các trường hợp nhất định.
Các biện pháp đánh giá chủ yếu tiến hành bằng cách xác định tỷ lệ giữa tình nguyện viên có sự phát triển kích thích da liên quan đến một phản ứng với một vật liệu đối chứng dương tính xảy ra đồng thời.
6.4.4. Mô tả phương pháp
6.4.4.1. Chọn tình nguyện viên
Tiêu chuẩn này được thiết kế dùng cho tình nguyện viên khỏe mạnh. Tình nguyện viên đã chọn phải ít nhất là 18 tuổi, không mang thai và không cho con bú. Thêm nữa, tình nguyện viên nếu có mẫn cảm với vật liệu thử trước đó hoặc cho thấy bất kỳ dấu hiệu viêm da nào phải loại khỏi cuộc thử. Chọn tình nguyện viên phải được bác sĩ chuyên khoa da liễu hoặc người có kinh nghiệm giám sát.
6.4.4.2. Chuẩn bị liều
Vật liệu thử dạng lỏng nhìn chung được sử dụng không pha loãng. Khi thử nghiệm vật liệu dạng rắn thì làm ẩm vật liệu thử bằng một lượng nước nhỏ (thường khoảng 0,2 ml) hoặc khi cần, dùng tá dược lỏng phù hợp khác để bảo đảm tiếp xúc tốt với da. Cấu trúc của vật liệu rắn phải được xem xét và phải lập luận giải thích việc lựa chọn chuẩn bị vật liệu thử. Khi dùng mẫu làm ẩm, cẩn thận bảo đảm rằng mỗi đối tượng nhận được cùng lượng vật liệu thử. Dùng cùng một lượng nước làm ẩm cho mỗi cá thể trong phép thử và ghi lại lượng đó.
Khi dùng các tá dược lỏng, ảnh hưởng của tá dược lỏng đến kích thích da bởi vật liệu thử phải được lưu tâm. Nếu dùng một tá dược lỏng không phải là nước để làm ẩm cho các hợp chất rắn, thì xem xét việc đặt băng dán với dịch lỏng trắng (tá dược đối chứng) trên mỗi đối tượng.
6.4.4.3. Quy trình
6.4.4.3.1. Số lượng tình nguyện viên
Ít nhất 30 tình nguyện viên hoàn thành phép thử, không ít hơn 1/3 số lượng tình nguyện là nam hoặc là nữ.
6.4.4.3.2. Đặt vật liệu thử
Đặt vật liệu thử vào da còn nguyên vẹn ở một vị trí thích hợp, ví dụ mặt ngoài cánh tay, bằng một khoang hút chứa một miếng gạc. Vị trí đặt phải giống nhau trong tất cả các tình nguyện viên và phải được ghi lại. Nhìn chung, miếng gạc có đường kính ít nhất là 1,8 cm, có thể đường kính 2,5 cm thích hợp hơn. Miếng gạc này được giữ tiếp xúc với da bởi mảnh băng không gây kích thích phù hợp, bao gồm dây băng không gây kích thích trong thời gian tiếp xúc.
Miếng gạc sẽ chuyển một liều thích hợp trên một đơn vị diện tích: xấp xỉ 50 mg đến 100 mg vật liệu thử trên một centimét vuông được xem là tốt nhất. Khi đặt ứng dụng vật liệu thử dạng lỏng, thường làm ẩm miếng gạc bằng 0,2 ml đến 0,4 ml dung dịch. Khi thử các vật liệu dạng rắn, thường làm ẩm và thêm 0,2 g vật liệu thử vào miếng gạc. Thay thế cho phương pháp đặt vật liệu dạng rắn, miếng gạc được làm ẩm và vật liệu thử phủ toàn bộ vị trí thử.
6.4.4.3.3. Khoảng thời gian tiếp xúc
Để tránh phản ứng mạnh không thể chấp nhận, phải thử nghiệm một cách thận trọng. Quy trình băng bó tiếp theo cho phép phát triển phản ứng kích thích dương tính nhưng không nghiêm trọng. Các miếng gạc được đặt vào liên tục bắt đầu với khoảng thời gian 15 phút và 30 phút, rồi lên đến 1 h, 2 h, 3 h và 4 h. Các giai đoạn tiếp xúc 15 phút và/hoặc 30 phút có thể bỏ, nếu có đủ chỉ dẫn rằng các phản ứng quá mức sẽ không xảy ra sau tiếp xúc 1 h. Phát triển đến tiếp xúc lâu hơn bao gồm tiếp xúc miếng đóng 24 h tại một vị trí da mới, sẽ phụ thuộc vào sự thiếu kích thích da (đánh giá lên đến ít nhất là 48 h) xuất hiện từ các tiếp xúc ngắn hơn, để đảm bảo rằng bất kỳ phản ứng kích thích chậm nào được đánh giá phù hợp.
Đặt vật liệu trong khoảng tiếp xúc dài hơn luôn được tiến hành tại một vị trí chưa được xử lý trước đây.
Cuối giai đoạn tiếp xúc, phải loại bỏ dư lượng của vật liệu thử, nơi nào có thể tiến hành được, dùng nước hoặc một dung môi thích hợp không làm thay đổi phản ứng hiện có hoặc sự nguyên vẹn của biểu bì.
6.4.4.3.4. Tiếp xúc có giới hạn
Ngoài việc tăng khoảng thời gian đặt theo pha như đã mô tả trong 6.4.4.3.3, nếu nghi ngờ vật liệu có thể gây kích thích mạnh thì nên dùng thời gian tiếp xúc giảm đáng kể, có thể trong một nhóm nhỏ tình nguyện viên. Tiến triển của nghiên cứu có thể được xác định dựa trên số liệu có được. Các miếng gạc tiếp theo chỉ được đặt vào sau thời điểm đọc 48 h/72 h.
6.4.4.3.5. Quan sát lâm sàng và cấp độ các phản ứng da
Các vị trí xử lý được kiểm tra dấu hiệu kích thích và phản ứng được cho điểm ngay sau khi bỏ miếng băng và tại 1 h đến 2 h, 24 h, 48 h và 72 h sau khi loại bỏ miếng băng. Nếu cần thiết để xác định khả năng thuận nghịch của phản ứng, giai đoạn quan sát có thể kéo dài đến sau 72 h. Ngoài ra, điều kiện của da trước và sau phép thử phải được mô tả kỹ (ví dụ, hình thành sắc tố và phạm vi hydrat hóa). Kích thích da được xác định cấp độ và ghi lại theo hệ thống cấp độ trong Bảng 3.
Có thể áp dụng các phương pháp kỹ thuật sinh học không xâm nhập (xem Phụ lục C).
Đối với các tình nguyện viên xếp loại 1 hoặc cao hơn sau khi tiếp xúc trong vòng ít hơn 4 h giả sử rằng họ sẽ có phản ứng mạnh hơn nếu tiếp xúc trong vòng 4 h với vật liệu. Khi tình nguyện viên xếp loại 1 hoặc cao hơn thì không cần cho tình nguyện viên đó tiếp xúc với vật liệu nữa. Các quan sát kỹ hơn cần tiến hành để chăm sóc tình nguyện viên theo đúng cách. Ngoài việc quan sát sự kích thích, phải ghi lại và mô tả đầy đủ các tác động khác. Ví dụ, tình nguyện viên phải được đào tạo để đưa ra ý kiến liên quan đến việc ứng dụng băng dán (ví dụ như các tác động cảm giác) và nhân viên đánh giá phải được đào tạo để chú ý các phản ứng tức thời (ví dụ như nổi mề đay) khi tháo băng. Các quan sát như vậy có thể không chỉ ra tác động kích thích, nhưng phải đưa vào báo cáo thử nghiệm nếu chú ý thấy. Nếu đáng kể, các quan sát đó phải được xem xét trong việc quản lý nghiên cứu để đảm bảo việc chăm sóc tình nguyện viên đúng cách.
Bảng 3 - Phép thử kích thích da người, thang cấp độ
| Mô tả phản ứng | Cấp độ |
| Không phản ứng | 0 |
| Phản ứng dương tính yếu (thường đặc trưng bởi ban đỏ nhẹ và/hoặc khô khắp hầu hết vị trí xử lý) | 1 |
| Phản ứng dương tính vừa (thường ban đỏ rõ ràng hoặc khô, có thể lan ra ngoài vị trí xử lý) | 2 |
| Phản ứng dương tính mạnh (mạnh và thường ban đỏ lan rộng với phù nề và/hoặc hình thành vảy) | 3 |
Số liệu quan trọng nhận được là số lượng tình nguyện viên có hoặc sẽ có kích thích da sau khi tiếp xúc đến 4 h. Thời gian cần cho một cá thể hình thành phản ứng (nếu có) không phải là một phần của kết quả được đánh giá; điều này chỉ liên quan đến việc bảo đảm chăm sóc tình nguyện viên đúng cách.
6.4.4.3.6. Cơ sở chọn lọc chất đối chứng dương đồng thời
Vì con người có những biểu hiện khác nhau trong phản ứng của họ với các chất kích thích nên phải có một đối chứng dương tính để xác định sự phù hợp của một sơ đồ thử để phát hiện tác động kích thích của hợp chất thử. Ưu tiên sử dụng natri dodecyl sulphat (SDS) 20 % như đối chứng dương vì các tác động kích thích của nó được đặc trưng rõ ràng (xem C.1). Có thể sử dụng các đối chứng khác nếu được lập luận và giải thích.
Một đối chứng dương thông thường như là một dấu làm chuẩn. Kích thích da không phải là một hiện tượng tuyệt đối. Tất cả vật liệu có thể gây ra kích thích da; đơn giản là vấn đề liều, bản chất và phạm vi tiếp xúc. Chính vì vậy, các phép thử kích thích da luôn tương đối và liên quan đến kích thích hóa học đã biết.
6.4.5. Số liệu và báo cáo
6.4.5.1. Số liệu
Số liệu bao gồm kết quả với vật liệu đối chứng dương tính và âm tính phải được tóm tắt thành dạng bảng biểu diễn loại kích thích tại 24 h, 48 h và 72 h sau khi tháo miếng gạc và bất kỳ các tác động nào quan sát thấy đối với mỗi cá thể.
6.4.5.2. Đánh giá/giải thích số liệu
Mục đích của phép thử này là để xác định liệu một vật liệu có gây ra nguy cơ kích thích da đáng kể sau khi tiếp xúc cấp hay không. Chính vì vậy, nếu vật liệu gây ra tần suất kích thích da trong các đối tượng thử tương tự hoặc cao hơn đối chứng dương tính thì vật liệu đó được xem là chất kích thích da đáng kể. Mặt khác, nếu vật liệu này gây ra tần suất kích thích da trong các đối tượng thấp hơn đáng kể so với đối chứng dương tính, thì vật liệu này có thể không được xem là chất kích thích da đáng kể. Điều quan trọng là số liệu tạm thời tạo ra trong tình huống chăm sóc tình nguyện viên không lẫn với các số liệu điểm cuối, ví dụ như tỷ lệ của đối tượng cho thấy phản ứng kích thích. Việc không để lẫn biến đổi cá thể về độ nhạy kích thích da với tiềm năng kích thích da nói chung của vật liệu thử cũng là quan trọng.
6.4.5.3. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm các thông tin sau:
a) xem xét vấn đề đạo lý và khẳng định các tình nguyện viên đều đồng thuận;
b) vật liệu thử:
- bản chất tự nhiên, và khi có liên quan, các đặc điểm lý hóa;
- số liệu xác định;
c) tá dược lỏng:
- xác định và giải thích việc lựa chọn tá dược lỏng dùng để làm ẩm vật liệu thử dạng rắn;
d) tình nguyện viên:
- số lượng tình nguyện viên đã được xử lý với vật liệu thử;
- phân bố tuổi/giới tính của tình nguyện viên;
e) kết quả:
- suất liều phản ứng tại 0 h, 1 h đến 2 h, 24 h, 48 h và 72 h và tại bất kỳ thời điểm ghi điểm số.
- trình bày thành bảng biểu số liệu phản ứng kích thích cho mỗi cá thể với mỗi giai đoạn quan sát (tóm tắt tần suất suất liều phản ứng kích thích tại 24 h, 48 h sau khi tháo miếng băng);
- mô tả các phản ứng kích thích quan sát được;
- mô tả bất kỳ tác động nào khác với kích thích quan sát được;
- xử lý thống kê kết quả (so sánh với đối chứng dương tính, ví dụ như dùng phép thử chính xác của Fisher);
- mô tả hoặc tham khảo một phép thử trên động vật in vitro hoặc in vivo nếu tiến hành như vậy trước khi tiến hành phép thử trên tình nguyện viên, bao gồm chi tiết của quy trình và kết quả nhận được cùng với vật liệu thử và tham khảo;
f) thảo luận kết quả.
7. Phép thử quá mẫn muộn
7.1. Chọn phép thử
Hai phương pháp sử dụng phổ biến nhất để thử nghiệm quá mẫn muộn là phép thử cực đại hóa chuột lang (GPMT) và phép thử miếng gạc áp sát (phép thử Buehler).
Phép thử cực đại hóa là phương pháp nhạy nhất và được ưu tiên cho các hóa chất đơn. Phép thử này cũng được thông báo là có ích để đánh giá các chất ngâm chiết. Tuy nhiên, giá trị của phương pháp thử này được trình bày thành tài liệu rõ nhất để áp dụng cho các hóa chất đơn. Gần đây, phương pháp u bạch huyết cục bộ chuột (LLNA) được chấp nhận trên trường quốc tế để thử nghiệm các hóa chất đơn như là phương pháp thay thế duy nhất cho phương pháp trên chuột lang [83].
CHÚ THÍCH Cơ sở và danh sách các phương pháp thay thế được nêu trong Phụ lục C.
7.2. Chọn nồng độ mẫu thử
7.2.1. Quy định chung
Hướng dẫn hiện hành để kiểm tra tiềm năng gây mẫn cảm của các hóa chất đơn khuyến cáo chỉ dùng một nồng độ cho cuộc thử. Tuy nhiên, kết quả thử phụ thuộc chủ yếu vào liều và nếu phép thử dùng để đánh giá một chất ngâm chiết thì đề nghị phân tích định lượng và định tính của chất ngâm chiết thử nghiệm.
7.2.2. Cảm ứng
Suất liều gây mẫn cảm phụ thuộc chủ yếu vào liều cảm ứng kích thích vừa phải. Nếu chưa đạt đến ngưỡng kích thích phải chọn nồng độ có thể cao nhất. Tuy nhiên, liều này phải không ảnh hưởng đến sức khỏe của động vật. Liều cảm ứng được lựa chọn dựa trên các thực nghiệm như được mô tả cho các phép thử cá thể. Các chất ngâm chiết không pha loãng với dung môi thường ứng dụng liều ngoài ruột không cần nghiên cứu thử.
7.2.3. Thử thách
Nồng độ thử thách cũng dựa vào các thực nghiệm trên các động vật mà trước đây không tiếp xúc với vật liệu thử. Phải dùng nồng độ dưới ngưỡng kích thích. Nên sử dụng một số nồng độ cho quy trình thử thách để tạo điều kiện thuận lợi khi đánh giá kết quả (xem C.2).
7.3. Các nhân tố quan trọng khác tác động đến kết quả thử
Các đặc điểm sinh hóa và vật lý của mẫu thử có thể ảnh hưởng đến sự lựa chọn phép thử. Vì phép thử cực đại hóa cần tiêm trong da; nếu mẫu thử không thể tiêm trong da thì phải dùng phương pháp thay thế.
Việc chọn tá dược lỏng có ảnh hưởng đến giá trị sinh học của vật liệu thử. Mặc dù không có tá dược nào là tốt nhất cho tất cả các vật liệu, một tá dược được lựa chọn tối ưu cho quá trình tiếp xúc bằng cách hòa tan và xâm nhập. Nồng độ cao nhất của vật liệu thử có thể không tác động đến giải thích kết quả. Hầu hết các nhà nghiên cứu thích mẫu thử là một dung dịch hơn vì sự phân tán thiên về hình thành cặn làm cho việc định liều khó khăn. Ví dụ về tá dược lỏng tiêm dưới da bao gồm dầu thực vật, muối, và propyleneglycol.
Dao động trong số các kết quả từ các phòng thí nghiệm khác nhau có thể có một số nguồn. Các nhân tố sau đây là quan trọng trong quy trình thử: điều kiện môi trường thử, vị trí thử trên động vật, phương pháp cạo lông (cạo/xén) hoặc làm rụng lông bằng hóa chất, kiểu thiết kế miếng gạc, số lượng vật liệu thử, chất lượng hút, thời gian tiếp xúc và đọc kết quả trên động vật. Phản ứng của động vật cũng biến đổi theo các nhân tố di truyền và chăn nuôi.
So sánh số lượng động vật thử có phản ứng dương tính khi ở liều quyết định với các đối chứng phù hợp là rất quan trọng để chỉ dẫn một kết quả thử dương tính, mặc dù độ nghiêm trọng của phản ứng sẽ hỗ trợ cho giải thích kết quả. Các phản ứng phụ ở liều quyết định được làm rõ nhất bằng cho thêm liều quyết định. Mô bệnh học được biết là không hỗ trợ cho việc đánh giá kết quả.
Để đảm bảo độ tái lập và độ nhạy của quy trình thử, các phép thử với chất gây dị ứng do tiếp xúc đã biết, ví dụ như mercaptobenzothiazol, hexyl xinamic alđehyt và benzocain phải được tiến hành đều đặn.
7.4. Phép thử cực đại hóa đối với quá mẫn muộn
7.4.1. Nguyên tắc
Phải đánh giá tiềm năng của vật liệu thử gây ra quá mẫn cho da ở chuột lang bằng kỹ thuật áp dụng cho các hóa chất đơn trong phép thử cực đại hóa trên chuột lang.
7.4.2. Chuẩn bị mẫu thử
Nếu vật liệu thử ở dạng rắn hoặc lỏng thì mẫu thử phải được chuẩn bị như quy định trong Phụ lục A. Nồng độ của mẫu thử cao nhất có thể không tác động đến giải thích kết quả (xem 7.4.4.2).
7.4.3. Động vật và nuôi dưỡng
Sử dụng chuột lang bạch tạng trưởng thành, trẻ khỏe, không phân biệt giới tính từ một chủng đơn giao phối xa nặng 300 g đến 500 g tại thời điểm bắt đầu phép thử. Nếu dùng con cái thì chúng phải chưa sinh đẻ và không mang thai.
Động vật được làm thích nghi và chăm sóc như quy định trong TCVN 7391-2 (ISO 10993-2). Các phép thử sơ bộ phải được tiến hành trên một bộ động vật để xác định nồng độ thử tối ưu (xem 7.4.4.2).
Nếu vật liệu thử dạng bột hoặc lỏng thì tối thiểu mười động vật được xử lý với mẫu thử và tối thiểu năm động vật dùng làm nhóm đối chứng. Nếu cần thử sơ bộ thì phép thử phải được tiến hành trên các động vật bổ sung.
Để thử nghiệm các chất ngâm chiết, tối thiểu mười động vật được xử lý với mẫu thử và tối thiểu năm động vật dùng làm nhóm đối chứng với dung môi. Nếu cần một phép thử sơ bộ thì phép thử này phải được tiến hành trên các động vật bổ sung.
Nếu thử nghiệm với mười động vật thử và năm động vật đối chứng cho kết quả hoàn toàn âm tính, thì không thể xảy ra trường hợp thêm mười động vật thử và năm động vật đối chứng nữa sẽ cho kết quả dương tính. Tuy nhiên, nếu xuất hiện bất kỳ phản ứng khả nghi nào thì tiến hành liều thử thách (xem 7.4.6). Nếu vẫn còn các phản ứng khả nghi thì tiến hành một nghiên cứu mới trên tối thiểu 20 động vật thử và mười động vật đối chứng.
7.4.4. Phương pháp thử
7.4.4.1. Chuẩn bị
Xén và cạo lông trên tất cả các vị trí xử lý trước tất cả các bước trong quy trình thử.
Khi tiêm trong da, tiêm 0,1 ml tại mỗi vị trí.
Đối với ứng dụng cục bộ, thấm đẫm một giấy lọc phù hợp hoặc miếng gạc thấm hút (4 cm2 đến 8 cm2) với mẫu thử rồi đặt miếng gạc vào vùng da đã bị xén lông, dưới một miếng băng hút được giữ chặt bằng một dải bao quanh thân động vật.
7.4.4.2. Phép thử sơ bộ
Các phép thử sơ bộ dùng để xác định nồng độ mẫu thử được dùng trong phép thử chính trong 7.4.4.3.
Các chất ngâm chiết không pha loãng dùng dung môi thông thường không cần thử nghiệm sơ bộ.
Cần xem xét đến xử lý trước tất cả động vật bằng cách tiêm với tá dược đầy đủ của Freund (FCA) để đánh giá khả năng của trạng thái da kích thích trong phép thử chính và chính vì vậy, làm nhiễu các thông số đọc. Đặt tại chỗ một phổ pha loãng của mẫu thử vào sườn của ít nhất ba động vật. Tháo băng hút và miếng gạc sau 24 h và đánh giá vị trí đặt đối với ban đỏ và phù nề bằng hệ thống cấp độ Magnusson và Kligman trong Bảng 4.
Đối với pha cảm ứng cục bộ trong phép thử chính, chọn nồng độ cao nhất chỉ gây ra ban đỏ nhẹ mà không tác động có hại đến động vật.
Đối với pha quyết định trong phép thử chính, chọn nồng độ cao nhất mà không gây ra ban đỏ.
Bảng 4 - Thang Magnusson và Kligman
| Phản ứng miếng gạc thử | Thang cấp độ |
| Thay đổi không nhìn thấy | 0 |
| Ban đỏ rời rạc hoặc loang lổ | 1 |
| Ban đỏ vừa phải và thành mảng | 2 |
| Ban đỏ mạnh và sưng | 3 |
7.4.4.3. Phép thử chính
7.4.4.3.1. Pha cảm ứng trong da
Tiêm hai lần 0,1 ml vào trong da mỗi động vật tại các vị trí tiêm (A, B và C) như trong Hình 2 tại vùng xương bả vai bị cạo lông.
Vị trí A: A 50:50 (tỷ lệ thể tích) nhũ tương bền của tá dược đầy đủ Freund trộn với dung môi đã chọn. Dùng muối sinh lý (BP, USP hoặc tương đương) đối với các vật liệu hòa tan trong nước.
Vị trí B: Mẫu thử (chất ngâm chiết không pha loãng); tiêm vào động vật đối chứng chỉ với dung môi.
Vị trí C: Mẫu thử tại nồng độ dùng ở vị trí B, tạo nhũ trong nhũ tương bền theo tỷ lệ thể tích 50:50 tá dược đầy đủ Freund và dung môi (50 %); tiêm động vật đối chứng với nhũ tương của dịch trắng với tá dược.
7.4.4.3.2. Pha cảm ứng cục bộ
Bảy ngày (±1 ngày) sau khi hoàn thành pha cảm ứng trong da, cung cấp mẫu thử bằng cách ứng dụng cục bộ vào vùng trong xương bả vai của mỗi động vật bằng cách sử dụng một miếng gạc có diện tích xấp xỉ 8 cm2 (giấy lọc hoặc gạc thấm hút) để phủ các vị trí tiêm trong da. Dùng nồng độ đã chọn trong 7.4.4.3.1 cho vị trí B. Nếu nồng độ tối đa có thể đạt được trong 7.4.4.3.1 không gây ra kích thích thì xử lý trước vùng đó với natri đođexyl sulfat 10 % bôi vào da 24 h ± 2 h trước khi đặt miếng gạc. Giữ chặt miếng gạc bằng một miếng băng hút. Tháo miếng băng hút và miếng gạc sau 48 h ± 2 h.
Chất ngâm chiết vừa chuẩn bị được ưu tiên hơn. Nếu một chất ngâm chiết được dự trữ lâu hơn 24 h sau đó độ ổn định của chất ngâm chiết trong điều kiện dự trữ phải được thẩm tra.
Xử lý các động vật đối chứng một cách tương tự, chỉ dùng dung dịch trắng.
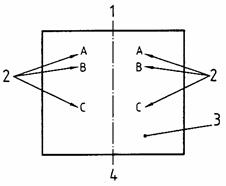
CHÚ DẪN
1 Điểm cùng sọ 3 Vùng trong xương bả vai bị cạo lông
2 Tiêm trong da 0,1 ml (xem 7.4.4.3.1) 4 Điểm cùng đuôi
Hình 2 - Định vị các vị trí tiêm trong da
7.4.4.3.3. Pha cho liều quyết định
Tại 14 ngày (±1 ngày) sau khi hoàn thành pha cảm ứng cục bộ, cho liều quyết định của mẫu thử với tất cả động vật thử và động vật đối chứng. Phân phát mẫu thử và đối chứng bằng tá dược lỏng theo phương pháp ứng dụng cục bộ vào các vị trí chưa được xử lý trong giai đoạn cảm ứng, chẳng hạn như sườn trên của mỗi động vật đặt các miếng gạc thích hợp hoặc các khoang được nhúng trong mẫu thử với nồng độ đã chọn trong 7.4.4.3.1 cho vị trí C. Các độ pha loãng của nồng độ này cũng có thể được đặt vào các vị trí chưa được xử lý khác theo cách tương tự. Giữ chặt bằng một băng hút. Tháo băng hút và miếng gạc sau 24 h ± 2 h.
7.4.5. Quan sát động vật
Quan sát vẻ bề ngoài vị trí da cho liều quyết định của động vật thử và động vật đối chứng 24 h và 48 h sau khi tháo băng. Đề nghị sử dụng ánh sáng tự nhiên hoặc đủ phổ để quan sát phản ứng da. Mô tả và cấp độ phản ứng da xuất hiện ban đỏ và phù nề theo thang Magnusson và Kligman trong Bảng 4 đối với mỗi vị trí cho liều quyết định và tại mỗi thời điểm. Tiến hành đọc kết quả mà không cần hiểu biết về xử lý để giảm thiểu thành kiến khi đánh giá kết quả.
7.4.6. Đánh giá kết quả
Cấp độ Magnussion và Kligman 1 hoặc cao hơn trong nhóm thử nhìn chung chỉ ra sự gây mẫn cảm, quy định cấp độ thấp hơn 1 được quan sát ở động vật đối chứng. Nếu cấp độ 1 hoặc cao hơn được quan sát thấy trong động vật đối chứng, thì phản ứng của động vật thử mà vượt quá phản ứng mạnh nhất trong động vật đối chứng được cho là do gây mẫn cảm. Nếu phản ứng không rõ ràng, đề nghị tiến hành tái liều quyết định để khẳng định lại kết quả từ lần cho liều quyết định đầu tiên. Kết quả của phép thử được trình bày như tần suất của kết quả cho liều quyết định dương tính ở động vật thử và động vật đối chứng.
Thông thường nhóm thử có số lượng động vật cho thấy phản ứng cao hơn nhóm đối chứng, mặc dù cường độ của phản ứng không cao hơn trong lô đối chứng. Trong những ví dụ này có thể cho liều quyết định lặp lại cần để xác định phản ứng một cách rõ ràng. Tiến hành cho liều quyết định lặp lại 1 đến 2 tuần sau lần cho liều quyết định đầu tiên. Phương pháp sử dụng phải như đã mô tả ở lần cho liều quyết định đầu tiên, sử dụng sườn bên kia của động vật.
Cần có một nhóm đối chứng xử lý FCA mới.
7.4.7. Báo cáo thử nghiệm
Báo cáo thử nghiệm bao gồm:
a) mô tả vật liệu hoặc trang thiết bị thử,
b) mục đích sử dụng/ứng dụng của mẫu thử hoặc trang thiết bị thử,
c) mô tả chi tiết phương pháp dùng để chuẩn bị mẫu hoặc trang thiết bị thử,
d) mô tả động vật thử,
e) phương pháp ứng dụng vào vị trí thử,
f) vị trí được đánh dấu và đọc như thế nào,
g) các ghi chép quan sát,
h) đánh giá kết quả.
7.5. Phép thử miếng gạc đóng cho quá mẫn muộn
7.5.1. Nguyên tắc
Đánh giá tiềm năng của vật liệu thử gây mẫn cảm cho da ở chuột lang.
7.5.2. Chuẩn bị mẫu thử
Nếu vật liệu không thể lấy theo liều thì vật liệu phải được chuẩn bị như quy định trong Phụ lục A bằng cách dùng các chất ngâm chiết phân cực và không phân cực. Khi hình dạng và kích thước cho phép thì các dụng cụ cục bộ (ví dụ điện cực) có thể nối vào.
7.5.3. Động vật và nuôi dưỡng
Sử dụng chuột lang bạch tạng trưởng thành, trẻ khỏe, không phân biệt giới tính từ một chủng đơn giao phối xa nặng 300 g đến 500 g khi bắt đầu phép thử. Nếu dùng con cái thì chúng phải chưa sinh đẻ và không mang thai.
Động vật được làm thích nghi và chăm sóc như quy định trong TCVN 7391-2 (ISO 10993-2). Các phép thử sơ bộ phải được tiến hành trên một bộ động vật để xác định các nồng độ mẫu thử tối ưu (xem 7.5.4.2).
Để thử nghiệm chất bột hoặc chất lỏng thì tối thiểu mười động vật được xử lý với vật liệu thử và tối thiểu năm động vật dùng làm nhóm đối chứng. Nếu cần phép thử sơ bộ thì phải tiến hành trên các động vật bổ sung.
Để thử nghiệm các chất ngâm chiết, tối thiểu mười động vật được xử lý với mỗi chất ngâm chiết và tối thiểu năm động vật dùng làm nhóm đối chứng với từng dung môi. Nếu cần phép thử sơ bộ thì phải tiến hành trên các động vật bổ sung.
Nếu phép thử nghiệm tiến hành với mười động vật thử nghiệm và năm đối chứng hoàn toàn là âm tính thì không thể xảy ra trường hợp thêm mười động vật thử và năm động vật đối chứng nữa sẽ cho kết quả dương tính. Tuy nhiên, nếu có bất kỳ phản ứng khả nghi nào thì nên tiến hành cho liều quyết định lặp lại (xem 7.5.6). Nếu vẫn còn các phản ứng khả nghi thì tiến hành một nghiên cứu mới trên tối thiểu 20 động vật thử và mười động vật đối chứng.
7.5.4. Quy trình thử
7.5.4.1. Chuẩn bị
Xén hoặc cạo sạch lông trên tất cả các vị trí xử lý trước tất cả các bước trong quy trình thử.
Đối với tất cả các ứng dụng cục bộ, thấm đẫm một miếng gạc (giấy lọc hoặc gạc thấm hút) có kích thước phù hợp với vật liệu thử hoặc chất ngâm chiết và đặt miếng gạc vào vùng bị xén lông, dưới một miếng băng hút trong 6 h. Kiềm chế từng động vật để đảm bảo sự thấm hút của các vị trí thử. Nếu dùng băng cuốn quanh, thì sự đầy đủ của nó phải được đánh giá trong từng phép thử.
7.5.4.2. Phép thử sơ bộ
Tiến hành phép thử sơ bộ để xác định nồng độ của mẫu thử dùng trong phép thử chính đã mô tả trong 7.5.4.3.
Trang thiết bị y tế dự định để sử dụng cục bộ và các chất ngâm chiết không pha loãng dùng các dung môi thông thường không cần thử nghiệm sơ bộ.
Ứng dụng cục bộ bốn nồng độ mẫu thử vào sườn của từng (ít nhất là ba) động vật bằng các miếng gạc thích hợp. Tháo miếng hút và miếng gạc sau 6 h. Đánh giá vị trí ứng dụng về ban đỏ và phù nề bằng thang cấp độ Magnusson và Kligman nêu trong Bảng 4 tại 24 h và 48 h sau khi tháo miếng gạc.
Chọn:
a) cho pha cảm ứng trong phép thử chính, nồng độ cao nhất đã gây ra ban đỏ nhẹ nhưng không ảnh hưởng có hại đến động vật,
b) cho pha liều quyết định trong phép thử chính, nồng độ cao nhất mà không gây ra ban đỏ.
7.5.4.3. Phép thử chính
7.5.4.3.1. Pha cảm ứng
Cung cấp mẫu thử bằng ứng dụng cục bộ vào vùng lưng trên bên trái bị xén lông của mỗi động vật bằng các miếng gạc thích hợp đã thấm mẫu thử ở các nồng độ đã chọn trong 7.5.4.2. a). Tháo vật kiềm chế, miếng băng hút và miếng gạc sau 6 h. Thực hiện quy trình này ba ngày mỗi tuần trong vòng ba tuần. Xử lý các động vật đối chứng theo cách tương tự, chỉ dùng dung dịch trắng.
7.5.4.3.2. Pha cho liều thử thách
14 ngày (±1 ngày) sau lần ứng dụng cảm ứng cuối cùng, cho liều quyết định tất cả động vật thử và đối chứng với mẫu thử. Phân phối mẫu thử bằng cách ứng dụng cục bộ một lần vào vùng đã xén lông chưa xử lý của mỗi động vật bằng miếng gạc thích hợp thấm mẫu thử ở các nồng độ đã chọn trong 7.5.4.2 b). Tháo vật kiềm chế, miếng băng hút và miếng gạc sau 6 h.
7.5.5. Quan sát động vật
Tại thời điểm 24 h ± 2 h sau lần tiếp xúc với liều quyết định cơ sở hoặc lần cho liều quyết định lặp lại, hoặc là:
a) nhổ lông tất cả động vật với loại thuốc rụng lông thương phẩm bằng cách đặt vật liệu lên vị trí thử và vùng bao quanh theo chỉ dẫn của nhà sản xuất, hoặc
b) cạo lông tất cả động vật trên vị trí cho liều quyết định và vùng bao quanh.
Rửa kỹ vùng rụng lông bằng nước ấm và làm khô động vật với khăn tắm trước khi trả chúng vào chuồng. Tối thiểu 2 h sau khi cạo lông xác định cấp độ vị trí thử theo Bảng 4. Lặp lại bước xác định cấp độ 48 h ± 2 h sau khi tháo miếng gạc quyết định. Đề nghị dùng ánh sáng tự nhiên hoặc ánh sáng đủ phổ để quan sát phản ứng da. Đề nghị tiến hành đọc kết quả mà không cần hiểu về quá trình xử lý để giảm thiểu thiên vị trong đánh giá kết quả.
7.5.6. Đánh giá kết quả
Áp dụng thang cấp độ Magnusson và Kligman trong Bảng 4.
Cấp độ 1 hoặc cao hơn trong nhóm thử nhìn chung chỉ ra sự gây mẫn cảm, nếu là cấp độ nhỏ hơn 1 quan sát được ở các động vật đối chứng. Nếu là cấp độ 1 hoặc cao hơn 1 quan sát được ở động vật đối chứng, thì phản ứng của động vật thử vượt quá phản ứng đối chứng cao nhất được cho là do gây mẫn cảm. Tiến hành cho liều quyết định lặp lại để khẳng định kết quả từ lần cho liều quyết định đầu tiên. Kết quả của phép thử được trình bày như tần suất của kết quả cho liều quyết định dương tính ở động vật thử và động vật đối chứng.
Thông thường, nhóm thử có số lượng lớn các động vật cho thấy phản ứng cao hơn nhóm đối chứng, mặc dù cường độ của phản ứng không cao hơn trong lô đối chứng. Trong những ví dụ này có thể cần cho liều quyết định lặp lại để xác định phản ứng một cách rõ ràng. Cho liều quyết định lặp lại được tiến hành 1 đến 2 tuần sau lần cho liều quyết định đầu tiên. Phương pháp sử dụng phải như đã mô tả đối với lần cho liều quyết định đầu tiên, sử dụng vùng chưa xử lý bên sườn còn lại của động vật.
Đề nghị dùng một nhóm đối chứng xử lý FCA mới.
7.5.7. Báo cáo thử nghiệm
Báo cáo thử nghiệm bao gồm:
a) mô tả vật liệu thử hoặc trang thiết bị thử,
b) mục đích sử dụng/ứng dụng của vật liệu thử hoặc trang thiết bị thử,
c) mô tả chi tiết phương pháp dùng để chuẩn bị mẫu thử hoặc vật liệu thử,
d) mô tả động vật thử,
e) phương pháp ứng dụng vào vị trí thử,
f) vị trí được đánh dấu và đọc như thế nào,
g) các ghi chép quan sát,
h) đánh giá kết quả, bao gồm các phương pháp thống kê.
8. Các nhân tố quan trọng để giải thích kết quả thử
Các phép thử trong tiêu chuẩn này là các công cụ quan trọng để phát triển các sản phẩm an toàn, miễn là các phép thử này do nhân viên được đào tạo thực hiện và giải thích.
Bằng chứng của quá mẫn tiếp xúc chậm bởi bất kỳ phương pháp nào không hẳn loại trừ việc sử dụng vật liệu thử hoặc trang thiết bị, bởi vì số lượng vật liệu thử trong quy trình thử có thể bị phóng đại so với điều kiện sử dụng thông thường. Phát hiện bất lợi dùng bất kỳ các quá trình được đánh giá chỉ ra sự cần thiết phải phân tích kỹ đã cho phép đánh giá rủi ro khi tiếp xúc với con người.
Các kết quả phép thử dự đoán do các quy trình đã mô tả trong tiêu chuẩn này tạo ra không thể đứng một mình. Một kết quả phép thử âm tính không phải luôn luôn loại đi khả năng sản phẩm có thể gây ra các phản ứng dị ứng cho da. Cả kết quả phép thử dương tính hoặc âm tính trong bất kỳ phương pháp thử nào phải được nghiên cứu cẩn thận bởi các nghiên cứu kỹ lưỡng tiếp theo để giảm thiểu các kết quả dương tính hoặc âm tính giả. Các kết quả phải được đánh giá hiệu lực bằng cách so sánh với các nguồn thông tin khác như:
a) số liệu công nghiệp và số liệu phàn nàn của người tiêu dùng;
b) kinh nghiệm với trang thiết bị có cùng thành phần;
c) kết quả thử chẩn đoán trong các phòng khám da liễu;
d) số liệu dịch tễ học đã có trước đây.
Phụ lục A
(quy định)
Chuẩn bị vật liệu thử nghiệm kích thích/gây mẫn cảm
A.1. Quy định chung
Tiến hành phép thử và giải thích số liệu từ các phép thử kích thích/gây mẫn cảm phải lưu ý đến bản chất, mức độ, tần suất, khoảng thời gian và điều kiện tiếp xúc của trang thiết bị y tế với người. Một trong số các thông số quan trọng với các phép thử này là việc chuẩn bị vật liệu thử.
A.2. Vật liệu tiếp xúc trực tiếp
A.2.1. Vật liệu thử dạng rắn
Vật liệu rắn có trạng thái vật lý thích hợp (ví dụ tấm, màng) được thí nghiệm thì không cần phải thay đổi. Chuẩn bị mẫu 2,5 cm x 2,5 cm và độ dày xấp xỉ kích thước sử dụng bình thường nhưng không lớn hơn 0,5 cm. Chuẩn bị mẫu đối chứng âm tính phù hợp theo cùng cách này. Đối chứng âm tính phải giống hệt với vật liệu thử về mặt vật lý và không phải là chất kích thích. Gạc thấm hút có thể dùng làm đối chứng thay thế nếu không thể xác định được đối chứng phù hợp hơn.
Vật liệu rắn có thể được tán thành bột, nên chú ý đảm bảo không làm nhiễm bẩn trong quá trình này, được làm ẩm với nước hoặc dung môi phù hợp không gây kích thích để đảm bảo tiếp xúc tốt với mô. Trong trường hợp sứ, cần tán nhỏ, nên nhớ rằng các đặc điểm hóa lý của sứ có thể bị biến đổi do tán sứ thành bột với các ảnh hưởng đáng kể đến hoạt tính sinh học.
Bột (ví dụ chất siêu thấm) phải được thử bằng lắng đọng trực tiếp hoặc tạo dạng nhão trong một dung môi thích hợp. Đối chứng dùng cùng một dung môi phải được đánh giá cùng với vật liệu thử đã làm ẩm, pha loãng hoặc làm lơ lửng.
CHÚ THÍCH: Diện tích bề mặt và/hoặc cỡ hạt là các nhân tố quan trọng trong các phản ứng sinh học, ví dụ như sự thực bào đóng vai trò quan trọng trong các phản ứng miễn dịch và viêm nhiễm.
A.2.2. Vật liệu thử dạng lỏng
Các chất lỏng phải được thử không pha loãng bằng lắng đọng trực tiếp, hoặc nếu thấy không thực tế, pha loãng với một dung môi thích hợp. Đối chứng dùng cùng dung môi phải được đánh giá cùng chất lỏng thử được pha loãng.
A.3. Chất ngâm chiết của vật liệu thử
Một chất rắn có thể được thử bằng cách chuẩn bị chất ngâm chiết từ chất rắn đó. Nếu thử chất ngâm chiết, chúng phải được chuẩn bị như đã mô tả trong TCVN 7391-12 (ISO 10993-12) sử dụng các dung môi phân cực, không phân cực và/hoặc bổ sung khi phù hợp. Phải thuyết minh đầy đủ về phương pháp ngâm chiết.
Đánh giá một mẫu trắng dùng dung môi ngâm chiết đồng thời với chất ngâm chiết của vật liệu thử.
A.4. Dung môi
Nếu vật liệu thử được ngâm chiết, pha loãng, tạo huyền phù hoặc làm ẩm thì phải dùng một dung môi phù hợp không gây kích thích. TCVN 7391-12 (ISO 10993-12) cung cấp danh sách các dung môi thích hợp.
A.5. Vật liệu thử vô trùng
Nếu sản phẩm thành phẩm được cung cấp trong điều kiện vô trùng thì vật liệu thử phải được tiệt trùng theo cùng quá trình trước khi thử nghiệm. Các sản phẩm tiệt trùng bằng etylen ôxit cho thấy khó khăn kỹ thuật ở chỗ etylen ôxit và các sản phẩm phản ứng của chúng có thể gây ra phản ứng sinh học trong các phép thử mô tả trong tiêu chuẩn này.
Để có thể phân biệt được các ảnh hưởng gây ra bởi vật liệu thử và những ảnh hưởng gây ra bởi dư lượng etylen ôxit khi quan sát một phản ứng kích thích, xem xét phải nêu ra các đánh giá phản ứng này với dụng cụ trước và sau khi tiệt trùng bằng etylen ôxit.
Phụ lục B
(quy định)
Phép thử kích thích đặc biệt
B.1. Quy định chung
Các phép thử kích thích đặc biệt sau đây tồn tại. Các phép thử này liên quan đến các trang thiết bị y tế dùng để ứng dụng vào các vùng đặc biệt. Nếu sử dụng phải giải thích cơ sở lựa chọn phương pháp thử.
B.2. Phép thử phản ứng trong da
B.2.1. Nguyên tắc
Phải đánh giá được tiềm năng vật liệu thử gây ra kích thích sau khi tiêm vào da chất ngâm chiết của vật liệu.
B.2.2. Loại trừ khỏi phép thử
Bất kỳ vật liệu nào cho thấy kích thích da, mắt hoặc niêm mạc, hoặc vật liệu có pH ≤ 2 hoặc ≥ 11,5 không được thử vào da.
B.2.3. Mẫu thử
Mẫu thử phải là một chất ngâm chiết được chuẩn bị theo Phụ lục A. Vì có nhiều vị trí thử trên mỗi động vật, nên có thể ứng dụng vài mẫu thử cùng với các đối chứng âm tính thích hợp hoặc dung dịch trắng.
B.2.4. Động vật và nuôi dưỡng
Sử dụng thỏ bạch, trưởng thành, khỏe, không phân biệt giới tính từ một chủng đơn, cân nặng không quá 2 kg. Động vật phải được làm cho thích nghi và chăm sóc như quy định trong TCVN 7391-2 (ISO 10993-2). Tối thiểu là hai động vật được dùng ban đầu để đánh giá vật liệu thử. Nếu phản ứng trong phép thử ban đầu có nghi ngờ hoặc không rõ ràng phải xem xét đến phép thử bổ sung.
B.2.5. Quy trình thử
Trong vòng 4 h đến 8 h trước khi tiến hành thử nghiệm xén hết lông trên lưng của động vật, khoảng cách đủ trên cả hai phía của xương sống để tiêm chất ngâm chiết.
Tiêm trong da 0,2 ml chất ngâm chiết nhận được với dung môi phân cực tại năm vị trí trên một phía của mỗi con thỏ (xem Hình B.1). Dùng kim nhỏ nhất phù hợp với độ nhớt của vật liệu thử để tiêm vào da.
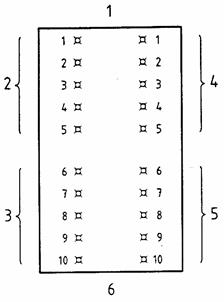
CHÚ DẪN
| 1 Điểm cùng sọ | 4 Tiêm 0,2 ml chất ngâm chiết không phân cực |
| 2 Tiêm 0,2 ml chất ngâm chiết phân cực | 5 Tiêm 0,2 ml đối chứng dung môi không phân cực |
| 3 Tiêm 0,2 ml đối chứng dung môi phân cực | 6 Điểm cùng đuôi |
Hình B.1 - Sắp xếp các vị trí tiêm
Tương tự, tiêm 0,2 ml của đối chứng dung môi phân cực tại năm vị trí từ phía sau trên cùng mặt của mỗi con thỏ (xem Hình B.1).
Lặp lại các quy trình trên cho chất ngâm chiết nhận được cùng dung môi không phân cực và đối chứng dung môi không phân cực trên phía còn lại của mỗi con thỏ (xem Hình B.1).
Nếu dùng các dung môi khác, lặp lại các bước trên với chất ngâm chiết nhận được cùng các dung môi khác và đối chứng dung môi.
B.2.6. Quan sát động vật
Chú ý vẻ bề ngoài của mỗi vị trí tiêm ngay sau khi tiêm và tại các thời điểm 24 h, 48 h và 72 h sau khi tiêm.
Cấp độ phản ứng mô cho ban đỏ và phù nề theo hệ thống nêu trong Bảng B.1 đối với mỗi vị trí tiêm và tại mỗi thời điểm quan sát rồi ghi lại kết quả.
CHÚ THÍCH Tiêm dầu vào dưới da thường gây ra phản ứng viêm nhiễm.
Tiêm vào tĩnh mạch một chất nhuộm sống thích hợp, ví dụ như xanh Trypan hoặc xanh Evans có thể tiến hành tại thời điểm đọc 72 h để giúp đánh giá phản ứng bằng cách mô tả vùng kích thích.
Các kỹ thuật không xâm nhập có thể được sử dụng để trợ giúp đánh giá nếu các kỹ thuật này có sẵn.
B.2.7. Đánh giá kết quả
Sau khi xác định cấp độ 72 h, tất cả các cấp độ ban đỏ và các cấp độ phù nề được cộng lại riêng biệt cho mỗi mẫu thử và tá dược trắng. Chia mỗi tổng này cho 12 (2 động vật x 3 giai đoạn xác định cấp độ x 2 loại cấp độ) để xác định điểm số trung bình chung cho mỗi mẫu thử với mỗi tá dược trắng tương ứng. Các yêu cầu của cuộc thử được đáp ứng nếu chênh lệch giữa điểm số trung bình mẫu thử và điểm số trung bình tá dược trắng bằng 1,0 hoặc nhỏ hơn. Nếu tại bất kỳ thời điểm quan sát phản ứng trung bình với mẫu thử lớn hơn đáng nghi ngờ so với phản ứng trung bình với tá dược trắng thì lặp lại cuộc thử bằng cách dùng thêm ba con thỏ nữa. Yêu cầu của cuộc thử được đáp ứng nếu chênh lệch giữa điểm số trung bình mẫu thử và tá dược trắng bằng 1,0 hoặc nhỏ hơn.
Bảng B.1 - Hệ thống cấp độ cho phản ứng trong da
| Phản ứng | Cấp độ |
| Ban đỏ và hình thành vảy |
|
| Không ban đỏ | 0 |
| Ban đỏ rất nhẹ (vừa đủ cảm nhận) | 1 |
| Ban đỏ rõ | 2 |
| Ban đỏ vừa phải | 3 |
| Ban đỏ mạnh (như củ cải đỏ) đến đóng vảy cản trở sự phân cấp độ ban đỏ | 4 |
| Hình thành phù nề |
|
| Không phù nề | 0 |
| Phù nề rất nhẹ (vừa đủ cảm nhận) | 1 |
| Phù nề rõ (bờ của vùng nổi lên rõ) | 2 |
| Phù nề vừa phải (nhô lên khoảng 1 mm) | 3 |
| Phù nề mạnh (nhô lên hơn 1 mm và phát triển xa vùng tiếp cận) | 4 |
| Tổng điểm số kích thích có thể | 8 |
| Các thay đổi có hại khác tại vị trí tiêm phải được ghi lại và báo cáo. | |
B.2.8. Báo cáo thử nghiệm
Báo cáo thử nghiệm bao gồm:
a) mô tả vật liệu thử hoặc trang thiết bị thử,
b) mục đích sử dụng/ứng dụng của trang thiết bị thử hoặc vật liệu thử,
c) mô tả chi tiết phương pháp dùng để chuẩn bị mẫu thử,
d) mô tả động vật thử,
e) phương pháp tiêm,
f) vị trí được đánh dấu và đọc như thế nào,
g) ghi lại các quan sát,
h) đánh giá kết quả.
B.3. Phép thử kích thích mắt
B.3.1. Quy định chung
Phép thử kích thích mắt chỉ được xem xét nếu không nhận được số liệu an toàn bằng các phương tiện khác và chỉ đối với các vật liệu sẽ tiếp xúc với mắt hay mí mắt.
CHÚ THÍCH Các hệ thống thử nghiệm in vitro được phát triển, khi đánh giá hiệu lực, có thể dùng ở vị trí phép thử kích thích mắt in vivo này.
B.3.2. Nguyên tắc
Phải đánh giá được tiềm năng vật liệu thử gây ra kích thích mắt.
B.3.3. Loại bỏ khỏi phép thử
Vật liệu và/hoặc các sản phẩm thành phẩm đã chứng minh rõ ràng là ăn mòn hoặc kích thích mạnh trong nghiên cứu da liễu không được cho kích thích mắt. Bất kỳ vật liệu nào cho thấy kích thích da hoặc vật liệu có pH ≤ 2 hoặc ≥ 11,5 không được thử và phải đánh dấu là chất kích thích mắt tiềm ẩn.
B.3.4. Vật liệu thử
Nếu vật liệu thử là chất lỏng, nhỏ giọt 0,1 ml dịch không pha loãng vào bao màng kết dưới của một mắt.
Nếu vật liệu thử là sản phẩm rắn hoặc hạt, nghiền nó thành bột mịn. Khi nén nhẹ, nhỏ giọt một lượng có thể tích 0,1 ml và không nặng hơn 100 mg vào màng kết dưới của một bên mắt.
CHÚ THÍCH Một số sản phẩm có thể không dễ dùng thử trực tiếp vào mắt. Phá hủy cơ học có thể làm cho phép thử trở lên vô dụng.
Nếu vật liệu thử chứa trong bình xịt bơm, bơm ra và nhỏ giọt 0,1 ml như áp dụng với chất lỏng.
Nếu vật liệu thử chứa trong hộp phun, kiểm tra bằng cách:
a) phun thành bụi một lần trong vòng 1 giây ở khoảng cách 10 cm trực tiếp vào mắt mở hoặc
b) cho bình phun vào một hộp chứa nguội rồi xử lý như áp dụng với chất lỏng.
Nếu vật liệu thử chỉ có thể áp dụng như chất ngâm chiết thì chuẩn bị chất ngâm chiết như mô tả trong Phụ lục A. Nhỏ giọt 0,1 ml dịch ngâm chiết vào bao màng kết dưới của một bên mắt.
Trong điều kiện giống với những gì đã sử dụng ở trên, chuẩn bị một dung dịch trắng dùng cả dung môi có cực và không cực, không có vật liệu thử.
B.3.5. Động vật và nuôi dưỡng
Sử dụng thỏ bạch trưởng thành, khỏe, không phân biệt giới tính từ một chủng đơn, nặng 2 kg đến 3 kg.
Động vật phải được làm thích nghi và chăm sóc như quy định trong TCVN 7391-2 (ISO 10993-2).
Một động vật ban đầu được dùng để đánh giá vật liệu thử. Nếu không có phản ứng thì phép thử ban đầu có thể được tiến hành sử dụng ba động vật.
Một phản ứng dương tính rõ ràng (xem Bảng B.2) trong một động vật thì không cần thử nghiệm bổ sung.
Nếu không quan sát thấy một phản ứng rõ ràng cho các vật liệu dạng rắn hoặc lỏng, thì sử dụng tối thiểu hai động vật nữa. Đối với chất ngâm chiết, sử dụng tối thiểu hai động vật nữa cho một chất ngâm chiết.
Nếu phản ứng trong cuộc thử sử dụng tối thiểu ba động vật mà vẫn nghi ngờ và không rõ thì phải xem xét đến thử nghiệm bổ sung.
B.3.6. Quy trình thử
Không quá 24 h trước khi bắt đầu phép thử, kiểm tra bằng mắt thường cả hai mắt của thỏ để xem bằng chứng khác thường của mắt. Nếu mắt cho thấy biểu hiện khác thường phải thay thế thỏ.
Khi kiểm tra mắt, có thể dùng natri fluorescein 2 % BP (Dược điển Vương quốc Anh) để nhận ra bất kỳ hư hại nào của giác mạc. Nên dùng kính soi đáy mắt, đèn soi cầm tay hoặc dụng cụ phù hợp khác.
Nhỏ giọt mẫu thử vào một bên mắt như quy định trong B.3.4.
Sau khi nhỏ giọt, giữ hai mí mắt với nhau trong khoảng 1 giây.
Mắt đối bên của mỗi động vật đóng vai trò như đối chứng và được xử lý với dung dịch trắng khi thử chất ngâm chiết.
Nếu tiếp xúc lặp lại với vật liệu được dự đoán trước và vật liệu thử không cho thấy phản ứng có ý nghĩa trong phép thử cấp, có thể tiến hành nghiên cứu tiếp xúc lặp lại. Tiếp xúc lặp lại chỉ được tiến hành sau khi hoàn thành phép thử tiếp xúc cấp (sau ít nhất 72 h). Khoảng thời gian tiếp xúc nên tương đồng với thời gian sử dụng vật liệu/trang thiết bị thử trong điều kiện lâm sàng.
B.3.7. Quan sát động vật
Đối với các động vật nhận được một lần nhỏ giọt vật liệu thử, kiểm tra cả hai mắt của mỗi động vật khoảng 1 h, 24 h, 48 h và 72 h sau khi nhỏ giọt.
Có thể cần quan sát thêm nếu có chấn thương dai dẳng để xác định tiến triển của vết thương hoặc tính thuận nghịch của chúng; quá trình này không cần vượt quá 21 ngày. Quan sát kéo dài không thể được xác minh đối với các động vật bị chấn thương nghiêm trọng.
CHÚ THÍCH Các hướng dẫn của Tổ chức Thuốc và Thực phẩm Hoa Kỳ về phép thử kính tiếp xúc cần 21 ngày tiếp xúc trong vòng 8 h mỗi ngày. Đây là ngoại lệ với hướng dẫn này.
Định cấp độ và ghi lại bất kỳ phản ứng đã quan sát theo thang cấp độ chấn thương mắt nêu trong Bảng B.2.
Đối với các động vật được nhỏ nhiều giọt vật liệu thử, phải kiểm tra cả hai mắt của mỗi động vật ngay trước khi và khoảng 1 h sau mỗi lần tra.
Nếu có bằng chứng về kích thích sau lần xử lý cuối cùng, có thể mở rộng quan sát. Có thể cần mở rộng quan sát nếu có sự liên quan của giác mạc dai dẳng hoặc kích thích mắt khác để xác định sự tiến triển của vết thương và tính thuận nghịch của chúng.
Định cấp độ và ghi lại bất kỳ phản ứng nào quan sát theo Bảng B.2.
Rút ngay động vật khỏi nghiên cứu rồi gây chết động vật một cách nhân đạo, nếu bất kỳ khi nào động vật này cho thấy:
a) phá hủy mắt rất nghiêm trọng (ví dụ như bong và loét kết mạc, thủng giác mạc, có máu hoặc mủ trong khoang trước); hoặc
b) vết máu hoặc chảy mủ; hoặc
c) loét giác mạc nghiêm trọng.
Rút ngay khỏi nghiên cứu bất kỳ động vật nào cho thấy ảnh hưởng tối đa trên hệ thống cấp độ trong Bảng B.2, ví dụ như:
- thiếu phản xạ nhẹ (phản ứng mống mắt cấp độ 2) hoặc đục giác mạc (cấp độ 4) không có bằng chứng hồi phục trong vòng 24 h hoặc
- nhiễm trùng tối đa kết mạc (phù kết mạc cấp độ 4 cùng mắt đỏ cấp độ 3) không có bằng chứng hồi phục trong vòng 48 h,
rồi gây chết động vật một cách nhân đạo.
B.3.8. Đánh giá kết quả
Khác nhau giữa mắt thử và mắt đối chứng phải được đặc trưng và giải thích dưới dạng hệ thống cấp độ nêu trong Bảng B.2.
a) Tiếp xúc cấp tính
Nếu mắt bị xử lý trong nhiều hơn một động vật cho thấy kết quả dương tính (các cấp độ được chú thích ở cuối Bảng B.2) tại bất kỳ quan sát nào, sau đó vật liệu được xem là một chất gây kích thích mắt và không cần thử nghiệm tiếp.
Nếu chỉ một trong số ba mắt bị xử lý cho thấy phản ứng trung bình hoặc nhẹ hoặc phản ứng nghi ngờ, thì xử lý thêm động vật nữa.
Khi xử lý thêm động vật, vật liệu thử bị xem là chất gây kích thích mắt nếu hơn nửa số mắt xử lý trong nhóm thử cho thấy kết quả dương tính (chú thích ở cuối Bảng B.2) tại bất kỳ giai đoạn quan sát nào.
Một phản ứng mạnh xảy ra trong duy nhất một động vật được xem là đủ để đánh dấu vật liệu này là chất gây kích thích mắt.
b) Tiếp xúc lặp lại
Vật liệu thử được xem là một chất gây kích thích mắt nếu hơn nửa số động vật trong nhóm thử cho kết quả dương tính (được chú thích ở phần cuối Bảng B.2) tại bất kỳ giai đoạn quan sát nào.
B.3.9. Báo cáo thử nghiệm
Báo cáo thử nghiệm bao gồm:
a) mô tả mẫu thử,
b) mục đích sử dụng/ứng dụng của mẫu thử,
c) mô tả chi tiết phương pháp dùng để chuẩn bị mẫu thử,
d) mô tả động vật thử,
e) phương pháp nhỏ giọt,
f) thực hiện việc đọc như thế nào,
g) ghi chép các quan sát,
h) đánh giá kết quả.
Bảng B.2 - Hệ thống cấp độ chấn thương mắt
| Phản ứng | Cấp độ |
| 1. Giác mạc Mức độ đục (vùng dày đặc nhất) Không đục Vùng rải rác hoặc khuếch tán, chi tiết của mống mắt có thể nhìn rõ Vùng mờ có thể thấy rõ, chi tiết của mống mắt không rõ Vùng trắng đục, không nhìn thấy chi tiết mống mắt, cỡ của đồng tử chỉ lờ mờ Mờ đục, không nhìn thấy chi tiết mống mắt
Vùng giác mạc liên quan 1/4 (hoặc thấp hơn), không phải là 0 Lớn hơn 1/4 nhưng nhỏ hơn 1/2 Lớn hơn 1/2 nhưng nhỏ hơn 3/4 Lớn hơn 3/4 đến toàn bộ vùng
2. Mống mắt Bình thường Các nếp vượt quá bình thường, sưng nề, sung huyết quanh giác mạc (bất kỳ hoặc tất cả hoặc kết hợp các yếu tố này) phản ứng tĩnh của mống mắt với ánh sáng (phản ứng chậm chạp là dương tính) Không phản ứng với ánh sáng, xuất huyết, hư hỏng toàn bộ (bất kỳ hoặc toàn bộ các yếu tố này)
3. Kết mạc Đỏ (đề cập đến màng kết mạc mi và kết mạc nhãn cầu không tính đến giác mạc và mống mắt) Mạch bình thường Mạch sung huyết quá mức bình thường Mạch đơn đỏ thẫm lan tỏa hơn không dễ thấy Đỏ thẫm lan tỏa
Phù kết mạc Không sưng Sưng trên mức bình thường (gồm cả màng chớp mắt) Sưng rõ ràng với sự lộn từng phần của mí mắt Sưng mí mắt khoảng đóng 1/2 Sưng mí mắt khoảng đóng 1/2 đến đóng hoàn toàn
Chảy mủ Không chảy mủ Bất kỳ lượng nào khác so với bình thường (không bao gồm một lượng nhỏ quan sát thấy trong khóe mắt trong của động vật bình thường) Chảy mủ với làm ẩm mí mắt và lông mí Chảy mủ làm ẩm mí mắt và lông mi và vùng đáng kể quanh mắt |
0 1a 2 a 3 a 4 a
0 1 2 3
0 1a
2a
1 2a 3a
0 1 2a 3a 4a
1
3 |
| a Kết quả dương tính. |
|
B.4. Phép thử kích thích niêm mạc miệng
B.4.1. Quy định chung
Phép thử kích thích miệng chỉ được xem xét cho vật liệu dự định tiếp xúc với mô miệng và nếu các số liệu an toàn không thể nhận được bằng các phương tiện khác.
B.4.2. Nguyên tắc
Phải đánh giá được tiềm năng vật liệu thử gây ra kích thích mô miệng.
B.4.3. Loại bỏ khỏi phép thử
Bất kỳ vật liệu nào cho thấy kích thích da hoặc mắt hoặc vật liệu có độ pH ≤ 2 hoặc ≥ 11,5 không được thử và được đánh dấu là chất kích thích mô miệng tiềm ẩn.
B.4.4. Vật liệu thử
Chuẩn bị vật liệu thử theo Phụ lục A.
B.4.5. Động vật và nuôi dưỡng
Sử dụng chuột đồng Syrian trưởng thành, trẻ khỏe, không phân biệt giới tính từ một chủng giao phối xa đơn. Động vật phải được làm thích nghi và chăm sóc như quy định trong TCVN 7391-2 (ISO 10993-2).
Ngoài các vấn đề nêu trên, khi thích hợp, lắp vào mỗi động vật một vòng đai phù hợp có độ rộng từ 3 mm đến 4 mm, đặt quanh cổ sao cho động vật có thể ăn uống và hô hấp bình thường nhưng ngăn cản cục bông tuột khỏi động vật. Cân mỗi động vật hàng ngày trong bảy ngày suốt thời kỳ thử. Kiểm tra bất kỳ động vật nào cho thấy suy giảm khối lượng cơ thể trong giai đoạn này và điều chỉnh vòng đai của nó, nếu cần. Nếu động vật tiếp tục bị giảm khối lượng, loại động vật đó khỏi cuộc thử.
Tối thiểu ba động vật phải được dùng ban đầu để đánh giá vật liệu thử.
CHÚ THÍCH Dùng thêm động vật xử lý với vật liệu đối chứng âm tính hoặc dung dịch trắng có thể xem xét.
Nếu phản ứng trong phép thử ban đầu có nghi ngờ hoặc không rõ ràng, cần phải xem xét đến phép thử bổ sung.
B.4.6. Quy trình thử
Tháo vòng đai khỏi mỗi động vật và lộn các túi má ra. Rửa túi bằng dung dịch muối sinh lý và kiểm tra xem có gì khác thường không.
Đối với vật liệu thử dạng rắn, đặt một mẫu (đường kính không lớn hơn 5 mm) trực tiếp vào túi má.
Đối với vật liệu thử dạng lỏng hoặc mẫu ngâm chiết, nhúng một cục bông trong mẫu, ghi lại thể tích hấp thụ và đặt cục bông vào trong túi của mỗi động vật. Thay thế, một thể tích phù hợp của mẫu có thể được dội vào trong túi má.
Không đặt mẫu trong túi má còn lại để làm đối chứng. Các động vật đối chứng phù hợp phải được thử song song.
Khi cần, đặt lại vòng đai và trả động vật trở lại chuồng.
Khoảng thời gian tiếp xúc nên là khoảng thời gian sử dụng thực tế của vật liệu, nhưng không ngắn hơn 5 phút.
Sau khi tiếp xúc, tháo vòng đai và cục bông rồi rửa túi má bằng muối sinh lý chú ý không làm nhiễm bẩn bao còn lại.
Đối với tiếp xúc cấp tính, lặp lại quy trình trên hàng giờ trong vòng 4 h.
Đối với các phép thử tiếp xúc lặp lại, dựa vào số lần ứng dụng, khoảng thời gian và khoảng cách thời gian tiếp xúc được dự đoán trước trong điều kiện lâm sàng.
B.4.7. Quan sát động vật
Kiểm tra các túi má bằng mắt sau khi bỏ cục bông và, nếu cần các ứng dụng lặp lại, ngay trước khi định liều tiếp theo.
Mô tả vẻ bên ngoài của túi má cho mỗi động vật và cấp độ phản ứng bề mặt bao cho ban đỏ theo hệ thống nêu trong Bảng B.3 đối với mỗi động vật tại mỗi khoảng thời gian. Ghi lại kết quả để báo cáo phép thử.
Tại thời điểm 24 h sau lần xử lý cuối cùng, kiểm tra các túi má bằng mắt, và gây chết nhân đạo chuột đồng và lấy mẫu mô từ vùng đại diện của các túi. Đặt mẫu mô vào thuốc cố định thích hợp trước khi xử lý để kiểm tra mô học.
Bảng B.3 - Hệ thống cấp độ cho phản ứng miệng và dương vật
| Phản ứng | Cấp độ |
| Ban đỏ và hình thành vảy Không ban đỏ Ban đỏ rất nhẹ (đủ để cảm nhận) Ban đỏ rõ Ban đỏ vừa phải Ban đỏ mạnh (củ cải đỏ) đến đóng vảy cản trở việc xác định cấp độ ban đỏ |
0 1 2 3 4 |
| Các thay đổi có hại khác của mô phải được ghi lại và báo cáo. | |
B.4.8. Đánh giá kết quả
B.4.8.1. Đánh giá đại thể
So sánh túi má xử lý với túi má trên mặt đối bên và nếu có nhóm đối chứng thì so sánh với túi của động vật trong nhóm đối chứng.
Các cấp độ (Bảng B.3) đối với mỗi quan sát được gộp vào và tổng được chia cho số lần quan sát để xác định cấp độ trung bình trên mỗi động vật.
CHÚ THÍCH 1 Các quan sát này có thể trợ giúp trong đánh giá mô học.
CHÚ THÍCH 2 Các quan sát ban đầu tiến hành trước lần ứng dụng đầu tiên của vật liệu thử không được gộp vào giá trị trung bình của cấp độ.
B.4.8.2. Đánh giá vi thể
Các tác động kích thích trên mô miệng phải được đánh giá vi thể bởi một nhà mô bệnh học. Nhà mô bệnh học có thể xác định cấp độ mỗi mô theo hệ thống trình bày trong Bảng B.4.
Các cấp độ đánh giá vi thể cho tất cả động vật trong nhóm thử được gộp lại và tổng này được chia cho số lần quan sát để nhận được giá trị trung bình nhóm thử. Lặp lại đối với nhóm đối chứng. Điểm số lớn nhất là 16.
Tổng điểm số lớn hơn chín cho đánh giá vi thể trong túi má đối chứng có thể chỉ ra bệnh học cơ bản hoặc trong một động vật đối chứng, giá trị này có thể chỉ ra chấn thương khi định liều. Cả hai tình huống này đều phải tiến hành phép thử lại, nếu động vật thử còn lại hoặc động vật đối chứng cho thấy điểm số cao tương đương.
Trừ giá trị trung bình nhóm đối chứng cho giá trị trung bình nhóm thử để nhận được chỉ số kích thích (xem Bảng B.5).
Đối với các phép thử tiếp xúc lặp lại, Bảng B.4 có thể cần được biến đổi để điều tiết phản ứng mô bổ sung liên quan tới kích thích kinh niên.
B.4.9. Báo cáo thử nghiệm
Báo cáo thử nghiệm bao gồm:
a) mô tả mẫu thử,
b) mục đích sử dụng/ứng dụng của mẫu thử,
c) mô tả chi tiết phương pháp dùng để chuẩn bị mẫu thử,
d) mô tả động vật thử,
e) phương pháp ứng dụng,
f) tiến hành đọc vị trí như thế nào,
g) ghi chép các quan sát,
h) đánh giá mô học,
i) đánh giá kết quả.
Bảng B.4 - Hệ thống cấp độ kiểm tra vi mô cho phản ứng mô miệng, dương vật, trực tràng, và âm đạo
| Phản ứng | Cấp độ |
| 1. Biểu mô Bình thường, còn nguyên Thoái hóa hoặc làm dẹt tế bào Dị sản Trợt điểm Trợt lan rộng
2. Sự thâm nhiễm bạch cầu (trên vi trường có độ phóng đại lớn) Không có Tối thiểu (ít hơn 25) Nhẹ (26 đến 50) Vừa phải (51 đến 100) Rõ rệt (hơn 100)
3. Sung huyết Không có Tối thiểu Nhẹ Vừa phải Rõ rệt, với phá hủy mạch
4. Phù nề Không có Tối thiểu Nhẹ Vừa phải Rõ rệt |
0 1 2 3 4
0 1 2 3 4
0 1 2 3 4
0 1 2 3 4 |
Bảng B.5 - Chỉ số kích thích
| Chỉ số kích thích | |
| Cấp độ trung bình | Mô tả phản ứng |
| 0 1 đến 4 5 đến 8 9 đến 11 12 đến 16 | Không Tối thiểu Nhẹ Vừa phải Mạnh |
| Những thay đổi có hại khác của mô phải được ghi lại và gộp vào đánh giá phản ứng. Hệ thống cấp độ kiểm tra vi thể trong Bảng B.4 áp dụng cho tất cả các phép thử đã được liệt kê. “Chỉ số kích thích” được phát triển để dùng với mô hình kích thích âm đạo nhưng có thể dùng cho các phép thử khác. | |
B.5. Phép thử kích thích dương vật
B.5.1. Quy định chung
Phép thử kích thích dương vật chỉ được xem xét cho vật liệu dự định tiếp xúc với mô dương vật và nếu không thể nhận được số liệu an toàn bằng các phương tiện khác.
B.5.2. Nguyên tắc
Phải đánh giá được tiềm năng của vật liệu thử gây ra kích thích mô dương vật.
B.5.3. Loại bỏ khỏi phép thử
Bất kỳ vật liệu nào gây kích thích da hoặc mắt hoặc vật liệu có độ pH ≤ 2 hoặc ≥11,5 không được thử và phải được đánh dấu là chất kích thích dương vật tiềm ẩn.
B.5.4. Mẫu thử
Nếu mẫu thử là một chất rắn hoặc lỏng thì phải được chuẩn bị như quy định trong Phụ lục A.
B.5.5. Động vật và nuôi dưỡng
Sử dụng thỏ bạch đực hoặc chuột lang. Chúng phải là những con trưởng thành, khỏe, cân nặng không dưới 2 kg đối với thỏ và 300 g đến 500 g đối với chuột lang.
Động vật phải được làm thích nghi và chăm sóc như quy định trong TCVN 7391-2 (ISO 10993-2).
Chiều dài dương vật có thể tiếp xúc phải ít nhất là 1 cm.
Do các biến đổi sắc tố riêng rẽ, động vật phải được quan sát và xác định cấp độ cho ban đỏ trước khi áp dụng phép thử đầu tiên. Phải dùng hệ thống nêu trong Bảng B.3 để xác định cấp độ ban đỏ. Không được sử dụng động vật cho thấy sự mất màu hoặc ban đỏ cấp độ 2 hoặc cao hơn.
Tối thiểu ban đầu phải sử dụng ba động vật để đánh giá vật liệu thử, và ba động vật trong nhóm đối chứng.
Nếu phản ứng trong phép thử ban đầu là nghi ngờ hoặc không rõ cần xem xét thử nghiệm bổ sung.
B.5.6. Quy trình thử
Đặt động vật ở vị trí nằm ngửa với các chi được giữ bởi một trợ lý.
Bằng ngón trỏ và ngón giữa ấn nhẹ vùng sinh dục để dương vật nhô ra.
Khi dương vật nhô ra, đặt đủ (khoảng 0,2 ml) mẫu thử để đảm bảo dương vật được mẫu bao phủ.
Cho dương vật thụt vào trong bao dương vật. Dùng các phương pháp để ngăn động vật khỏi liếm vào vị trí thử và làm hỏng kích thích cơ sở do các nhân tố thứ cấp (ví dụ như vòng cổ Elizabethan).
Thay thế, có thể giữ động vật trong một cũi được thiết kế phù hợp trong vòng 1 h sau lần ứng dụng cuối cùng.
Đối với tiếp xúc cấp, lặp lại quy trình trên hàng giờ trong vòng 4 h.
Đối với các phép thử tiếp xúc lặp lại kéo dài, dựa trên số lần ứng dụng, khoảng thời gian tiếp xúc được dự đoán trước trong điều kiện lâm sàng.
B.5.7. Quan sát động vật
Đối với tiếp xúc cấp, chú ý đến vẻ ngoài của dương vật 1 h sau ứng dụng ban đầu (ví dụ như ngay trước lần ứng dụng tiếp theo) và các xử lý theo sau. Chú ý và ghi lại vẻ ngoài của dương vật 1 h, 24 h và 48 h sau lần ứng dụng cuối cùng.
Đối với các phép thử tiếp xúc lặp lại kéo dài, chú ý đến vẻ ngoài của dương vật 1 h sau lần ứng dụng ban đầu và ngay trước lần ứng dụng tiếp theo.
Phân cấp độ các phản ứng ban đỏ bề mặt da theo hệ thống nêu trong Bảng B.3 cho mỗi động vật tại mỗi khoảng thời gian và ghi lại kết quả để báo cáo phép thử.
Nếu bất kỳ động vật nào có biểu hiện màu đỏ với lần ứng dụng phép thử đầu tiên, thì chỉ số cấp độ đưa ra trước lần ứng dụng đầu tiên của mẫu thử phải được trừ đi chỉ số cấp độ ban đỏ tại lần quan sát để xác định chỉ số cấp độ ban đỏ gây ra do mẫu thử. Chỉ số cấp độ có thể cao nhất cho một quan sát là 4.
B.5.8. Đánh giá kết quả
B.5.8.1. Đánh giá đại thể
So sánh dương vật và bao dương vật bị xử lý với dương vật của các động vật đối chứng.
Các cấp độ (Bảng B.3) cho mỗi quan sát được gộp lại rồi chia cho số lần quan sát để xác định giá trị cấp độ trung bình trên mỗi động vật.
CHÚ THÍCH 1 Các quan sát này có thể hỗ trợ trong đánh giá mô học.
CHÚ THÍCH 2 Các quan sát ban đầu tiến hành trước lần ứng dụng đầu tiên của vật liệu thử không được tính vào giá trị trung bình của cấp độ.
Ngay sau 48 h quan sát, gây chết nhân đạo động vật. Mổ dương vật ngoại biên và bao dương vật đặt vào thuốc hãm thích hợp trước khi xử lý cho kiểm tra mô học.
B.5.8.2. Đánh giá vi thể
Tác động kích thích đến da dương vật phải được đánh giá bởi một nhà mô bệnh học. Nhà mô bệnh học có thể xác định cấp độ mỗi mô theo hệ thống trình bày trong Bảng B.4.
Cấp độ để đánh giá vi thể cho tất cả động vật trong nhóm thử được gộp lại và tổng này chia cho số lần quan sát để nhận được giá trị trung bình nhóm thử. Điểm số lớn nhất là 16.
Lặp lại đánh giá này cho nhóm đối chứng.
Tổng điểm số lớn hơn chín cho đánh giá vi thể trong động vật đối chứng có thể chỉ ra sự chấn thương khi định liều. Cần thí nghiệm lại nếu động vật thử hoặc đối chứng còn lại cho thấy giá trị cao tương đương.
Trừ giá trị trung bình nhóm đối chứng cho giá trị trung bình nhóm thử để nhận được chỉ số kích thích (xem Bảng B.5).
Đối với các phép thử tiếp xúc lặp lại kéo dài, Bảng B.4 có thể cần biến đổi để điều tiết các phản ứng mô bổ sung liên quan đến kích thích trường diễn.
B.5.9. Báo cáo thử nghiệm
Báo cáo thử nghiệm bao gồm:
a) mô tả mẫu thử,
b) mục đích sử dụng/ứng dụng của mẫu thử,
c) mô tả chi tiết phương pháp dùng để chuẩn bị mẫu thử,
d) mô tả động vật thử,
e) phương pháp ứng dụng,
f) tiến hành đọc vị trí như thế nào,
g) ghi chép các quan sát,
h) đánh giá mô học,
i) đánh giá kết quả.
B.6. Phép thử kích thích trực tràng
B.6.1. Khái quát
Phép thử kích thích trực tràng chỉ được xem xét cho các vật liệu dự định để tiếp xúc với mô trực tràng và nếu các số liệu an toàn không thể nhận được bằng các phương tiện khác.
B.6.2. Nguyên tắc
Phải đánh giá tiềm năng của vật liệu thử gây ra kích thích mô trực tràng.
B.6.3. Loại bỏ khỏi phép thử
Bất kỳ vật liệu nào kích thích da hoặc mắt và những vật liệu có độ pH ≤ 2 hoặc ≥ 11,5 không được thử và phải được đánh dấu là một chất kích thích trực tràng tiềm ẩn.
B.6.4. Vật liệu thử
Nếu vật liệu thử là chất rắn hoặc lỏng, vật liệu này phải được chuẩn bị như quy định trong Phụ lục A.
B.6.5. Động vật và nuôi dưỡng
Sử dụng thỏ bạch trưởng thành, khỏe, không phân biệt giới tính từ một chủng đơn, cân nặng không ít hơn 2 kg. Nếu dùng các loài khác thì sự chọn lựa phải được giải thích.
Các động vật phải được làm thích nghi và chăm sóc như quy định trong TCVN 7391-2 (ISO 10993-2).
Tối thiểu ba động vật được dùng ban đầu để đánh giá vật liệu thử và ba động vật dùng làm nhóm đối chứng.
Nếu phản ứng trong phép thử ban đầu là nghi ngờ hoặc không rõ, cần xem xét thử nghiệm bổ sung.
Động vật phải được kiểm tra sự chảy mủ trực tràng, sưng tấy và/hoặc bằng chứng nhiễm ruột thấp, kích thích và/hoặc tổn thương trước mỗi lần xử lý.
B.6.6. Quy trình thử
Gắn một ống thông mềm ngắn (6 cm) hoặc ống thông dò đầu nhọn vào một ống tiêm có dung tích để chuyển là 1 ml rồi bơm vào ống tiêm và ống thông 1 ml mẫu thử. Chuẩn bị một ống tiêm gắn ống thông riêng cho mỗi động vật.
Giữ động vật bằng cách đặt nó trong một dụng cụ kìm hãm mà cho phép tiếp cận với đáy chậu hoặc một trợ lý giữ cẩn thận động vật và giữ cho chân sau ở vị trí để lộ ra đáy chậu.
Trước khi lồng vào, làm ẩm ống thông bằng mẫu đối chứng hoặc là chất bôi trơn thích hợp.
Túm và nâng đuôi của động vật lên để lộ ra đáy chậu. Lồng nhẹ ống thông đã được làm ẩm sâu vào trong trực tràng rồi đặt toàn bộ 1 ml liều từ ống tiêm. Rút ống thông và vứt bỏ.
Do sự khác nhau về dung tích của trực tràng ở mỗi loài động vật, nên một số mẫu thử có thể bị thải ra trong hoặc ngay sau khi nó được đặt vào. Loại bỏ nhẹ nhàng bất kỳ vật liệu bị tháo ra bằng giấy thấm mềm.
Lặp lại quy trình trên tại các khoảng thời gian 24 h hàng ngày trong 5 ngày liên tiếp.
Đối với các phép thử lặp lại kéo dài, dựa trên số lần ứng dụng, khoảng thời gian tiếp cận được dự đoán trước trong điều kiện lâm sàng.
B.6.7. Quan sát động vật
24h sau lần ứng dụng đầu tiên và ngay trước mỗi lần xử lý, chú ý và ghi lại vẻ ngoài của trực tràng cho các dấu hiệu chảy mủ, ban đỏ và kích thích.
Các động vật cho thấy chảy mủ nhiều, sưng tấy và/hoặc các biểu hiện thấy khó cho liều phải gây chết nhân đạo và kiểm tra mô (xem B.6.8.1).
B.6.8. Đánh giá kết quả
B.6.8.1. Đánh giá đại thể
24 h sau liều cuối cùng, gây chết nhân đạo động vật. Giải phẫu toàn bộ ruột dưới, mở theo chiều dọc và kiểm tra dấu hiệu kích thích, tổn thương tầng biểu mô và hoại tử.
Đặt trực tràng và phần xa của đại tràng vào thuốc cố định phù hợp trước khi xử lý để kiểm tra mô học. So sánh mô trực tràng của thỏ thí nghiệm với mô trực tràng của thỏ đối chứng.
Ghi lại và mô tả đại thể của mô trực tràng cho mỗi động vật, chú ý sự khác nhau giữa vị trí thử và đối chứng.
CHÚ THÍCH Các quan sát này có thể hỗ trợ trong đánh giá mô học.
B.6.8.2. Đánh giá vi thể
Tác động kích thích trên mô trực tràng phải được đánh giá bởi một nhà mô bệnh học. Nhà mô bệnh học có thể xác định cấp độ từng mô theo hệ thống trình bày trong Bảng B.4.
Cộng các giá trị cấp độ cho đánh giá vi mô đối với tất cả các động vật trong nhóm thử rồi chia tổng này cho số lần quan sát để nhận được giá trị trung bình của nhóm thử. Điểm số lớn nhất là 16.
Lặp lại cho nhóm đối chứng.
Tổng điểm số lớn hơn chín đối với đánh giá vi mô trong một động vật đối chứng có thể chỉ ra sự chấn thương khi định liều. Cần thử lại nếu các động vật thử hoặc động vật đối chứng còn lại cho giá trị cao tương đương.
Trừ giá trị trung bình nhóm đối chứng cho giá trị trung bình nhóm thử để nhận được chỉ số kích thích (xem Bảng B.5).
Đối với các phép thử tiếp xúc lặp lại kéo dài, Bảng B.4 cần thay đổi để điều tiết các phản ứng mô bổ sung liên quan với kích thích trường diễn.
B.6.9. Báo cáo thử nghiệm
Báo cáo thử nghiệm bao gồm:
a) mô tả mẫu thử,
b) mục đích sử dụng/ứng dụng/ của mẫu thử,
c) mô tả chi tiết phương pháp dùng để chuẩn bị mẫu thử,
d) mô tả động vật thử,
e) phương pháp ứng dụng,
f) tiến hành đọc vị trí như thế nào,
g) ghi chép các quan sát,
h) đánh giá mô học,
i) đánh giá kết quả.
B.7. Phép thử kích thích âm đạo
B.7.1. Quy định chung
Phép thử kích thích âm đạo chỉ được xem xét cho các vật liệu dự định dùng để tiếp xúc với mô âm đạo và nếu các số liệu an toàn không thể nhận được bằng các phương tiện khác.
B.7.2. Nguyên tắc
Phải đánh giá được tiềm năng vật liệu thử gây ra kích thích mô âm đạo.
B.7.3. Loại bỏ khỏi phép thử
Bất kỳ vật liệu nào gây kích thích da hoặc mắt hoặc vật liệu có độ pH ≤ 2 hoặc ≥ 11,5 không được thử và phải đánh dấu là chất kích thích âm đạo tiềm ẩn.
B.7.4. Vật liệu thử
Nếu vật liệu thử là rắn hoặc lỏng thì vật liệu này phải được chuẩn bị như quy định trong Phụ lục A.
B.7.5. Động vật và nuôi dưỡng
Sử dụng thỏ bạch tạng cái trưởng thành, khỏe, từ một chủng đơn, nặng không dưới 2 kg. Nếu sử dụng các loài khác sự lựa chọn phải giải thích.
Động vật phải được làm thích nghi và chăm sóc như quy định trong TCVN 7391-2 (ISO 10993-2).
Tối thiểu ba động vật được dùng ban đầu để đánh giá vật liệu thử, và ba động vật trong nhóm đối chứng.
Nếu phản ứng trong phép thử ban đầu nghi ngờ hoặc không rõ, phải xem xét thử nghiệm bổ sung.
Các động vật phải được kiểm tra xem có chảy mủ âm đạo, sưng tấy và/hoặc bằng chứng viêm nhiễm âm đạo, kích thích và/hoặc chấn thương trước mỗi lần xử lý. Cũng tiến hành kiểm tra trên giai đoạn chu kỳ động dục để đảm bảo không gây ra một phản ứng dương tính giả, dựa trên những thay đổi sinh lý trong âm đạo.
B.7.6. Quy trình thử
Gắn một ống thông mềm ngắn (6 cm) hoặc ống thông vòng đầu nhọn vào một ống tiêm có dung tích chứa hơn 1 ml rồi bơm vào ống tiêm và ống thông 1 ml mẫu thử. Chuẩn bị một ống tiêm có gắn với ống thông riêng cho mỗi động vật.
Giữ động vật bằng cách đặt nó trong một dụng cụ kiềm chế tiếp xúc được với âm đạo hoặc một trợ lý giữ cẩn thận động vật và giữ chân sau theo cách để lộ âm đạo.
Làm ẩm ống thông bằng mẫu đối chứng hoặc một chất bôi trơn phù hợp.
Túm và nâng đuôi của động vật để lộ ra miệng âm đạo. Lồng nhẹ ống thông đã làm ẩm sâu vào âm đạo rồi đặt toàn bộ liều 1 ml từ ống tiêm. Rút ống thông và vứt bỏ.
Do sự khác nhau về dung tích của âm đạo ở mỗi loài động vật nên một số mẫu thử có thể bị thải ra trong hay ngay sau khi mẫu được đặt vào. Loại bỏ nhẹ nhàng bất kỳ vật liệu bị tháo ra bằng giấy thấm mềm.
Lặp lại quy trình trên tại các khoảng thời gian 24 h hàng ngày trong 5 ngày liên tiếp.
Đối với các phép thử lặp lại kéo dài, dựa trên số lần ứng dụng, khoảng thời gian tiếp cận được dự đoán trước trong điều kiện lâm sàng.
B.7.7. Quan sát động vật
Tại thời điểm 24 h sau lần ứng dụng đầu tiên và ngay trước mỗi lần xử lý, chú ý và ghi lại vẻ ngoài của miệng âm đạo và đáy chậu cho dấu hiệu chảy mủ, ban đỏ và phù nề.
Động vật cho thấy chảy mủ nhiều, ban đỏ và/hoặc phù nề và thấy khó định liều phải gây chết nhân đạo và kiểm tra mô (xem B.6.8.1).
B.7.8. Đánh giá kết quả
B.7.8.1. Đánh giá đại thể
Tại thời điểm 24 h sau lần cho liều cuối cùng, gây chết nhân đạo động vật. Giải phẫu toàn bộ âm đạo, mở theo chiều dọc và kiểm tra các dấu hiệu kích thích, tổn thương tầng biểu mô và chết hoại.
Đặt âm đạo vào dung dịch cố định trước khi kiểm tra mô học. Lấy ba phần bao gồm phần cổ, giữa và đuôi của mỗi âm đạo.
So sánh âm đạo của động vật xử lý với vật liệu thử với âm đạo của động vật đối chứng.
Ghi lại và mô tả đại thể của mô âm đạo của mỗi động vật, chú ý sự khác nhau giữa các nhóm đối chứng và thí nghiệm.
CHÚ THÍCH Các quan sát này có thể hỗ trợ đánh giá mô học.
B.7.8.2. Đánh giá vi thể
Tác động kích thích trên mô âm đạo phải được đánh giá bởi một nhà mô bệnh học. Nhà mô bệnh học có thể xác định cấp độ mỗi mô theo hệ thống trình bày trong Bảng B.4.
Cộng các giá trị cấp độ cho đánh giá vi mô tất cả các động vật trong nhóm thử rồi chia tổng này cho số lần quan sát để nhận được giá trị trung bình của nhóm thử. Điểm số lớn nhất là 16.
Lặp lại cho nhóm đối chứng.
Tổng điểm số lớn hơn chín cho đánh giá vi thể trong một động vật đối chứng có thể chỉ ra sự chấn thương khi định liều, cần thử lại nếu các động vật thử hoặc đối chứng còn lại cho giá trị cao tương tự.
Trừ giá trị trung bình nhóm đối chứng cho giá trị trung bình nhóm thử để nhận được chỉ số kích thích (xem Bảng B.5).
Đối với các phép thử tiếp xúc lặp lại kéo dài, Bảng B.4 cần thay đổi để điều tiết các phản ứng mô bổ sung liên quan với kích thích trường diễn.
B.7.9. Báo cáo thử nghiệm
Báo cáo thử nghiệm bao gồm:
a) mô tả mẫu thử,
b) mục đích sử dụng/ứng dụng của mẫu thử,
c) mô tả chi tiết phương pháp dùng để chuẩn bị mẫu thử,
d) mô tả động vật thử,
e) phương pháp ứng dụng,
f) tiến hành đọc vị trí được như thế nào,
g) ghi chép các quan sát,
h) đánh giá mô học,
i) đánh giá kết quả.
Phụ lục C
(tham khảo)
Thông tin cơ sở
C.1. Thông tin cơ sở về phép thử kích thích
Thử nghiệm kích thích da trong các động vật nhỏ được tiến hành để giúp xác định vật liệu có thể là chất kích thích tiềm ẩn niêm mạc và/hoặc da người. Một chất kích thích sơ đẳng là một vật liệu gây ra thay đổi viêm nhiễm cho da do tác động phá hủy trực tiếp được đặc trưng bởi việc có quá trình viêm nhiễm hoặc trong trường hợp kích thích mạnh, có phồng da và/hoặc chết hoại.
Thỏ là động vật thử ưu tiên dùng, như một lượng lớn thông tin đã dẫn chứng về kích thích da của động vật này tại Cơ quan Đăng ký tác động độc của hóa chất (RTECS). Trong số hơn 2000 hạng mục RTECS, 85 % báo cáo kết quả thử là về thỏ, 7,5 % về người, 4 % về chuột và 3 % về chuột lang. Như vậy, thỏ được dùng để tạo ra phần lớn số liệu có sẵn trong tài liệu mở. Không cần làm trầy da vị trí thử như bằng chứng cho thấy các phản ứng tương tự giữa vùng da bị trầy và không bị trầy.
Các phép thử kích thích da có thể cho các kết quả biến đổi do biến đổi trong số lượng các nhân tố liên quan đến phép thử, ví dụ như vật chủ, liều thử, cỡ miếng gạc, mức độ hút, chiều dài tiếp xúc, tá dược lỏng, thời gian đọc và chất lượng đọc. Chính vì vậy, trong các phép thử kích thích da người quan trọng là phải có vật liệu đã biết rõ đối chứng âm tính và dương tính để so sánh các kết quả phép thử với vật liệu
đối chứng làm cho kết quả tương đối. Là một đối chứng kích thích dương tính, natri dodecyl sulphát (SDS) có độ tinh khiết 99 % được ưu tiên lựa chọn, vì nó chính là chất kích thích được sử dụng rộng rãi nhất trong các nghiên cứu lâm sàng [2], [4], [31]. Chất này sẵn có và không gây hại. Axit nonanoic có kiểu tác động khác SDS cũng có thể dùng làm đối chứng dương tính [18], [19].
Tiếp xúc với SDS xác định nhóm tình nguyện viên và đóng vai trò như một điểm tham khảo. SDS được phân loại như một chất kích thích da theo các tiêu chí của EU (Chỉ thị 88/379/EEC, ngày 7/6/1988). Tuy nhiên không rõ liệu SDS tại hoặc gần mức độ ngưỡng phản ứng tại đó các hóa chất được xem là chất gây kích thích da hay không. Chính vì vậy, không sử dụng vật liệu nguyên chất mà phù hợp hơn là lấy một điểm tham khảo mức độ tối thiểu SDS dung dịch lỏng 20 % (nồng độ khối lượng) được xem xét bởi ít nhất một nhóm vùng (các nước châu Âu) như chất kích thích da cấp [31].
Sử dụng động vật thử cho thử nghiệm kích thích da đang giảm do sự hình thành các mô hình in vitro và sử dụng thường xuyên hơn các tình nguyện viên [10], [14]. Kỹ thuật sinh học hoặc các phương pháp đo vật thể không xâm nhập được dùng để định lượng phản ứng kích thích và qua đó giảm sự phụ thuộc vào các thang đọc bằng mắt chủ quan hơn [12], [16], [17]. Tuy nhiên, nhiều thập kỷ trải qua về kinh nghiệm đã nhận được phép thử kích thích da Draize trên thỏ bạch. Phương pháp này nêu trong tài liệu tham khảo [8]. Vật liệu thử được đưa vào miếng gạc đến các vị trí nguyên vẹn trên lưng bị xén lông. ứng dụng được tiến hành trên ba con thỏ. Miếng gạc được giữ bằng băng dính và toàn thân của động vật được cuốn một miếng băng bán thấm hoặc thấm trong 4 h. Sau 4 h tháo bỏ miếng gạc, làm sạch vị trí thử và 1 h sau đó xác định cấp độ phản ứng ban đỏ hoặc phù nề. Phản ứng cũng được xác định cấp độ tại 24 h, 48 h và 72 h.
Phép thử kích thích mắt thỏ được phát triển để tiên đoán sự kích thích mắt ở người [27]. Draize [26] xuất bản một hệ thống xác định cấp độ để hỗ trợ đánh giá kích thích mắt. Hướng dẫn minh họa được trích dẫn để hỗ trợ cho việc đánh giá chấn thương mắt.
Các phương pháp in vitro thay thế cho nghiên cứu tác động của kích thích mắt đang được phát triển nhưng vẫn chưa được đánh giá hiệu quả và công nhận trên thế giới [21].
Các số liệu bao quát về kích thích da người của Viện Nghiên cứu chuyên khảo vật liệu có mùi thơm về các loại dầu chủ yếu và các hương liệu khác đã xuất bản trong Độc học thực phẩm và mỹ phẩm. Dự thảo hướng dẫn của OECD về Nghiên cứu kích thích da tình nguyện viên cung cấp thêm thông tin cơ sở. Nhóm hóa chất của chương trình hướng dẫn của OECD vẫn chưa đạt được sự thỏa thuận cần phát triển một hướng dẫn của OECD cho các tác động da ở tình nguyện viên.
C.2. Thông tin cơ sở về phép thử gây mẫn cảm cho phản ứng quá mẫn muộn
Gây mẫn cảm ở người xảy ra sau các tiếp xúc ngoài da một lần hoặc nhiều lần được khởi đầu và gây ra bởi các thành phần của hệ thống miễn dịch. Quan trọng nhất là hapten (hóa chất) phải là chất cho da và có thể xâm nhập vào trong. Sau đó nó phản ứng với protein của da để hình thành phức hợp kháng nguyên. Các tế bào Langerhan tại ranh giới biểu bì/da trình kháng nguyên này cho các tế bào lympho đặc hiệu bị hoạt hóa để khởi đầu phản ứng miễn dịch. Một tỷ lệ nhỏ các tế bào lympho này là các tế bào nhớ tồn tại lâu và đóng vai trò như các chất kích hoạt chủ yếu trong pha quyết định. Chính vì vậy, tái tiếp xúc có thể gây ra các phản ứng có hại môi giới bởi lymphokin giải phóng từ các tế bào lympho và các tế bào viêm nhiễm khác mà bị hấp dẫn đến vùng tổn thương.
Vào năm 1895 Jadassohn áp dụng phép thử miếng gạc để phơi bày dị ứng do tiếp xúc với thủy ngân ở một bệnh nhân lâm sàng. Cách đổi mới này cung cấp cơ sở khoa học cho các phép thử về sau nhằm chẩn đoán và tiên đoán dị ứng tiếp xúc ở người và động vật. Phát triển các phép thử tương lai/dự đoán để đánh giá tiềm năng gây mẫn cảm của hóa chất đi theo công trình tiên phong của Landsteiner và Chase [49] đã chứng minh chắc chắn việc sử dụng chuột lang để nghiên cứu phản ứng quá mẫn muộn.
Magnusson và Kligman [50] đã khai thác nhiều biến số của thử nghiệm chuột lang và trình bày một quy trình, đó là phép thử cực đại hóa chuột lang (GPMT) dựa trên việc tiêm trong da (có hoặc không có tá dược đầy đủ Freund, FCA) tiếp sau bởi ứng dụng cục bộ của vật liệu thử vào cùng một vùng. Quy trình gốc cần quá trình xử lý trước của vị trí thử nếu vật liệu thử không phải là chất kích thích. Theo định nghĩa, quy trình này phát hiện được các chất gây mẫn cảm yếu vì “yếu” bao gồm phạm vi tác động zero của các chất phản ứng dương tính. Quy trình này là một phép thử mẫn cảm và được sử dụng rộng rãi. Sử dụng tá dược đầy đủ Freund tăng độ nhạy của phương pháp thử, và trong một số trường hợp có thể đánh giá quá cao tiềm năng gây mẫn cảm của hợp chất đang được nói đến.
Vào năm 1965 Buehler [41] tán thành việc sử dụng miếng gạc tiếp xúc để cung cấp sự hút thấm như một phương pháp tiếp xúc tối ưu và để bắt chước các quy trình dùng cho người (Thử miếng gạc đệm lặp lại ở người: HRIPT). Gợi ý rằng quy trình miếng gạc hút là nhạy và sẽ dự đoán chính xác các chất gây mẫn cảm vừa phải cho đến mạnh, chính vì vậy, tránh được sự tiếp xúc của đối tượng con người với các phản ứng có hại trong HRIPT. Số liệu trình bày cho thấy sự ưu việt của hút thấm so với tiêm da và các ứng dụng cục bộ kiểu mở. Kích thích hệ thống miễn dịch bằng tá dược không được sử dụng. Phương pháp này được thiết lập như một kỹ thuật đủ nhạy để phát hiện các chất gây mẫn cảm yếu nhất và cho thấy đủ linh hoạt để dùng trong quá trình đánh giá nguy cơ. Tuy nhiên, phép thử miếng gạc tiếp xúc (thí nghiệm Buehler) ít nhạy hơn so với GPMT [46].
Hai phép thử này, phép thử miếng gạc đóng ở Hoa Kỳ và GPMT ở Châu Âu được sử dụng nhiều nhất để đánh giá an toàn. Hai phép thử này cũng là các phương pháp thử được sử dụng nhiều trong hướng dẫn thử hiện hành của EU và OECD. Kết quả từ các phép thử gây mẫn cảm chuột lang phụ thuộc vào nhiều nhân tố kỹ thuật và liên quan đến động vật, giải thích các biến đổi giữa các phòng thí nghiệm về kết quả phép thử, ví dụ như chủng động vật, giới tính, tuổi, điều kiện thí nghiệm xung quanh, vị trí thử trên động vật, phương pháp loại bỏ lông (xén/cạo) hoặc làm rụng lông bằng hóa chất, kiểu thiết kế miếng gạc, số lượng vật liệu thử, chất lượng hút thấm, thời gian tiếp xúc và đọc phản ứng mô. Nhiều phép thử khác được sử dụng và nghiên cứu và tất cả các phép thử này đều có người đề xuất. Hiện có một số quy trình được ghi nhận có thể chấp nhận cho mục đích điều tiết, nếu quy trình này được đưa ra thành tài liệu chuẩn và được các nhà nghiên cứu đánh giá công nhận. Trong mọi trường hợp quy trình phải được tiến hành theo tham khảo gốc. Danh sách các phép thử được cung cấp trong Bảng C.1.
Chuyên khảo gần đây của ECETOC đưa ra sự cập nhật về thử nghiệm gây mẫn cảm cho da [44].
Bảng C.1 - Các phép thử gây mẫn cảm tiếp xúc chậm thay thế
| 1. Phép thử tá dược đầy đủ Freund 2. Phép thử tá dược phân hóa 3. Phép thử ngoài da mở 4. Phép thử tối ưu Mauer 5. Phép thử gan bàn chân chuột lang 6. Phép thử tăng cường tiếp xúc lũy tích 7. Phép thử da bị xước (tá dược và miếng gạc) 8. Phép thử sưng tai chuột 9. Phép thử u bạch huyết cục bộ |
Phương pháp cuối cùng trong Bảng C.1, phép thử u bạch huyết cục bộ của chuột (LLNA) thu hút được sự chú ý. Phương pháp này đã được Tổ chức Hợp tác và Phát triển kinh tế chấp nhận như một phương pháp thay thế độc lập cho các phép thử chuột lang hiện hành và như một sự cải tiến cho sử dụng động vật [83].
Cơ sở khoa học cho phép thử là đo lường sự kết hợp của 3H-metyl thymidin vào tế bào bạch huyết để dẫn lưu các u bạch huyết của chuột đã tiếp xúc cục bộ với hạt thí nghiệm là một phép đo khả năng gây mẫn cảm. Cơ sở này không có pha quyết định. Điểm cuối quan tâm là chỉ số kích thích đưa ra tỷ lệ kết hợp thymidin trong u bạch huyết từ các động vật đã cho liều so với sự hợp nhất vào các u bạch huyết trong động vật đối chứng. Phép thử là dương tính khi chỉ số kích thích vượt quá 3 (SI > 3). Một đánh giá trong phòng thí nghiệm và giữa các phòng thí nghiệm của LLNA chứng minh mối quan hệ phản ứng liều có thể tái lập được trong và giữa các phòng thí nghiệm [60], [76], [78], [72], [59], [65], [82]. Tuy nhiên những khó khăn trong việc phân biệt hóa các chất kích thích và dị ứng với LLNA đã được báo cáo [72], [62], [79]. Chính vì vậy, LLNA có thể cho các kết quả dương tính giả với các chất kích thích và có thể đánh giá quá cao khả năng gây dị ứng của các chất với cả đặc điểm gây kích thích và gây dị ứng [59]. Tuy nhiên, LLNA có ưu điểm so với các phương pháp trên chuột lang vì khoảng thời gian thử ngắn hơn, điểm cuối có chủ đích hơn, cần ít cơ chất hơn và bỏ qua việc tiêm tá dược đầy đủ Freund. Có thể cải tiến quy trình thử bằng phân tích các vật ghi kích hoạt tế bào và đo tế bào dòng [68], [69]. Liệu những tiến bộ này có thể được tiến hành trong thực tế trong các quy trình LLNA chuẩn cho độc học thông thường chưa được xác định. Mặt khác, LLNA cho phép chọn lựa hạn chế hơn tá dược lỏng thử; hầu hết các nghiên cứu đã dùng một hỗn hợp axeton và dầu ôliu. Một nghiên cứu gần đây cho thấy khả năng biến đổi của kết quả sử dụng các tá dược lỏng khác nhau [77]. Hơn nữa, không thể với LLNA để nghiên cứu pha thách thức hoặc dạng phản ứng chéo do các động vật bị giết sau khi xử lý cảm ứng trước khi thu hoạch các u bạch huyết.
Phương pháp u bạch huyết vùng kheo (PLNA) tiến hành dưới da gan bàn chân [63], [66], [81] là một phương pháp u bạch huyết thay thế. Phương pháp này ngoài việc đo trực tiếp sự kích hoạt u bạch huyết các kháng nguyên báo cáo có thể sử dụng để xác định cấp độ điều biến miễn dịch do hóa chất nghiên cứu gây ra [58].
Quá trình đánh giá rủi ro không nên dựa vào một mô hình hoặc một phương pháp, nên tiến hành kỹ lưỡng để đảm bảo tối đa độ an toàn cho người tiêu dùng. Nhìn chung, điều này đưa đến cả mô hình thực nghiệm của người và động vật. Phải có linh hoạt trong việc chọn mô hình và phương pháp, miễn là thuyết minh được lập thành văn bản và/hoặc đánh giá.
Các phép thử âm tính ở chuột lang, khi chúng được tiến hành đúng, có thể là xác định nếu nồng độ thử có một nhân tố đủ an toàn trong mọi điều kiện sử dụng. Tuy nhiên, nên tránh phân loại vật liệu thử một mình trên cơ sở phạm vi tác động và/hoặc độ nghiêm trọng, không xem xét đúng việc sử dụng thành phẩm.
Rủi ro, ví dụ phạm vi tác động và độ nghiêm trọng của phản ứng dị ứng với sản phẩm được xác định chủ yếu với bốn nhân tố sau: tiềm năng gây mẫn cảm của dị ứng nguyên hóa học, lượng có mặt trong sản phẩm, độ sẵn có sinh học và điều kiện tiếp xúc. Tiềm năng gây mẫn cảm tương đối của các hóa chất có thể được định nghĩa bằng nồng độ cảm ứng tối thiểu cần để cảm ứng một mức độ gây mẫn cảm xác định: nồng độ này càng thấp thì chất gây mẫn cảm càng tiềm ẩn [80], [40]. Phạm vi tác động có ý nghĩa của chứng viêm da do tiếp xúc với các chất gây dị ứng được tìm thấy trong những người sử dụng khi dư lượng của chất gây dị ứng trong sản phẩm vượt quá nồng độ cảm ứng tối thiểu của nó nhận được bằng GPMT [51].
Mặt khác, thử nghiệm dự đoán của hỗn hợp và sản phẩm ít được đánh giá hiệu lực hơn và có thể tiến hành sau khi kiểm tra các hợp phần sản phẩm. Do vậy, thiết kế phép thử và giải thích kết quả là không chắc chắn, nhưng một vài phép thử đã trình bày khả năng này. Trong các thực nghiệm trên động vật với chất ngâm chiết axeton từ một chiếc áo len gây ra viêm da tiếp xúc ở người, các chất gây dị ứng (phosgene chlorophenylhydrazone) được chứng minh [48]. Trong một trường hợp khác thực nghiệm trên động vật với các chất ngâm chiết bằng axeton/clorofom từ ủng cao su đã gây ra viêm da tiếp xúc ở người thì mercaptobenzothiazole và dibenzothiazyldisulfit thực sự được tìm thấy là chất gây dị ứng [47]. Tầm quan trọng của việc sử dụng một dung môi hữu cơ thích hợp đã được chứng minh rõ ràng. Chất ngâm chiết được tạo ra với dung môi hữu cơ cảm ứng phản ứng nhạy ở chuột lang, trong khi các chất ngâm chiết bằng dung dịch muối không gây ra phản ứng như vậy.
Các hướng dẫn phép thử sinh học cơ bản của dụng cụ và trang thiết bị y tế của Nhật Bản (1995) áp dụng quy trình chuẩn bị mẫu với dung môi hữu cơ sau khi bốc hơi dung môi để thu được cặn và quy trình đánh giá nguy cơ bằng cách so sánh phần trăm chất cặn tạo ra từ vật liệu với độ hòa loãng theo phần trăm tối thiểu của chất cặn (hỗn hợp) mà vẫn cảm ứng quá mẫn muộn ở động vật.
Các phương pháp thử nghiệm khả năng gây mẫn cảm in vitro hiện không có sẵn cho mục đích sử dụng thông thường [13].
Thư mục tài liệu tham khảo
Tham khảo chung cho các phép thử kích thích da và mắt và gây mẫn cảm cho da
[1] TCVN 7391-6 (ISO 10993-6) Đánh giá sinh học đối với trang thiết bị y tế - Phần 6: Phép thử hiệu ứng tại chỗ sau cấy dưới da
[2] Agner T. Noninvasive measuring methods for the investegation of irritant patch test reactions. A study of patients with hand eczema, atopic dermatitis and controls. Acta Derm. Venereol. Suppl. Stockh., 173, pp 1-26, 1992
[3] World Medical Association. Declaration of Helsinki. Recommendation guiding phisicians in biomedical research involving human subjects. Adopted by the 18 th World Medical Assembly, Hensinki June 1964, amended by the 29th World Medical Assembly, Tokyo, October 1975, the 35th World Medical Assembly, Venice, October 1983 and the 41th World Medical Assembly, Hong Kong, September 1989. Proc XXVIth Conf., Geneva, 1993
[4] Lee C.H. and Maibach H.I. The sodium lauryl sulfate model: an overview. Contact Dermaltitis, 33, pp. 1-7, 1995
[5] Marzulli F.N. and Maibach H.I. (eds) Dermatotoxicology, 5th edn., Hemisphere Publ. Corp., 1996
[6] Organization for Economic Cooperation and Development (OECD) Guideline for the testing of chemicals. Acute dermal irritation stydy in human volunteers. Draft document, Nov. 1997
[7] Organization for Economic Cooperation and Development (OECD) Guideline for the testing of chemicals. No. 406, Skin sensitization, OECD Publicatons, 1992
[8] Organization for Economic Cooperation and Development (OECD) Guideline for the testing of chemicals. No. 404, Acute skin irritation/corrosion, OECD Publicatons, 1992
[9] Organization for Economic Cooperation and Development (OECD) Guideline for the testing of chemicals. No. 405, Acute eye irritation/corrosion, OECD Publicatons, 1992
[10] Ponec M. In vitro models to predict skin irritation. In: The irritant Contact Dermatitis Syndrome. Van de Valk P.G.M. and Maibach H.I. (eds) Boca Raton, CRC Press, pp. 335-341, 1996
[11] Russel W.M.S. and Burch R.L. The principle of humane experimental technique, 238 pp., London, Methuen, 1959
[12] Serup J. And Jemec G.B.E. Handbook of non-invasive methods and the skin. CRC Press, 1995
[13] Silva O. de., Basketter D.A., Barratt M.D. et al. Altermative methods for skin sensitization testing. The Report and Recommendations of ECVAM Workshop 19. ATLA, 24, pp. 329-334, 1996
[14] Simion F.A. In vivo models to predict skin irritation. In: The Irritant Contact Dermatitis Syndrome. Van der Valk P.G.M. and Maibach H.I. (eds). Boca Raton, CRC Press, pp. 329-334, 1996
[15] Svendsen O., Garthoff B., Spielmann H. Et al. Alternatives to the animal testing of medical devices. ATLA, 24, pp. 659-670, 1996
[16] Wahlberg J.E. Assessment of skin irritancy: measurement of skin fold thichness. Contact Dermatitis, 9, pp 21-26, 1983
[17] Wahlberg J.E. and Wahlberg E.N. Quantification of skin blood flow at patch test sites. Contact Dermatitis, 17, pp 229-233, 1987
[18] Wahlberg J.E. and Mailbach H.I. Nonanoic acid irritation - A positive control at routine patch testing. Contact Dermatitis, 6, pp 128-130, 1980
[19] Wahlberg J.E. Wrangsjo K. And Hietasola A. Skin irritancy from nonanoic acid. Contact Dermatitis, 13, pp 266-269, 1985
[20] Weil S.C. and Scala R.A. Study of intra- and interlaboratory variability in the results of rabbit eye and skin irritaion tests. Toxicol. Appl. Pharmacol., 12, pp. 276-360, 1971
Tài liệu tham khảo cho các phép thử kích thích da và mắt
[21] Bakks M., Berg N. And Bruner L.H. et al. Eye irritation testing forward. ATLA, 27, pp. 53-78,1999
[22] BAS KETTER DA, WHITILE E., GRIFFITHS HA et a/. The identification and classification of skin irritation hazard by a human patch test. Food Chem. Toxicol., 32, pp. 769-775, 1994
[23] BOTHAM PA, EARL LX, FENTEM J.H. et a/. Alternative methods for skin irritation testing: the current status. ALTA, 26, pp. 195-212, 1998
[24] BRUNER L.H., KAIN D.J., ROBERTS DA et al. Evaluation of seven in vitro alternatives for ocular testing. Fundam. Appl. Toxico/., 17, pp. 136-149, 1991
[25] DRAIZE J.H. Dermal Toxicity. Association of food and drug officials of the U.S, FDA, Washington, D.C. pp. 46-59, 1955
[26] DRAIZE J.H. Appraisal of the safety of chemicals in foods, drugs, and cosmetics, Austin, Texas.. Association of food and drug officials of the United States, Texas State Department of Health, Texas, 1959
[27] European Chemical Industry Ecology and Toxicology Centre. Eye irritation testing, Monograph 11, Brussels, Belgium, 1988
[28] European Chemical Industry Ecology and Toxicology Centre. Skin irritation, Monograph 15, Brussels, Belgium, 1990
[29] GERNER L., GRAETSCHEL G.,KAHL J. et al. Development of a decision support system for the introduction of alternative methods into local irritancy/corrosivity testing strategies. Development of a relational database. ALTA, 26, pp. 11-28,2000
[30] STEINBERG M., AKERS WA, WEEKS M. et al. A comparison of test techniques based on rabbit and human skin responses to irritants with recommendations, regarding the evaluation of mildly or moderately irritating compounds. Animal Models in Dermatology. Maibach H.I. (ed.), N.Y., Churchill Livingstone, pp. 1-11, 1975
[31] YORK M., GRIFFITHS HA, WHITTLE E. et al. Evaluation of a human patch test for the identification and classification of skin irritation potential. Contact Dermatitis, 34, pp. 204-212, 1996
Tài liệu tham khảo cho các phép thử kích thích miệng
[32] Nilsson R., Fallan J.O., Larsson K.S. et al. Electrical impedance - A new parameter for oral mucosal irritation tests. J. Mater. Science: Materials in Medicine, 3, p. 278, 1992
[33] Roy M. and White H.I. Establishment of an improved technique for hamster mucous membrane irritation testing. J.Dent. Res., 11, pp.365-1375,1986
Tài liệu tham khảo cho các phép thử kích thích âm đạo
[34] Chvapil M., Chvapil T.A., Owen J.A. et al. Reaction of vaginal tissue of rabbits to enseted ponges made of various materials. J. Biomad. Mater. Res., 13, pp.1-13.1979.
[35] Eckstein P., Jackson M.C., Millman N. et al. Comparisons of vaginal tolerance tests of permicidal preparations in rabbits and monkeys. J. Reprod. Fertil., 20, pp. 85-93, 1969
[36] Kaminski M. and Willigan D.A. pH and the potentia irritancy of douche formulations to the vaginal mucosa of the albino rabit and rat. Food chem. Toxicol., 20, pp. 193-196, 1992
[37] Muller P., Raabe G., Horold J. et al. Action of chromic peracetic acid (wofasteril) adminstration on the rabbit oral mucoca, vaginal mucosa and skin. Exp. Pathol., 34, pp.223-228, 1988
Tài liệu tham khảo cho các phép thử gây mẫn cảm cho da
[38] Andersen K.E. and Maibach H.I. Contact allergy predictive tests in guinea pigs., Curr. Probl. Dermatol., 14, 1985
[39] Andersen K.E. and Maibach H.I. Guinea pig. Sensitization assays. An overview, Curr. Probl. Dermatol., 14, pp. 263-290, 1985
[40] Andersen K.E., Vlund A. and Frankild S. The guinea pig maximization test with a multiple dose design. Acta Derm. Venereol., 75, pp. 463-469,1995
[41] Buehler E.V. Delayed contact hypersensitivity in the guinea pig. Acta Dermatol., 91, pp. 171-175,1965
[42] Buehler E.V. A rationale for the selection of occlusion to induce and ilicit delayed contact hypersensitivity in the guinea pig. A prospective test. Curr. Probl. Dermatol., 14, pp. 39-58,1958
[43] European Chemical Industry Ecology and Toxicology Centre. Skin sensitization testing, Monograph 14, Brussels, Belgium, 1990
[44] European Chemical Industry Ecology and Toxicology Centre. Skin sensitization testing for the purpose of hazard identification and risk assessment. Monograph 29, Brussels, Belgium, 2000
[45] FRANKILD S., BASKETIER DA and ANDERSEN K.E. The value and limitations of rechallenge in the guinea pig maximization test. Contact Dermatitis, 35, pp. 135-140,1996
[46] FRANKILD S., V0LUND A., WAHLBERG J.E. et al. Comparison of the sensitivities of the Buehler test and the guinea pig maximization test for predictive testing of contact allergy. Acta Derm. Venereol., 80, pp. 256-262, 2000
[47] KANIWA MA, MOMMA J., IKARASHI.Yet al. A method for identifying causative chemicals of allergic contact dermatitis using a combination of chemical analysis and patch testing in patients and animal groups: application to a case of rubber boot dermatitis. Contact Dermatitis, 27, pp. 166-173, 1992
[48] KOJIMA S., MOMMA J. and KANIWA M.A. Phosgene (chlorophenyl) hydrazones, strong sensitizers found in yellow sweaters bleached with sodium hypochlorite, defined as causative allergens for contact dermatitis by an experimental screening method in animals [published erratum appears in Contact Dermatitis, 23, p. 383]. Contact Dermatitis, 23, pp. 129-141, 1990
[49] LANDSTEINER K. and CHASE M.W. Studies on the sensitization of animals with simple chemical compounds. J. Exp. Mea,69,p. 767,1939
[50] MAGNUSSON B. and KLIGMAN A.M. The identification of contact allergens by animal assay. The guinea pig maximization test. J. Invest. Dermatol., 52, pp. 268-276, 1969
[51] NAKAMURA A., MOMMA J., SEKIGNCHI H. et al. A new protocol and criteria for quantitative determination of sensitization potencies of chemicals by guinea pig maximization test. Contact Dermatitis, 31, pp. 72-85, 1994
[52] NEWMANN E.A., BUEHLER EY and PARKER R.D. Delayed contact hypersensitivity in the vagina and skin of the guinea pig. Fundam. Appl. Toxicol., 3, pp. 521-527,1983
[53] POLIKANDRITOU M. Enhancement of the sensitivity of the Buehler method by use of the Hill Top chamber. Soc. Cosmetic Chem., 36, pp. 151-168, 1996
[54] Rllz H.L. and BUEHLER E.V. Planning, conduct and interpretation of guinea pig sensitization patch tests. In DRILL V. and lAzAR P. (eds.) Current concepts in cutaneous toxicity, Academic Press, New York pp. 25-40, 1979
[55] ROBERTS D.W. Structure-activity' relationships for skin sensitization potential of diacrylates and dimethacrylates. Contact Dermatitis, 17, pp. 281-289, 1987
[56] ROBINSON M.K., STOTTS J., DANNEMAN P.J. et al. A risk assessment process for allergic contact sensitization. Food. Chem. Toxicol., 27, pp. 479-489, 1989
[57] ROBINSON M.K., NUSAIR T.L., FLETCHER E.R et al. A review of the Buehler guinea pig skin sensitization test and its use in a risk assessment process for human skin sensitization. Toxicology, 61, pp. 91-107, 1990
Tài liệu tham khảo cho LLNA
[58] Albers R., Broeders A., Van Der Pijl A. et al. The use of reporter antigens in the popliteal lymph node assay to assess immonomodulation by chemicals. Toxicol. Appl. Pharmacol., 143, pp. 102-109, 1977
[59] Basketter D.A., Lea L.J., Cooper K. Et al. Threshold for classification as a skin sensitizer in the local lymph node assay: a statistical evaluation. Food. Chem. Toxicol., 37, pp. 1167-1174,1999
[60] Basketter D.A., Roberts D.W., Cronin M. et al. The value of the local lymph node assay in quantitative structure-activity investigations. Contact Dermatitis, 27, pp 137-142, 1992
[61] Basketter D.A. and Scholes E.W. Comparison of the local lymph node assay wth the guiea pig maximization test for the detection of a range of contact allergens. Food. Chem. Toxicol., 30, pp. 65-69,1992
[62] Basketter D.A., Scholes E.W. and Kimber I. The performance of the local lymph node assay with chemicals identified as contact allergens in the human maximization. Food. Chem. Toxicol., 37, pp. 1167-1174,1999
[63] DE BAKKER J.M., KAMMOLLER ME, MULLER E.S.M. et al. Kinetics and morphology of chemically induced popliteal lymph node reactions compared with antigen-mitogen-, and graft- versus-host-reaction-inducedresponses. Virchows Archiv. B Cell Pathol., 58, pp. 279-287,1990
[64] DEAN J., TWERDOK L.E., ANDERSEN K.E. et al. The murine local lymph node assay: A test method for assessing the allergic contact dermatitis potential of chemicals/compounds. NIH publication No. 99-494, Research Triangle Park, 1999, available at http://iccvam.niehs.nih.gov/methodslllnadocslllnarep.pdf
[65] DEARMAN RJ., BASKETIER DA and KIMBER I. Local lymph node assay: use in hazard and risk assessment. J. Appl. toxicol., 19, pp. 299-306, 1999
[66] DESCOTES J., PATRIARCA C., VIAL T. et al. The popliteal lymph node assay in 1996. Toxicol., 119, pp. 45-49, 1997
[67] EDWARDS D.A., SORANOO T.M., AMORUSO MA et al. Screening petrochemicals for contact hypersensitivity potential: a comparison of the murine local lymph node assay with guinea pig and human test data. Fundam. Appl. Toxicol., 23, pp. 179-187, 1994
[68] GERBERICK G.F., GRUSE L.w. and RYAN CA Local lymph node assay: differentiating allergic and irritant responses using flow cytometry. Methods, 19, pp. 48-55, 1999(a)
[69] GERBERICK G.F., GRUSE L.W., MILLER C.M. et al. Selective modulation of B-cell activation markers CD86 and I-AK on murine draining lymph node cells following allerg.en or irritant treatment. Toxicol. Appl. Pharmacal, 159, pp. 142-151, 1999(b)
[70] IKARASHI Y., OHNO K., MOMMA J. et al. Assessment of contact sensitivity of two thiourea rubber accelerators: comparison of two mouse lymph node assays with the guinea pig maximization test. Food Chem. Toxico/., 32, pp. 1067-1072, 1994
[71] IKARASHI Y., TSUCHIYA T. and NAKAMURA A. Detection of contact sensitivity of metal salts using the murine ~Ioclainode assay. Toxico/.Left., 62, pp. 53-61,1992
[72] IKARASHI Y., TSUCHIYA T. and NAKAMURA A. A sensitive mouse lymph node assay with two application phases for detection of contact allergens. Arch. Toxico/., 67, pp. 629-636, 1993
[73] IKARASHI Y., TSUCHIYA T. and NAKAMURA A. Application of sensitive mouse lymph node assay for detection of contact sensitization capacity of dyes. J. App/. Toxicol., 16, pp. 349-354, 1996
[74] IKARASHI Y., TSUKAMOTO Y., TSUCHIYA T. et al. Influence of irritants on lymph node cell proliferation and the detection of contact sensitivity to metal salts in the murine local lymph node assay. Contact Dermatitis, 29, pp. 128-132, 1993,
[75] KIMBER I. and BASKETIER D.A. The murine local lymph node assay: a commentary on collaborative studies and new directions. Food Chem. Toxicol., 30, pp. 165-169, 1992
[76] KIMBER I., HILTON J., DEARMAN RJ. et a/. An international evaluation of the murine local lymph node assay and comparison of modified procedures. Toxico/., 103, pp: 63-73, 1995
[77] LEA L.J., WARBRICK E.V., DEARMAN RJ. et a/. The impact of vehicle on assessment of relative skin sensitization potency or 1,4-dihydroquinone in the local lymph node assay. Am. J. Contact Dermatitis, 10, pp. 213-218.1999
[78] LOVELESS S. E., LADICS G.S., GERBERICK G.F. et al. Further evaluation of the local lymph node assay in the final phase of an international collaborative trial. Toxico/., 108, pp. 141-52, 1996
[79] MONTELIUS J., WAHLKVIST H., BoMAN A. et a/. Experience with the murine local lymph node assay: inability to discriminate between allergens and irritants. Acta Derm. Venerea/., 74, pp. 22-27, 1994
[80] ROBERTS D.W. Structure-activity relationships of skin sensitization potential of diacrylates and dimethacrylates. Contact Dermatitis, 17, pp. 281-289, 1987
[81] VIAL T., CARLEER J., LEGRAIN B. at al. The popliteal lymph node assay: results of a preliminary interlaboratory validation study. Toxico/., 122, pp. 213-218, 1997
[82] Warbrick E.V., Dearman R.J., Lea L.J., et al. Local lymph node assay responses to paraphenyl lenediamine: intra- and inter-laboratory evaluations. J. Appl. Toxicol., 19,pp. 225-260. 1999
[83] Organiztion for Economic Cooperation and Development, Guideline for the testing of chemicals No. 429, Skin sensitisation: Local lymph node assay, OECD Publication, 2002
MỤC LỤC
Lời nói đầu
Lời giới thiệu
1. Phạm vi áp dụng
2. Tài liệu viện dẫn
3. Thuật ngữ và định nghĩa
4. Các nguyên tắc chung - Các bước tiếp cận
5. Xem xét trước khi thử
5.1. Quy định chung
5.2. Loại vật liệu
5.3. Thông tin về thành phần hóa học
5.4. Đặc trưng vật liệu
6. Các phép thử kích thích
6.1. Phép thử kích thích in vitro
6.2. Yếu tố được xem xét khi thiết kế và lựa chọn các phép thử in vivo
6.3. Phép thử kích thích da động vật
6.4. Phép thử kích thích da người
7. Phép thử quá mẫn muộn
7.1. Chọn phép thử
7.2. Chọn nồng độ mẫu thử
7.3. Các nhân tố quan trọng khác tác động đến kết quả thử
7.4. Phép thử cực đại hóa hóa đối với quá mẫn muộn
7.5. Phép thử miếng gạc đóng cho quá mẫn muộn
8. Các nhân tố quan trọng để giải thích kết quả thử
Phụ lục A (quy định) Chuẩn bị vật liệu thử nghiệm kích thích/gây mẫn cảm
Phụ lục B (quy định) Phép thử kích thích đặc biệt
Phụ lục C (tham khảo) Thông tin cơ sở
Thư mục tài liệu tham khảo
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 7391-10:2007 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 7391-10:2007 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 7391-10:2007 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 7391-10:2007 DOC (Bản Word)