- Tổng quan
- Nội dung
- VB gốc
- Tiếng Anh
- Hiệu lực
- VB liên quan
- Lược đồ
-
Nội dung hợp nhất
Tính năng này chỉ có tại LuatVietnam.vn. Nội dung hợp nhất tổng hợp lại tất cả các quy định còn hiệu lực của văn bản gốc và các văn bản sửa đổi, bổ sung, đính chính... trên một trang. Việc hợp nhất văn bản gốc và những văn bản, Thông tư, Nghị định hướng dẫn khác không làm thay đổi thứ tự điều khoản, nội dung.
Khách hàng chỉ cần xem Nội dung hợp nhất là có thể nắm bắt toàn bộ quy định hiện hành đang áp dụng, cho dù văn bản gốc đã qua nhiều lần chỉnh sửa, bổ sung.
- Tải về
Văn bản hợp nhất 03/VBHN-BYT năm 2016 do Bộ Y tế ban hành hợp nhất Thông tư về việc hướng dẫn hoạt động xuất khẩu, nhập khẩu thuốc và bao bì tiếp xúc trực tiếp với thuốc
| Số hiệu: | 03/VBHN-BYT | Ngày ký xác thực: | 24/05/2016 |
| Loại văn bản: | Văn bản hợp nhất | Cơ quan hợp nhất: | Bộ Y tế |
|
Ngày đăng công báo:
|
Đang cập nhật |
Người ký:
|
Phạm Lê Tuấn |
|
Số công báo:
Số công báo là mã số ấn phẩm được đăng chính thức trên ấn phẩm thông tin của Nhà nước. Mã số này do Chính phủ thống nhất quản lý.
|
Đang cập nhật |
Ngày hết hiệu lực:
Ngày hết hiệu lực là ngày, tháng, năm văn bản chính thức không còn hiệu lực (áp dụng).
|
Đang cập nhật |
TÓM TẮT VĂN BẢN HỢP NHẤT 03/VBHN-BYT
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
|
| CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
THÔNG TƯ
Hướng dẫn hoạt động xuất khẩu, nhập khẩu thuốc
và bao bì tiếp xúc trực tiếp với thuốc
_________
Thông tư số 47/2010/TT-BYT ngày 29 tháng 12 năm 2010 của Bộ trưởng Bộ Y tế hướng dẫn hoạt động xuất khẩu, nhập khẩu thuốc và bao bì tiếp xúc trực tiếp với thuốc được sửa đổi, bổ sung bởi các thông tư sau:
1. Thông tư số 45/2011/TT-BYT ngày 21 tháng 12 năm 2011 của Bộ trưởng Bộ Y tế sửa đổi, bổ sung một số điều của Quyết định số 1570/2000/QĐ-BYT ngày 22/5/2000 của Bộ trưởng Bộ Y tế về việc triển khai áp dụng nguyên tắc “Thực hành tốt phòng kiểm nghiệm thuốc”; Quyết định số 2701/2001/QĐ-BYT ngày 29/6/2001 của Bộ trưởng Bộ Y tế về việc triển khai áp dụng nguyên tắc “Thực hành tốt bảo quản thuốc”; Thông tư số 06/2004/TT-BYT ngày 28/5/2004 hướng dẫn sản xuất gia công thuốc; Quyết định 3886/2004/QĐ-BYT ngày 13/11/2004 của Bộ Y tế về việc triển khai áp dụng nguyên tắc, tiêu chuẩn “Thực hành tốt sản xuất thuốc” theo khuyến cáo của Tổ chức Y tế thế giới; Thông tư số 13/2009/TT-BYT ngày 01/9/2009 của Bộ Y tế hướng dẫn hoạt động thông tin quảng cáo thuốc; Thông tư số 22/2009/TT-BYT ngày 24/11/2009 của Bộ Y tế quy định về đăng ký thuốc; Thông tư số 47/2010/TT-BYT ngày 29/12/2010 hướng dẫn hoạt động xuất khẩu, nhập khẩu thuốc và bao bì tiếp xúc trực tiếp với thuốc (sau đây gọi tắt là Thông tư số 45/2011/TT-BYT), có hiệu lực kể từ ngày 05 tháng 02 năm 2012.
2. Thông tư số 38/2013/TT-BYT ngày 15 tháng 11 năm 2013 của Bộ trưởng Bộ Y tế sửa đổi, bổ sung một số điều của Thông tư số 47/2010/TT-BYT ngày 29 ngày 12 năm 2010 của Bộ trưởng Bộ Y tế hướng dẫn hoạt động xuất khẩu, nhập khẩu thuốc và bao bì tiếp xúc trực tiếp với thuốc (sau đây viết tắt là Thông tư số 38/2013/TT-BYT), có hiệu lực kể từ ngày 01 tháng 01 năm 2014.
3. Thông tư số 13/2015/TT-BYT ngày 28 tháng 05 năm 2015 của Bộ trưởng Bộ Y tế sửa đổi Khoản 2 Điều 21 Thông tư số 47/2010/TT-BYT ngày 29 ngày 12 năm 2010 của Bộ trưởng Bộ Y tế hướng dẫn hoạt động xuất khẩu, nhập khẩu thuốc và bao bì tiếp xúc trực tiếp với thuốc (sau đây viết tắt là Thông tư số 13/2015/TT-BYT), có hiệu lực kể từ ngày 15 tháng 07 năm 2015.
Căn cứ Luật Dược số 34/2005/QH11 ngày 14 tháng 06 năm 2005;
Căn cứ Luật Phòng, chống ma túy số 23/2000/QH10 ngày 09 tháng 12 năm 2000 và Luật sửa đổi, bổ sung một số điều của Luật Phòng, chống ma tuý số 16/2008/QH12 ngày 03 tháng 06 năm 2008;
Căn cứ Nghị định số 188/2007/NĐ-CP ngày 27 tháng 12 năm 2007 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Căn cứ Nghị định số 79/2006/NĐ- CP ngày 09 tháng 08 năm 2006 của Chính phủ quy định chi tiết thi hành một số điều của Luật Dược;
Căn cứ Nghị định số 58/2003/NĐ-CP ngày 29 tháng 5 năm 2003 quy định về kiểm soát nhập khẩu, xuất khẩu, vận chuyển quá cảnh lãnh thổ Việt Nam chất ma tuý, tiền chất, thuốc gây nghiện, thuốc hướng tâm thần;
Căn cứ Nghị định số 12/2006/NĐ-CP ngày 23 tháng 01 năm 2006 của Chính phủ quy định chi tiết thi hành Luật Thương mại về hoạt động mua bán hàng hóa quốc tế và các hoạt động đại lý mua, bán, gia công và quá cảnh hàng hóa với nước ngoài;
Căn cứ Quyết định số 151/2007/QĐ-TTg ngày 12 tháng 9 năm 2007 của Thủ tướng Chính phủ ban hành quy định về việc nhập khẩu thuốc chưa có số đăng ký tại Việt Nam;
Bộ trưởng Bộ Y tế ban hành Thông tư hướng dẫn hoạt động xuất khẩu, nhập khẩu thuốc và bao bì tiếp xúc trực tiếp với thuốc như sau.[1]
Chương I. NHỮNG QUY ĐỊNH CHUNG
Điều 1. Phạm vi điều chỉnh
1. Thông tư này hướng dẫn hoạt động xuất khẩu, nhập khẩu thuốc và bao bì tiếp xúc trực tiếp với thuốc.
2. Thuốc xuất khẩu, nhập khẩu theo đường phi mậu dịch để chữa bệnh cho bản thân và cho gia đình không thuộc phạm vi điều chỉnh của Thông tư này.
Điều 2. Giải thích từ ngữ
Trong Thông tư này, các từ ngữ dưới đây được hiểu như sau:
1. Nước xuất xứ là nước sản xuất dạng bào chế cuối cùng và/hoặc xuất xưởng lô hoặc nước nơi sản phẩm được vận chuyển đến nước nhập khẩu.
2. Cơ sở sản xuất là cơ sở thực hiện ít nhất một công đoạn sản xuất và/hoặc xuất xưởng thành phẩm.
3. Bao bì thương phẩm của thuốc là bao bì chứa đựng thuốc và lưu thông cùng với thuốc. Bao bì thương phẩm của thuốc gồm hai loại:
- Bao bì trực tiếp là bao bì chứa đựng tiếp xúc trực tiếp với thuốc;
- Bao bì ngoài là bao bì dùng để bao gói một hoặc một số đơn vị thuốc có bao bì trực tiếp.
4. Chất phóng xạ là chất phát ra bức xạ do quá trình phân rã hạt nhân, chuyển mức năng lượng hạt nhân, có hoạt độ phóng xạ riêng hoặc tổng hoạt độ lớn hơn mức miễn trừ.
5. Dược chất phóng xạ là dược chất có chứa chất phóng xạ dùng cho việc chẩn đoán và điều trị bệnh.
6. Thuốc phóng xạ là thuốc có chứa một hoặc nhiều dược chất phóng xạ dùng để chẩn đoán hay điều trị bệnh.
7. Mức miễn trừ khai báo, cấp phép là mức hoạt độ phóng xạ mà từ mức đó trở xuống chất phóng xạ được coi là không nguy hại cho con người, môi trường.
Điều 3. Điều kiện và phạm vi của tổ chức, cá nhân tham gia xuất khẩu, nhập khẩu thuốc, bao bì tiếp xúc trực tiếp với thuốc
1. Đối với thương nhân là doanh nghiệp Việt Nam:
a) Doanh nghiệp có Giấy chứng nhận đủ điều kiện kinh doanh thuốc và có kho thuốc đạt tiêu chuẩn “Thực hành tốt bảo quản thuốc” (GSP) được nhập khẩu trực tiếp và nhận uỷ thác nhập khẩu thuốc thành phẩm, nguyên liệu làm thuốc, vắc xin, sinh phẩm y tế, thuốc từ dược liệu, thuốc đông y, thuốc phóng xạ được miễn trừ khai báo, cấp phép phù hợp với phạm vi kinh doanh ghi trong Giấy chứng nhận đủ điều kiện kinh doanh thuốc và giấy chứng nhận GSP;
b) Doanh nghiệp kinh doanh trang thiết bị y tế và Doanh nghiệp có Giấy chứng nhận đủ điều kiện kinh doanh thuốc được nhập khẩu trực tiếp và nhận uỷ thác nhập khẩu sinh phẩm chẩn đoán In Vitro;
c) Doanh nghiệp có Giấy chứng nhận đủ điều kiện kinh doanh thuốc và có giấy chứng nhận đạt tiêu chuẩn “Thực hành tốt sản xuất thuốc” (GMP) được nhập khẩu nguyên liệu để sản xuất thuốc của chính doanh nghiệp và bán cho các doanh nghiệp sản xuất thuốc khác;
d) Doanh nghiệp sản xuất có Giấy chứng nhận đủ điều kiện kinh doanh thuốc từ dược liệu được nhập khẩu dược liệu để phục vụ nhu cầu sản xuất của chính doanh nghiệp và bán cho các cơ sở sản xuất thuốc khác, các cơ sở khám chữa bệnh đông y;
đ) Doanh nghiệp có Giấy chứng nhận đủ điều kiện kinh doanh thuốc và có Giấy phép tiến hành các công việc bức xạ do cơ quan có thẩm quyền cấp còn hiệu lực được nhập khẩu trực tiếp thuốc phóng xạ không được miễn trừ khai báo, cấp phép.
2. Đối với thương nhân là doanh nghiệp có vốn đầu tư trực tiếp nước ngoài tại Việt Nam có Giấy chứng nhận đủ điều kiện kinh doanh thuốc (phạm vi sản xuất thuốc) được nhập khẩu nguyên liệu để phục vụ sản xuất thuốc của chính doanh nghiệp. Các hoạt động xuất khẩu, nhập khẩu thuốc không phục vụ sản xuất thuốc của doanh nghiệp sẽ được Bộ Y tế hướng dẫn tại văn bản khác.
3. Thương nhân Việt Nam có Giấy chứng nhận đủ điều kiện kinh doanh thuốc được xuất khẩu, ủy thác xuất khẩu, nhận ủy thác xuất khẩu thuốc, trừ thuốc gây nghiện, thuốc hướng tâm thần, tiền chất dùng làm thuốc và thuốc phóng xạ.
4. Thương nhân được phép ủy thác nhập khẩu thuốc theo đúng phạm vi hoạt động quy định tại Giấy chứng nhận đủ điều kiện kinh doanh thuốc, trừ thuốc gây nghiện, thuốc hướng tâm thần, tiền chất dùng làm thuốc và thuốc phóng xạ.
5. Các tổ chức, cá nhân không phải là thương nhân trên cơ sở hợp đồng được ký kết theo quy định của pháp luật, được ủy thác xuất khẩu, ủy thác nhập khẩu thuốc phục vụ nhu cầu sử dụng của chính tổ chức, cá nhân đó, trừ thuốc gây nghiện, thuốc hướng tâm thần, tiền chất dùng làm thuốc và thuốc phóng xạ.
6. Văn phòng đại diện của các thương nhân nước ngoài có Giấy phép hoạt động về thuốc và nguyên liệu làm thuốc tại Việt Nam, các thương nhân Việt Nam có Giấy chứng nhận đủ điều kiện kinh doanh thuốc được phép nhập khẩu thuốc phục vụ công tác đăng ký lưu hành (bao gồm cả các thuốc để kiểm nghiệm, kiểm định theo yêu cầu của việc đăng ký thuốc).
7. Các cơ sở có chức năng nghiên cứu, kiểm nghiệm, cơ sở sản xuất thuốc được phép nhập khẩu thuốc phục vụ công tác nghiên cứu, kiểm nghiệm.
8. Các cơ sở khám bệnh, chữa bệnh của các tỉnh, thành phố, y tế ngành và các tổ chức của Việt Nam (gọi tắt là bên Việt Nam) được phép nhận thuốc viện trợ từ các tổ chức từ thiện, tổ chức phi Chính phủ, cá nhân người nước ngoài, người Việt Nam ở nước ngoài (gọi tắt là bên nước ngoài) gửi tặng, viện trợ và chịu trách nhiệm về sử dụng thuốc hiệu quả an toàn, hợp lý, đúng mục đích viện trợ.
9. Tổ chức, cá nhân có thuốc thử lâm sàng được nhập khẩu thuốc để phục vụ việc thử lâm sàng theo đề cương nghiên cứu thử thuốc trên lâm sàng đã được Bộ Y tế phê duyệt.
10. Tổ chức, cá nhân có đề cương nghiên cứu sinh khả dụng, tương đương sinh học đã được phê duyệt tại cơ quan kỹ thuật chuyên ngành do Bộ Y tế ủy quyền được nhập khẩu thuốc để phục vụ việc nghiên cứu sinh khả dụng, tương đương sinh học.
11. Thương nhân được phép nhập khẩu, xuất khẩu bao bì tiếp xúc trực tiếp với thuốc.
12. Đối với thương nhân nước ngoài cung cấp thuốc vào Việt Nam:
a) Thương nhân nước ngoài cung cấp thuốc, dược liệu, thuốc từ dược liệu, thuốc đông y vào Việt Nam phải là doanh nghiệp có Giấy phép hoạt động về thuốc và nguyên liệu làm thuốc tại Việt Nam;
b) Thương nhân nước ngoài cung cấp tá dược, bao bì tiếp xúc trực tiếp với thuốc và các tổ chức, cá nhân quy định tại khoản 5, 6, 7, 8 và 9 Điều này không bắt buộc phải là các doanh nghiệp có Giấy phép hoạt động về thuốc và nguyên liệu làm thuốc tại Việt Nam;
c) Trường hợp các thuốc cần cho nhu cầu phòng, điều trị bệnh và nguyên liệu cần cho nhu cầu sản xuất thuốc trong nước nhưng các doanh nghiệp có Giấy phép hoạt động về thuốc và nguyên liệu làm thuốc tại Việt Nam không cung cấp hoặc cung cấp không đủ nhu cầu, Cục Quản lý Dược - Bộ Y tế xem xét, quyết định cho phép nhập khẩu từ các doanh nghiệp cung cấp thuốc có uy tín trên thế giới.
Điều 4. Quy định chung về nhập khẩu, xuất khẩu thuốc
1. Chất lượng thuốc, bao bì tiếp xúc trực tiếp với thuốc nhập khẩu
Thương nhân sản xuất, nhập khẩu, xuất khẩu, cung cấp, ủy thác, nhận ủy thác nhập khẩu, xuất khẩu thuốc, bao bì tiếp xúc trực tiếp với thuốc phải chịu trách nhiệm về chất lượng, an toàn của thuốc nhập khẩu theo quy định của Luật Dược, Luật Thương mại và các quy định khác về quản lý chất lượng thuốc hiện hành.
2. Hạn dùng của thuốc nhập khẩu:
a) Thuốc thành phẩm nhập khẩu vào Việt Nam có hạn dùng trên 24 tháng thì hạn dùng còn lại tối thiểu phải là 18 tháng kể từ ngày đến cảng Việt Nam. Đối với thuốc có hạn dùng bằng hoặc dưới 24 tháng thì hạn dùng phải còn tối thiểu là 12 tháng kể từ ngày đến cảng Việt Nam;
b) Vắc xin, sinh phẩm y tế chưa có số đăng ký, khi nhập khẩu vào Việt Nam phải có hạn dùng còn lại ít nhất là 2/3 hạn dùng kể từ ngày đến cảng Việt Nam;
c) Vắc xin, sinh phẩm y tế có số đăng ký lưu hành còn hiệu lực tại Việt Nam, khi nhập khẩu vào Việt Nam phải có hạn dùng còn lại ít nhất là 1/2 hạn dùng kể từ ngày đến cảng Việt Nam;
d) Sinh phẩm chẩn đoán bệnh In Vitro có hạn dùng bằng hoặc dưới 12 tháng nhập khẩu vào Việt Nam hạn dùng phải còn lại ít nhất 03 tháng kể từ ngày đến cảng Việt Nam;
đ) Nguyên liệu làm thuốc nhập khẩu vào Việt Nam, trừ dược liệu, phải có hạn dùng còn lại trên 36 tháng kể từ ngày đến cảng Việt Nam, đối với nguyên liệu có hạn dùng bằng hoặc dưới 36 tháng thì ngày hàng về đến cảng Việt Nam không được quá 06 tháng kể từ ngày sản xuất;
e)[2] Thuốc viện trợ, viện trợ nhân đạo, thuốc hiếm, thuốc cho nhu cầu điều trị của bệnh viện có hạn dùng lớn hơn hoặc bằng 24 tháng, hạn dùng còn lại của thuốc phải còn tối thiểu 12 tháng kể từ ngày đến cảng Việt Nam. Trường hợp thuốc có hạn dùng dưới 24 tháng thì hạn dùng còn lại kể từ ngày đến cảng Việt Nam tối thiểu phải bằng 1/3 hạn dùng của thuốc;”
g) Các thuốc, nguyên liệu làm thuốc không đáp ứng các quy định về hạn dùng của thuốc tại các điểm a, b, c, d, đ khoản này nhưng đảm bảo chất lượng và cần thiết nhập khẩu để phục vụ nhu cầu điều trị, nhu cầu sản xuất thuốc trong nước, Cục Quản lý dược- Bộ Y tế xem xét, quyết định và chịu trách nhiệm cho phép nhập khẩu.
3.[3] Yêu cầu đối với phiếu kiểm nghiệm:
Khi làm thủ tục thông quan, doanh nghiệp nhập khẩu thuốc, bao bì tiếp xúc trực tiếp với thuốc phải xuất trình Hải quan cửa khẩu bản chính phiếu kiểm nghiệm của cơ sở sản xuất chứng nhận đạt tiêu chuẩn chất lượng cho từng lô thuốc nhập khẩu của nhà sản xuất trừ dược liệu và các thuốc quy định tại Điều 12, 13, 14, 15, 17 và 18 của Thông tư này.
Trường hợp từ 02 cơ sở trở lên tham gia sản xuất thuốc thì chấp nhận bản chính phiếu kiểm nghiệm của cơ sở sản xuất hoặc phiếu kiểm nghiệm của cơ sở đóng gói cuối cùng hoặc của cơ sở chịu trách nhiệm xuất xưởng.
Hải quan cửa khẩu lưu bản sao phiếu kiểm nghiệm có đóng dấu xác nhận của doanh nghiệp nhập khẩu.
4. Quyền sở hữu trí tuệ về thuốc, bao bì tiếp xúc trực tiếp với thuốc:
Thương nhân sản xuất, nhập khẩu, xuất khẩu, cung cấp, ủy thác, nhận ủy thác nhập khẩu, xuất khẩu thuốc, bao bì tiếp xúc trực tiếp với thuốc phải chịu trách nhiệm về quyền sở hữu trí tuệ của thuốc, bao bì tiếp xúc trực tiếp với thuốc do chính cơ sở sản xuất, nhập khẩu, xuất khẩu, cung cấp, ủy thác nhập khẩu, xuất khẩu.
5. Kiểm định, thử thuốc trên lâm sàng đối với vắc xin, sinh phẩm y tế là huyết thanh có chứa các kháng thể nhập khẩu:
a) Đối với vắc xin, sinh phẩm y tế là huyết thanh có chứa các kháng thể dùng để phòng bệnh và chữa bệnh có số đăng ký hoặc chưa có số đăng ký lưu hành tại Việt Nam nhập khẩu sau khi thông quan được đưa về kho của doanh nghiệp bảo quản theo qui định và chỉ được phép đưa ra sử dụng khi có văn bản của Viện Kiểm định quốc gia Vắc xin và Sinh phẩm y tế xác nhận lô vắc xin, huyết thanh có chứa các kháng thể dùng để phòng bệnh và chữa bệnh nhập khẩu đạt tiêu chuẩn chất lượng và an toàn trên động vật thí nghiệm.
b) Đối với vắc xin, sinh phẩm y tế là huyết thanh có chứa các kháng thể dùng để phòng bệnh và chữa bệnh chưa có số đăng ký nhập khẩu dùng cho các chương trình, dự án quốc gia phải thực hiện thử thuốc trên lâm sàng theo quy định tại Quyết định số 01/2007/QĐ-BYT ngày 11/01/2007 của Bộ trưởng Bộ Y tế quy định về thử thuốc trên lâm sàng.
Riêng đối với vắc xin, sinh phẩm y tế là huyết thanh có chứa các kháng thể dùng để phòng bệnh và chữa bệnh chưa có số đăng ký lưu hành nhưng đã được Tổ chức y tế thế giới (WHO) tiền kiểm định và đã được lưu hành rộng rãi trên thế giới do các tổ chức quốc tế đã thường xuyên hợp tác với Việt Nam trong lĩnh vực y tế như WHO, UNICEF... viện trợ cho Việt Nam, tùy từng trường hợp cụ thể, Cục Quản lý Dược – Bộ Y tế yêu cầu bằng chứng thực hiện dây chuyền lạnh và có kết quả đạt yêu cầu về thử nghiệm an toàn trên người ở thực địa mới được phép đưa vào sử dụng.
c) Đối với vắc xin, sinh phẩm y tế là huyết thanh có chứa kháng thể dùng để phòng bệnh và chữa bệnh được nhập khẩu theo quy định tại Điều 13, 14, 15 và 16 Thông tư này, trường hợp cần thiết, Cục Quản lý Dược - Bộ Y tế sẽ yêu cầu thử nghiệm an toàn trên người ở thực địa và sau khi có kết quả đạt yêu cầu về thử nghiệm an toàn trên người ở thực địa mới được phép đưa vào sử dụng.
6. Nhãn thuốc nhập khẩu:
Nhãn thuốc nhập khẩu phải thực hiện theo đúng quy định tại Nghị định số 89/2006/NĐ-CP ngày 30/9/2006 của Chính phủ về nhãn hàng hóa, các quy định tại Thông tư số 04/2008/TT-BYT ngày 12/05/2008 của Bộ trưởng Bộ Y tế về hướng dẫn ghi nhãn thuốc trừ nhãn của các thuốc quy định tại Điều 12, 13, 14, 15, 16, 17 và 18 của Thông tư này.
7. Kê khai, kê khai lại giá thuốc:
Việc kê khai, kê khai lại giá thuốc nhập khẩu thực hiện theo quy định tại Thông tư liên tịch số 11/2007/TTLT-BYT-BTC-BCT ngày 31/8/2007 của Bộ Y tế - Bộ Tài chính - Bộ Công Thương hướng dẫn thực hiện quản lý nhà nước về giá thuốc dùng cho người.
8. Báo cáo:
a) Trong vòng 10 ngày kể từ khi vắc xin, sinh phẩm y tế là huyết thanh có chứa các kháng thể được nhập khẩu về kho, doanh nghiệp nhập khẩu gửi báo cáo nhập khẩu đối với từng lô hàng nhập về Cục Quản lý dược- Bộ Y tế và Viện Kiểm định Quốc gia Vắc xin và sinh phẩm y tế (Mẫu số 1a).
b) Doanh nghiệp nhập khẩu phải báo cáo về Cục Quản lý dược- Bộ Y tế tình hình xuất, nhập khẩu thuốc định kỳ hàng tháng bằng file điện tử tới hộp thư [email protected] trước ngày 10 tháng sau; báo cáo 06 tháng bằng văn bản trước ngày 10 tháng 7 và báo cáo cả năm trước ngày 10 tháng 01 của năm sau. (Mẫu số 1b1 đến b13).
c) Doanh nghiệp nhập khẩu thuốc để tham gia trưng bày, triển lãm hội chợ và các trường hợp tạm nhập, tái xuất khác: trong thời hạn 10 ngày sau khi kết thúc hoạt động trưng bày, triển lãm hội chợ hoặc hết hạn tạm nhập phải tái xuất và phải có văn bản báo cáo Cục Quản lý dược- Bộ Y tế về số lượng và tình hình tái xuất (Mẫu số 1c)
9. Lệ phí:
Doanh nghiệp nhập khẩu thuốc phải nộp lệ phí theo quy định tại Quyết định số 44/2005/QĐ-BTC ngày 12/07/2005 của Bộ trưởng Bộ Tài chính quy định chế độ thu, nộp, quản lý và sử dụng phí thẩm định kinh doanh thương mại có điều kiện thuộc lĩnh vực y tế, phí thẩm định tiêu chuẩn và điều kiện hành nghề y dược, lệ phí cấp giấy phép xuất, nhập khẩu và cấp chứng chỉ hành nghề y, dược; Quyết định số 59/2008/QĐ-BTC ngày 21/07/2008 về việc sửa đổi, bổ sung Quyết định số 44/2005/QĐ-BTC ngày 12/07/2005 của Bộ trưởng Bộ Tài chính quy định chế độ thu, nộp, quản lý và sử dụng phí thẩm định kinh doanh thương mại có điều kiện thuộc lĩnh vực y tế, phí thẩm định tiêu chuẩn và điều kiện hành nghề y dược, lệ phí cấp giấy phép xuất, nhập khẩu và cấp chứng chỉ hành nghề y, dược và các văn bản pháp luật khác có liên quan.
10. Thời hạn hiệu lực của giấy phép nhập khẩu, xuất khẩu thuốc:
Giấy phép nhập khẩu, xuất khẩu thuốc có giá trị 01 năm kể từ ngày ký.
11. Hồ sơ pháp lý trong hồ sơ nhập khẩu thuốc:
a) Giấy chứng nhận sản phẩm dược phẩm (CPP), giấy chứng nhận lưu hành tự do (FSC), giấy chứng nhận đạt tiêu chuẩn thực hành tốt sản xuất thuốc (GMP) hoặc các giấy chứng nhận đạt tiêu chuẩn tương đương đối với sinh phẩm chẩn đoán In Vitro có thể nộp bản chính hoặc bản sao hoặc bản dịch tiếng Việt từ tiếng nước ngoài nhưng phải đáp ứng các quy định cụ thể đối với từng loại giấy chứng nhận quy định tại điểm b, điểm c hoặc điểm d khoản này và các quy định chung như sau:
- Trường hợp nộp bản chính: Bản chính phải có đầy đủ chữ ký trực tiếp, họ tên, chức danh, ghi rõ ngày cấp và dấu xác nhận của cơ quan có thẩm quyền nước sở tại cấp giấy chứng nhận; phải được hợp pháp hóa lãnh sự tại cơ quan đại diện ngoại giao Việt Nam theo quy định của pháp luật về hợp pháp hóa lãnh sự, trừ trường hợp các giấy tờ pháp lý do cơ quan có thẩm quyền của nước đã ký kết Hiệp định tương trợ tư pháp với Việt Nam cấp;
- Trường hợp nộp bản sao: Bản sao do cơ quan có thẩm quyền của Việt Nam chứng thực hợp lệ theo quy định của pháp luật Việt Nam về chứng thực bản sao từ bản chính;
- Trường hợp nộp bản dịch tiếng Việt từ tiếng nước ngoài: bản dịch tiếng Việt phải có công chứng theo quy định (công chứng ở đây được hiểu là phải được cơ quan công chứng địa phương hoặc cơ quan đại diện ngoại giao, cơ quan lãnh sự hoặc cơ quan khác được uỷ quyền của nước ngoài chứng nhận chữ ký của người dịch theo quy định của pháp luật) và phải nộp kèm theo bản chính hoặc bản sao giấy chứng nhận theo quy định nêu trên;
- Thời hạn hiệu lực của các giấy chứng nhận: thời hạn hiệu lực phải được ghi cụ thể trên các giấy chứng nhận và phải còn hiệu lực tại thời điểm thẩm định; không chấp nhận công văn gia hạn giấy chứng nhận này. Trường hợp giấy chứng nhận này không ghi rõ thời hạn hiệu lực, chỉ chấp nhận các giấy chứng nhận được cấp trong thời gian 24 tháng kể từ ngày cấp.
b) Giấy chứng nhận sản phẩm dược ngoài việc đáp ứng các quy định tại điểm a khoản này còn phải đáp ứng các quy định sau:
- Phải có xác nhận thuốc được phép lưu hành ở nước xuất xứ, trường hợp thuốc không lưu hành ở nước xuất xứ, Công ty cung cấp phải có giải trình lý do để Cục Quản lý dược- Bộ Y tế xem xét;
- Trường hợp thuốc được sản xuất qua nhiều công đoạn ở các nước khác nhau, không thể xác định được nước xuất xứ duy nhất, cơ sở nhập khẩu thuốc phải nộp CPP của nước sản xuất ra dạng bào chế cuối cùng hoặc CPP của nước xuất xưởng lô. Trường hợp không có CPP của cả hai nước xuất xứ nêu trên, Cục Quản lý dược- Bộ Y tế sẽ xem xét chấp nhận CPP của nước nơi sản phẩm được vận chuyển đến nước nhập khẩu;
- Trường hợp không có CPP của các nước xuất xứ nêu trên, chỉ chấp nhận CPP của thuốc đó do cơ quan có thẩm quyền của một trong các nước Anh, Pháp, Đức, Mỹ, Nhật Bản, Úc, Canada hoặc của cơ quan thẩm định, đánh giá các sản phẩm y tế của Châu Âu - EMEA cấp;
- Do cơ quan quản lý dược có thẩm quyền (theo danh sách của WHO trên website http://www.who.int) của nước xuất xứ ban hành; cấp theo mẫu của WHO áp dụng đối với Hệ thống chứng nhận chất lượng của các sản phẩm dược lưu hành trong thương mại quốc tế.
c) Giấy chứng nhận lưu hành tự do ngoài việc đáp ứng các quy định tại điểm a khoản này còn phải đáp ứng các quy định sau:
- Phải có xác nhận thuốc được phép lưu hành ở nước xuất xứ, trường hợp thuốc không lưu hành ở nước xuất xứ, Công ty cung cấp phải có giải trình lý do để Cục Quản lý dược- Bộ Y tế xem xét;
- Do cơ quan có thẩm quyền ở nước xuất xứ cấp, có đủ các thông tin về thành phần, hàm lượng, dạng bào chế và thời hạn hiệu lực của chứng nhận.
d) Giấy chứng nhận đạt tiêu chuẩn thực hành tốt sản xuất thuốc, hoặc các giấy chứng nhận đạt hệ thống quản lý chất lượng khác (ví dụ ISO 9001…) và phải do cơ quan có thẩm quyền ở nước xuất xứ cấp, có xác nhận tên và địa chỉ nhà sản xuất.
Điều 5. Quy định về lập đơn hàng, ngôn ngữ và hình thức hồ sơ
1. Đơn hàng nhập khẩu, xuất khẩu thuốc, bao bì tiếp xúc trực tiếp với thuốc được lập thành 03 bản theo mẫu phù hợp với từng loại thuốc theo quy định tại Thông tư này. Sau khi được phê duyệt, 02 bản lưu tại Cục Quản lý dược- Bộ Y tế, 01 bản gửi doanh nghiệp nhập khẩu, xuất khẩu thuốc. Bản gửi doanh nghiệp nhập khẩu, xuất khẩu thuốc có đóng dấu "Bản gửi doanh nghiệp" làm thủ tục tại Hải quan cửa khẩu. Đơn hàng nhập khẩu, xuất khẩu thuốc gây nghiện, hướng tâm thần, tiền chất dùng làm thuốc kể cả dạng đơn chất hoặc phối hợp đã có số đăng ký lưu hành còn hiệu lực được lập thành 02 bản.
2. Trường hợp doanh nghiệp nhận ủy thác nhập khẩu, xuất khẩu thuốc, phải ghi rõ tên công ty ủy thác nhập khẩu, xuất khẩu thuốc trên đơn hàng.
3. Hồ sơ, tài liệu kèm theo đơn hàng phải được chuẩn bị trên khổ giấy A4, đóng thành 01 bộ chắc chắn. Hồ sơ phải được sắp xếp theo đúng trình tự của mục lục, có phân cách giữa các phần. Các phần phân cách phải được đánh số thứ tự để dễ tham khảo và được đóng dấu xác nhận của doanh nghiệp nhập khẩu ở trang đầu tiên của mỗi phần trong toàn bộ hồ sơ và có trang bìa ghi rõ: tên đơn vị nhập khẩu, số đơn hàng, ngày lập đơn hàng, loại đơn hàng.
4. Ngôn ngữ sử dụng trong hồ sơ nhập khẩu thuốc:
Hồ sơ nhập khẩu thuốc nước ngoài phải viết bằng tiếng Việt hoặc tiếng Anh. Trường hợp hồ sơ viết bằng tiếng Anh, các thông tin trong Tờ hướng dẫn sử dụng thuốc phải viết bằng tiếng Việt, trừ các nội dung sau được phép ghi bằng các ngôn ngữ khác có gốc chữ cái La-tinh:
a) Tên biệt dược, tên gốc hoặc tên chung quốc tế của thuốc;
b) Tên chung quốc tế hoặc tên khoa học của thành phần, thành phần định lượng của thuốc trong trường hợp không dịch được ra tiếng Việt hoặc dịch được ra tiếng Việt nhưng không có nghĩa;
c) Tên và địa chỉ doanh nghiệp nước ngoài sản xuất, nhượng quyền sản xuất thuốc.
5. Đối với thuốc thành phẩm chưa có số đăng ký nhập khẩu theo quy định tại Điều 11 Thông tư này, mỗi thuốc phải lập thành một đơn hàng riêng, trừ trường hợp thuốc có chung tất cả các yếu tố sau có thể xin nhập khẩu trong cùng một hồ sơ:
a) Tên thuốc;
b) Dạng bào chế;
c) Công thức cho một đơn vị liều (đối với dạng thuốc đơn liều) hoặc cùng nồng độ hàm lượng (đối với thuốc đa liều);
d) Nhà sản xuất;
Điều 6. Một số quy định khác
1. Thuốc nhập khẩu lưu hành trên thị trường phải đáp ứng quy định tại khoản 1 Điều 36 Luật Dược.
2. Thuốc nhập khẩu phục vụ cho các dự án, chương trình mục tiêu y tế quốc gia, thuốc viện trợ, viện trợ nhân đạo; thuốc nhập khẩu cho mục đích thử lâm sàng, làm mẫu đăng ký, phục vụ công tác nghiên cứu, kiểm nghiệm, kiểm định; thuốc nhập khẩu để tham gia trưng bày, triển lãm hội chợ phải được sử dụng đúng mục đích, đúng đối tượng và không được phép lưu hành trên thị trường.
3. Thuốc viện trợ do các tổ chức, cá nhân quy định tại khoản 8 Điều 3 của Thông tư này nhập khẩu, sau khi tiếp nhận đơn vị tiếp nhận phải thành lập Hội đồng để kiểm kê, đánh giá, phân loại thuốc và nhập kho để quản lý. Chỉ được phép đưa những thuốc đảm bảo chất lượng, còn hạn dùng vào sử dụng cho công tác điều trị. Đối với những thuốc không được phép sử dụng, phải thành lập Hội đồng để tiến hành hủy thuốc theo quy định tại Thông tư số 09/2010/TT- BYT ngày 28 tháng 4 năm 2010 về Quản lý chất lượng, đảm bảo không gây ô nhiễm môi trường.
Thủ trưởng các đơn vị tiếp nhận thuốc viện trợ phải hoàn toàn chịu trách nhiệm về chất lượng thuốc, sử dụng thuốc hiệu quả, hợp lý và an toàn.
4. Thuốc viện trợ, viện trợ nhân đạo phải đảm bảo các yêu cầu sau:
a) Phải được phép lưu hành ở nước sở tại. Đối với vắc xin, sinh phẩm y tế là huyết thanh có chứa kháng thể phải thuộc danh mục vắc xin, sinh phẩm y tế đã được Tổ chức Y tế khuyến cáo sử dụng;
b) Phải đáp ứng đúng những yêu cầu sử dụng thực tế của đơn vị nhận viện trợ và chính sách quốc gia về thuốc của Việt Nam;
c) Không thuộc danh mục thuốc gây nghiện, danh mục nguyên liệu và thuốc thành phẩm cấm nhập khẩu để làm thuốc dùng cho người (trừ trường hợp nhập khẩu thuốc phục vụ chương trình, dự án quốc gia đã được Chính phủ phê duyệt);
d) Phải có nguồn gốc rõ ràng và bảo đảm các tiêu chuẩn về chất lượng, an toàn, hiệu quả sử dụng ở cả nước viện trợ và Việt Nam. Vắc xin, sinh phẩm y tế viện trợ phải có phiếu kiểm nghiệm đạt tiêu chuẩn chất lượng của cơ quan kiểm định quốc gia nước sở tại hoặc cơ quan có thẩm quyền đối với lô hàng nhập khẩu, đồng thời phải được Viện Kiểm định quốc gia vắc xin và sinh phẩm y tế đánh giá chất lượng trước khi nhập khẩu;
đ) Phải được đóng gói trong đồ bao gói thích hợp, có ghi rõ: tên thuốc, hoạt chất, hàm lượng, dạng bào chế, quy cách đóng gói, kèm theo hướng dẫn sử dụng thuốc và có danh mục chi tiết đi kèm theo từng đơn vị đóng gói
e) Trường hợp đặc biệt, thuốc viện trợ phục vụ cho các chương trình nghiên cứu không đáp ứng quy định tại điểm a, b, c, d và đ khoản này, có thể xem xét cho phép tiếp nhận căn cứ trên các tài liệu pháp lý, kỹ thuật liên quan của chương trình nghiên cứu.
5. Dược liệu sử dụng để sản xuất, pha chế và thuốc thang tại các cơ sở sản xuất thuốc, cơ sở khám chữa bệnh bằng đông y phục vụ cho công tác phòng và chữa bệnh cho người phải đạt tiêu chuẩn chất lượng và được cung cấp bởi các cơ sở có đủ điều kiện kinh doanh thuốc.
6. Thuốc phóng xạ, ngoài việc thực hiện các quy định của Thông tư này phải tuân theo các quy định của Pháp luật có liên quan đến việc đảm bảo an toàn bức xạ.
Chương II. HÌNH THỨC QUẢN LÝ NHẬP KHẨU, XUẤT KHẨU THUỐC VÀ BAO BÌ TIẾP XÚC TRỰC TIẾP VỚI THUỐC
Điều 7. Nhập khẩu thuốc, bao bì tiếp xúc trực tiếp với thuốc
1. Cấm nhập khẩu để làm thuốc dùng cho người các thuốc thành phẩm và nguyên liệu làm thuốc quy định tại Danh mục nguyên liệu và thuốc thành phẩm cấm nhập khẩu để làm thuốc (Phụ lục ).
2. Thuốc có số đăng ký lưu hành còn hiệu lực, trừ thuốc gây nghiện, hướng tâm thần và tiền chất dùng làm thuốc, được nhập khẩu theo nhu cầu không phải đề nghị cấp giấy phép nhập khẩu hoặc xác nhận đơn hàng nhập khẩu.
3. Thuốc, bao bì tiếp xúc trực tiếp với thuốc nhập khẩu phải có giấy phép nhập khẩu của Cục Quản lý dược- Bộ Y tế bao gồm:
a) Thuốc gây nghiện, hướng tâm thần, tiền chất dùng làm thuốc, kể cả dạng đơn chất hoặc phối hợp đã có số đăng ký lưu hành còn hiệu lực;
b) Thuốc thành phẩm, nguyên liệu làm thuốc, vắc xin, sinh phẩm y tế chưa có số đăng ký;
c) Bao bì tiếp xúc trực tiếp với thuốc.
Điều 8. Xuất khẩu thuốc, bao bì tiếp xúc trực tiếp với thuốc
1. Thuốc gây nghiện, hướng tâm thần, tiền chất dùng làm thuốc, kể cả dạng đơn chất hoặc phối hợp khi xuất khẩu phải có giấy phép xuất khẩu của Cục Quản lý dược - Bộ Y tế .
2. Thuốc, bao bì tiếp xúc trực tiếp với thuốc, trừ các thuốc quy định tại khoản 1 Điều này khi xuất khẩu đơn vị xuất khẩu làm thủ tục trực tiếp với Hải quan cửa khẩu không cần có giấy phép xuất khẩu của Bộ Y tế.
Chương III. HỒ SƠ, THỦ TỤC NHẬP KHẨU THUỐC, BAO BÌ TIẾP XÚC TRỰC TIẾP VỚI THUỐC, KIỂM ĐỊNH THUỐC NHẬP KHẨU
Mục 1. NHẬP KHẨU THUỐC CÓ SỐ ĐĂNG KÝ LƯU HÀNH CÒN HIỆU LỰC
Điều 9. Thuốc gây nghiện, hướng tâm thần và tiền chất dùng làm thuốc
1. Hồ sơ:
a) Đơn hàng nhập khẩu (Mẫu số 2a, 2b);
b) Báo cáo tồn kho thuốc gây nghiện (hoặc thuốc hướng tâm thần, tiền chất dùng làm thuốc) (Mẫu số 3).
2. Thủ tục:
Doanh nghiệp gửi hồ sơ đến Cục Quản lý dược- Bộ Y tế. Trong thời hạn 15 ngày làm việc kể từ khi nhận được hồ sơ hợp lệ, Cục Quản lý dược- Bộ Y tế cấp giấy phép nhập khẩu. Trường hợp không cấp giấy phép, Cục Quản lý dược- Bộ Y tế có văn bản trả lời doanh nghiệp và nêu rõ lý do.
Điều 10. Các thuốc khác, trừ các thuốc quy định tại Điều 9 của Thông tư này
Doanh nghiệp nhập khẩu làm thủ tục trực tiếp tại Hải quan cửa khẩu và xuất trình Hải quan cửa khẩu danh mục thuốc nhập khẩu (Mẫu số 4) kèm theo bản chính hoặc bản sao công chứng hợp lệ các tài liệu sau :
a) Giấy phép lưu hành sản phẩm hoặc Quyết định cấp số đăng ký lưu hành; các văn bản cho phép thay đổi, bổ sung, đính chính khác (nếu có);
b) Giấy phép hoạt động về thuốc và nguyên liệu làm thuốc tại Việt Nam đối với công ty nước ngoài cung cấp thuốc, trừ các thương nhân quy định tại điểm b, c khoản 12 Điều 3 của Thông tư này.
Mục 2. NHẬP KHẨU THUỐC CHƯA CÓ SỐ ĐĂNG KÝ LƯU HÀNH
Điều 11. Thuốc thành phẩm có chứa dược chất chưa có số đăng ký hoặc dược chất đã có số đăng ký nhưng chưa đáp ứng đủ nhu cầu điều trị, sinh phẩm y tế dùng để phòng bệnh, chữa bệnh, chẩn đoán
1. Điều kiện và số lượng thuốc xem xét cấp giấy phép nhập khẩu:
Thực hiện theo quy định tại Điều 7 Quyết định số 151/2007/QĐ-TTg ngày 12/9/2007 của Thủ tướng Chính phủ ban hành Quy định về việc nhập khẩu thuốc chưa có số đăng ký tại Việt Nam.
2. Hồ sơ:
a) Đơn hàng nhập khẩu (Mẫu số 5a, 5b, 5c, 5d, 5đ);
b) Giấy chứng nhận sản phẩm dược. Trường hợp không có Giấy chứng nhận sản phẩm dược, có thể thay thế bằng FSC và GMP. Trường hợp có nhiều cơ sở sản xuất tham gia vào quá trình sản xuất thuốc, cơ sở nhập khẩu thuốc phải nộp giấy chứng nhận GMP của tất cả các cơ sở sản xuất có tham gia trong quá trình sản xuất ra thành phẩm;
c) Tiêu chuẩn và phương pháp kiểm tra chất lượng thuốc;
d) Nhãn thuốc và tờ hướng dẫn sử dụng có đóng dấu của doanh nghiệp nhập khẩu, bao gồm: 01 bộ nhãn gốc kèm tờ hướng dẫn sử dụng gốc của thuốc đang được lưu hành thực tế ở nước xuất xứ (trừ vắc xin, sinh phẩm y tế); 02 bộ nhãn dự kiến lưu hành tại Việt Nam kèm tờ hướng dẫn sử dụng tiếng Việt;
đ) Báo cáo tồn kho đối với thuốc gây nghiện, hướng tâm thần và tiền chất dùng làm thuốc (Mẫu số 3);
e) Hồ sơ tiền lâm sàng và lâm sàng đối với thuốc chứa dược chất mới, thuốc có sự kết hợp mới của các dược chất đó lưu hành.
3. Thủ tục :
Doanh nghiệp gửi hồ sơ đến Cục Quản lý dược- Bộ Y tế. Trong thời hạn 20 ngày làm việc kể từ khi nhận được hồ sơ hợp lệ, Cục Quản lý dược- Bộ Y tế xem xét cấp giấy phép nhập khẩu. Trường hợp không cấp giấy phép, Cục Quản lý dược- Bộ Y tế có văn bản trả lời doanh nghiệp và nêu rõ lý do.
Điều 12. Thuốc hiếm, thuốc cho nhu cầu điều trị của bệnh viện trong trường hợp đặc biệt
1. Hồ sơ:
a) Đơn hàng nhập khẩu (Mẫu số 6a);
b) Dự trù thuốc hiếm, thuốc cho nhu cầu điều trị của bệnh viện trong trường hợp đặc biệt (Mẫu số 6b);
c) Các tài liệu quy định tại điểm b, c, d, đ, và e khoản 2 Điều 11, trừ các trường hợp sau:
- Doanh nghiệp tổ chức chuỗi nhà thuốc đạt tiêu chuẩn “Thực hành tốt nhà thuốc” GPP cần thiết nhập khẩu các thuốc thuộc danh mục thuốc hiếm, thuốc nhập khẩu cho nhu cầu điều trị của bệnh viện trong trường hợp đặc biệt để bán tại các nhà thuốc đạt GPP trong hệ thống: phải có văn bản nêu rõ lý do chưa cung cấp được hồ sơ, phiếu kiểm nghiệm gốc, và cam kết chịu trách nhiệm về đảm bảo chất lượng thuốc nhập khẩu;
- Doanh nghiệp nhập khẩu những thuốc thuộc danh mục thuốc hiếm, thuốc nhập khẩu cho nhu cầu điều trị của bệnh viện trong trường hợp đặc biệt hoặc những thuốc có hoạt chất, nồng độ, hàm lượng, dạng bào chế chưa có số đăng ký lưu hành tại Việt Nam nhưng được ghi trong các tài liệu chuyên môn mà không cung cấp được các hồ sơ quy định tại khoản 2 Điều 11 của Thông tư này và phiếu kiểm nghiệm gốc của lô thuốc nhập khẩu thì hồ sơ phải kèm theo: Văn bản nêu rõ lý do chưa cung cấp được hồ sơ của thuốc nhập khẩu, phiếu kiểm nghiệm gốc của lô thuốc và cam kết về đảm bảo chất lượng thuốc nhập khẩu; Báo cáo sử dụng thuốc (nhu cầu sử dụng, tính an toàn, hiệu quả điều trị của thuốc).
2.[4] Thủ tục:
Doanh nghiệp gửi hồ sơ đến Cục Quản lý dược- Bộ Y tế. Trong thời hạn 07 ngày làm việc kể từ khi nhận được hồ sơ hợp lệ, Cục Quản lý dược- Bộ Y tế xem xét cấp giấy phép nhập khẩu. Trường hợp không cấp giấy phép, Cục Quản lý dược- Bộ Y tế có văn bản trả lời doanh nghiệp và nêu rõ lý do.
Điều 13. Vắc xin, sinh phẩm y tế theo nhu cầu điều trị đặc biệt của cơ sở điều trị, cơ sở tiêm phòng và cơ sở xét nghiệm
1. Hồ sơ:
a) Đơn hàng nhập khẩu (Mẫu số 7a);
b) Dự trù vắc xin, sinh phẩm y tế của cơ sở tiêm phòng, cơ sở xét nghiệm (Mẫu số 7b);
d) Bản cam kết của công ty cung cấp về việc đảm bảo chất lượng vắc xin, sinh phẩm y tế cung cấp cho Việt Nam (Mẫu số 7c);
đ) Các tài liệu kèm theo (nếu có) bao gồm: Giấy chứng nhận cơ sở sản xuất đạt tiêu chuẩn GMP hoặc Giấy chứng nhận cơ sở sản xuất đạt tiêu chuẩn hệ thống quản lý chất lượng (ISO) do cơ quan có thẩm quyền cấp (đối với sinh phẩm chẩn đoán In Vitro), Giấy phép lưu hành vắc xin, sinh phẩm y tế, Giấy phép lưu hành tại một số nước khác mà vắc xin, sinh phẩm y tế đó đã được đăng ký và lưu hành. Trong trường hợp đặc biệt, công ty chưa cung cấp đủ các tài liệu này hoặc vắc xin, sinh phẩm y tế không đáp ứng quy định tại điểm b, c, và điểm d khoản 2 Điều 4 của Thông tư này nhưng cần thiết cho nhu cầu sử dụng, Cục Quản lý dược - Bộ Y tế xem xét, quyết định.
2. Thủ tục:
Doanh nghiệp gửi hồ sơ đến Cục Quản lý Dược - Bộ Y tế. Trong thời hạn 15 ngày làm việc kể từ khi nhận được hồ sơ hợp lệ, Cục Quản lý Dược- Bộ Y tế xem xét cấp giấy phép nhập khẩu và yêu cầu gửi hồ sơ, mẫu cho Viện Kiểm định Quốc gia Vắc xin và Sinh phẩm y tế đối với vắc xin, sinh phẩm y tế nhập khẩu trong trường hợp cần thiết.
Trường hợp không cấp giấy phép Cục Quản lý dược - Bộ Y tế có văn bản trả lời doanh nghiệp và nêu rõ lý do.
Điều 14. Thuốc đáp ứng nhu cầu cấp bách cho phòng, chống dịch bệnh, khắc phục hậu quả thiên tai, thảm họa
1. Hồ sơ: Đơn hàng nhập khẩu (Mẫu số 8);
2. Thủ tục:
Doanh nghiệp gửi hồ sơ đến Cục Quản lý dược- Bộ Y tế. Trong thời hạn 05 ngày làm việc kể từ khi nhận được hồ sơ hợp lệ, Cục Quản lý dược- Bộ Y tế xem xét cấp giấy phép nhập khẩu. Trường hợp không cấp giấy phép, Cục Quản lý dược- Bộ Y tế có văn bản trả lời doanh nghiệp và nêu rõ lý do.
Điều 15. Thuốc phục vụ cho các chương trình mục tiêu y tế quốc gia
1. Hồ sơ:
a) Đơn hàng nhập khẩu (Mẫu số 9);
b) Văn bản của cơ quan có thẩm quyền về việc nhập khẩu thuốc phục vụ chương trình mục tiêu y tế quốc gia (trường hợp cần thiết Cục Quản lý dược- Bộ Y tế có thể yêu cầu các hồ sơ theo quy định tại điểm b, c, d và e khoản 2 Điều 11 của Thông tư này);
c) Đối với vắc xin, sinh phẩm y tế là huyết thanh có chứa các kháng thể dùng để phòng bệnh, chữa bệnh ngoài các giấy tờ quy định tại điểm a và b khoản 1 Điều này phải có thêm các giấy tờ sau đây:
- Giấy chứng nhận của cơ quan có thẩm quyền nước sở tại cho phép lưu hành hoặc xuất khẩu vắc xin, sinh phẩm y tế;
- Giấy chứng nhận cơ sở sản xuất đạt tiêu chuẩn GMP;
- Phiếu kiểm nghiệm đạt tiêu chuẩn chất lượng vắc xin, sinh phẩm y tế của cơ quan kiểm định quốc gia hoặc cơ quan khác có thẩm quyền nước sở tại đối với lô hàng nhập (có xác nhận sao y bản chính của doanh nghiệp nhập khẩu);
- Kết quả thử thuốc trên lâm sàng hoặc kết quả thử nghiệm an toàn trên người ở thực địa theo quy định tại điểm b khoản 5 Điều 4 của Thông tư này.
d) Đối với các vắc xin, sinh phẩm y tế nhập khẩu theo kết quả trúng thầu của đấu thầu quốc gia hoặc quốc tế tại Việt Nam, các giấy tờ theo quy định tại tiết 1, 2 và 3 điểm c khoản 1 Điều này đã được chương trình xem xét khi xét hồ sơ thầu thì hồ sơ đề nghị nhập khẩu không phải bắt buộc có các giấy tờ trên.
2. Thủ tục:
a) Thuốc của chương trình mục tiêu y tế quốc gia phải được nhập khẩu ủy thác qua các doanh nghiệp có chức năng nhập khẩu thuốc trực tiếp. Trên nhãn thuốc phải có dòng chữ "Thuốc chương trình không được bán”.
b) Trong thời hạn 15 ngày làm việc kể từ khi nhận được hồ sơ hợp lệ, Cục Quản lý Dược- Bộ Y tế xem xét cấp giấy phép nhập khẩu. Trường hợp không cấp giấy phép, Cục Quản lý Dược- Bộ Y tế có văn bản trả lời doanh nghiệp và nêu rõ lý do.
Điều 16. Thuốc viện trợ, viện trợ nhân đạo
1. Hồ sơ:
a) Công văn đề nghị nhập khẩu của cơ sở nhận viện trợ, viện trợ nhân đạo;
b) Danh mục thuốc viện trợ, viện trợ nhân đạo (Mẫu số 10);
c) Văn bản của cơ quan có thẩm quyền về việc cho phép cơ sở nhận thuốc viện trợ, viện trợ nhân đạo;
d) Đối với vắc xin, sinh phẩm y tế là huyết thanh có chứa các kháng thể dùng để phòng bệnh, chữa bệnh ngoài các giấy tờ quy định tại điểm a, b và c khoản 1 Điều này phải có thêm các giấy tờ quy định tại tiết 1,2 và 3 điểm c khoản 1 Điều 15 của Thông tư này.
2. Thủ tục:
Cơ sở nhập khẩu gửi hồ sơ đến Sở Y tế trên địa bàn, trường hợp thuốc chứa dược chất mới, thuốc có sự kết hợp mới của các dược chất đã lưu hành, vắc xin, sinh phẩm y tế: cơ sở nhập khẩu gửi hồ sơ đến Cục Quản lý dược- Bộ Y tế. Trong thời hạn 15 ngày làm việc kể từ khi nhận được đơn hàng, hồ sơ hợp lệ, Sở Y tế hoặc Cục Quản lý dược- Bộ Y tế xem xét cấp giấy phép nhập khẩu. Trường hợp không cấp giấy phép, Sở Y tế hoặc Cục Quản lý dược- Bộ Y tế có văn bản trả lời cơ sở và nêu rõ lý do.
Điều 17. Thuốc dùng cho mục đích thử lâm sàng, làm mẫu đăng ký và phục vụ việc nghiên cứu, kiểm nghiệm, kiểm định, nghiên cứu sinh khả dụng/tương đương sinh học
Thực hiện theo quy định tại khoản 1, 2, 4 Điều 9 Quyết định số 151/2007/QĐ-TTg ngày 12/9/2007 của Thủ tướng Chính phủ Quy định về việc nhập khẩu thuốc chưa có số đăng ký tại Việt Nam.
1. Hồ sơ:
a) Đơn hàng nhập khẩu (Mẫu số 11a, 11b, 11c);
b) Đề cương nghiên cứu thử thuốc trên lâm sàng đã được Bộ trưởng Bộ Y tế phê duyệt đối với thuốc nhập khẩu để thử nghiệm lâm sàng;
c) Đề cương nghiên cứu sinh khả dụng, tương đương sinh học đã được phê duyệt tại cơ quan kỹ thuật chuyên ngành do Bộ Y tế ủy quyền đối với thuốc nhập khẩu để nghiên cứu sinh khả dụng,tương đương sinh học;
d) Văn bản phê duyệt của cơ quan có thẩm quyền cho phép thực hiện đối với các đề tài nghiên cứu có phê duyệt hoặc văn bản yêu cầu của cơ quan có thẩm quyền về việc nhập khẩu thuốc để kiểm nghiệm, kiểm định;
đ) Trường hợp cơ sở sản xuất, nghiên cứu, kiểm nghiệm muốn nhập khẩu thuốc để phục vụ việc nghiên cứu, kiểm nghiệm của chính cơ sở phải kèm theo văn bản đề nghị và cam kết thuốc nhập khẩu chỉ sử dụng để phục vụ việc nghiên cứu, kiểm nghiệm của cơ sở.
Số lượng xin nhập khẩu phải phù hợp với quy mô sản xuất, nghiên cứu, kiểm nghiệm, kiểm định. Trường hợp sau khi sản xuất thử, nguyên liệu nhập khẩu còn dư mà công ty muốn đưa vào sản xuât thuốc đã được cấp số đăng ký thì phải báo cáo về Cục Quản lý dược số lượng tồn, hạn dùng, tình trạng chất lượng và xin phép được sử dụng để sản xuất thuốc thành phẩm.[5]
e)[6] Bản sao Giấy chứng nhận đủ điều kiện kinh doanh thuốc có đóng dấu của doanh nghiệp đối với trường hợp doanh nghiệp lần đầu tiên xin nhập khẩu thuốc làm mẫu.
2. Thủ tục:
Cơ sở nhập khẩu gửi hồ sơ đến Cục Quản lý dược- Bộ Y tế. Trong thời hạn 15 ngày làm việc kể từ khi nhận được đơn hàng, hồ sơ hợp lệ, Cục Quản lý dược- Bộ Y tế xem xét cấp giấy phép nhập khẩu. Trường hợp không cấp giấy phép, Cục Quản lý dược - Bộ Y tế có văn bản trả lời cơ sở và nêu rõ lý do.
Điều 18. Thuốc để tham gia trưng bày, triển lãm hội chợ và các trường hợp tạm nhập, tái xuất thuốc khác
Thực hiện theo quy định tại khoản 3 Điều 9 Quyết định số 151/2007/QĐ-TTg ngày 12/9/2007 của Thủ tướng Chính phủ quy định về việc nhập khẩu thuốc chưa có số đăng ký tại Việt Nam và quy định tại Điều 12 Nghị định số 12/2006/NĐ-CP ngày 23/01/2006 của Chính phủ quy định chi tiết thi hành Luật Thương mại về hoạt động mua bán hàng hóa quốc tế và các hoạt động đại lý mua, bán, gia công và quá cảnh hàng hóa với nước ngoài.
Điều 19. Nguyên liệu làm thuốc, dược liệu chưa có số đăng ký lưu hành, bao bì tiếp xúc trực tiếp với thuốc [7]
1. Nguyên liệu làm thuốc được phép nhập khẩu theo Danh mục nguyên liệu làm thuốc được phép nhập khẩu do Cục Quản lý Dược công bố (không yêu cầu phải có giấy phép nhập khẩu) theo quy định tại Khoản 2 Điều này hoặc theo hình thức giấy phép nhập khẩu theo quy định tại Khoản 3 Điều này.
2. Nhập khẩu theo Danh mục nguyên liệu làm thuốc được phép nhập khẩu do Cục Quản lý Dược công bố (không yêu cầu phải có giấy phép).
a) Danh mục nguyên liệu làm thuốc được phép nhập khẩu (không yêu cầu phải có giấy phép) do Cục Quản lý Dược công bố gồm các dược chất, trừ các nguyên liệu thuộc danh mục thuốc gây nghiện, hướng tâm thần, tiền chất dùng làm thuốc. Trường hợp cơ sở sản xuất thay đổi nguồn gốc hoặc tiêu chuẩn chất lượng nguyên liệu, cơ sở sản xuất phải nộp hồ sơ đăng ký thay đổi theo quy định tại Phụ lục II ban hành kèm theo Thông tư số 22/2009/TT-BYT ngày 24 tháng 11 năm 2009 của Bộ trưởng Bộ Y tế quy định việc đăng ký thuốc và chỉ được nhập khẩu sau khi có văn bản của Cục Quản lý Dược đồng ý nội dung thay đổi, bổ sung của Cục Quản lý Dược.
b) Trình tự, thủ tục công bố
- Bộ Y tế (Cục Quản lý Dược) công bố Danh mục nguyên liệu làm thuốc được phép nhập khẩu (không yêu cầu phải có giấy phép) tại trang thông tin điện tử của Cục Quản lý Dược (www.dav.gov.vn) theo Mẫu số 16 ban hành kèm theo Thông tư này.
- Trong vòng 30 ngày kể từ ngày thuốc được cấp số đăng ký, Cục Quản lý Dược công bố Danh mục nguyên liệu làm thuốc được phép nhập khẩu.
c) Doanh nghiệp nhập khẩu
Cơ sở sản xuất thuốc được cấp số đăng ký chỉ được phép nhập khẩu nguyên liệu theo đúng Danh mục đã được công bố.
Doanh nghiệp kinh doanh có chức năng nhập khẩu nguyên liệu làm thuốc được phép nhập khẩu nguyên liệu thuộc Danh mục nguyên liệu làm thuốc được phép nhập khẩu (không yêu cầu phải có giấy phép) do Cục Quản lý Dược công bố.
d) Hồ sơ và thủ tục nhập khẩu
- Cơ sở sản xuất có nhu cầu nhập khẩu nguyên liệu để sản xuất thuốc, doanh nghiệp nhập khẩu nguyên liệu để kinh doanh làm thủ tục trực tiếp với Hải quan cửa khẩu để được nhập khẩu các nguyên liệu theo Danh mục đã được Cục Quản lý Dược công bố;
- Cơ sở sản xuất thuốc phải xuất trình Giấy chứng nhận đủ điều kiện sản xuất thuốc hoặc Giấy chứng nhận thực hành tốt sản xuất thuốc theo quy định tại điểm c, điểm d khoản 1 Điều 3 Thông tư này.
- Doanh nghiệp nhập khẩu nguyên liệu để kinh doanh phải xuất trình Giấy chứng nhận đủ điều kiện kinh doanh thuốc (hình thức bán buôn hoặc xuất nhập khẩu thuốc) và giấy chứng nhận GSP với phạm vi kinh doanh phù hợp theo quy định tại điểm a khoản 1 Điều 3 Thông tư này.
- Thời hạn nhập khẩu nguyên liệu làm thuốc theo hình thức công bố có thời hạn như hiệu lực số đăng ký của thuốc sản xuất từ nguyên liệu đó;
- Doanh nghiệp nước ngoài cung cấp nguyên liệu làm thuốc vào Việt Nam phải có Giấy phép hoạt động về thuốc và nguyên liệu làm thuốc tại Việt Nam còn hiệu lực theo quy định tại khoản 12 Điều 3 Thông tư này.
3. Nhập khẩu nguyên liệu làm thuốc theo hình thức giấy phép nhập khẩu
a) Nguyên liệu làm thuốc được nhập khẩu theo hình thức giấy phép nhập khẩu bao gồm:
- Nguyên liệu làm thuốc không thuộc diện được phép nhập khẩu theo hình thức công bố quy định tại khoản 2 Điều này;
- Nguyên liệu thuộc danh mục thuốc gây nghiện, hướng tâm thần, tiền chất dùng làm thuốc;
- Nguyên liệu là tá dược, vỏ nang thuốc, bao bì tiếp xúc trực tiếp với thuốc;
- Nguyên liệu dùng cho nghiên cứu, kiểm nghiệm;
b) Doanh nghiệp nhập khẩu nguyên liệu theo hình thức giấy phép nhập khẩu và doanh nghiệp nước ngoài cung cấp nguyên liệu làm thuốc vào Việt Nam được quy định tại Điều 3 Thông tư này.
c) Hồ sơ đề nghị cấp giấy phép nhập khẩu
- Đơn hàng nhập khẩu theo Mẫu số 12a, 12b, 12c, 12d, 12đ ban hành theo Thông tư này.
- Bản tiêu chuẩn chất lượng và bản phương pháp kiểm nghiệm nguyên liệu, dược liệu, bao bì tiếp xúc trực tiếp với thuốc đối với các nguyên liệu, bao bì có tiêu chuẩn chất lượng và phương pháp kiểm nghiệm của nhà sản xuất hoặc bản photo chuyên luận tiêu chuẩn chất lượng của dược điển trừ trường hợp áp dụng tiêu chuẩn dược điển châu Âu, Anh, Hoa Kỳ, Quốc tế, Nhật Bản.
- Đối với nguyên liệu làm thuốc là thuốc gây nghiện, hướng tâm thần, tiền chất làm thuốc phải gửi kèm theo Báo cáo tồn kho theo Mẫu số 3 ban hành theo Thông tư này.
d) Trình tự, thủ tục
Doanh nghiệp gửi hồ sơ đến Cục Quản lý Dược - Bộ Y tế. Trong thời hạn 07 ngày làm việc kể từ khi nhận được hồ sơ hợp lệ, Cục Quản lý Dược- Bộ Y tế xem xét cấp giấy phép nhập khẩu.
Đối với nguyên liệu làm thuốc là thuốc gây nghiện, hướng tâm thần, tiền chất làm thuốc, trong thời hạn 15 ngày làm việc kể từ khi nhận được hồ sơ hợp lệ, Cục Quản lý Dược- Bộ Y tế xem xét cấp giấy phép nhập khẩu.
Trường hợp không cấp giấy phép, Cục Quản lý Dược - Bộ Y tế có văn bản trả lời doanh nghiệp và nêu rõ lý do.
đ) Giấy phép nhập khẩu nguyên liệu làm thuốc chưa có số đăng ký có giá trị tối đa 02 năm kể từ ngày ký.”
Điều 20. Thuốc phóng xạ
1. Đối với thuốc phóng xạ trong trường hợp được miễn trừ khai báo, cấp phép: thực hiện theo quy định tại Điều 11 của Thông tư này.
2. Đối với thuốc phóng xạ trong trường hợp không được miễn trừ khai báo, cấp phép: thực hiện theo quy định tại Điều 11 của Thông tư này và kèm theo Giấy phép tiến hành các công việc bức xạ do cơ quan có thẩm quyền cấp cho doanh nghiệp trực tiếp kinh doanh thuốc phóng xạ.
Mục 3. KIỂM ĐỊNH THUỐC NHẬP KHẨU
Điều 21. Vắc xin, sinh phẩm y tế là huyết thanh có chứa các kháng thể
1. Hồ sơ:
a) Phiếu gửi mẫu kiểm định;
b) Hồ sơ tóm tắt sản xuất và kiểm định của lô vắc xin, sinh phẩm y tế nhập khẩu (bản sao có đóng dấu xác nhận của nhà sản xuất);
c) Giấy phép xuất xưởng của Cơ quan có thẩm quyền nước sở tại hoặc cơ quan tương đương khác kèm theo từng lô hàng nhập (bản sao có đóng dấu xác nhận của Giám đốc doanh nghiệp nhập khẩu);
d) Bằng chứng bảo đảm về dây chuyền lạnh trong quá trình vận chuyển lô hàng nhập khẩu.
e) Mẫu vắc xin, sinh phẩm y tế là huyết thanh có chứa các kháng thể nhập khẩu để kiểm định (số lượng mẫu theo qui định cho từng loại vắc xin, sinh phẩm y tế).
2[8]. Thủ tục:
Doanh nghiệp nhập khẩu gửi hồ sơ đến Viện Kiểm định quốc gia Vắc xin và Sinh phẩm y tế. Trong thời hạn 14 ngày làm việc kể từ khi nhận đủ mẫu và hồ sơ theo qui định, Viện Kiểm định quốc gia Vắc xin và Sinh phẩm y tế trả lời bằng văn bản về chất lượng vắc xin, sinh phẩm y tế và về an toàn trên động vật thí nghiệm của vắc xin, sinh phẩm y tế gửi doanh nghiệp.
Chương IV. HỒ SƠ, THỦ TỤC XUẤT KHẨU THUỐC VÀ BAO BÌ TIẾP XÚC TRỰC TIẾP VỚI THUỐC
Điều 22. Thuốc gây nghiện, hướng tâm thần và tiền chất
1. Hồ sơ:
a) Đơn hàng xuất khẩu (Mẫu số 13a, 13b );
b)[9] Văn bản cho phép nhập khẩu của cơ quan có thẩm quyền của nước nhập khẩu (bản chính, bản sao hoặc bản dịch tiếng Việt đáp ứng quy định tại tiết 1, 2 và 3 điểm a khoản 11 Điều 4 của Thông tư này).
c) Thuốc thành phẩm gây nghiện dạng phối hợp quy định tại khoản 2 Điều 1 của Thông tư số 10/2010/TT-BYT ngày 29/4/2010 hướng dẫn các hoạt động liên quan đến thuốc gây nghiện; thuốc thành phẩm hướng tâm thần, tiền chất dạng phối hợp quy định tại khoản 2 Điều 1 của Thông tư số 11/2010/TT-BYT ngày 29/4/2010 hướng dẫn các hoạt động liên quan đến thuốc hướng tâm thần, tiền chất dùng làm thuốc xuất khẩu để làm mẫu đăng ký, hội chợ, triển lãm, nghiên cứu không bắt buộc phải có hồ sơ theo quy định tại điểm b khoản 1 Điều này nhưng phải có văn bản giải trình rõ lý do và mục đích xuất khẩu thuốc của doanh nghiệp xuất khẩu;
d) [10](được bãi bỏ)
2. Thủ tục:
Trong thời hạn 15 ngày làm việc kể từ khi nhận được đơn hàng, hồ sơ hợp lệ, Cục Quản lý dược- Bộ Y tế xem xét cấp giấy phép xuất khẩu. Trường hợp không cấp giấy phép, Cục Quản lý dược- Bộ Y tế có văn bản trả lời doanh nghiệp và nêu rõ lý do.
Điều 23. Các thuốc khác không phải là thuốc gây nghiện, hướng tâm thần và tiền chất dùng làm thuốc ở dạng đơn chất hoặc phối hợp, bao bì tiếp xúc trực tiếp với thuốc
Thuốc sản xuất trong nước được cấp Giấy chứng nhận lưu hành tự do (FSC) hoặc Giấy chứng nhận sản phẩm dược phẩm (CPP) để xuất khẩu. Số lượng FSC, CPP được cấp theo yêu cầu của cơ sở.
1. Hồ sơ:
Đơn đề nghị cấp FSC hoặc CPP (Mẫu số 14);
Trường hợp nước nhập khẩu yêu cầu cơ sở nộp FSC hoặc CPP theo mẫu do nước đó quy định, Cục Quản lý dược- Bộ Y tế có thể xem xét cấp FSC dựa trên mẫu được yêu cầu.
2. Thủ tục:
a) Thủ tục cấp lại FSC theo quy định của Điều 13 Quyết định số 10/2010/QĐ-TTg ngày 10/2/2010 của Thủ tướng Chính phủ quy định giấy chứng nhận lưu hành tự do đối với sản phẩm hàng hóa xuất khẩu và nhập khẩu.
b) Cơ sở xuất khẩu thuốc không phải làm thêm thủ tục đăng ký hồ sơ thương nhân để cấp FSC.
c) Trong thời hạn 05 ngày làm việc kể từ khi nhận được hồ sơ hợp lệ, Cục Quản lý dược- Bộ Y tế cấp FSC hoặc CPP (Mẫu số 15a, 15b).
Chương V. XỬ LÝ VI PHẠM
Điều 24. Xử lý vi phạm
1. Trường hợp doanh nghiệp xuất khẩu, nhập khẩu có hành vi giả mạo hoặc tự ý sửa chữa hồ sơ, tài liệu, giấy tờ pháp lý của các cơ quan chức năng của Việt Nam hoặc của nước ngoài; sử dụng con dấu giả hoặc giả mạo chữ ký hoặc dấu của cơ sở nhập khẩu, cơ sở sản xuất và các cơ sở liên quan trong hồ sơ xuất khẩu, nhập khẩu thuốc thì Cục Quản lý Dược- Bộ Y tế có công văn cảnh báo cơ sở và dừng tiếp nhận, xem xét hồ sơ xuất khẩu, nhập khẩu thuốc của cơ sở, cụ thể như sau:
a) Dừng tiếp nhận, xem xét hồ sơ xuất khẩu, nhập khẩu thuốc của cơ sở trong thời hạn 03 tháng đối với trường hợp vi phạm lần đầu;
b) Dừng tiếp nhận, xem xét hồ sơ xuất khẩu, nhập khẩu thuốc của cơ sở 06 tháng đến 12 tháng đối với trường hợp vi phạm 02 lần trong 12 tháng;
c) Tùy theo mức độ vi phạm, Cục Quản lý Dược- Bộ Y tế sẽ có công văn gửi công ty sản xuất, công ty cung cấp thuốc và dừng tiếp nhận, xem xét hồ sơ đăng ký thuốc hoặc dừng tiếp nhận, xem xét hồ sơ đăng ký hoạt động về thuốc và nguyên liệu làm thuốc tại Việt Nam của công ty nước ngoài.
Ngoài các hình thức trên, Cục Quản lý Dược- Bộ Y tế sẽ công khai nội dung vi phạm của cơ sở trên trang thông tin điện tử của Bộ Y tế; thông báo tới cơ quan Thanh tra, cơ quan Hải quan và các cơ quan chức năng có thẩm quyền để xem xét, xử lý theo quy định của pháp luật.
2. Cơ quan, tổ chức, cá nhân vi phạm tùy theo mức độ sẽ bị dừng tiếp nhận, xem xét hồ sơ xuất khẩu, nhập khẩu thuốc hoặc bị xử phạt hành chính hoặc truy cứu trách nhiệm hình sự theo quy định của pháp luật.
Chương VI. ĐIỀU KHOẢN THI HÀNH
Điều 25. Hiệu lực thi hành [11]
Thông tư này có hiệu lực thi hành sau 45 ngày kể từ ngày ký. Bãi bỏ Thông tư số 06/2006/TT-BYT ngày 16/05/2006 của Bộ Y tế hướng dẫn xuất khẩu, nhập khẩu thuốc và mỹ phẩm; Thông tư số 13/1998/TT-BYT ngày 15/10/1998 của Bộ Y tế hướng dẫn việc tiếp nhận, quản lý và sử dụng thuốc viện trợ của nước ngoài vào Việt Nam; các quy định về nhập khẩu vắc xin và sinh phẩm y tế tại Thông tư số 08/2006/TT-BYT ngày 13/06/2006 của Bộ Y tế hướng dẫn nhập khẩu vắc xin, sinh phẩm y tế; hóa chất, chế phẩm diệt côn trùng, diệt khuẩn dùng trong lĩnh vực gia dụng và y tế và trang thiết bị y tế.
Trong quá trình thực hiện, nếu có khó khăn, vướng mắc đề nghị các đơn vị báo cáo về Cục Quản lý dược - Bộ Y tế để xem xét, giải quyết./.
| BỘ Y TẾ | XÁC THỰC VĂN BẢN HỢP NHẤT |
| Số: 03/VBHN-BYT |
Hà Nội, ngày 24 tháng 5 năm 2016 |
|
Nơi nhận: - Văn phòng Chính phủ: Công báo, Cổng TTĐTCP; - Bộ trưởng Nguyễn Thị Kim Tiến (để b/c); - Cổng Thông tin điện tử Bộ Y tế; - Website Cục Quản lý Dược; - Lưu: VT, QLD (03b), PC. |
KT. BỘ TRƯỞNG THỨ TRƯỞNG (đã ký)
Phạm Lê Tuấn |
DANH MỤC NGUYÊN LIỆU VÀ THUỐC THÀNH PHẨM CẤM NHẬP KHẨU ĐỂ LÀM THUỐC DÙNG CHO NGƯỜI
(Ban hành kèm theo Thông tư số 47/2010/TT-BYT ngày 29 tháng 12 năm 2010 của Bộ trưởng Bộ Y tế)
| TT | Tên hoạt chất | Tên khoa học |
| 1 | (+) - Lysergide(LSD, LSD-25) | 9,10-didehydro-N,N-diethyl-6-methylergoline-8b-carboxamide |
| 2 | 1-Phenyl-2-propanone | 1-phenyl-2-propanone; |
| 3 | 2C-B | 4-bromo-2,5dimethoxyphenyl-ethylamine |
| 4 | 3,4-Methylenedioxyphenyl-2-propanone | (2-propanone,1-[3,4(methylenedioxy)phenyl]-); |
| 5 | 3-methylfentanyl | N-(3-methyl-1-phenethyl-4-piperidyl)propionanilide |
| 6 | 3-methylthiofentanyl | N-[3-methyl-1-[2-(2-thienyl)ethyl]-4-piperidyl]propionanilide |
| 7 | 4-methylaminorex | (+)-cis-2-amino-4-methyl-5-phenyl-2-oxazoline |
| 8 | 4-MTA | α-methyl-4-methylthiophenethlamine |
| 9 | Acetic anhydride | acetic oxide |
| 10 | Acetone | 2-propanone |
| 11 | Acetorphine | 3-O-acetyltetrahydro-7α-(1-hydroxy-1-methylbutyl)-6,14-endo-ethenooripavine |
| 12 | Acetyl-alpha-methylfentanyl | N-[1 α -methylphenethyl)-4-piperidyl]acetanilide |
| 13 | Acetylmethadol | 3-acetoxy-6-dimethylamino-4,4-diphenylheptane |
| 14 | Alphacetylmethadol | α-3-acetoxy-6-dimethylamino-4,4-diphenylheptane |
| 15 | Alphameprodine | α-3-ethyl-1-methyl-4-phenyl-4-propionoxypiperidine |
| 16 | Alphamethadol | α-6-dimethylamino-4,4-diphenyl-3-heptanol |
| 17 | Alpha-methylfentanyl | N-[1-( α-methylphenethyl)-4-piperidyl]propionanilide |
| 18 | Alpha-methylthiofentanyl | N-[1-[1-methyl-2-(2-thienyl)ethyl]-4-piperidyl]propionanilide |
| 19 | Alphaprodine | α-1,3-dimethyl-4-phenyl-4-propionoxypiperidine |
| 20 | Amfetamine (Amphetamine) | (+)-α-methylphenethylamine |
| 21 | Amineptine | 7-[(10,11-dihydro-5H-dibenzo[a,d]cyclohepten-5-yl)amino]heptanoic acid |
| 22 | Ampletamine |
|
| 23 | Analgin (metamizol; Dipyrone) |
|
| 24 | Anileridine | 4-Piperidinecarboxylic acid, 1--[2-(4-aminophenyl)ethyl]-4-phenyl-, ethyl ester |
| 25 | Anthranilic acid | 2-aminobenzoic acid; |
| 26 | Aprotinin |
|
| 27 | Astemizole | 1-[(4-fluorophenyl)methyl]-N-[1-[2-(4-methoxyphenyl)ethyl]-4-piperidyl]-benzoimidazol-2-amine |
| 28 | Benzaldehyde | Benzoic Aldehyde; Benzenecarbonal |
| 29 | Benzethidine | 1-(2-benzyloxyethyl)-4-phenylpiperidine-4-carboxylic acid ethyl esterBenzylmorphine 3-benzylmorphine |
| 30 | Benzyl Cyanide | 2-Phenylacetonenitrile |
| 31 | Betacetylmethadol | β-3-acetoxy-6-dimethylamino-4,4-diphenylheptane |
| 32 | Beta-hydroxy-3-methylfentanyl | N-[1-(β--hydroxyphenethyl)-3-methyl-4-piperidyl]propionanilide |
| 33 | Beta-hydroxyfentanyl | N-[1-( β-hydroxyphenethyl)-4-piperidyl]propionanilide |
| 34 | Betameprodine | β-3-ethyl-1-methyl-4-phenyl-4-propionoxypiperidine |
| 35 | Betamethadol | β-6-dimethylamino-4,4-diphenyl-3-heptanol |
| 36 | Betaprodine | β-1,3-dimethyl-4-phenyl-4-propionoxypiperidine |
| 37 | Brolamfetamine (DOB) | (+)-4-bromo-2,5-dimethoxy-α-methylphenethylamine |
| 38 | Cannabis and Cannabis resin | Cây cần sa và các sản phẩm chiết xuất từ cây cần sa |
| 39 | Cathinone | (-)-(S)-2-aminopropiophenone |
| 40 | Cerivastatine | acide (6E)-(3R,5S)-7-[4-(4-fluorophényl)-5-(méthoxyméthyl)-2,6-bis(1-méthyléthyl)-3-pyridyl]-3,5-dihydroxyhept-6-énoïque |
| 41 | Chlormezanone |
|
| 42 | Clonitazene | 2-(p-chlorobenzyl)-1-diethylaminoethyl-5-nitrobenzimidazole |
| 43 | Coca leaf | lá cây Coca |
| 44 | Codoxime | dihydrocodeinone-6-carboxymethyloxime |
| 45 | CYCLOBARBITAL | 5-(1-cyclohexen-1-yl)-5-ethylbarbituric acid |
| 46 | Desomorphine | dihydrodeoxymorphine |
| 47 | Desomorphine | dihydrodeoxymorphine |
| 48 | DET | 3-[2-(diethylamino)ethyl]indole |
| 49 | Dexamfetamine (Dexamphetamine) | (+)-α-methyphenethylamine |
| 50 | Dexfenfluramine |
|
| 51 | Dextropropoxyphen | a- (+)- 4- dimethylamino- 1,2- diphenyl- 3- methyl- 2 - butanol propionate |
| 52 | Diampromide | N-[2-(methylphenethylamino)propyl]propionanilide |
| 53 | Diethylamine | N-Ethylethanamine |
| 54 | Diethylthiambutene | 3-diethylamino-1,1-di(2’-thienyl)-1-butene |
| 55 | Dihydroetorphine | 7,8-dihydro-7 α-[1-(R)-hydroxy-1-methylbutyl]-6,14-endo-ethanotetrahydrooripavine |
| 56 | Dihydromorphine |
|
| 57 | Dimenoxadol | 2-dimethylaminoethyl-1-ethoxy-1,1-diphenylacetate |
| 58 | Dimepheptanol | 6-dimethylamino-4,4-diphenyl-3-heptanol |
| 59 | Dimethylthiambutene | 3-dimethylamino-1,1-di(2'-thienyl)-1-butene |
| 60 | Dioxaphetyl butyrate | Ethyl-4-morpholino-2,2-diphenylbutyrate |
| 61 | DMA | (+)-2,5-dimethoxy-α-methylphenethylamine |
| 62 | DMHP | 3-(1,2dimethylheptyl)-7,8,9,10-tetrahydro-6,6,9-trimethyl-6H-dibenzo[b,d]pyran-1-o1 |
| 63 | DMT | 3-[2(dimethylamino)ethyl]lindole |
| 64 | DOET | (+)-4-ethyl-2,5-dimethoxy-α-phenethylamine |
| 65 | Dronabinol | (6αR,10αR)-6α,7,8,10α-tetrahydro-6,6,9-trimethyl-3-pentyl-6H-dibenzo[b,d]pyran-1-o1 |
| 66 | Ecgonine | its esters and derivatives which are convertible to ecgonine and cocaine |
| 67 | Erythromycine d¹ng muèi Estolate |
|
| 68 | Ethyl ether | 1,1'-oxybis[ethane] |
| 69 | Ethylene Diacetate | 1,1-Ethanediol Diacetate |
| 70 | Ethylmethylthiambutene | 3-ethylmethylamino-1,1-di(2’-thienyl)-1-butene |
| 71 | Eticyclidine (PCE) | N-ethyl-1-phenylcyclohexylamine |
| 72 | Etonitazene | 1-diethylaminoethyl-2-p-ethoxybenzyl-5-nitrobenzimidazole |
| 73 | Etorphine | tetrahydro-7 α-(1-hydroxy-1-methylbutyl)-6,14-endo-ethenooripavine |
| 74 | Etoxeridine | 1-[2-(2-hydroxyethoxy)ethyl]-4-phenylpiperidine-4-carboxylic acid ethyl ester |
| 75 | Etryptamine | 3-(2-aminobutyl)indole |
| 76 | Fenetylline | 7-[2-[(α-methylphenethyl)amino]ethyl]-theophylline |
| 77 | Fenfluramine |
|
| 78 | Formamide | Methanamide; Carbamaldehyde |
| 79 | Furethidine | 1-(2-tetrahydrofurfuryloxyethyl)-4-phenylpiperidine-4-carboxylic acid ethyl ester |
| 80 | Gatifloxacin |
|
| 81 | GHB | γ-hydroxybutyric acid |
| 82 | Glafenine |
|
| 83 | Heroin | Diacetylmorphine |
| 84 | Hydrocodone | Dihydrocodeinone |
| 85 | Hydromorphinol | 14-hydroxydihydromorphine |
| 86 | Hydroxypethidine | 4-m-hydroxyphenyl-1-methylpiperidine-4-carboxylic acid ethyl ester |
| 87 | Isomethadone | 6-dimethylamino-5-methyl-4,4-diphenyl-3-hexanone |
| 88 | Isosafrole | (1,3-benzodioxole,5-(1-propenyl)-) |
| 89 | Ketobemidone | 4-m-hydroxyphenyl-1-methyl-4-propionylpiperidine |
| 90 | Levamfetamine (Levamphetamine) | (-)-(R)-α-methylphenethylamin |
| 91 | Levamisole | (6S)-2,3,5,6-Tetrahydro-6-phenylimidazo [2,1-b] thiazole |
| 92 | Levomethamphetamine | (-)-N,α-dimethylphenethylamine |
| 93 | Levomethorphan* | (-)-3-methoxy-N-methylmorphinan |
| 94 | Levomoramide | (-)-4-[2-methyl-4-oxo-3,3-diphenyl-4-(1-pyrrolidinyl)butyl]morpholine |
| 95 | Levophenacylmorphan | (-)-3-hydroxy-N-phenacylmorphinan |
| 96 | Lysergic acid | ((8ß)-9,10-didehydro-6-methylergoline-8-carboxylic; |
| 97 | MDE, N-ethyl MDA | (+)-N-ethyl-α-methyl-3,4-(methylenedioxy)phenethylamine |
| 98 | MDMA | (+)-N,α-dimethyl-3,4-(methylene-dioxy) phenethylamine |
| 99 | Mecloqualone | 3-(o-chlorophenyl)-2-methyl-4(3H)-quinazolinone |
| 100 | Mescaline | 3,4,5-trimethoxyphenethylamine |
| 101 | Mescathinone | 2-(methylamino)-1-phenylpropan-1-one |
| 102 | Metamfetamine (Metamphetamine) | (+)-(S)-N,α-dimethylphenethylamine |
| 103 | Metamfetamine racemate | (+)-N,α-dimethylphenethylamine |
| 104 | Metazocine | 2'-hydroxy-2,5,9-trimethyl-6,7-benzomorphan |
| 105 | Methadone intermediate | 4-cyano-2-dimethylamino-4,4-diphenylbutane |
| 106 | Methaqualone | 2-methyl-3-o-tolyl-4(3H)-quinazolinone |
| 107 | Methyl ethyl ketone | 2-butanone |
| 108 | Methylamine | Monomethylamine; Aminomethane |
| 109 | Methyldesorphine | 6-methyl-.6-deoxymorphine |
| 110 | Methyldihydromorphine | 6-methyldihydromorphine |
| 111 | Metopon | 5-methyldihydromorphinone |
| 112 | MMDA | 5-methoxy-α-methyl-3,4-(methylenedioxy)phenethylamine |
| 113 | Moramide intermediate | 2-methyl-3-morpholino-1,1-diphenylpropane carboxylic acid |
| 114 | Morpheridine | 1-(2-morpholinoethyl)-4-phenylpiperidine-4-carboxylic acid ethyl ester |
| 115 | MPPP | 1-methyl-4-phenyl-4-piperidinol propionate (ester) |
| 116 | N-Acetylanthranilic acid | benzoic acid, 2-(acetylamino)- |
| 117 | N-hydroxy MDA | (+)-N-[α-methyl-3,4-(methylenedioxy) phenethyl]hydroxylamine |
| 118 | Nimesulide (trừ thuốc thành phẩm dạng dùng ngoài da, nguyên liệu để sản xuất thuốc dùng ngoài da) |
|
| 119 | Nitroethane |
|
| 120 | N-Methylpseudoephedrine |
|
| 121 | Noracymethadol | (±.)-α-3-acetoxy-6-methylamino-4,4-diphenylheptane |
| 122 | Norlevorphanol | (-)-3-hydroxymorphinan |
| 123 | Normethadone | 6-dimethylamino-4,4-diphenyl-3-hexanone |
| 124 | Normorphine | Demethylmorphine |
| 125 | Norpipanone | 4,4-diphenyl-6-piperidino-3-hexanone |
| 126 | Para-fluorofentanyl | 4'-fluoro-N-(1-phenethyl-4-piperidyl)propionanilide |
| 127 | Parahexyl | 3-hexyl-7,8,9,10-tetrahydro-6,6,9-trimethyl-6H-dibenzo[b,d] pyran-1-o1 |
| 128 | PEMOLINE | 2-amino-5-phenyl-2-oxazolin-4-one |
| 129 | PEPAP | 1-phenethyl-4-phenyl-4-piperidinol acetate (ester) |
| 130 | Pethidine intermediate A | 4-cyano-1-methyl-4-phenylpiperidine |
| 131 | Pethidine intermediate B | 4-phenylpiperidine-4-carboxylic acid ethyl ester |
| 132 | Pethidine intermediate C | 1-methyl-4-phenylpiperidine-4-carboxylic acid |
| 133 | Phenacetine | N-(4-Ethoxyphenyl) acetamide; p-acetophenetidide |
| 134 | Phenadoxone | 6-morpholino-4,4-diphenyl-3-heptanone |
| 135 | Phenampromide | N-(1-methyl-2-piperidinoethyl)propionanilide |
| 136 | Phencyclidine (PCP) | 1-(1-phenylcyclohexyl)piperidine |
| 137 | Phenmetrazine | 3-methyl-2-phenylmorpholine |
| 138 | Phenolphtalein | 3,3-bis (4-hydroxyphenyl)-1-(3H)-isobenzofuranone |
| 139 | Phenomorphan | 3-hydroxy-N-phenethylmorphinan |
| 140 | Phenoperidine | 1-(3-hydroxy-3-phenylpropyl)-4-phenylpiperidine-4-carboxylic acid ethyl ester |
| 141 | Phenylacetic acid | benzeneacetic acid |
| 142 | Phenylpropanolamin (Norephedrin) | Benzenemethanol, a - (1- aminoethyl)- (+)- |
| 143 | Piminodine | 4-phenyl-1-(3-phenylaminopropyl)piperidine-4-carboxylic acid ethyl ester |
| 144 | Piperidine | Piperidine |
| 145 | Piperonal | 1,3-benzodioxole-5-carboxaldehyde; |
| 146 | Piperonyl Methyl Cetone |
|
| 147 | PIPRADROL | 1,1-diphenyl-1-(2-piperidyl)methanol |
| 148 | Piritramide | 1-(3-cyano-3,3-diphenylpropyl)-4-(1-piperidino)piperidine-4-carboxylic acid amide |
| 149 | PMA | p-methoxy-α-methylphenethylamine |
| 150 | Pratolol |
|
| 151 | Proheptazine | 1,3-dimethyl-4-phenyl-4-propionoxyazacycloheptane |
| 152 | Properidine | 1-methyl-4-phenylpiperidine-4-carboxylic acid isopropyl ester |
| 153 | Psilocine, psilotsin | 3-[2-(dimethylamino)ethyl]indole-4-o1 |
| 154 | Psilocybine | 3-[2-(dimethylamino)ethyl]indole-4-yl dihydrogen phosphate |
| 155 | Pyramidon (Aminophenazone) | 4-diméthylamino-2,3-diméthyl-1-phényl-3-pyrazolin-5-one |
| 156 | Racemethorphan | (±)-3-methoxy-N-methylmorphinan |
| 157 | Racemoramide | (±)-4-[2-methyl-4-oxo-3,3-diphenyl-4-(1-pyrrolidinyl)butyl]morpholine |
| 158 | Racemorphan | (±)-3-hydroxy-N-methylmorphinan |
| 159 | Remifentanil | 1-(2-methoxy carbonylethyl)-4-(phenylpropionylamino)piperidine-4-carboxylic acid methyl ester |
| 160 | Rolicyclidine (PHP, PCPY) | 1-(1-phenylcyclohexyl)pyrrolidine |
| 161 | Safrole | (1,3-benzodioxole,5-(2-propenyl)-); HS code: 2932.94 CAS number: 94-59-7 |
| 162 | Santonin | [3s-(3 α, 3aα, 5aβ, 9bβ]-3a,5,5a,9b - Tetrahydro - 3 5a, 9 - trimethylnaphtho [1,2-b] furan-2, 8 (3H,4H)- dione |
| 163 | Secobarbital | 5-ally-5-(1-methylbutyl)barbituric acid |
| 164 | Sibutramine | (±)-dimethyl-1-[1-(4- chlorophenyl) cyclobutyl]-N,N,3-trimethylbutan- 1-amine |
| 165 | STP, DOM | 2,5-dimethoxy-α,4-dimethylphenethylamine |
| 166 | Sulphuric acid 1 | sulfuric acid |
| 167 | Tenamfetamine (MDA) | α-methyl-3,4-(methylenedioxy) phenethylamine |
| 168 | Tenocyclidine (TCP) | 1-[1-(2-thienyl)cyclohexyl]piperidine |
| 169 | Terfenadine |
|
| 170 | Tetrahydrocannabinol | 7,8,9,10-tetrahydro-6,6,9-trimethyl-3-pentyl-6H-dibenzo[b,d] pyran-1-o1; (9R,10αR)-8,9,10,10α-tetrahydro-6,6,9-trimethyl-3-pentyl-6H-dibenzo[b,d]pyran-1-o1; (6αR,9R,10αR)-6α,9,10,10α-tetrahydro-6,6,9-trimethyl-3-pentyl-6H-dibenzo[b,d]pyran-1-o1; (6αR,10αR)-6α,7,10,10α-tetrahydro-6,6,9-trimethyl-3-pentyl-6H-dibenzo[b,d]pyran-1-o1; 6α,7,8,9-tetrahydro-6,6,9-trimethyl-3-pentyl-6H-dibenzo[b,d]pyran-1-o1; (6αR,10αR)-6α,7,8,9,10,10a-hexahydro-6,6,dimethyl-9-methylene-3-pentyl-6H-dibenzo[b,d]pyran-1-o1 |
| 171 | Thebaine | 6,7,8,14-Tetradehydro-4,5-epoxy-3,6-dimethoxy-17-methylmorphinan; paramorphine |
| 172 | Thiofentanyl | N-[1-[2-(2-thienyl)ethyl]-4-piperidyl]propionanilide |
| 173 | Tilidine | (±)-ethyl-trans-2-(dimethylamino)-1-phenyl-3-cyclohexene-1-carboxylate |
| 174 | TMA | (+)-3,4,5-trimethoxy-α-methylphenethylamine |
| 175 | Toluene | benzene, methyl- |
| 176 | Trimeperidine | 1,2,5-trimethyl-4-phenyl-4-propionoxypiperidine |
| 177 | Ziperol | α-(α-methoxybenzy)-4-(β-methoxyphenethyl)-1-piperazineethanol |
| 178 | Zomepirac | 5-(4-Chlorobenzoyl)-1, 4-dimethyl-H-pyrrole-2-acetic acid |
* Danh mục sẽ bao gồm cả các hoạt chất thuộc Danh mục các chất ma túy và tiền chất do Chính phủ ban hành nhưng không thuộc danh mục thuốc gây nghiện, danh mục thuốc hướng tâm thần và danh mục tiền chất dùng làm thuốc do Bộ Y tế quy định.
Mẫu số 1a [12]
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc_________ |
BÁO CÁO NHẬP KHẨU VẮC XIN SINH PHẨM
| STT | Tên vắc xin, SPYT, hàm lượng, dạng bào chế, quy cách đóng gói | Đơn vị tính | Ngày sản xuất Hạn dùng | Ngày nhập khẩu | Số lô | Số lượng | Công dụng | Đối với đơn hàng xin GPXK | Công ty sản xuất, Tên nước | Tên Công ty cung cấp, Tên nước | Công ty nhập khẩu | Tên đơn vị ủy thác nhập khẩu (nếu có) | |
| Số giấy phép nhập khẩu (nếu có) | Ngày cấp | ||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
| ....., ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký, ghi rõ họ tên, đóng dấu) |
Mẫu số 1b1
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc
|
THÔNG TIN THUỐC CÓ SỐ ĐĂNG KÝ NHẬP KHẨU
(Từ ..… đến ……)
Kính gửi: ………………………………………………….
| Stt | Tên thuốc | Nồng độ hoặc hàm lượng | Tên hoạt chất | Qui cách đóng gói | Tên cơ sở sản xuất | Tên nước sản xuất | Tên cơ sở nhập khẩu | Tên cơ sở nhập khẩu uỷ thác (nếu có) | Tên nước xuất khẩu | Số đăng ký | Đơn vị tính
| Mã HS | Số lượng (thực nhập) | Giá nhập khẩu | Loại giá nhập khẩu (CIF, FOB…) | Tổng giá trị nhập | Ngày nhập khẩu | Cửa khẩu nhập | Phương thức vận chuyển |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Người lập (ký, ghi họ tên)
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu (ký, ghi họ tên, đóng dấu) |
Mẫu số 1b2
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập - Tự do - Hạnh phúc_________
|
THÔNG TIN THUỐC CHƯA CÓ SỐ ĐĂNG KÝ NHẬP KHẨU
(Từ …… đến ……)
Kính gửi: ………………………………………………….
| Stt | Tên thuốc | Nồng độ hoặc hàm lượng | Tên hoạt chất | Qui cách đóng gói | Tên cơ sở sản xuất | Tên nước sản xuất | Tên cơ sở nhập khẩu | Tên cơ sở NK uỷ thác (nếu có) | Tên nước xuất khẩu | GPNK (Số, ngày ) | Đơn vị tính
| Mã HS | Số lượng (thực nhập) | Giá nhập khẩu
| Loại giá nhập khẩu (CIF, FOB…) | Tổng giá trị nhập | Ngày nhập khẩu | Cửa khẩu nhập | Phương thức vận chuyển |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Người lập (ký, ghi họ tên)
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký, ghi họ tên, đóng dấu) |
Mẫu số 1b3
| TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... | CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc_________
|
THÔNG TIN THUỐC NHẬP KHẨU KHẨN CẤP CHO NHU CẦU
PHÒNG CHỐNG DỊCH, THIÊN TAI
(Từ …… đến ……)
Kính gửi: ………………………………………………….
| Stt | Tên thuốc | Nồng độ hoặc hàm lượng | Tên hoạt chất | Qui cách đóng gói | Tên cơ sở sản xuất | Tên nước sản xuất | Tên cơ sở nhập khẩu | Tên cơ sở NK uỷ thác (nếu có) | Tên nước xuất khẩu | GPNK (Số, ngày ) | Đơn vị tính
| Mã HS | Số lượng (thực nhập) | Giá nhập khẩu
| Loại giá nhập khẩu (CIF, FOB…) | Tổng giá trị nhập | Ngày nhập khẩu | Cửa khẩu nhập | Phương thức vận chuyển |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Người lập (ký, ghi họ tên)
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký, ghi họ tên, đóng dấu) |
Mẫu số 1b4
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... | CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc_________
|
THÔNG TIN THUỐC NHẬP KHẨU
PHỤC VỤ CHO CÁC CHƯƠNG TRÌNH MỤC TIÊU QUỐC GIA
(Từ…… đến ……)
Kính gửi: ………………………………………………….
| Stt | Tên thuốc | Nồng độ hoặc hàm lượng | Tên hoạt chất | Qui cách đóng gói | Tên cơ sở sản xuất | Tên nước sản xuất | Tên cơ sở nhập khẩu | Tên cơ sở NK uỷ thác (nếu có) | Tên nước xuất khẩu | GPNK (Số, ngày ) | Đơn vị tính
| Mã HS | Số lượng (thực nhập) | Giá nhập khẩu
| Loại giá nhập khẩu (CIF, FOB…) | Tổng giá trị nhập | Ngày nhập khẩu | Cửa khẩu nhập | Phương thức vận chuyển |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Người lập (ký, ghi họ tên)
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký tên, ghi họ tên, đóng dấu) |
Mẫu số 1b5
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc_________
|
THÔNG TIN THUỐC NHẬP KHẨU VIỆN TRỢ VÀ VIỆN TRỢ NHÂN ĐẠO
(Từ …… đến ……)
Kính gửi: ………………………………………………….
| Stt | Tên thuốc | Nồng độ hoặc hàm lượng | Tên hoạt chất | Qui cách đóng gói | Tên cơ sở sản xuất | Tên nước sản xuất | Tên cơ sở nhập khẩu | Tên cơ sở NK uỷ thác (nếu có) | Tên nước xuất khẩu | GPNK (Số, ngày ) | Đơn vị tính
| Mã HS | Số lượng (thực nhập) | Giá nhập khẩu
| Loại giá nhập khẩu (CIF/ FOB…) | Tổng giá trị nhập | Ngày nhập khẩu | Cửa khẩu nhập | Phương thức vận chuyển |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Người lập (ký, ghi họ tên)
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký tên, ghi họ tên, đóng dấu) |
Mẫu số 1b6
|
TÊN DOANH NGHIỆP XUẤT KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
THÔNG TIN THUỐC XUẤT KHẨU
(không bao gồm thuốc gây nghiện, hướng tâm thần)
(Từ …… đến ……)
Kính gửi: ………………………………………………….
| Stt | Tên thuốc | Nồng độ hoặc hàm lượng | Tên hoạt chất | Qui cách đóng gói | Tên cơ sở sản xuất | Tên nước sản xuất | Tên cơ sở xuất khẩu | Tên nước nhập khẩu | Số đăng ký/Giấy phép nhập khẩu | Đơn vị tính
| Số lượng (thực xuất) | Giá xuất khẩu | Tổng giá trị xuất khẩu | Ngày xuất khẩu | Cửa khẩu | Phương thức vận chuyển |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Người lập (ký, ghi họ tên)
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký tên, ghi họ tên, đóng dấu) |
Mẫu số 1b7
| TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... | CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
THÔNG TIN NGUYÊN LIỆU LÀM THUÔC NHẬP KHẨU
(CÓ SỐ ĐĂNG KÝ HOẶC CHƯA CÓ SỐ ĐĂNG KÝ)
(Từ …… đến ……)
Kính gửi: ………………………………………………….
| Stt | Tên nguyên liệu | Số đăng ký/ giấy phép nhập khẩu | Ngày cấp | Tên cơ sở sản xuất | Nước sản xuất | Mã HS | Đơn vị tính
| Số lượng | Giá nhập khẩu
| Loại giá nhập khẩu (CIF, FOB…) | Tổng giá trị nhập | Tên cơ sở nhập khẩu | Tên cơ sở nhập khẩu uỷ thác (nếu có) | Nước xuất khẩu | Ngày xuất khẩu | Cửa khẩu | Phương thức vận chuyển |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Người lập (ký, ghi họ tên)
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký tên, ghi họ tên, đóng dấu) |
Mẫu số 1b8
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
THÔNG TIN BAO BÌ, TÁ DƯỢC LÀM THUỐC NHẬP KHẨU
(Từ …… đến ……)
Kính gửi: ………………………………………………….
| Stt | Tên bao bì, tá dược | Số đăng ký/ giấy phép nhập khẩu | Ngày cấp | Tên cơ sở sản xuất | Nước sản xuất | Mã HS | Đơn vị tính
| Số lượng | Giá nhập khẩu
| Loại giá nhập khẩu (CIF, FOB…) | Tổng giá trị nhập | Tên cơ sở nhập khẩu | Tên cơ sở nhập khẩu uỷ thác (nếu có) | Nước xuất khẩu | Ngày nhập khẩu | Cửa khẩu | Phương thức vận chuyển |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Người lập (ký, ghi họ tên)
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký tên, ghi họ tên, đóng dấu) |
Mẫu số 1b9
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
THÔNG TIN THUỐC THÀNH PHẨM NHẬP KHẨU CÓ CHỨA HOẠT CHẤT GÂY NGHIỆN
HOẶC THUỐC HƯỚNG TÂM THẦN, TIỀN CHẤT DÙNG LÀM THUỐC
(Từ ..…… đến ……)
Kính gửi: ………………………………………………….
| Stt
| Tên thuốc
| Hàm lượng hoặc nồng độ | Quy cách đóng gói | Tên cơ sở sản xuất | Nước sản xuất | Số Giấy phép nhập khẩu (GPNK) | Ngày cấp số GPNK | Số đăng ký (nếu có | Ngày cấp SĐK (nếu có) | Đơn vị tính nhỏ nhất
| Số lượng
| Giá nhập khẩu thực tế
| Loại giá nhập khẩu (CIF, FOB…) | Tổng giá trị nhập | Tên cơ sở nhập khẩu | Cơ sở uỷ thác nhập khẩu (nếu có)
| Nước xuất khẩu | Ngày nhập khẩu | Cửa khẩu nhập | Phương thức vận chuyển |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Người lập (ký, ghi họ tên)
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu (ký, ghi họ tên, đóng dấu) |
Mẫu số 1b10
|
TÊN DOANH NGHIỆP XUẤT KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
THÔNG TIN THUỐC THÀNH PHẨM XUẤT KHẨU CÓ CHỨA HOẠT CHẤT GÂY NGHIỆN HOẶC THUỐC HƯỚNG TÂM THẦN, TIỀN CHẤT DÙNG LÀM THUỐC
(Từ…… đến ……)
Kính gửi: ………………………………………………….
| Stt | Tên thuốc | Nồng độ hoặc hàm lượng | Tên hoạt chất | Qui cách đóng gói | Tên cơ sở sản xuất | Tên nước sản xuất | Tên cơ sở xuất khẩu | Tên nước nhập khẩu | Số Giấy phép xuất khẩu | Số đăng ký (nếu có) | Đơn vị tính
| Số lượng (thực xuất) | Giá xuất khẩu | Tổng giá trị xuất khẩu | Ngày xuất khẩu | Cửa khẩu | Phương thức vận chuyển |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 10 | 11 |
| 14 | 16 | 17 | 18 |
| 19 | 20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Người lập (ký, ghi họ tên)
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu (ký, ghi họ tên, đóng dấu) |
Mẫu số 1b11
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... | CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
THÔNG TIN NGUYÊN LIỆUTHUỐC GÂY NGHIỆN HOẶC HƯỚNG TÂM THẦN, TIỀN CHẤT DÙNG LÀM THUỐC NHẬP KHẨU
(Từ …… đến ……)
Kính gửi: ………………………………………………….
| Stt | Tên nguyên liệu | Số đăng ký / giấy phép nhập khẩu | Ngày cấp | Tên cơ sở sản xuất | Nước sản xuất | Mã HS | Đơn vị tính
| Số lượng | Giá nhập khẩu
| Loại giá nhập khẩu (CIF, FOB…) | Tổng giá trị nhập | Tên cơ sở nhập khẩu | Tên cơ sở nhập khẩu uỷ thác (nếu có) | Nước xuất khẩu | Ngày nhập khẩu | Cửa khẩu | Phương thức vận chuyển |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 10 | 11 | 14 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Người lập (ký, ghi họ tên)
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký, ghi họ tên, đóng dấu) |
Mẫu số 1b12
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
THÔNG TIN DƯỢC LIỆU, THUỐC TỪ DƯỢC LIỆU, THUỐC ĐÔNG Y NHẬP KHẨU
(Từ …… đến ……)
Kính gửi: ………………………………………………….
| Stt | Tên dược liệu, hoặc thuốc | Tên khoa học (nếu có) | Cơ sở sản xuất | Nước sản xuất | Đơn vị nhập khẩu | Đơn vị nhập khẩu uỷ thác (nếu có) | Nước xuất khẩu | Số ĐK hoặc Giấy phép NK (Số, ngày) | Đơn vị tính
| Số lượng
| Giá nhập khẩu (CIF) | Tổng giá trị nhập | Ngày nhập khẩu | Cửa khẩu |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Người lập (ký, ghi họ tên)
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký, ghi họ tên, đóng dấu) |
Mẫu số 1b13
|
TÊN DOANH NGHIỆP XUẤT KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
THÔNG TIN DƯỢC LIỆU, THUỐC TỪ DƯỢC LIỆU, THUỐC ĐÔNG Y XUẤT KHẨU
(Từ …… đến ……)
Kính gửi: ………………………………………………….
| Stt | Tên dược liệu, hoặc thuốc | Tên Khoa học (nếu có) | Tên cơ sở sản xuất | Tên cơ sở xuất khẩu | Tên nước nhập khẩu | Số đăng ký/Giấy phép nhập khẩu | Đơn vị tính
| Số lượng XK | Giá xuất khẩu | Tổng giá trị xuất khẩu | Ngày xuất khẩu | Cửa khẩu | Phương thức vận chuyển |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Người lập (ký, ghi họ tên)
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký, ghi họ tên, đóng dấu) |
.
Mẫu số 1c
| Tên cơ sở nhập khẩu | CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập - tự do - hạnh phúc ______________________ |
Kính gửi: Cục Quản lý dược- Bộ Y tế
BÁO CÁO TẠM NHẬP/TÁI XUẤT THUỐC
| TT | Tên thuốc, nồng độ, hàm lượng, dạng bào chế, quy cách đóng gói | Đơn vị tính | Số lượng nhập | Số giấy phép tạm nhập | Ngày nhập | Số giấy phép xuất khẩu | Ngày xuất |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Ngày ........tháng..............năm
Người đứng đầu cơ sở (Ký tên, ghi họ tên, đóng dấu) |
Mẫu số 2a
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc
|
ĐƠN HÀNG NHẬP KHẨU THUỐC THÀNH PHẨM GÂY NGHIỆN
(HOẶC THUỐC HƯỚNG TÂM THẦN, TIỀN CHẤT DÙNG LÀM THUỐC)
ĐÃ CÓ SỐ ĐĂNG KÝ
Kính gửi: Cục Quản lý dược – Bộ Y tế
Tên doanh nghiệp nhập khẩu (bao gồm cả tên viết tắt, tên tiếng Việt, tn tiếng Anh):................................................................................
Địa chỉ (bằng tiếng Việt, tiếng Anh):................................................................................................................................................................
| STT | Tên thuốc , hàm lượng, dạng bào chế, quy cách đóng gói | Hoạt chất | Đơn vị tính | Số đăng ký | Hạn dựng | Số lượng | Tên hoạt chất gây nghiện (hoặc hoạt chất hướng tâm thần, tiền chất dùng làm thuốc) - hàm lượng có trong 1 đơn vị đó chia liều hoặc chưa chia liều | Tổng khối lượng hoạt chất gây nghiện (hoặc hoạt chất hướng tâm thần, tiền chất dùng làm thuốc) xin nhập khẩu (quy ra gam) | Tên & địa chỉ Công ty sản xuất - tên nước | Tên & địa chỉ Công ty xuất khẩu - tên nước | Tên & địa chỉ Công ty cung cấp - tên nước |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cửa khẩu dự định sẽ đưa hàng về (ghi rõ tên sân bay, hải cảng):
Chú ý: Tên và địa chỉ của Công ty sản xuất, Công ty xuất khẩu, Công ty cung cấp phải ghi đầy đủ, chi tiết.
| Nơi nhận: - Cục Quản lý Dược – Bộ Y tế; - Lưu tại đơn vị. | ..... , ngày... tháng... năm....Giám đốc doanh nghiệp nhập khẩu(Ghi rõ họ tên, ký, đóng dấu) |
Mẫu số 2b
| TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... | CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
ĐƠN HÀNG NHẬP KHẨU THUỐC THÀNH PHẨM GÂY NGHIỆN
(HOẶC THUỐC HƯỚNG TÂM THẦN, TIỀN CHẤT DÙNG LÀM THUỐC)
ĐÃ CÓ SỐ ĐĂNG KÝ Ở DẠNG PHỐI HỢP
Kính gửi: Cục Quản lý dược – Bộ Y tế
Tên doanh nghiệp nhập khẩu (bao gồm cả tên viết tắt, tên tiếng Việt, tên tiếng Anh):................................................................................
Địa chỉ (bằng tiếng Việt, tiếng Anh):................................................................................................................................................................
| STT | Tên thuốc, hàm lượng, dạng bào chế, quy cách đóng gói | Hoạt chất | Đơn vị tính | Số đăng ký | Hạn dùng | Số lượng | Tên hoạt chất gây nghiện (hoặc hoạt chất hướng tâm thần, tiền chất dùng làm thuốc) - Hàm lượng có trong 1 đơn vị đã chia liều hoặc chưa chia liều | Tổng số khối lượng hoạt chất gây nghiện (hoặc hoạt chất hướng tâm thần, tiền chất dùng làm thuốc) tính ra gam | Tên & địa chỉ công ty sản xuất – Tên nước | Tên & địa chỉ công ty xuất khẩu – Tên nước | Tên & địa chỉ công ty cung cấp- Tên nước | Tên & địa chỉ công ty uỷ thác nhập khẩu (nếu có) * |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cửa khẩu dự định sẽ đưa hàng về (ghi rõ tên sân bay, hải cảng):
Chú ý: Tên và địa chỉ của Công ty sản xuất,Công ty xuất khẩu, Công ty cung cấp phải ghi đầy đủ, chi tiết.
- Nếu không phải là nhập khẩu ủy thác, phỉ ghi rõ là: “Kinh doanh trực tiếp“.
| Nơi nhận: - Cục Quản lý dược – Bộ Y tế ; - Lưu tại đơn vị. | ..... Ngày... tháng... năm....Giám đốc doanh nghiệp nhập khẩu(Ghi rõ họ tên, ký, đóng dấu) |
Mẫu số 3 [13]
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc
|
BÁO CÁO TỒN KHO THUỐC GÂY NGHIỆN
(HOẶC THUỐC HƯỚNG TÂM THẦN, TIỀN CHẤT DÙNG LÀM THUỐC)
(Nguyên liệu, thành phẩm)
Kính gửi: Cục Quản lý Dược – Bộ Y tế.
| STT | Tên thuốc, hàm lượng, dạng bào chế, quy cách đóng gói | Đơn vị tính | Số lượng tồn kho kỳ trước | Số lượng nhập trong kỳ | Tổng số | Tổng số xuất trong kỳ | Tồn kho đến ngày …/…/… | Hư hao | Ghi chú |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nơi nhận : Người lập báo cáo …. Ngày……..tháng…….năm…..
- Cục QLD- Bộ Y tế ;
- Lưu tại cơ sở Giám đốc doanh nghiệp nhập khẩu
(ký, ghi rõ họ tên, đóng dấu)
*Chú ý: Số lượng báo cáo phải được cập nhật ngay trước thời gian xin nhập khẩu.
* Báo cáo áp dụng: Cơ sở bán buôn thuốc.
Mẫu số 4
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
DANH MỤC NHẬP KHẨU THUỐC THÀNH PHẨM CÓ SỐ ĐĂNG KÝ
Kính gửi: Hải quan cửa khẩu............
(Doanh nghiệp) kính gửi Hải quan cửa khẩu...........danh mục thuốc có số đăng ký nhập khẩu như sau:
| STT | Tên thuốc, hàm lượng, dạng bào chế, quy cách đóng gói | Hoạt chất | Số đăng ký
| Hạn dùng | Tên công ty đăng ký - Tên nước | Tên công ty sản xuất - Tên nước | Tên công ty cung cấp - Tên nước | Tên & địa chỉ công ty uỷ thác nhập khẩu (nếu có) * | Ghi chú |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* Nếu không phải là nhập khẩu ủy thác, phỉ ghi rõ là: “Kinh doanh trực tiếp“
| Nơi nhận: - Như trên; - Lưu tại DN |
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký, ghi họ tên, đóng dấu) |
Mẫu số 5a
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc __________________________ |
ĐƠN HÀNG NHẬP KHẨU THUỐC THÀNH PHẨM GÂY NGHIỆN
(HOẶC THUỐC HƯỚNG TÂM THẦN, TIỀN CHẤT DÙNG LÀM THUỐC) CHƯA CÓ SỐ ĐĂNG KÝ
Kính gửi: Cục Quản lý dược – Bộ Y tế
Tên doanh nghiệp nhập khẩu (bao gồm cả tên viết tắt, tên tiếng Việt, tên tiếng Anh):................................................................................
Địa chỉ (bằng tiếng Việt, tiếng Anh):................................................................................................................................................................
| Tên thuốc, hàm lượng, dạng bào chế, quy cách đóng gói | Hoạt chất | Đơn vị tính | Số lượng | Hạn dùng | Tiêu chuẩn chất lượng (ghi rõ TC Dược điển hoặc TCNSX) | Công dụng | Tên hoạt chất gây nghiện (hoặc hoạt chất hướng tâm thần, tiền chất dùng làm thuốc) - Hàm lượng có trong 1 đơn vị đã chia liều hoặc chưa chia liều | Tổng số khối lượng hoạt chất gây nghiện (hoặc hoạt chất hướng tâm thần, tiền chất dùng làm thuốc) tính ra gam | Tên & địa chỉ công ty sản xuất- Tên nước | Tên & địa chỉ công ty xuất khẩu- Tên nước | Tên & địa chỉ công ty cung cấp- Tên nước |
|
|
|
|
|
|
|
|
|
|
|
|
|
Cửa khẩu dự định sẽ đưa hàng về (ghi rõ tên sân bay, hải cảng):
Chú ý: Tên và địa chỉ của Công ty sản xuất, Công ty xuất khẩu, Công ty cung cấp phải ghi đầy đủ, chi tiết.
| Nơi nhận: - Cục Quản lý dược – Bộ Y tế ; - Lưu tại đơn vị. | ..... Ngày... tháng... năm....Giám đốc doanh nghiệp nhập khẩu(Ghi rõ họ tên, ký, đóng dấu) |
Mẫu số 5b
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc
|
ĐƠN HÀNG NHẬP KHẨU THUỐC THÀNH PHẨM CÓ CHỨA THUỐC GÂY NGHIỆN
(HOẶC THUỐC HƯỚNG TÂM THẦN, TIỀN CHẤT DÙNG LÀM THUỐC)
CHƯA CÓ SỐ ĐĂNG KÝ Ở DẠNG PHỐI HỢP
Kính gửi: Cục Quản lý dược – Bộ Y tế
Tên doanh nghiệp nhập khẩu (bao gồm cả tên viết tắt, tên tiếng Việt, tên tiếng Anh):................................................................................
Địa chỉ (bằng tiếng Việt, tiếng Anh):................................................................................................................................................................
| STT | Tên thuốc, hàm lượng, dạng bào chế, quy cách đóng gói | Hoạt chất | Đơn vị tính | Hạn dùng | Số lượng | Tên hoạt chất gây nghiện (hoặc hoạt chất hướng tâm thần, tiền chất dùng làm thuốc) - Hàm lượng có trong 1 đơn vị đã chia liều hoặc chưa chia liều | Tổng số khối lượng hoạt chất gây nghiện (hoặc hoạt chất hướng tâm thần, tiền chất dùng làm thuốc) tính ra gam | Tên & địa chỉ công ty sản xuất – Tên nước | Tên & địa chỉ công ty xuất khẩu – Tên nước | Tên & địa chỉ công ty cung cấp- Tên nước | Tên & địa chỉ công ty uỷ thác nhập khẩu (nếu có) * |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cửa khẩu dự định sẽ đưa hàng về (ghi rõ tên sân bay, hải cảng):
Chú ý: Tên và địa chỉ của Công ty sản xuất,Công ty xuất khẩu, Công ty cung cấp phải ghi đầy đủ, chi tiết.
* Nếu không phải là nhập khẩu ủy thác, phải ghi rõ là: “Kinh doanh trực tiếp“
| Nơi nhận: - Cục Quản lý dược – Bộ Y tế - Lưu tại đơn vị | ....., ngày... tháng... năm....Giám đốc doanh nghiệp nhập khẩu(Ghi rõ họ tên, ký, đóng dấu) |
Mẫu số 5c
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc
|
ĐƠN HÀNG NHẬP KHẨU THUỐC THÀNH PHẨM CHƯA CÓ SỐ ĐĂNG KÝ
Kính gửi: Cục Quản lý Dược – Bộ Y tế
(Doanh nghiệp) kính đề nghị Cục Quản lý Dược – Bộ Y tế xem xét duyệt để Doanh nghiệp nhập khẩu thuốc chưa có số đăng ký sau:
| Tên thuốc, hàm lượng, dạng bào chế, quy cách đóng gói | Hoạt chất | Đơn vị tính | Số lượng | Hạn dùng | Tiêu chuẩn chất lượng | C«ng dông | Tên công ty sản xuất - Tên nước | Tên công ty cung cấp - Tên nước | Tên đơn vị uỷ thác nhập khẩu (nếu có) * |
|
|
|
|
|
|
|
|
|
|
|
* Nếu không phải là nhập khẩu ủy thác, phải ghi rõ là: “Kinh doanh trực tiếp“
CỤC QUẢN LÝ DƯỢCChấp thuận đơn hàng nhập khẩu gồm …. trang …. khoản kèm theo Công văn số...../QLD- KD ngày.... tháng.... năm.... của Cục Quản lý dược – Bộ Y tế. Hà Nội, ngày... tháng... năm... Cục trưởng |
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký tên, đóng dấu) |
Mẫu số 5d
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
ĐƠN HÀNG NHẬP KHẨU VẮC XIN, SINH PHẨM Y TẾ LÀ HUYẾT THANH CÓ CHỨA KHÁNG THỂ CHƯA CÓ SỐ ĐĂNG KÝ
Kính gửi: Cục Quản lý Dược – Bộ Y tế
(Doanh nghiệp) kính đề nghị Cục Quản lý Dược – Bộ Y tế xem xét duyệt để Doanh nghiệp nhập khẩu vắc xin, sinh phẩm y tế là huyết thanh có chứa kháng thể chưa cú số đăng ký sau:
| Tên vắc xin, hàm lượng, dạng bào chế, quy cách đóng gói | Đơn vị tính | Số lượng | Ngày sản xuất/ Hạn dựng | Công dụng | Tên công ty sản xuất - Tên nước | Tên công ty cung cấp - Tên nước | Tên đơn vị uỷ thác nhập khẩu (nếu có)* |
|
|
|
|
|
|
|
|
|
* Nếu không phải là nhập khẩu ủy thác, phải ghi rõ là: “Kinh doanh trực tiếp“
CỤC QUẢN LÝ DƯỢCChấp thuận đơn hàng nhập khẩu gồm ..... trang .... khoản kèm theo Công văn số...../QLD-KD ngày.... tháng.... năm.... của Cục Quản lý dược – Bộ Y tế. Hà Nội, ngày... tháng... năm... Cục trưởng |
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký, ghi họ tên, đóng dấu) |
Mẫu số 5đ
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
ĐƠN HÀNG NHẬP KHẨU SINH PHẨM Y TẾ
ĐỂ CHẨN ĐOÁN BỆNH CHƯA CÓ SỐ ĐĂNG KÝ
Kính gửi: Cục Quản lý Dược – Bộ Y tế
(Doanh nghiệp) kính đề nghị Cục Quản lý dược – Bộ Y tế xem xét duyệt để Doanh nghiệp nhập khẩu sinh phẩm y tế dùng để chẩn đoán bệnh chưa có số đăng ký sau:
| Tên sinh phẩm y tế, hàm lượng, dạng bào chế, quy cách đóng gói | Đơn vị tính | Số lượng nhập khẩu | Ngày sản xuất /Hạn dựng | Công dụng | Tên công ty sản xuất - Tên nước | Tên công ty cung cấp - Tên nước | Tên đơn vị uỷ thác nhập khẩu (nếu có)* |
|
|
|
|
|
|
|
|
|
* Nếu không phải là nhập khẩu ủy thác, phải ghi rõ là: “Kinh doanh trực tiếp“
CỤC QUẢN LÝ DƯỢCChấp thuận đơn hàng nhập khẩu gồm trang khoản kèm theo Công văn số...../QLD-KD ngày.... tháng.... năm.... của Cục Quản lý Dược – Bộ Y tế. Hà Nội, ngày... tháng... năm... Cục trưởng |
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký, ghi họ tên, đóng dấu) |
Mẫu số 6a [14]
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
ĐƠN HÀNG NHẬP KHẨU THUỐC HIẾM, THUỐC CHO NHU CẦU ĐIỀU TRỊ CỦA BỆNH VIỆN
TRONG TRƯỜNG HỢP ĐẶC BIỆT
Kính gửi: Cục Quản lý Dược - Bộ Y tế
(Doanh nghiệp) kính đề nghị Cục Quản lý Dược - Bộ Y tế xem xét duyệt để Doanh nghiệp nhập khẩu thuốc hiếm, thuốc cho nhu cầu điều trị của bệnh viện trong trường hợp đặc biệt như sau:
| Tên thuốc, hàm lượng, dạng bào chế, quy cách đóng gói | Hoạt chất | Đơn vị tính | Số lượng | Hạn dùng | Tiêu chuẩn chất lượng | Công dụng | Tên công ty sản xuất - Tên nước | Tên công ty cung cấp - Tên nước | Tên đơn vị uỷ thác nhập khẩu (nếu có) * |
|
|
|
|
|
|
|
|
|
|
|
- Doanh nghiệp chỉ được nhận ủy thác nhập khẩu khi nộp đầy đủ hồ sơ theo quy định tại Điều 12 Thông tư này. Nếu không phải là nhập khẩu ủy thác, phải ghi rõ là: “Kinh doanh trực tiếp“
CỤC QUẢN LÝ DƯỢCChấp thuận đơn hàng nhập khẩu gồm …. trang …. khoản kèm theo Công văn số...../QLD- KD ngày.... tháng.... năm.... của Cục Quản lý Dược – Bộ Y tế. Hà Nội, ngày... tháng... năm... Cục trưởng |
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký, ghi rõ họ tên, đóng dấu) |
Mẫu số 6b
| TÊN BỆNH VIỆN |
| CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: V/v dự trù mua thuốc điều trị |
| Độc lập – Tự do – Hạnh phúc
|
DỰ TRÙ THUỐC HIẾM, THUỐC CHO NHU CẦU ĐIỀU TRỊ CỦA BỆNH VIỆN
TRONG TRƯỜNG HỢP ĐẶC BIỆT
Kính gửi: (Tên doanh nghiệp nhập khẩu)
Tên bệnh viện:
Địa chỉ:
Điện thoại :
Fax :
Số giường bệnh :
Để đáp ứng đủ thuốc phục vụ công tác khám chữa bệnh, Bệnh viện ….. đề nghị doanh nghiệp (tên doanh nghiệp) nhập khẩu các thuốc sau để cung cấp cho nhu cầu điều trị của Bệnh viện:
| STT | Tên thuốc, hàm lượng, dạng bào chế, quy cách đóng gói | Hoạt chất | Đơn vị tính | Số lượng dự trù | Tiêu chuẩn chất lượng | Công dụng | Tên nhà sản xuất – Tên nước |
| 1
|
|
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
| 3 |
|
|
|
|
|
|
|
Cam kết của Bệnh viện:
1. Các thuốc dự trù trên đây chỉ sử dụng để phục vụ công tác khám chữa bệnh của bệnh viện.
2. Bệnh viện chịu trách nhiệm về việc tiếp nhận, sử dụng thuốc hợp lý, an toàn.
|
| ..... , ngày... tháng... năm.... Giám đốc bệnh viện (ký, ghi rõ họ tên, đóng dấu) |
Mẫu số 7a[15]
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
ĐƠN HÀNG NHẬP KHẨU VẮC XIN, SINH PHẨM Y TẾ THEO NHU CẦU ĐIỀU TRỊ ĐẶC BIỆT CỦA CƠ SỞ ĐIỀU TRỊ,
CƠ SỞ TIÊM PHÒNG, CƠ SỞ XÉT NGHIỆM
Kính gửi: Cục Quản lý Dược - Bộ Y tế
(Doanh nghiệp) kính đề nghị Cục Quản lý Dược – Bộ Y tế xem xét duyệt để Doanh nghiệp nhập khẩu vắc xin, sinh phẩm y tế chưa có số đăng ký sau:
| Tên vắc xin, SPYT hàm lượng, dạng bào chế, quy cách đóng gói | Đơn vị tính | Số lượng nhập khẩu | Hạn dựng | Công dụng | Tên công ty sản xuất - Tên nước | Tên công ty cung cấp - Tên nước | Tên đơn vị uỷ thác nhập khẩu (nếu có)* |
|
|
|
|
|
|
|
|
|
* Nếu không phải là nhập khẩu ủy thác, phải ghi rõ là: “Kinh doanh trực tiếp“
Doanh nghiệp xin cam kết thực hiện đúng các quy định liên quan đến việc nhập khẩu, vận chuyển, bảo quản, phân phối các vắc xin (sinh phẩm y tế) trên theo đúng qui định hiện hành.
CỤC QUẢN LÝ DƯỢCChấp thuận đơn hàng nhập khẩu gồm... trang... khoản kèm theo Công văn số.../QLD-KD ngày... tháng... năm... của Cục Quản lý Dược - Bộ Y tế. Hà Nội, ngày... tháng... năm... CỤC TRƯỞNG | ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký, ghi rõ họ tên, đóng dấu) |
Mẫu số 7b
Tên cơ sở: CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
......, ngày.....tháng..... năm ...
DỰ TRÙ VẮC XIN, SINH PHẨM Y TẾ
Kính gửi: (Tên doanh nghiệp nhập khẩu)
Cơ sở điều trị, tiêm phòng;Cơ sở xét nghiệm (đối với sinh phẩm chẩn đoán): ……………………………………………………………………………………
Địa chỉ:
Điện thoại: Fax:
Kính đề nghị doanh nghiệp (tên doanh nghiệp) xem xét cho nhập các sản phẩm chưa có số đăng ký sau:
| TT | Tên vắc xin, hàm lượng, dạng bào chế, quy cách đóng gói | Đơn vị tính | Số lượng | Tên đơn vị sản xuất (tên nước) | Đối tượng sử dụng |
| 1 2 3 |
|
|
|
|
|
Sau khi nghiên cứu Thông tư số 22/2009/TT-BYT ngày 24/11/2009 của Bộ trưởng Bộ Y tế Quy định việc đăng ký thuốc, Thông tư số ________2010/TT-BYT ngày ________ hướng dẫn thực hiện việc nhập khẩu thuốc, bao bì tiếp xúc trực tiếp với thuốc, Quyết định số 23/2008/QĐ-BYT ngày 07/7/2008 về việc quản lý, sử dụng vắc xin, sinh phẩm y tế dùng cho người, chúng tôi xin cam kết sử dụng các vắc xin (sinh phẩm y tế) trên đúng mục đích, đúng đối tượng, đúng chỉ định theo các qui định hiện hành, chịu sự thanh tra, kiểm tra của cơ quan có thẩm quyền, chỉ sử dụng trong cơ quan chúng tôi. Trong trường hợp có tai biến xảy ra hoặc các vi phạm khác, chúng tôi xin hoàn toàn chịu trách nhiệm trước pháp luật về mục đích, đối tượng, chỉ định cũng như mọi vấn đề liên quan đến việc sử dụng loại vắc xin (sinh phẩm y tế) này.
GIÁM ĐỐC CƠ SỞ
(Ký, ghi rõ họ tên, đóng dấu)
Mẫu số 7c [16]
COMMITMENT
BẢN CAM KẾT
To ensure the quality of vaccine and medical biological products
Đảm bảo chất lượng vắc xin, sinh phẩm y tế
To: Drug Administration of Vietnam
Ministry of Health, S.R Vietnam
138A Giang vo Street, Ha noi, Viet Nam
Kính gửi: Cục Quản lý Dược - Bộ Y tế
138A, Giảng Võ, Hà Nội, Việt Nam
Supplier’s name/Tên công ty cung cấp:
Address/Địa chỉ:
Telephone number/ Điện thoại Fax: Telex:
Manufacturer’s name/Tên công ty sản xuất:
Address/Địa chỉ:
We ensure that the following vaccines and medical biological products distributed by our company:
Chúng tôi xin bảo đảm các vắc xin, sinh phẩm y tế sau do chúng tôi cung cấp:
| No | Name of vaccine, biologicals, Packaging form (Tên vắc xin, sinh phẩm và quy cách đóng gói) | Produced by (Sản xuất bởi) |
|
|
|
|
|
|
|
|
|
|
|
|
- Produced according to GMP criteria and met with all requirements setting for the quality of vaccines and biological products of local authorities.
Được sản xuất theo tiêu chuẩn GMP, đồng thời đạt các yêu cầu về chất lượng vắc xin, sinh phẩm y tế của cơ quan có thẩm quyền tại nước xuất xứ.
- Curently licensed to be placed on the market for use in the original country and first market authorisation was issued on:
Sản phẩm trên hiện đang được phép lưu hành tại nước xuất xứ và được cấp phép lần đầu vào năm:
We commit ourself to comform to the law and regulation in the field of vaccine and biological products and accept the inspection and examination of Vietnam authorities.
Chúng tôi xin chấp hành các luật lệ và quy định trong lĩnh vực vắc xin, sinh phẩm y tế của nước Cộng hoà xã hội chủ nghĩa Việt Nam và chịu sự thanh tra kiểm tra của cơ quan có thẩm quyền của Việt Nam.
We will bear a responsibilities for the quality of the above vaccines and biological products.
Chúng tôi xin hoàn toàn chịu trách nhiệm trước pháp luật về tiêu chuẩn chất lượng của vắc xin, sinh phẩm y tế trên.
….., ngày…..tháng …… năm ...
Director of Supplier Director of Manufacturer
(Giám đốc công ty cung cấp) (Giám đốc công ty sản xuất)
Sign (ký, ghi rõ họ tên) Sign (ký, ghi rõ họ tên)
Mẫu số 8
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc _________________________ |
ĐƠN HÀNG NHẬP KHẨU THUỐC KHẨN CẤP CHO NHU CẦU PHÒNG CHỐNG DỊCH, THIÊN TAI, THẢM HỌA
Kính gửi: Cục Quản lý dược – Bộ Y tế
(Doanh nghiệp) đề nghị Cục Quản lý dược – Bộ Y tế xét duyệt đơn hàng phòng chống dịch, thiên tai sau:
| STT | Tên thuốc, hàm lượng dạng bào chế, quy cách đóng gói | Đơn vị tính | Số lượng | Tiêu chuẩn chất lượng | Hạn dùng | Hoạt chất | Công dụng | Tên công ty sản xuất - Tên nước | Tên công ty cung cấp - Tên nước | SĐK (nếu có) | Ghi chú |
| 1 |
|
|
|
|
|
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
|
|
|
|
| … |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CỤC QUẢN LÝ DƯỢCChấp thuận đơn hàng nhập khẩu gồm... trang... khoản kèm theo Công văn số.../QLD-KD ngày... tháng... năm... của Cục Quản lý dược – Bộ Y tế. Hà Nội, ngày... tháng... năm... Cục trưởng |
| ........, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký, ghi rõ họ tên, đóng dấu) |
Mẫu số 9
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc _________________________ |
ĐƠN HÀNG NHẬP KHẨU THUỐC PHỤC VỤ CHO CÁC CHƯƠNG TRÌNH, DỰ ÁN QUỐC GIA
(Ghi rõ tên chương trình)
Kính gửi: Cục Quản lý Dược – Bộ Y tế
(Doanh nghiệp) đề nghị Cục Quản lý dược – Bộ Y tế xét duyệt đơn hàng nhập khẩu thuốc cho chương trình (tên chương trình) như sau:
| STT | Tên thuốc, hàm lượng dạng bào chế, quy cách đóng gói | Đơn vị tính | Số lượng
| Hạn dùng | Hoạt chất | Tên công ty sản xuất – Tên nước | Tên công ty cung cấp – Tên nước | SĐK (nếu có) |
| 1 |
|
|
|
|
|
|
|
|
| … |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CỤC QUẢN LÝ DƯỢCChấp thuận đơn hàng nhập khẩu gồm... trang... khoản kèm theo Công văn số.../QLD-KD ngày... tháng... năm... của Cục Quản lý Dược – Bộ Y tế. Hà Nội, ngày... tháng... năm... Cục trưởng | Ý kiến Chủ nhiệm chương trình | ........, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký, ghi họ tên, đóng dấu) |
| Mẫu số 10
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc _________________________ |
DANH MỤC THUỘC VIỆN TRỢ, VIỆN TRỢ NHÂN ĐẠO
(kèm theo công văn số.........ngày......tháng..... năm......)
| STT | Tên thuốc, hàm lượng, dạng bào chế, quy cách đóng gói | Đơn vị tính | Số lượng | Hoạt chất chính | Hạn dùng | Tên công ty sản xuất | Ghi chú |
| 1 2 |
|
|
|
|
|
|
|
| Cục Quản lý dược Xác nhận danh mục này gồm..... trang.... khoản đúng theo quy định trong công văn số..../QLD-KD ngày... tháng... năm... của Cục Quản lý dược Hà Nội, ngày.... tháng... năm... Cục trưởng | Ngày.... tháng.... năm.... Người đứng đầu cơ sở xin tiếp nhận viện trợ (Ký, ghi họ tên, đóng dấu) |
Mẫu số 11a [17]
| TÊN CƠ SỞ NHẬP KHẨU Số: ……………....... | CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc ________________________ |
ĐƠN HÀNG NHẬN THUỐC LÀM MẪU ĐĂNG KÝ LƯU HÀNH, KIỂM NGHIỆM/ NGHIÊN CỨU/THỬ NGHIỆM LÂM SÀNG/ NGHIÊN CỨU SINH KHẢ DỤNG/TƯƠNG ĐƯƠNG SINH HỌC [18]
Kính gửi: Cục Quản lý Dược - Bộ Y tế
(Cơ sở nhập khẩu) kính đề nghị Cục Quản lý Dược – Bộ Y tế xét duyệt cho nhận các thuốc làm mẫu đăng ký lưu hành, kiểm nghiệm/ nghiên cứu/ thử nghiệm lâm sàng/nghiên cứu sinh khả dụng/tương đương sinh học sau:
| STT | Tên thuốc hàm lượng dạng bào chế, quy cách đóng gói | Hoạt chất | Đơn vị tính | Số lượng
| Hạn dùng [19] | Tên công ty sản xuất - Tên nước | Tên công ty cung cấp - Tên nước | Ghi chú |
| 1 |
|
|
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| CỤC QUẢN LÝ DƯỢC Chấp thuận đơn hàng nhập khẩu gồm... trang... khoản kèm theo Công văn số... ...../QLD -…. ngày... tháng... năm... của Cục Quản lý Dược - Bộ Y tế. Hà Nội, ngày... tháng... năm... CỤC TRƯỞNG
| ........, ngày... tháng... năm...... Người đứng đầu cơ sở (ký, ghi rõ họ tên, đóng dấu) |
Mẫu số 11b
|
TÊN CƠ SỞ NHẬP KHẨU SỐ:…………. |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc _______________________ |
ĐƠN HÀNG NHẬN THUỐC GÂY NGHIỆN (HƯỚNG TÂM THẦN, TIỀN CHẤT DÙNG LÀM THUỐC)
Ở DẠNG PHỐI HỢP LÀM MẪU ĐĂNG KÝ LƯU HÀNH, NGHIÊN CỨU, KIỂM NGHIỆM, NGHIÊN CỨU SINH KHẢ DỤNG/TƯƠNG ĐƯƠNG SINH HỌC [20]
Kính gửi: Cục Quản lý dược – Bộ Y tế
(Doanh nghiệp) kính đề nghị Cục Quản lý dược – Bộ Y tế xét duyệt cho nhận các thuốc làm mẫu đăng ký lưu hành sau:
| STT | Tên thuốc, hàm lượng, dạng bào chế, quy cách đóng gói | Hoạt chất | Đơn vị tính | Số lượng | Tên hoạt chất gây nghiện (hoặc hoạt chất hướng tâm thần, tiền chất dùng làm thuốc) - Hàm lượng có trong 1 đơn vị đó chia liều hoặc chưa chia liều | Tổng số khối lượng hoạt chất gây nghiện (hoặc hoạt chất hướng tâm thần, tiền chất dùng làm thuốc) tính ra gam | Tên, địa chỉ công ty sản xuất - Tên nước | Tên, địa chỉ công ty cung cấp - Tên nước |
| 1 |
|
|
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
|
CỤC QUẢN LÝ DƯỢCChấp thuận đơn hàng nhập khẩu gồm... trang... khoản kèm theo Công văn số.../QLD-KD ngày... tháng... năm... của Cục Quản lý Dược – Bộ Y tế. Hà Nội, ngày... tháng... năm... Cục trưởng | ........, ngày... tháng... năm...... Người đứng đầu cơ sở(ký, ghi rõ họ tên, đóng dấu) |
Mẫu số 11c
|
TÊN CƠ SỞ NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc _________________________ |
ĐƠN HÀNG NHẬN THUỐC GÂY NGHIỆN (HƯỚNG TÂM THẦN, TIỀN CHẤT DÙNG LÀM THUỐC)
LÀM MẪU ĐĂNG KÝ LƯU HÀNH, NGIÊN CỨU, KIỂM NGHIỆM, NGHIÊN CỨU SINH KHẢ DỤNG/TƯƠNG ĐƯƠNG SINH HỌC
Kính gửi: Cục Quản lý dược – Bộ Y tế
(Doanh nghiệp) (bao gồm tên viết tắt, tên tiếng việt, tiếng Anh)
Địa chỉ (bằng tiếng Việt và tiếng Anh)
kính đề nghị Cục Quản lý dược – Bộ Y tế xét duyệt cho nhận các thuốc làm mẫu đăng ký lưu hành sau:
| STT | Tờn thuốc, hàm lượng, dạng bào chế, quy cách đóng gói | Hoạt chất | Đơn vị tính | Số lượng | Tên hoạt chất gây nghiện (hoặc hoạt chất hướng tâm thần, tiền chất dùng làm thuốc) - Hàm lượng có trong 1 đơn vị đó chia liều hoặc chưa chia liều | Tổng số khối lượng hoạt chất gây nghiện (hoặc hoạt chất hướng tâm thần, tiền chất dùng làm thuốc) tính ra gam | Tên, địa chỉ công ty sản xuất - Tên nước | Tên, địa chỉ công ty xuất khẩu - Tên nước | Tên, địa chỉ công ty cung cấp - Tên nước |
| 1 |
|
|
|
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
|
|
Cửa khẩu dự định hành đưa về (ghi rõ tên sân bay, cảng)
Chú ý: Tên và địa chỉ công ty sản xuất, cung cấp phải ghi đầy đủ và chi tiết.
|
Nơi nhận:- Cục QLD –BYT; - Lưu tại đơn vị. |
| ........, ngày... tháng... năm...... Người đứng đầu cơ sở(ký, ghi rõ họ tên, đóng dấu) |
Mẫu số 12a [21]
TÊN DOANH NGHIỆP NHẬP KHẨU CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
Số: ……………....... Độc lập – Tự do – Hạnh phúc
![]()
ĐƠN HÀNG NHẬP KHẨU NGUYÊN LIỆU, TÁ DƯỢC, BÁN THÀNH PHẨM THUỐC CHƯA CÓ SỐ ĐĂNG KÝ
Kính gửi: Cục Quản lý Dược - Bộ Y tế
(Doanh nghiệp) đề nghị Cục Quản lý Dược - Bộ Y tế xét duyệt nhập khẩu các nguyên liệu, tá dược để sản xuất thuốc như sau:
| STT | Tên nguyên liệu, hàm lượng, dạng bào chế, quy cách đóng gói | Đơn vị tính | Số lượng | Tiêu chuẩn chất lượng | Tên công ty sản xuất - Tên nước | Tên công ty cung cấp - Tên nước | Số đăng ký của thuốc được sản xuất từ bán thành phẩm đề nghị nhập (nếu nhập bán thành phẩm) |
| 1 |
|
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
| 3 |
|
|
|
|
|
|
|
CỤC QUẢN LÝ DƯỢCChấp thuận đơn hàng nhập khẩu gồm..... trang.... khoản kèm theo Công văn số...../QLD-KD ngày.... tháng.... năm.... của Cục Quản lý Dược – Bộ Y tế. Hà Nội, ngày... tháng... năm... CỤC TRƯỞNG |
| ....., ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký, ghi rõ họ tên, đóng dấu) |
Mẫu số 12b [22]
|
TÊN DOANH NGHIỆP NHẬP KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
ĐƠN HÀNG NHẬP KHẨU DƯỢC LIỆU CHƯA CÓ SỐ ĐĂNG KÝ
Kính gửi: Cục Quản lý Dược - Bộ Y tế
(Doanh nghiệp) đề nghị Cục Quản lý dược – Bộ Y tế xét duyệt nhập khẩu các dược liệu để sản xuất thuốc sau:
| STT | Tên dược liệu (tên tiếng Việt), bộ phận dùng | Tên khoa học (tiếng La tinh) | Đơn vị tính | Số lượng | Tiêu chuẩn chất lượng | Nguồn gốc dược liệu - Tên nước | Tên công ty cung cấp - Tên nước | Ghi chú |
| 1 |
|
|
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
|
| 3 |
|
|
|
|
|
|
|
|
CỤC QUẢN LÝ DƯỢCChấp thuận đơn hàng nhập khẩu gồm..... trang.... khoản kèm theo Công văn số...../QLD-KD ngày.... tháng.... năm.... của Cục Quản lý Dược – Bộ Y tế. Hà Nội, ngày... tháng... năm... CỤC TRƯỞNG |
| ......, ngày... tháng... năm...... Giám đốc doanh nghiệp nhập khẩu(ký, ghi rõ họ tên, đóng dấu) |
Mẫu số 12c [23]
|
|
|
| Số: ……………… |
|
ĐƠN HÀNG NHẬP KHẨU BAO BÌ TIẾP XÚC TRỰC TIẾP VỚI THUỐC
Kính gửi: Cục Quản lý Dược - Bộ Y tế
(Doanh nghiệp) đề nghị Cục Quản lý Dược - Bộ Y tế xét duyệt nhập khẩu bao bì tiếp xúc trực tiếp với thuốc sau để sản xuất thuốc:
| STT | Tên bao bì tiếp xúc trực tiếp với thuốc | Đơn vị tính | Số lượng | Tiêu chuẩn chất lượng | Tên công ty sản xuất - Tên nước | Tên công ty cung cấp - Tên nước | Ghi chú |
| 1 |
|
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
| CỤC QUẢN LÝ DƯỢC Chấp thuận đơn hàng nhập khẩu gồm …. trang.... khoản kèm theo Công văn số ……/QLD-KD ngày.... tháng....năm.... của Cục Quản lý Dược - Bộ Y tế. Hà Nội, ngày... tháng... năm... CỤC TRƯỞNG | ….., ngày …. tháng …. năm … |
Mẫu số 12d [24]
|
Số: ……………… |
|
|
|
|
ĐƠN HÀNG NHẬP KHẨU NGUYÊN LIỆU THUỐC GÂY NGHIỆN, HOẶC NGUYÊN LIỆU THUỐC HƯỚNG TÂM THẦN, TIỀN CHẤT DÙNG LÀM THUỐC
Kính gửi: Cục Quản lý Dược - Bộ Y tế
Tên doanh nghiệp nhập khẩu (bao gồm cả tên viết tắt, tên tiếng Việt, tên tiếng Anh): …………………………………………………………………..
Địa chỉ (bằng tiếng Việt, tiếng Anh): ………………………………………………………………………………………………………………………
| STT | Tên nguyên liệu, hàm lượng, dạng bào chế, quy cách đóng gói | Đơn vị tính | Tiêu chuẩn chất lượng | Số đăng ký (nếu có) | Số lượng | Tên và địa chỉ Công ty sản xuất - Tên nước | Tên và địa chỉ Công ty xuất khẩu - Tên nước | Tên và địa chỉ Công ty cung cấp - Tên nước | Ghi chú |
| 1 |
|
|
|
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
|
|
Cửa khẩu dự định sẽ đưa hàng về (ghi rõ tên sân bay, hải cảng):
Chú ý: Tên và địa chỉ của Công ty sản xuất, Công ty cung cấp phải ghi đầy đủ, chi tiết.
| Nơi nhận: | ….. Ngày … tháng … năm… |
Mẫu số 12đ [25]
|
Số: / |
|
ĐƠN HÀNG NHẬP KHẨU NGUYÊN LIỆU, BÁN THÀNH PHẨM CHƯA CÓ SỐ ĐĂNG KÝ
(Đối với các trường hợp đặc biệt, nguyên liệu, bán thành phẩm chứa Streptodornase, Streptokinase và chứa các Cephalosporin, các chất ức chế beta-lactamase…..)
Kính gửi: Cục Quản lý Dược - Bộ Y tế
(Doanh nghiệp) đề nghị Cục Quản lý Dược - Bộ Y tế xét duyệt nhập khẩu các nguyên liệu, tá dược để sản xuất thuốc như sau:
| STT | Tên nguyên liệu, hàm lượng, dạng bào chế | Đơn vị tính | Số lượng | Tiêu chuẩn chất lượng | Tên công ty sản xuất - Tên nước | Tên công ty cung cấp - Tên nước | Số đăng ký của thuốc được sản xuất từ nguyên liệu đề nghị nhập | Hoạt chất, nồng độ, hàm lượng của thuốc được sản xuất từ nguyên liệu đề nghị nhập khẩu |
| 1 |
|
|
|
|
|
|
|
|
Cam kết của doanh nghiệp:
Các nguyên liệu đề nghị nhập khẩu chỉ để sản xuất thuốc thành phẩm đã được cấp số đăng ký lưu hành còn hiệu lực.
(Doanh nghiệp) cam kết thực hiện đúng các quy định hiện hành về xuất nhập khẩu thuốc và các quy định về dược có liên quan.
| CỤC QUẢN LÝ DƯỢC Chấp thuận đơn hàng nhập khẩu gồm …. trang.... khoản kèm theo Công văn số ……/QLD-KD ngày.... tháng....năm.... của Cục Quản lý Dược - Bộ Y tế. Hà Nội, ngày... tháng... năm...
| ….., ngày …. tháng …. năm … |
Mẫu số 13a [26]
| TÊN DOANH NGHIỆP XUẤT KHẨU Số: ……………....... | CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
ĐƠN HÀNG XUẤT KHẨU THUỐC GÂY NGHIỆN
(HOẶC THUỐC HƯỚNG TÂM THẦN, TIỀN CHẤT DÙNG LÀM THUỐC)
Kính gửi : Cục Quản lý dược – Bộ Y tế
Tên doanh nghiệp xuất khẩu (bao gồm cả tên viết tắt, tên tiếng Việt, tên tiếng Anh):................................................................................
Địa chỉ (bằng tiếng Việt, tiếng Anh):................................................................................................................................................................
| STT | Tên thuốc, hàm lượng, dạng bào chế, quy cách đóng gói | Hoạt chất | Đơn vị tính | Số đăng ký (nếu có) | Số lượng | Tên thuốc gây nghiện (hoặc thuốc hướng tâm thần, tiền chất dùng làm thuốc) - Hàm lượng có trong 1 đơn vị đã chia liều hoặc chưa chia liều | Tổng số khối lượng thuốc gây nghiện (hoặc thuốc hướng tâm thần, tiền chất dùng làm thuốc) tính ra gam | Tên, địa chỉ công ty sản xuất - Tên nước | Tên, địa chỉ công ty nhập khẩu- Tên nước |
| 1 |
|
|
|
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
|
|
Cửa khẩu dự định sẽ xuất hàng (ghi rõ tên sân bay, hải cảng):
(**) Doanh nghiệp xin cam kết thực hiện theo hợp đồng xuất khẩu và không lưu hành các sản phẩm chưa được cấp số đăng ký lưu hành tại Việt Nam và sản phẩm với mẫu nhãn sản xuất để xuất khẩu.
Chú ý: (*) Tên và địa chỉ của Công ty sản xuất, Công ty nhập khẩu phải ghi đầy đủ, chi tiết.
(**) Trường hợp xin xuất khẩu thuốc chưa có SĐK lưu hành
| Nơi nhận: - Cục Quản lý dược- Bộ Y tế. - Lưu tại đơn vị | ..... Ngày... tháng... năm....Giám đốc DN xuất khẩu(Ghi rõ họ tên, ký, đóng dấu)
|
Mẫu số 13b [27]
|
TÊN DOANH NGHIỆP XUẤT KHẨU Số: ……………....... |
CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc
|
ĐƠN HÀNG XUẤT KHẨU THUỐC GÂY NGHIỆN (HƯỚNG TÂM THẦN, TIỀN CHẤT DÙNG LÀM THUỐC)
Ở DẠNG PHỐI HỢP
Kính gửi: Cục Quản lý dược – Bộ Y tế
Tên doanh nghiệp xuất khẩu (bao gồm cả tên viết tắt, tên tiếng Việt, tên tiếng Anh):................................................................................
Địa chỉ (bằng tiếng Việt, tiếng Anh):................................................................................................................................................................
| STT | Tên thuốc, hàm lượng, dạng bào chế, quy cách đóng gói | Hoạt chất | Đơn vị tính | Số lượng | Tên hoạt chất gây nghiện (hoặc hoạt chất hướng tâm thần, tiền chất dùng làm thuốc) - Hàm lượng có trong 1 đơn vị đã chia liều hoặc chưa chia liều | Tổng số khối lượng hoạt chất gây nghiện (hoặc hoạt chất hướng tâm thần, tiền chất dùng làm thuốc) tính ra gam | Tên, địa chỉ công ty sản xuất - Tên nước (*) | Tên, địa chỉ công ty nhập khẩu - Tên nước |
| 1 |
|
|
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cửa khẩu dự định sẽ xuất hàng (ghi rõ tên sân bay, hải cảng):
(**) Doanh nghiệp xin cam kết thực hiện theo hợp đồng xuất khẩu và không lưu hành các sản phẩm chưa được cấp số đăng ký lưu hành tại Việt Nam và sản phẩm với mẫu nhãn sản xuất để xuất khẩu.
Chú ý:
(*) Tên và địa chỉ của Công ty sản xuất, Công ty nhập khẩu phải ghi đầy đủ, chi tiết.
(**) Trường hợp xin xuất khẩu thuốc chưa có SĐK lưu hành
| Nơi nhận: - Cục Quản lý dược – Bộ Y tế - Lưu tại đơn vị | | ..... Ngày... tháng... năm....Giám đốc DN xuất khẩu(Ghi rõ họ tên, ký, đóng dấu) |
Mẫu số 14
TÊN DOANH NGHIỆP CỘNG HOÀ XÃ HỘI CHỦ NGHĨA VIỆT NAM
Số: ……………....... Độc lập - Tự do - Hạnh phúc
….., ngày…..tháng …… năm ...
Kính gửi: Cục Quản lý dược - Bộ Y tế
Doanh nghiệp: ………………………………………………................………
………………………………………………………………....
Địa chỉ:
Điện thoại: Fax:
Kính đề nghị Cục Quản lý dược- Bộ Y tế xem xét cấp Giấy chứng nhận lưu hành tự do (FSC)/ Giấy chứng nhận sản phẩm dược phẩm (CPP) cho các sản phẩm thuốc sau:
| TT | Tên thuốc | Hoạt chất, thành phần, hàm lượng (nồng độ) | Quy cách đóng gói | Tiêu chuẩn chất lượng | Hạn dùng | Số đăng ký |
|
|
|
|
|
|
|
|
GIÁM ĐỐC DOANH NGHIỆP
(Ký tên, ghi họ tên, đóng dấu)
|
|
Mẫu số 15a
| CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM Bộ Y tế Việt Nam Cục quản lý Dược
| THE SOCIALIST REPUBLIC OF VIETNAM Ministry of Health Drug Administration of Vietnam |
GIẤY CHỨNG NHẬN LƯU HÀNH TỰ DO
FREE SALE CERTIFICATE
CỤC QUẢN LÝ DƯỢC- BỘ Y TẾ CHỨNG NHẬN:
Drug Administration of Vietnam certifies:
Nhà máy sản xuất dược phẩm:
The pharmaceutical manufactuer:
Địa chỉ:
Address:
Được sản xuất và lưu hành trên lãnh thổ Việt Nam sản phẩm dược sau:
Has been authorized to legally manufacture and trade in whole territory of Vietnam
the folloing pharmaceutical product:
|
TÊN THUỐC | Name of product:
|
|
HOẠT CHẤT CHÍNH | Active ingredient (s):
|
| ĐÓNG GÓI | Packaging:
|
|
TIÊU CHUẨN CHẤT LƯỢNG: | Specification:
|
|
HẠN DÙNG: | Shelf-life:
|
|
SỐ ĐĂNG KÝ: | Registration number:
|
|
BAN HÀNH KÈM THEO QUYẾT ĐỊNH SỐ: | Which was approved in the decision:
|
|
GIẤY PHÉP CÓ GIÁ TRỊ ĐẾN NGÀY: | This certificate is valid until:
|
Name of authorized pers
Mẫu số 15b MINISTRY OF HEALTH VIETNAM
Certificate No: DRUG ADMINISTRATION
Certificate of a Pharmaceutical Product(This certificate conforms to the format recommended by the World Health Organization) | Exporting (certifying) country: Viet NamImporting (requesting)country: |
Proprietary Names ( if applicable ) and dosage form:
Active Ingredient ( s ) and amount ( s ) per unit dose:
1.Is this product licensed to be placed on the market for use in the exporting country? If yes, complete Box A, if no, complete Box B.
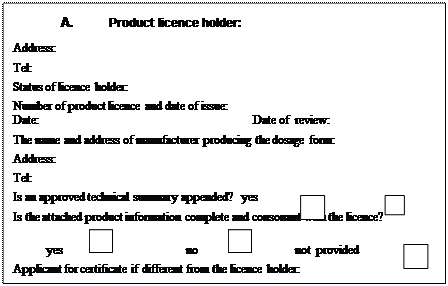 | |||
 | |||
|
|
If no, proceed to question 3
Periodicity of routine inspection ( years): At least once every two years
|
![]() Do the facilities and operations conforms GMP as recommend by the World Health Organization? yes no
Do the facilities and operations conforms GMP as recommend by the World Health Organization? yes no
|
|
Address of the certifying authority: Name of authorized person:
Ministry of Health Vietnam
Drug Administration Signature:
138A - Giang Vo - Ha Noi - Viet Nam Stamp and date:
Mẫu số 16 [28]
CÔNG BỐ DANH MỤC NGUYÊN LIỆU LÀM THUỐC ĐƯỢC PHÉP NHẬP KHẨU KHÔNG YÊU CẦU PHẢI CÓ GIẤY PHÉP NHẬP KHẨU ĐỂ SẢN XUẤT THUỐC THEO HỒ SƠ ĐĂNG KÝ THUỐC
| STT | Tên nguyên liệu | Tiêu chuẩn chất lượng | Tên công ty sản xuất nguyên liệu | Tên nước (nơi sản xuất nguyên liệu | Tên thuốc thành phẩm | SĐK thuốc thành phẩm | Ngày cấp SĐK | Thời hạn hiệu lực SĐK | Ngày công bố, số văn bản công bố | Tên Công ty sản xuất thuốc thành phẩm |
| 1 |
|
|
|
|
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
|
|
|
| 3 |
|
|
|
|
|
|
|
|
|
|
[1] Thông tư số 45/2011/TT-BYT có căn cứ ban hành như sau:
“Căn cứ Luật Dược số 34/2005-QH-11 ngày 14 tháng 6 năm 2005;
Căn cứ Nghị định số 188/2007/NĐ-CP ngày 27/12/2007 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và tổ chức bộ máy Bộ Y tế
Bộ Y tế hướng dẫn việc triển khai áp dụng nguyên tắc, tiêu chuẩn “Thực hành tốt phòng kiểm nghiệm thuốc”, “Thực hành tốt bảo quản thuốc”, “Thực hành tốt sản xuất thuốc”, hướng dẫn sản xuất gia công thuốc, thông tin quảng cáo thuốc, hướng dẫn hoạt động xuất khẩu, nhập khẩu thuốc và bao bì tiếp xúc trực tiếp với thuốc, quy định về đăng ký thuốc như sau:”
Thông tư số 38/2013/TT-BYT có căn cứ ban hành như sau:
“Căn cứ Luật Dược số 34/2005-QH-11 ngày 14 tháng 6 năm 2005;
Căn cứ Nghị định số 63/2012/NĐ-CP ngày 31 tháng 8 năm 2012 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Căn cứ Quyết định số 42/2013/QĐ-TTg ngày 15 tháng 7 năm 2013 của Thủ tướng Chính phủ Quy định về quản lý thuốc dùng cho người theo đường xuất khẩu, nhập khẩu phi mậu dịch và sửa đổi, bổ sung một số điều của Quy định về việc nhập khẩu thuốc chưa có số đăng ký tại Việt Nam ban hành kèm theo Quyết định số 151/2007/QĐ-TTg ngày 12 tháng 9 năm 2007 của Thủ tướng Chính phủ;
Theo đề nghị của Cục trưởng Cục Quản lý Dược,
Bộ trưởng Bộ Y tế ban hành Thông tư sửa đổi, bổ sung một số điều của Thông tư số 47/2010/TT-BYT ngày 29 tháng 12 năm 2010 hướng dẫn hoạt động xuất khẩu, nhập khẩu thuốc và bao bì tiếp xúc trực tiếp với thuốc.”
Thông tư số 13/2015/TT-BYT có căn cứ ban hành như sau:
“Căn cứ Luật Dược số 34/2005-QH-11 ngày 14 tháng 6 năm 2005;
Căn cứ Nghị định số 63/2012/NĐ-CP ngày 31 tháng 8 năm 2012 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Căn cứ Nghị định số 79/2006/NĐ- CP ngày 09 tháng 08 năm 2006 của Chính phủ quy định chi tiết thi hành một số điều của Luật Dược;
Căn cứ Nghị định số 187/2013/NĐ-CP ngày 20 tháng 11 năm 2013 của Chính phủ quy định chi tiết thi hành Luật Thương mại về hoạt động mua bán hàng hoá quốc tế và các hoạt động đại lý mua, bán, gia công và quá cảnh hàng hóa với nước ngoài;
Căn cứ Quyết định số 151/2007/QĐ-TTg ngày 12 tháng 9 năm 2007 của Thủ tướng Chính phủ ban hành quy định về việc nhập khẩu thuốc chưa có số đăng ký tại Việt Nam;
Theo đề nghị của Cục trưởng Cục Quản lý dược,
Bộ trưởng Bộ Y tế ban hành Thông tư sửa đổi Khoản 2 Điều 21 Thông tư số 47/2010/TT- BYT ngày 29 tháng 12 năm 2010 của Bộ Y tế hướng dẫn hoạt động xuất khẩu, nhập khẩu thuốc và bao bì tiếp xúc trực tiếp với thuốc.”
[2] Điểm này được sửa đổi, bổ sung theo quy định tại Khoản 1 Điều 7 của Thông tư số 45/2011/TT-BYT, có hiệu lực kể từ ngày 05 tháng 02 năm 2012.
[3] Khoản này được sửa đổi theo quy định tại Khoản 1 Điều 1 Thông tư số 38/2013/TT-BYT, có hiệu lực kể từ ngày 01 tháng 01 năm 2014.
[4] Khoản này được sửa đổi theo quy định tại Khoản 2 Điều 7 của Thông tư số 45/2011/TT-BYT, có hiệu lực kể từ ngày 05 tháng 02 năm 2012.
[5] Đoạn này được bổ sung theo quy định tại Khoản 3 Điều 7 của Thông tư số 45/2011/TT-BYT, có hiệu lực kể từ ngày 05 tháng 2 năm 2012.
[6] Điểm này được bổ sung theo quy định tại Khoản 4 Điều 7 của Thông tư số 45/2011/TT-BYT, có hiệu lực kể từ ngày 05 tháng 2 năm 2012.
[7] Điều này được sửa đổi theo quy định tại Khoản 2 Điều 1 của Thông tư số 38/2013/TT-BYT, có hiệu lực kể từ ngày 01 tháng 01 năm 2014.
[8] Khoản này được sửa đổi theo quy định tại Điều 1 của Thông tư số 13/2015/TT-BYT, có hiệu lực kể từ ngày 15 tháng 7 năm 2015.
[9] Điểm này được sửa đổi theo quy định tại Khoản 6 Điều 7 của Thông tư số 45/2011/TT-BYT, có hiệu lực kể từ ngày 05 tháng 02 năm 2012.
[10] Điểm này được bãi bỏ theo quy định tại Khoản 7 Điều 7 của Thông tư số 45/2011/TT-BYT, có hiệu lực kể từ ngày 05 tháng 02 năm 2012.
[11] Thông tư số 45/2011/TT-BYT, có hiệu lực kể từ ngày 05 tháng 02 năm 2012 quy định như sau:
“Điều 8. Hiệu lực thi hành
Thông tư này có hiệu lực thi hành kể từ ngày 05 tháng 02 năm 2012. Các quy định trước đây trái với quy định tại Thông tư này đều bãi bỏ.
Trong quá trình thực hiện, nếu có khó khăn vướng mắc, đề nghị các đơn vị phản ánh kịp thời về Cục Quản lý dược - Bộ Y tế để nghiên cứu sửa đổi, bổ sung cho phù hợp./.
Thông tư số 38/2013/TT-BYT, có hiệu lực kể từ ngày 01 tháng 01 năm 2014 quy định như sau:
“Điều 2. Điều khoản chuyển tiếp
1. Hồ sơ đề nghị cấp giấy phép nhập khẩu thuốc chưa có số đăng ký nộp trước ngày 01 tháng 01 năm 2014 thực hiện theo quy định tại Thông tư số 47/2010/TT-BYT ngày 29 tháng 12 năm 2010 của Bộ trưởng Bộ Y tế hướng dẫn hoạt động xuất khẩu, nhập khẩu thuốc và bao bì trực tiếp với thuốc.
2. Giấy phép nhập khẩu nguyên liệu làm thuốc chưa có số đăng ký được cấp trước ngày Thông tư này có hiệu lực được phép thực hiện cho đến hết thời hạn ghi trong giấy phép.
Điều 3. Trách nhiệm thi hành
1. Cục Quản lý Dược công bố trước ngày 31 tháng 12 năm 2014 đối với tất cả các thuốc đã được cấp số đăng ký trước ngày 01 tháng 7 năm 2014.
2. Kể từ ngày 01 tháng 7 năm 2014, Cục Quản lý Dược công bố nguyên liệu thuộc Danh mục nguyên liệu làm thuốc được phép nhập khẩu (không yêu cầu phải có giấy phép) trong vòng 30 ngày làm việc kể từ ngày thuốc được cấp số đăng ký.
Điều 4. Hiệu lực thi hành
Thông tư này có hiệu lực thi hành kể từ ngày 01 tháng 01 năm 2014.
Khoản 3 Điều 4, Điều 19 Thông tư 47/2010/TT-BYT và Mẫu số 1a, Mẫu số 12a, 12b, 12c, 12d, Mẫu số 3 ban hành theo Thông tư 47/2010/TT-BYT hết hiệu lực thi hành kể từ ngày Thông tư này có hiệu lực.
Trong quá trình thực hiện, nếu có khó khăn, vướng mắc, đề nghị các tổ chức, cá nhân phản ánh kịp thời về Bộ Y tế (Cục Quản lý Dược) để được hướng dẫn hoặc sửa đổi, bổ sung cho phù hợp./.”
Thông tư số 13/2015/TT-BYT có hiệu lực kể từ ngày 15 tháng 07 năm 2015 quy định như sau:
Điều 2. Hiệu lực thi hành
1. Thông tư này có hiệu lực thi hành kể từ ngày 15 tháng 7 năm 2015.
2. Khoản 2 Điều 21 Thông tư số 47/2010/TT- BYT ngày 29 tháng 12 năm 2010 của Bộ Y tế hướng dẫn hoạt động xuất khẩu, nhập khẩu thuốc và bao bì tiếp xúc trực tiếp với thuốc hết hiệu lực thi hành kể từ ngày Thông tư này có hiệu lực.
Điều 3. Trách nhiệm thi hành
Chánh Văn phòng Bộ, Cục trưởng Cục Quản lý Dược, Vụ trưởng, Cục trưởng, Tổng cục trưởng thuộc Bộ Y tế, Thủ trưởng các cơ quan, đơn vị trực thuộc Bộ, Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc Trung ương và Thủ trưởng cơ quan y tế các Bộ, ngành chịu trách nhiệm thi hành Thông tư này.
Trong quá trình thực hiện, nếu có vướng mắc, đề nghị phản ánh kịp thời về Bộ Y tế (Cục Quản lý Dược) để nghiên cứu, giải quyết./.
[12] Mẫu này được thay thế bới Mẫu số 3 Phụ lục I ban hành kèm theo Thông tư số 38/2013/TT-BYT, có hiệu lực kể từ ngày 01 tháng 01 năm 2014
[13] Mẫu này được thay thế bới Mẫu số 4 Phụ lục I ban hành kèm theo Thông tư số 38/2013/TT-BYT, có hiệu lực kể từ ngày 01 tháng 01 năm 2014
[14] Mẫu này được thay thế bới Mẫu số 5 Phụ lục I ban hành kèm theo Thông tư số 38/2013/TT-BYT, có hiệu lực kể từ ngày 01 tháng 01 năm 2014
[15] Mẫu này được thay thế bới Mẫu số 6 Phụ lục I ban hành kèm theo Thông tư số 38/2013/TT-BYT sửa đổi, bổ sung một số điều của Thông tư số 47/2010/TT-BYT của Bộ trưởng Bộ Y tế hướng dẫn hoạt động xuất khẩu, nhập khẩu thuộc và bao bì trực tiếp với thuộc, có hiệu lực kể từ ngày 01 tháng 01 năm 2014.
[16] Mẫu này được thay thế bới Mẫu số 7 Phụ lục I ban hành kèm theo Thông tư số 38/2013/TT-BYT sửa đổi, bổ sung một số điều của Thông tư số 47/2010/TT-BYT của Bộ trưởng Bộ Y tế hướng dẫn hoạt động xuất khẩu, nhập khẩu thuộc và bao bì trực tiếp với thuộc, có hiệu lực kể từ ngày 01 tháng 01 năm 2014.
[17] Mẫu này được thay thế bới Mẫu số 8 Phụ lục I ban hành kèm theo Thông tư số 38/2013/TT-BYT, có hiệu lực kể từ ngày 01 tháng 01 năm 2014.
[18] Nhập khẩu với mục đích gì thì chỉ ghi mục đích đó (Mẫu đăng ký lưu hành hoặc kiểm nghiệm/nghiên cứu hoặc thử nghiệm …).
[19] Các trường hợp không xác định hạn dùng thì ghi không xác định và lý do (hóa chất dùng kiểm nghiệm …).
[20] Nhập khẩu với mục đích gì thì chỉ ghi mục đích đó (Mẫu đăng ký lưu hành hoặc kiểm nghiệm/nghiên cứu hoặc thử nghiệm …).
[21] Mẫu này được thay thế bới Mẫu số 2a Phụ lục I ban hành kèm theo Thông tư số 38/2013/TT-, có hiệu lực kể từ ngày 01 tháng 01 năm 2014
[22] Mẫu này được thay thế bới Mẫu số 2b Phụ lục I ban hành kèm theo Thông tư số 38/2013/TT-BYT, có hiệu lực kể từ ngày 01 tháng 01 năm 2014
[23] Mẫu này được thay thế bới Mẫu số 2c Phụ lục I ban hành kèm theo Thông tư số 38/2013/TT-BYT, có hiệu lực kể từ ngày 01 tháng 01 năm 2014
[24] Mẫu này được thay thế bới Mẫu số 2d Phụ lục I ban hành kèm theo Thông tư số 38/2013/TT-BYT, có hiệu lực kể từ ngày 01 tháng 01 năm 2014
[25] Mẫu này được bổ sung bới Mẫu số 2đ Phụ lục I ban hành kèm theo Thông tư số 38/2013/TT-BYT, có hiệu lực kể từ ngày 01 tháng 01 năm 2014
[26] Mẫu này được sửa đổi bởi Mẫu số 13a ban hành kèm theo Phụ lục 5 Thông tư số 45/2011/TT-BYT, có hiệu lực kể từ ngày 05 tháng 2 năm 2012.
[27] Mẫu này được sửa đổi bởi Mẫu số 13b ban hành kèm theo Phụ lục 5 Thông tư số 45/2011/TT-BYT, có hiệu lực kể từ ngày 05 tháng 2 năm 2012.
[28] Mẫu này được bổ sung bởi Mẫu số 1 Phụ lục I ban hành kèm theo Thông tư số 38/2013/TT-BYT, có hiệu lực kể từ ngày 01 tháng 01 năm 2014
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Văn bản hợp nhất 03/VBHN-BYT DOC (Bản Word)
Văn bản hợp nhất 03/VBHN-BYT DOC (Bản Word)