- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 9581:2018 ISO 18743:2015 Vi sinh vật trong chuỗi thực phẩm - Phát hiện ấu trùng Trichinella trong thịt bằng phương pháp phân hủy nhân tạo
| Số hiệu: | TCVN 9581:2018 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
28/12/2018 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 9581:2018
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 9581:2018
TIÊU CHUẨN QUỐC GIA
TCVN 9581:2018
ISO 18743:2015
VI SINH VẬT TRONG CHUỖI THỰC PHẨM - PHÁT HIỆN ẤU TRÙNG TRICHINELLA TRONG THỊT BẰNG PHƯƠNG PHÁP PHÂN HỦY NHÂN TẠO
Microbiology of the food chain - Detection of Trichinella larvae in meat by artificial digestion method
Lời nói đầu
TCVN 9581:2018 thay thế TCVN 9581:2013;
TCVN 9581:2018 hoàn toàn tương đương với ISO 18743:2015;
TCVN 9581:2018 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F8 Thịt và sản phẩm thịt biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Trichinella spp. là tác nhân gây bệnh giun xoắn ở người, một căn bệnh gây nguy hiểm cho sức khỏe cộng đồng và có thể ảnh hưởng đến vấn đề kinh tế trong chăn nuôi lợn. Do tầm quan trọng của bệnh nhiễm trùng này, những nỗ lực chính cần tập trung vào việc kiểm soát và/hoặc loại trừ Trichinella từ lợn nuôi, nguồn lây nhiễm quan trọng nhất sang người. Các phương pháp phân hủy để phát hiện ấu trùng Trichinella trong các mẫu cơ từ lợn và các loài động vật khác dùng làm thực phẩm cho người (ví dụ: ngựa, lợn rừng và gấu), có hiệu quả trong dự phòng nhiễm giun xoắn ở người. Do những hạn chế độ nhạy của phương pháp phân hủy, các phương pháp này có thể không phát hiện được động vật bị nhiễm với số lượng rất nhỏ ấu trùng trong các mẫu cơ, có thể gây nguy cơ nhiễm trùng cận lâm sàng ở người.
VI SINH VẬT TRONG CHUỖI THỰC PHẨM - PHÁT HIỆN ẤU TRÙNG TRICHINELLA TRONG THỊT BẰNG PHƯƠNG PHÁP PHÂN HỦY NHÂN TẠO
Microbiology of the food chain - Detection of Trichinella larvae in meat by artificial digestion method
CẢNH BÁO - Người sử dụng tiêu chuẩn này cần thành thạo với thực hành phòng thử nghiệm thông thường. Tiêu chuẩn này không thể đưa ra được hết tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Người sử dụng tiêu chuẩn này phải tự thiết lập các thao tác an toàn thích hợp và xác định khả năng áp dụng các giới hạn quy định trước khi sử dụng tiêu chuẩn.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp phát hiện Trichinella spp. giai đoạn ấu trùng trong cơ thịt của động vật dùng làm thực phẩm cho người. Tiêu chuẩn này có thể áp dụng để kiểm tra thịt từ các loài động vật nuôi và các loài động vật rừng, có thể bị nhiễm giun xoắn thuộc chi Trichinella.
Phương pháp này không cho phép nhận diện các loài hoặc kiểu gen của ký sinh trùng được phát hiện; việc nhận diện các loài hoặc kiểu gen có thể được thực hiện bằng các phương pháp phân tử.
Phương pháp được mô tả trong tiêu chuẩn này được sử dụng kết hợp với Hướng dẫn của OIE về các thử nghiệm chần đoán và vắcxin và Hướng dẫn của Ủy ban quốc tế về bệnh giun xoắn (ICT) để thử nghiệm Trichinella và kiểm tra thân thịt để dùng làm thực phẩm, trừ khi đã được chứng minh bằng cách khác rằng động vật này không có nguy cơ phơi nhiễm Trichinella.
Phương pháp dùng bộ khuấy từ/phân hủy nhân tạo được coi là phương pháp chuẩn vì đã được chứng minh là cho các kết quả đáng tin cậy nhất trong các nghiên cứu đánh giá xác nhận.
CHÚ THÍCH: Có thể sử dụng các phương pháp thay thế với điều kiện là có văn bản về tính tương đương của các phương pháp đó với phương pháp quy định trong tiêu chuẩn này.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 6404 (ISO 7218), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Yêu cầu chung và hướng dẫn kiểm tra vi sinh vật
International Commission on Trichinellosis [ICT], "Quality Assurance in Digestion Testing Programs for Trichinella", Recommendations and Guidelines. 2012 [Ủy ban quốc tế về bệnh giun xoắn (ICT), “Đảm bảo chất lượng đối với các chương trình thử nghiệm phân hủy Trichinella". Các khuyến nghị và hướng dẫn, 2012]
World Organisation for Animal Health (OIE), Chapter 2.1.16 - "Trichinellosis", Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. 7th ed. 2012 [Tổ chức Thú y thế giới (OIE), Chương 2.1.16 “Bệnh giun xoắn”, Hướng dẫn sử dụng các thử nghiệm chẩn đoán và vắcxin cho động vật trên cạn, xuất bản lần thứ 7, 2012]
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau:
3.1
Ấu trùng cơ Trichinella (Trichinella muscle larvae)
ML
Giai đoạn ấu trùng đầu tiên (L1) của giun tròn thuộc chi Trichinella, nằm ở cơ vân của các loài động vật và có thể lây nhiễm sang người
CHÚ THÍCH: Các ấu trùng này có chiều dài khoảng 0,7 mm đến 1,1 mm và rộng 0,03 mm.
3.2
Phép thử phân hủy (digestion assay)
Phương pháp phát hiện ấu trùng Trichinella trong mô cơ, sử dụng enzym để phân hủy và giải phóng ấu trùng, sau đó là các bước lọc và lắng, phát hiện ấu trùng thu được bằng kính hiển vi
3.3
Số ấu trùng trên gam
Ipg
Số lượng ấu trùng Trichinella có trong một gam mô thịt
4 Nguyên tắc
4.1 Yêu cầu chung
Phương pháp phân hủy nhân tạo được chấp nhận là phương pháp chuẩn quốc tế (xem OIE, Hướng dẫn sử dụng các thử nghiệm chẩn đoán và vắcxin cho động vật trên cạn, 2012, Chương 2.1.16 - Bệnh giun xoắn, trang 307), dựa vào sự phân hủy các sợi cơ bằng enzym trong dung dịch pepsin và axit clohydric, tiếp theo là các bước lắng và rửa, có thể sử dụng các phương pháp tương đương đã được đánh giá xác nhận giá trị sử dụng. Hiệu năng của phép thử bị ảnh hưởng nhiều bởi cỡ mẫu (1 g mẫu có thể phát hiện tin cậy mức nhiễm ≥ 3 Ipg và từ 3 g đến 5 g mẫu sẽ cho phép phát hiện tin cậy ≥ 1 Ipg), loại cơ thịt được chọn, phương pháp được sử dụng và kỹ năng của kỹ thuật viên thực hiện thử nghiệm. Để bảo vệ sức khỏe, phương pháp phải đạt được độ nhạy tối thiểu từ 1 đến 3 ấu trùng/g, do đó, cần lấy cỡ mẫu cơ thích hợp của động vật cần thử nghiệm. Hiện không có các biện pháp kiểm soát chất lượng nội bộ có thể được sử dụng trong khi thực hiện phương pháp này. Một số nguyên tắc cơ bản được sử dụng như dưới đây (xem 4.2 đến 4.9).
4.2 Cỡ mẫu
Để kiểm tra từng thân thịt động vật dùng làm thực phẩm theo các mục đích sức khỏe cộng đồng, thu thập mẫu từ các vị trí thích hợp (xem Phụ lục A) và cỡ mẫu phải dựa trên phân tích nguy cơ, nhưng không ít hơn 1 g mỗi thân thịt.
4.3 Xay trộn/nghiền trộn mẫu
Các mẫu thịt được cắt nhỏ bằng cách sử dụng máy trộn hoặc máy nghiền để tăng diện tích bề mặt cho quá trình phân hủy bằng enzym. Quy trình trộn hoặc nghiền phải được điều chỉnh để tối đa hóa hiệu quả phân hủy.
CHÚ THÍCH: Việc trộn hoặc nghiền không kỹ có thể dẫn đến phân hủy kém, nhưng trộn hoặc nghiền quá kỹ có thể làm hỏng hoặc phá vỡ ấu trùng cơ.
4.4 Chuẩn bị dịch phân hủy
Pepsin bán sẵn trên thị trường ở dạng bột, dạng hạt và dạng lỏng. Hoạt độ của pepsin phải được chứng nhận và pepsin phải được bảo quản theo khuyến cáo của nhà sản xuất.
CHÚ THÍCH: Việc sử dụng pepsin dạng lỏng sẽ thuận lợi hơn vì có thể làm giảm nguy cơ mắc bệnh nghề nghiệp, ví dụ như phản ứng gây dị ứng cho nhân viên phòng thí nghiệm.
4.5 Phân hủy thịt đã cắt nhỏ
Ấu trùng Trichinella sống có khả năng kháng với dịch phân hủy pepsin-HCI và do đó có thể thu được từ mô cơ. Ấu trùng Trichinella đã chết có thể bị phá hủy do phân hủy nhân tạo.
Để việc phân hủy hiệu quả và nhanh chóng, tỷ lệ tối đa 1:20 của thịt so với dịch phân hủy và nhiệt độ 45 °C ± 2 °C phải được duy trì trong suốt quá trình. Thời gian cần thiết để phân hủy ít nhất là 30 min, nhưng trong trường hợp các mẫu cơ ít phản hủy hơn, như từ thân động vật hoang dã, hoặc lưỡi của nhiều loài (xem Phụ lục A), thời gian phân hủy phải tăng lên, nếu không thì phải được đánh giá xác nhận đối với nền mẫu cụ thể, nhưng cũng không được vượt quá tổng số 60 min.
CHÚ THÍCH: Nếu các điều kiện nhiệt độ-thời gian thấp hơn các giá trị yêu cầu, có thể dẫn đến sự phân hủy mô cơ không hoàn toàn. Ngược lại, nhiệt độ cao (trên 50 °C) hoặc thời gian phân hủy kéo dài có thể dẫn đến phá hủy ấu trùng hoặc làm bất hoạt pepsin.
4.6 Lọc dịch phân hủy
Sau khi phân hủy, dịch phân hủy phải được lọc qua rây có cỡ mắt rây cụ thể (6.11), để giữ lại các mô chưa phân hủy, nhưng cho phép ấu trùng đi qua. Rây không được chứa các mảnh vụn trước khi sử dụng và phải được làm ướt trước để dịch phân hủy đi qua nhanh.
4.7 Làm lắng dịch phân hủy
Phần dịch lắng ấu trùng được thực hiện trong một phễu chiết (lắng lần 1) vá một ống thủy tinh (lắng lần 2). Ấu trùng được gom lại từ phần dịch lắng lần 1 và lần 2. Thời gian lắng tương ứng là 30 min và 10 min đối với phần dịch lắng lần 1 và lần 2 (xem Phụ lục B đối với thời gian lắng các mẫu cơ đông lạnh). Nếu thời gian lắng ngắn hơn quy định trên thì không phải tất cả ấu trùng có thể lắng được và có thể không được thu hồi trong phần dịch lắng thu được.
4.8 Kiểm tra bằng kính hiển vi
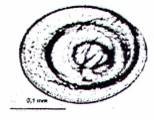
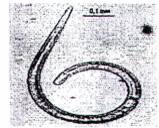
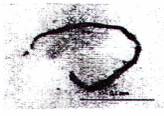
Kiểm tra bằng kính hiển vi phần dịch lắng thứ 2 cho phép người phân tích có kinh nghiệm xác nhận ấu trùng Trithinella và phân biệt với nhiều loại giun tròn khác, sinh vật khác hoặc tạp chất. Để kiểm tra phần dịch lắng, cần hiểu rõ về các đặc điểm hình thái cơ bản của ấu trùng Trichinella, bao gồm kích thước (dài từ 0,7 mm đến 1,1 mm và rộng 0,03 mm), hình dạng và màu sắc (xem Hình C.1 và Hình C.2). Đặc điểm phân biệt rõ nhất của ấu trùng giun xoắn Trichinella là có stichosome gồm một dãy các tế bào hình đĩa bọc ngoài thực quản và chiếm 1/2 thân phía trước; không thể nhận biết cơ quan này bằng kính hiển vi soi nỗi nhưng có thể nhìn thấy bằng kính hiển vi quang học có hai thấu kính hội tụ. Ấu trùng Trichinella có thể xuất hiện ở dạng xoắn (khi lạnh) hoặc chuyển động (khi ẩm) hoặc hình chữ C (khi chết).
Để đạt chất lượng khi thực hiện thử nghiệm phân hủy thông thường, người phân tích phải thực hiện đầy đủ phương pháp dùng bộ khuấy từ/từ phân hủy nhân tạo bằng cách sử dụng các mẫu Trichinella thêm chuẩn (kênh thử nghiệm thành thạo) để thống nhất việc thu hồi và nhận diện ấu trùng. Người phân tích cần được đào tạo về thực hiện thử nghiệm thành thạo phù hợp với hướng dẫn đối với giun xoắn.
4.9 Thẩm tra kết quả
Nếu phát hiện dương tính hoặc nghi ngờ kết quả thì cần nhận diện và khẳng định ở cấp độ loài trong phòng thí nghiệm chuẩn đủ điều kiện, theo định nghĩa của "Các khuyến nghị và hướng dẫn của ICT về Đảm bảo Chất lượng đối với các Chương trình thử nghiệm phân hủy Trichinella", Phần 1 - Đảm bảo chất lượng trong thử nghiệm quy định đối với Trichinella, nghĩa là "phòng thí nghiệm được chính thức công nhận bởi cơ quan quốc gia hoặc quốc tế về trình độ chuyên môn khoa học và chẩn đoán bắt buộc đối với bệnh động vật và/hoặc phương pháp thử nghiệm cụ thể".
5 Thuốc thử
5.1 Nước máy, đã đun nóng đến 47 °C ± 2 °C.
5.2 Axit clohydric (25 %, nồng độ mol: 7,8 đến 7,9, hoặc tỷ lệ phần trăm khác).
5.3 Pepsin (Dạng bột hoặc dạng hạt: 1:10 000 NF, 1:12 500 BP, 2 000 FIP; chất lỏng: 660 U/ml).
CHÚ THÍCH: Hoạt độ của pepsin dạng bột được biểu thị trên gam hoặc “NF” (US National Formulary), "BP" (British Pharmacopoea) hoặc "FIP" (Federation Internationale de Pharmacie); hoạt độ của pepsin lỏng được biểu thị bằng đơn vị Dược điển Châu Âu trên mỗi mililit với tối thiểu 660 U/ml. Các hoạt độ pepsin khác có thể được sử dụng, miễn là hoạt độ cuối cùng trong dịch phân hủy tương đương với hoạt độ của 10 g 1 : 10.000 NF.
5.4 Etanol (cồn etyl 70 % đến 90 %).
5.5 Natri hypoclorit.
6 Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thí nghiệm vi sinh thông thường [xem TCVN 6404 (ISO 7218)1 và cụ thể như sau.
6.1 Khay lấy mẫu hoặc túi chất dẻo được dán nhãn dùng cho mẫu thử.
6.2 Dao, kéo và kẹp để cắt mẫu và loại bỏ các mô không phân hủy được.
6.3 Cân đã hiệu chuẩn, để cân mẫu và/hoặc pepsin (độ chính xác ± 0,1 g).
6.4 Máy xay trộn bằng thủy tinh, chất dẻo hoặc thép, có lưỡi dao sắc (thường xuyên được kiểm tra và/hoặc thay đổi).
6.5 Máy khuấy từ, với tấm gia nhiệt có thể điều chỉnh hoặc máy khuấy từ được đặt trong tủ ấm.
6.6 Nhiệt kế, (chính xác đến ± 0,5 °C, dài nhiệt độ đo được tối thiểu từ 20 °C đến 70 °C).
6.7 Thanh khuấy, (dài tối thiểu 5 cm).
6.8 Cốc thủy tinh có mỏ, (dung tích tối thiểu 3 L).
6.9 Lá nhòm hoặc nắp đậy, để đậy cốc thủy tinh.
6.10 Phễu (thủy tinh, chất dẻo hoặc thép), (đường kính tối thiểu khoảng 15 cm).
6.11 Rây, bằng đồng hoặc thép không gỉ, kích thước mesh cụ thể từ 180 µm đến 200 µm (đường kính khoảng 10 cm hoặc lớn hơn).
6.12 Phễu chiết thủy tình hình nón (dung tích tối thiểu là 2,5 L), tốt nhất là có nút an toàn polytetrafluoroethylen (PTFE) (van khóa).
6.13 Ống nghiệm hoặc ống đong (bằng thủy tinh, có dung tích 50 ml hoặc 100 ml).
6.14 Đĩa Petri (đường kính khoảng 90 mm), kẻ ô vuông khoảng 1 cm hoặc tương đương để đếm ấu trùng.
6.15 Kính hiển vi nổi, có nguồn sáng truyền qua có thể điều chỉnh hoặc dụng cụ soi giun xoắn có bảng nằm ngang. Nên sử dụng loại có khả năng chụp và lưu giữ hình ảnh, nhưng không cần ghi lại các kết quả nghi ngờ.
6.16 Pipet, có dung tích 1 ml, 10 ml và 25 ml.
6.17 Lọ nhỏ, để thu nhận ấu trùng
Không nên sử dụng cốc hoặc phễu chiết bằng chất dẻo hoặc teflon (trừ các van khóa) vì bề mặt thô ráp và tích tĩnh điện có thể làm cho ấu trùng bám vào bề mặt bên trong.
Các dụng cụ nêu trong 6.2, 6.4 và 6.11 cần thường xuyên được làm sạch để không sót lại ấu trùng từ các lần phân tích trước đó.
7 Lấy mẫu, ghi nhãn và vận chuyển
Việc lấy mẫu, ghi nhãn và vận chuyển không phải là một phần của tiêu chuẩn này, nhưng được nêu rõ trong Phụ lục A. Nếu không có tiêu chuẩn cụ thể liên quan đến lấy mẫu thân động vật hoặc các bộ phận của chúng thì các bên cần thỏa thuận về vấn đề này.
Để thu được độ nhạy cần thiết cho thử nghiệm Trichinella ở động vật, cần lấy cỡ mẫu cơ thích hợp (xem Phụ lục A). Các mẫu cơ được lấy từ thân thịt để thử nghiệm phản hủy ít nhất cần gấp đôi lượng cần kiểm tra, để còn loại các mô không phân hủy được.
Khi nhận mẫu, nhân viên phòng thử nghiệm phải kiểm tra tính phù hợp của mẫu bằng cách kiểm tra khối lượng, thành phần, điều kiện, ghi nhãn và các tài liệu kèm theo [được quy định trong 8.3 của TCVN 6404 (ISO 7218)].
Các mẫu cơ cần được phân tích ngay hoặc bảo quản ở 2 °C đến 8 °C để làm chậm quá trình phân hủy tự nhiên và tránh cấp đông.
8 Chuẩn bị mẫu
Các mẫu được sử dụng để thử nghiệm không được chứa chất béo, gân và màng cơ. Nếu mô lưỡi được sử dụng thì phải loại lớp bề mặt khó phân hủy của mô liên kết trước khi thử nghiệm. Cỡ mẫu riêng lẻ tối thiểu để thử nghiệm bằng phân hủy nhân tạo cần được xác định (xem Phần 5 của "Các hướng dẫn khuyến cáo về đảm bảo chất lượng trong chương trình thử nghiệm phân hủy Trichinella". Các khuyến cáo về thành phần cơ bản và yêu cầu tối thiểu đối với chương trình chứng nhận phòng thí nghiệm Trichinella - B.6 Thu thập và xử lý mẫu). Các mẫu từ các cá thể động vật đơn lẻ có thể được gộp lại; khối lượng cơ tối đa trong mẫu chung để phân hủy phải là 100 g, nhưng có thể thêm tối đa 15 g mô cơ bổ sung, nếu cần. Đối với các mẫu gộp có tổng khối lượng cơ thấp hơn (ví dụ: 50 g), thể tích dịch phân hủy và các thành phần có thể được điều chỉnh cho phù hợp, tối thiểu là 1 L.
9 Cách tiến hành
9.1 Yêu cầu chung
Sơ đồ của phương pháp dùng bộ khuấy từ được thể hiện trong Hình C.1.
9.2 Xay trộn/nghiền trộn
Để xay/nghiền, phải bổ sung một lượng nhỏ (50 ml đến 100 ml cho 100 g thịt) dịch phân hủy hoặc nước (45 °C ± 2 °C) vào thịt trong máy xay/máy nghiền để dễ đồng hóa. Việc xay/nghiền phải được tiếp tục cho đến khi thịt được xay nhỏ hoặc nghiền kỹ (thường là ba lần gián đoạn, mỗi lần từ 5 s đến 10 s) nhưng không kéo dài quá lâu vì sẽ gây hại cho ấu trùng.
9.3 Chuẩn bị dịch phân hủy
Pepsin được sử dụng để chuẩn bị dịch phân hủy phải có hoạt độ thích hợp với quá trình phản hủy (xem 5.3). Dịch phân hủy phải được chuẩn bị mới cho mỗi lần phân tích. Các bước chuẩn bị dịch phân hủy như sau:
a) thêm 16 ml axit clohydric 25 % (xem Điều 5) vào cốc thủy tinh có mỏ chứa 2 L nước máy đã được làm nóng trước đến 45 °C ± 2 °C;
b) cho que khuấy vào cốc, đặt cốc trên bộ khuấy từ được làm nóng trước hoặc trên bộ khuấy từ đặt trong tủ ấm và bắt đầu khuấy;
c) thêm 10 g pepsin dạng bột hoặc dạng hạt (1:10 000 NF) hoặc 30 ml pepsin dạng lỏng (660 U/ml).
CHÚ THÍCH 1: Bước quan trọng nhất là bắt buộc tuân thủ trình tự pha trộn dịch phân hủy: 1. nước, 2. axit clohydric và 3. pepsin. Điều này sẽ ngăn ngừa sự suy giảm hoạt độ pepsin do tiếp xúc trực tiếp với axit clohydric đặc.
CHÚ THÍCH 2: Nếu dung dịch gốc của axit clohydric có sẵn khác 25 % thì phải được điều chỉnh cho phù hợp. Ví dụ, nếu sử dụng dung dịch gốc axit clohydric 37 % (nồng độ mol: 12,1) thì thêm 11 ml vào 2 L nước đã được làm nóng trước.
CHÚ THÍCH 3: Có thể sử dụng pepsin với các hoạt độ khác, miễn là hoạt độ cuối cùng trong dịch phân hủy tương đương với hoạt độ của 10 g pepsin 1:10 000 NF.
9.4 Phân hủy thịt cắt nhỏ trong cốc thủy tinh
a) Sau khi xay/nghiền, thịt được chuyển vào cốc thủy tinh 3 L có chứa dịch phân hủy (xem 9.3). Để tránh thất thoát ấu trùng do mô cơ dính vào dụng cụ, máy xay trộn/nghiền trộn phải được rửa kỹ bằng dịch phân hủy trong cốc và bát trộn cũng cần được rửa kỹ bằng một lượng nhỏ dịch phân hủy sau đó được rót trở lại cốc có mỏ.
b) Đậy cốc thủy tinh bằng giấy nhôm để giảm bay hơi và giữ nhiệt độ không đổi 45 °C + 2 °C.
c) Thường xuyên sử dụng nhiệt kế để theo dõi nhiệt độ của dịch phân hủy.
d) Đảm bảo trong quá trình khuấy, dịch phân hủy được quay ở tốc độ đủ cao để tạo xoáy mà không bị bắn tung tóe.
e) Phân hủy mẫu trong 30 min; thời gian phân hủy có thể tăng nếu cần nhưng không được vượt quá 60 min.
9.5 Lọc dịch phân hủy
a) Đảm bảo khóa của phễu chiết được đóng hoàn toàn, cẩn thận rót dịch phân hủy (tránh tràn và đổ tràn) vào phễu chiết qua rây có kích thước mắt rây cụ thể (6.11).
b) Rửa cốc thủy tinh và rây bằng một lượng nước vòi bổ sung (tối thiểu 100 ml) để tránh thất thoát ấu trùng do mô cơ dính vào hoặc ấu trùng bám trên bề mặt của thủy tinh và rây.
c) Quá trình phân hủy được coi là thỏa đáng nếu các mảnh vụn còn sót lại trên rây bao gồm chủ yếu là mô cơ không phân hủy (thường bao gồm màng cơ và mô liên kết) không lớn hơn 5 % khối lượng mẫu ban đầu.
d) Nếu mô cơ chưa phân hủy hoặc mô không phải mô cơ còn trên rây vượt quá mức nêu trên thì phải lặp lại quy trình phân hủy. Trong trường hợp mô cơ không phân hủy quá nhiều, phần còn lại phải được phân hủy và kiểm tra bổ sung cho phần phân hủy ban đầu, hoặc lấy mẫu mới và lặp lại toàn bộ phương pháp (lặp lại quy trình từ 9.2).
CHÚ THÍCH: Vì rây được sử dụng để tách các mành cơ từ ấu trùng Trichinella sau khi phân hủy, không phải để đo, nên cỡ mắt rây không cần phải hiệu chuẩn định kỳ.
9.6 Làm lắng dịch phân hủy trong phễu chiết
Để cho dịch phân hủy lắng trong 30 min.
CHÚ THÍCH: Mặc dù không cần thiết, nhưng nên gõ nhẹ phễu chiết (ví dụ 10 min một lần) có thể giúp ấu trùng lắng xuống đáy phễu.
9.7 Thu phần dịch lắng lần 1 và lần 2
a) Cho khoảng 40 ml dịch phân hủy (phần dịch lắng ban đầu) vào ống thủy tinh.
Nhanh chóng mở hoàn toàn van khóa của phễu và để đảm bảo không có ấu trùng nào bị kẹt lại hoặc không được xả ra do tốc độ dòng chảy thấp.
CHÚ THÍCH 1: Nếu thể tích phần dịch lắng ban đầu quá nhỏ thì ấu trùng có thể vẫn còn trong dịch phân hủy trong phễu chiết và có thể bị thất thoát. Ngược lại, việc có quá nhiều mảnh sẽ ảnh hưởng đến độ trong, nếu thể tích phần dịch lắng lần 1 quá lớn.
b) Để yên 40 ml phần dịch lắng lần 1 trong 10 min.
CHÚ THÍCH 2: Nếu thời gian lắng quá ngắn, có thể thất thoát ấu trùng do không đủ thời gian để lắng.
c) Cẩn thận hút 30 ml phần nổi phía trên, để lại thể tích không quá 10 ml (phần dịch lắng thứ 2).
CHÚ THÍCH 3: Nếu người phân tích cho rằng dịch phân hủy chưa đủ để kiểm tra thì có thể thực hiện bước rửa (thêm 30 ml nước máy và để yên trong 10 min và lặp lại bước 9.7 c).
d) Đổ phần dịch lắng lần 2 vào đĩa Petri hoặc bể đếm ấu trùng. Để lấy hết ấu trùng có thể dính vào bề mặt bên trong của thủy tinh, ống phải được tráng rửa bằng 10 ml nước sau đó cho nước rửa vào đĩa Petri.
e) 20 ml cuối cùng của dịch phân hủy trong đĩa Petri phải được giữ trong ít nhất 1 min để mọi ấu trùng lắng xuống trước khi kiểm tra bằng kính hiển vi.
9.8 Kiểm tra bằng kính hiển vi
a) Kiểm tra dịch phân hủy trong đĩa Petri về độ trong với kính hiển vi soi nổi hoặc dụng cụ soi giun xoắn (trichinoscope) ở độ phóng đại 10x đến 20x.
b) Độ trong của dịch phân hủy phải được kiểm tra bằng khả năng nhìn thấy đường kẻ ô của đĩa Petri hoặc đọc được tờ giấy in đặt dưới đĩa Petri. Nếu phần dịch lắng thứ hai không đủ trong suốt để dễ dàng xác định ấu trùng thì phải thực hiện các bước sau:
1) chuyển phần dịch lắng thứ hai và dùng nước máy tráng đĩa Petri hoặc bể đếm ấu trùng vào ống thủy tinh sạch và thêm nước máy đến tổng thể tích khoảng 40 ml;
2) để lắng trong 10 min;
3) cẩn thận hút phần nổi phía trên [xem 9.7 c)], để lại thể tích 10 ml.
4) rót phần dịch lắng này và dùng 10 ml nước máy rửa ống nghiệm cho vào đĩa Petri có kẻ ô ban đầu.
c) Kiểm tra dịch phân hủy trong đĩa Petri từ ô này sang ô khác bằng kính hiển vi soi nổi hoặc dụng cụ soi giun xoắn ở độ phóng đại 10x đến 20x trong ít nhất 10 min (đây được coi là thời gian tối thiểu để kiểm tra của người có kỹ năng). Việc kiểm tra phải được thực hiện một cách hệ thống, cẩn thận để tránh dịch chuyển chất lỏng trong đĩa Petri.
d) Việc kiểm tra phải được thực hiện ngay sau khi phân hủy; nếu không, đĩa Petri phải được bảo quản lạnh và dịch phân hủy phải được kiểm tra trong cùng ngày phân hủy.
e) Mọi kết quả nghi ngờ là Trichinella hoặc các sinh vật khác phải được kiểm tra thêm bằng kính hiển vi ở độ phóng đại 60x đến 100x (xem Hình C.2).
f) Nếu kết quả có phát hiện Trichinella dương tính thì ấu trùng phải được chuyển ngay vào lọ nhỏ (1 ml đến 2 ml) đổ đầy cồn etyl 70 % đến 90 % (nồng độ cuối cùng) để bảo quản.
g) Khuyến cáo khẳng định việc nhận diện bằng kính hiển vi và sinh học phân tử (ví dụ bằng PCR) ở cấp độ loài/kiểu gen của mọi loại ấu trùng phải được thực hiện bởi phòng thí nghiệm được trang bị đầy đủ.
Nếu có yêu cầu, các mẫu gộp có Trichinella dương tính hoặc nghi ngờ phải được truy vết tới thân thịt ban đầu qua việc phân hủy số lượng mẫu gộp nhỏ và tăng dần của cỡ mẫu tăng, từ các thân thịt có liên quan. Các mẫu gộp có kết quả âm tính cần được loại trừ, các mẫu gộp có kết quả dương tính cần tiếp tục được lấy mẫu và thử nghiệm cho đến khi việc phân hủy các mô từ thân thịt riêng lẻ cho kết quả dương tính.
10 Hệ thống văn bản
Mỗi phòng thí nghiệm phải có một bản ghi chép công việc chứng minh việc thử nghiệm Trichinella được thực hiện đúng theo các tiêu chuẩn đảm bảo chất lượng thích hợp. Mỗi phòng thí nghiệm có một bảng (xem Phụ lục D) để người phân tích ghi lại dữ liệu cho các báo cáo thử nghiệm và do đó, lập hồ sơ cần thiết cho việc đánh giá chất lượng và điều tra truy vết. Các nội dung chính trong bảng nêu trên bao gồm thông tin theo dõi mẫu, hồ sơ lưu về phương pháp được người đã qua đào tạo thực hiện đúng, hồ sơ lưu về các vấn đề cùng những điểm bất thường và hồ sơ kết quả. Bảng này được lưu giữ theo yêu cầu.
11 Biểu thị kết quả
Kết quả phải được biểu thị là "có mặt" hoặc "không có mặt" ấu trùng Trichinella trong "x" gam mẫu.
12 Các biện pháp an toàn
Chất lỏng (dịch phân hủy, chất lòng nỗi phía trên, nước tráng rửa, v.v...) cũng như dụng cụ thủy tinh và các thiết bị khác, có thể bị nhiễm ấu trùng Trichinella, phải được khử nhiễm bằng cách sấy ở ít nhất 70 °C hoặc bằng phương pháp hóa học thay thế (ví dụ: dùng natri hypoclorit ở nồng độ cuối cùng là 0,01 % clo hoạt độ, tối thiểu trong 3 h) trước khi loại bỏ hoặc rửa.
Phụ lục A
(quy định)
Lấy mẫu
A.1 Yêu cầu chung
Để có được độ nhạy mong muốn đối với thử nghiệm Trichinella ở động vật nuôi hoặc động vật hoang dã, phải lấy cỡ mẫu cơ thích hợp từ cơ của các loài động vật đích. Xem Bảng A.1 để biết danh mục các cơ của các loài động vật. Cỡ mẫu cần thử nghiệm phải được xác định dựa trên phân tích nguy cơ nhiễm Trichinella ở động vật đang được điều tra, kiến thức khoa học về độ nhạy thử nghiệm và mục đích thử nghiệm.
Bảng A.1 - Các phần cơ thích hợp để thử nghiệm Trichinella của một số loài động vật
| Các loài động vật | Các phần cơ được chọn |
| Lợn nhà (Sus scrofa domesticus) | Cơ hoành, cơ hàm |
| Ngựa (Equus ferus caballus) | Cơ hoành, cơ hàm, lưỡi |
| Lợn rừng (Sus scrota) | Cơ hoành, chân trước, lưỡi |
| Chó nhà (Canis lupus familiaris) | Cơ hoành, cơ hàm, lưỡi |
| Gấu (Ursus spp.) | Cơ hoành, cơ hàm, lưỡi |
| Hải mã (Odobenus spp.) | Lưỡi |
| Hải cẩu (họ Phocidae) | Cơ hoành, cơ sườn, lưỡi |
| Cá sấu (Crocodylus niloticus) | Cơ sườn, cơ hàm |
| Cáo (Vulpes spp.) | Cơ hoành, chân trước, lưỡi |
| Gấu chó (Nyctereutes procyorwides) | Cơ hoành, chân trước, lưỡi |
Đối với lợn, các mẫu cơ sẽ được lấy từ các trụ cơ hoành hoặc từ cơ cắn. Trong trường hợp không có các cơ của vị trí đó, phải lấy một lượng lớn các mẫu cơ từ các cơ vân khác gần xương hoặc gân.
Các mẫu phải bao gồm các mô cơ vân; tránh dùng mô liên kết hoặc chất béo, không thích hợp cho thử nghiệm phân hủy. Mẫu phải được lấy bằng dao hoặc dụng cụ cắt khác.
Khối lượng mẫu phải gấp hai lần khối lượng cần thiết để thực hiện phép thử, để cho phép cắt tỉa các mô không phá hủy để thu được lượng cơ vân cần thiết cho phép thử.
A.2 Nhận dạng mẫu
Các mẫu cơ (mẫu gộp) phải được dán nhãn khi thu thập để theo dõi từng thân thịt động vật và các bộ phận của chúng (ví dụ: đối với mẫu ngựa, việc ghi nhẫn phải thể hiện sự tương ứng giữa mẫu, đầu ngựa và thân thịt).
A.3 Hệ thống tài liệu
Chuẩn bị ít nhất cho mỗi lô động vật, một tài liệu báo cáo tất cả các thông tin có liên quan về lô hàng và sự tương ứng giữa các mẫu và thân thịt.
A.4 Vận chuyển
Chuyển các mẫu đến phòng thí nghiệm càng sớm càng tốt ở nhiệt độ sao cho ngăn cản sự phân hủy mẫu, nhưng tránh làm lạnh [vận chuyển được quy định trong 8.2 của TCVN 6404 (ISO 7218)].
Phụ lục B
(quy định)
Mẫu đông lạnh
B.1 Yêu cầu chung
Mẫu cơ từ động vật (ví dụ: giám sát động vật hoang dã), không thể kiểm tra trực tiếp sau khi thu thập hoặc không thể bào quản ở nhiệt độ mát trong vài ngày, phải được bảo quản trong điều kiện đông lạnh (-20 °C) cho đến khi thử nghiệm. Mặc dù đông lạnh là lựa chọn cuối cùng cho thử nghiệm Trichinella, đôi khi thân thịt cần phải được đông lạnh trước khi thử nghiệm (ví dụ: cáo trong vùng nhiễm sán Echinococcus multilocularis). Việc đông lạnh sẽ tiêu diệt hầu hết các loài và kiểu gen của Trichinella, nhưng một số loài và kiểu gen có khả năng chịu đông lạnh một phần hoặc hoàn toàn (ví dụ: T. nativa). Kết quả từ các nghiên cứu thực nghiệm cho thấy ấu trùng chết có thời gian lắng đọng kéo dài do sự thay đổi mật độ và hình dạng của chúng (từ ấu trùng đến hình chữ C). Vì vậy, thời gian lắng cần được kéo dài cho các mẫu cơ đông lạnh, lưu ý rằng thời gian lắng lâu hơn có thể dẫn đến một lượng lớn các mảnh trong phần dịch lắng.
Phương pháp phân hủy nhân tạo có thể được áp dụng cho các mẫu đông lạnh có sửa đổi tại các điểm sau (xem B.2 đến B.4).
B.2 Lấy mẫu
Khối lượng mẫu đông lạnh được thử nghiệm bằng cách phân hủy cần được tăng để bù cho việc giảm độ nhạy của phép thử, vì quá trình cấp đông có thể ảnh hưởng đến kết quả phân hủy; các loài không chịu được cấp đông sẽ bị tiêu diệt và do đó có thể bị phá hủy trong quá trình phân hủy.
B.3 Làm lắng
Nếu các mẫu cơ đã được đông lạnh trước khi phân hủy, ấu trùng của các loài Trichinella nhạy với cấp đông sẽ chết. Vì ấu trùng chết sẽ duỗi thẳng và giải phóng khỏi mô cơ nên tốc độ lắng của chúng giảm đi. Do đó, thời gian lắng (xem 9.6) đối với các mẫu cơ đông lạnh, trong đó có ấu trùng chết được dự kiến kéo dài đến 60 min.
B.4 Kiểm tra bằng kính hiển vi
Ấu trùng chết có thể ở dạng duỗi thẳng và trong; do đó khó phát hiện bằng kính hiển vi và phải đặc biệt chú ý trong việc kiểm tra dịch phân hủy trong đĩa Petri.
Sự thoái hóa ADN xảy ra nhanh trong ấu trùng chết, cản trở việc nhận diện phân tử ấu trùng ở loài hoặc kiểu gen.
Phụ lục C
(tham khảo)
Phương pháp phân hủy nhân tạo bằng khuấy từ
Xem Hình C.1 và Hình C.2.
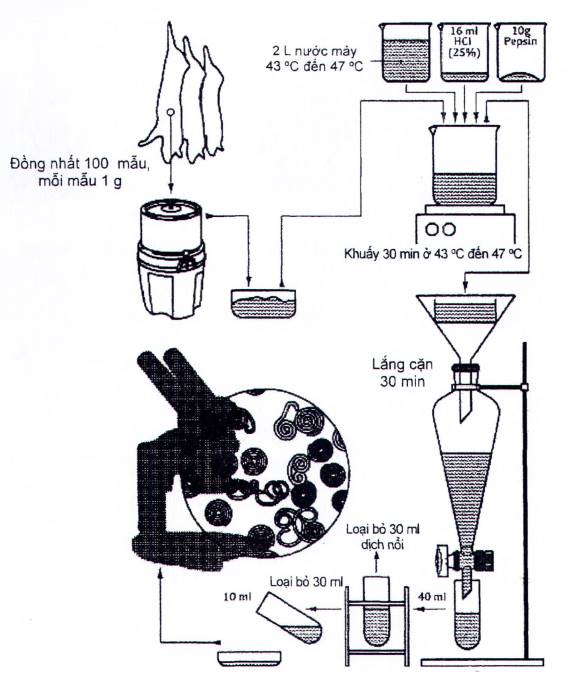
Hình C.1 - Sơ đồ phương pháp
|
|
|
|
| a) Ấu trùng cơ Trichineila | b) Tạp chất - Lông mao | c) Ấu trùng của các giun tròn khác - Metastrongylus sp |
|
|
|
|
| d) Ấu trùng cơ Trichinella | e) Tạp chất - sợi xơ | f) Ấu trùng của các giun tròn khác - Taxocara sp |
Hình C.2 - Kết quả soi hiển vi sau khi phân hủy
Phụ lục D
(tham khảo)
Ví dụ về bảng ghi chép trong phòng thí nghiệm để ghi dữ liệu thử nghiệm mẫu chung bằng thử nghiệm phân hủy
| SOP |
| Pepsin: số lô | Số thứ tự bao: |
| Mã số mẫu | Lợn g | Ngựa g | Lợn rừng g | Các loài động vật khác | Thời gian phân hủy min | Phần giữ lại trên rây 9 | Âm tính | Nghi ngờ dương tính | Số lượng ấu trùng trên gam |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CHÚ THÍCH
| Ngày | Người phân tích | Chữ ký | Ngày | Người phê duyệt | Chữ ký |
Thư mục tài liệu tham khảo
[1] Forbes L.B., Gajadhar A.A. A validated Trichinella digestion assay and an associated sampling and quality assurance system for use in testing pork and horse meat J. Food Prot. 1999, 62 pp. 1308-1313
[2] GAJADHAR a.a., POZIO E., GAMBLE H.R., NÖCKLER K., MADDOX-HYTTEL C., FORBES L.B., VALLEE I,, ROSSI P., MARINCULIC A., BOIREAU P. Trichinella diagnostics and control: Mandatory and best practices for ensuring food safety. Vet. Parasitol. 2009, 159pp. 197-205
[3] GAMBLE H.R. Detection of trichinellosis in pigs by artificial digestion and enzyme immunoassay. J. Food Prot. 1996, 59pp. 295-298
[4] GAMBLE H.R., BESSONOV A.s., CUPERLOVIC K., GAJADHAR A.A., VAN KNAPEN F„ NÖCKLER K., Schenone H, Zhu X. International Commission on Trichinellosis: Recommendations on methods for the control of Trichinella in domestic and wild animals intended for human consumption. Vet. Parasitol. 2000, 93 pp. 393-408
[5] GOTTSTEIN B., POZIO E., NÖCKLER K.. Epidemiology, diagnosis, treatment, and control of trichinellosis. Clin Microbiol Rev.2009, 22(1), pp. 127-145
[6] KAPEL C.M.O., WEBSTER P., GAMBLE R. Muscle distribution of sylvatic and domestic Trichinella larvae in production animals and wildlife. Vet. Parasitol. 2005, 132 pp. 101-105
[7] LECLAIR D., FORBES L.B., SUPPA S., GAJADHAR A.A. Evaluation of a digestion assay and determination of sample size and tissue for the reliable detection of Trichinella larvae in walrus meat. J. Vet. Diagn. Invest. 2003, 15 pp. 188-191
[8] LARTEr N.C., FORBES L.B., ELKIN B.T., Allaire D.G. Prevalence of Trichinella spp. in black bears, grizzly bears, and wolves in the Dehcho Region, Northwest Territories, Canada, including the first report of T. nativa in a grizzly bear from Canada. J. Wildl. Dis. 2011, 47 pp. 745-749
[9] MURREL K.D., POZIO E. The Worldwide Occurrence and Impact of Human Trichinellosis, 1986-20. Emerg. Infect. Dis. 2011, 17 pp. 2194-2202. Epub 2011 Dec. DOI: 10.3201/eid1712.110896
[10] NÖCKLER K, RECKINGER S, SZABO I, Maddox-Hyttel C, POZIO E, VAN DER GIESSEN J, VALLÉE I, BOIREAU P. Comparison of three artificial digestion methods for detection of non-encapsulated Trichinella pseudospiralis larvae in pork. Vet Parasltol. 2009,159(3-4), pp. 341-344. Epub 2008 Nov 1. PubMed PMID: 19062196
[11] NÖCKLER K., POZIO E., VOIGT W.P., HEIDRICH J. Detection of Trichinella infection in food animals. Vet. Parasitol. 2000, 93pp. 335-350
[12] NOCKLER K., KAPEL C.M.O. Detection of Trichinella, meat inspection and Hygiene, legislation. In: FAO/WHO/OIE guidelines for the surveillance, management, prevention and control of trichinellosis, (DUPOUY-CAMET J., MURRELL K.D., eds ). World Organisation for Animal Health Press, Paris, 2007, pp. 61-98.
[13] Webster P., MADDOX-HYTTEL C., NÖCKLER K., MALAKAUSKAS A., VAN DER GIESSEN J., POZIO E., BOIREAU P., KAPEL C.M. Meat inspection for Trichinella in pork, horsemeat and game within EU: available technology and its present implementation. Euro Surveill. 2006, 11(1) pp. 50-55
[14] Commission Internationale sur la Trichinellose. http://www.trichinellosis.org/Guidelines.html
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 9581:2018 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 9581:2018 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 9581:2018 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 9581:2018 DOC (Bản Word)