- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Việt Nam TCVN 6401:1998 ISO 10560:1993 (E) Sữa và các sản phẩm sữa
| Số hiệu: | TCVN 6401:1998 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học, Công nghệ và Môi trường | Lĩnh vực: | Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
01/01/1998 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 6401:1998
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 6401:1998
TIÊU CHUẨN VIỆT NAM
TCVN 6401 : 1998
ISO 10560 : 1993 (E)
SỮA VÀ CÁC SẢN PHẨM SỮA – PHÁT HIỆN LISTERIA MONOCYTOGEN
Milk and milk products – Detection of Listeria monocytogenes
Lời nói đầu
TCVN 6401 : 1998 hoàn toàn tương đương với ISO 10560 : 1993 (E)
TCVN 6401 : 1998 do Ban kỹ thuật tiêu chuẩn TCVN/TC/F12 Sữa và sản phẩm sữa biên soạn, Tổng cục Tiêu chuẩn – Đo lường – Chất lượng đề nghị, Bộ Khoa học, Công nghệ và Môi trường ban hành.
SỮA VÀ SẢN PHẨM SỮA – PHÁT HIỆN LISTERIA MONOCYTOGEN
Milk and milk products – Detection of Listeria monocytogenes
1. Phạm vi áp dụng
Tiêu chuẩn này qui định phương pháp phát hiện Listeria monocytogens trong sữa và sản phẩm sữa.
2. Tiêu chuẩn trích dẫn
TCVN 6404 : 1998 (ISO 7218:1997) Vi sinh vật học – Nguyên tắc chung về kiểm tra vi sinh vật.
TCVN 6263 : 1997 (ISO 8261:1989) Sữa và sản phẩm sữa – Chuẩn bị mẫu thử và các dung dịch pha loãng để kiểm tra vi sinh vật.
3. Định nghĩa
Áp dụng định nghĩa sau đây trong tiêu chuẩn này:
Listeria spp: Các vi sinh vật tạo thành các khuẩn lạc đặc trưng trên môi trường đặc chọn lọc và cho thấy rõ các đặc tính hình thái học, sinh lý học và sinh hóa như mô tả, khi tiến hành thử theo tiêu chuẩn này.
3.1.1. Listeria monocytogen: là một loài Listeria gây bệnh và có thể phân biệt với loài Listeria không gây bệnh khác có mặt trong sữa và sản phẩm sữa bằng các đặc tính sinh hóa nhất định.
3.2. Phát hiện Listeria monocytogen: là việc xác định sự có mặt hay không của các vi sinh vật này trong một khối lượng hay một thể tích được qui định, khi tiến hành thử theo tiêu chuẩn này.
4. Nguyên tắc
Nhìn chung, việc phát hiện Listeria spp, đòi hỏi ít nhất ba giai đoạn liên tục như trong 4.1 đến 4.3. Xem thêm sơ đồ qui trình thử trong hình 1.
Phần mẫu thử (25 g hoặc 25 ml)
+
Môi trường tăng sinh chọn lọc (225 ml)
Nuôi ấm ở 30oC trong 48 h
¯
Ria cấy trên thạch Oxford
Nuôi ấm ở 37oC trong 48 h
¯
Chọn năm khuẩn lạc đặc trưng từ mỗi đĩa
¯
Cấy vào môi trường TSYEA
Nuôi ấm ở 37oC trong 24 h (hoặc lâu hơn, nếu cần)
¯
Các phép thử tiếp theo
Hình 1 – Sơ đồ qui trình thử
4.1. Tăng sinh trong môi trường lỏng chọn lọc
Cấy phần mẫu thử vào môi trường chọn lọc và nuôi ấm ở 30oC trong 48 h.
4.2. Phân lập và nhận dạng sơ bộ
Cấy từ mẫu thử trong môi trường tăng sinh (4.1) vào môi trường phân lập, nuôi ấm ở 37oC và sau 48 h kiểm tra sự có mặt các khuẩn lạc được coi là Listeria spp giả định theo dáng vẻ bên ngoài.
4.3. Khẳng định
Cấy truyền các khuẩn lạc Listeria spp. giả định (4.2) lên một môi trường đặc trưng không chọn lọc, và khẳng định bằng các thử nghiệm hình thái, sinh lý và sinh hóa.
5. Môi trường nuôi cấy và thuốc thử
5.1. Khái quát
Xem TCVN 6404 : 1998 (ISO 7218)
5.2. Môi trường nuôi cấy
5.2.1. Môi trường chọn lọc: Môi trường tăng sinh
5.2.1.1. Môi trường cơ bản
5.2.1.1.1. Thành phần
| Canh thang tripton đậu tương:1) Cao men: Nước: | 30 g 6g 1 000ml |
| 1) Thành phần của canh thang đậu tương: Tripton (thủy phân pancratic từ casein): Soyton (thủy phân papaic từ bột đậu tương): Dextroza: Natri clorua: Dikali photphat: |
17 g 3 g 2,5 g 5 g 2,5 g |
5.2.1.1.2 Chuẩn bị
Hòa tan các thành phần khô hoặc môi trường cơ bản hoàn chỉnh khô trong nước bằng cách đun sôi.
Nếu cần, chỉnh pH sao cho sau khi khử trùng pH là 7,3 ở nhiệt độ 25oC.
Phân phối từng lượng 225 ml vào các bình thí nghiệm dung tích 500 ml (hoặc các bội số của 225 ml vào các bình thí nghiệm có dung tích thích hợp). Khử trùng 15 phút trong nồi hấp áp lực (6.1.1.2) ở 121oC.
5.2.1.2. Phần bổ sung 1
5.2.1.2.1. Thành phần
| Acriflavin hidroclorua: Nước: | 23 mg 10 ml |
5.2.1.2.2. Chuẩn bị
Hòa tan arciflavin hidroclorua trong nước. Khử trùng qua lọc.
Chú thích 1 – Về chi tiết kỹ thuật khử trùng bằng cách lọc, có thể tham khảo bất kỳ tài liệu nào thích hợp về vi sinh vật học.
5.2.1.3. Phần bổ sung 2
5.2.1.3.1. Thành phần
| Axit nalidixic (muối natri): Natri hidroxit (0,05 mol/l): | 46 mg 10 ml |
5.2.1.3.2. Chuẩn bị
Hòa tan axit nalidixic trong dung dịch natri hidroxit. Khử trùng qua lọc.
5.2.1.4. Phần bổ sung 3
5.2.1.4.1 Thành phần
| Xicloheximid: Etanola: Nước: | 57,5 mg 4 ml 6 ml |
5.2.1.4.2 Chuẩn bị
Hòa tan xicloheximid trong hỗn hợp etanola/nước. Khử trùng qua lọc.
5.2.1.5. Môi trường hoàn chỉnh
Bảo quản riêng môi trường cơ bản (5.2.1.1) và các phần bổ sung đã chuẩn bị (từ 5.2.1.2 đến 5.2.1.4) chỗ tối ở nhiệt độ từ 2oC đến 5oC. Chuẩn bị môi trường hoàn chỉnh bằng cách thêm: 1 ml của phần bổ sung 1; 2 ml của phần bổ sung 2 và 2 ml của phần bổ sung 3 vào 225 ml môi trường cơ bản (5.2.1.1).
Chú thích 2 – Khi cần có thể sử dụng các bình thí nghiệm có dung tích thích hợp khác, như các bội số tương ứng với 1 ml, 2 ml và 225 ml.
5.2.2. Môi trường phân lập (thạch Oxford)
5.2.2.1. Môi trường thạch cơ bản
5.2.2.1.1. Thành phần
| Môi trường thạch columbia cơ bản: Aesculin: Amoni sắt (III) xitrat: Liti clorua: Nước: | 39 g 1 g 0,5 g 15 g 1 000 ml |
5.2.2.1.2 Chuẩn bị
Hòa tan các thành phần rắn trong nước bằng cách đun sôi.
5.2.2.2. Phần bổ sung cho 500 ml môi trường trên
5.2.2.2.1. Thành phần
| Xicloheximid: Colistin sunfat: Acriflavin: Xefotetan: | 200 mg 10 mg 2,5 mg 1 mg | Fostomixin: Etanola: Nước: | 5 mg 2,5 ml 2,5 ml |
5.2.2.2.2. Chuẩn bị
Hòa tan các thành phần rắn trong hỗn hợp etanola/nước. Khử trùng qua lọc.
5.2.2.3 Chuẩn bị môi trường hoàn chỉnh
Lấy 500 ml môi trường thạch cơ bản (5.2.2.1). Khử trùng 15 phút trong nồi hấp áp lực (6.1.1.2) ở nhiệt độ 121oC. Làm nguội tới 50oC và bằng thao tác vô trùng thêm phần bổ sung (5.2.2.2). Độ pH của môi trường cuối cùng này phải là 7,0 ở 25oC.
Phân phối môi trường vào các đĩa Petri vô trùng với các lượng khoảng 15 ml và để cho đông lại.
5.2.3. Môi trường nuôi cấy đặc: Thạch cao men tripon đậu tương (TSYEA)
5.2.3.1. Thành phần
| Canh thang tripon đậu tương: Cao men: Thạch 1): Nước: | 30 g 6 g từ 12 g đến 18 g 1 000 ml |
| 1) Tùy theo cường độ gel của thạch | |
5.2.3.2. Chuẩn bị
Hòa tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi.
Nếu cần, chỉnh pH để sau khi khử trùng pH là 7,3 ở nhiệt độ 25oC.
Phân phối các lượng khoảng 6 ml môi trường nuôi cấy đặc vào các ống nghiệm (6.2.2).
Khử trùng các ống nghiệm này 15 phút trong nồi hấp áp lực (6.1.1.2) ở nhiệt độ 121oC.
Đặt các ống ở tư thế ngang.
Để chuẩn bị các đĩa thạch, khử trùng môi trường nuôi cấy đặc trong các bình hoặc các chai có dung tích thích hợp. Phân phối môi trường này khi chúng vẫn còn lỏng theo các lượng khoảng 15 ml các đĩa Petri vô trùng và để cho đông lại.
5.2.4. Môi trường nuôi cấy lỏng: canh thang cao men tripton đậu tương (TSYEB)
5.2.4.1. Thành phần
Thành phần của môi trường này như quy định trong 5.2.1.1.1. Sử dụng 6g cao men.
5.2.4.2. Chuẩn bị
Chuẩn bị môi trường này theo 5.2.1.1.2.
Phân phối theo các lượng khoảng 6 ml vào các ống nghiệm trước khi khử trùng trong nồi hấp áp lực.
5.2.5. Thạch máu
5.2.5.1. Thành phần
| Môi trường cơ bản của thạch máu No.2: 1) Nước: Máu ngựa hoặc máu cừu đã loại tơ huyết: | 40 g 1 000 ml 70 ml |
| 1) Thành phần của thạch máu No.2: Pepton proteoza: Thủy phân gan: Cao men: Natri clorua: Thạch (tùy theo cường độ gel của thạch): |
15 g 2,5 g 5 g 5 g 12g-18g |
5.2.5.2. Chuẩn bị
Hòa tan môi trường thạch máu khô trong nước bằng cách đun sôi.
Nếu cần, chỉnh pH sao cho sau khi khử trùng pH là 7,0 ở nhiệt độ 25oC. Phân phối môi trường vào các ống nghiệm hoặc các bình thí nghiệm dung tích không quá 500 ml.
Khử trùng thạch máu 15 phút trong nồi hấp áp lực (6.1.1.2) ở 121oC.
Làm nguội môi trường này tới 45oC. Bổ sung máu đã loại tơ huyết và lắc đều.
Phân phối môi trường theo các lượng khoảng 20 ml vào các đĩa Petri vô trùng và để cho đông lại.
5.2.6. Canh thang có hidrat cacbon
5.2.6.1. Môi trường cơ bản
5.2.6.1.1. Thành phần
| Pepton proteoza: Cao thịt bò: Natri clorua: | 10 g 1 g 5 g | Bromocresol đỏ tía: Nước: | 0,02 g 1 000 ml |
5.2.6.1.2. Chuẩn bị
Hòa tan các thành phần trên trong nước bằng cách đun sôi.
Nếu cần, chỉnh pH sao cho sau khi khử trùng pH là 6,8, ở nhiệt độ 25oC.
Phân phối môi trường này vào các ống nghiệm theo các lượng sao cho sau khi khử trùng còn lại 9 ml.
Khử trùng thạch máu 15 phút trong nồi hấp áp lực (6.1.1.2) ở 121oC.
5.2.6.2. Các dung dịch hidrat cacbon
5.2.6.2.1. Thành phần
| Hidrat cacbon 1) Nước | 5 g 1 00 ml |
| 1) Cần có 100ml dung dịch L-rhamnoza và 100ml dung dịch D-xyloza | |
5.2.6.2.2. Chuẩn bị
Hòa tan riêng rừng hidrat cacbon trong 100ml nước. Khử trùng qua lọc.
5.2.6.3. Môi trường hoàn chỉnh
Đối với mỗi loại hidrat cacbon, bằng thao tác vô trùng thêm 1ml dung dịch (5.2.6.2) vào 9 ml môi trường cơ bản (5.2.6.1). Nếu các thể tích môi trường cơ bản chuẩn bị nhỏ hơn, thì thêm các thể tích dung dịch hidrat cacbon tương ứng nhỏ hơn.
5.2.7. Môi trường di động
5.2.7.1. Thành phần
| Pepton casein: Pepton thịt: | 20,0 g 6,1 g | Thạch: Nước: | 3,5 g 1 000 ml |
5.2.7.2. Chuẩn bị
Hòa tan các thành phần trên trong nước bằng cách đun sôi.
Nếu cần, chỉnh pH sao cho sau khi khử trùng pH là 7,3, ở nhiệt độ 25oC.
Phân phối môi trường này vào các ống nghiệm theo các lượng khoảng 5 ml.
Khử trùng 15 phút trong nồi hấp áp lực (6.1.1.2) ở 121oC.
Chú thích 3 – Có thể dùng các môi trường có bán sẵn trên thị trường để kiểm tra tính di động.
5.2.8. Phép thử CAMP
Có thể dùng các đĩa thạch máu (5.2.5) cho thử nghiệm này, nhưng tốt nhất dùng các đĩa thạch máu cừu lớp kép có lớp máu rất mỏng (5.2.8.3).
5.2.8.1. Môi trường cơ bản
5.2.8.1.1. Thành phần
| Môi trường cơ bản của thạch máu No.2 (xem 5.2.5): | 40 g |
| Nước: | 1 000 ml |
5.2.8.1.2. Chuẩn bị
Hòa tan môi trường cơ bản khô trong nước bằng cách đun sôi.
Nếu cần, chỉnh pH sao cho sau khi khử trùng pH là 7,0, ở nhiệt độ 25oC.
Phân phối môi trường cơ bản này vào các lọ hoặc bình với lượng khoảng 100 ml.
Khử trùng 15 phút trong nồi hấp áp lực (6.1.1.2) ở 121oC. Làm nguội tới 45oC.
5.2.8.2 Môi trường máu
5.2.8.2.1. Thành phần
| Môi trường cơ bản (5.2.8.1): | 100 ml |
| Máu ngựa hoặc máu cừu đã loại tơ huyết: | 7 ml |
5.2.8.2.2. Chuẩn bị
Thêm máu đã loại tơ huyết vào môi trường cơ bản tan chảy đã khử trùng (5.2.8.1).
5.2.8.3. Môi trường hoàn chỉnh
Phân phối môi trường cơ bản (5.2.8.1) vào các đĩa Petri vô trùng với các lượng khoảng 10 ml và để cho đông lại. Rót vào mỗi đĩa một lớp rất mỏng môi trường máu (5.2.8.2), không quá 3 ml.
Để yên cho đông lại. Nếu như máu rót vào đĩa có chứa môi trường cơ bản đã chuẩn bị từ trước, thì có thể làm ấm 20 phút trong tủ ấm, để ở 37oC trước khi rót sang lớp máu.
Làm khô các đĩa trước khi sử dụng.
5.2.8.4. Chất cấy phản ứng CAMP
Chủng Staphylococcus aureus làm tan máu ![]() yếu (thí dụ như NCTC 1803) và chủng Rhodococcus equi (thí dụ như NCTC1621) cần phải thử CAMP. Không phải tất cả các chủng Staphylococcus aureus đều thích hợp thử CAMP.
yếu (thí dụ như NCTC 1803) và chủng Rhodococcus equi (thí dụ như NCTC1621) cần phải thử CAMP. Không phải tất cả các chủng Staphylococcus aureus đều thích hợp thử CAMP.
Bảo quản các chất cấy gốc của S. aureus, R.equi, L.monocytogenes, L. innocua và L.ivanivii bằng cách nuôi cấy lên môi trường TSYEA (5.2.3), nuôi ấm ở 37oC từ 24h đến 28h, hoặc cho đến khi thấy mọc và bảo quản trong tủ lạnh (6.1.10) ở 4oC. Cấy truyền ít nhất là một lần trong một tháng.
5.3. Thuốc thử
5.3.1. Dung dịch hidro peroxit, 3% (V/V)
6. Thiết bị và dụng cụ thủy tinh
Chú ý – Khử trùng tất cả các thiết bị, dụng cụ tiếp xúc với môi trường nuôi cấy, dịch pha loãng hoặc mẫu thử, trừ khi các thiết bị, dụng cụ đã vô trùng sẵn (các dụng cụ bằng chất dẻo).
6.1. Thiết bị
Sử dụng các thiết bị thí nghiệm vi sinh thông thường và các dụng cụ đặc biệt sau:
6.1.1. Thiết bị để khử trùng khô (tủ sấy) hoặc thiết bị để khử trùng ướt (nồi hấp áp lực) (xem TCVN 6263 : 1997).
6.1.1.1. Tủ sấy, có thể duy trì nhiệt độ ở 173oC ± 3oC.
6.1.1.2. Nồi hấp áp lực, có thể duy trì nhiệt độ ở 121oC ± 1oC.
6.1.2. Tủ ấm, có thể duy trì nhiệt độ ở 30oC ± 1oC.
6.1.3. Tủ ấm, có thể duy trì nhiệt độ ở 37oC ± 1oC.
6.1.4. Tủ ấm, có thể duy trì nhiệt độ ở 25oC ± 1oC.
6.1.5. Nồi cách thủy, có thể duy trì nhiệt độ ở 45oC ± 1oC hoặc ở 37oC ± 1oC.
6.1.6. Thiết bị nghiền – trộn
Có thể sử dụng một trong các thiết bị sau đây:
a) máy trộn quay, vận hành với tốc độ từ 8 000 vòng / phút đến 45 000 vòng / phút, có cốc đựng bằng thủy tinh hoặc bằng kim loại có nắp, chịu được các điều kiện khử trùng; hoặc
b) máy trộn kiểu nhu động (stomacher), có các túi bằng chất dẻo vô trùng
Chú thích 4 – Cốc hoặc túi bằng chất dẻo phải có đủ dung tích để trộn mẫu với lượng chất pha loãng thích hợp. Nói chung, thể tích của vật chứa phải gấp đôi thể tích của mẫu thử cộng với chất pha loãng.
6.1.7. Que cấy bằng hợp chất platin/iridin, niken/crom, hoặc nhựa, có đường kính vòng cấy khoảng 3mm.
6.1.8. Kim cấy bằng hợp chất platin / iridin, niken/crom, hoặc nhựa.
6.1.9. pH mét bù nhiệt (để đo pH của môi trường đã chuẩn bị và của thuốc thử), có thể đo chính xác tới ± 0,1 đơn vị pH ở nhiệt độ 25oC.
6.1.10. Tủ lạnh (để bảo quản môi trường đã chuẩn bị và thuốc thử), có thể duy trì nhiệt độ từ +2oC đến +5oC.
6.1.11. Nguồn tia sáng trắng.
6.1.12. Gương phẳng hoặc gương hình lòng chảo.
6.1.13. Giá ba chân, để chiếu sáng đĩa Petri.
6.1.14. Kính hiển vi đối pha, có vật kính soi dầu.
6.2. Dụng cụ thủy tinh
Tất cả các dụng cụ thủy tinh phải bền khi khử trùng nhiều lần.
6.2.1. Bình thủy tinh, để khử trùng và bảo quản môi trường nuôi cấy và nuôi ấm môi trường lỏng.
6.2.2. Ống nghiệm nuối cấy 1), đường kính 16 mm và dài 125 mm.
6.2.3. Ống đong, để chuẩn bị môi trường hoàn chỉnh.
6.2.4. Pipet chia độ, có dung tích 25 ml, 10 ml và 1 ml, được chia vạch 0,5 ml và 0,1 ml.
6.2.5. Đĩa Petri vô trùng.
6.2.6. Phiến kính soi tiêu bản.
6.2.7. Bi thủy tinh.
7. Lấy mẫu
Điều quan trọng là phòng thí nghiệm nhận được mẫu đúng là mẫu đại diện và không bị hư hỏng hoặc bị biến đổi trong suốt quá trình vận chuyển và bảo quản.
Việc lấy mẫu không qui định trong tiêu chuẩn này. Nên tiến hành lấy mẫu theo TCVN 6400:1998 (ISO 707).
Cần phải tuân theo các hướng dẫn về lấy mẫu để kiểm tra vi sinh vật.
8. Chuẩn bị mẫu thử
Xem TCVN 6263 : 1997 (ISO 8261).
8.1. Sữa
Lắc kỹ mẫu sao cho các vi sinh vật phân bố càng đều càng tốt bằng cách đảo chiều bình đựng mẫu 25 lần. Tránh không để tạo bọt hoặc phải để cho bọt tan hết. Thời gian từ khi trộn đến khi lấy ra phần mẫu thử không lâu quá 3 phút.
8.2. Sữa bột, bột của dịch tách ra khi sản xuất phomát và bơ, lactoza, casein và caseinat
Trộn kỹ lượng chứa trong lọ kín bằng cách lắc và đảo chiều liên tục. Nếu mẫu thử đựng trong lọ kín còn nguyên, quá đầy nên khó lắc trộn, thì chuyển sang lọ chứa to hơn và trộn đều.
8.3. Bơ
Làm tan chảy mẫu thử trong một lọ vô trùng, đặt vào nồi cách thủy (6.1.5) ở 45oC. Lắc lọ mẫu trong khi làm tan chảy và lấy ngay lọ đựng mẫu ra khỏi nồi cách thủy khi mẫu vừa tan hết.
8.4. Phomát
Thông thường mẫu thí nghiệm bao gồm phần thịt và phần cùi. Các bên liên quan thỏa thuận với nhau về các phần được coi là mẫu thử.
Tiến hành theo qui định trong 9.1.5.
8.5. Kem lạnh thực phẩm
Tiến hành như trong trường hợp đối với bơ (8.3) nhưng sử dụng nồi cách thủy (6.1.5) ở nhiệt độ dưới 37oC, vì mẫu thử không được phép để quá nhiệt độ này.
8.6. Sữa lên men, sữa chua, custard và các món tráng miệng
Trộn kỹ lượng chứa trong lọ kín bằng cách lắc và đảo chiều liên tục, hoặc mở lọ và trộn lượng chứa bên trong bằng thìa hoặc dao trộn vô trùng.
9. Cách tiến hành
Đối với các điểm chú ý về an toàn, xem phụ lục A và hình 1.
9.1. Cấy vào môi trường tăng sinh
Chú thích 5 – Để giảm bớt khối lượng công việc khi có nhiều phần mẫu thử 25 g lấy để kiểm tra từ 1 lô sữa hoặc các sản phẩm sữa nhất định, và khi có cơ bản cho thấy là việc hợp nhất (gộp chung các phần mẫu thử) sẽ không làm ảnh hưởng đến kết quả của mẫu sữa kiểm tra thì có thể gộp chung các phần mẫu thử trên lại. Thí dụ: nếu có 10 phần x 25 g được lấy kiểm tra, thì gộp 10 đơn vị này lại thành “1 phần mẫu thử” hợp nhất 250 g và hòa tan hoặc khuếch tán vào 2,25 l môi trường tăng sinh.
Cho phần mẫu thử vào môi trường tăng sinh (5.2.1) theo qui định trong 9.1.1 đến 9.1.7.
9.1.1. Sữa
Cho 25 ml mẫu thử vào 225 ml môi trường tăng sinh (5.2.1) và lắc đều.
9.1.2. Sữa bột, bột của dịch tách ra khi sản xuất phomát, bột bơ loãng và caseinat
Cân 25 g mẫu thử một cách vô trùng cho vào bình thí nghiệm có nút, chứa 225 ml môi trường tăng sinh (5.2.1). Lắc để hòa tan.
9.1.3. Casein
Cân 25 g mẫu thử một cách vô trùng cho vào cốc đựng của máy trộn (6.1.6), và thêm 225 ml môi trường tăng sinh (5.2.1) ở 45oC. Trộn từ 1 đến 3 phút để hòa tan kỹ phần mẫu thử.
9.1.4. Bơ
Lắc mẫu thử đã tan chảy và dùng 1 pipet đã được làm ấm tới khoảng 45oC để lấy 25 ml mẫu cho vào bình thí nghiệm có chứa 225 ml môi trường tăng sinh (5.2.1). Lắc đều.
9.1.5. Phomát
Cân 25 g mẫu thử một cách vô trùng cho vào cốc đựng của máy trộn (6.1.6). Thêm 225 ml môi trường tăng sinh (5.2.1) đã được làm ấm trước đến 37oC. Trộn kỹ phần mẫu thử bằng máy trộn.
9.1.6. Sản phẩm sữa đông lạnh (kể cả kem thực phẩm)
Dùng pipet lấy 25 g mẫu thử đã tan chảy cho vào bình thí nghiệm chứa 225 ml môi trường tăng sinh (5.2.1) và lắc đều.
9.1.7. Sữa lên men, sữa chua, custard và món tráng miệng
Cân 25 g mẫu thử một cách vô trùng cho vào bình thí nghiệm có đậy nút, có chứa bi thủy tinh (6.2.7) và 225 ml môi trường tăng sinh (5.2.1). Lắc để hòa tan.
Khi kiểm tra mẫu thử có độ pH thấp, cần kiểm tra một cách vô trùng độ pH của huyền phù bằng giấy chỉ thị và nếu thấy cần thì chỉnh pH tới 7,0 ± 0,5, ở 25oC.
9.2. Nuôi ấm
Nuôi ấm môi trường tăng sinh đã được cấy mẫu trong tủ ấm (6.1.2) ở 30oC trong 48h.
9.3. Phân lập và nhận dạng sơ bộ
9.3.1. Dùng que cấy vòng (6.1.7), ria cấy mẫu đã nuôi ở trên lên bề mặt đĩa thạch Oxford (5.2.2) để thu được các khuẩn lạc tách biệt rõ ràng.
9.3.2. Lật sấp đĩa và đặt vào tủ ấm (6.1.3) để ở 37oC trong 48h.
9.3.3. Kiểm tra đĩa cấy sự có mặt các khuẩn lạc Listeria spp. đặc trưng (Các khuẩn lạc được bao quanh bởi quầng màu nâu thẫm hoặc đen).
9.4. Khẳng định
9.4.1. Chọn các khuẩn lạc để khẳng định
Từ mỗi đĩa môi trường phân lập (thạch Oxford, 5.2.2) chọn năm khuẩn lạc điển hình hoặc có nghi ngờ, hoặc, nếu có ít hơn năm khuẩn lạc như trên thì tất cả để thử khẳng định.
9.4.2. Nuôi ấm
Ria cấy các khuẩn lạc đã chọn lên bề mặt đĩa thạch TSYEA (5.2.3) sao cho các khuẩn lạc mọc phân tách rõ. Đặt các đĩa này trong tủ ấm (6.1.3) ở 37oC trong 24h, hoặc cho đến khi có các khuẩn lạc mọc. Độ dày của lớp môi trường thạch (15ml/1 đĩa) là quan trọng với độ rọi Henry tốt (xem phần dưới).
Dùng chùm tia sáng trắng (6.1.11) đủ sáng rõ để kiểm tra các đĩa, rọi tới đáy của đĩa tạo góc 45o (xem hình 2). Khi kiểm tra các khuẩn lạc dưới ánh sáng truyền qua này (độ rọi Henry) thẳng từ bên trên đĩa, các khuẩn lạc Listeria ssp. có màu xanh lam và bề mặt có dạng hạt.
Nếu như các đĩa TSYEA không cho nhiều khuẩn lạc điển hình mọc tách biệt tốt thì ria cấy lại 1 khuẩn lạc và tiếp tục như mô tả trên.
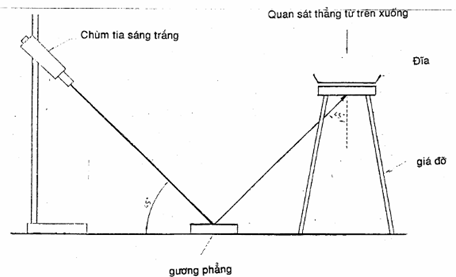
Hình 2 – Kiểm tra các đĩa có các khuẩn lạc nghi ngờ
9.4.3. Phản ứng catalaza
Lấy một khuẩn lạc điển hình và hòa vào một giọt dung dịch hidro peroxit 3% (5.3.1) trên phiến kính. Khi thấy có tạo bọt khí chứng tỏ là Listeria ssp. catalaza dương tính.
9.4.4. Đặc tính hình thái và bắt màu
9.4.4.1. Chuẩn bị mẫu cấy từ môi trường TSYEB (5.2.4) giống như khuẩn lạc điển hình sử dụng để thử phản ứng tính phân giải máu (9.4.6). Chọn một khuẩn lạc điển hình và hòa vào một ống nghiệm chứa môi trường TSYEB. Nuôi trong tủ ấm (6.1.4) ở nhiệt độ 200C đến 25oC cho tới khi thấy màu đục rõ (từ 8h đến 24h).
Chuẩn bị một tiêu bản ướt bằng cách dùng một vòng đầy chất cấy đã được nuôi ấm và đem kiểm tra dưới kính hiển vi (6.1.4). Vi khuẩn Listeria ssp. xuất hiện thưa, dạng que ngắn có chuyển động quay nhẹ hoặc hỗn loạn.
Các chủng vi khuẩn mọc ở nhiệt độ trên 25oC có thể không cho thấy chuyển động này. Phải luôn luôn so sánh với một chủng vi khuẩn đã biết trước. Các dạng cầu, trực khuẩn lớn, hoặc các trực khuẩn chuyển động nhanh, dạng bơi thì không phải Listeria ssp.
Một phép tử bổ sung về tính chuyển động bằng cách dùng kim cấy (6.1.8) cấy sâu vào môi trường di động (5.2.7) bằng cách lấy từ một khuẩn lạc điển hình trên TSYEA (9.4.2) và nuôi trong tủ ấm (6.1.4) ở 25oC trong 48h.
Kiểm tra sự mọc xung quanh vết cấy. Listeria ssp. là loại có chuyển động, cho kiểu mọc điển hình giống như cái ô. Nếu kết quả là âm tính, nuôi ấm thêm 5 ngày và kiểm tra lại vết cấy.
9.4.4.2. Tiến hành thử về phản ứng Gram từ một khuẩn lạc điển hình trên môi trường TSYEA (9.4.2). Listeria ssp. là loại trực khuẩn Gram dương.
9.4.5. Đặc tính phân giải máu
Nếu các đặc tính hình thái, sinh lý học và phản ứng catalaza cho thấy có khả năng có Listeria ssp., thì cấy lên các đĩa thạch máu (5.2.5) để xác định phản ứng haemolytic.
Làm khô bề mặt thạch trước khi sử dụng. Vạch các ô hình lưới trên đáy đĩa Petri từ 20 đến 25 ô trên một đĩa. Lấy một khuẩn lạc điển hình trên đĩa TSYEA và dùng kim cấy (6.1.8) chấm vào mỗi ô một khuẩn lạc. Đồng thời chấm các chủng kiểm tra dương tính và âm tính (L.monocytogenes, L.ivanivii và L.innocua).
Sau khi nuôi ấm (6.1.3) ở 37oC trong 48h, kiểm tra các chủng từ mẫu thử và chuẩn so sánh. L.monocytogenes cho các vùng sáng, trong và hẹp (kiểm tan máu ![]() ); L.innocua có thể cho vùng không trong xung quanh vết chấm. L.ivanovii thường cho các vùng vạch trong, rộng, của kiểm tan máu
); L.innocua có thể cho vùng không trong xung quanh vết chấm. L.ivanovii thường cho các vùng vạch trong, rộng, của kiểm tan máu ![]() . Đặt các đĩa vào vùng rọi sáng để so sánh các chủng xét nghiệm với chuẩn so sánh.
. Đặt các đĩa vào vùng rọi sáng để so sánh các chủng xét nghiệm với chuẩn so sánh.
9.4.6. Các phép thử khẳng định sinh hóa tiếp theo
Sử dụng chất cấy trong TSYEB (9.4.4.1).
9.4.6.1. Sử dụng hidrat cacbon
Cấy vào mỗi ống canh thang lên men hidrat cacbon (5.2.6) một vòng que cấy đầy, hoặc 0,1ml từ chủng nuôi ở TSYEB (9.4.6). Nuôi ấm (6.1.3) ở 37oC trong 7 ngày. Các phản ứng dương tính (sinh axit) cho màu vàng và phần lớn xẩy ra trong vòng từ 24g đến 48h.
9.4.6.2. Phép thử CAMP
Ria cấy các chủng S.aureus và R. equi thành những vạch đơn ngang đĩa thạch máu (5.2.5 hoặc 5.2.8) sao cho hai vệt cấy này song song và cân đối nhau trên đĩa (xem hình 3). Vết cấy cần phải mảnh, và đều đặn được thực hiện bằng cách giữ kim cấy (6.1.8) hoặc vòng cấy (6.1.7) ở các độ vuông góc so với mặt thạch.
Ria cấy chủng xét nghiệm theo cách tương tự, vuông góc với các vệt cấy trên sao cho chủng xét nghiệm và các chủng cho phản ứng không chạm nhau nhưng phải rất gần nhau, cách nhau từ 1 mm đến 2mm. Một vài chủng xét nghiệm có thể được ria cấy trên cùng một đĩa thạch.
Đồng thời, ria cấy các chủng đối chứng từ L.monocytogenes, L.innocua và L.ivanivii. Nếu dùng thạch máu (5.2.5), thì nuôi ấm các đĩa (6.1.3) ở 37oC từ 18 đến 24h. Nếu dùng đĩa lớp kép thì nuôi ấm các đĩa từ 12h đến 18h.
Vùng phân giải máu ![]() ở điểm giao nhau của chủng xét nghiệm và S.aureus tăng lên thì được coi là phản ứng dương tính.
ở điểm giao nhau của chủng xét nghiệm và S.aureus tăng lên thì được coi là phản ứng dương tính.
Phản ứng dương tính với R.equi cho thấy 1 quầng tan máu rộng (5mm đến 10 mm) “hình đầu mũi tên”. Nó được thấy như một vùng tròn nhỏ từ quầng tan máu lan rộng hơn chỉ khoảng 2 mm so với chủng xét nghiệm và nằm trong vùng tan máu yếu do sự phát triển của chủng S. aureus. Một phản ứng tương tự có thể được thấy ở điểm giao nhau của chủng xét nghiệm với R.equi, nhưng được coi là âm tính. Các vùng tan máu rộng không xuất hiện xung quanh vệt cấy của chủng S. aureus.
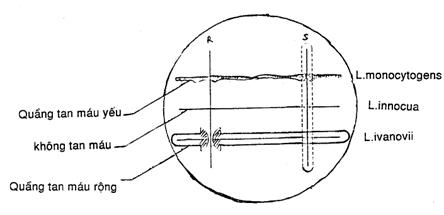
Hình. 3 – Cấy các đĩa thử CAMP
Chú thích
1) Cấy các đĩa thạch máu lớp mỏng như sơ đồ trên. Các vạch thẳng đứng biểu thị các vệt cấy của các chủng S.aureus (S) và R.equi (R). Các đường ngang biểu thị các vệt cấy của chủng xét nghiệm. Các vùng gạch chéo cho thấy các vị trí quầng tan máu tăng lên.
2) Các vùng đánh dấu lấm chấm biểu thị vùng chịu ảnh hưởng của S.aureus.
9.5. Diễn giải các đặc tính hình thái và sinh lý, và phản ứng sinh hóa (xem bảng 1)
Tất cả các chủng Listeria spp. đều là các trực khuẩn nhỏ, Gram dương (chỉ với các mẫu cấy 24h tuổi) có tính chuyển động trong tiêu bản ướt và trong môi trường di động. Chúng là các chủng Listeria spp. catalaza dương tính. L.monocytogens chuyển hóa ramnoza nhưng không chuyển hóa xyloza. L.monocytogens, L.ivanovii và L.seeligeri (phản ứng yếu) tạo tan máu ![]() khi cấy trong thạch máu. Lấy khuẩn lạc này để kiểm tra tính tan máu ở mặt dưới khuẩn lạc. Trong ba chủng Listeria spp. làm tan máu. chỉ có L.monocytogens không chuyển hóa xyloza và dương tính với ramnoza.
khi cấy trong thạch máu. Lấy khuẩn lạc này để kiểm tra tính tan máu ở mặt dưới khuẩn lạc. Trong ba chủng Listeria spp. làm tan máu. chỉ có L.monocytogens không chuyển hóa xyloza và dương tính với ramnoza.
Bảng 1 – Các phản ứng nhận biết Listeria ssp.
| Các loài | Sinh axit | Thử CAMP | ||
| Ramnoza | Xyloza | S. aureus | R.equi | |
| L.monocytogens | + | - | + | - |
| L.innocua | v | - | - | - |
| L.ivanovii | - | + | - | + |
| L.seeligeri | - | + | (+) | - |
| L.welshimeri | v | + | - | - |
| L.grayi | - | - | - | - |
| L.murrayi | v | - | - | - |
| v = phản ứng có thể thay đổi (+) = phản ứng yếu + = Phản ứng dương tính - = không phản ứng | ||||
L.monocytogens và L.seeligeri (phản ứng yếu) cho 1 phản ứng CAMP dương tính với S. aureus nhưng không dương tính với R.equi.
L.ivanovii phản ứng với R.equi nhưng không phản ứng với S. aureus. Các chủng Listeria ssp. khác cho phản ứng CAMP âm tính với cả hai chủng phản ứng trên.
9.6. Khẳng định cuối cùng
Các chủng được coi là Listeria ssp. (9.5) có thể gửi tới phòng thí nghiệm chứng nhận Listeria để định danh.
Mẫu gửi đến phòng thí nghiệm phải kèm theo tất cả các thông tin có liên quan đến các chủng này.
Chú thích
6) Đối với sữa nguyên liệu đôi khi cho thấy việc cấy truyền vào canh thang tăng sinh sau khi nuôi ấm 24h và 48h có thể tăng độ nhạy của phương pháp.
7) Phương pháp này cho thấy kém nhạy hơn đối với một vài phomat vệt đỏ và phomat xanh so với các sản phẩm khác (thí dụ, độ nhạy của phương pháp này đối với phomat Limburger kém đi ở mật độ L.monocytogens nhỏ hơn 2/g). Đối với vài loại phomat nhất định, việc nuôi ấm canh thang tăng sinh nên kéo dài tới 7 ngày. Nên cấy các đĩa môi trường phân lập khi canh thang tăng sinh đã được nuôi ấm 48h và cả sau 7 ngày.
8) Thạch palcam (xem tiêu chuẩn trích dẫn) có thể dùng để làm môi trường phân lập bổ sung cho môi trường Oxford. Nên chuẩn bị các đĩa theo hướng dẫn của các nhà sản xuất và nuôi ấm ở 37oC trong 48h trong tủ ấm (6.1.3). Các khuẩn lạc thuộc chủng Listeria ssp. có đường kính khoảng 2 mm và được bao quanh bởi 1 quầng đen trên nền môi trường đỏ.
9) Phương pháp này cũng có thể dùng để phát hiện L.monocytogens trong các mẫu lấy tại nơi sản xuất. Tuy nhiên, chưa có sự phối hợp nào để đánh giá khả năng xuất hiện vi sinh vật này trong các mẫu thử như vậy.
9.7. Các chủng kiểm tra
Để kiểm tra tính năng của môi trường tăng sinh và môi trường nhận biết, nhằm đảm bảo cho việc phát triển L.monocytogens, một dung dịch pha loãng mẫu chuẩn từ chủng mới phân lập cần được cấy vào một bình kiểm tra có chứa môi trường tăng sinh (xem 9.2). Thêm từ 10 tế bào đến 100 tế bào L.monocytogens / một bình.
Tiến hành với các bình kiểm tra giống như đối với mẫu cấy xét nghiệm để chứng minh rằng chủng kiểm tra dương tính mọc được.
10. Biểu thị kết quả
Theo diễn giải về đọc kết quả, báo cáo sự có mặt hay không Listeria monocytogens trong phần mẫu thử, ghi rõ mẫu thử theo khối lượng bằng gam, hoặc theo thể tích bằng mililít.
11. Báo cáo kết quả
Báo cáo kết quả phải ghi rõ
- Phương pháp lấy mẫu, nếu biết,
- Phương pháp sử dụng,
- Kết quả thử nghiệm thu được, và,
- Nếu kiểm tra độ lặp lại, kết quả xác định cuối cùng thu được.
Cũng cần phải đề cập đến tất cả các chi tiết thao tác không qui định trong tiêu chuẩn này, hoặc được xem là tùy ý, cùng với mọi tình huống bất thường có thể ảnh hưởng đến kết quả.
Báo cáo kết quả cũng bao gồm các thông tin cần thiết về việc nhận biết đầy đủ mẫu thử.
PHỤ LỤC A
(qui định)
Lưu ý về an toàn
A.1. Các qui trình được nêu trong tiêu chuẩn này chỉ được thực hiện trong các phòng thí nghiệm có các điều kiện thích hợp và dưới sự kiểm tra của nhà vi sinh vật học có chuyên môn.
A.2. Các qui trình này không được tiến hành trong các phòng thí nghiệm kiểm tra chất lượng, hay tại các cơ sở sản xuất hay chế biến thực phẩm, nơi có nguy cơ nhiễm bẩn từ môi trường.
A.3. Phải luôn thực hiện đầy đủ các lưu ý về vi khuẩn học trong suốt quá trình tiến hành qui trình qui định trong tiêu chuẩn này. Phải đặc biệt chú ý tới việc khử trùng các thiết bị đã sử dụng và môi trường sau khi kiểm tra mẫu có nghi ngờ và trước khi loại bỏ hay tái sử dụng.
Đối với các lưu ý về an toàn chi tiết hơn, xem TCVN 6404 : 1998 (ISO 7218 : 1997), đặc biệt là điều 3, điều 4 và điều 7.
PHỤ LỤC B
(thm khảo)
[1] TCVN 6400 : 1998 (ISO 707 : 1998) Sữa và sản phẩm sữa – Phương pháp lấy mẫu.
[2] VANNETTEN, P., PERALES, l.,CURTIS, G.D.W. và MOSSEI, D.A.A. Môi trường lỏng và môi trường phân lập chọn lọc để phát hiện và định lượng Listeria monocytogens. Tạp chí quốc tế về vi sinh vật học thực phẩm, 8,1989, trang 299-316.
1) Có thể dùng ống nhiệm có nắp đậy làm bằng thủy tinh
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 6401:1998 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 6401:1998 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 6401:1998 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 6401:1998 DOC (Bản Word)