- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 11681:2016 ISO 10932:2010 Sữa và sản phẩm sữa-Xác định nồng độ ức chế tối thiểu của kháng sinh đối với bifidobacteria và vi khuẩn lactic không phải cầu khuẩn đường ruột
| Số hiệu: | TCVN 11681:2016 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2016 |
Hiệu lực:
|
Đang cập nhật |
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 11681:2016
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 11681:2016
TIÊU CHUẨN QUỐC GIA
TCVN 11681:2016
ISO 10932:2010
SỮA VÀ SẢN PHẨM SỮA - XÁC ĐỊNH NỒNG ĐỘ ỨC CHẾ TỐI THIỂU CỦA KHÁNG SINH ĐỐI VỚI BIFIDOBACTERIA VÀ VI KHUẨN LACTIC KHÔNG PHẢI CẦU KHUẨN ĐƯỜNG RUỘT
Milk and milk products - Determination of the minimal inhibitory concentration (MIC) of antibiotics applicable to bifidobacteria and non-enterococcal lactic acid bacteria (LAB)
Lời nói đầu
TCVN 11681:2016 hoàn toàn tương đương với ISO 10932:2010;
TCVN 11681:2016 do Ban kỹ thuật Tiêu chuẩn quốc gia TCVN/TC/F12 Sữa và sản phẩm sữa biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
SỮA VÀ SẢN PHẨM SỮA - XÁC ĐỊNH NỒNG ĐỘ ỨC CHẾ TỐI THIỂU CỦA KHÁNG SINH ĐỐI VỚI BIFIDOBACTERIA VÀ VI KHUẨN LACTIC KHÔNG PHẢI CẦU KHUẨN ĐƯỜNG RUỘT
Milk and milk products - Determination of the minimal inhibitory concentration (MIC) of antibiotics applicable to bifidobacteria and non-enterococcal lactic acid bacteria (LAB)
CẢNH BÁO - Kháng sinh là những chất có thể gây nguy hiểm. Biện pháp phòng ngừa cần thiết phải được thực hiện để tránh tiếp xúc với các chất này. Đặc biệt, kanamycin có thể gây ảnh hưởng xấu đến thai nhi (nguy cơ R61) và chloramphenicol có thể gây ung thư (nguy cơ R45).
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp xác định nồng độ ức chế tối thiểu (MIC) của một loạt các loại kháng sinh đối với bifidobacteria và vi khuẩn axit lactic (LAB) không gây bệnh đường ruột.
CHÚ THÍCH: Khác với phương pháp khuếch tán đĩa, là phương pháp bán định lượng, thường sử dụng phương pháp pha loãng vi lượng trong canh thang cho phép định lượng MIC của sinh vật thử nghiệm trong một dãy dung dịch pha loãng các kháng sinh. Nồng độ thấp nhất của một loại kháng sinh có thể ức chế hoàn toàn sự phát triển có thể quan sát được của một vi khuẩn thử nghiệm được coi là MIC.
Tiêu chuẩn này khuyến cáo rằng phương pháp pha loãng vi lượng trong canh thang là phương pháp chuẩn.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi (nếu có).
TCVN 6404 (ISO 7218) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Yêu cầu chung và hướng dẫn kiểm tra vi sinh vật
TCVN 6507-5 (ISO 6887-5) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 5: Các nguyên tắc cụ thể để chuẩn bị mẫu sữa và sản phẩm sữa
TCVN 8128-1 (ISO/TS 11133-1) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Hướng dẫn chuẩn bị và sản xuất môi trường nuôi cấy - Phần 1: Hướng dẫn chung về đảm bảo chất lượng đối với việc chuẩn bị môi trường nuôi cấy trong phòng thử nghiệm
TCVN 8128-2 (ISO/TS 11133-2) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Hướng dẫn chuẩn bị và sản xuất môi trường nuôi cấy - Phần 2: Các hướng dẫn thực hành về thử hiệu năng của môi trường nuôi cấy *)
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng thuật ngữ và định nghĩa sau đây:
3.1
Nồng độ ức chế tối thiểu (minimal inhibitory concentration)
MIC
Nồng độ thấp nhất mà trong các điều kiện in vitro xác định, ức chế hoàn toàn sự phát triển có thể quan sát của vi khuẩn trong một khoảng thời gian xác định.
[ISO 20776-1: 2006[6], 2.4]
CHÚ THÍCH: MIC được biểu thị bằng microgam trên mililit.
4 Nguyên tắc
Lấy hầu hết các khuẩn lạc riêng rẽ trên đĩa thạch hòa vào dung dịch muối vô trùng. Riêng Bifidobacterium spp. được hòa vào trong môi trường LSM-Cys đã làm giảm oxi trước.
Huyền phù vi khuẩn được pha loãng với môi trường khuyến cáo.
Đĩa pha loãng vi lượng được chuẩn bị với một dãy các dung dịch pha loãng hai lần của kháng sinh.
Huyền phù vi khuẩn đã pha loãng được phân phối vào các giếng của đĩa và ủ trong điều kiện khuyến cáo.
Nồng độ thấp nhất của một loại kháng sinh có thể ức chế hoàn toàn sự phát triển có thể quan sát của vi khuẩn được coi là MIC.
5 Chất pha loãng, môi trường nuôi cấy và thuốc thử
5.1 Vật liệu cơ bản
Chỉ sử dụng thuốc thử loại tinh khiết phân tích và sử dụng nước cất hoặc nước loại khoáng hoặc nước có độ tinh khiết tương đương, trừ khi có quy định khác. Xem TCVN 6507-5 (ISO 6887-5).
5.2 Dung dịch pha loãng
Xem TCVN 6507-5 (ISO 6887-5).
5.3 Môi trường nuôi cấy
5.3.1 Thạch MRS
5.3.1.1 Thành phần
| Pepton 1 (tryptic sản phẩm thủy phân của casein) | 10,0 g |
| Chất chiết thịt | 10,0 g |
| Chất chiết nấm men (khô) | 5,0 g |
| Glucose | 20,0 g |
| Polysorbat 80 (sorbitan mono-oleat đã polyethoxyl hóa)a | 1,0 ml |
| Dikali hydro phosphat (K2HPO4) | 2,0 g |
| Natri axetat ngậm ba phân tử nước (NaCH3CO2.3H2O) | 5,0 g |
| Diamoni xitrat [(NH4)2HC6H5O7] | 2,0 g |
| Magie sulfat ngậm bảy phân tử nước (MgSO4.7H2O) | 0,2 g |
| Mangan sulfat ngậm bốn phân tử nước (MnSO4.4H2O) | 0,05 g |
| Thạch | 10 g đến 15 gb |
| Thêm nước đến | 1 000 mlc |
| a Tween 80 là sản phẩm thích hợp có bán sẵn. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng chúng. b Tùy thuộc nào sức đông của thạch. c Khi sử dụng các đĩa pha loãng vi lượng tự chuẩn bị (8.4.5.1), thì môi trường MRS cần được chuẩn bị với nồng độ cao gấp đôi bằng cách chỉ thêm nước đến 500 ml. | |
5.3.1.2 Chuẩn bị
Hòa các thành phần vào trong nước. Vừa khuấy vừa đun nóng huyền phù đến sôi, để hòa tan hoàn toàn. Nếu cần, chỉnh pH (6.7) đến 6,35 ± 0,2 bằng axit clohydric loãng hoặc dung dịch natri hydroxit loãng trước khi hấp áp lực. Sau khi hấp áp lực, pH của môi trường thạch MRS là 6,2 ± 0,2 ở 25°C. Phân phối môi trường với các lượng 100 ml ± 1 ml vào các chai (6.8) dung tích 150 ml hoặc với các lượng 200 ml ± 2 ml vào chai (6.8) dung tích 250 ml.
Khử trùng trong nồi hấp áp lực (6.5) duy trì ở 121°C trong 15 min. Nếu môi trường được sử dụng ngay, để nguội trong nồi cách thủy đun sôi (6.6) trong khoảng từ 44°C đến 47°C. Nếu không sử dụng ngay, trước khi dùng làm tan thạch MRS (5.3.1.1) trong nồi cách thủy đun sôi (6.6) và xoay nhẹ để tránh tạo bọt khí, sau đó để nguội trong nồi cách thủy đun sôi (6.6) trong khoảng từ 44°C đến 47°C.
Rót khoảng từ 15 ml đến 20 ml môi trường đã chuẩn bị vào các đĩa Petri (6.10). Để cho môi trường nguội và đông đặc bằng cách đặt các đĩa Petri đã đậy nắp trên mặt phẳng mát nằm ngang.
Trước khi sử dụng, làm khô bề mặt thạch theo TCVN 8128-1 (ISO/TS 11133-1).
Các đĩa thạch MRS đã chuẩn bị có thể được bảo quản trong túi bằng chất dẻo kín khí để ở nơi tối và giữ trong khoảng từ 2°C đến 8°C được 2 tuần.
Kiểm tra các đĩa thạch về nhiễm khuẩn theo TCVN 8128-2 (ISO/TS 11133-2).
Thạch MRS hoàn chỉnh có bán sẵn trên thị trường, nhưng kết quả thu được có thể khác nhau đáng kể đối với sản phẩm từ các nhà cung cấp khác nhau. Do đó, nếu sử dụng, cần kiểm tra môi trường thạch MRS thương mại so sánh với cùng môi trường nhưng được chuẩn bị theo tiêu chuẩn này.
5.3.2 Thạch MRS-cystein (thạch MRS-Cys)
Thạch MRS-Cys gồm thạch MRS (5.3.1) có bổ sung 0,3 g L-cystein trên mỗi lít môi trường.
5.3.2.1 Môi trường cơ bản - thạch MRS
Xem 5.3.1.
5.3.2.2 Dung dịch gốc L-Cystein
5.3.2.2.1 Thành phần
| L-Cystein hydroclorua | 0,3 g |
| Thêm nước đến | 10,0 ml |
5.3.2.2.2 Chuẩn bị
Hòa tan L-cystein hydroclorua trong nước. Khử trùng bằng cách lọc qua bộ lọc 0,2 μm (6.12) vào một ống nghiệm vô trùng (6.13).
Dung dịch gốc L-cystein có thể được bảo quản ở nơi tối và giữ trong khoảng từ 2°C đến 8°C cho đến 1 tuần. Không để dung dịch tiếp xúc trực tiếp với ánh sáng mặt trời.
5.3.2.3 Môi trường hoàn chỉnh
5.3.2.3.1 Thành phần
| Môi trường cơ bản (5.3.1) | 100 ml |
| Dung dịch gốc L-cystein (5.3.2.2) | 1,0 ml |
5.3.2.3.2 Chuẩn bị
Ngay trước khi sử dụng, làm tan chảy thạch MRS (5.3.1) trong nồi cách thủy đun sôi (6.6). Làm nguội thạch trong nồi cách thủy (6.6) được duy trì ở nhiệt độ trong khoảng từ 44°C đến 47°C.
Bổ sung 1,0 ml dung dịch gốc L-cystein (5.3.2.2) một cách vô trùng vào 100 ml thạch MRS (5.3.1). Trộn rất cẩn thận để tránh tạo bọt khí.
Rót khoảng từ 15 ml đến 20 ml môi trường đã chuẩn bị vào các đĩa Petri (6.10). Để môi trường nguội và đông đặc bằng cách đặt các đĩa Petri đã đậy nắp trên mặt phẳng mát nằm ngang. Trước khi sử dụng, làm khô bề mặt thạch theo TCVN 8128-1 (ISO/TS 11133-1).
Các đĩa thạch MRS-Cys đã chuẩn bị có thể được bảo quản trong túi bằng chất dẻo kín khí để ở nơi tối và giữ trong khoảng từ 2°C đến 8°C được 1 tuần.
Kiểm tra các đĩa thạch về nhiễm khuẩn theo TCVN 8128-2 (ISO/TS 11133-2).
Thạch MRS-Cys hoàn chỉnh có bán sẵn trên thị trường, nhưng kết quả thu được có thể khác nhau đáng kể đối với sản phẩm từ các nhà cung cấp khác nhau. Do đó, nếu sử dụng, cần kiểm tra môi trường thạch MRS-Cys thương mại so sánh với cùng môi trường nhưng được chuẩn bị theo tiêu chuẩn này.
5.3.3 Thạch M17-sacarose
Thạch M17-sucrose gồm thạch M17 (5.3.3.1) có bổ sung 5,0 g sacarose cho mỗi lít môi trường.
5.3.3.1 Môi trường cơ bản - thạch M17
5.3.3.1.1 Thành phần
| Trypton (thủy phân casein tuyến tụy) | 5,0 g |
| Pepton đậu nành | 5,0 g |
| Chất chiết thịt bò | 5,0 g |
| Chất chiết nấm men (khô) | 2,5 g |
| Axit ascorbic (C6H8O6) | 0,5 g |
| Magie sulfat ngậm bảy phân tử nước (MgSO4.7H2O) | 0,25 g |
| Dinatri glycerophosphat (C3H7PO6Na2.5H2O) | 19,0 g |
| Thạch | 10 g đến 15 ga |
| Thêm nước đến | 950 ml |
| a Tùy thuộc vào sức đông của thạch. | |
5.3.3.1.2 Chuẩn bị
Hòa các thành phần trong nước. Vừa khuấy vừa đun đến sôi cho đến khi hòa tan hoàn toàn. Nếu cần, chỉnh pH (6.7) đến 7,35 ± 0,2 bằng axit clohydric loãng hoặc natri hydroxit loãng trước khi hấp áp lực. Sau khi hấp áp lực, pH của môi trường thạch M17 là 7,2 ± 0,2 ở 25°C. Phân phối môi trường với các lượng 95 ml ± 1 ml vào chai (6.8) dung tích 150 ml hoặc với các lượng 190 ml ± 2 ml vào chai (6.8) dung tích 250 ml.
Khử trùng trong nồi hấp áp lực (6.5) duy trì ở 121°C trong 15 min. Nếu môi trường được sử dụng ngay, để nguội trong nồi cách thủy (6.6) trong khoảng từ 44°C đến 47°C. Nếu không sử dụng ngay, làm tan chảy thạch M17 (5.3.3.1) trong nồi cách thủy đun sôi (6.6) và xoay nhẹ để tránh tạo bọt khí, sau đó để nguội trong nồi cách thủy (6.6) trong khoảng từ 44°C đến 47°C.
5.3.3.2 Dung dịch gốc sacarose
5.3.3.2.1 Thành phần
| Sacarose | 5,0 g |
| Thêm nước đến | 50 ml |
5.3.3.2.2 Chuẩn bị
Hòa tan sacarose trong nước. Khử trùng bằng cách lọc qua bộ lọc cỡ lỗ 0,2 μm (6.12) vào ống nghiệm vô trùng (6.13).
5.3.3.3 Môi trường hoàn chỉnh
5.3.3.3.1 Thành phần
| Môi trường cơ bản (5.3.3.1) | 95,0 ml |
| Dung dịch gốc sacarose (5.3.3.2) | 5,0 ml |
5.3.3.3.2 Chuẩn bị
Ngay trước khi sử dụng, làm tan chảy thạch M17 (5.3.3.1) trong nồi cách thủy đun sôi (6.6). Làm nguội trong nồi cách thủy (6.6) đến khoảng từ 44°C và 47°C. Thêm 5,0 ml dung dịch gốc sacarose (5.3.3.2) một cách vô trùng vào 95,0 ml thạch M17 (5.3.3.1). Xoay nhẹ để tránh tạo bọt khí.
Rót khoảng từ 15 ml đến 20 ml môi trường đã chuẩn bị vào các đĩa Petri (6.10). Để môi trường nguội và đông đặc bằng cách đặt các đĩa Petri đã đậy nắp trên mặt phẳng mát nằm ngang.
Trước khi sử dụng, làm khô bề mặt thạch theo TCVN 8128-1 (ISO/TS 11133-1).
Có thể bảo quản các đĩa thạch M17-sacarose đã chuẩn bị trong túi bằng chất dẻo kín khí để ở nơi tối và giữa trong khoảng nhiệt độ từ 2°C đến 8°C được 2 tuần.
Kiểm tra các đĩa thạch về nhiễm khuẩn theo TCVN 8128-2 (ISO/TS 11133-2).
5.3.4 Thạch M17-lactose
Thạch M17-lactose gồm có thạch M17 (5.3.3.1) có bổ sung 5,0 g lactose cho mỗi lít môi trường.
5.3.4.1 Môi trường cơ bản - M17
Xem 5.3.3.1.
5.3.4.2 Dung dịch gốc lactose
5.3.4.2.1 Thành phần
| Lactose | 5,0 g |
| Nước đến | 50 ml |
5.3.4.2.2 Chuẩn bị
Hòa tan lactose trong nước. Khử trùng bằng cách lọc qua bộ lọc cỡ lỗ 0,2 μm (6.12) vào ống nghiệm vô trùng (6.13).
5.3.4.3 Môi trường hoàn chỉnh
5.3.4.3.1 Thành phần
| Môi trường cơ bản (5.3.3.1) | 95,0 ml |
| Dung dịch gốc lactose (5.3.4.2) | 5,0 ml |
5.3.4.3.2 Chuẩn bị
Ngay trước khi sử dụng, làm tan chảy thạch M17 (5.3.3.1) trong nồi cách thủy đun sôi (6.6). Làm nguội trong nồi cách thủy (6.6) đến khoảng từ 44°C và 47°C. Thêm 5,0 ml dung dịch gốc lactose (5.3.4.2) một cách vô trùng vào 95,0 ml thạch M17 (5.3.3.1). Xoay nhẹ để tránh tạo bọt khí.
Rót khoảng từ 15 ml đến 20 ml môi trường đã chuẩn bị vào các đĩa Petri (6.10). Để môi trường nguội và đông đặc bằng cách đặt các đĩa Petri đã đậy trên mặt phẳng mát nằm ngang.
Trước khi sử dụng, làm khô bề mặt thạch theo TCVN 8128-1 (ISO/TS 11133-1).
Có thể bảo quản các đĩa thạch M17-lactose đã chuẩn bị trong túi bằng chất dẻo kín khí để ở nơi tối và giữ trong khoảng nhiệt độ từ 2°C và 8°C được 2 tuần.
Kiểm tra các đĩa thạch về nhiễm khuẩn theo TCVN 8128-2 (ISO/TS 11133-2).
5.3.5 Thạch Elliker
5.3.5.1 Thành phần
| Thủy phân casein tuyến tụy | 20,0 g |
| Chất chiết nấm men (khô) | 5,0 g |
| Gelatin | 2,5 g |
| Dextrose | 5,0 g |
| Lactose | 5,0 g |
| Sacarose | 5,0 g |
| Nath clorua (NaCl) | 4,0 g |
| Natri axetat ngậm ba phân tử nước (Na CH3CO2.3H2O) | 1,5 g |
| Axit ascorbic (C6H8O6) | 0,5 g |
| Thạch | 10 g đến 15 ga |
| Thêm nước đến | 1 000 ml |
| a Tùy thuộc vào sức đông của thạch. | |
5.3.5.2 Chuẩn bị
Hòa các thành phần trong nước. Vừa khuấy vừa đun nóng huyền phù đến sôi cho đến khi tan hết. Nếu cần, chỉnh pH (6,7) đến 6,95 ± 0,2 bằng axit clohydric loãng hoặc natri hydroxit loãng trước khi hấp áp lực. Sau khi hấp, pH của môi trường thạch MRS là 6,8 ± 0,2 ở 25°C. Phân phối môi trường với các lượng 100 ml ± 1 ml vào các chai (6.8) dung tích 150 ml hoặc với các lượng 200 ml ± 2 ml vào các chai (6.8) 250 ml.
Khử trùng trong nồi hấp áp lực (6.5) 15 min duy trì ở 121°C. Nếu môi trường được sử dụng ngay, để nguội trong nồi cách thủy (6.6) trong khoảng từ 44°C và 47°C. Nếu không sử dụng ngay, làm tan chảy thạch Elliker (5.3.5.1) trong nồi cách thủy đun sôi (6.6) trong khi xoay nhẹ để tránh tạo bọt khí, sau đó để nguội trong nồi cách thủy (6.6) trong khoảng từ 44°C và 47°C.
Rót khoảng 15 ml đến 20 ml môi trường đã chuẩn bị vào các đĩa Petri (6.10). Làm nguội môi trường. Làm đông đặc bằng cách đặt các đĩa Petri đã mở nắp trên mặt phẳng mát nằm ngang.
Trước khi sử dụng, làm khô bề mặt thạch theo TCVN 8128-1 (ISO/TS 11133-1).
Có thể bảo quản các đĩa thạch Elliker đã chuẩn bị trong túi bằng chất dẻo kín khí để ở nơi tối và giữ trong khoảng nhiệt độ từ 2°C và 8°C được 2 tuần.
Kiểm tra các đĩa thạch về nhiễm khuẩn theo TCVN 8128-2 (ISO/TS 11133-2).
5.3.6 Môi trường IST
5.3.6.1 Thành phần
| Casein thủy phân | 11,0 g |
| Pepton | 3,0 g |
| Glucose | 2,0 g |
| Natri clorua | 3,0 g |
| Tinh bột hòa tan | 1,0 g |
| Dinatri hydrophosphat | 2,0 g |
| Natri axetat | 1,0 g |
| Magie glycerophosphat | 0,2 g |
| Canxi gluconat | 0,1 g |
| Cobalt(ll) sulfat | 0,001 g |
| Đồng(ll) sulfat | 0,001 g |
| Kẽm sulfat | 0,001 g |
| Sắt(ll) sulfat | 0,001 g |
| Mangan(ll) clorua | 0,002 g |
| Menadion | 0,001 g |
| Cyanocobalamin | 0,001 g |
| L-Cystein hydroclorua | 0,02 g |
| L-Tryptophan | 0,02 g |
| Pyrodoxin | 0,003 g |
| Pantothenat | 0,003 g |
| Nicotinamid | 0,003 g |
| Biotin | 0,000 3 g |
| Thiamin | 0,000 04 g |
| Adenin | 0,01 g |
| Guanin | 0,01 g |
| Xanthin | 0,01 g |
| Uracil | 0,01 g |
| Thêm nước đến | 1 000 mla |
| a Khi sử dụng các đĩa pha loãng vi lượng chuẩn bị thủ công (8.4.5.1), thì môi trường IST cần được chuẩn bị ở nồng độ cao gấp hai lần bằng cách thêm nước đến 500 ml. | |
5.3.6.2 Chuẩn bị
Hòa các thành phần trong nước. Trộn kỹ huyền phù cho đến khi hòa tan hoàn toàn. Phân phối môi trường với các lượng 100 ml ± 1 ml vào chai (6.8) dung tích 150 ml hoặc với các lượng 200 ml ± 2 ml vào chai (6.8) dung tích 250 ml.
Khử trùng trong nồi hấp áp lực (6.5) ở 121°C trong 15 min. Nếu cần, chỉnh pH (6,7) sao cho sau khi khử trùng, pH là 7,4 ± 0,2. Nếu môi trường được sử dụng ngay, để nguội trong nồi cách thủy (6.6) đến 32°C.
Môi trường IST đã chuẩn bị (5.3.6.1) có thể được bảo quản ở nơi tối, đậy kín và giữ trong khoảng nhiệt độ từ 2°C đến 8°C được 2 tuần.
Kiểm tra môi trường về nhiễm khuẩn theo TCVN 8128-2 (ISO/TS 11133-2).
5.3.7 Môi trường IST lactose
Môi trường IST lactose gồm có môi trường IST và 10,0 g lactose trên một lít môi trường.
5.3.7.1 Thành phần
| Môi trường IST (5.3.6) | 90,0 ml |
| Dung dịch gốc lactose (5.3.4.2) | 10,0 ml |
5.3.7.2 Chuẩn bị
Chuẩn bị môi trường IST (5.3.6) và dung dịch gốc lactose (5.3.4.2). Trộn một cách vô trùng môi trường đã chuẩn với dung dịch gốc theo tỷ lệ quy định trong 5.3.7.1 trong chai vô trùng (6.8) dung tích 150 ml. Nếu sử dụng các đĩa pha loãng vi lượng chuẩn bị thủ công (8.4.5.1), thì chuẩn bị IST với 1 % khối lượng môi trường lactose với nồng độ IST cao gấp đôi (xem Chú thích bảng thành phần trong 5.3.6.1).
Môi trường IST lactose đã chuẩn bị có thể được bảo quản trong chai có nắp vặn, để ở nơi tối và giữ trong khoảng nhiệt độ từ 2°C đến 8°C đến 2 tuần. Kiểm tra môi trường về nhiễm khuẩn theo TCVN 8128-2 (ISO/TS 11133-2).
5.3.8 Môi trường LSM
Môi trường LSM gồm có 90 % môi trường IST và 10 % môi trường MRS
5.3.8.1 Thành phần
| Môi trường IST (5.3.6) | 90,0 ml |
| Môi trường MRS (5.3.1 ) không có thạch | 10,0 ml |
5.3.8.2 Chuẩn bị
Chuẩn bị riêng rẽ môi trường IST (5.3.6) và môi trường MRS (5.3.1) không có thạch. Trộn đều trước khi hấp áp lực theo tỷ lệ quy định trong 5.3.8.1. Chỉnh pH (6.7) đến 6,85 ± 0,1 bằng axit clohydric loãng hoặc natri hydroxit loãng trước khi hấp áp lực. Sau khi hấp, pH của môi trường LSM là 6,7 ± 0,1.
Nếu sử dụng các đĩa pha loãng vi lượng (8.4.5.1) chuẩn bị thủ công, thì chuẩn bị môi trường LSM bằng cách sử dụng nồng độ môi trường IST cao gấp đôi (xem Chú thích trong bảng thành phần trong 5.3.6.1) và môi trường MRS (xem chú thích trong bảng thành phần trong 5.3.1.1).
Phân phối môi trường đã chỉnh pH (5.3.8.1) vào chai (6.8) dung tích 150 ml. Khử trùng trong nồi hấp áp lực (6.5) duy trì ở 121°C trong 15 min. Nếu môi trường được sử dụng ngay, thì làm nguội trong nồi cách thủy (6.6) đến 28°C hoặc 37°C.
Môi trường LSM đã chuẩn bị có thể được bảo quản trong chai có nắp vặn, để ở nơi tối và giữ trong khoảng nhiệt độ từ 2°C và 8°C được 2 tuần.
Kiểm tra môi trường về nhiễm khuẩn theo TCVN 8128-2 (ISO/TS 11133-2).
5.3.9 Môi trường LSM-Cystein (môi trường LSM-Cys)
Môi trường LSM-Cys gồm có môi trường LSM (5.3.8) bổ sung 0,3 g L-Cystein cho mỗi lít môi trường.
5.3.9.1 Thành phần
| Môi trường LSM (5.3.8) | 100,0 ml |
| L-Cystein hydroclorua | 0,03 g |
5.3.9.2 Chuẩn bị
Cho 0,03 g L-Cystein hydroclorua vào 100 ml môi trường LSM không hấp áp lực (5.3.8). Trộn đều cho đến khi hòa tan hoàn toàn. Chỉnh pH (6,7) đến 6,85 ± 0,1 bằng axit clohydric loãng hoặc natri hydroxit loãng trước khi hấp áp lực. Sau khi hấp áp lực, pH của môi trường LSM-Cys phải là 6,7 ± 0,1.
Nếu sử dụng các đĩa pha loãng vi lượng chuẩn bị thủ công (8.4.5.1), thì chuẩn bị môi trường LSM-Cys ở nồng độ cao gấp đôi (xem 5.3.8.2).
Phân phối môi trường đã chỉnh pH (5.3.9) vào chai (6.8) dung tích 150 ml.
Khử trùng trong nồi hấp áp lực (6.5) duy trì ở 121°C trong 15 min. Nếu môi trường được sử dụng ngay, để nguội trong nồi cách thủy (6.6) đến 37°C.
Môi trường LSM-Cys đã chuẩn bị có thể được bảo quản trong chai có nắp vặn chặt, để ở nơi tối và giữ trong khoảng nhiệt độ từ 2°C đến 8°C được 1 tuần.
Kiểm tra môi trường về nhiễm khuẩn, theo TCVN 8128-2 (ISO/TS 11133-2).
5.3.10 Dung dịch nước muối
Dung dịch nước muối gồm 0,85 % khối lượng natri clorua trong nước.
5.3.10.1 Thành phần
| Natri clorua | 0,85 g |
| Thêm nước đến | 100 ml |
5.3.10.2 Chuẩn bị
Hòa tan natri clorua trong nước. Khử trùng bằng cách lọc dung dịch qua bộ lọc cỡ lỗ 0,2 μm (6.12) vào ống nghiệm vô trùng (6.13).
6 Thiết bị và dụng cụ thủy tinh
6.1 Yêu cầu chung
Khử trùng tất cả các thiết bị, dụng cụ tiếp xúc với mẫu thử, chất pha loãng, các dung dịch pha loãng hoặc môi trường nuôi cấy theo quy định trong TCVN 6404 (ISO 7218). Các dụng cụ thủy tinh phải bền với việc khử trùng lặp lại.
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm vi sinh thông thường để chuẩn bị mẫu thử và các dung dịch pha loãng được quy định trong TCVN 6404 (ISO 7218) và cụ thể như sau:
6.2 Tủ ấm, có khả năng duy trì nhiệt độ ở 28°C ± 1°C, 32°C ± 1°C và 37°C ± 1°C tương ứng.
6.3 Tủ ấm kỵ khí, có khả năng duy trì nhiệt độ ở 28°C ± 1°C, 32°C ± 1°C và 37°C ± 1°C, tương ứng hoặc bình nuôi cấy kỵ khí, cung cấp một lượng cacbon dioxit từ 9 % đến 13 %.
6.4 Thiết bị đếm khuẩn lạc, xem TCVN 6404 (ISO 7218).
6.5 Nồi hấp áp lực, có khả năng duy trì nhiệt độ ở 121°C ± 1°C.
6.6 Nồi cách thủy, có khả năng duy trì nhiệt độ từ 28°C đến 55°C và ở nhiệt độ sôi.
6.7 Máy đo pH, được bù nhiệt, có thể đọc chính xác đến pH ± 0,1 đơn vị ở 25°C.
6.8 Chai hoặc bình, dung tích 150 ml hoặc 250 ml có nắp đậy thích hợp (để giữ môi trường nuôi cấy).
6.9 Pipet, vô trùng, đã được hiệu chuẩn để dùng cho vi khuẩn, có thể phân phối các lượng 0,05 ml ± 0002 ml, 0,1 ml ± 0,02 ml theo TCVN 11086 (ISO 7550) [5], 1,0 ml ± 0,02 ml và 10 ml ± 0,2 ml theo loại A của TCVN 7151 (ISO 648) [1].
6.10 Đĩa Petri, vô trùng, làm bằng thủy tinh không màu hoặc bằng chất dẻo, đường kính 90 mm, có chiều sâu bên trong tối thiểu 10 mm. Đáy không có những bất thường mà có thể ảnh hưởng đến việc đếm khuẩn lạc.
6.11 Thìa, vô trùng, làm bằng thủy tinh hoặc kim loại.
6.12 Dụng cụ lọc, vô trùng, có bộ lọc màng cellulose axetat cỡ lỗ danh nghĩa 0,2 μm.
6.13 Ống nghiệm, vô trùng, dung tích 5 ml, 20 ml hoặc 50 ml có nắp đậy thích hợp.
6.14 Bộ dàn mẫu, vô trùng, làm bằng thủy tinh, kim loại hoặc bằng chất dẻo.
6.15 Tủ sấy, lò hoặc tủ ấm (ví dụ: tủ có không khí phân dòng), được thông gió (để làm khô bề mặt của đĩa thạch).
6.16 Ống cryo, vô trùng, dung tích 2 ml.
6.17 Máy đo quang phổ, có khả năng đo mật độ quang ở bước sóng 625 nm.
6.18 Đĩa pha loãng vi lượng, có 96 giếng chuẩn.
7 Lấy mẫu
Phòng thử nghiệm phải nhận được đúng mẫu đại diện của sản phẩm và không bị hư hỏng hoặc bị thay đổi trong suốt quá trình vận chuyển và bảo quản.
Việc lấy mẫu không quy định trong tiêu chuẩn này. Nên lấy mẫu theo TCVN 6400 (ISO 707)[2].
8 Cách tiến hành
8.1 Nhân giống
8.1.1 Trước khi phân tích độ nhạy, nhân giống cần thử nghiệm trên môi trường thạch theo các điều kiện ủ khuyến cáo (xem Bảng 1). Nếu một chủng không phát triển tốt trong môi trường hoặc các điều kiện khuyến cáo, thì bổ sung nguồn carbon khác hoặc thay đổi thông số để tạo điều kiện cho phát triển.
Bảng 1 - Các điều kiện nhân giống
| Các loài | Môi trường (thạch) | Nhiệt độ °C | Điều kiện nuôi cấy | Thời gian ủ h |
| Bifidobacterium spp. | MRS-Cys | 37 | Kỵ khí | 24 đến 48 |
| Lactobacillus brevis | MRS | 28 | Kỵ khí hoặc hiếu khí | 16 đến 24 |
| Lactobacillus plantarum/pentosus | MRS | 28 | Kỵ khí hoặc hiếu khí | 16 đến 24 |
| Lactobacillus sakei | MRS | 28 | Kỵ khí hoặc hiếu khí | 16 đến 24 |
| Nhóm Lactobacillus delbrueckii | MRS | 37 | Kỵ khí | 16 đến 24 |
| Các lactobacilli khác | MRS | 37 | Kỵ khí hoặc hiếu khí | 16 đến 24 |
| Lactococcus lactis | M 17-lactose hoặc Elliker | 32 | Kỵ khí hoặc hiếu khí | 16 đến 24 |
| Streptococcus thermophilus | M 17-sucrose hoặc Elliker | 37 | Kỵ khí hoặc hiếu khí | 16 đến 24 |
8.2.1 Chủng được bảo quản đông lạnh trước tiên có thể được phục hồi trong môi trường lỏng theo các điều kiện như trong Bảng 1 trước khi nhân chủng trên môi trường thạch.
8.2 Kiểm soát chất lượng các chủng và thử nghiệm
a) Lactobacillus plantarum ATCC® 14917™1) (ở 28°C).
b) Lactobacillus paracasei ATCC® 334™1) (ở 37°C).
c) Lactococcus lactis ATCC® 19435™1) (ở 32°C).
d) Streptococcus thermophilus LMG 183111) (ở 37°C).
e) Bifidobacterium longum ATCC® 15707™1) (ở 37°C).
Các quy trình kiểm soát chất lượng sau đây có khả năng áp dụng cho các chủng thử nghiệm.
Mỗi lần thử nghiệm một chủng quan tâm, thì nên kiểm tra chủng kiểm soát chất lượng thuộc các loài tương tự của chủng thử nghiệm đó.
a) đối với lactobacilli được nuôi cấy ở 28°C, sử dụng Lactobacillus plantarum ATCC® 14917™1);
b) đối với lactobacilli được nuôi cấy ở 37°C, sử dụng Lactobacillus paracasei ATCC® 334™1);
c) đối với Bifidobacterium spp., sử dụng Bifidobacterium longum ATCC® 15707™1).
8.3 Điều kiện phát triển đối với phép thử độ nhạy của kháng sinh
Xem Bảng 2.
Bảng 2 - Các điều kiện phát triển đối với phép thừ độ nhạy của kháng sinh
| Sinh vật | Môi trường | Nhiệt độ °C | Điều kiện nuôi cấy | Thời gian ủ h |
| Bifidobacterium spp. | LSM-Cys | 37 | Kỵ khí | 48 |
| Lactobacillus brevis | LSM | 28 | Kỵ khí | 48 |
| Lactobacillus plantarum/pentosus | LSM | 28 | Kỵ khí | 48 |
| Lactobacillus sakei | LSM | 28 | Kỵ khí | 48 |
| Các lactobacilli khác | LSM | 37 | Kỵ khí | 48 |
| Lactococcus lactis | IST | 32 | Kỵ khí | 48 |
| Streptococcus thermophilus | IST-lactose | 37 | Kỵ khí | 48 |
Để thử nghiệm Bifidobacterium spp., nên làm giảm môi trường trước trong các điều kiện kỵ khí một ngày trước khi thử nghiệm.
8.4 Chuẩn bị đĩa pha loãng vi lượng
8.4.1 Dải nồng độ của các loại kháng sinh
Dải nồng độ của các kháng sinh được liệt kê trong Bảng 3.
Bảng 3 - Dải nồng độ của các kháng sinh
| Kháng sinh | Nhóm | Dải nồng độ μg/ml |
| Gentamicin | Aminoglycoside | 0,5 đến 256 |
| Kanamycin | Aminoglycoside | 2 đến 1 024 |
| Streptomycin | Aminoglycoside | 0,5 đến 256 |
| Neomycin | Aminoglycoside | 0,5 đến 256 |
| Tetracycline | Tetracycline | 0,125 đến 64 |
| Erythromycin | Macrolide | 0,016 đến 8 |
| Clindamycin | Lincosamide | 0,032 đến 16 |
| Chloramphenicol | Chloramphenicol | 0,125 đến 64 |
| Ampicillin | ß-Lactam | 0,032 đến 16 |
| Vancomycin | Glycopeptide | 0,25 đến 128 |
| Quinupristin và hỗn hợp dalfopristin | Streptogramin | 0,016 đến 8 |
| Linezolid | Oxazolidinon | 0,032 đến 16 |
| Trimethoprim | Chất ức chế dihydrofolat reductase | 0,125 đến 64 |
| Ciprofloxacin | Fluoroquinolon | 0,25 đến 128 |
| Rifampicin | Rifamycin | 0,125 đến 64 |
8.4.2 Trình bày đĩa pha loãng vi lượng
8.4.2.1 Yêu cầu chung
Trình bày đĩa pha loãng vi lượng được nêu trong Bảng 4 và Bảng 5.
Bảng 4 - Trình bày đĩa pha loãng vi lượng - Bảng 1
| Kháng sinh | 1a | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12b |
| Gentamicin | P | 0,5 | 1 | 2 | 4 | 8 | 16 | 32 | 64 | 128 | 256 | N |
| Kanamycin | P | 2 | 4 | 8 | 16 | 32 | 64 | 128 | 256 | 512 | 1024 | N |
| Streptomycin | P | 0,5 | 1 | 2 | 4 | 8 | 16 | 32 | 64 | 128 | 256 | N |
| Tetracycline | P | 0,125 | 0,25 | 0,5 | 1 | 2 | 4 | 8 | 16 | 32 | 64 | N |
| Erythromycin | P | 0,016 | 0,032 | 0,063 | 0,125 | 0,25 | 0,5 | 1 | 2 | 4 | 8 | N |
| Clindamycin | P | 0,032 | 0,063 | 0,125 | 0,25 | 0,5 | 1 | 2 | 4 | 8 | 16 | N |
| Chloramphenicol | P | 0,125 | 0,25 | 0,5 | 1 | 2 | 4 | 8 | 16 | 32 | 64 | N |
| Ampicillin | P | 0,032 | 0,063 | 0,125 | 0,25 | 0,5 | 1 | 2 | 4 | 8 | 16 | N |
| a Giếng chứng dương tính không chứa kháng sinh, nhưng có chủng thử nghiệm và môi trường có chứa dung môi được sử dụng để hòa tan kháng sinh ở nồng độ cao nhất. b Giếng chứng âm tính không chứa chủng thử nghiệm và kháng sinh, nhưng có môi trường. | ||||||||||||
Bảng 5 - Trình bày đĩa pha loãng vi lượng - Bảng 2
| Kháng sinh | 1b | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12c |
| Neomycin | P | 0,5 | 1 | 2 | 4 | 8 | 16 | 32 | 64 | 128 | 256 | N |
| Vancomycin | P | 0,25 | 0,5 | 1 | 2 | 4 | 8 | 16 | 32 | 64 | 128 | N |
| Quinupristin và hỗn hợp dalfopristin hoặc virginiamycina | P | 0,016 | 0,032 | 0,064 | 0,125 | 0,25 | 0,5 | 1 | 2 | 4 | 8 | N |
| Linezolid | P | 0,032 | 0,064 | 0,125 | 0,25 | 0,5 | 1 | 2 | 4 | 8 | 16 | N |
| Trimethoprim | P | 0,125 | 0,25 | 0,5 | 1 | 2 | 4 | 8 | 16 | 32 | 64 | N |
| Ciprofloxacin | P | 0,25 | 0,5 | 1 | 2 | 4 | 8 | 16 | 32 | 64 | 128 | N |
| Rifampicin | P | 0,125 | 0,25 | 0,5 | 1 | 2 | 4 | 8 | 16 | 32 | 64 | N |
| a Rất khó thu được đĩa pha loãng vi lượng kết hợp với hỗn hợp quinupristin và daltopristin. Thay vào đó, có thể sử dụng các đĩa pha loãng vi lượng với virginiamycin đã chuẩn bị trước, là kháng sinh tương tự được sử dụng, ví dụ sử dụng trong thú y. Virginiamycin cũng được sử dụng trong các thử nghiệm liên phòng (Phụ lục A). b Giếng chứng dương tính không chứa kháng sinh, nhưng có chủng thử nghiệm và môi trường có chứa dung môi được sử dụng để hòa tan kháng sinh ở nồng độ cao nhất. c Giếng chứng âm tính không chứa chủng thử nghiệm và kháng sinh, nhưng có môi trường. | ||||||||||||
8.4.2.2 Dung dịch pha loãng kháng sinh
Để phân tích đĩa pha loãng vi lượng, đầu tiên chuẩn bị một dung dịch gốc ở nồng độ khuyến cáo của kháng sinh. Khi chuẩn bị dung dịch gốc, chỉnh khối lượng của kháng sinh về hiệu lực.
Tính hiệu lực, wp, bằng cách sử dụng công thức sau:
![]()
Trong đó:
was là độ tinh khiết phân tích;
wac là phần hoạt tính, đó là axit tự do hoặc bazơ và không phải là muối, sử dụng một lượng tối thiểu của dung môi để hòa tan bột kháng sinh;
wH2O là hàm lượng nước do có mặt hydrat bất kỳ.
Sử dụng một trong các công thức sau để tính khối lượng, m, hoặc thể tích V của bột hoặc chất pha loãng cần cho dung dịch gốc.
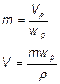
Xem ví dụ sử dụng gentamicin trong Bảng 6.
Bảng 6 - Từng bước chuẩn bị dung dịch làm việc của kháng sinh
| Bước | Nguồn gốc dung dịch | Nồng độ μg/ml | Thể tích ml | Nước (5.1) ml | Dung dịch nồng độ kép μg/ml |
| 1 | Dung dịch gốc | 5 120 | 1 | 9 | 512 |
| 2 | Bước 1 | 512 | 1 | 1 | 256 |
| 3 | Bước 1 | 512 | 1 | 3 | 128 |
| 4 | Bước 1 | 512 | 1 | 7 | 64 |
| 5 | Bước 4 | 64 | 1 | 1 | 32 |
| 6 | Bước 4 | 64 | 1 | 3 | 16 |
| 7 | Bước 4 | 64 | 1 | 7 | 8 |
| 8 | Bước 7 | 8 | 1 | 1 | 4 |
| 9 | Bước 7 | 8 | 1 | 3 | 2 |
| 10 | Bước 7 | 8 | 1 | 7 | 1 |
8.4.2.3 Chuẩn bị dung dịch cuối cùng
Pha loãng 1 ml từng nguồn dung dịch nêu trong Bảng 6, từ bước 1 đến bước 10 với nước (5.1).
8.4.2.4 Phân phối dung dịch cuối cùng
Phân phối, đối với bước 1 đến bước 10 (8.4.2.3), 50 μl của dung dịch nồng độ kép thu được vào giếng của đĩa pha loãng vi lượng (6.18) như trong Bảng 4 hoặc Bảng 5.
8.4.2.5 Bảo quản các đĩa pha loãng vi lượng
Nếu các đĩa pha loãng vi lượng không sử dụng ngay, có thể đậy kín đĩa và bảo quản ở nhiệt độ dưới -20°C đến khi sử dụng.
Kháng sinh trong các đĩa pha loãng đông lạnh thường vẫn ổn định trong vài tháng. Kiểm tra hiệu năng của các đĩa pha loãng vi lượng với một chủng kiểm chứng.
8.4.3 Chuẩn bị các đĩa pha loãng vi lượng
Có thể sử dụng các đĩa pha pha loãng đã phủ trước kháng sinh VetMIC™2). Dùng 100 μl dung dịch (8.4.5.2) cho nồng độ kháng sinh xác định như trong hướng dẫn.
Các đĩa có thể được giữ trong 2 năm ở nhiệt độ phòng.
8.4.4 Chuẩn bị chất cấy
8.4.4.1 Lấy các khuẩn lạc riêng rẽ ra khỏi đĩa thạch (8.1). Hòa các khuẩn lạc thu được trong ống nuôi cấy bằng thủy tinh hoặc chất dẻo vô trùng có chứa 2 ml đến 5 ml dung dịch nước muối vô trùng.
Trong trường hợp của Bifidobacterium spp., hòa các khuẩn lạc thu được trong môi trường LSM-Cys đã làm giảm trước.
8.4.4.2 Hòa các khuẩn lạc cho đến khi độ đục của dung dịch đạt chuẩn 1 McFarland hoặc mật độ quang ở bước sóng 625 nm là 0,16 đến 0,2 khi được đo bằng máy đo quang phổ (6.17). Dung dịch huyền phù tương ứng với khoảng 3 x 108 cfu/ml.
Đối với S. thermophilus và Lactob. delbrueckii, thì dung dịch huyền phù 1 McFarland của một số chủng có thể thấp hơn 3 x 108 cfu/ml. Trong trường hợp này, nên sử dụng độ đục McFarland tương ứng với khoảng 3 x 108 cfu/ml.
8.4.5 Dung dịch pha loãng huyền phù vi khuẩn với môi trường khuyến cáo
8.4.5.1 Đĩa pha loãng vi lượng chuẩn bị thủ công
Pha loãng huyền phù vi khuẩn 500 lần trong môi trường được khuyến cáo (Bảng 2). Môi trường này được pha loãng hai lần với dung dịch kháng sinh và do đó, nồng độ vi khuẩn phải cao gấp đôi so với 8.4.5.2 (xem 5.3.8.2).
Phân phối huyền phù vi khuẩn đã pha loãng sau khi chuẩn bị trong vòng 30 min.
8.4.5.2 Đĩa pha loãng vi lượng được phủ trước
Pha loãng huyền phù vi khuẩn 1 000 lần trong môi trường khuyến cáo.
Phân phối huyền phù vi khuẩn pha loãng sau khi chuẩn bị trong vòng 30 min.
8.4.6 Phân phối huyền phù vi khuẩn vào giếng của đĩa pha loãng vi lượng
8.4.6.1 Đĩa pha loãng vi lượrng được chuẩn bị thủ công
Khi sử dụng các đĩa đông lạnh, rã đông dung dịch kháng sinh đông lạnh trong điều kiện kỵ khí (6.3) ngay trước khi dùng.
Phân phối 50 μl huyền phù đã pha loãng (8.4.5.1) vào mỗi giếng (khoảng 3 x 104 cfu/giếng) của đĩa pha loãng vi lượng (8.4.2).
Ủ các đĩa theo các điều kiện nêu trong Bảng 2. Khi sử dụng bình kỵ khí, chồng các đĩa với nắp để môi trường giữa các đĩa đồng nhất với môi trường kỵ khí trong bình.
8.4.6.2 Đĩa pha loãng vi lượng đã phủ trước
Khi sử dụng các đĩa đã phủ trước (8.4.3), phân phối 100 μl huyền phù đã pha loãng (8.4.5.2) vào mỗi giếng (khoảng 3 x 104 cfu/giếng) của đĩa pha loãng vi lượng (8.4.3).
Ủ các đĩa theo các điều kiện nêu trong Bảng 2. Khi sử dụng bình kỵ khí, chồng các đĩa với nắp để môi trường giữa các đĩa đồng nhất với môi trường kỵ khí trong bình.
8.4.7 Đọc MIC
Quan sát để đọc MIC sau khi ủ 48 h.
Sau khi ủ, kiểm tra các giếng chứng âm tính để quan sát sự phát triển. Nếu thấy có nhiễm khuẩn thì loại bỏ tất cả các dữ liệu được tạo ra từ chủng có liên quan.
CHÚ THÍCH: Không có sự phát triển trong các giếng chứng dương tính cho thấy chủng thử nghiệm nhạy với dung môi được sử dụng để hòa tan kháng sinh (ví dụ axit xitric có trong dung dịch đệm sử dụng cho ampicillin). Trong trường hợp này, số đọc MIC của kháng sinh cụ thể này là không liên quan.
Nếu các kiểm chứng dương tính và âm tính được kiểm tra và chấp nhận, thì sự phát triển được quan sát xác định đối với mỗi kháng sinh bằng cách so sánh với kiểm chứng dương.
Tốt nhất là đặt bảng điều khiển trên đỉnh của bộ phận quan sát, ở dạng giá đỡ có gương rộng. Đèn cho ánh sáng gián tiếp tạo điều kiện cho việc đọc kết quả.
Sự phát triển của vi khuẩn dễ dàng phát hiện được trong gương như một viên trên đáy giếng. Loại bỏ các dãy giếng bất kỳ khi quan sát thấy phát triển không liên tục (ví dụ: phát triển ở mức 16 μg/ml và 64 μ/ml, nhưng không phải ở 32 μg/ml).
Điểm cuối được xác định là nồng độ kháng sinh thấp nhất mà tại đó không thấy có sự phát triển. Ghi lại nồng độ này là MIC của kháng sinh đối với một chủng cụ thể.
Trimethoprim đối kháng trong môi trường có thể giúp phát triển nhẹ. Vì vậy, đọc điểm kết thúc tại nồng độ, trong đó có 80 % hoặc giảm sự phát triển lớn hơn so với kiểm chứng.
Nếu một chủng không phát triển tốt trong môi trường hoặc điều kiện khuyến cáo, thì có thể bổ sung một nguồn carbon khác hoặc thay đổi các điều kiện để thúc đẩy tăng trưởng.
Tuy nhiên, cần chứng minh rằng việc bổ sung nguồn carbon hoặc thay đổi các điều kiện phát triển ảnh hưởng không đáng kể (nhiều hơn hoặc ít hơn hai lần) đến việc đánh giá MIC bằng cách kiểm tra chủng đối chứng và các chủng khác của cùng một loài.
8.4.8 Xác định giá trị ngưỡng dịch tễ
Trong dự án ACE-ART, MIC được dùng để xác định giá trị ngưỡng dịch tễ thay vì điểm gãy lâm sàng của các loài LAB.
Theo định nghĩa EUCAST, giá trị ngưỡng dịch tễ dùng để phân biệt giữa các vi sinh vật chưa thuần (lấy từ ngoài môi trường và đề kháng không ổn định với chất thử nghiệm) và các sinh vật đã thuần (chủng nuôi và đề kháng được với chất thử nghiệm).
9 Biểu thị kết quả
Biểu thị nồng độ ức chế tối thiểu bằng microgam trên mililit.
10 Độ chụm
10.1 Phép thử nghiệm liên phòng
Các giá trị về độ lặp lại và độ tái lập thu được từ các kết quả thử nghiệm liên phòng thực hiện theo CLSI M23-A2[17]. Chi tiết về phép thử nghiệm liên phòng về độ chụm của phương pháp này được nêu trong Phụ lục A.
Các giá trị được thể hiện cho mức xác suất 95 % và có thể không áp dụng được cho các dải nồng độ và nền mẫu khác với các dải nồng độ và nền mẫu đã nêu.
10.2 Độ lặp lại
Chênh lệch tuyệt đối giữa hai kết quả thử nghiệm độc lập riêng rẽ thu được trên vật liệu thử giống hệt nhau, do một người thực hiện, sử dụng cùng thiết bị, thực hiện trong cùng một khoảng thời gian ngắn nhất, không quá 5 % các trường hợp vượt quá các giá trị nêu trong Phụ lục A đối với mỗi chủng.
10.3 Độ tái lập
Chênh lệch tuyệt đối giữa hai kết quả thử nghiệm độc lập riêng rẽ thu được khi sử dụng cùng phương pháp, tiến hành thử trên vật liệu thử giống hệt nhau, được báo cáo từ hai phòng thử nghiệm không quá 5 % các trường hợp vượt quá các giá trị nêu trong Phụ lục A đối với mỗi chủng.
11 Báo cáo kết quả thử nghiệm
Báo cáo thử nghiệm phải bao gồm ít nhất các thông tin sau:
a) tất cả các thông tin cần thiết để nhận biết đầy đủ về chủng;
b) phương pháp lấy mẫu được sử dụng, nếu biết;
c) phương pháp thử nghiệm được sử dụng, tham khảo tiêu chuẩn này;
d) tất cả các chi tiết thao tác không quy định trong tiêu chuẩn này, hoặc được xem là tùy chọn, cùng với các chi tiết bất thường có thể đã ảnh hưởng đến kết quả;
e) các kết quả thử nghiệm thu được và nếu lặp lại đã được kiểm tra thì nêu kết quả cuối cùng thu được.
Phụ lục A
(tham khảo)
Thử nghiệm liên phòng
A.1 Yêu cầu chung
Phép thử nghiệm cộng tác quốc tế gồm có tám phòng thử nghiệm của bảy nước tham gia. Nghiên cứu này được chia thành ba phần và tối đa là bảy phòng thử nghiệm tham gia vào mỗi phần.
Phép thử nghiệm được tổ chức theo CLSI M23-A2[17] được xây dựng đặc biệt cho thử độ nhạy in vitro. Như quy định trong 6.2.2, “Để giám sát việc thực hiện các phép thử dung dịch pha loãng in vitro, cần thiết lập các giới hạn dao động được chấp nhận của MIC sử dụng các chủng kiểm soát chất lượng (QC) thích hợp”. Ngoài ra, “Để thiết lập các giới hạn kiểm soát chất lượng (QC) đối với các phép thử pha loãng, các kết quả từ ít nhất bảy phòng thử nghiệm của bảy tổ chức riêng biệt cần được phân tích” và “Đối với vi khuẩn kỵ khí và các sinh vật đặc thù khác, cần sử dụng ba lô thạch hoặc canh thang (phù hợp với các tiêu chuẩn áp dụng) từ các nhà sản xuất khác nhau, nếu có thể.”
Để giải thích các kết quả, có nói: “Tốt nhất là, ít nhất 95 % các giá trị cần bao gồm trong dải đề xuất và sẽ bao gồm chế độ ± 1 log. Tốt nhất là một dãy ba độ pha loãng; Tuy nhiên, đôi khi cần đến dãy bốn độ pha loãng”.
Đặc biệt để thực hiện các phép thử “Mỗi một phòng trong số bảy phòng thử nghiệm cần thực hiện mười lần lặp lại của mỗi chủng QC trên mỗi lô môi trường. Mỗi lần lặp lại nên sử dụng các huyền phù chất cấy đã chuẩn bị riêng rẽ. Nghiên cứu này cần được tiến hành trong tối thiểu ba ngày với tối đa là bốn lần nhắc lại mỗi ngày cho 70 điểm dữ liệu cho từng lô môi trường và 210 điểm dữ liệu tổng số”.
Nghiên cứu liên phòng bao gồm năm chủng kiểm chứng quy định trong 8.2. Môi trường LSM bao gồm hỗn hợp của hai canh thang (phép thử độ nhạy ISO và MRS).
Môi trường thử độ nhạy ISO là môi trường được xác định tốt để thử nghiệm độ nhạy, trong khi đó MRS được thực hiện theo các công thức khác nhau của các nhà sản xuất khác nhau. Để hạn chế tổng số các phép thử, chỉ cần thử nghiệm ba nhãn hiệu MRS khác nhau (Oxoid, BD, AES) trong khi đó chỉ sử dụng môi trường thử độ nhạy ISO Oxoid. Ngoài ra, 25 chủng đã được thử nghiệm lặp lại hai lần trong bảy phòng thử nghiệm để kiểm tra xác nhận phương pháp này là thích hợp để thử nghiệm độ nhạy đối với bifidobacteria và vi khuẩn axit lactic không gây bệnh đường ruột.
Xem Bảng A.1.
A.2 Kết quả
A.2.1 Yêu cầu chung
Một phòng thử nghiệm luôn báo cáo giá trị MIC của linezolid cao hơn so với các phòng thử nghiệm khác.
Trong các Bảng A.2 đến A.12, các ô in đậm cho thấy dữ liệu trong dải QC và các ô màu xám cho thấy nằm dưới dải (không có phát triển) hoặc trên dải (phát triển ở tất cả các giếng).
Bảng A1 - Nghiên cứu liên phòng thử nghiệm
| Chủng | Môi trường | Số hãng MRS | Số lượng phòng thử nghiệm tham gia | Tổng số điểm dữ liệu cho mỗi kháng sinh |
| Lactobacillus plantarum ATCC® 14917™ a | LSM | 3 | 6 | 180 |
| Lactobacillus paracasei ATCC® 334™ a | LSM | 3 | 7 | 210 |
| Lactococcus lactis ATCC® 19435™ a | IST | 0 | 7 | 70 |
| Streptococcus thermophilus LMG18311 a | 1ST ± 1 % lactose | 0 | 7 | 70 |
| Bifidobacterium longum ATCC® 15707™ a | LSM-Cys | 3 | 6 | 180 |
| a Ví dụ về sản phẩm thích hợp bán sẵn trên thị trường và tiêu chuẩn này không ấn định phải sử dụng chúng. | ||||
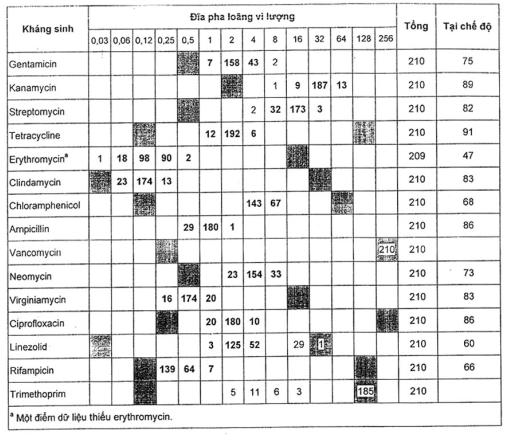
Bảng A.2 - Kết quả đối với Lactobacillus paracasei ATCC® 334™ 1)
A.2.2 Lactobacillus paracasei ATCC® 334™ 1)
Các MIC đối với hai kháng sinh nằm trên dải (vancomycin và trimethoprim). Đối với 13 loại kháng sinh khác được thử nghiệm, kết quả trong vòng ± 1 log của chế độ đối với 95 % các điểm dữ liệu.
Không tìm thấy những điểm khác biệt giữa ba thương hiệu của môi trường MRS (không có dữ liệu).
Năm chủng tiếp theo của Lacto. paracasei (Bảng A.3), ba chủng Lactob. rhamnosus (Bảng A.4) và hai chủng Lactob. acidophilus (Bảng A.5) đã được thử nghiệm và kết quả là chấp nhận được.
Các chủng Lactob. acidophilus có giá trị MIC cao hơn đối với clindamycin và ciprofloxacin.
Bảng A.3 - Kết quả đối với năm chủng Lactobacillus paracasei
Bảng A.4 - Kết quả đối với ba chủng Lactobacillus rhamnosus
Bảng A.5 - Kết quả đối với hai chủng Lactobacillus acidophilus
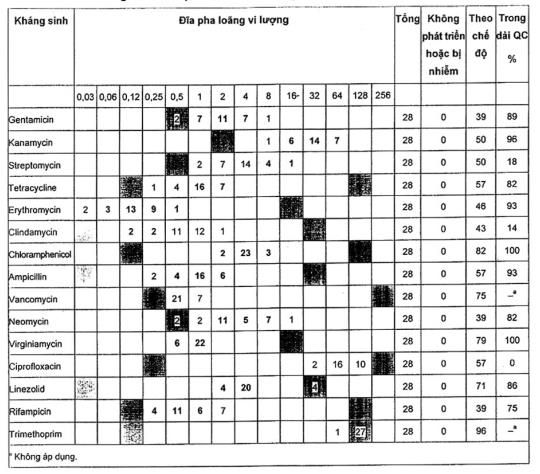
A.2.3 Bifidobacterium longum ATCC® 15707™ 1)
Sáu phòng thử nghiệm tham gia thử nghiệm chủng này, có ít yêu cầu hơn CLSI M23-A2[17]. Tuy nhiên, đối với một số các loại kháng sinh, kết quả cho thấy rằng dãy kiểm soát chất lượng có thể được thiết lập.
B. longum ATCC® 15707™ 1) khó thử nghiệm hơn so với các chủng khác. Đối với một số loại kháng sinh, một phòng thử nghiệm không tạo ra kết quả tương tự như các phòng thử nghiệm khác. Một phòng thử nghiệm cho giá trị MIC về aminoglycosid thấp hơn hai lần so với các phòng thử nghiệm khác và các dữ liệu MIC này đã được loại ra khỏi dữ liệu aminoglycoside, để lại 150 điểm dữ liệu về bốn loại kháng sinh (gentamycin, kanamycin, neomycin, streptomycin).
Một phòng thử nghiệm đã cho các giá trị MIC về ampicillin rất thấp và các kết quả này đã được loại ra.
Cuối cùng, các kết quả của erythromycin từ một phòng thử nghiệm đã được loại ra vì các giá trị MIC quá thấp. Các giá trị MIC của trimethoprim bao trùm một dải rộng và không có thông số kiểm soát chất lượng có thể được đề nghị, để chỉ ra rằng phương pháp này không áp dụng đối với kháng sinh này.
Nồng độ clindamycin và rifampicin trên các đĩa chuẩn bị trước ở dải MIC thấp, điều này có nghĩa là trong một số thực nghiệm không có sự phát triển ngay cả ở nồng độ thấp nhất.
Bảng A.6 - Kết quả đối với Bifidobacterium longum ATCC® 15707 ™1)
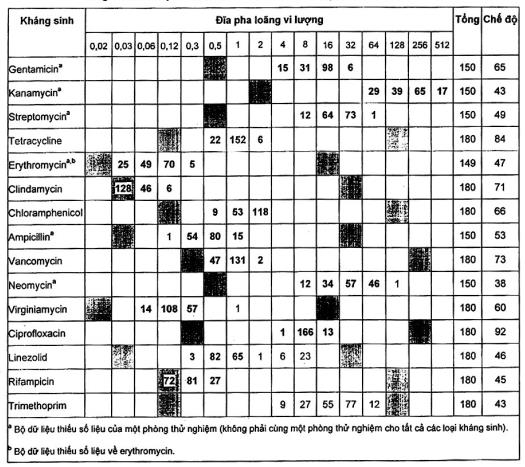
Năm chủng B. longum tiếp theo đã được thử nghiệm. Hầu hết các kết quả đều nằm trong dải QC, nhưng có một số vấn đề được ghi lại có nhiễm bẩn và không có sự phát triển. Đối với hầu hết các loại kháng sinh, một vài kết quả nằm ngoài dải chuẩn chỉ ra rằng phương pháp này nên thận trọng khi thử nghiệm bifidobacteria.
Bảng A.7 - Kết quả đối với năm dòng Bifidobacterium longum
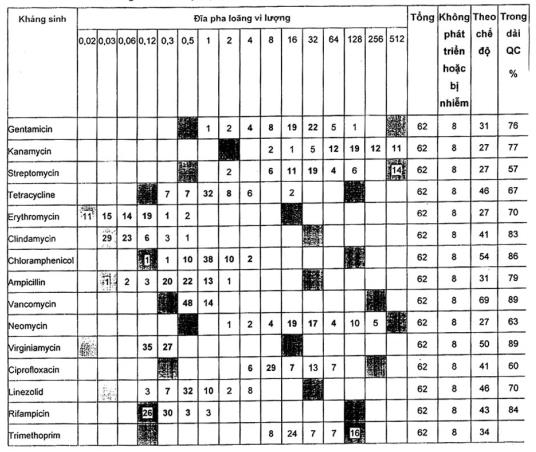
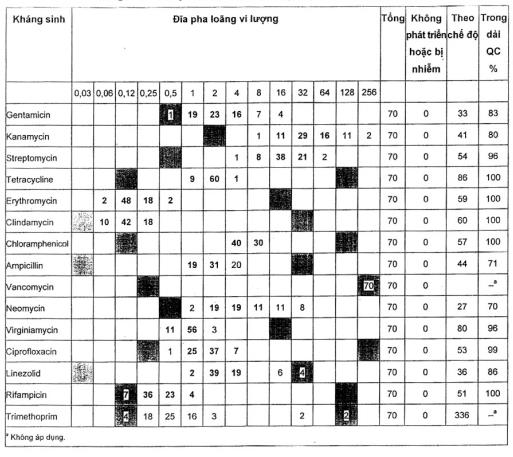
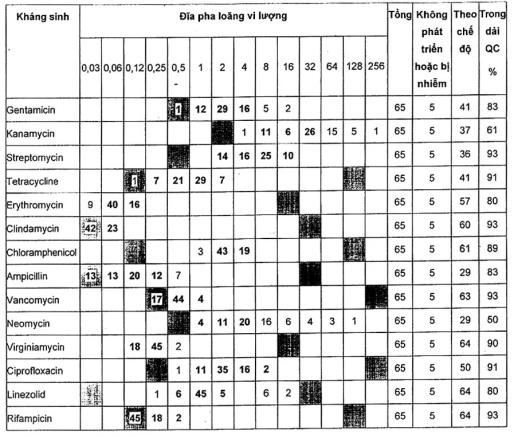
A.2.4 Lactococcus lactis ATCC® 19435™ 1)
Đối với tất cả các loại kháng sinh trừ trimethoprim, các dải kiểm soát chất lượng có thể được đề nghị mặc dù chúng được dựa trên 70 điểm dữ liệu. Các giá trị MIC đối với trimethoprim nằm trên dải.
Một phòng thử nghiệm đã nhiễm ở các giếng với vancomycin và ampicillin và những kết quả đã được loại ra. Các nồng độ của gentamicin, kanamycin, neomycin và vancomycin trên các đĩa chuẩn bị trước ở dải MIC thấp, nghĩa là trong một số thực nghiệm không có sự phát triển ngay cả ở nồng độ thấp nhất.
Bảng A.8 - Kết quả đối với Lactococcus lactis ATCC® 19435™1)
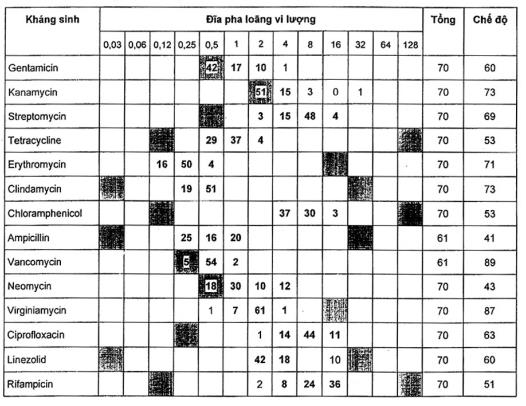
Năm chủng Lactic, lactis bổ sung đã được thử nghiệm và tất cả các kết quả được nêu trong Bảng A.9 là chấp nhận được.
Bảng A.9 - Kết quả đối với năm dòng Lactococcus lactis
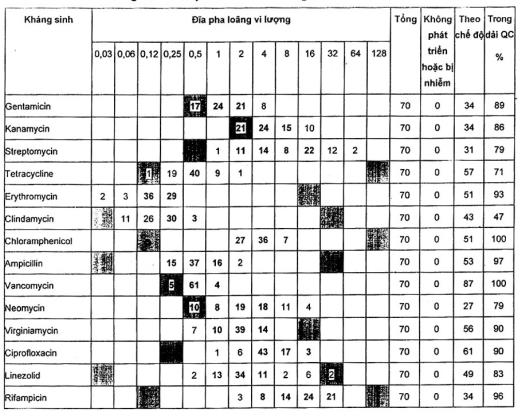
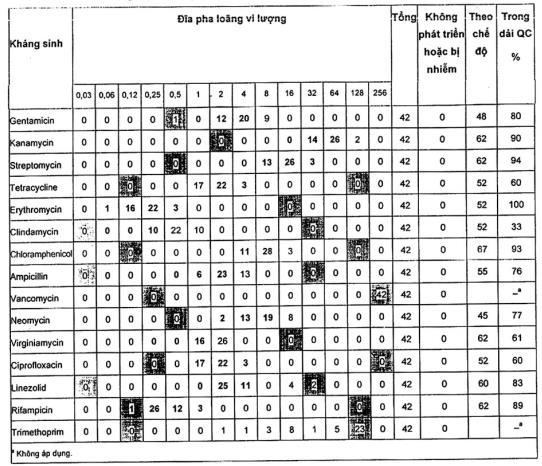
A.2.5 Streptococcus thermophilus LMG 183111)
Đối với tất cá các loại kháng sinh trừ trimethoprim, các dải kiểm soát chất lượng có thể được đề nghị mặc dù chúng được dựa trên 70 điểm dữ liệu. Các MIC về trimethoprim nằm trên dải.
Một phòng thử nghiệm đã không báo cáo giá trị MIC của streptomycin.
Nồng độ clindamycin, ampicillin, neomycin, vancomycin và rifampicin trên các đĩa đã chuẩn bị trước ở dải MIC thấp, nghĩa là trong một số thử nghiệm không có sự phát triển ngay cả ở nồng độ thấp nhất.
Bảng A.10 - Kết quả đối với Streptococcus thermophilus LMG 183111)
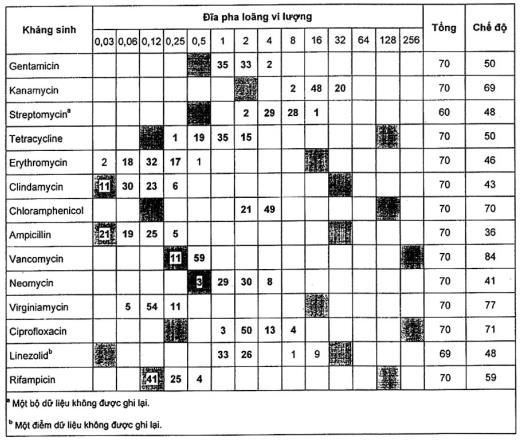
Năm chủng bổ sung của S. thermophilus đã được thử nghiệm và gần như tất cả các kết quả có thể chấp nhận như nêu trong Bảng A.11.
Một phòng thử nghiệm báo cáo kanamycin và neomycin MIC cao hơn so với các phòng thử nghiệm khác.
Bảng A.11 - Kết quả của năm dòng Streptococcus thermophilus
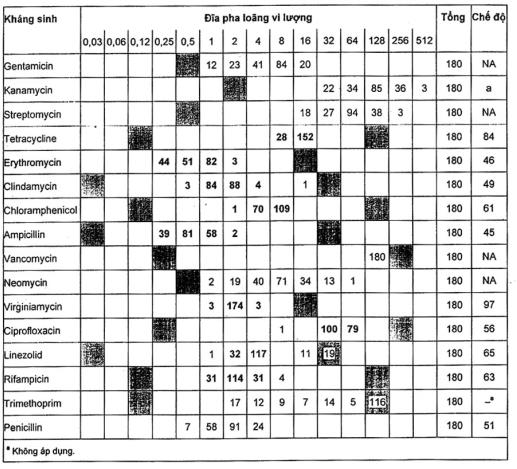
A.2.6 Lactobacillus plantarum ATCC® 14.917 TM1)
Chủng kháng với vancomycin. Các dải kiểm soát chất lượng có thể không được đề xuất cho các aminoglycosid (gentamicin, kanamycin, neomycin, streptomycin), cũng không được đề xuất cho trimethoprim, vì các dải MIC là quá rộng đối với các loại kháng sinh này. Không có khác biệt quan sát được giữa ba thương hiệu MRS (dữ liệu không hiển thị).
Bảng A.12 - Kết quả đối với Lactobacillus plantarum ATCC 14917™1)
A.3 Các thông số kiểm soát chất lượng
Các thông số kiểm soát chất lượng được thiết lập theo khuyến nghị trong CLSI M23-A2[17] “Ít nhất là 95 % các giá trị cần nằm trong dải đề xuất và sẽ bao gồm chế độ ± 1 log. Tốt nhất là dải ba độ pha loãng; tuy nhiên đôi khi có thể cần dải bốn pha loãng.
Bảng A.13 - Các thông số kiểm soát chất lượng
| Kháng sinh | Lactobacillus paracasei ATCC® 334™ a μg/ml | Lactobacillus plantarum ATCC® 14917™ a μg/ml | Bifidobacterium longum ATCC® 15707™ a μg/ml | Lactococcus lactis ATCC® 19435™ a μg/ml | Streptococcus thermophilus LMG 18311a μg/ml |
| Gentamicin | 1 đến 4 | ― b | 4 đến 32 | 0,5 đến 2 | 0,5 đến 4 |
| Kanamycin | 16 đến 64 | ― b | 64 đến 512 | 2 đến 8 | 8 đến 32 |
| Streptomycin | 8 đến 32 | ― b | 8 đến 64 | 2 đến 16 | 2 đến 16 |
| Tetracycline | 1 đến 4 | 8 đến 32 | 0,5 đến 2 | 0,5 đến 2 | 0,25 đến 2 |
| Erythromycin | 0,06 đến 0,5 | 0,25 đến 2 | 0,03 đến 0,25 | 0,12 đến 0,5 | 0,06 đến 0,25 |
| Clindamycin | 0,06 đến 0,25 | 0,5 đến 4 | 0,03 đến 0,12 | 0,25 đến 1 | 0,03 đến 0,25 |
| Chloramphenicol | 2 đến 8 | 4 đến 16 | 0,5 đến 4 | 2 đến 16 | 2 đến 8 |
| Ampicillin | 0,5 đến 2 | 0,25 đến 2 | 0,25 đến 1 | 0,12 đến 1 | 0,03 đến 0,25 |
| Vancomycin | ― b | ― b | 0,5 đến 2 | 0,25 đến 1 | 0,25 đến 1 |
| Neomycin | 2 đến 8 | ― b | 8 đến 64 | 0,5 đến 4 | 0,5 đến 4 |
| Virginiamycin | 0,25 đến 1 | 1 đến 4 | 0,06 đến 0,25 | 0,5 đến 4 | 0,06 đến 0,25 |
| Ciprofloxacin | 1 đến 4 | 16 đến 64 | 4 đến 16 | 4 đến 16 | 1 đến 8 |
| Linezolid | 1 đến 4 | 2 đến 8 | 0,25 đến 1 | 1 đến 4 | 0,5 đến 2 |
| Rifampicin | 0,12 đến 1 | 1 đến 4 | 0,12 đến 0,5 | 4 đến 32 | 0,12 đến 0,5 |
| Trimethoprim | ― b | ― b | ― b | ― b | ― b |
| a Ví dụ về sản phẩm thích hợp có bán sẵn. Thông tin này đưa ra tạo thuận tiện cho người sử dụng và tiêu chuẩn này không ấn định phải sử dụng chúng. b Không áp dụng. | |||||
Thư mục tài liệu tham khảo
[1] TCVN 7151 (ISO 648), Dụng cụ thí nghiệm bằng thủy tinh - Pipet một mức
[2] TCVN 6400 (ISO 707), Sữa và sản phẩm sữa - Hướng dẫn lấy mẫu
[3] TCVN 6910-1 (ISO 5725-1) Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo - Phần 1: Nguyên tắc và định nghĩa chung.
[4] TCVN 6910-2 (ISO 5725-2) Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo - Phần 2: Phương pháp cơ bản xác định độ lặp lại và độ tái lập của phương pháp đo tiêu chuẩn.
[5] TCVN 11086 (ISO 7550), Dụng cụ thí nghiệm bằng thủy tinh - Micropipet dùng một lần
[6] ISO 20776-1:2006, Clinical laboratory testing and in vitro diagnostic test systems - Susceptibility testing of infectious agents and evaluation of performance of antimicrobial susceptibility test devices - Part 1: Reference method for testing the in vitro activity of antimicrobial agents against rapidly growing aerobic bacteria involved in infectious diseases
[7] KLARE, I., KONSTABEL, C., MULLER-BERTLING, S., REISSBRODT, R., HUYS, G., VANCANNEYT, M., SWINGS, J., GOOSSENS, H., WITTE, W. Evaluation of new broth media for microdilution antibiotic susceptibility testing of Lactobacilli, Pediococci, Lactococci, and Bifidobacteria. Appl. Environ. Microbiol. 2005, 71, pp. 8982-8986
[8] MCDERMOTT, P.F., BODEIS, S.M., AARESTRUP, F.M., BROWN, S., TRACZEWSKI, M., FEDORKA-CRAY, P., WALLACE, M., CRITCHLEY, I.A., THORNSBERRY, C., GRAFF, S., FLAMM, R., BEYER, J., SHORTRIDGE, D., PIDDOCK, L.J., RICCI, V., JOHNSON, M.M., JONES, R.N., RELLER, B., MIRRETT, S., ALDROBI, J., RENNIE, R., BROSNIKOFF, C., TURNBULL, L, STEIN, G., SCHOOLEY, S., HANSON, R.A., WALKER, R.D. Development of a standardized susceptibility test for Campylobacter with quality - control ranges for ciprofloxacin, doxycycline, erythromycin, gentamicin, and meropenem. Microb. Drug Resist. 2004, 10, pp. 124-131
[9] VANKERCKHOVEN, V., HUYS, G., VANCANNEYT, M., VAEL, C., KLARE, I., ROMOND, M.-B., ENTENZA, J.M.,MOREILLON, P., Wind, R.D., KNOL, J., WIERTZ, E., POT, B., VAUGHAN, E.E., KAHLMETER, G., GOOSSENS, H. Biosafety assessment of probiotics used for human consumption: Recommendations from the EU-PROSAFE project. Trends Food Sci. Technol. 2008, 19, pp. 102-114
[10] HUYS, G., D'HAENE, K., DANIELSEN, M., MÄTTÖ, J., EGERVÄRN, M., VANDAMME, P. Phenotypic and molecular assessment of antimicrobial resistance in Lactobacillus paracasei strains of food origin. J. Food Prot. 2008, 71, pp. 339-344
[11] FLOREZ, A.B., DANIELSEN, M., KORHONEN, J., ZYCKA, J., VON WRIGHT, A., BARDOWSKI, J., MAYO, B. Antibiotic survey of Lactococcus lactis strains to six antibiotics by Etest, and establishment of new susceptibility-resistance cut-off values. J. Dairy Res. 2007, 74, pp. 262-268
[12] EGERVÄRN, M., DANIELSEN, M., ROOS, S., LINDMARK, H., LINDREN, S. Antibiotic susceptibility profiles of Lactobacillus reuteri and Lactobacillus fermentum. J. Food Prot. 2007, 70, pp. 412-418
[13] FLOREZ, A.B., EGERVÄRN, M., DANIELSEN, M., TOSI, L., MORELLI, L., LINDREN, S., MAYO, B.Susceptibility of Lactobacillus plantarum strains to six antibiotics and definition of new susceptibility - resistance cutoff values. Microb. Drug Resist. 2006, 12, pp. 252-256
[14] TOSI, L, BERRUTI, G., DANIELSEN, M., WIND, A., HUYS, G., MORELLI, L. Susceptibility of Streptococcus thermophilus to antibiotics. Antonie Van Leeuwenhoek 2007, 92, pp. 21-28
[15] KLARE, I., KONSTABEL, C., WERNER, G., HUYS, G., VANKERCKHOVEN, V., KAHLMETER, G., HILDEBRANT, B., MÜLLER-BERTLING, S., WITTE, W., GOOSSENS, H. Antimicrobial susceptibilities of Lactobacillus, Pediococcus and Lactococcus human isolates and cultures intended for probiotic or nutritional use. J. Antimicrob. Chemother. 2007, 59, pp. 900-912
[16] DANIELSEN, M., MAYRHOFER, S., DOMIG, K.J., AMTMANN, E., MAYER, H.K., FLOREZ, A.B., Mayo, B., Korhonen, J., Tosi, L. Assessment of the antimicrobial wild - type minimum inhibitory concentration distributions of species of the Lactobacillus delbrueckii group. Dairy Sci. Technol. 2008, 88, pp. 183-191
[17] CLSI M23-A2, Vol. 21 No 7. Development of in vitro susceptibility testing criteria and quality control parameters: Approved guideline, second edition
*) TCVN 8128-1:2009 (ISO/TS 11133-1:2009) và TCVN 8128-2:2009 (ISO/TS 11133-2:2003) đã được soát xét và thay thế bằng TCVN 8128:2015 (ISO 11133:2014) Vi sinh vật trong thực phẩm, thức ăn chăn nuôi và nước - Chuẩn bị, sản xuất, bảo quản và thử hiệu năng của môi trường nuôi cấy.
1) Đây là ví dụ về sản phẩm thích hợp có sẵn. Thông tin này đưa ra tạo thuận lợi cho người sử dụng tiêu chuẩn này và không ấn định phải sử dụng chúng.
2) VetMIC™ là tên thương mại của sản phẩm được sử dụng bởi Viện Thú y Quốc gia, Uppsala, Thụy Điển. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn này và không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu cho kết quả tương đương.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 11681:2016 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 11681:2016 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 11681:2016 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 11681:2016 DOC (Bản Word)