- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 11471:2016 Phụ gia thực phẩm–Tinh bột biến tính
| Số hiệu: | TCVN 11471:2016 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
25/11/2016 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 11471:2016
TCVN 11471:2016: Tiêu chuẩn dành cho phụ gia thực phẩm Tinh bột biến tính
Tiêu chuẩn Quốc gia TCVN 11471:2016 được ban hành bởi Bộ Khoa học và Công nghệ, cụ thể là Tổng cục Tiêu chuẩn Đo lường Chất lượng, vào ngày 25 tháng 10 năm 2016 và có hiệu lực ngay sau ngày công bố. Tiêu chuẩn này quy định về các loại tinh bột biến tính được sử dụng làm phụ gia thực phẩm, nhằm đảm bảo chất lượng và an toàn cho người tiêu dùng.
Tiêu chuẩn áp dụng cho nhiều loại tinh bột biến tính khác nhau, trong đó có Dextrin (INS 1400) và các loại tinh bột biến tính bằng phương pháp xử lý khác như tinh bột xử lý bằng axit (INS 1401), kiềm (INS 1402), tẩy màu (INS 1403), oxy hóa (INS 1404) và enzym (INS 1405). Đặc biệt, tiêu chuẩn cũng chỉ rõ các quy trình sản xuất và các yêu cầu về độ tinh khiết của các sản phẩm tinh bột biến tính.
Về yêu cầu độ tinh khiết, tiêu chuẩn quy định cụ thể hạn mức cho các chất độc hại như hàm lượng lưu huỳnh dioxit không vượt quá 50 mg/kg đối với tinh bột ngũ cốc biến tính và 10 mg/kg đối với các loại tinh bột biến tính khác. Đối với hàm lượng chì, giới hạn không được vượt quá 2 mg/kg. Tiêu chuẩn cũng đưa ra yêu cầu chi tiết cho mỗi loại tinh bột biến tính khác nhau, với các tiêu chí đặc trưng như hàm lượng nhóm cacboxyl, hàm lượng phosphat và khả năng hòa tan của các sản phẩm.
Ngoài ra, tiêu chuẩn cũng quy định các phương pháp thử nghiệm theo TCVN 6469:2010, từ nhận biết phẩm chất tinh bột đến xác định các chỉ tiêu vật lý và hóa học như hàm lượng các nhóm anion, nhóm este và hàm lượng các kim loại nặng.
TCVN 11471:2016 nhằm mục tiêu bảo vệ sức khỏe người tiêu dùng và nâng cao chất lượng sản phẩm thực phẩm, đồng thời tạo cơ sở pháp lý cho các cơ quan quản lý và các doanh nghiệp trong sản xuất và kinh doanh tinh bột biến tính. Việc tuân thủ các quy định trong tiêu chuẩn này là rất quan trọng đối với các doanh nghiệp sản xuất thực phẩm để đảm bảo sản phẩm an toàn, chất lượng và phù hợp với yêu cầu của thị trường trong nước và quốc tế.
Tiêu chuẩn không chỉ tác động đến người tiêu dùng mà còn ảnh hưởng lớn đến các doanh nghiệp nghiên cứu, sản xuất và chế biến thực phẩm, giúp họ kiểm soát chất lượng và nâng cao giá trị sản phẩm. Các cán bộ công chức và cơ quan quản lý cũng cần chú trọng trong việc áp dụng tiêu chuẩn này nhằm đảm bảo việc thực hiện và giám sát các quy định liên quan đến an toàn thực phẩm.
Tải tiêu chuẩn Việt Nam TCVN 11471:2016
TIÊU CHUẨN QUỐC GIA
TCVN 11471:2016
PHỤ GIA THỰC PHẨM - TINH BỘT BIẾN TÍNH
Food additive - Modified starches
Lời nói đầu
TCVN 11471:2016 được xây dựng trên cơ sở tham khảo JECFA Monograph 16 (2014) Modified starches;
TCVN 11471:2016 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F18 Đường, mật ong và sản phẩm tinh bột biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
PHỤ GIA THỰC PHẨM - TINH BỘT BIẾN TÍNH
Food additive - Modified starches
1 Phạm vi áp dụng
Tiêu chuẩn này áp dụng cho các loại tinh bột biến tính dưới đây, được sử dụng làm phụ gia thực phẩm.
| Dextrin, tinh bột rang: | INS 1) 1400 |
| Tinh bột xử lý bằng axit: | INS 1401 |
| Tinh bột xử lý bằng kiềm: | INS 1402 |
| Tinh bột tẩy màu: | INS 1403 |
| Tinh bột oxy hóa: | INS 1404 |
| Tinh bột xử lý bằng enzym: | INS 1405 |
| Tinh bột đơn (monostarch) phosphat: | INS 1410 |
| Tinh bột kép (distarch) phosphat: | INS 1412 |
| Tinh bột kép phosphat đã phosphat hóa: | INS 1413 |
| Tinh bột kép phosphat đã axetyl hóa: | INS 1414 |
| Tinh bột axetat: | INS 1420 |
| Tinh bột kép adipat đã axetyl hóa: | INS 1422 |
| Tinh bột hydroxypropyl: | INS 1440 |
| Tinh bột kép phosphat hydroxypropyl: | INS 1442 |
| Tinh bột natri octenylsucinat: | INS 1450 |
| Tinh bột oxy hóa đã axetyl hóa: | INS 1451 |
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 6469:2010, Phụ gia thực phẩm - Phương pháp đánh giá ngoại quan và xác định các chỉ tiêu vật lý
TCVN 8900-6:2012, Phụ gia thực phẩm - Xác định các thành phần vô cơ - Phần 6: Định lượng antimon, bari, cadimi, crom, đồng, chì và kẽm bằng đo phổ hấp thụ nguyên tử ngọn lửa
TCVN 8900-7:2012, Phụ gia thực phẩm - Xác định các thành phần vô cơ - Phần 7: Định lượng antimon, bari cadimi, crom, đồng, chì và kẽm bằng đo phổ phát xạ nguyên tử plasma cảm ứng cao tần (ICP-AES)
TCVN 8900-8:2012, Phụ gia thực phẩm - Xác định các thành phần vô cơ - Phần 8: Định lượng chì và cadimi bằng đo phổ hấp thụ nguyên tử dùng lò graphit
3 Mô tả
3.1 Định nghĩa sản phẩm
Tinh bột biến tính là các loại tinh bột thực phẩm có một hoặc một số thuộc tính ban đầu đã được làm thay đổi bằng cách xử lý phù hợp với Thực hành sản xuất tốt (GMP), theo một trong những quy trình nêu trong Bảng 2.
Trong trường hợp tinh bột được xử lý bằng nhiệt trong môi trường axit hoặc kiềm, sẽ tạo ra các đoạn mạch nhỏ. Khi tinh bột được tẩy màu, về cơ bản chỉ có sự thay đổi về màu sắc. Quá trình oxy hóa liên quan đến việc tạo thành các nhóm cacboxyl. Kết quả axetyl hóa là thay thế nhóm hydroxyl bằng este axetyl. Xử lý bằng thuốc thử như axit orthophosphoric dẫn đến thay thế vị trí 2, 3 hoặc 6 của anhydroglucose trừ khi vị trí số 6 có liên kết nhánh. Trong trường hợp liên kết ngang, khi dùng chất thay thế đa chức năng như phospho oxyclorua, kết nối hai mạch, cấu trúc có thể là: Tinh bột -O-R-O- tinh bột, trong đó R là nhóm liên kết ngang và tinh bột có cấu trúc thẳng và/hoặc phân nhánh.
Các sản phẩm thương mại có thể được xác định bởi các thông số cho kiểu biến tính cụ thể như trong cột thứ 3 của Bảng 2 và cũng có thể được quy định thêm về hao hụt khối lượng khi sấy, tro sulfat, protein và chất béo.
3.2 Kí hiệu
C.A.S (mã số hóa chất):
| Tinh bột axetat: | 9045-28-7 |
| Tinh bột kép adipat đã axetyl hóa: | 68130-14-3 |
| Tinh bột hydroxypropyl: | 9049-76-7 |
| Tinh bột kép phosphat hydroxypropyl: | 53124-00-8 |
| Tinh bột oxy hóa đã axetyl hóa: | 68187-08-6 |
3.3 Chức năng sử dụng: Chất làm dày, chất ổn định, chất kết dính, chất nhũ hóa
4 Các yêu cầu
4.1 Nhận biết
4.1.1 Tính chất cảm quan
Hầu hết tinh bột biến tính có dạng bột không mùi, màu trắng hoặc trắng nhạt. Tùy thuộc vào phương pháp sấy, sản phẩm này có thể gồm các hạt tinh bột có vẻ ngoài giống như tinh bột tự nhiên hoặc kết thành các khối gồm nhiều hạt (như hạt trân châu) hoặc nếu hồ hóa (gelatin hóa) sơ bộ thì gồm dạng vảy, dạng bột vô định hình hoặc dạng hạt thô.
4.1.2 Độ hòa tan
Không tan trong nước lạnh (nếu không hồ hóa sơ bộ), tạo các dung dịch keo nhớt điển hình trong nước nóng; không tan trong etanol.
CHÚ THÍCH: Theo TCVN 6469:2010, chất được coi là “không tan” nếu phải cần trên 10 000 phần dung môi để hòa tan 1 phần chất tan.
4.1.3 Cấu trúc hiển vi
Đạt yêu cầu của phép thử trong 5.1.2.
4.1.4 Nhuộm màu iot
Đạt yêu cầu của phép thử trong 5.1.3.
4.1.5 Khử đồng
Đạt yêu cầu của phép thử trong 5.1.4.
4.1.6 Phép thử phân biệt
Đạt yêu cầu của phép thử đối với từng dạng tinh bột trong 5.1.5.
4.2 Độ tinh khiết
Yêu cầu về độ tinh khiết của tinh bột biến tính được quy định trong Bảng 1.
Bảng 1 - Độ tinh khiết của tinh bột biến tính
| Tên chỉ tiêu | Mức yêu cầu |
| 1. Hàm lượng lưu huỳnh dioxit |
|
| - đối với tinh bột ngũ cốc biến tính, mg/kg, không lớn hơn | 50 |
| - đối với tinh bột biến tính khác, trừ khi được quy định trong Bảng 2, mg/kg, không lớn hơn | 10 |
| 2. Hàm lượng chì, mg/kg, không lớn hơn | 2 |
Yêu cầu bổ sung về độ tinh khiết đối với các chế phẩm tinh bột biến tính bằng hóa học được quy định trong Bảng 2.
Bảng 2 - Yêu cầu bổ sung vô độ tinh khiết đối với các chế phẩm tinh bột biến tính bằng hóa học
| Loại tinh bột biến tính | Tóm lược phương pháp xử lý | Yêu cầu đối với sản phẩm cuối cùng |
| Dextrin, tinh bột rang | Xử lý nhiệt khô với axit clohydric hoặc axit ortho-phosphoric | pH = 2,5 ÷ 7,0 |
| Tinh bột xử lý bằng axit | Xử lý bằng axit clohydric hoặc axit ortho-phosphoric hoặc axit sulfuric | pH = 4,8 ÷ 7,0 |
| Tinh bột xử lý bằng kiềm | Xử lý bằng natri hydroxit hoặc kali hydroxit | pH = 5,0 ÷ 7,5 |
| Tinh bột tẩy màu | Xử lý bằng axit peraxetic và/hoặc hydro peroxit, hoặc natri hypoclorit, hoặc natri clorit, hoặc lưu huỳnh dioxit hoặc các dạng sulfit khác, hoặc kali permanganat hoặc amoni persuffat | Hàm lượng nhóm cacbonyl bổ sung không lớn hơn 0,1 %; Không có hóa chất dư; Dư lượng lưu huỳnh dioxit không lớn hơn 50 mg/kg; Dư lượng mangan không lớn hơn 50 mg/kg |
| Tinh bột xử lý bằng enzym | Xử lý trong dung dịch nước ở nhiệt độ dưới điểm hồ hóa với một hoặc nhiều enzym thủy phân tinh bột dùng cho thực phẩm | Dư lượng lưu huỳnh dioxit không lớn hơn 50 mg/kg |
| Tinh bột oxy hóa | Xử lý bằng natri hypoclorit | Hàm lượng các nhóm cacboxyl không lớn hơn 1,1 %; Dư lượng lưu huỳnh dioxit không lớn hơn 50 mg/ |
| Tinh bột đơn phosphat | Este hóa bằng axit ortho-phosphoric, hoặc natri ortho-phosphat hoặc kali ortho-phosphat, hoặc natri tripolyphosphat | Hàm lượng phosphat tính theo phospho không lớn hơn 0,5 % đối với tinh bột khoai tây hoặc tinh bột lúa mì và không lớn hơn 0,4 % đối với các loại tinh bột khác. |
| Tinh bột kép phosphat | Este hóa bằng natri trimetaphosphat hoặc phospho oxyclorua | Hàm lượng phosphat tính theo phospho không lớn hơn 0,5 % đối với tinh bột khoai tây hoặc tinh bột lúa mì và không lớn hơn 0,4 % đối với các loại tinh bột khác. |
| Tinh bột kép phosphat đã phosphat hoá | Kết hợp các biện pháp xử lý đối với tinh bột đơn phosphat và tinh bột kép phosphat | Hàm lượng phosphat tính theo phospho không lớn hơn 0,5 % đối với tinh bột khoai tây hoặc tinh bột lúa mì và không lớn hơn 0,4 % đối với các loại tinh bột khác. |
| Tinh bột kép phosphat đã axetyl hóa | Este hóa bằng natri trimetaphosphat hoặc phospho oxyclorua kết hợp với este hóa bằng anhydrid axetic hoặc vinyl axetat | Hàm lượng các nhóm axetyl không lớn hơn 2,5 %; Hàm lượng phosphat tính theo phospho không lớn hơn 0,14 % đối với tinh bột khoai tây hoặc tinh bột lúa mì và không lớn hơn 0,04 % đối với các loại tinh bột khác; Hàm lượng vinyl axetat không lớn hơn 0,1 mg/ |
| Tinh bột axetat | Este hóa bằng anhydrid axetic hoặc vinyl axetat | Hàm lượng các nhóm axetyl không lớn hơn 2,5 % |
| Tinh bột kép adipat đã axetyl hóa | Este hóa bằng anhydrid axetic và anhydrid adipic | Hàm lượng các nhóm axetyl không lớn hơn 2,5 %; Hàm lượng các nhóm adipat không lớn hơn 0,135 % |
| Tinh bột hydroxypropyl | Este hóa bằng propylen oxit | Hàm lượng các nhóm hydroxypropyl không lớn hơn 7,0 %: Hàm lượng propylen clorohydrin không lớn hơn 1 mg/ |
| Tinh bột kép phosphat hydroxypropyl | Este hóa bằng natri trimetaphosphat hoặc phospho oxyclorua kết hợp với este hóa bằng propylen oxit | Hàm lượng các nhóm hydroxypropyl không lớn hơn 7,0 %; Hàm lượng propylen clorohydrin không lớn hơn 1 mg/kg: Dư lượng phosphat tính theo phospho không lớn hơn 0,14 % đối với tinh bột khoai tây hoặc tinh bột lúa mì và không lớn hơn 0,04 % đối với các loại tinh bột khác |
| Tinh bột natri octenylsucinat | Este hóa bằng anhydrid octenylsucinic | Hàm lượng các nhóm octenylsucinyl không lớn hơn 3 %; Dư lượng axit octenyl sucinic không lớn hơn 0,3 % |
| Tinh bột oxy hóa đã axetyl hóa | Xử lý bằng natri hypoclorit sau đó este hóa bằng anhydrid axetic | Hàm lượng các nhóm axetyl không lớn hơn 2,5 %; Hàm lượng các nhóm cacboxyl không lớn hơn 1,3 % |
5 Phương pháp thử
5.1 Phép thử nhận biết
5.1.1 Xác định độ hòa tan, theo 3.7 của TCVN 6469:2010.
5.1.2 Xác định cấu trúc hiển vi
Tinh bột biến tính chưa được hồ hóa vẫn giữ được cấu trúc hạt, có thể xác định là tinh bột nhờ quan sát bằng kính hiển vi. Hình dạng, kích thước và đôi khi tính phân lớp là các đặc trưng của nguồn gốc thực vật. Dưới ánh sáng phân cực qua lăng kính nicol, có thể quan sát được độ phân cực điển hình.
5.1.3 Phép thử nhuộm màu iot
Cho một vài giọt kali tri-iodua 0,1 N vào huyền phù mẫu thử. Các tinh bột này nhuộm màu iot giống như nhuộm màu với tinh bột tự nhiên. Màu có thể từ màu xanh đậm đến đỏ.
5.1.4 Phép thử khử đồng
5.1.4.1 Thuốc thử
5.1.4.1.1 Dung dịch axit clohydric loãng, 3 %
5.1.4.1.2 Dung dịch kiềm nóng đồng (II) tartrat (dung dịch Fehling)
Dung dịch đồng (dung dịch A): Hòa tan 34,66 g tinh thể đồng sulfat ngậm năm phân tử nước (CuSO4.5H2O) trong lượng nước vừa đủ và thêm nước đến 500 ml. Bảo quản trong bình kín khí.
Dung dịch tartrat kiềm (dung dịch B): Hòa tan 173 g tinh thể kali natri tartrat ngậm bốn phân tử nước (KNaC4H4O6.4H2O) và 50 g natri hydroxyt (NaOH) trong lượng nước vừa đủ và thêm nước đến 500 ml. Bảo quản trong bình chịu kiềm.
Khi sử dụng, trộn các thể tích bằng nhau của dung dịch A và dung dịch B.
5.1.4.2 Cách tiến hành
Cho khoảng 2,5 g mẫu thử (đã được rửa trước bằng nước) vào bình đun sôi, thêm 10 ml dung dịch axit clohydric loãng (5.1.4.1.1) và 70 ml nước, trộn, đun hồi lưu trong 3 h và để nguội. Cho 0,5 ml dung dịch thu được vào 5 ml dung dịch kiềm nóng đồng (II) tartrat (5.1.4.1.2). Kết tủa màu đỏ thẫm được tạo thành.
5.1.5 Phép thử phân biệt (để phân biệt các loại tinh bột được xử lý theo các biện pháp khác nhau)
5.1.5.1 Phép thử đối với tinh bột oxy hóa bằng hypoclorit (không thử đối với tinh bột khoai tây oxy hóa nhẹ)
5.1.5.1.1 Nguyên tắc
Tinh bột oxy hóa bằng hypoclorit có chứa nhóm cacboxyl nên có thuộc tính anion. Tinh bột loại này có thể được nhuộm bằng các chất nhuộm màu tích điện dương như xanh metylen.
5.1.5.1.2 Cách tiến hành
Giữ huyền phù gồm 50 mg mẫu thử trong 25 ml dung dịch nước thuốc nhuộm 1 % trong 5 min đến 10 min và thỉnh thoảng khuấy. Sau khi gạn phần dung dịch dư, tinh bột được rửa bằng nước cất. Kiểm tra bằng kính hiển vi cho màu rõ, nếu mẫu là tinh bột oxy hóa hypoclorit. Do vậy, phép thử cho phép phân biệt được tinh bột oxy hóa bằng hypoclorit với tinh bột tự nhiên hay tinh bột biến tính bằng axit có cùng nguồn gốc thực vật.
5.1.5.2 Phản ứng đặc hiệu của các nhóm axetyl
5.1.5.2.1 Nguyên tắc
Axetat được giải phóng nhờ quá trình xà phòng hóa tinh bột đã axetyl hóa. Sau khi cô đặc, axetat được chuyển thành axeton bằng cách gia nhiệt với canxi hydroxit [Ca(OH2], axeton tạo thành được nhuộm màu xanh bằng ortho-nitrobenzaldehyd.
5.1.5.2.2 Cách tiến hành
Tạo huyền phù 10 g mẫu trong 25 ml nước và bổ sung 20 ml dung dịch natri hydroxit 0,4 N. Sau khi lắc trong 1 h, tinh bột được lọc ra và làm bay hơi phần dịch lọc thu được trong tủ sấy ở 110 °C. Phần còn lại sau khi bay hơi được hòa trong một vài giọt nước và được chuyển sang ống nghiệm. Thêm canxi hydroxit và gia nhiệt ống nghiệm. Nếu mẫu là tinh bột đã axetyl hóa thì sẽ tạo thành hơi axeton. Hơi này tạo thành màu xanh trên mảnh giấy tẩm dung dịch o-nitrobenzaldehyd bão hòa trong dung dịch natri hydroxit 2 N. Màu xanh sẽ dễ nhận biết hơn khi làm mất màu vàng ban đầu của các thuốc thử bằng cách nhỏ 1 giọt dung dịch axit clohydric 10 %.
5.1.5.3 Phép thử dương tính đối với các nhóm este
Phổ hồng ngoại của một tấm film mỏng có dải hấp thụ điển hình ở khoảng 1,720 cm-1 là chỉ thị về sự có mặt của các nhóm este. Giới hạn phát hiện là khoảng 0,5 % các nhóm axetyl, adipyl hoặc sucinyl trong sản phẩm.
5.2 Phép thử độ tinh khiết
5.2.1 Xác định hàm lượng lưu huỳnh dioxit
5.2.1.1 Phạm vi áp dụng
Phương pháp này được áp dụng đối với mẫu tinh bột biến tính dạng lỏng hoặc dạng rắn, kể cả khi có mặt các hợp chất chứa lưu huỳnh dễ bay hơi khác.
5.2.1.2 Nguyên tắc
Lưu huỳnh dioxit (SO2) được giải phóng ra khỏi mẫu trong môi trường axit sôi và được tách ra bằng dòng khí cacbon dioxit. Khí tách ra được dẫn vào dung dịch hydro peroxit loãng và bị oxy hóa thành axit sulfuric, được chuẩn độ bằng dung dịch kiềm chuẩn. Cũng có thể định lượng axit sulfuric theo bari sulfat.
5.2.1.3 Thuốc thử
5.2.1.3.1 Dung dịch natri cacbonat (Na2CO3)
Hòa tan khoảng 15 g natri cacbonat hoặc 40 g natri cacbonat ngậm mười phân tử nước trong nước cất và pha loãng đến 100 ml.
5.2.1.3.2 Dung dịch hydro peroxit (H2O2), 3 %
Pha loãng 10 ml hydro peroxit trung tính 30 % với nước cất đến 100 ml.
5.2.1.3.3 Axit clohydric đặc.
5.2.1.4 Thiết bị, dụng cụ
5.2.1.4.1 Bộ dụng cụ Monier-Williams, để xác định axit sulfurơ, có các khớp nối thủy tinh hình côn chuẩn (xem Hình 1).
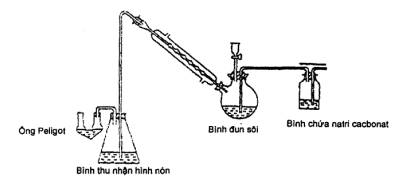
Hình 1 - Bộ dụng cụ Monier-Williams
Bộ dụng cụ gồm bình cầu đáy tròn hai cổ dung tích 1 000 ml nối với một ống khí vào, một phễu nhỏ giọt dung tích 60 ml có van khóa kích thước lỗ 2 mm, được nối với ống sinh hàn ngược. Một ống dẫn nối với phần trên của sinh hàn tới đáy của bình thu nhận hình nón dung tích 250 ml, bình này được nối với ống Peligot.
Trong quá trình thao tác, lượng khí cacbon dioxit thoát ra được dẫn qua bình rửa và tạo thành bọt khi qua hỗn hợp phản ứng nóng, dẫn lưu huỳnh dioxit qua ống sinh hàn vào bình thu nhận và được hấp thụ hoàn toàn.
5.2.1.4.2 Thiết bị sinh cacbon dioxit hoặc bình khí nén cacbon dioxit.
5.2.1.4.3 Pipet.
5.2.1.4.4 Buret.
5.2.1.4.5 Cân, có thể cân chính xác đến 1 g.
5.2.1.5 Cách tiến hành
Cho cacbon dioxit từ thiết bị sinh cacbon dioxit hoặc bình khí nén cacbon dioxit (5.2.1.4.2) qua dung dịch rửa natri cacbonat (5.2.1.3.1) để loại clo, sau đó đi qua ống dẫn khí vào bình đun sôi. Cho 15 ml dung dịch hydro peroxit 3 % (5.2.1.3.2) vào bình thu nhận và 5 ml dung dịch này vào ống Peligot. Lắp bộ dụng cụ Monier-Williams (5.2.1.4.1), cho 300 ml nước cất và 20 ml axit clohydric đặc (5.2.1.3.3) vào bình đun sôi qua phễu nhỏ giọt. Đun sôi hỗn hợp trong khoảng 10 min trong dòng khí cacbon dioxit.
Cân 100 g mẫu thử, chính xác đến 1 g và hòa mẫu trong khoảng 300 ml nước cất vừa đun sôi. Chuyển phần hồ nhão vào bình đun qua phễu nhỏ giọt, điều chỉnh tốc độ thêm mẫu và tốc độ dòng khí qua dụng cụ để ngăn sự quay trở lại của hydro peroxit, kể cả không khí, hoặc làm cháy mẫu. Đun sôi nhẹ hỗn hợp trong 1 h có sục chậm dòng khí cacbon dioxit. Ngắt dòng nước trong bộ sinh hàn ngay trước khi kết thúc chưng cất. Khi ống dẫn ở ngay bên trên bình thu nhận bị nóng, tháo ngay ống ra khỏi sinh hàn. Rửa lượng chứa trong ống dẫn và ống Peligot vào bình thu nhận và chuẩn độ bằng dung dịch natri hydroxit 0,1 N, sử dụng chất chỉ thị xanh bromphenol.
CHÚ THÍCH Phép xác định theo khối lượng có thể thực hiện sau khi chuẩn độ. Axit hóa bằng axit clohydric, kết tủa bằng bari clorua, để lắng, lọc, rửa, nung và cân lượng kết tủa bari sulfat.
Thực hiện phép thử trắng thuốc thử và hiệu chính kết quả.
5.2.1.6 Tính kết quả
Hàm lượng lưu huỳnh dioxit, X1, biểu thị bằng phần trăm khối lượng, được tính theo Công thức (1):
![]() (1)
(1)
Trong đó:
S là thể tích dung dịch natri hydroxit 0,1 N dùng để chuẩn độ mẫu thử, tính bằng mililit (ml);
B là thể tích dung dịch natri hydroxit 0,1 N dùng để chuẩn độ mẫu trắng, tính bằng mililit (ml);
0,0032 là số gam lưu huỳnh dioxit tương ứng với 1 ml dung dịch natri hydroxit 0,1 N;
w là khối lượng mẫu thử, tính bằng gam (g).
5.2.2 Xác định pH, theo 3.8 của TCVN 6469:2010.
Chuẩn bị mẫu như sau: Hòa 20 g mẫu với 80 ml nước và khuấy liên tục ở tốc độ trung bình trong 5 min (trong trường hợp mẫu là tinh bột đã hồ hóa sơ bộ, cân 3 g và tạo huyền phù với 97 ml nước).
5.2.3 Xác định hàm lượng nhóm cacboxyl
5.2.3.1 Nguyên tắc
Tinh bột có chứa cacboxyl được cân bằng với axit vô cơ để chuyển các muối cacboxyl thành dạng axit. Các cation và axit dư được loại bỏ bằng cách rửa với nước. Mẫu đã rửa được hồ hóa trong nước và được chuẩn độ bằng dung dịch kiềm chuẩn.
5.2.3.2 Thuốc thử
5.2.3.2.1 Dung dịch axit clohydric, 0,1 N.
5.2.3.2.2 Dung dịch natrihydroxit, 0,1 N, đã chuẩn hóa.
5.2.3.2.3 Dung dịch chỉ thị phenolphthalein, 1 %.
5.2.3.3 Thiết bị, dụng cụ
5.2.3.3.1 Máy nghiền phòng thử nghiệm.
5.2.3.3.2 Cốc có mỏ, dung tích 150 ml và 600 ml.
5.2.3.3.3 Phễu thủy tinh xốp có lỗ trung bình hoặc phễu nhỏ.
5.2.3.3.4 Nồi hơi hoặc nồi cách thủy đun sôi.
5 2.3.3.5 Buret.
5.2.3.3.6 Pipet.
5.2.3.3.7 Cân phân tích.
5.2.3.3.8 Rây, loại 20 mesh hoặc mịn hơn.
5.2.3.4 Cách tiến hành
Nếu cần, nghiền kỹ mẫu bằng máy nghiền phòng thử nghiệm (5.2.3.3.1) lọt hết qua rây 20 mesh hoặc mịn hơn (5.2.3.3.8) và trộn kỹ, thực hiện cẩn thận để tránh thay đổi độ ẩm đáng kể.
Cân chính xác một lượng mẫu chứa không quá 0,25 mili đương lượng cacboxyl và chuyển định lượng vào cốc có mỏ dung tích 150 ml (5.2.3.3.2).
CHÚ THÍCH 1: Lượng mẫu không lớn hơn 5,0 g đối với tinh bột oxy hóa trung bình hoặc nhỏ hơn 0,15 g đối với tinh bột oxy hóa cao.
Thêm 25 ml dung dịch axit clohydric 0,1 N (5.2.3.2.1) và thỉnh thoảng khuấy trong thời gian 30 min. Lọc chân không lớp hồ nhão qua phễu thủy tinh xốp có lỗ trung bình hoặc phễu nhỏ (5.2.3.3.3), sử dụng dòng nước nhỏ từ bình rửa để giúp chuyển toàn bộ lượng mẫu. Rửa mẫu bằng nước cất (thường 300 ml là đủ) cho đến khi phần dịch lọc không còn chứa clorua khi thử bằng bạc nitrat.
CHÚ THÍCH 2: Cho 1 ml dung dịch bạc nitrat 1 % vào 5 ml dịch lọc. Xuất hiện kết tủa hoặc dung dịch đục trong vòng 1 min nếu có mặt clorua.
Chuyển định lượng mẫu đã khử khoáng vào cốc có mỏ dung tích 600 ml (5 2.3.3.2) cùng với nước cất và tạo mẫu thành bột nhão trong 300 ml nước cất. Gia nhiệt huyền phù mẫu trong nồi hơi hoặc trên nồi cách thủy đun sôi (5.2.3.3.4), khuấy liên tục cho đến khi tinh bột hồ hóa và tiếp tục gia nhiệt trong 15 min để đảm bảo tinh bột hồ hóa hoàn toàn.
CHÚ THÍCH 3: Không nên gia nhiệt trên đĩa nóng hoặc trên đèn đốt Bunsen. Sự quá nhiệt trên lượng mẫu quá nhỏ sẻ phân hủy mẫu và dẫn đến kết quả cacboxyl cao.
CHÚ THÍCH 4: Việc hồ hóa tạo điều kiện chuẩn độ nhanh và phát hiện chính xác điểm kết thúc chuẩn độ.
Lấy mẫu ra khỏi nồi cách thủy và chuẩn độ khi còn nóng bằng dung dịch natri hydroxit 0,1 N (5.2.3.2.2) đến điểm kết thúc chuẩn độ sử dụng chỉ thị phenolphthalein (5.2.3.2.3). Cũng có thể phát hiện điểm kết thúc bằng cách đo điện thế tại pH 8,3.
Thực hiện phép thử trắng trên mẫu thử để hiệu chỉnh các chất axit tự nhiên. Cân cùng một lượng tinh bột như đã lấy để chuẩn độ cacboxyl và trộn với 10 ml nước cất. Khuấy sau các khoảng thời gian 5 min trong 30 min. Lọc chân không hồ nhão qua một phễu thủy tinh xốp có lỗ xốp trung bình hoặc phễu nhỏ (5.2.3.3 3) và rửa mẫu bằng 200 ml nước cất. Hồ hóa và chuẩn độ mẫu bằng dung dịch natri hydroxit 0,1 N giống như đã thực hiện với mẫu đã khử khoáng.
CHÚ THÍCH 5: Chuẩn độ mẫu trắng được tiến hành trên mẫu đã được rửa bằng nước để hiệu chỉnh các thành phần axit không được đưa vào bằng cách oxy hóa hoặc tạo dẫn xuất. Các axit béo tự do tạo phức với amylose trong tinh bột ngô thông thường là những chất có đóng góp chính đối với độ chuẩn mẫu trắng.
5.2.3.5 Tính kết quả
Hàm lượng nhóm cacboxyl, X2, tính bằng phần trăm khối lượng theo Công thức (2):
![]() (2)
(2)
Trong đó:
V1 là thể tích dung dịch natri hydroxit 0,1 N dùng cho mẫu thử, tính bằng mililit (ml);
V2 là thể tích dung dịch natri hydroxit 0,1 N dùng cho mẫu trắng, tính bằng mililit (ml);
0,0045 là số gam nhóm cacboxyl tương ứng với 1 ml dung dịch natri hydroxit 0,1 N;
m là khối lượng mẫu, tính bằng gam (g)
CHÚ THÍCH Các nhóm phosphat có mặt tự nhiên trong tinh bột khoai tây làm tăng thể tích chuẩn độ trong phương pháp này. Cần hiệu chỉnh kết quả (giảm) theo hàm lượng phosphat trong tinh bột khoai tây sau khi xác định hàm lượng phospho của mẫu thử. Độ hiệu chỉnh (giảm) hàm lượng nhóm cacboxyl được tính theo công thức sau:
![]()
Trong đó: P là hàm lượng phospho, tính theo phần trăm (%).
5.2.4 Xác định hàm lượng mangan
5.2.4.1 Thuốc thử
5.2.4.1.1 Dung dịch chuẩn mangan, 0,5 mg/lít.
5.2.4.1.2 Dung dịch axit clohydric, 0,5 N.
5.2.4.2 Thiết bị, dụng cụ
5.2.4.2.1 Thiết bị đo quang phổ hấp thụ nguyên tử, được trang bị đầu đốt sử dụng hỗn hợp không khí axetylen, với đèn catot rỗng mangan, có thể đo độ hấp thụ tại bước sóng 279,5 nm.
5.2.4.2.2 Bình định mức Kohlrausch (bình định mức miệng rộng), dung tích 200 ml.
5.2.4.2 3 Máy li tâm, có thể tạo gia tốc hưởng tâm 650 g.
5.2.4.2.4 Pipet.
52.4.2.5 Buret.
5.2.4.26 Cân phân tích, có thể cân chính xác đến 1 mg.
5.2.4.3 Chuẩn bị dung dịch mẫu thử
Chuyển 10,000 g mẫu vào bình định mức Kohlrausch dung tích 200 ml (5.2.4.2.2) đã được tráng bằng dung dịch axit clohydric 0,5 N (5.2.4.1.2), thêm 140 ml dung dịch axit clohydric 0,5 N và lắc mạnh trong 15 min, tốt nhất là dùng máy lắc. Thêm dung dịch axit clohydric 0,5 N đến vạch và lắc. Li tâm khoảng 100 ml hỗn hợp trong ống ly tâm có thành dày chịu nhiệt hoặc lọ ở gia tốc 650 g trong 5 min và thu lấy dung dịch lỏng phía trên.
5.2.4.4 Cách tiến hành
Vận hành thiết bị đo quang phổ hấp thụ nguyên tử (5.2.4.2.1) theo hướng dẫn của nhà sản xuất và hút nước cất qua đầu đốt không khí-axetylen trong 5 min để thu được số đọc độ hấp thụ đường nền tại bước sóng 279,5 nm.
Thực hiện tương tự trên phần thể tích dung dịch chuẩn mangan (5.2.4.1.1) và ghi lại số đọc độ hấp thụ. Cuối cùng, hút dung dịch mẫu thử (5.2.4.3) và ghi lại số đọc độ hấp thụ. Hiệu chỉnh các số đọc này với số đọc độ hấp thụ đường nền.
5.2.4.5 Tính kết quả
So sánh độ hấp thụ thu được từ dung dịch mẫu thử với độ hấp thụ của dung dịch chuẩn mangan và nhân giá trị này với 20 để có được hàm lượng mangan trong mẫu ban đầu, tính bằng miligam trên kilogam (mg/kg).
5.2.5 Xác định hàm lượng phospho
5.2.5.1 Thuốc thử
5.2.5.1.1 Dung dịch amoni molybdat, 5 %
Hòa tan 50 g amoni molybdat ngậm bốn phân tử nước [(NH4)6Mo7O24.4H2O] trong 900 ml nước ấm, làm nguội đến nhiệt độ phòng, thêm nước đến 1 000 ml và trộn.
5.2.5.1.2 Dung dịch amoni vanadat, 0,25 %
Hòa tan 2,5 g amoni metavanadat (NH4VO3) trong 600 ml nước sôi, làm nguội tới khoảng 60 °C đến 70 °C và thêm vào 20 ml axit nitric. Làm nguội đến nhiệt độ phòng, thêm nước đến 1 000 ml và trộn.
5.2.5.1.3 Dung dịch kẽm axetat, 10 %
Hòa tan 120 g kẽm axetat ngậm hai phân tử nước [Zn(C2H3O2)2.2H2O] trong 880 ml nước và lọc qua giấy lọc Whatman số 2V hoặc giấy lọc tương đương trước khi sử dụng.
5.2.5.1.4 Dung dịch axit nitric, 29 %
Cho 300 ml axit nitric (tỷ trọng 1,42) vào 600 ml nước và trộn.
5.2.5.1.5 Dung dịch chuẩn phospho, 100 μg/ml
Hòa tan 438,7 mg kali dihydro phosphat (KH2PO4) trong nước đựng trong bình định mức 1 000 ml, thêm nước đến vạch và trộn.
5.2.5.1.6 Metanol.
5.2.5.1.7 Etanol tuyệt đối.
5.2.5.2 Thiết bị, dụng cụ
5.2.5.2.1 Thiết bị đo quang phổ, có thể đo ở bước sóng 460 nm.
5.2.5.2.2 Cuvet, chiều dài đường quang 1 cm.
5.2.5.2.3 Bình định mức, dung tích 100 ml và 200 ml.
5.2.5.2.4 Pipet.
5.2.5.2.5 Cốc có mỏ, dung tích 250 ml.
5.2.5.2.6 Máy lắc.
5.2.5.2.7 Phễu thủy tinh xốp có cỡ lỗ trung bình dung tích 150 ml hoặc phễu Buchner.
5.2.5.2.8 Tủ sấy.
5.2.5.2.9 Tủ sấy chân không, có thể hoạt động ở áp suất không quá 13330 Pa (100 mmHg).
5.2.5.2.10 Rây, loại 20 mesh hoặc mịn hơn.
5.2.5.2.11 Cốc bay hơi Vycor.
5.2.5.2.12 Cân phân tích, có thể cân chính xác đến 1 mg.
5.2.5.3 Cách tiến hành
5.2.5.3.1 Dựng đường chuẩn
Dùng pipet lấy 5 ml, 10 ml và 15 ml dung dịch chuẩn phospho (5.2.5.1.5) cho vào các bình định mức 100 ml (5.2 5.2.3) riêng rẽ, bao gồm cả bốn bình dùng cho phép thử trắng. Thêm vào mỗi bình lần lượt 10 ml dung dịch axit nitric (5.2.5.1.4), 10 ml dung dịch amoni vanadat (5.2.5.1.2) và 10 ml dung dịch amoni molybdat (5.2.5.1.1), trộn kỹ sau mỗi lần thêm. Thêm nước đến 100 ml, trộn và để yên trong 10 min. Đo độ hấp thụ của mỗi dung dịch chuẩn trong cuvet 1 cm ở bước sóng 460 nm bằng thiết bị đo quang phổ thích hợp, sử dụng mẫu trắng để cài đặt giá trị độ hấp thụ trên thiết bị về “0”.
Dựng đường chuẩn của độ hấp thụ theo nồng độ từng dung dịch, tính bằng miligam phospho trên 100 ml.
5.2.5 3.2 Xử lý sơ bộ mẫu thử
a) Đối với các sản phẩm tinh bột không tan trong nước lạnh
Cho 20 g đến 25 g mẫu thử vào cốc có mỏ dung tích 250 ml (5.2.5.2.5), thêm vào 200 ml hỗn hợp metanol-nước (tỷ lệ thể tích 7 : 3), phân tán mẫu và lắc bằng máy trong 15 min. Thu hồi tinh bột bằng cách lọc chân không vào phễu thủy tinh xốp có cỡ lỗ trung bình dung tích 150 ml hoặc phễu Buchner (5.2.5 2.7) và rửa bánh tinh bột ướt bằng 200 ml hỗn hợp metanol-nước. Hòa lại bánh tinh bột ướt thành bột nhão trong dung môi, rửa lần hai theo cách tương tự.
Làm khô bánh tinh bột lọc trong tủ sấy (5.2.5.2.8) ở nhiệt độ nhỏ hơn 50 °C, sau đó nghiền mẫu qua rây loại 20 mesh hoặc mịn hơn (5.2.5.2.10) và trộn đều. Xác định hàm lượng chất khô bằng cách sấy một phần 5 g trong tủ sấy chân không (5.2.5.2.9) ở 120 °C trong 5 h.
b) Đối với tinh bột đã hồ hóa sơ bộ và các loại tinh bột tan trong nước khác
Chuẩn bị dung dịch bột nhão 1 % đến 2 % trong nước, sau đó cho vào ống cellophan và thẩm tách theo nước cất liên tục trong 30 h đến 40 h. Kết tủa tinh bột bằng cách rót dung dịch vào axeton theo tỉ lệ phần thể tích axeton : dung dịch bột nhão bằng 4:1, vừa rót vừa khuấy. Thu hồi tinh bột bằng cách lọc chân không vào phễu thủy tinh xốp có lỗ xốp trung bình hoặc phễu Buchner (5.2.5.27), rửa bánh lọc bằng etanol tuyệt đối (5.2.5.1.7). Làm khô bánh lọc và xác định hàm lượng chất khô theo hướng dẫn đối với tinh bột không tan trong nước.
5.2.5.3.3 Chuẩn bị mẫu thử
Cân chính xác 10 g mẫu đã xử lý sơ bộ (5.2.5.3.2), tính theo chất khô và chuyển vào cốc Vycor (5.2.5.2.11) và thêm 10 ml dung dịch kẽm axetat (5.2.5.1.3), phân tán dung dịch đều trong mẫu. Làm bay hơi đến khô trên tấm gia nhiệt sau đó tăng nhiệt và đốt mẫu trên bếp điện hoặc trên ngọn lửa khí. Nung trong lò nung ở 550 °C cho đến khi tro không còn cacbon (khoảng 1 h đến 2 h), làm nguội. Làm ướt tro bằng 15 ml nước và rửa chậm xuống thành cốc bằng 5 ml dung dịch axit nitric (5.2.5.1.4). Gia nhiệt đến sôi, làm nguội và chuyển định lượng hỗn hợp vào bình định mức dung tích 200 ml (5.2.5.2.3), rửa cốc ba lần mỗi lần 20 ml nước và cho nước rửa vào bình. Thêm nước đến 200 ml và trộn.
Chuyển một lượng đã đong chính xác (V ml) của dung dịch vừa chuẩn bị, chứa không lớn hơn 1,5 mg phospho, vào bình định mức dung tích 100 ml (5.2.5.2.3) và thêm vào 10 ml dung dịch axit nitric (5.2.5 1.4), 10 ml dung dịch amoni vanadat (5.2.5.1.2) và 10 ml dung dịch amoni molybdat (5.2.5.1.1), trộn kỹ sau mỗi lần thêm. Thêm nước đến vạch, trộn và để yên trong 10 min.
5.2.5.3.4 Xác định
Đo độ hấp thụ của dung dịch mẫu thử trong cuvet 1 cm ở bước sóng 460 nm bằng thiết bị đo quang phổ thích hợp, sử dụng mẫu trắng để cài đặt thiết bị về 0. Từ đường chuẩn (5.2.5.3.1), xác định số miligam phospho trong lượng mẫu lấy, ghi lại giá trị này là a.
5.2.5.4 Tính kết quả
Tính hàm lượng phospho có trong mẫu thử ban đầu, X3, biểu thị bằng miligam trên kilogam (mg/kg), theo Công thức (3):
![]() (3)
(3)
Trong đó:
a là số miligam phospho trong lượng mẫu lấy, xác định được từ đường chuẩn (5.2.5.3.1);
W là khối lượng mẫu thử, tính bằng gam (g);
V là thể tích dung dịch thử, tính bằng mililit (ml), xem 5.2.5.3.3.
5.2.6 Xác định hàm lượng nhóm axetyl
5.2.6.1 Thuốc thử
5.2.6.1.1 Dung dịch chỉ thị phenolphthalein.
5.2.6.1.2 Dung dịch natri hydroxit, 0,1 N.
5.2.6.1.3 Dung dịch natri hydroxit, 0,45 N.
5.2.6.1.4 Dung dịch axit clohydric, 0,2 N.
5.2.6.2 Thiết bị, dụng cụ
5.2.6.2.1 Cân phân tích, có thể cân chính xác đến 1 mg.
5.2.6.2.2 Bình nón, dung tích 250 ml.
5.2.6.2.3 Máy lắc.
5.2.6.2.4 Buret.
5.2.6.2.5 Pipet.
5.2.6.3 Cách tiến hành
Cân 5 g mẫu thử, chính xác đến 1 mg, cho vào bình nón dung tích 250 ml (5.2.6.2.2). Hòa vào trong 50 ml nước, thêm vài giọt phenolphthalein (5.2.6.1.1) và chuẩn độ bằng dung dịch natri hydroxit 0,1 N (5.2.6.1.2) đến khi xuất hiện màu hồng nhạt. Thêm 25,0 ml dung dịch natri hydroxit 0,45 N (5.2.6.1.3), đậy nắp bình và lắc mạnh trong 30 min, thích hợp nhất là lắc bằng máy.
CHÚ THÍCH Nhiệt độ không được quá 30 °C, nếu không một vài loại tinh bột có thể bị hồ hóa.
Mở nắp, rửa nắp và thành trong của bình nón bằng một vài mililit nước và chuẩn độ kiềm dư bằng dung dịch axit clohydric 0,2 N (5.2.6.1.4) cho đến khi mất màu hồng.
Thực hiện chuẩn độ mẫu trắng trên 25 ml dung dịch natri hydroxit 0,45 N.
5.2.6.4 Tính kết quả
Hàm lượng các nhóm axetyl, X4, tính bằng phần trăm khối lượng theo Công thức (4):
![]()
Trong đó:
S là thể tích dung dịch axit clohydric 0,2 N đã dùng để chuẩn độ mẫu thử, tính bằng mililit (ml);
B là thể tích dung dịch axit clohydric 0,2 N đã dùng để chuẩn độ mẫu trắng, tính bằng mililit (ml);
N là nồng độ đương lượng của dung dịch axit clohydric;
W là khối lượng mẫu, tính bằng gam (g);
5.2.7 Xác định hàm lượng nhóm vinyl axetat (phương pháp sắc ký khí)
5.2.7.1 Thuốc thử
5.2.7.1.1 Vinyl axetat (tinh khiết).
5.2.7.1.2 Tinh bột chuẩn, chứa hàm lượng vinyl axetat 5 mg/kg
Cân chính xác 150 mg vinyl axetat (5.2.7.1.1) cho vào bình định mức dung tích 100 ml. hòa tan và thêm nước cất đến vạch. Cho 1 ml dung dịch này vào bình định mức dung tích 10 ml và thêm nước cất đến vạch. Cho 1 ml dung dịch đã pha loãng này vào 30 g tinh bột chưa biến tính có cùng nguồn gốc thực vật với mẫu thử, đựng trong bình dung tích 100 ml có lớp lót septum. Đậy kín bình ngay bằng lớp lót septum.
5.2.7.2 Thiết bị, dụng cụ
5.2.7.2.1 Hệ thống sắc ký
Sử dụng thiết bị sắc ký khí được trang bị cột thủy tinh nhồi Porapak Q, loại 80 mesh đến 100 mesh (hoặc tương đương) dài 2 m, đường kính trong 2 mm; detector ion hóa ngọn lửa; thực hiện với các điều kiện sau:
- Tốc độ dòng khí mang (nitơ): 20 ml/min
- Nhiệt độ cổng bơm mẫu: 200 °C
- Nhiệt độ cột: 50 °C
- Nhiệt độ detector: 200 °C
5.2.7.2.2 Bình định mức, dung tích 100 ml.
5.2.7.2.3 Nồi cách thủy, có thể giữ ổn định ở nhiệt độ 70 °C.
5.2.7.2.4 Xyranh.
5.2.7.2.5 Cân phân tích, có thể cân chính xác đến 1 mg.
5.2.7.2 Cách tiến hành
Cân 30 g mẫu thử cho vào bình định mức dung tích 100 ml (5.2.7.2.2) có lớp lót septum. Đậy kín bình. Đặt bình chứa mẫu thử và bình có chứa tinh bột chuẩn vào nồi cách thủy có nhiệt độ không đổi 70 °C (5.2.7.2.3) trong 30 min. Rút lấy 2,0 ml từ thể tích khí trống (headspace) trong bình chứa mẫu chuẩn, dùng xyranh kín khí (5.2.7.2.4), bơm trực tiếp vào cổng bơm của thiết bị sắc ký khí và ghi chiều cao pic của sắc ký đồ. Bơm tương tự 2 ml thể tích khí ở khoảng trống của bình chứa mẫu thử vào thiết bị sắc ký.
Tính hàm lượng vinyl axetat trong mẫu thử từ việc so sánh chiều cao các pic trên sắc ký đồ mẫu thử và chất chuẩn.
5.2.8 Xác định hàm lượng nhóm adipat
5.2.8.1 Thuốc thử
5.2.8.1.1 N,N-Bis-trimetylsilyltrifluoroaxetamid (BSTFA), ví dụ của hãng Macherey-Nagel, D 5160 Dueren, Đức hoặc tương đương.
5.2.8.1.2 Dung dịch axit glutaric, 1,0 mg/ml
Hòa tan 1 g axit glutaric trong nước và pha loãng đến 1 000 ml.
5.2.8.1.3 Dung dịch axit adipic, 1,0 mg/ml
Hòa tan 1 g axit adipic trong 900 ml nước ấm, làm nguội đến nhiệt độ phòng, pha loãng đến 1 000 ml và trộn.
5.2.8.1.4 Dung dịch natri hydroxit, 4 N.
5.2.8.1.5 Dung dịch axit clohydric, 12 N.
5.2.8.1.6 Etyl axetat.
5.2.8.1.7 Nath sulfat, khan.
5.2.8.1.8 Pyridin.
5.2.8.1.9 Tinh bột ngô nếp.
5.2.8.2 Thiết bị, dụng cụ
5.2.8.2.1 Thiết bị sắc ký khí, Hewlett-Packard Model 7620A hoặc tương đương, được trang bị detector ion hóa ngọn lửa và máy phân tích Model 3370A hoặc loại tương đương.
Các thông số cột: làm bằng thép không rỉ có chiều dài 2 m, đường kính trong 1,83 mm, được nhồi bằng OV-17 5 % trên Chromosorb GAW-DMCS 80 mesh đến 100 mesh (hoặc tương đương); ổn định cột ở 350 °C trong 24 h với tốc độ khí mang nitơ 40 ml/min.
Tốc độ dòng khí hoạt động (ml/min); khí mang nitơ là 30, hydro là 40, không khí là 400.
Nhiệt độ: buồng bơm mẫu 280 °C, detector 250 °C, cột 140 °C.
Các thời gian lưu: axit glutaric là 2,83 min; axit adipic là 4,5 min.
5.2.8.2.2 Bình nón, dung tích 250 ml và 500 ml.
5.2.8.2.3 Nồi cách thủy.
5.2.8.2.4 Phễu chiết, dung tích 250 ml.
5.2.8.2.5 Bình đáy tròn, dung tích 1 lít.
5.2.8.2.6 Giấy lọc, Whatman số 1.
5.2.8.2.7 Bộ cô quay, có thể hoạt động ở nhiệt độ không quá 40 °C, áp suất chân không 6665 Pa (50 mgHg).
5.2.8.2.8 Bộ lọc, Milipore 0,45 μm hoặc loại tương đương.
5.2.8.2.9 Cân phân tích, có thể cân chính xác đến 1 mg.
5.2.8.2.10 Pipet.
5.2.8.3 Cách tiến hành
5.2.8.3.1 Hiệu chuẩn
Cân các lượng 1,0 g tinh bột ngô nếp (5.2.8.1.9), chính xác đến 1 mg, cho vào bốn bình nón dung tích 250 ml (5.2.8.2.2). Thêm vào mỗi bình 50 ml nước và 1,0 ml dung dịch axit glutaric 1,0 mg/ml (5.2.8.1.2) . Thêm vào các bình lần lượt 0,25 ml, 0,5 ml; 0,75 ml và 1 ml dung dịch axit adipic 1,0 mg/ml (5.2.8.1.3) . Khi đó, mỗi bình chứa 1 mg axit glutaric và lần lượt là 0,25 mg; 0,5 mg; 0,75 mg và 1 mg axit adipic.
Dùng tay lắc mạnh các bình để phân tán hoàn toàn tinh bột và thêm 50 ml dung dịch natri hydroxit 4 N (5 2.8.1.4). Tiếp tục lắc mạnh trong 5 min, đặt mỗi bình trong nồi cách thủy ở nhiệt độ môi trường và thêm cẩn thận 20 ml dung dịch axit clohydric 12 N (5.2.8.1.5) vào mỗi bình.
Khi bình nguội, chuyển định lượng hỗn hợp trong bình vào phễu chiết dung tích 250 ml (5.2.8.2.4). Chiết với 100 ml etyl axetattinh khiết (5.2.8.1.6). Rút lớp nước ở dưới vào một cốc có mỏ; thu lớp dung môi hữu cơ phía trên vào một bình nón dung tích 500 ml (5.2.8.2.2) chứa 20 g natri sulfat khan (5.2.8.1.7). Chuyển phần nước quay trở lại phễu chiết và lặp lại chiết bằng etyl axetat hai lần nữa. Lắc các bình định kỳ trong 10 min và sau đó lọc qua giấy lọc Whatman số 1 (5.2.8.2.6) vào trong các bình đáy tròn dung tích 1 lít (5.2.8.2.5). Rửa các bình và các cặn không tan trên giấy lọc hai lần bằng 50 ml etyl axetat. Làm bay hơi toàn bộ phần chiết hữu cơ và nước rửa của mỗi bình cho đến khi khô hoàn toàn ở nhiệt độ không quá 40 °C, áp suất chân không 6665 Pa (50 mgHg).
Việc làm bay hơi etyl axetat cần được thực hiện càng nhanh càng tốt vì dễ xảy ra các phản ứng thủy phân khi để yên. Các sản phẩm thủy phân làm giảm độ phân giải của axit adipic khi tách sắc ký.
Thêm lần lượt 2 ml pyridin (5.2.8.1.8) và 1 ml N,N-Bis-trimetylsilyltrifluoroaxetamid (5.2.8.1.1) vào các phần khô. Đậy nắp từng bình cầu đáy tròn và rửa bề mặt bên trong thật kỹ bằng cách xoay bình. Để yên các bình trong 1 h sau đó chuyển khoảng 2 ml từ mỗi bình vào các lọ thủy tinh nhỏ và đậy kín ngay. Bơm 4 μl vào thiết bị sắc ký khí.
Xác định các thời gian lưu đối với mỗi axit và xác định chiều cao pic đối với axit glutaric và đối với mỗi nồng độ axit adipic. Dựng đồ thị biểu diễn quan hệ tuyến tính giữa tỷ lệ chiều cao pic của exit adipic/chiều cao pic của axit glutaric với hàm lượng axit adipic.
Cách khác, sử dụng hệ số đáp ứng, RF, được tính theo Công thức (5):
![]() (5)
(5)
Trong đó:
HS và Hi là chiều cao pic lần lượt của axit adipic chuẩn và axit glutaric;
WS là khối lượng axit adipic chuẩn.
Giá trị RF cần được kiểm tra hàng tuần.
5.2.8.3.2 Xác định hàm lượng adipat tổng số
Cân 1,0 g mẫu thử, chính xác đến 1 mg, cho vào bình nón dung tích 250 ml (5.2.8.2.2), thêm vào 50 ml nước và 1,0 ml dung dịch axit glutaric 1,0 mg/ml (5.2.8.1.2). Tiến hành theo 5.2.8.3.1, từ đoạn “Dùng tay lắc mạnh các bình để phân tán hoàn toàn tinh bột...” đến “...Bơm 4 μl vào thiết bị sắc ký khí”.
Ghi lại chiều cao các pic đối với axit adipic và axit glutaric (chất chuẩn nội).
5.2.8.3.3 Xác định hàm lượng axit adipic tự do
Cân 5,0 g mẫu thử, chính xác đến 1 mg, cho vào bình nón dung tích 250 ml (5.2.8.2.2), thêm vào 100 ml nước và 1 ml dung dịch axit glutaric (5.2.8.1.2). Lắc mạnh trong 1 h, lọc qua bộ lọc Milipore 0,45 μm (5.2.8.2.8), thêm 1 ml dung dịch axit clohydric đặc vào phần dịch lọc và chuyển định lượng vào phễu chiết dung tích 250 ml (5.2.8.2.4). Tiến hành theo 5.2.8.3.1, từ đoạn “Chiết với 100 ml etyl axetat tinh khiết (5.2.8.1.6)..." đến "...Bơm 4 μl vào thiết bị sắc ký khí”.
Ghi lại chiều cao các pic đối với axit adipic và axit glutaric (chất chuẩn nội).
5.2.8.4 Tính kết quả
Hàm lượng adipat tổng số và axit adipic tự do có trong mẫu thử, A, biểu thị theo phần trăm khối lượng, được tính theo Công thức (6):
![]() (6)
(6)
Trong đó:
Hx là chiều cao pic của axit adipic trong dung dịch mẫu thử;
Hix là chiều cao pic của axit glutaric trong dung dịch mẫu thử;
RF là hệ số đáp ứng đối với axit adipic, tính được theo Công thức (5);
S là khối lượng mẫu trong dung dịch mẫu thử, tính bằng gam (g).
Hàm lượng các nhóm adipat có trong mẫu thử, X5, biểu thị theo phần trăm khối lượng, được tính theo Công thức (7):
X5 = At - Af (7)
Trong đó:
At là hàm lượng adipat tổng số, tính theo phần trăm khối lượng;
Af là hàm lượng axit adipic tự do, tính theo phần trăm khối lượng.
5.2.9 Xác định hàm lượmg nhóm hydroxypropyl
5.2.9.1 Thuốc thử và vật liệu thử
5.2.9.1.1 Ninhydrin, dung dịch 3 % tinh thể 1,2,3,-triketohydrinden trong dung dịch natri bisulfit 5 %.
5.2.9.1.2 Axit sulfuric đặc.
5.2.9.1.3 Dung dịch axit sulfuric, 1 N.
5.2.9.1.4 Dung dịch chuẩn propylen glycol, 10 μg/ml, 20 μg/ml, 30 μg/ml, 40 μg/ml và 50 μg/ml.
5.2.9.1.5 Tinh bột chưa biến tính, có cùng nguồn gốc với mẫu thử (ví dụ tinh bột ngô hoặc khoai tây).
5.2.9.2 Thiết bị, dụng cụ
5.2.9.2.1 Cân phân tích, có thể cân chính xác đến 0,1 mg.
5.2.9.2.2 Bình định mức, dung tích 100 ml.
5.2.9.2.3 Ống nghiệm chia vạch, dung tích 25 ml, có nắp thủy tinh.
5.2.9.2.4 Pipet.
5.2 9.2.5 Nồi cách thủy đun sôi.
5.2.9.2.6 Thiết bị đo độ hấp thụ, có thể đo ở bước sóng 590 nm.
5 2.9.2.7 Cuvet, chiều dài đường quang 1 cm.
5:2.9.3 Cách tiến hành
Cân từ 50 mg đến 100 mg mẫu thử và mẫu tinh bột chưa biến tính (5.2.9.1.5), chính xác đến 0,1 mg, cho vào các bình định mức dung tích 100 ml (5.2.9.2.2), thêm vào mỗi bình 25 ml dung dịch axit sulfuric 1 N (5.2.9.1.3). Đặt các bình trong nồi cách thủy đun sôi (5.2.9.2.5) và gia nhiệt cho đến khi tạo thành dung dịch. Làm nguội bình và thêm nước đến vạch. Nếu cần, pha loãng thêm mẫu thử để hàm lượng hydroxypropyl không lớn hơn 4 mg/100 ml và pha loãng mẫu tinh bột trắng (tinh bột chưa biến tính) với cùng tỷ lệ.
Dùng pipet lấy 1 ml dung dịch cho vào các ống nghiệm chia vạch 25 ml (5.2.9.2.3) được ngâm trong nước lạnh, thêm từng giọt 8 ml axit sulfuric đặc (5.2.9.1.4) vào mỗi ống. Lắc đều và đặt trong nồi cách thủy đun sôi (5.2.9.2.5) trong đúng 3 min. Chuyển ngay các ống nghiệm vào chậu đá lạnh cho đến khi dung dịch được làm lạnh. Thêm 0,6 ml dung dịch ninhydrin (5.2.9.1.1), cẩn thận để cho thuốc thử chảy xuống thành của ống nghiệm. Lắc kỹ ngay và đặt các ống nghiệm trong chậu nước 25 °C trong 100 min. Chỉnh thể tích mỗi ống đến 25 ml bằng axit sulfuric đặc (5.2.9.1.2) và trộn bằng cách đảo ngược các ống vài lần (không được lắc). Chuyển ngay dung dịch vào các cuvet 1 cm (5.2.9.2.7) và sau đúng 5 min đo độ hấp thụ ở bước sóng 590 nm, sử dụng mẫu trắng tinh bột làm mẫu chuẩn.
Dựng đường chuẩn, sử dụng 1 ml của các dung dịch chuẩn có nồng độ 10 μg/ml, 20 μg/ml, 30 μg/ml, 40 μg/ml và 50 μg/ml.
5.2.9.4 Tính kết quả
Hàm lượng các nhóm hydroxypropyl có trong mẫu thử, X8, biểu thị theo phần trăm khối lượng, được tính theo Công thức (8):
![]() (8)
(8)
Trong đó:
| C | là hàm lượng propylen glycol trong dung dịch mẫu thử tính được dựa vào đường chuẩn, tính bằng microgam trên mililit (μg/ml); |
| F | là hệ số pha loãng (nếu cần pha loãng hơn); |
| W | là khối lượng mẫu, tính bằng miligam (mg). |
5.2.10 Xác định hàm lượng nhóm propylen clorohydrin
5.2.10.1 Thuốc thử và vật liệu thử
5.2.10.1.1 Dietyl ete, dạng khan.
5.2.10.1.2 Florisil, loại 60/100 mesh, ví dụ: sản phẩm của Floridin Co., 3 Penn Center, PA 15235, Hoa Kì hoặc loại tương đương.
5.2.10.1.3 Propylen clorohydrin, ví dụ: Eastman No. P1325, chứa 25 % 2-cloro-1-propanol của Eastman Kodak Co., Rochester, N.Y. 14650, Hoa Kì hoặc loại tương đương.
5.2.10.1.4 Dung dịch chuẩn
Lấy 25 μl hỗn hợp các đồng phân propylen clorohydrin gồm 75 % 1-cloro-2-propanol và 25 % 2-cloro-1- propanol cho vào xyranh 50 μl (5.2.10.2.4). Cân chính xác xyranh và bơm lượng chứa trong xyranh vào bình định mức dung tích 500 ml (5.2.10.2.5) và đổ đầy nước. Cân lại xyranh và tính khối lượng của các clorohydrin đã lấy. Thêm nước vào bình định mức đến 500 ml và trộn. Dung dịch này chứa khoảng 27.5 mg hỗn hợp các clorohydrin hoặc khoảng 55 μg/ml. Chuẩn bị dung dịch mới trong ngày sử dụng.
5.2.10.1.5 Dung dịch axit sulfuric, 2 N.
5.2.10.1.6 Dung dịch natri hydroxit, 25 %.
5.2.10.1.7 Natri sulfat khan.
5.2.10.1.8 Tinh bột ngô nếp chưa biến tính (chưa tạo dẫn xuất).
5.2.10.2 Thiết bị, dụng cụ
5.2.10.2.1 Thiết bị sắc ký khí, ví dụ: Hewlett-Packard Model 5750 hoặc loại tương đương. Nên sử dụng thiết bị cột kép được trang bị detector ion hóa ngọn lửa, có bộ tích phân và hệ thống ghi dữ liệu.
Cột sắc ký khí: Sử dụng cột thép không rỉ, dài 3 m, đường kính ngoài 3,2 mm, được nhồi 10 % Carbowax 20 M trên 80/100 mesh Gas Chrom 2 hoặc tương đương. Sau khi nhồi, trước khi sử dụng, ổn định cột qua đêm trong điều kiện nhiệt độ 200 °C, sử dụng dòng khí heli với tốc độ 25 ml/min.
5.2.10.2.2 Bộ cô đặc Kuderna-Danish, có bình cầu dung tích 500 ml, có bán sẵn trên thị trường, ví dụ: từ Kontes Glass Co., Vineland, N.J., Hoa Kì hoặc loại tương đương.
5.2.10.2.3 Bình áp lực, dung tích 200 ml, có bộ rửa Neoprene, nắp đậy thủy tinh và gắn bằng kẹp kim loại, có bán sẵn trên thị trường, ví dụ: từ Fisher Scientific Co., Pittsburgh, PA, Hoa Kì hoặc loại tương đương.
5.2.10.2.4 Xyranh, 50 μl.
5.2.10.2.5 Bình định mức, dung tích 5 ml và 500 ml.
5.2.10.2.6 Nồi cách thủy đun sôi.
5.2.10.2.7 Nồi cách thủy, duy trì ở 50 °C đến 55 °C.
5.2.10.2.8 Phễu Buchner.
5.2.10.2.9 Phễu chiết, dung tích 500 ml
5.2.10.2.10 Giấy lọc, Whatman số 1 hoặc loại tương đương.
5.2.10.2.11 Máy khuấy từ.
5.2.10.2.12 Cân phân tích, có thể cân chính xác đến 1 mg.
5.2.10.2.13 Pipet.
5.2.10.3 Cách tiến hành
5.2.10.3.1 Chuẩn bị mẫu thử
Cho 50,0 g mẫu thử đã được trộn vào bình áp lực (5.2.10.2.3) và thêm vào 125 ml dung dịch axit sulfuric 2 N (5.2.10.1.5). Đậy nắp bình và xoay hỗn hợp cho đến khi mẫu được phân tán hoàn toàn. Đặt bình trong nồi cách thủy đun sôi (5.2.10.2.6), gia nhiệt trong 10 min sau đó xoay bình để trộn các thành phần và gia nhiệt trong nồi cách thủy thêm 15 min nữa. Làm nguội trong không khí tới nhiệt độ phòng sau đó trung hòa mẫu thủy phân đến pH 7 bằng dung dịch natri hydroxit 25 % (5.2.10.1.6) và lọc qua giấy lọc Whatman số 1 (5.2.10.2.10) vào phễu Buchner (5.2.10.2.8), có hút. Rửa bình và giấy lọc bằng 25 ml nước và gộp nước rửa với phần dịch lọc. Thêm vào 30 g natri sulfat khan (5.2.10.1.7) và khuấy bằng máy khuấy từ (5.2.10.2.11) trong 5 min đến 10 min, hoặc cho đến khi natri sulfat được hòa tan hoàn toàn. Chuyển dung dịch này vào một phễu chiết dung tích 500 ml (5.2.10.2.9) được trang bị với nút teflon, rửa bình bằng 25 ml nước và gộp nước rửa vào dung dịch mẫu thử. Chiết bằng 5 phần, mỗi phần 50 ml dietyl ete (5.2.10.1.1), mất 5 min cho mỗi lần chiết để tách pha hoàn toàn. Chuyển các phần dịch chiết ete vào bộ cô đặc (5.2.10.2.2), đặt bình thu nhận có chia độ của bộ cô đặc trong nồi cách thủy duy trì ở 50 °C đến 55 °C (5.2.10.2.7) và cô đặc dịch chiết đến khi còn 4 ml.
CHÚ THÍCH Dịch chiết ete của mẫu có thể chứa tạp chất ngoại lai gây trở ngại đến phân tích và/hoặc việc giải thích sắc ký đồ. Các tạp chất này là các sản phẩm được sinh ra trong quá trình thủy phân. Các khó khăn khi phân tích do sự có mặt các tạp chất này có thể tránh được bằng cách áp dụng biện pháp xử lý làm sạch như sau:
Cô đặc dịch chiết ete tới 8 ml, thay vì 4 ml như đã đề cập ở trên. Thêm vào 10 g Florisil, trước đó được gia nhiệt đến 130 °C trong 16 h ngay trước khi dùng, cho vào cột sắc ký có kích thước thích hợp, sau đó gõ nhẹ cột và thêm vào 1 g natri sulfat khan vào dính cột. Làm ẩm cột bằng 25 ml dietyl ete và chuyển định lượng dịch chiết cô đặc vào cột, dùng các phần nhỏ ete. Rửa giải bằng 3 phần mỗi tần 25 ml ete, gộp tất cả phần rửa giải, chuyển vào dụng cụ cô đặc và cô đặc đến 4 ml.
Làm nguội dịch chiết đến nhiệt độ phòng, dùng các phần nhỏ dietyl ete để chuyển định lượng dịch chiết vào bình định mức dung tích 5 ml (5.2.10.2.5), thêm ete đến vạch và trộn.
5.2.10.3.2 Chuẩn bị mẫu kiểm chứng
Chuyển các phần 50,0 g tinh bột ngô nếp chưa biến tính (5.2.10.1.8) vào năm bình áp lực riêng rẽ và thêm vào mỗi bình 125 ml dung dịch axit sulfuric 2 N (5.2.10.1.5). Thêm lần lượt 0; 0,5; 1; 2 và 5 ml dung dịch chuẩn (5.2.10.1.4) vào các bình để có được các nồng độ propylen clorohydrin so với tinh bột lần lượt là 0; 0,5; 1,0; 2,0 và 5,0 mg/kg. Tính nồng độ chính xác trong mỗi bình từ khối lượng các propylen clorohydrin đã sử dụng trong 5.2.10.1.4. Đậy nắp bình và xoay cho đến khi lượng chứa trong mỗi bình được hòa tan hoàn toàn, tiến hành thủy phân, trung hòa, lọc, chiết, cô phần dịch chiết và cuối cùng pha loãng theo 5.2.10.3.1.
5.2.10.3.3 Xác định
Các điều kiện vận hành có thể khác nhau tùy thuộc vào thiết bị cụ thể được sử dụng, nhưng sắc ký đồ thích hợp thu được bằng thiết bị sắc ký, ví dụ: Hewlett-Packard Model 5750 (5.2.10.2.1) sử dụng nhiệt độ cột 110 °C đẳng nhiệt; nhiệt độ cổng bơm 210 °C; nhiệt độ detector 240 °C; tốc độ dòng khí hydro 30 ml/min; tốc độ dòng khí mang là heli 25 ml/min hoặc không khí 350 ml/min.
Bơm các lượng 2 μl của từng dịch chiết cô đặc của mẫu kiểm chứng được chuẩn bị theo 5.2.10.3.2, để đủ thời gian giữa các lần bơm đối với các pic tín hiệu tương ứng với hai đồng phân clorohydrin ghi lại được (và tích phân) và để thổi sạch cột. Ghi và tính tổng các diện tích đáp ứng từ hai đồng phân clorohydrin đối với mỗi mẫu kiểm chứng.
Trong các điều kiện hoạt động như trên, bơm 2,0 μl dịch chiết cô đặc của mẫu thử được chuẩn bị theo 5.2.10.3.1, ghi lại và tính tổng các diện tích đáp ứng từ mẫu thử.
Dựng đường chuẩn tuyến tính của tổng các diện tích đáp ứng của từng mẫu kiểm chứng theo các nồng độ propylen clorohydrin (mg/kg) thu được từ lượng thực tế của đồng phân clorohydrin đã sử dụng.
Sử dụng tổng các diện tích đáp ứng tương ứng với 1-cloro-2-propanol và 2-cloro-1-propanol từ mẫu thử, xác định nồng độ của hỗn hợp các propylen clorohydrin (mg/kg) trong mẫu thử đối chiếu với đồ thị đường chuẩn thu được từ các mẫu kiểm chứng.
CHÚ THÍCH: Sau khi có được kinh nghiệm về cách tiến hành và dựng đường chuẩn từ các mẫu đối chứng tuyến tính và lặp lại, số mẫu kiểm chứng có thể được giảm đến một mẫu có chứa khoảng 5 mg/kg hỗn hợp các đồng phân propylen clonohydrin.
5.2.10.4 Tính kết quả
Hàm lượng propylen clorohydrin có trong mẫu thử, X7, biểu thị theo miligam trên kilogam (mg/kg), được tính theo Công thức (9):
![]() (9)
(9)
Trong đó:
| C | là nồng độ của các propylen clorohydrin (tổng của các đồng phân) trong mẫu kiểm chứng, tính bằng miligam trên kilogam (mg/kg); |
| a | là tổng diện tích đáp ứng được tạo ra bởi các đồng phân propylen clorohydrin trong mẫu thử; |
| A | là tổng diện tích đáp ứng được tạo ra bởi các đồng phân propylen clorohydrin trong mẫu kiểm chứng. |
5.2.11 Xác định hàm lượng nhóm octenylsucinyl trong tinh bột natri octenul sucinat
5.2.11.1 Thuốc thử
5.2.11.1.1 Isopropanol (propan-2-ol).
5.2.11.1.2 Dung dịch axit clohydric trong isopropanol, 2,5 M.
5.2.11.1.3 Dung dịch isopropanol trong nước, 90 %.
5.2.11.1.4 Dung dịch bạc nitrat, 0,1 N.
5.2.11.1.5 Dung dịch natri hydroxit, 0,1 N.
5.2.11.1.6 Dung dịch chỉ thị phenolphthalein.
5.2.11.2 Thiết bị, dụng cụ
5.2.11.2.1 Cân phân tích, có thể cân chính xác đến 1 mg.
5.2.11.2.2 Pipet.
5.2.11.2.3 Buret.
5.2.11.2.4 Cốc có mỏ, dung tích 150 ml và 600 ml.
5.2.11.2.5 Ống đong chia vạch.
5.2.11.2.6 Máy khuấy từ.
5.2.11.2.7 Phễu Buchner.
5.2.11.2.8 Nồi cách thủy đun sôi.
5.2.11.3 Cách tiến hành
Cân chính xác khoảng 5,000 g mẫu vào cốc có mỏ dung tích 150 ml (5.2.11.2.4), làm ướt mẫu bằng một vài mililit Isopropanol (5.2.11.1.1). Dùng pipet thêm 25 ml dung dịch axit clohydric 2,5 M trong isopropanol (5.2.11.1.2), để axit rửa mẫu bám trên thành cốc. Khuấy hỗn hợp trong 30 min bằng máy khuấy từ (5.2.11.2.6). Thêm vào 100 ml isopropanol 90 % (5.2.11.1.3) từ ống đong chia vạch (5.2.11.2.5). Khuấy trong 10 min. Lọc mẫu qua phễu Buchner (5.2.11.2.7) và rửa bánh lọc bằng isopropanol 90 % cho đến khi dịch lọc thu được không còn ion clorua (dùng dung dịch bạc nitrat 0,1 N để kiểm tra các ion clorua). Chuyển định lượng dịch lọc vào cốc có mỏ dung tích 600 ml (5.2.11.2.4) và dùng khoảng 300 ml nước cất. Đặt cốc có mỏ trên các nồi cách thủy đun sôi (5.2.11.2.8) trong 30 min trong khi vẫn khuấy. Chuẩn độ dung dịch khi vẫn nóng, bằng dung dịch natri hydroxit 0,1 N (5.2.11.1.5), dùng phenolphthalein (5.2.11.1.6) làm chất chỉ thị.
5.2.11.4 Tính kết quả
Hàm lượng nhóm octenyl sucinyl có trong mẫu thử, X8, biểu thị theo phần trăm khối lượng, được tính theo Công thức (10):
![]() (10)
(10)
Trong đó:
V là thể tích dung dịch natri hydroxit đã dùng để chuẩn độ, tính bằng mililit (ml):
N là nồng độ đương lượng của dung dịch natri hydroxit;
W là khối lượng của mẫu, tính bằng gam (g).
5.2.12 Xác định dư lượng axit octenyl sucinic trong tinh bột natri octenyl sucinat
5.2.12.1 Nguyên tắc
Phép xác định bằng HPLC trên dịch chiết 2-bromaxetophenon-derivatis trong metanol của mẫu.
5.2.12.2 Thuốc thử
5.2.12.2.1 Metanol.
5.2.12.2.2 Dung dịch kali hydroxit trong metanol, 0,16 N.
5.2.12.2.3 Axetonitril.
5.2.12.2.4 Thuốc thử tạo dẫn xuất
Cân 2,8 g 2-p-dibromoaxetophenon và 0,28 g 1,4,7,10,13,16-hexaoxacyclooctadecan (18-Crown-6), hòa tan trong 50 ml axetonitril.
5.2.12.2.5 Dung dịch chuẩn hiệu chuẩn
5.2.12.2.5.1 Dung dịch A
Dung dịch octenyl sucinat axit anhydrit trong metanol, 105,14 mg/ml.
5.2.12.2.5.2 Dung dịch B
Dùng xyranh (5.2.12.3.7) lấy 0,25 ml dung dịch A (5.2.12.2.5) cho vào bình định mức dung tích 25 ml (5.2.12.3.8). Thêm metanol (5.2.12.2.1) đến vạch, thu được dung dịch B.
5.2.12.2.5.3 Dung dịch chuẩn làm việc (dung dịch C1, C2, C3)
Chuyển 0,5 ml; 1 ml và 2 ml dung dịch B (5.2.12.2.5.2) vào 3 bình cầu đáy tròn dung tích 50 ml (5.2.12.3.9). Thêm vào mỗi bình 1 ml dung dịch kali hydroxit 0,16 N trong metanol (5.2.12.2.2). Làm khô dung dịch bằng thiết bị bay hơi nhanh ở 30 °C (5.2.12.3.6). Hòa tan cặn thu được trong 2 ml metanol. Cho 0,5 ml mỗi dung dịch này vào các lọ phản ứng (5.2.12.3.3), thêm 0,5 ml thuốc thử tạo dẫn xuất (5.2.12.2.4). Thêm 2 ml axetonitril (5.2.12.2.3) vào mỗi lọ. Đậy kín lọ phản ứng và gia nhiệt ở 80 °C trong 30 min. Làm nguội dung dịch phản ứng đến nhiệt độ phòng. Chuẩn bị dung dịch ngay trước khi phân tích bằng HPLC.
5.2.12.3 Thiết bị, dụng cụ
5.2.12.3.1 Cân phân tích, có thể cân chính xác đến 0,1 mg.
5.2.12.3.2 Thiết bị HPLC, được trang bị cột Micro-Bondapark C18 hoặc loại tương đương, detector UV có thể hoạt động tại bước sóng 254 nm.
5.2.12.3.3 Lọ phản ứng.
5.2.12.3.4 Bình nón, dung tích 25 ml.
5.2.12.3.5 Máy lắc.
5.2.12.3.6 Thiết bị bay hơi, có thể làm bay hơi nhanh ở 30 °C.
5.2.12.3.7 Xyranh.
5.2.12.3.8 Bình định mức, dung tích 25 ml.
5.2.12.3.9 Bình cầu đáy tròn, dung tích 50 ml.
5.2.12.4 Cách tiến hành
5.2.12.4.1 Chiết và chuẩn bị dung dịch mẫu
Cân chính xác 500 mg mẫu thử, chính xác đến 0,1 mg, cho vào bình nón dung tích 25 ml (5.2.12.3.4), bổ sung 15 ml metanol (5.2.12.2.1), đậy nắp bình và lắc trên máy lắc (5.2.12.3.5) qua đêm. Lọc hỗn hợp chiết bằng giấy lọc. Rửa cặn 3 lần mỗi lần dùng 7 ml metanol. Gộp các phần dịch lọc (khoảng 80 % dư lượng axit octenyl sucinic được chiết bằng quy trình này). Thêm vào các phần dịch chiết thu được 1 ml dung dịch kali hydroxit 0,16 N trong metanol (5.2.12.2.2). Làm khô các phần dịch chiết thu được bằng thiết bị cô nhanh ở 30 °C (5.2.12.3.6). hòa tan cặn thu được trong 2 ml metanol. Lấy 0,5 ml dung dịch cặn cho vào lọ phản ứng (5.2.12.3.3) thêm 0,5 ml thuốc thử tạo dẫn xuất (5.2.12.2.4). Thêm 2 ml axetonitril (5.2.12.2.3) vào lọ phản ứng. Đậy kín lọ phản ứng và gia nhiệt ở 80 °C trong 30 min. Làm nguội dung dịch phản ứng đến nhiệt độ phòng và phân tích HPLC trong vòng 24 h.
5.2.12.4.2 Điều kiện sắc ký
| - Cột | Micro-Bondapark C18 hoặc loại tương đương |
| - Pha động: | metanol và nước với gradient rửa giải là 70 % đến 80 % metanol trong nước trong 5 min |
| - Tốc độ dòng: | 1,5ml/min |
| - Detector: | UV tại bước sóng 254 nm |
| - Thể tích bơm: | 5 pl |
5.2.12.4.3 Dựng đường chuẩn
Phân tích HPLC đối với các dung dịch chuẩn làm việc C1, C2, C3 (5.2.12.2.5.3). Lượng axit octenyl sucinic trong mỗi lần bơm 5 μl các dung dịch này như sau:
- đối với dung dịch C1: 0,2375 μg;
- đối với dung dịch C2: 0,4750 μg;
- đối với dung dịch C3: 0,9500 μg.
Dựng đường chuẩn của chiều cao pic thu được từ trên sắc ký đồ so với lượng chất chuẩn trong mỗi lần bơm.
5.2.12.4.4 Xác định
Bơm 5 μl dung dịch mẫu thử đã chuẩn bị (5.2.12.4.1) vào máy HPLC và đọc lượng axit octenyl sucinic trong lần bơm từ đường chuẩn (5.2.12.4.3).
5.2.12.5 Tính kết quả
Dư lượng axit octenyl sucinic có trong mẫu thử, X9, biểu thị theo phần trăm khối lượng, được tính theo Công thức (11):
![]() (11)
(11)
Trong đó:
V là lượng axit octenyl sucinic đựợc bơm vào (xem 5.2.12.4.4);
W là khối lượng mẫu thử, tính bằng gam (g).
CHÚ THÍCH Công thức này được hiệu chỉnh về độ thu hồi 100 % bằng cách chia cho 0,80; do vậy 240/0,80 = 300.
5.2.13 Xác định hàm lượng chì, theo TCVN 8900-6:2012, TCVN 8900-7:2012 hoặc TCVN 8900-8:2012.
1) INS: Mã số quốc gia về phụ gia thực phẩm
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 11471:2016 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 11471:2016 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 11471:2016 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 11471:2016 DOC (Bản Word)