- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 11131:2015 ISO/TS 20836:2005 Vi sinh vật trong thực phẩm, thức ăn chăn nuôi-Phản ứng chuỗi polymerase (PCR) để phát hiện vi sinh vật gây bệnh từ thực phẩm-Phép thử hiệu năng đối với máy chu trình nhiệt
| Số hiệu: | TCVN 11131:2015 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm , Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
31/12/2015 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 11131:2015
Tiêu chuẩn Quốc gia TCVN 11131:2015: Phép thử hiệu năng đối với máy chu trình nhiệt
Tiêu chuẩn Quốc gia TCVN 11131:2015, được ban hành ngày 31/12/2015 bởi Tổng cục Tiêu chuẩn Đo lường Chất lượng, có hiệu lực từ ngày 01/01/2016. Tiêu chuẩn này tương đương với ISO/TS 20836:2005, quy định về phương pháp phản ứng chuỗi polymerase (PCR) để phát hiện vi sinh vật gây bệnh trong thực phẩm và hướng dẫn về phép thử hiệu năng đối với máy chu trình nhiệt.
TCVN 11131:2015 đưa ra các yêu cầu liên quan đến lắp đặt, vận hành và bảo trì máy chu trình nhiệt, thiết bị thiết yếu dùng trong các xét nghiệm PCR. Các thiết bị này yêu cầu bảo trì định kỳ để đảm bảo hoạt động hiệu quả. Tiêu chuẩn cũng đề cập đến các bộ phận làm lạnh/nóng và thời hạn sử dụng của các bộ phận này, nhấn mạnh tầm quan trọng của việc kiểm tra thường xuyên để duy trì chất lượng xét nghiệm.
Một phần quan trọng của tiêu chuẩn này là việc kiểm tra hiệu năng của máy chu trình nhiệt thông qua hai phương pháp: kiểm tra hiệu năng sinh hóa và kiểm tra hiệu năng vật lý. Các quy trình này bao gồm việc đảm bảo rằng máy hoạt động đúng nhiệt độ cần thiết khi thực hiện xét nghiệm PCR, nhằm đảm bảo độ chính xác trong việc phát hiện vi sinh vật gây bệnh.
Tiêu chuẩn cũng liệt kê rõ các bước cần thực hiện để tiến hành kiểm tra hiệu năng của máy, trong đó yêu cầu ghi chép lại tất cả các thông tin liên quan như số nhận biết máy chu trình nhiệt, kết quả thử nghiệm, và những lưu ý trong quá trình thử nghiệm. Việc ghi lưu hồ sơ này rất quan trọng để theo dõi hiệu suất hoạt động của thiết bị qua thời gian.
Đặc biệt, tiêu chuẩn cảnh báo về các rủi ro an toàn có thể xảy ra trong quá trình sử dụng các vật liệu và thiết bị liên quan. Người dùng cần thiết lập các thao tác an toàn thích hợp để bảo vệ sức khỏe và an toàn trong quá trình thực hiện các xét nghiệm và bảo trì thiết bị.
TCVN 11131:2015 cũng đề cập đến quy trình chuẩn bị mẫu lấy từ các sản phẩm thực phẩm hoặc thức ăn chăn nuôi để tiến hành phát hiện vi sinh vật, nhằm điều chỉnh các yêu cầu yêu cầu cho các phương pháp định tính.
Tóm lại, Tiêu chuẩn Quốc gia TCVN 11131:2015 không chỉ cung cấp hướng dẫn kỹ thuật cho các cơ sở để đảm bảo hiệu suất của máy chu trình nhiệt mà còn nhấn mạnh tầm quan trọng của việc duy trì an toàn trong quá trình xét nghiệm và bảo dưỡng thiết bị.
Tải tiêu chuẩn Việt Nam TCVN 11131:2015
TIÊU CHUẨN QUỐC GIA
TCVN 11131:2015
ISO/TS 20836:2005
VI SINH VẬT TRONG THỰC PHẨM VÀ THỨC ĂN CHĂN NUÔI - PHẢN ỨNG CHUỖI POLYMERASE (PCR) ĐỂ PHÁT HIỆN VI SINH VẬT GÂY BỆNH TỪ THỰC PHẨM - PHÉP THỬ HIỆU NĂNG ĐỐI VỚI MÁY CHU TRÌNH NHIỆT
Microbiology of food and animal feeding stuffs - Polymerase chain reaction (PCR) for the detection of food-borne pathogens - Performance testing for thermal cyclers
Lời nói đầu
TCVN 11131:2015 hoàn toàn tương đương với ISO/TS 20836:2005;
TCVN 11131:2015 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F13 Phương pháp phân tích và lấy mẫu biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Tiêu chuẩn này nằm trong bộ tiêu chuẩn với tên chung là Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phản ứng chuỗi polymerase (PCR) để phát hiện vi sinh vật gây bệnh từ thực phẩm:
TCVN 7682 (ISO 20838), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phản ứng chuỗi polymerase (PCR) để phát hiện sinh vật gây bệnh từ thực phẩm - Yêu cầu về khuếch đại và phát hiện đối với các phương pháp định tính
TCVN 10781 (ISO/TS 13136) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện vi sinh vật gây bệnh trong thực phẩm bằng phản ứng chuỗi polymerase (PCR) thời gian thực - Phát hiện Escherichia coli sinh độc tố Shiga (STEC) và xác định các nhóm huyết thanh O157, O111, O26, O103 và O145
TCVN 11131 (ISO/TS 20836), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phản ứng chuỗi polymerase (PCR) để phát hiện vi sinh vật gây bệnh từ thực phẩm - Phép thử hiệu năng đối với máy chu trình nhiệt
TCVN 11132 (ISO 22118) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phản ứng chuỗi polymerase (PCR) để phát hiện và định lượng vi sinh vật gây bệnh từ thực phẩm - Đặc tính hiệu năng
TCVN 11133 (ISO 22119), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phản ứng chuỗi polymerase real-time (PCR real-time) để phát hiện và định lượng vi sinh vật gây bệnh từ thực phẩm - Định nghĩa và yêu cầu chung
TCVN 11134 (ISO 22174), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phản ứng chuỗi polymerase (PCR) để phát hiện vi sinh vật gây bệnh từ thực phẩm - Định nghĩa và yêu cầu chung
ISO 20837, Microbiology of food and animal feeding stuffs - Polymerase chain reaction (PCR) for the detection of food-borne pathogens - Requirements for sample preparation for qualitative detection [Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phản ứng chuỗi polymerase (PCR) để phát hiện vi sinh vật gây bệnh từ thực phẩm - Yêu cầu về chuẩn bị mẫu để phát hiện định tính].
VI SINH VẬT TRONG THỰC PHẨM VÀ THỨC ĂN CHĂN NUÔI - PHẢN ỨNG CHUỖI POLYMERASE (PCR) ĐỂ PHÁT HIỆN VI SINH VẬT GÂY BỆNH TỪ THỰC PHẨM - PHÉP THỬ HIỆU NĂNG ĐỐI VỚI MÁY CHU TRÌNH NHIỆT
Microbiology of food and animal feeding stuffs - Polymerase chain reaction (PCR) for the detection of food-borne pathogens - Performance testing for thermal cyclers
CẢNH BÁO - Khi áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác gây nguy hiểm. Tiêu chuẩn này không đưa ra được hết tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Người sử dụng tiêu chuẩn này phải tự thiết lập các thao tác an toàn thích hợp và xác định khả năng áp dụng hoặc các giới hạn quy định trước khi sử dụng tiêu chuẩn.
1. Phạm vi áp dụng
Tiêu chuẩn này đưa ra các yêu cầu cơ bản đối với việc lắp đặt, vận hành và bảo dưỡng máy chu trình nhiệt. Máy chu trình nhiệt là thiết bị có độ bền cao, nhưng vẫn cần được bảo dưỡng định kì. Những bộ phận làm lạnh/nóng, sử dụng công nghệ Peltier hay công nghệ khác, đều có thời hạn sử dụng nhất định. Việc vận hành tốt các yếu tố gia nhiệt/làm nguội phụ thuộc đồng thời vào chất lượng của thiết bị gia nhiệt/làm nguội và cách sử dụng và bảo trì hợp lý.
Ngoài ra, để đưa ra yêu cầu cho một chương trình bảo dưỡng rõ ràng, xem Phụ lục A và B về các quy trình xác định hiệu năng của máy chu trình nhiệt bằng các phương pháp sinh hóa và vật lý.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi (nếu có).
TCVN 11134 (ISO 22174), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phản ứng chuỗi polymerase (PCR) để phát hiện vi sinh vật gây bệnh từ thực phẩm - Định nghĩa và yêu cầu chung.
TCVN ISO/IEC 17025, Yêu cầu chung về năng lực của phòng thử nghiệm và hiệu chuẩn.
3. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau đây:
3.1. Nắp nóng (Heated lid)
Tính năng tùy chọn của máy chu trình nhiệt, được sử dụng để ngăn chặn mẫu bay hơi.
3.2. Độ ổn đồng đều nhiệt (temperature uniformity)
Sự đồng đều nhiệt độ trong bộ phận kiểm soát nhiệt (ví dụ: hộp làm nóng).
3.3. Kiểm tra hiệu năng sinh hóa (biochemical performance test)
Quy trình kiểm tra xác định hiệu năng của máy chu trình nhiệt bằng các biện pháp sinh hóa (ví dụ: PCR nhạy nhiệt).
3.4. Kiểm tra hiệu năng vật lý (physical performance test)
Quy trình kiểm tra xác định hiệu năng của máy chu trình nhiệt bằng các các biện pháp vật lý.
3.5. Hệ thống PCR không ổn định (non-robust PCR system)
Hệ thống PCR, trong đó có một vài sai lệch nhỏ về hóa chất chạy PCR hoặc nhiệt độ PCR so với quy định dẫn đến việc khuếch đại kém hiệu quả.
3.6. Vị trí tới hạn (critical positions)
Vị trí hay khu vực mà sai lệch nhiệt độ mẫu thử so với nhiệt độ hiển thị dễ xảy ra hơn so với những khu vực khác trong giá đỡ mẫu của máy chu trình nhiệt.
4. Lắp đặt máy chu trình nhiệt
Tuân thủ hướng dẫn của nhà sản xuất.
Những nội dung dưới đây cần được xem xét:
a) Máy chu trình nhiệt phải được lắp đặt và sử dụng ở nhiệt độ và độ ẩm thích hợp;
b) Máy chu trình nhiệt phải được đặt ở nơi:
- Có thể nhìn để kiểm tra được;
- Cho phép trao đổi nhiệt ổn định với môi trường xung quanh và không khí lưu thông tự do;
- Có môi trường ổn định.
5. Bảo dưỡng máy chu trình nhiệt
Phòng thử nghiệm cần thiết lập và thực hiện chương trình bảo dưỡng cụ thể cho từng máy chu trình nhiệt, dựa trên nhật kí sử dụng hoặc số lần chạy.
6. Kiểm tra hiệu năng
6.1. Yêu cầu chung
Kiểm tra hiệu năng của từng máy chu trình nhiệt phải được thực hiện và ghi chép lại sử dụng gián tiếp phương pháp kiểm tra hiệu năng sinh hóa hay trực tiếp phương pháp kiểm tra hiệu năng vật lý.
6.2. Kiểm tra hiệu năng bằng sinh hóa
Cần thực hiện quy trình sinh hóa để kiểm tra hiệu năng máy chu trình nhiệt, có thể sử dụng phương pháp PCR không ổn định nhạy nhiệt.
Ví dụ về phương pháp thích hợp được nêu trong Phụ lục A. Có thể sử dụng phương pháp PCR bất kỳ khác nếu đáp ứng được tất cả các yêu cầu.
Tần suất kiểm tra hiệu năng phải dựa trên số giờ sử dụng hoặc số lần chạy của từng máy chu trình nhiệt.
6.3. Kiểm tra hiệu năng vật lý
Cần thực hiện quy trình vật lý để kiểm tra hiệu năng để đo nhiệt độ thực của mẫu tại mỗi giếng trong chu trình nhiệt độ và để so sánh với nhiệt độ hiển thị.
Ví dụ về phương pháp thích hợp được nêu trong Phụ lục B. Cần kiểm tra hiệu năng vật lý nếu việc kiểm tra hiệu năng sinh hóa trước đó chưa thực hiện hoặc việc kiểm tra hiệu năng sinh hóa cho thấy khuếch đại kém hiệu quả.
Tần suất kiểm tra hiệu năng phải được dựa trên số giờ sử dụng hoặc số lần chạy của từng máy chu trình nhiệt.
7. Báo cáo thử nghiệm
Báo cáo thử nghiệm ít nhất phải bao gồm các thông tin sau đây:
- số nhận biết máy chu trình nhiệt;
- viện dẫn tiêu chuẩn này và Phụ lục được sử dụng cho thử nghiệm;
- ngày thử nghiệm;
- người chịu trách nhiệm phân tích;
- kết quả thử nghiệm;
- tất cả những điểm cần lưu ý trong quá trình thử nghiệm;
- mọi sai lệch, thêm vào hay lược bớt so với quy định của phép thử;
- tất cả những thông tin có liên quan đến thử nghiệm cụ thể.
Phòng thử nghiệm phải lưu giữ hồ sơ quy trình tại chỗ để có thể nhận diện và ghi lại những bất thường liên quan đến hiệu năng máy chu trình nhiệt (xem thêm TCVN ISO/IEC 17205).
PHỤ LỤC A
(Tham khảo)
KIỂM TRA HIỆU NĂNG SINH HÓA - PHƯƠNG PHÁP PCR KIỂM TRA ĐỘ CHÍNH XÁC CỦA NHIỆT ĐỘ
A.1. Yêu cầu chung
Phương pháp này kiểm tra xác nhận độ chính xác nhiệt độ gắn mồi của máy chu trình nhiệt. Phép kiểm tra này nhạy với sự tăng nhiệt độ gắn mồi thật tương quan với nhiệt độ hiển thị trong một chu trình nhiệt độ xác định.
A.2. Nguyên tắc
Độ chính xác của nhiệt độ đặt sẵn/hiển thị được kiểm tra bằng PCR được thiết kế riêng. Các mẫu PCR rất nhạy với nhiệt độ gắn mồi vượt quá mức trong chu trình nhiệt độ.
Một trình tự ADN 362 cặp base, trong đó có vị trí đích cho PCR, được tạo ra bằng việc khuếch đại vùng biên của vị trí trong véc tơ pGEM với cặp mồi giải mã M13 chuẩn. Đoạn gen nhân bản được nêu trong Hình A.1.

Hình A.1. - Mẫu và trình tự mồi được dùng trong kiểm tra hiệu năng của máy chu trình nhiệt
Trình tự của sản phẩm PCR được tạo ra bằng việc dùng các mồi M13 (gạch chân 2 lần) trong quá trình khuếch đại trình tự đích từ plasmid pGEM (pSC171)) sửa đổi. Các mồi được dùng trong hệ thống thử nghiệm để đánh giá máy chu trình nhiệt được tô đậm và trình bày riêng (VAL1 và VAL2, xem A.3.5.3 và A.3.5.4). Trình tự sản phẩm PCR được tạo ra trong quá trình kiểm tra hiệu năng chu trình nhiệt được gạch chân. Những chỗ không phù hợp được in đậm.
Các mồi VAL1 và VAL2 cho ra sản phẩm PCR có độ dài 116 cặp base và được nhận biết bằng điện di gel agarose. Do sự không phù hợp tại đầu 3’ của mồi VAL1, mà PCR nhạy với nhiệt độ gắn mồi vượt quá bình thường so với nhiệt độ xác định. Khi vượt quá dải từ 63 oC đến 66 oC có thể dẫn tới việc khuếch đại kém hiệu quả và không thể phát hiện sản phẩm PCR 116 cặp base.
Các mẫu phải được đặt tại các vị trí đại diện cho vùng nhiệt độ có thể kiểm soát được, bao gồm các vị trí tới hạn. Trong trường hợp không biết vị trí tới hạn, các mẫu phải được để ở vị trí trung tâm và các góc [1].
Ví dụ về máy chu trình nhiệt có 96 giếng được nêu trong Hình A.2.
A.3. Chất phản ứng
Chỉ dùng các chất phản ứng tinh khiết phân tích để dùng cho với các phương pháp xác định sinh học phân tử.
A.3.1. Nước
Đối với các phản ứng khuếch đại, luôn sử dụng nước không có ADNse và RNase. Những loại nước siêu tinh khiết thích hợp có bán sẵn trên thị trường.
A.3.2. Dung dịch đệm PCR (không có MgCI2), 10x (150 mmol/l TRIS, pH 8; 500 mmol/l KCI).
A.3.3. Dung dịch MgCl2, c(MgCI2) = 25 mmol/l.
A.3.4. Dung dịch dNTP, c(dNTP) = 10 mmol/l (cho mỗi nucletotide).
A.3.5. Oligonucleotide
Oligonucleotide cần phải tinh sạch sau khi tổng hợp.
A.3.5.1. Mồi xuôi để thiết lập trình tự đích 362 cặp base
Véc tơ nhân bản thực khuẩn M13mp8 (GenBank No. M77826.1).
Mồi M13(-26): 5’-CAg gAA ACA gCT ATg AC-3’.
A.3.5.2. Mồi ngược để thiết lập trình tự đích 362 cặp base
Véc tơ nhân bản thực khuẩn M13mp8 (GenBank No. M77826.1).
Mồi M13(-20): 5’-gTA AAA CgA Cgg CCA gT-3’
A.3.5.3. Mồi xuôi để kiểm tra nhiệt độ gắn mồi của máy chu trình nhiệt
Cấu trúc tổng hợp:
Mồi VAL1: 5’-gAT ACA gAA ACA TCg gTT ggC-3’
A.3.5.4. Mồi ngược để kiểm tra nhiệt độ gắn mồi của máy chu trình nhiệt
Cấu trúc tổng hợp:
Mồi VAL2: 5’-gTg TAA CTT gAT gCC ATC Agg-3’
A.3.6. Plasmid pSC171)
A.3.7. ADN-polymerase ổn định nhiệt (dành cho PCR khởi động nóng), 5U/ml.
A.3.8. Agarose, phù hợp cho việc điện di và chia tách ADN theo kích cỡ mong muốn.
A.3.9. Axit boric (H3BO3), chỉ dùng cho dung dịch đệm TBE.
A.3.10. Bromophenol xanh (C19H9Br4O5SNa) và/hoặc xylen cyanole FF (C25H27N2O6S2Na).
A.3.11. Axit axetic băng (CH3COOH), chỉ dùng cho dung dịch đệm TAE.
A.3.12. Muối axit etylen diamin tetraaxetic dinatri (Na2-EDTA) (C10H14N2O8Na2).
A.3.13. Etidi bromua (EtBr) (C21H20N3Br).
A.3.14. Glyxerol (C3H8O3).
A.3.15. Natri axetat (CH3COONa), chỉ dùng cho dung dịch đệm TAE.
A.3.16. Axit clohydric (HCI).
A.3.17. Natri hydroxit (NaOH).
A.3.18. Tris (hydroxymethyl) aminometan (TRIS) [NH2C(CH2OH)3].
A.3.19. Dung dịch đệm TAE, 1x, c(TRIS) = 0,050 mol/l, c(CH3COONa) = 0,020 mol/l, c(Na2-EDTA) = 0,001 mol/l.
Chỉnh pH đến 8,0 bằng axit axetic băng hoặc natri hydroxit.
Dung dịch đệm TAE có thể được chuẩn bị dưới dạng dung dịch gốc đậm đặc 10x. Nếu dung dịch xuất hiện dạng kết tủa, thì không tiếp tục sử dụng. Dung dịch đậm đặc phải được pha loãng với nước (A.3.1).
A.3.20. Dung dịch đệm TRIS/borat (TBE), 0,5x, c(TRIS) = 0,055 mol/l, c(H3BO3) = 0,055 mol/l, c(Na2-EDTA) = 0,001 mol/l.
Chỉnh pH đến 8,0 bằng axit clohydric hoặc natri hydroxit.
Dung dịch đệm TBE có thể được chuẩn bị dưới dạng dung dịch gốc đậm đặc 10x. Nếu dung dịch xuất hiện dạng kết tủa thì không tiếp tục sử dụng. Dung dịch đậm đặc phải được pha loãng với nước (A.3.1).
A.3.21. Dung dịch đệm để chạy mẫu, 5x, f(glycerol) = 50 %, r(xanh bromophenol) = 2,5 g/l và/hoặc r(xylen cyanole FF) = 2,5 g/l, hòa tan vào dung dịch đệm điện di (A.3.19 hoặc A.3.20).
A.3.22. Dung dịch etidi bromua, r(EtBr) = 0,5 mg/l.
Dung dịch etidi bromua phải được bảo quản ở nồng độ đậm đặc (ví dụ 10 mg/ml) ở 5 oC ở nơi tối.
LƯU Ý: EtBr là chất có khả năng gây biến đổi gen, ung thư và gây quái thai. Sử dụng găng tay và mặt nạ khi sử dụng EtBr. Nếu được, phải làm việc trong tủ hốt. EtBr phải được xử lí đúng cách dưới dạng chất thải hóa học.
Dung dịch gốc phải được chuẩn bị bằng cách cho một lượng nước vừa đủ vào lọ chứa EtBr bột, hoặc EtBr viên có khối lượng phù hợp.
Bảo quản dung dịch EtBr tránh ánh sáng trong quá trình hòa tan. Hòa tan chậm ở nhiệt độ phòng bằng cách trộn đều từ từ. Không được đun nóng.
A.3.23. Chất chuẩn khối lượng phân tử ADN, ví dụ chế phẩm thương mại có các đoạn ADN có độ dài từ 100 cặp base đến 200 cặp base.
A.4. Thiết bị, dụng cụ
A.4.1. Máy chu trình nhiệt
A.4.2. Lò vi sóng hoặc nồi cách thủy đun sôi.
A.4.3. Thiết bị điện di gel thạch agarose, với các phụ kiện và nguồn điện.
A.4.4. Đèn cực tím hoặc đèn điện, làm việc ở bước sóng 312 nm.
A.4.5. Bộ phận ghi, ví dụ như hệ thống chụp ảnh với film ASA 3000 hay bộ lọc UV phù hợp với huỳnh quang của EtBr, hoặc hệ thống quay phim với máy quay CCD, bộ lọc UV và phần mềm phân tích định lượng (tùy chọn).
A.5. Cách tiến hành
A.5.1. Chuẩn bị trình tự đích 362 cặp base
A.5.1.1. Cài đặt PCR
Nồng độ cuối cùng thích hợp của các chất phản ứng được nêu trong Bảng A.1. Phương pháp này sử dụng thể tích PCR cuối cùng là 50 ml cho một phản ứng.
Bảng A.1 - Thành phần của Mastermix (PCR-mix)
| Chất phản ứng | Nồng độ cuối cùng | Thể tích từng mẫu (ml) |
| Plasmit pSC17 | 10 000 bản sao ~6 pg | 2,0 |
| Nước |
| 31,8 |
| Dung dịch đệm PCR 10x (không có MgCI2) | 1x | 5,0 |
| Dung dịch MgCI2a, 25 mmol/l | 2,5 mmol/l | 5,0 |
| Dung dịch dNTP, 10 mmol/l | 0,2 mmol/l | 1,0 |
| Mồi M13 (-26), 5 mmol/l | 0,25 mmol/l | 2,5 |
| Mồi M13 (-20), 5 mmol/l | 0,25 mmol/l | 2,5 |
| Taq-ADN-polymerase, 5 U/ml | 1 đơn vị cho một phản ứng | 0,2 |
| a Nếu dung dịch đệm PCR chứa sẵn MgCl2, thì nồng độ cuối cùng của MgCl2 trong hỗn hợp phản ứng phải được điều chỉnh cho đúng 2,5 mmol/l. | ||
A.5.1.2. Chương trình thời gian nhiệt độ
Chương trình thời gian nhiệt độ được nêu trong Bảng A.2.
Chương trình này có thể được thay đổi theo kiểu loại máy chu trình và/hoặc enzym sử dụng.
Bảng A.2 - Chương trình thời gian nhiệt độ
| Biến tính ban đầu | 2 min/95 oC |
| Khuếch đại | 10 s/95 oC |
|
| 30 s/45 oC |
|
| 20 s/72 oC |
| Số chu trình | 40 |
| Kéo dài cuối cùng | 2 min/72 oC |
A.5.1.3. Tinh sạch sản phẩm PCR và xác định kết quả
Một lượng 5 ml của sản phẩm PCR được tách bằng điện di trên gel agarose và được nhuộm với etidi bromua để hiển thị sản phẩm PCR. Số thể tích sản phẩm còn lại sẽ được tinh sạch và kết quả được xác định bằng đo quang phổ hoặc phương pháp phù hợp bất kỳ[2].
A.5.1.4. Chuẩn bị các nồng độ khuôn mẫu
Từ kết quả sản phẩm PCR, số bản sao đoạn gene 362 cặp base được tinh bằng các quy trình chuyển đổi tiêu chuẩn.
Các sản phẩm PCR được chuẩn bị trong nước ở 3 dung dịch có nồng độ khác nhau: 1 000 bản sao/ml, 100 bản sao/ml và 10 bản sao/ml.
Các nồng độ ADN đích được mã hóa như sau:
- a = 1 000 bản sao/ml (tương ứng với 5 000 bản sao cho một PCR);
- b = 100 bản sao/ml (tương ứng với 500 bản sao cho một PCR);
- c = 10 bản sao/ml (tương ứng với 50 bản sao cho một PCR).
A.5.2. Kiểm tra máy chu trình nhiệt
A.5.2.1. Cài đặt PCR
Phương pháp này sử dụng thể tích PCR cuối cùng là 50 ml cho một phản ứng. Chất phản ứng và nồng độ cuối được nêu trong Bảng A.3.
Sử dụng ít nhất 16 phản ứng PCR cho máy chu trình nhiệt 96 giếng.
Cài đặt PCR như sau:
- chuẩn bị hỗn hợp PCR;
- chia hỗn hợp PCR ra làm 3 phần và 1 kiểm soát âm tính;
- thêm ADN đích ở 3 nồng độ khác nhau vào 3 phần để tạo hỗn hợp đích PCR.
- chia mỗi hỗn hợp đích PCR ra làm 5 phần sao chép và đưa tất cả vào đĩa đựng mẫu trong máy chu trình nhiệt ở những vị trí xác định.
Bảng A.3 - Chất phản ứng bổ sung
| Thuốc thử | Nồng độ cuối cùng | Thể tích cho một mẫu (ml) | Thể tích khuyến cáo cho 16 mẫu (ml) |
| Nước |
| 24,78 | 401,48b |
| Dung dịch đệm PCR 10x (không chứa MgCl2) | 1x | 5,0 | 80,0 |
| Dung dịch MgCI2a, 25 mmol/l | 3 mmol/l | 6,0 | 96,0 |
| Dung dịch dNTP, 10 mmol/l | 0,2 mmol/l | 1,0 | 16,0 |
| Mồi VAL1, 5mmol/l | 0,4 mmol/l | 4,0 | 64,0 |
| Mồi VAL2, 5mmol/l | 0,4 mmol/l | 4,0 | 64,0 |
| Taq-ADN-polymerase, 5 U/ml | 1,1 đơn vị cho một phản ứng | 0,22 | 3,52 |
| a Nếu dung dịch đệm PCR đã chứa MgCl2, thì nồng độ cuối cùng của MgCl2 trong hỗn hợp phản ứng phải được điều chỉnh đến 3 mmol/I. b Thay nước cho 16 phản ứng và 5 ml cho kiểm chứng dương (5 ml khuôn mẫu được thay thế bởi 5 ml nước). | |||
Chia hỗn hợp PCR vào 3 phần, mỗi phần 225 ml và 1 mẫu 50 ml kiểm soát âm tính (NTC). Thêm vào phần thứ nhất 25 ml ADN đích ở nồng độ “a” chứa 1 000 bản sao/ml, phần thứ hai thêm 25 ml ADN đích ở nồng độ “b” chứa 100 bản sao/ ml, và cho phần thứ ba thêm 25 ml ADN đích ở nồng độ “c” chứa 10 bản sao/ml và trộn cẩn thận. Chuẩn bị 5 phản ứng 50 ml cho từng hỗn hợp và đặt vào trong máy chu trình nhiệt theo sơ đồ ở Hình A.2.
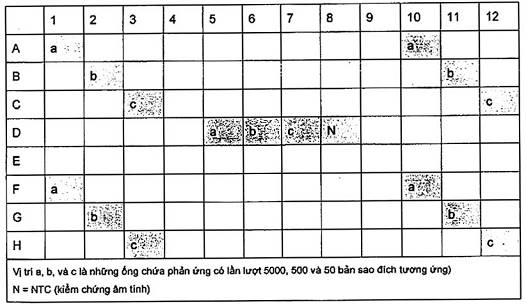
Hình A.2 - Sơ đồ các ống PCR để kiểm tra máy chu trình nhiệt 96 giếng
A.5.2.2. Chương trình thời gian nhiệt độ
Chương trình thời gian nhiệt độ nêu trong Bảng A.4.
Bảng A.4 - Chương trình thời gian nhiệt độ
| Biến tính ban đầu | 2 min/95 oC |
| Khuếch đại | 10 s/95 oC |
|
| 20 s/63 oC |
|
| 20 s/72 oC |
| Số chu trình | 40 |
| Kéo dài cuối cùng | 5 min/72 oC |
A.5.3. Phát hiện
A.5.3.1. Yêu cầu chung
Các sản phẩm PCR được nhận biết bằng điện di. Sử dụng dung dịch đệm TAE hoặc TBE cho chạy điện di. Sử dụng cùng một loại dung dịch đệm để hòa tan agarose và đổ vào giá điện di.
A.5.3.2. Chuẩn bị thạch agarose, điện di và nhuộm
Cân một lượng agarose thích hợp (A.3.8) trộn với dung dịch đệm điện di (A.3.19 hoặc A.3.20) để có được nồng độ cuối cùng ρ = 20 g/l. Lớp gel không được dày quá 1cm.
Trộn 5 ml từng sản phẩm PCR với khoảng 1 ml dung dịch đệm để chạy mẫu (A.3.21) và cho vào gel.
Cho marker khối lượng phân tử vào một giếng riêng.
Tiến hành điện di ở nhiệt độ phòng. Sử dụng điện thế phù hợp để giữ điện thế ổn định tối đa là 5 V/cm giữa các điện cực.
Sau khi điện di hoàn tất, ủ gel ít nhất 30 min trong dung dịch etidi bromua (A.3.22) ở nhiệt độ phòng, ở nơi tối.
Có thể sử dụng các phương pháp nhuộm gel agarose khác nếu cho kết quả tương đương.
Chuyển thạch gel vào để soi bằng đèn cực tím (A.4.4). Bật đèn cực tím và ghi lại huỳnh quang của ADN bằng việc chụp ảnh hoặc quay phim.
A.6. Diễn giải kết quả
Kích thước của sản phẩm PCR được xác định bằng cách so sánh với các đoạn trong chất chuẩn khối lượng phân tử ADN (A.3.23)
Nếu trong tất cả các mẫu thử phát hiện được sản phẩm khuếch đại là các cặp base 116, thì sai số nhiệt độ gắn mồi ở 63 oC là nhỏ hơn 3 oC. Nếu không thấy sản phẩm nào, thì hoặc là có sự vượt quá nhiệt độ hoặc biến tính không đủ. Cả hai trường hợp này là do việc kiểm soát chương trình nhiệt độ trong máy chu trình nhiệt không được tốt.
Việc diễn giải kết quả được nêu trong Bảng A.5.
Bảng A.5 - Diễn giải kết quả
| Số lượng bản sao | Hiệu năng chấp nhận được: sản phẩm phát hiện thấy | Hiệu năng không chấp nhận được: sản phẩm không phát hiện |
| 5 000 | 5 trên 5 | < 5 trên 5 |
| 500 | 5 trên 5 | < 5 trên 5 |
| 50 | £ 5 trên 5a |
|
| a Các phản ứng với 50 bản sao cho 1 phản ứng có thể cho ra các dải ADN nhạt | ||
Trong trường hợp kết quả hiệu năng không chấp nhận được (xem bảng A.5), thì cần kiểm tra lại. Nếu kết quả được xác nhận, thì hiệu năng của máy chu trình nhiệt là có vấn đề và thiết bị phải được kiểm tra hiệu năng vật lý.
PHỤ LỤC B
(Tham khảo)
KIỂM TRA HIỆU NĂNG VẬT LÝ
B.1. Yêu cầu chung
Đây là phương pháp để kiểm tra chính xác nhiệt độ máy chu trình nhiệt trong các điều kiện hoạt động. Việc kiểm tra này ghi lại nhiệt độ chất lỏng trong ống mẫu.
B.2. Nguyên tắc
Nhiệt độ được đo bằng cặp nhiệt điện hay thiết bị khác có khả năng đo được nhiệt độ ở trong lọ có chứa nước.
Quy trình kiểm tra vật lý được tiến hành trong các điều kiện đang chạy PCR. Theo đó thì quá trình kiểm tra sẽ bao gồm loạt 3 cấp độ nhiệt độ được sử dụng để biến tính, gắn mồi và kéo dài mồi.
Nếu như máy chu trình nhiệt có nắp đậy, thì việc đo phải tiến hành khi nắp được đậy.
B.3. Chất phản ứng
B.3.1. Nước
B.4. Thiết bị, dụng cụ
B.4.1. Máy chu trình nhiệt
B.4.2. Thiết bị ghi nhiệt độ: đầu dò ghi nhiệt độ, dây dẫn và các thiết bị đo nhiệt độ.
Định kỳ hiệu chuẩn bộ phận đo nhiệt độ đối với dải nhiệt độ sử dụng.
B.5. Cách tiến hành
B.5.1. Bố trí phép thử
Đặt đầu dò nhiệt độ tại các vị trí đại diện cho dải kiểm soát nhiệt độ. Việc chọn vị trí tới hạn phải được cân nhắc cẩn thận. Khi không xác định được vị trí tới hạn thì đặt ngẫu nhiên các cảm biến trong các giếng.
Ví dụ : Đối với máy chu trình 96 giếng, chia số giếng thành 6 vùng bằng nhau. Đặt ít nhất 2 đầu dò nhiệt độ tại mỗi vùng. Do đó có ít nhất 12 điểm nhiệt độ được ghi[1].
B.6. Ghi các giá trị nhiệt độ
Cần cài đặt tần suất ghi nhiệt độ sao cho ít nhất 1 giá trị nhiệt độ được ghi lại cho một vị trí trong một giây [1].
Tối thiểu, thực hiện đo trong ba lần chạy máy liên tục, mỗi lần ít nhất 30 chu trình.
Cho mỗi vị trí kiểm tra, tính trung bình giữa điểm nhiệt độ cao nhất và thấp nhất ở điểm thời gian to (điểm thời gian khi chương trình nhiệt độ bắt đầu) và tx (điểm thời gian lúc chương trình nhiệt độ kết thúc) cho các bước biến tính, gắn mồi và kéo dài [1].
B.7. Giải thích kết quả
Khảo sát nghiên cứu nhiệt độ ở vị trí cao nhất và thấp nhất. Cả 2 nhiệt độ này phải hoặc nằm trong dải nhiệt độ ghi của máy hoặc nếu không có quy định về độ chính xác của nhiệt độ, thì không được sai lệch lớn hơn 0,5 oC so với nhiệt độ chương trình. Nhiệt độ phải nằm trong dải quy định đối với mỗi bước trong chu trình và trong quá trình chạy.
Không sử dụng các máy chu trình nhiệt không đảm bảo được các điều kiện trên.
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] SCHODER D., SCHMALWIESER A., SCHAUBERGER G., KUHN M., HOORFAR J. and WAGNER M. Physical characteristics of six new thermocyclers. Clin. Chem., 49, 6, 2003, pp. 960-963
[2] HEATON P.A. Quantification of total DNA by spectroscopy. In: Analytical Molecular Biology: Quality and Validation, ed. Sauders G. S and Parker H.C., RCS publications, 1999, UK
1) Đây là ví dụ về sản phẩm thich hợp có bán sẵn. Thông tin này được đưa ra để thuận tiện cho người sử dụng tiêu chuẩn mà không ấn định sử dụng sản phẩm này. Các sản phẩm tương tự có thể được sử dụng nếu cho kết quả tương đương.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 11131:2015 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 11131:2015 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 11131:2015 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 11131:2015 DOC (Bản Word)