- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 9970:2013 Thành phần sterol trong chất béo sữa khan
| Số hiệu: | TCVN 9970:2013 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2013 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 9970:2013
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 9970:2013
TIÊU CHUẨN QUỐC GIA
TCVN 9970:2013
ISO 12078:2006
CHẤT BÉO SỮA DẠNG KHAN – XÁC ĐỊNH THÀNH PHẦN STEROL BẰNG SẮC KÝ KHÍ LỎNG (PHƯƠNG PHÁP CHUẨN)
Anhydrous milk fat – Determination of sterol composition by gas liquid chromatography (Reference method)
Lời nói đầu
TCVN 9970:2013 hoàn toàn tương đương với ISO 12078:2006;
TCVN 9970:2013 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F12 Sữa và sản phẩm sữa biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
CHẤT BÉO SỮA DẠNG KHAN – XÁC ĐỊNH THÀNH PHẦN STEROL BẰNG SẮC KÝ KHÍ LỎNG (PHƯƠNG PHÁP CHUẨN)
Anhydrous milk fat – Determination of sterol composition by gas liquid chromatography (Reference method)
CẢNH BÁO – Việc áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác gây nguy hiểm. Tiêu chuẩn này không đưa ra được tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Người sử dụng tiêu chuẩn này phải tự thiết lập các thao tác an toàn và xác định khả năng áp dụng các giới hạn qui định trước khi sử dụng tiêu chuẩn.
1. Phạm vi áp dụng
Tiêu chuẩn này qui định phương pháp chuẩn dùng sắc ký khí lỏng để xác định thành phần sterol của chất béo sữa dạng khan được tách ra từ các sản phẩm sữa.
Khi phân tích chất béo sữa ở dạng hỗn hợp với chất béo thực vật thì quy trình này có thể đánh giá được hầu hết các phytosterol chính. Quy trình này đã được đánh giá trên các mẫu chất béo sữa có chứa khoảng 28% đến 32% chất béo thực vật.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 4851 (ISO 3696), Nước dùng để phân tích trong phòng thí nghiệm – Yêu cầu kỹ thuật và phương pháp thử.
TCVN 8103 (ISO 14156), Sữa và sản phẩm sữa – Phương pháp chiết lipit và các hợp chất hòa tan trong lipit.
ISO 6799, Animal and vegetable fats and oils – Determination of composition of the sterol fraction – Method using gas-liquid chromatography (Dầu, mỡ động vật và thực vật – Xác định thành phần sterol – Phương pháp sắc ký khí lỏng*).
3. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng thuật ngữ và định nghĩa sau:
3.1. Thành phần sterol (sterol composition)
Phần khối lượng của các chất xác định được bằng qui trình qui định trong tiêu chuẩn này.
CHÚ THÍCH: Thành phần sterol có thể được biểu thị bằng số miligam trên 100 g chất béo hoặc bằng phần trăm hàm lượng sterol tổng số.
4. Nguyên tắc
Dung dịch chuẩn thích hợp (betulin) được bổ sung vào phần mẫu thử. Chất béo được xà phòng hóa bằng dung dịch kali hydroxit trong metanol. Chất không xà phòng hóa được chiết bằng dietyl ete. Các sterol trong chất không xà phòng hóa được tách bằng sắc ký lớp mỏng. Các sterol được chuyển hóa thành các dẫn xuất silyl. Tiến hành chạy sắc ký khí lỏng sử dụng cột mao quản. Các sterol riêng rẽ được nhận biết bằng cách so sánh với thời gian lưu của chất chuẩn đối chứng. Các sterol được định lượng bằng các chuẩn theo phương pháp nội chuẩn.
Trong tiêu chuẩn này sử dụng sắc ký lớp mỏng (TLC) để tinh sạch, đảm bảo loại bỏ các chất nhiễm bẩn có thể có mặt trong chất không xà phòng hóa.
5. Thuốc thử
Chỉ sử dụng thuốc thử loại tinh khiết phân tích, trừ khi có qui định khác.
5.1. Nước, phù hợp với loại 2 qui định trong TCVN 4851 (ISO 3696).
5.2. Metanol (CH3OH), có ít hơn hoặc bằng 0,5% khối lượng nước.
5.3. Thuốc thử xà phòng hóa, dung dịch kali hydroxit trong metanol, c(KOH) = 2 mol/l.
Hòa tan 11,2 g KOH trong 100 ml metanol (5.2) và trộn đều.
5.4. Natri sulfat (Na2SO4), khan.
5.5. n-Hexan [CH3(CH2)4CH3].
5.6. Di-isopropyl ete ([CH3)2CH]2O, không chứa peroxit và các dư lượng.
5.7. Betulin, độ tinh khiết 99%.
5.8. Dung dịch chuẩn betulin
Cân chính xác khoảng 60 mg betulin (5.7) cho vào bình định mức một vạch 100 ml (6.3). Thêm khoảng 60 ml di-isopropyl ete (5.6) và trộn kỹ cho đến khi hòa tan hết. Làm ấm nhẹ đến khoảng 50 oC trong nồi cách thủy để giúp cho việc hòa tan betulin dễ hơn. Đợi cho đến khi nhiệt độ của dung dịch giảm đến nhiệt độ phòng. Pha loãng đến vạch 100 ml bằng di-isopropyl ete.
Dung dịch chuẩn betulin có thể bền được một tháng khi bảo quản trong tủ lạnh.
5.9. Cholesterol, độ tinh khiết 99%.
5.10. Dung dịch chuẩn cholesterol
Cân chính xác khoảng 60 mg cholesterol (5.9) cho vào bình định mức một vạch 100 ml (6.3). Pha loãng đến vạch 100 ml bằng n-hexan (5.5) và trộn.
Dung dịch chuẩn cholesterol có thể bền được một tháng khi bảo quản trong tủ lạnh.
5.11. Campesterol, độ tinh khiết 65%.
5.12. Dung dịch chuẩn campesterol
Cân chính xác khoảng 10 mg campesterol (5.11) cho vào bình định mức một vạch 100 ml (6.3). Pha loãng đến vạch bằng n-hexan (5.5) và trộn.
Dung dịch chuẩn campesterol có thể bền được một tháng khi bảo quản trong tủ lạnh.
5.13. Stigmasterol, độ tinh khiết 95%.
5.14. Dung dịch chuẩn stigmasterol
Cân chính xác khoảng 10 mg stigmasterol (5.13) cho vào bình định mức một vạch 100 ml (6.3). Pha loãng đến vạch bằng n-hexan (5.5) và trộn.
Dung dịch chuẩn stigmasterol có thể bền được một tháng khi bảo quản trong tủ lạnh.
5.15. β-Sitosterol, độ tinh khiết 95%.
5.16. Dung dịch chuẩn β-Sitosterol
Cân chính xác khoảng 10 mg β-sitosterol (5.15) cho vào bình định mức một vạch 100 ml (6.3). Pha loãng đến vạch bằng n-Hexan (5.5) và trộn.
Dung dịch chuẩn β-sitosterol có thể bền được một tháng khi bảo quản trong tủ lạnh.
Vì dung dịch chuẩn phytosterol (5.12, 5.14 và 5.16) chỉ được dùng để đánh giá định tính, chúng có thể được thay bằng các sterol được chuẩn bị từ dầu đậu nành có chứa campesterol, stigmasterol và β-sitosterol làm các thành phần chính.
5.17. Dietyl ete (C2H5OC2H5), không chứa peroxit và các dư lượng.
5.18. Cloroform (CHCl3)
5.19. Etanol (C2H5OH), tuyệt đối.
5.20. Dung dịch amoniac (NH3), chứa khoảng 25% khối lượng NH3 [(ρ20(NH3) = 910 g/l)].
5.21. Pyridin (C5H5N.3H2O), khô.
5.22. Thuốc thử silyl hóa, như trimetychlorosilan, hexametyldisilazan hoặc loại tương đương.
5.23. Dung dịch 2’, 7’-Diclofluorescein, có nồng độ etanol tuyệt đối 5 g/l hoặc dung dịch rodamin G, etanol tuyệt đối nồng độ 1,5 g/l.
6. Thiết bị, dụng cụ
CẢNH BÁO – Vì phép xác định này có thể sử dụng các dung môi bay hơi dễ cháy, nên tất cả các thiết bị điện được dùng phải tuân theo qui định an toàn khi sử dụng các dung môi này.
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm thông thường và các thiết bị, dụng cụ cụ thể sau:
6.1. Cân phân tích, có thể cân chính xác đến 1 mg, với số đọc 0,1 mg.
6.2. Bình cầu đáy tròn, cổ mài, dung tích từ 200 ml đến 250 ml.
6.3. Bình định mức một vạch, dung tích 100 ml.
6.4. Bộ sinh hàn, khít với bình cầu đáy tròn (6.2).
6.5 Nồi cách thủy, có thể duy trì ở 50 oC ± 2 oC và ở điểm sôi.
6.6. Pipet một vạch, dung tích 10 ml.
6.7. Pipet một vạch, dung tích 1 ml.
6.8. Phễu chiết, dung tích 500 ml.
6.9. Phễu thủy tinh, đường kính 100 mm.
6.10. Giấy lọc khô, gấp nếp, loại lọc nhanh, đường kính 250 mm.
6.11. Bộ cô quay chân không, có nồi cách thủy có thể duy trì nhiệt độ đến sôi.
6.12. Ống đong chia vạch, dung tích 100 ml và 250 ml.
6.13. Nguồn khí nitơ, khí có độ tinh khiết ít nhất là 99%.
6.14. Micropipet hoặc microxyranh, có thể phân phối các giọt 0,3 μl đến 0,4 μl.
Có thể sử dụng bộ nhỏ giọt tự động thích hợp.
6.15. Tủ sấy, có thể duy trì nhiệt độ ở 103 oC ± 2 oC.
6.16. Tấm sắc ký đã phủ silica1), dùng cho sắc kí lớp mỏng, kích thước 200 mm x 200 mm.
6.17. Bể triển khai sắc ký bằng thủy tinh, có nắp đậy bằng thủy tinh mài, có kích thước phù hợp với các tấm đã phủ silica (6.16).
6.18. Thiết bị phun.
6.19. Đèn UV, có thể làm việc ở bước sóng 254 nm.
6.20. Dao nhỏ.
6.21. Bình cầu đáy tròn, dung tích 25 ml, cổ mài.
6.22. Bơm chân không.
6.23. Phễu lọc hình trụ, có bộ lọc bằng thủy tinh xốp đường kính 40 μm, khớp với bình cầu đáy tròn 25 ml (6.21) và có bộ chuyển đổi chân không.
6.24. Bình hút ẩm
6.25. Ống đong chia vạch, cổ mài, dung tích 100 ml.
6.26. Pipet chia vạch, dung tích 1 ml.
6.27. Lọ nhỏ, phía trong dạng hình nón, dung tích 5 ml và 10 ml.
6.28. Máy sắc ký khí lỏng, được trang bị detector ion hóa ngọn lửa và hệ thống bơm mao quản (bộ chia dòng hoặc bơm lên cột).
6.28.1. Khí mang, khí heli hoặc hydro, có độ tinh khiết ít nhất 99,999%.
6.28.2. Các loại khí khác, không chứa các tạp chất hữu cơ (CnHm nhỏ hơn 1 phần triệu), nitơ và hydro có độ tinh khiết ít nhất 99,995% và không khí nhân tạo.
6.28.3. Cột mao quản, có pha tĩnh phù hợp để tách thành công các sterol có các độ phân cực khác nhau tùy thuộc vào thành phần hóa học của chúng (metylpolysiloxan, metylphenylpoly-siloxan, polygycol). Chọn pha tĩnh, chiều dài cột (từ 10m đến 30 m), đường kính trong (từ 0,22 mm đến 0,32 mm) và chiều dày màng phim (bằng hoặc lớn hơn 0,12 μm) theo kinh nghiệm của phòng thử nghiệm và hệ thống bơm được áp dụng. Trong mọi trường hợp, cột đã chọn phải tách được hoàn toàn pic dung môi và cholesterol, độ phân giải đường nền giữa các pic cholesterol, campesterol, stigmasterol và β-sitosterol. Tuy nhiên, không được có sự loang đường nền xuất hiện trong suốt quá trình chạy sắc ký khí. Các ví dụ về sơ đồ mẫu sắc ký khí thu được bằng cách sử dụng hai điều kiện vận hành khác nhau được nêu trong các Hình A.1 và Hình A.2.
6.28.4. Detector ion hóa ngọn lửa, có thể được gia nhiệt cao hơn nhiệt độ cuối cùng của lò cột 30 oC.
6.28.5. Bộ bơm mẫu, khi sử dụng bộ chia dòng thì nhiệt độ của bộ bơm có thể được gia nhiệt cao hơn nhiệt độ cuối cùng của lò cột 30 oC. Còn khi sử dụng bộ bơm trên cột lạnh, thì bộ bơm phải duy trì được ở nhiệt độ thấp hơn nhiệt độ sôi của dung môi vài độ.
CHÚ THÍCH: Nhiệt độ lò (đẳng nhiệt hoặc đã được cài đặt) và dòng khí mang phụ thuộc vào cột được chọn và hệ thống bơm tương ứng.
6.28.6. Xyranh, dung tích 1 μl đến 10 μl.
6.28.7. Hệ thống tích phân, tốt nhất là được trang bị máy tính.
6.29. Điều kiện sắc ký khí
Cài đặt thiết bị theo hướng dẫn của nhà sản xuất. Nhiệt độ lò và dòng khí mang phụ thuộc vào cột được chọn và hệ thống bơm tương ứng. Các ví dụ dưới đây cho thấy các điều kiện có thể áp dụng đối với các hệ thống bơm chia dòng và trên cột.
6.29.1. Bơm chia dòng
Ví dụ về các điều kiện có thể áp dụng với bộ bơm chia dòng là:
a) Cột mao quản: Silica nung chảy có 5% phenyl và 95% metylpolysiloxan, dài 15 m, đường kính trong 0,22 mm, chiều dày màng phim 0,24 μm;
b) Hệ thống bơm: Chia dòng với tỷ lệ 1:30, cài đặt ở 300 oC;
c) Khí mang: Khí heli, cài đặt tốc độ 0,6 ml/min;
d) Detector: Ion hóa ngọn lửa (FID) cài đặt ở 300 oC;
e) Nhiệt độ lò: Đẳng nhiệt, cài đặt ở 260 oC;
f) Mẫu: Sterol tách bằng phương pháp qui định được pha loãng trong 1 ml n-hexan;
g) Thời gian lưu: Tính bằng phút;
6.29.2. Bơm trên cột
Ví dụ về các điều kiện có thể áp dụng với bộ bơm trên cột là:
a) Cột mao quản: Silica nung chảy có 5% phenyl và 95% metylpolysiloxan, dài 15 m, đường kính trong 0,32 mm, chiều dài màng phim 0,12 μm;
b) Hệ thống bơm: Trên cột;
c) Khí mang: Khí hydro, cài đặt tốc độ 2,4 ml/min;
d) Detector: Ion hóa ngọn lửa (FID) cài đặt ở 330 oC;
e) Nhiệt độ lò: Nhiệt độ ban đầu 60 oC trong 1 min; cài đặt gradient thứ nhất ở 40 oC/min, khi tăng đến 250 oC thì ngừng trong 1 min; cài đặt gradient thứ hai ở 6 oC/min, khi tăng đến 320 oC thì ngừng ở nhiệt độ này trong 10 min;
f) Mẫu: Sterol được tách bằng phương pháp qui định được pha loãng trong 5 ml n-hexan;
g) Thời gian lưu: Tính bằng phút;
7. Lấy mẫu
Mẫu gửi đến phòng thử nghiệm phải đúng là mẫu đại diện. Mẫu không bị hư hỏng hoặc thay đổi trong suốt quá trình vận chuyển hoặc bảo quản.
Việc lấy mẫu không qui định trong tiêu chuẩn này, nên lấy mẫu theo TCVN 6400 (ISO 707).
8. Chuẩn bị mẫu thử
Chuẩn bị mẫu thử theo TCVN 8103 (ISO 14156). Làm tan chảy mẫu trong tủ sấy (6.15) ở 50 oC.
9. Cách tiến hành
9.1. Dung dịch chuẩn sterol
9.1.1. Dung dịch hiệu chuẩn để xác định hệ số đáp ứng cholesterol
Dùng pipet một vạch (6.7) chuyển 1 ml dung dịch chuẩn cholesterol (5.10) sang lọ nhỏ 5 ml (6.27).
Dùng một pipet một vạch (6.7) khác thêm vào lọ này 1 ml dung dịch chất chuẩn (nội) betulin (5.8) và trộn. Loại dung môi dưới dòng khí nitơ nhẹ trong khi vẫn làm ấm trong nồi cách thủy (6.5) ở 50 oC.
9.1.2. Dung dịch định tính để xác định thời gian lưu của sterol
Dùng các pipet một vạch (6.7) riêng rẽ chuyển các dung dịch chuẩn sterol đã chuẩn bị trong 5.10, 5.12, 5.14 và 5.16 tương ứng, mỗi dung dịch 1 ml vào lọ nhỏ 10 ml (6.27). Dùng pipet một vạch (6.7) khác thêm vào lọ này 1 ml dung dịch chất chuẩn (nội) betulin (5.8) và trộn. Loại dung môi dưới dòng khí nitơ nhẹ trong khi vẫn làm ấm trong nồi cách thủy (6.5) ở 50 oC.
Khi sử dụng dầu đậu nành thay các chất chuẩn tinh khiết thì sử dụng cùng quy trình như đã dùng đối với phần mẫu thử trong 9.2.
9.2. Phần mẫu thử
Lắc mẫu thử đã tan chảy (Điều 8) 1 min để đồng hóa mẫu thử. Cân khoảng 2 g mẫu thử, chính xác đến 1 mg, cho vào bình cầu đáy tròn (6.2).
9.3. Xà phòng hóa
Dùng pipet một vạch (6.6) chuyển 10 ml dung dịch chất chuẩn (nội) betulin (5.8) và 100 ml thuốc thử xà phòng hóa (5.3) vào phần mẫu thử (9.2). Lắp bình cầu đáy tròn vào bộ sinh hàn (6.4). Đun sôi nhẹ trên nồi cách thủy (6.5) ở 80 oC trong khoảng 1 h.
CHÚ THÍCH: Khi dự kiến có sôi mạnh thì thêm vài hạt chống trào.
9.4. Chiết chất không xà phòng hóa
Làm nguội bình cầu đáy tròn đến 35 oC. Chuyển định lượng dung dịch thử sang phễu chiết (6.8). Thêm 100 ml dietyl ete (5.17) và 200 ml nước cất. Sử dụng một phần của từng dung môi đã nêu, tráng bình cầu để không làm thất thoát mẫu. Lắc mạnh trong khi vẫn thường xuyên loại khí. Để cho tách lớp và trong hoàn toàn.
Tháo lớp nước phía dưới vào phễu chiết (6.8) thứ hai. Chiết dung dịch xà phòng thu được bằng 100 ml dietyl ete (5.17) theo cùng trình tự như trên. Thực hiện lần chiết thứ ba bằng 50 ml dietyl ete.
Gộp các dịch chiết ete thu được vào một phễu chiết (6.8) khác. Thêm 100 ml nước và lắc nhẹ (trong giai đoạn này nếu lắc mạnh sẽ tạo nhũ tương). Sau khi tách lớp, tháo lớp nước. Rửa dung dịch ete thu được hai lần, mỗi lần dùng 50 ml nước. Nếu tạo nhũ tương trong quá trình rửa thì thêm vài giọt etanol (5.19).
Lọc dung dịch ete qua giấy lọc khô gấp nếp (6.10), đã được nhồi ít nhất 30 g natri sulfat (5.4), vào bình cầu đáy tròn (6.2). Tráng phễu chiết bằng một lượng nhỏ dietyl ete (5.17). Cho bay hơi dung môi trên bộ cô quay chân không (6.11) trong khi làm nóng nhẹ bình cầu trong nồi cách thủy ở 50 oC.
9.5. Sắc ký lớp mỏng (TLC)
9.5.1. Chuẩn bị các tấm sắc ký lớp mỏng
Hoạt chất các tấm sắc ký đã phủ silica (6.16) trước khi sử dụng trong tủ sấy (6.15) ở 103 oC trong 1 h. Bảo quản các tấm sắc ký này trong bình hút ẩm (6.24) trước khi sử dụng.
9.5.2. Chuẩn bị bể triển khai sắc ký bằng thủy tinh
Chuẩn bị hỗn hợp dietyl ete/cloroform với tỷ lệ 10:90 (thể tích) trong ống đong chia vạch 100 ml (6.25). Dùng pipet chia vạch (6.26) bổ sung 0,5 ml dung dịch amoniac (5.20). Đậy nắp ống đong và lắc nhẹ.
Rót hỗn hợp sang bể triển khai sắc ký (6.17). Đậy nắp và để cân bằng pha lỏng/hơi đến bão hòa.
9.5.3. Sắc ký lớp mỏng chất không xà phòng hóa
Hòa tan chất không xà phòng hóa trong 1 ml cloroform (5.18). Dùng micropipet hoặc microxyranh (6.14) chuyển 400 μl sang tấm silica trong một vạch liên tục. Để một phần rộng 20 mm phía trái và một phần rộng 40 mm phía phải của tấm sắc khí không sử dụng. Thêm 40 μl dung dịch chuẩn betulin (5.8) và 40 μl dung dịch chuẩn cholesterol (5.10) với cùng mức như đường nạp mẫu vào giữa vạch phần 40 mm phía phải của tấm sắc ký.
Chuyển tấm sắc ký sang bể triển khai (6.17). Đậy nắp và đợi cho đến khi dung môi chạy đến điểm thấp hơn mép trên của tấm sắc ký 10 mm. Lấy tấm sắc ký ra khỏi bể và để cho dung môi bay hơi ở nhiệt độ phòng.
Phun dung dịch 2’,7’-dichlorofluorescein (5.23) lên tấm sắc ký. Để cho dung môi bay hơi và kiểm tra dưới đèn UV (6.19).
Nhận biết từng vạch sterol bằng cách so sánh với vạch chuẩn cholesterol phía bên phải của tấm. Dùng dao nhỏ (6.20) hoặc dụng cụ thích hợp khác để cạo các vạch sterol ra. Chuyển phần bột thu được sang phễu lọc hình trụ (6.23).
Lắp phễu vào bình cầu đáy tròn (6.21) và thêm 5 ml cloroform (5.18). Nối bơm chân không (6.22) và lọc toàn bộ dung môi qua phần chứa sterol vào bình cầu.
Tháo bơm chân không và lọc lại với 5 ml diety ete (5.17). Tiến hành lọc lại một lần nữa với 5 ml cloroform (5.18) và 5 ml dietyl ete tương ứng.
Loại bỏ dung môi bằng cách sử dụng bộ cô quay chân không (6.11), trong khi vẫn làm ấm nhẹ bình cầu trong nồi cách thủy ở 50 oC.
9.6. Chuẩn bị các dẫn xuất silyl
Chuyển hóa các sterol thu được trong 9.5.3 thành các dẫn xuất trimetyl-silyl.
CHÚ THÍCH: Nhiều loại thuốc thử có sẵn như qui định trong 5.22 dùng để chuyển các sterol thành các dẫn xuất trimetyl silyl (TMS). Thể tích và tỷ lệ các thuốc thử này được dùng tùy thuộc vào mức độ phản ứng của chúng nên không thể đưa ra được các điều kiện chuẩn. Trong mọi trường hợp, có thể tham khảo quy trình sau: bổ sung 200 μl dung dịch bis(trimetylsilyl) trifluoacetamin và trimetylcholorosilan (tỷ lệ 99:1) và 200 μl pyridin (5.21) vào sterol thu được trong 9.5.3 và trộn. Làm ấm dung dịch thu được trong nồi cách thủy ở 70 oC trong 30 min.
Loại bỏ dung môi dưới dòng khí nitơ nhẹ trong khi vẫn làm ấm trong nồi cách thủy ở 50 oC. Pha loãng bằng n-Hexan đến nồng độ thích hợp đối với hệ thống bơm sắc ký khí lỏng được sử dụng (ví dụ: 0,5 ml đối với bộ bơm chia dòng và 5 ml đối với bộ bơm lên cột).
Sử dụng dung dịch này để bơm lên máy sắc ký khí.
CHÚ THÍCH: Nếu có mặt pic thứ hai sau pic betulin chứng tỏ không silyl hóa hoàn toàn.
9.7. Phân tích định tính
Chuẩn bị các dẫn xuất trimetyl-silyl của dung dịch sterol (9.1.2) theo 9.6. Bơm dung dịch dẫn xuất vào máy sắc ký khí. Ghi lại thời gian lưu của các sterol chuẩn. Phân tích phần mẫu thử (9.6) trong cùng điều kiện đã dùng cho dung dịch sterol.
CHÚ THÍCH 1: Thứ tự rửa giải các sterol chính như sau: cholesterol, campesterol, stigmasterol và β-sitosterol. Chất chuẩn nội betulin rửa giải sau β-sitosterol. Sử dụng sắc ký đồ nêu trong Hình A.1 để nhận biết các sterol này.
CHÚ THÍCH 2: Nếu dầu đậu nành được dùng để nhận biết các phytosterol thì việc phân tích dung dịch trong 9.1.1 có thể cho phép xác định thời gian lưu của cholesterol.
Nhận biết các pic của mẫu thử bằng cách so sánh thời gian lưu thu được với thời gian lưu của dung dịch chuẩn.
9.8. Phân tích định lượng
9.8.1. Tính hệ số đáp ứng
Chuẩn bị các dẫn xuất trimetyl-silyl của dung dịch hiệu chuẩn (9.1.1) theo 9.6. Bơm dung dịch dẫn xuất vào máy sắc ký khí. Xác định các diện tích pic của betulin và cholesterol.
Tính hệ số đáp ứng, Fr, đến hai chữ số thập phân theo công thức sau:
![]()
Trong đó:
wc là khối lượng cholesterol có trong dung dịch hiệu chuẩn (9.1.1);
wb là khối lượng betulin có trong dung dịch hiệu chuẩn (9.1.1);
Ab là diện tích pic betulin;
Ac là diện tích pic cholesterol;
Pc là độ tinh khiết của cholesterol (5.9), (ví dụ: Pc = 0,99);
Pb là độ tinh khiết của betulin (5.7), (ví dụ: Pb = 0,99).
CHÚ THÍCH: Hệ số đáp ứng tính được đối với cholesterol cũng có thể áp dụng cho các sterol khác (campesterol, stigmasterol và β-sitosterol).
9.8.2. Xác định phần mẫu thử
Phân tích mẫu thử trong các điều kiện như đã dùng đối với dung dịch hiệu chuẩn. Xác định diện tích pic của betulin, cholesterol và các sterol khác, nếu phát hiện thấy.
Lặp lại việc bơm dung dịch hiệu chuẩn và tính Fr theo 9.8.1.
9.8.3. Tính và biểu thị kết quả
9.8.3.1. Tính các sterol theo phần khối lượng
Tính hệ số đáp ứng trung bình đối với cholesterol, Fr,a độ lệch chuẩn và hệ số biến thiên giữa các giá trị. Phép xác định thành công khi cho hệ số đáp ứng gần với 1 và hệ số biến thiên nhỏ hơn 2.
Tính phần khối lượng của từng sterol, wi, theo công thức sau:
![]()
Trong đó:
wi là phần khối lượng của từng sterol (cholesterol, campesterol, stigmasterol và β-sitosterol) có trong mẫu, tính bằng miligam trên 100 g chất béo;
wb là khối lượng betulin bổ sung vào phần mẫu thử (9.3), tính bằng miligam (mg);
Pb là độ tinh khiết của betulin (5.7), (ví dụ: Pc = 0,99);
Ai là diện tích pic của từng sterol có trong phần mẫu thử (9.8.2);
Fr,a là giá trị trung bình của hệ số đáp ứng cholesterol (9.8.3.1);
Ab là diện tích pic betulin (9.8.2);
ms là khối lượng phần mẫu thử, tính bằng gam (g) (9.2).
9.8.3.2. Tính các sterol theo phần trăm tổng số
Tính phần khối lượng của từng sterol, wi, theo phần trăm khối lượng tổng số của các sterol theo công thức sau:
![]()
9.8.3.3. Biểu thị kết quả
Biểu thị kết quả đến một chữ số thập phân.
10. Độ chụm
10.1. Phép thử liên phòng thử nghiệm
Các chi tiết của phép thử liên phòng thử nghiệm phù hợp với TCVN 6910-1 (ISO 5725-1) và TCVN 6910-2 (ISO 5725-2) về độ chụm của phương pháp được nêu trong Phụ lục B.
Các giá trị về giới hạn độ tái lập và độ lặp lại được biểu thị ở mức xác suất 95% và có thể không thể áp dụng cho các dải nồng độ và chất nền khác với các dải nồng độ và chất nền đã nêu.
10.2. Độ lặp lại
Chênh lệch tuyệt đối giữa hai kết quả thử độc lập, đơn lẻ, thu được khi sử dụng cùng phương pháp, tiến hành trên vật liệu thử giống hệt nhau, trong một phòng thử nghiệm, do một người thực hiện, sử dụng cùng thiết bị, trong một khoảng thời gian ngắn, không được quá 5% các trường hợp lớn hơn:
| - đối với cholesterol: | r = 21,2 mg/100 g chất béo; | sr = 7,57 mg/100 g chất béo; |
| - đối với campesterol: | r = 3,4 mg/100 g chất béo; | sr = 1,21 mg/100 g chất béo; |
| - đối với stigmasterol: | r = 2,8 mg/100 g chất béo; | sr = 1,01 mg/100 g chất béo; |
| - đối với β-sitosterol: | r = 7,5 mg/100 g chất béo; | sr = 2,70 mg/100 g chất béo. |
10.3. Độ tái lập
Chênh lệch tuyệt đối giữa hai kết quả thử đơn lẻ thu được khi sử dụng cùng phương pháp, tiến hành thử trên vật liệu giống thử hệt nhau, trong các phòng thử nghiệm khác nhau, do những người khác nhau thực hiện, sử dụng các thiết bị khác nhau, không quá 5 % các trường hợp lớn hơn:
| - đối với cholesterol: | R = 40,4 mg/100 g chất béo; | sR = 14,44 mg/100 g chất béo; |
| - đối với campesterol: | R = 5,6 mg/100 g chất béo; | sR = 2,00 mg/100 g chất béo; |
| - đối với stigmasterol: | R = 4,3 mg/100 g chất béo; | sR = 1,52 mg/100 g chất béo; |
| - đối với β-sitosterol: | R = 11,4 mg/100 g chất béo; | sR = 4,60 mg/100 g chất béo. |
11. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải ghi rõ:
a) mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
b) phương pháp lấy mẫu đã dùng, nếu biết;
c) phương pháp thử đã sử dụng, viện dẫn tiêu chuẩn này;
d) tất cả các chi tiết thao tác không qui định trong tiêu chuẩn này, hoặc tùy ý lựa chọn cùng với các chi tiết bất thường nào khác có thể ảnh hưởng tới kết quả;
e) kết quả thử thu được, hoặc nếu kiểm tra độ lặp lại thì nêu kết quả cuối cùng thu được.
Phụ lục A
(Tham khảo)
Các ví dụ về phân tích sắc ký khí lỏng
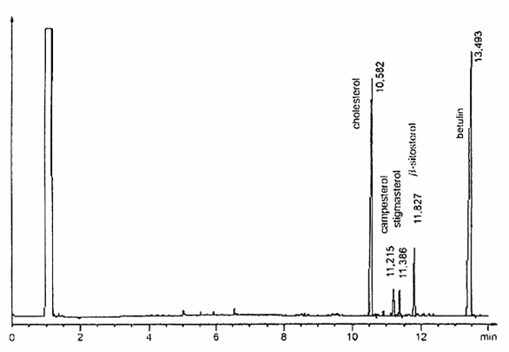
Hình A.1 – Ví dụ về mẫu sắc ký đồ GC của các sterol thu được trong các điều kiện GC trong 6.29.1
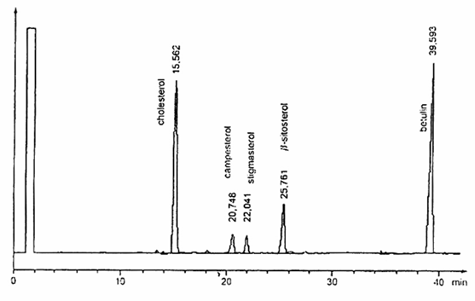
Hình A.2 – Ví dụ về mẫu sắc đồ GC của các sterol thu được trong các điều kiện GC trong 6.29.2
Phụ lục B
(Tham khảo)
Kết quả của phép thử liên phòng thử nghiệm
Phép thử liên phòng này gồm có 11 phòng thử nghiệm tham gia thực hiện phù hợp với TCVN 6910-1 (ISO 5725-1) và TCVN 6910-2 (ISO 5725-2) trên ba mẫu chất béo sữa dạng khan chứa từ 28% đến 32% chất béo thực vật. Ba mẫu hỗn hợp chất béo này được chia thành sáu cặp mẫu mù giống nhau.
Phép thử liên phòng này do Instituto del Frio (CSIC) (ES) và Instituto Sperimentale Lattiero Caseario (IT) tổ chức thực hiện. Các kết quả phần khối lượng của cholesterol, campesterol, stigmasterol and β-sitosterol được biểu thị bằng miligam trên 100 g chất béo.
Các kết quả thu được đã được phân tích thống kê theo TCVN 6910-2 (ISO 5725-2) để cho dữ liệu về độ chụm như trong Bảng B.1.
Bảng B.1 – Các kết quả thử liên phòng thử nghiệm
| Cholesterol | |||
|
| Mẫu 1 | Mẫu 2 | Mẫu 3 |
| Số lượng phòng thử nghiệm còn lại sau khi trừ ngoại lệ | 8 | 7 | 9 |
| Giá trị trung bình, (mg/100g chất béo) | 191,1 | 190,5 | 181,9 |
| Độ lệch chuẩn lặp lại, sr, (mg/100 g chất béo) Hệ số biến thiên lặp lại, % Giới hạn lặp lại, r (=2,8 sr), (mg/100 g chất béo) | 6,75 3,5 18,9 | 4,02 2,1 11,3 | 11,96 6,6 33,5 |
| Độ lệch chuẩn tái lập, sR, (mg/100 g chất béo) Hệ số biến thiên tái lập, % Giới hạn tái lập, R (=2,8 sR), (mg/100 g chất béo) | 14,74 7,7 41,3 | 14,79 7,8 41,4 | 13,79 7,6 38,6 |
| Campesterol | |||
|
| Mẫu 1 | Mẫu 2 | Mẫu 3 |
| Số lượng phòng thử nghiệm còn lại sau khi trừ ngoại lệ | 8 | 10 | 9 |
| Giá trị trung bình, (mg/100g chất béo) | 15,6 | 17,6 | 18,0 |
| Độ lệch chuẩn lặp lại, sr, (mg/100 g chất béo) Hệ số biến thiên lặp lại, % Giới hạn lặp lại, r (=2,8 sr), (mg/100 g chất béo) | 1,10 7,0 3,1 | 0,88 5,0 2,5 | 1,66 9,2 4,6 |
| Độ lệch chuẩn tái lập, sR, (mg/100 g chất béo) Hệ số biến thiên tái lập, % Giới hạn tái lập, R (=2,8 sR), (mg/100 g chất béo) | 1,31 8,4 3,7 | 2,57 14,6 7,2 | 2,11 11,8 5,9 |
| Stigmasterol | |||
|
| Mẫu 1 | Mẫu 2 | Mẫu 3 |
| Số lượng phòng thử nghiệm còn lại sau khi trừ ngoại lệ | 10 | 10 | 9 |
| Giá trị trung bình, (mg/100g chất béo) | 12,3 | 13,2 | 13,9 |
| Độ lệch chuẩn lặp lại, sr, (mg/100 g chất béo) Hệ số biến thiên lặp lại, % Giới hạn lặp lại, r (=2,8 sr), (mg/100 g chất béo) | 1,04 8,4 2,9 | 0,75 5,7 2,1 | 1,22 8,8 3,4 |
| Độ lệch chuẩn tái lập, sR, (mg/100 g chất béo) Hệ số biến thiên tái lập, % Giới hạn tái lập, R (=2,8 sR), (mg/100 g chất béo) | 1,57 12,7 4,4 | 1,53 11,6 4,3 | 1,46 10,5 4,1 |
| b-sitosterol | |||
|
| Mẫu 1 | Mẫu 2 | Mẫu 3 |
| Số lượng phòng thử nghiệm còn lại sau khi trừ ngoại lệ | 10 | 9 | 9 |
| Giá trị trung bình, (mg/100g chất béo) | 37,7 | 39,7 | 41,7 |
| Độ lệch chuẩn lặp lại, sr, (mg/100 g chất béo) Hệ số biến thiên lặp lại, % Giới hạn lặp lại, r (=2,8 sR), (mg/100 g chất béo) | 2,26 6,0 6,3 | 1,60 4,0 4,5 | 4,23 10,1 11,9 |
| Độ lệch chuẩn tái lập, sR, (mg/100 g chất béo) Hệ số biến thiên tái lập, % Giới hạn tái lập, R (=2,8 sr), (mg/100 g chất béo) | 3,77 10,0 10,6 | 3,97 10,0 11,1 | 4,46 10,7 12,5 |
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] TCVN 6400 (ISO 707), Sữa và sản phẩm sữa – Hướng dẫn lấy mẫu.
[2] TCVN 6910-1:2001 (ISO 5725-1:1994), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo. Phần 1: Nguyên tắc và định nghĩa chung.
[3] TCVN 6910-2:2001 (ISO 5725-2:1994), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo. Phần 2: Phương pháp cơ bản xác định độ lặp lại và độ tái lập của phương pháp đo tiêu chuẩn.
*) ISO 6799 đã hủy.
1) Machery nagel Sirt 25 hoặc Merck 5715 silica 60 là các ví dụ về sản phẩm thích hợp có bán sẵn. Thông tin đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng các sản phẩm này.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 9970:2013 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 9970:2013 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 9970:2013 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 9970:2013 DOC (Bản Word)