- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 9531:2012 Xác định các hydrocacbon thơm đa vòng trong dầu mỡ động thực vật
| Số hiệu: | TCVN 9531:2012 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2012 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 9531:2012
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 9531:2012
TIÊU CHUẨN QUỐC GIA
TCVN 9531:2012
ISO 15753:2006
WITH AMENDMENT 1:2011
DẦU MỠ ĐỘNG VẬT VÀ THỰC VẬT - XÁC ĐỊNH CÁC HYDROCACBON THƠM ĐA VÒNG
Animal and vegetable fats and oils - Determination of polycyclic aromatic hydrocarbons
Lời nói đầu
TCVN 9531:2012 hoàn toàn tương đương với ISO 15753:2006 và Sửa đổi 1:2011.
TCVN 9531:2012 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F13 Phương pháp phân tích và lấy mẫu biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị. Bộ Khoa học và Công nghệ công bố.
DẦU MỠ ĐỘNG VẬT VÀ THỰC VẬT - XÁC ĐỊNH CÁC HYDROCACBON THƠM ĐA VÒNG
Animal and vegetable fats and oils - Determination of polycyclic aromatic hydrocarbons
1. Phạm vi áp dụng
Tiêu chuẩn này quy định hai phương pháp xác định 15 hydrocacbon thơm đa vòng (PAH) trong dầu mỡ động vật và thực vật gồm:
- phương pháp chung;
- phương pháp riêng đối dầu dừa và dầu thực vật có các axit béo mạch ngắn.
Các phương pháp này không áp dụng để định lượng các hợp chất dễ bay hơi như naphtalen, axenaphten và floren. Do phương pháp gây ra nhiễu nền, nên dầu cọ và bã dầu oliu không thể phân tích được bằng phương pháp này.
Giới hạn định lượng đối với hầu hết các hợp chất được phân tích là 0,2 mg/kg, ngoại trừ floranten và benzo(g,h,i)perylen có giới hạn định lượng là 0,3 mg/kg và indeno(1,2,3-c,d)pyren có giới hạn định lượng là 1 mg/kg.
CHÚ THÍCH: Các kết quả về bã dầu oliu trong Phụ lục B chỉ ra rằng phương pháp này không áp dụng cho loại dầu này. Dữ liệu về độ chụm xác định được là rất thấp.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 6128 (ISO 661), Dầu mỡ động vật và thực vật - Chuẩn bị mẫu thử.
3. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này áp dụng thuật ngữ và định nghĩa sau:
3.1
Hydrocacbon thơm đa vòng (polycyclic aromatic hydrocarbon)
(PAH)
Hợp chất có chứa hai hoặc nhiều hơn hai vòng hydrocacbon thơm ngưng tụ (dung hợp) và có thể xác định được hàm lượng theo phương pháp quy định trong tiêu chuẩn này.
CHÚ THÍCH 1: Hàm lượng hydrocacbon thơm đa vòng được tính bằng microgam trên kilogam.
CHÚ THÍCH 2: Thông thường, các PAH được chia thành PAH nhẹ có từ hai đến bốn vòng thơm và PAH nặng có năm hoặc nhiều hơn năm vòng thơm.
VÍ DỤ
PAH nhẹ gồm có:
Naphatalen (CAS RN [91-20-3]), axenaphten (CAS RN [83-32-9]), axenaphtylen (CAS RN [208-96-8]), floren (CAS RN [86-73- 7]). antraxen (CAS RN [120-12-7]). phenantren (CAS RN [85-01-8]), floranten (CAS RN [206-44-0]), crysen (CAS RN [218-01- 9]), benz(a)antraxen (CAS RN [56-55-3]), pyren (CAS RN [129-00-0]).
PAH nặng gồm có:
Benzo(a)pyren (CAS RN [50-32-8)), benzo(b)florenten (CAS RN (205-99-2]), benzo(k)floranten(CAS RN [207-08-9]), benzo(g,h,i)perylen (CAS RN [191-24-2]), dibenz(a,h)antraxen (CAS RN [53-70-3]), indeno (1,2,3-c,d)pyrene (CAS RN [193-39-5]).
4. Nguyên tắc
Các hydrocacbon thơm đa vòng được chiết bằng hỗn hợp axetonitril/axeton, rồi được tinh sạch trên cột pha đảo C18, sau đó làm sạch trên cột chiết liên kết Florisil. Xác định hàm lượng của từng hydrocacbon thơm đa vòng sau khi tách được bằng sắc ký lỏng hiệu năng cao (HPLC) và đo huỳnh quang ở các bước sóng kích thích và bước sóng phát xạ.
5. Thuốc thử và vật liệu thử
CẢNH BÁO - Chú ý các quy định về việc xử lý các chất độc hại và trách nhiệm của người thực hiện. Cần tuân thủ các biện pháp an toàn đối với tổ chức cá nhân.
Chỉ sử dụng các loại thuốc thử tinh khiết phân tích, trừ khi có quy định khác.
Kiểm tra chất lượng của các dung môi trước khi sử dụng bằng cách cho bay hơi để cô đặc dung môi khoảng 1 000 lần, rồi phân tích dịch cô đặc bằng HPLC (từ 300 ml thành 300 ml). Sắc đồ phải không có các pic trong vùng rửa giải của PAH.
5.1. Metanol. loai siêu tinh khiết phân tích1).
5.2. Hexan, loại dùng cho HPLC1)
5.3. Axetonitril, loại dùng cho HPLC1)
5.4. Axeton, loại dùng cho HPLC1)
5.5. Diclometan, loại dùng cho HPLC1)
5.6. Toluen, loại dùng cho HPLC1)
5.7. Nước, loại dùng cho HPLC1)
5.8. Tetrahydrofuran, loại dùng cho HPLC1)
5.9. Hỗn hợp dung môi 1: axetonitril/axeton (60 % / 40 % thể tích).
Lượng dung môi sử dụng cho mỗi mẫu: 41 ml cho phương pháp chung, 36 ml cho phương pháp riêng đối với dầu dừa.
5.10 Hỗn hợp dung môi 2: axetonitril/axeton (80 % / 20 % thể tích)
Lượng dung môi sử dụng cho mỗi mẫu: 2 x 11 ml cho phương pháp riêng đối với dầu dừa.
5.11. Hỗn hợp dung môi 3: hexan/diclometan (75 % / 25 % thể tích).
Lượng dung môi sử dụng cho mỗi mẫu: 7 ml cho phương pháp chung, 2 x7 ml cho phương pháp riêng đối với dầu dừa.
5.12. Hỗn họp tetrahydrofuran/metanol (50 % / 50 % thể tích).
5.13. Dung dịch chuẩn có 16 PAH trong toluen đã được EPA chứng nhận2), ở nồng độ 100 mg/ml (100 mg/l) gồm có: naphatalen, axenaphtylen, axenaphten, floren, phenantren, antraxen, floranten, pyren, benz(a)antraxen, chrysen, benzo(b)floranten, benzo(k)floranten, benzo(a)pyren, dibenz(a)antraxen, benzo(g,h,i)perylen, indeno(1,2,3-c,d)pyren. Dung dịch này được bảo quản ở nhiệt độ - 20 oC.
Trước khi sử dụng, làm ấm dung dịch đến nhiệt độ môi trường trong ít nhất 1 h.
CHÚ THÍCH Axenaphtylen không phải là chất huỳnh quang, do đó không thể xác định được bằng phương pháp này.
5.14. Dung dịch chuẩn gốc, nồng độ 200 ng/ml (200 mg/l)
Dùng microxyranh 250 ml (6.11), lấy 100 ml dung dịch chuẩn (5 13) cho vào bình định mức 50 ml (6.20) và pha loãng đến vạch bằng axetonitril.
5.15. Dung dịch chuẩn làm việc, nồng độ 50 ng/ml (50 mg/l).
Dùng microxyranh 250 ml (6.11), lấy 250 ml dung dịch chuẩn gốc (5.14) cho vào 750 ml hỗn hợp THF/metanol (5.12) hoặc axetonitril (5.3).
5.16. Cột chiết liên kết C183), pha 2 g, dung tích 12 ml.
5.17. Cột chiết liên kết Florisil3),1 pha 500 mg, dung tích 3 ml.
5.18. Dòng khí nitơ, áp suất quy định ở 34,5 kPa (5 psi, khoảng 1,5 l/min).
6. Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm thông thường và các thiết bị, dụng cụ cụ thể như sau:
Có thể sử dụng các ống nghiệm thủy tinh dùng một lần. Việc sử dụng các ống thủy tinh là cần thiết do các ống chất dẻo có thể chứa các PAH.
6.1. Máy ly tâm, có khả năng đạt được tốc độ li tâm thấp nhất 4 000 min-1, thích hợp cho các ống 100 ml và 10 ml.
6.2. Hệ thống HPLC có rửa giải gradient hai kênh, có bình chứa dung môi dung tích 1 lít, bộ lọc màng pha động, bơm, bộ lấy mẫu tự động, cột điều chỉnh nhiệt độ cài đặt ở 25 oC, có detector huỳnh quang lập trình theo thời gian đối với bước sóng kích thích và bước sóng phát xạ khác nhau, máy tính để thu nhận và xử lý dữ liệu.
6.3. Cột pha đảo C184), dài 250 mm, đường kính trong 4,6 mm, cỡ hạt 5 mm, thích hợp để phân tích PAH.
6.4. Máy trộn Vortex.
6.5. Bộ cô quay tự động5), dùng cho ống nghiệm 10 ml (tùy chọn) hoặc nồi cách thủy (6.6).
Các điều kiện vận hành được khuyến cáo:
- nhiệt độ nồi cách thủy 35 oC.
- áp suất khí nitơ 34,5 kPa
6.6. Nồi cách thủy, đã điều chỉnh ở nhiệt độ 35 oC.
6.7. Cân, có thể đọc được chính xác đến 0,1 mg.
6.8. Ống ly tâm, dung tích 100 ml (mỗi mẫu cho vào một ống).
6.9. Ống ly tâm hình nón, dung tích 11 ml (mỗi mẫu cho vào ba ống), có vách ngăn PTFE và được đậy nắp vặn (mỗi mẫu một nắp vặn).
6.10. Ống đong chia độ, loại A quy định trong TCVN 8488 (ISO 4788)6).
6.11. Microxyranh, dung tích 250 ml.
6.12. Xyranh, dung tích 1 000 ml.
6.13. Pipet chia độ, loại A quy định trong TCVN 7150 (ISO 835)[4], dung tích 5 ml.
6.14. Xyranh, dung tích 5 ml, được trang bị một đầu nối dùng cho cột SPE.
6.15. Lọ (vial) dùng cho bộ lấy mẫu tự động.
6.16. Lọ micro (microvial), dung tích 250 ml, thích hợp để dùng cho hệ thống HPLC.
6.17. Bể siêu âm, có nhiệt độ của nước không lớn hơn 40 oC.
6.18. Pipet pasteur, quy định trong TCVN 7152 (ISO 7712)[7], có nút bông trên đầu để tránh bị nhiễm bẩn.
6.19. Dụng cụ gồm có giá đỡ và kẹp6), để giữ cột SPE hoặc cố định vị trí làm việc của SPE tự động, nếu thích hợp.
CHÚ THÍCH: Tùy thuộc vào cách xử lý mẫu SPE đã sử dụng mà các phương pháp chiết đưa ra có thay đổi chút ít (thời gian, áp suất, thể tích).
6.20. Bình định mức một vạch, loại A, quy định trong TCVN 7153 (ISO 1042)[5], dung tích 50 ml.
7. Lấy mẫu
Mẫu gửi đến phòng thử nghiệm phải là mẫu đại diện. Mẫu không bị hư hỏng hoặc biến đổi trong suốt quá trình vận chuyển hoặc bảo quản
Việc lấy mẫu không quy định trong tiêu chuẩn này. Nên lấy mẫu theo TCVN 2625 (ISO 5555).
8. Chuẩn bị mẫu thử
Chuẩn bị mẫu thử theo TCVN 6128 (ISO 661). Trước khi lấy mẫu, các mẫu dạng lỏng phải ở nhiệt độ phòng và được đồng hóa bằng bộ khuấy từ.
Lấy mẫu nền dạng rắn bằng cách làm nóng chảy toàn bộ mẫu hoặc làm nóng chảy rồi đồng hóa một vài mẫu ở tâm.
9. Quy trình để xác định PAH từ dầu mỡ: Phương pháp chung
9.1. Các lưu ý ban đầu
Để thu được các kết quả lặp lại, thì nhiệt độ môi trường của phòng thử nghiệm phải được điều chỉnh (< 20 °C). Việc điều chỉnh nhiệt độ này là điều kiện rất quan trọng để chiết PAH ra khỏi dầu dừa (hoặc dầu thực vật có chứa các axit béo mạch ngắn). Các loại dầu này có chứa các axit béo mạch ngắn và mạch dài; khi nhiệt độ môi trường cao hơn 20 oC thì độ hòa tan của các axit béo mạch ngắn tăng.
Trước khi sử dụng, rửa toàn bộ bình ba lần bằng hexan (5.2).
Mỗi dãy mẫu phải gồm có một mẫu trắng (9.2) và dung dịch chuẩn chiết được ở cùng điều kiện với mẫu để tính các giá trị độ thu hồi của quá trình chiết (9.3). Các giá trị độ thu hồi phải nằm trong dải từ 70 % đến 110 %. Các giá trị trung bình của độ thu hồi được nêu trong Bảng A.1.
Đổi với phép phân tích định lượng, thì phải chiết và phân tích riêng hai phần mẫu thử, kết quả cuối cùng là giá trị trung bình các kết quả của hai mẫu con này.
Nếu không thể kết thúc phép phân tích trong ngày thì bảo quản dịch chiết mẫu qua đêm trong điều kiện đông lạnh sâu ở nhiệt độ ít nhất là - 18 °C:
- ngày thứ nhất: bước 1, bước 2 và bước 3 tinh sạch trên cột C18 (xem Hình A.1).
- ngày thứ hai: bước 3, tinh sạch trên cột Florisil và chuẩn bị hệ thống HPLC để phân tích mẫu (xem Hình A.1).
- ngày và đêm tiếp theo: phân tích các mẫu (xem Bảng A.2).
9.2. Mẫu trắng
Để đảm bảo dung môi và cột không có chất nhiễm bẩn, thì trước hết tiến hành quy trình tinh sạch (theo 9.5, 9.6 và Điều 11) trên mẫu trắng (mẫu có hỗn hợp dung môi nhưng không có dầu), sắc đồ thu được phải không chứa các hợp chất có liên quan. Nếu sắc đồ thu được có các chất gây nhiễu, thì phải xác định và loại bỏ nguồn gây nhiễu. Các giá trị mẫu trắng không được sử dụng để hiệu chỉnh các giá trị của mẫu thử vì các giá trị mẫu trắng thường không đồng nhất (độ lặp lại).
9.3 .Xác định các giá trị của độ thu hồi (không có nền)
Tiến hành phép thử với dung dịch chuẩn để đánh giá hiệu quả chiết của cột. Dùng xyranh dung tích 250 ml (6.11), pha 1 750 ml hỗn hợp dung môi 1 (5.9) với 250 ml dung dịch chuẩn làm việc (5.15). Chuyển hỗn hợp vào cột C18 và xử lý theo quy định trong 9.5, 9.6 và Điều 11.
CẢNH BÁO - Khi loại bỏ các dung môi dưới dòng khi nitơ (xem 9.5.6), thi không làm bay hơi đến khô mà giữ lại khoảng 50 ml dung môi trong lọ, nếu không PAH bay hơi sẽ bị thất thoát.
9.4. Tách chiết (chiết dạng lỏng/lỏng)
9.4.1. Sơ đồ quy trình tách chiết được nêu trong Bảng A.1.
9.4.2. Cân khoảng 2,5 g mẫu, chính xác đến 1 mg, cho vào trong ống ly tâm 100 ml (6.8). Thêm 10 ml hỗn hợp dung môi 1 (5.9).
9.4.3 Lắc ống ly tâm trong 30 s bằng máy trộn vortex (một nửa tốc độ), rồi sau đó cho ống ly tâm vào bể siêu âm (6.17) trong 5 min.
9.4.4. Ly tâm trong 5 min ở tốc độ 4 000 min-1.
9.4.5. Cẩn thận lấy lớp dung dịch trên cùng bằng pipet Pasteur (6.18) và chuyển lớp dung dịch này vào ống hình nón đã cân (6.9).
9.4.6. Cho bay hơi dung môi ra khỏi ống hình nón trong khoảng từ 30 min đến 40 min, dưới dòng khí nitơ (5.18), cũng có thể sử dụng nồi cách thủy ở nhiệt độ 35 oC (6.6) hoặc bộ cô quay tự động (6.5).
9.4.7. Lặp lại việc chiết hai lần, mỗi lần 10 ml hỗn hợp dung môi 1 (5.9). Cô đặc dịch chiết trong cùng ống hình nón dưới dòng khí nitơ (5.18), dùng nồi cách thùy cài đặt ở nhiệt độ 35 oC (6.6) hoặc dùng bộ cô quay tự động (6.5). Chất béo còn lại phải khoảng từ 200 mg đến 800 mg.
Nếu khối lượng chất béo còn lại cao hơn 800 mg, thì phương pháp chung (Điều 9) là không thích hợp và nên sử dụng phương pháp riêng đối với dầu dừa (Điều 10).
9.5 Tinh sạch trên cột chiết liên kết C18 (chiết dạng rắn/lỏng)
9.5.1. Ổn định cột: Đặt cột (5.16) trên giá đỡ (6.19). Tráng cột bằng metanol (5.1) 2 lần mỗi lần 12 ml. sau đó tráng bằng axetonitril (5.3) 2 lần mỗi lần 12 ml. Để dung môi chảy qua cột dưới áp suất khí quyển.
9.5.2 Đặt ống hình nón đã cân (6.9) dưới cột (5.16).
9.5.3. Dùng xyranh (6.12) hoặc pipet chia độ (6.13), lấy 2 ml hỗn hợp dung môi 1 (5.9) cho vào ống hình nón có chứa chất béo còn lại (9.4.6). Lắc ống bằng máy trộn vortex (6.4) trong 15 s. Ly tâm trong 30 s. Chuyển lớp dung dịch trên cùng vào cột (5.16) bằng pipet Pasteur (6.18). Lặp lại việc chiết hai lần (2 ml hỗn hợp dung môi 1, trộn đều, ly tâm và chuyển lên cột). Thu lấy dung môi giải hấp từ cột cùng với dung môi rửa giải.
9.5.4. Thêm 5 ml hỗn hợp dung môi 1 (5.9) vào phía đỉnh cột (5.16) và tiếp tục rửa giải dưới áp suất khí quyển.
9.5.5. Dùng xyranh (6.14), bơm không khí vào cột để rửa giải dung môi còn lại và tất cả các PAH còn lưu lại trong pha.
9.5.6. Loại bỏ dung môi dưới dòng khí nitơ (5.18) bằng nồi cách thủy cài đặt ở nhiệt độ 35 oC (6.6) hoặc bộ cô quay tự động (6.5). Chất béo còn lại không được quá 50 mg.
9.5.7. Pha loãng phần chất béo còn lại trong 1 ml hexan (5.2) được đong bằng xyranh (6.12). Đậy chặt ống hình nón và bảo quản ở nhiệt độ - 18 oC cho đến khi tiếp tục sử dụng.
9.6. Tinh sạch trên cột chiết liên kết Florisil (chiết dạng rắn/lỏng)
9.6.1 Để cho dịch chiết (9.5.7) ấm đến nhiệt độ môi trường trong ít nhất 1 h.
9.6.2 Ổn định cột: Đặt cột (5.17) trên giá đỡ (6.19). Tráng cột bằng diclometan (5.5) 5 lần, mỗi lần 3 ml, sau đó tráng bằng hexan (5.2) 4 lần mỗi lần 3 ml.
9.6.3. Đặt ống hình nón đã cân (6.9) dưới cột (5.17).
9.6.4. Chuyển dịch chiết (9.5.7) vào cột (5.17) bằng pipet pasteur (6.18).
9.6.5. Dùng xyranh (6.12) hoặc pipet chia độ (6.13), lấy 1 ml hỗn hợp dung môi 3 (5.11) cho vào ống hình nón có chứa dịch chiết. Lắc ống trong 15 s bằng máy trộn vortex rồi chuyển hỗn hợp vào cột (5.17). Tráng ống bằng hỗn hợp dung môi 3 (5.11) 2 lần, mỗi lần 2 ml rồi chuyển dung môi lên cột. Thu lấy dung môi giải hấp từ cột cùng với dung môi rửa giải.
Cẩn thận tránh tiếp xúc giữa pipet và ống hình nón để tránh bị nhiễm bẩn chéo.
9.6.6. Rửa giải 4 ml hỗn hợp dung môi 3 (5.11) qua cột (5.17) Dùng xyranh (6.14). bơm không khí vào cột để rửa giải dung môi còn lại.
9.6.7. Cô đặc dung dịch bằng khí nitơ (5.18) bằng nồi cách thủy cài đặt ở nhiệt độ 35 oC (6.6) hoặc bộ cô quay tự động (6.5) đến khoảng 1 ml (cô đặc từ 10 min đến 15 min). Thêm khoảng 0,5 ml toluen (5.6) (bảo quản) và tiếp tục làm bay hơi cho đến khi còn lại khoảng 50 ml dung môi.
Không để đung môi bay hơi hoàn toàn.
9.6.8. Thể tích của dịch chiết được xác định bằng cách cân ống hình nón rồi tính theo tỷ trọng của toluen. Bổ sung lượng dung môi cần thiết [MeOH/THF (5.12) hoặc axetonitril (5.3)], Vbổsung, đến 250 ml
Vbổsung = 250 - ![]()
Trong đó
m là khối lượng mẫu, tính bằng miligam (mg);
d là tỷ trọng của toluen (0,866 9 kg/m3).
9.6.9. Chuyển mẫu vào lọ micro (6.16) được đặt trong lọ (6.15).
10. Quy trình xác định các PAH từ dầu mỡ: Phương pháp riêng đối với dầu dừa
10.1. Chiết lần thứ nhất (chiết dạng lỏng/lỏng)
10.1.1. Sơ đồ quy trình tách chiết được nêu trong Hình A.2.
10.1.2. Cân khoảng 2 g mẫu, chính xác đến 1 mg, cho vào ống ly tâm 100 ml (6.8). Thêm 10 ml hỗn hợp dung môi 1 (5.9).
10.1.3. Lắc ống ly tâm trong 30 s bằng máy trộn vortex (một nửa tốc độ), sau đó đặt ống vào bể siêu âm (6.17) trong 5 min.
10.1.4. Ly tâm trong 5 min ở tốc độ 4 000 min-1.
10.1.5. Cẩn thận lấy lớp dung môi trên cùng bằng pipet Pasteur (6.18) rồi cho vào ống hình nón (6.9).
10.1.6. Cho bay hơi dung môi ra khỏi ống hình nón trong khoảng từ 30 min đến 40 min bằng dòng khí nitơ (5.18), sử dụng nồi cách thủy cài đặt ở nhiệt độ 35 oC (6.6) hoặc bộ cô quay tự động (6.5).
10.1.7. Lặp lại việc chiết hai lần, mỗi lần 10 ml hỗn hợp dung môi 1 (5.9). Cô đặc dịch chiết trong cùng một ống hình nón dưới dòng khí nitơ (5.18) sử dụng nồi cách thủy cài đặt ở nhiệt độ 35 oC (6.6) hoặc bộ cô quay tự động (6.5).
10.2. Chiết lần thứ hai (chiết dạng lỏng/lỏng)
10.2.1. Dùng xyranh (6.12) hoặc pipet chia độ (6.13), lấy 2 ml hỗn hợp dung môi 1 (5.9) cho vào ống hình nón có chứa chất béo còn lại (10.1.7). Lắc mạnh ống bằng máy trộn vortex trong 15 s. Ly tâm trong 30 s. Chia dịch chiết thành hai phần bằng nhau cho vào trong hai ống hình nón đã cân (6.9).
Cẩn thận trành tiếp xúc giữa pipet và ống hình nón để tránh bị nhiễm bẩn chéo.
10.2.2. Lặp lại hai lần quy trình quy định trong 10.2.1, sử dụng cùng ống hình nón.
10.2.3. Cô đặc hai dịch chiết dưới dòng khí nitơ (5.18), sử dụng nồi cách thủy cài đặt ở nhiệt độ 35 oC hoặc bộ cô quay tự động (6.5). Lượng chất béo còn lại trong mỗi dịch chiết nên khoảng 250 mg.
10.3. Tinh sạch trên cột chiết liên kết C18 (chiết dạng rắn/lỏng)
10.3.1. Ổn định cột: Đặt hai cột (5.16) lên giá đỡ (5.19). Tráng cột bằng metanol (5.1) 2 lần mỗi lần 12 ml, sau đó tráng bằng axetonitril (5.3) 2 lần mỗi lần 12 ml. Để yên dung môi chảy qua cột dưới áp suất khí quyển.
10.3.2 Đặt ống hình nón đã cân (6.9) dưới mỗi cột (5.16).
10.3.3 Dùng xyranh (6.12) hoặc pipet chia độ (6.13), lấy 2 ml hỗn hợp dung môi 2 (5.10) cho vào hai ống hình nón có chứa chất béo còn lại (10.2.3). Lắc ống bằng máy trộn vortex trong 15 s. Chuyển toàn bộ dịch chiết của mỗi ống vào từng cột (5.16) bằng pipet Pasteur (6.18). Tráng ống bằng hỗn hợp dung môi 2 (5.10) 2 lần mỗi lần 2 ml. rồi chuyển hỗn hợp lên trên cột. Thu lấy dung môi giải hấp từ cột cùng với dung môi rửa giải.
10.3.4. Rửa giải 5 ml hỗn hợp dung môi 2 (5.10) qua các cột (không bơm không khí lên cột).
10.3.5. Loại bỏ dung môi dưới dòng khí nitơ (5.18), sử dụng nồi cách thủy cài đặt ở nhiệt độ 35 oC (6.6) hoặc bộ cô quay tự động (6.5). Lượng chất béo còn lại phải từ 50 mg đến 100 mg.
10.3.6 Pha loãng lượng chất béo còn lại trong 1 ml hexan (5.2), được đong bằng xyranh (6.12). Đậy chặt ống hình nón và bảo quản ở nhiệt độ - 18oC đến ngày hôm sau.
10.4. Tinh sạch trên cột chiết liên kết Florisil (chiết dạng rắn/lỏng)
10.4.1. Để cho dịch chiết (10.3.6) ấm đến nhiệt độ môi trường trong ít nhất 1 h.
10.4.2. Ổn định cột: Đặt hai cột (5.17) trên giá đỡ (6.19). Tráng cột bằng diclometan (5.5) 5 lần mỗi lần 3 ml, sau đó tráng bằng hexan (5.2) 4 lần mỗi lần 3 ml.
10.4.3. Đặt ống hình nón đã cân (6.9) dưới mỗi cột (5.17).
10.4.4. Chuyển mỗi dịch chiết (10.3.6) vào từng cột (5.17) bằng pipet Pasteur (6 18).
10.4.5. Dùng xyranh (6.12) hoặc pipet chia độ (6.13), lấy 1 ml hỗn hợp dung môi 3 (5.11) cho vào từng ống chiết. Lắc ống trong 15 s bằng máy trộn vortex rồi chuyển hỗn hợp vào cột (5.17). Tráng ống bằng dung môi 3 (5.11)2 lần mỗi lần 2 ml và chuyển dung môi lên cột. Thu lấy dung môi giải hấp từ cột cùng với dung môi rửa giải.
10.4.6. Rửa giải 4 ml hỗn hợp dung môi 3 (5.11) qua cột (5.17) (không bơm không khí vào cột).
10.4.7. Cô đặc dung dịch dưới dòng khí nitơ (5.18), sử dụng nồi cách thủy cài đặt ở nhiệt độ 35 oC hoặc bộ cô quay tự động (6.5) đến khoảng 1 ml (cô đặc từ 10 min đến 15 min). Thu lấy hai dịch chiết vào cùng một ống hình nón bằng cách chuyển dịch chiết từ ống hình nón này vào ống hình nón kia. Tráng ống hình nón rỗng bằng hexan (5.2) 3 lần mỗi lần 1 ml. Thêm khoảng 0,5 ml toluen (5.6) (bảo quản) bằng xyranh (6.12) và tiếp tục làm bay hơi đến khoảng 50 ml.
Không nên loại bỏ hết dung môi.
10.4.8. Thể tích của dịch chiết được xác định bằng cách cân ống hình nón rồi tính theo tỷ trọng của toluen. Bổ sung lượng dung môi cần thiết (MeOH/THF (5.12) hoặc axetonitril (5.3)], Vbổsung, đến 200 ml
Vbổsung = 250 - ![]()
Trong đó
m là khối lượng mẫu, tính bằng miligam (mg);
d là tỷ trọng của toluen (0,866 9 kg/m3).
10.4.9. Chuyển mẫu vào lọ micro (6.16) được đặt trong lọ (6.15).
11. Phân tích sắc ký lỏng hiệu năng cao (HPLC)
11.1. Điều kiện vận hành
| Pha động: | Hỗn hợp dung môi A: axetonitril Hỗn hợp dung môi B: axetonitril/nước (50:50 thể tích) |
| Tốc độ dòng: | 1,2ml/min |
| Thể tích bơm: | 20 ml |
| Nhiệt độ cột: | 25 oC |
Ví dụ về chương trình rửa giải dung môi được nêu trong Bảng 1. Chương trình gradient rửa giải dung môi cần được thay đổi theo cột được sử dụng.
Bảng 1 – Chương trình gradient rửa giải trên cột pha đảo C18
| Thời gian min | Hỗn hợp dung môi A % | Hỗn hợp dung môi B % |
| 0 | 0 | 100 |
| 5 | 0 | 100 |
| 27 | 60 | 40 |
| 36 | 100 | 0 |
| 41 | 100 | 0 |
| 43 | 0 | 100 |
| 45 | 0 | 100 |
11.2. Thông số phát hiện
Phổ kích thích và phổ phát xạ có thể thay đổi nhẹ theo các thiết bị khác nhau. Để xác định bước sóng kích thích và bước sóng phát xạ cực đại thì phổ của mỗi hợp chất phải được thu nhận từ dung dịch chuẩn làm việc 16 PAH (5.15) như sau.
- Trước tiên, xác định bước sóng phát xạ cực đại bằng cách quét tại bước sóng kích thích tùy chọn trong khoảng từ 300 nm đến 550 nm (xem Bảng 2);
- Sau đó, xác định bước sóng kích thích cực đại bằng cách quét tại bước sóng phát xạ xác định được trước đó từ 200 nm đến 350 nm.
Đối với mỗi nhóm trong bảy nhóm hợp chất (xem Bảng 2) có thời gian lưu gần nhau, chọn một tập hợp các bước sóng kích thích/phát xạ càng gần với bước sóng cực đại của mỗi hợp chất càng tốt.
Ví dụ, lựa chọn bước sóng thu được với máy đo huỳnh quang HP 1100 được nêu trong Bảng 2.
Bảng 2 – Chương trình phát hiện
| Nhóm | Thành phần | Thời gian min | Bước sóng kích thích nm | Bước sóng phát xạ nm |
| 1 | Naphatalen Acenaphten floren | 0 | 270 | 324 |
| 2 | Phenantren Antraxen | 12,6 | 248 | 375 |
| 3 | Floranten | 16,4 | 280 | 462 |
| 4 | Pyren Benz(a)antraxen Chrysen | 18,05 | 270 | 385 |
| 5 | Benzo(b)floranten | 28,0 | 256 | 446 |
| 6 | Benzo(k)floranten Benzo(a)floranten Dibenz(a,h)antraxen Benzo(g,h,i)pyren | 31,1 | 292 | 410 |
| 7 | lndeno(1,2,3-c,d)pyren | 38,0 | 274 | 507 |
Ở các điều kiện này thì thu được sắc đồ trong Hình 1 đối với dung dịch chuẩn 16 PAH.
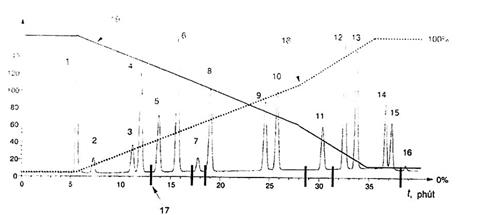
| 1 Toluen | 11 Benzo(b)floranten |
| 2 Naphtalen | 12 Benzo(k)floranten |
| 3 Axenaphten | 13 Benzo(a)pyren |
| 4 Floren | 14 Dibenz(a,h)antraxen |
| 5 Phenantren | 15 Benzo(g,h,i)perylen |
| 6 Antraxen | 16 Indeno(1,2,3-c,d)pyren |
| 7 Floranten | 17 vị trí bước sóng thay đổi |
| 8 Pyren | 18 hỗn hợp dung môi A (axetonitril) |
| 9 Benz(a)antraxen | 19 hỗn hợp dung môi B (axetonitril/nước tỷ lệ 50/50 thể tích) |
| 10 Chrysen |
|
Hình 1 - Sắc đồ của dung dịch chuẩn làm việc (5.15)
11.3. Phép phân tích mẫu và dung dịch chuẩn
Mẫu và dung dịch chuẩn phải được bơm ít nhất hai lần. Độ lệch chuẩn tương đối của diện tích đối với hai lần bơm của cùng một mẫu không vượt quá 5 %. Nếu độ lệch chuẩn vượt quá 5 %, thì cần tối ưu hóa các điều kiện HPLC, mẫu và các dung dịch chuẩn nên được bơm vào lần thứ hai.
Trình tự bơm như sau:
a) dung dịch chuẩn (5.15);
b) dung dịch chuẩn tách chiết được (xem 9.3);
c) mẫu.
Ví dụ, chi tiết trình tự bơm được nêu trong Bảng A.2.
PAH có trong mẫu được xác định bằng cách so sánh thời gian lưu sắc đồ của mẫu với thời gian lưu gần nhất của sắc đồ mẫu đối chứng. Sắc đồ được nêu trong Hình A.3 thu được đối với mẫu dầu oliu nguyên chất.
11.4. Phép thử khẳng định sự có mặt của PAH
Ngoài ra, bơm mỗi mẫu thêm hai lần nữa: một lần để ghi lại phổ phát xạ của từng hợp chất và một lần để ghi lại phổ kích thích. Việc ghi lại phổ của từng hợp chất cho phép khẳng định sự có mặt của các hợp chất cần phân tích bằng cách so sánh phổ của chúng với phổ đối chứng.
12. Biểu thị kết quả
Trước khi tính, kiểm tra các điểm sau:
- chất lượng mẫu trắng;
- độ lệch chuẩn tương đối giữa hai lần bơm cùng một mẫu (không được vượt quá 5 %);
- phần trăm độ thu hồi của từng PAH (9.3 và Bảng A.1).
Thực hiện việc tính kết quả bằng phương pháp chuẩn ngoại.
Tính hàm lượng ci của PAH trong mẫu, bằng microgam trên kilogam:
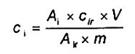
Trong đó
Ai là diện tích pic (trung bình hai lần bơm) của mỗi PAH trong dung dịch mẫu;
Air là diện tích pic (trung bình hai lần bơm) của mỗi PAH trong dung dịch chuẩn làm việc (5.15);
cir là nồng độ của mỗi PAH trong dung dịch chuẩn làm việc (5.15), tính bằng microgam trên kilogam (mg/kg);
V là thể tích của dịch chiết cuối, tính bằng mililit (ml);
m là khối lượng của mẫu, tính bằng gam (g).
Đối với phép phân tích định lượng, thì mỗi mẫu phải được chiết hai lần. Hàm lượng của mỗi PAH được tính bằng trung bình của hai giá trị thu được, được biểu thị chính xác đến 0,1 mg/kg.
13. Độ chụm
13.1. Phép thử liên phòng thử nghiệm
Các kết quả phép thử liên phòng thử nghiệm về độ chụm của phương pháp được nêu trong Phụ lục B.
Giá trị giới hạn lặp lại và giá trị giới hạn tái lập được tính chính xác khoảng 95 % và có thể không áp dụng cho các dải nồng độ và chất nền khác với các dải nồng độ và chất nền đã nêu.
13.2. Độ lặp lại
Chênh lệch tuyệt đối giữa hai kết quả thử riêng rẽ độc lập thu được khi sử dụng cùng một phương pháp, trên vật liệu thử giống hệt nhau, trong cùng một phòng thử nghiệm, do cùng một người thao tác, sử dụng cùng thiết bị, trong cùng một khoảng thời gian ngắn, không được quá 5 % các trường hợp lớn hơn giới hạn lặp lại r được tính từ bảng sau.
| Nồng độ PAH đơn lẻ, c (mg/kg) | từ 0 mg/kg đến 10 mg/kg | từ 10 mg/kg đến 100 mg/kg |
| Giới hạn lặp lại, r (mg/kg) | 0,37 x c | 0,12 x c + 3,7 |
Trong đó c là trung bình của hai kết quả thử nghiệm, tính bằng microgam trên kilogam.
13.3 Độ tái lập
Chênh lệch tuyệt đối giữa hai kết quả thử riêng rẽ thu được khi sử dụng cùng một phương pháp, trên vật liệu thử giống hệt nhau, trong các phòng thử nghiệm khác nhau, do những người thao tác khác nhau, sử dụng thiết bị khác nhau, không được quá 5 % các trường hợp lớn hơn giới hạn tái lập R được tính từ bảng sau.
| Nồng độ PAH đơn lẻ, c (mg/kg) | từ 0 mg/kg đến 10 mg/kg | từ 10 mg/kg đến 40 mg/kg | từ 10 mg/kg đến 100 mg/kg |
| Giới hạn tái lập, R (mg/kg) | 1,1 x c | 0,86 x c + 1,5 | 40 mg /kg |
Trong đó c là trung bình của hai kết quả thử nghiệm, tính bằng microgam trên kilogam.
14. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải ghi rõ:
a) mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
b) phương pháp thử đã sử dụng, viện dẫn tiêu chuẩn này;
c) mọi chi tiết thao tác không quy định trong tiêu chuẩn này hoặc tùy chọn cũng như các sự cố bất kỳ có thể ảnh hưởng đến kết quả thử nghiệm;
d) các kết quả thử nghiệm và đơn vị biểu thị;
e) giá trị độ thu hồi của từng PAH.
PHỤ LỤC A
(Tham khảo)
Các giá trị độ thu hồi, sơ đồ, sắc đồ và trình tự bơm
Bảng 1 - Giá trị độ thu hồi trung bình của hydrocacbon đa vòng trong dầu
| Hợp chất | Phương pháp chung | Phương pháp đối với dầu dừa |
| Phenantren | > 70 % | > 70 % |
| Antraxen | > 70 % | > 70 % |
| Floranten | > 70 % | > 70 % |
| Pyren | > 70 % | > 70 % |
| Benz(a)antraxen | > 70 % | > 70 % |
| Chrysen | > 70 % | > 70 % |
| Benzo(b)floranten | > 70 % | > 70 % |
| Benzo(k)floranten | > 70 % | > 70 % |
| Benzo(a)pyren | > 70 % | > 60 % |
| Dibenzo(a,h)antraxen | >70% | > 60 % |
| Benzo(g,h,i)perylen | > 60 % | > 50 % |
| Indeno (1,2,3-c,d)pyren | > 70 % | > 50 % |
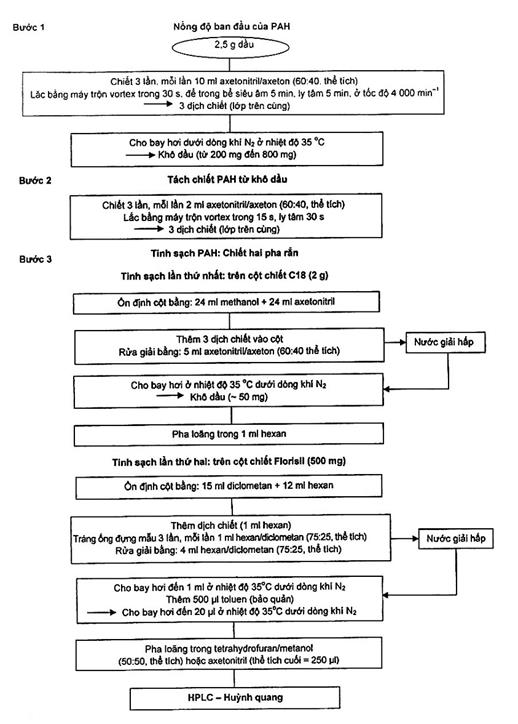
Hình A.1 – Sơ đồ quy trình tách chiết: Phương pháp chung
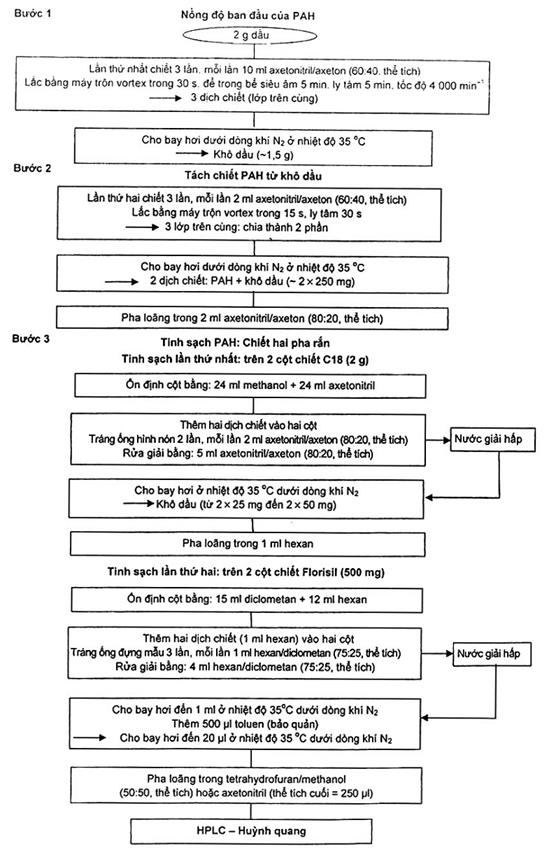
Hình A.2 – Sơ đồ quy trình tách chiết: Phương pháp quy định đối với dầu dừa
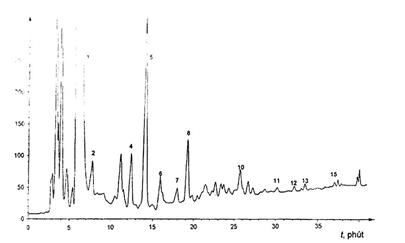
| CHÚ DẪN |
|
|
|
|
| |
| 1 | Toluen | (dung môi) |
| 9 | Benz(a)antraxen | nd |
| 2 | Naphtalen | (10,2 mg/kg) |
| 10 | Chrysen | (1,0 mg/kg) |
| 3 | Axenaphten | nd |
| 11 | Benzo(b)floranten | (0,4 mg/kg) |
| 4 | Floren | (2,2 mg/kg) |
| 12 | Benzo(k)floranten | (0,2 mg/kg) |
| 5 | Phenantren | (15,2 mg/kg) |
| 13 | Benzo(a)pyren | (0,2 mg/kg) |
| 6 | Antraxen | (1,4 mg/kg) |
| 14 | Dibenz(a,h)antraxen | nd |
| 7 | Floranten | (4,2 mg/kg |
| 15 | Benzo(g,h,i)perylen | (0,4 mg/kg) |
| 8 | Pyren | (4,3 mg/kg |
| 16 | lndeno(1,2,3-c,d)pyren | nd |
| nd = không phát hiện được |
|
|
|
| ||
Hình A.3 - Sắc đồ của mẫu dầu oliu nguyên chất
Bảng A.2 – Trình tự bơm HPLC
| Số thứ tự | Lọ | Số lần bơm | Phương pháp thu nhận |
| Phép xác định hàm lượng PAH | |||
| 1 | Tetrahydrofuran/methanol (50:50, thể tích) | 1 | Bước sóng quy định |
| 2 | Mẫu trắng (9.2) | 1 | Bước sóng quy định |
| 3 | Dung dịch chuẩn, 50 ng/ml (5.15) | 2 | Bước sóng quy định |
| 4 | Dung dịch chuẩn chiết được (9.3) | 2 | Bước sóng quy định |
| 5 | Mẫu 1 | 2 | Bước sóng quy định |
| 6 | Dung dịch chuẩn, 50 ng/ml (5.15) | 2 | Bước sóng quy định |
| 7 | Mẫu 2 | 2 | Bước sóng quy định |
| 8 | Mẫu 3 | 2 | Bước sóng quy định |
| 9 | Dung dịch chuẩn, 50 ng/ml (5.15) | 2 | Bước sóng quy định |
| 10 | Mẫu 4 | 2 | Bước sóng quy định |
| 11 | Mẫu 5 | 2 | Bước sóng quy định |
| 12 | Dung dịch chuẩn, 50 ng/ml (5.15) | 2 | Bước sóng quy định |
| 13 | Mẫu 6 | 2 | Bước sóng quy định |
| 14 | Mẫu 7 | 2 | Bước sóng quy định |
| 15 | Dung dịch chuẩn, 50 ng/ml (5.15) | 2 | Bước sóng quy định |
|
| Tổng thời gian phân tích | 23 h |
|
| Phép khẳng định sự có mặt của PAH | |||
| 1 | Mẫu 1 | 1 | Phát xạ |
| 2 | Mẫu 2 | 1 | Phát xạ |
| 3 | Mẫu 3 | 1 | Phát xạ |
| 4 | Mẫu 4 | 1 | Phát xạ |
| 5 | Mẫu 5 | 1 | Pháỉ xạ |
| 6 | Mẫu 6 | 1 | Phát xạ |
| 7 | Mẫu 7 | 1 | Phát xạ |
| 8 | Mẫu 1 | 1 | Kích thích |
| 9 | Mẫu 2 | 1 | Kích thích |
| 10 | Mẫu 3 | 1 | Kích thích |
| 11 | Mẫu 4 | 1 | Kích thích |
| 12 | Mẫu 5 | 1 | Kích thích |
| 13 | Mẫu 6 | 1 | Kích thích |
| 14 | Mẫu 7 | 1 | Kích thích |
Phụ lục B
(Tham khảo)
Các kết quả của phép thử liên phòng thử nghiệm
Phép thử liên phòng thử nghiệm ở cấp quốc tế đã được ITERG (Pháp) tổ chức thực hiện vào năm 2002/2003, trong đó có 19 phòng thử nghiệm tham gia, với mỗi mẫu mỗi phòng thu được hai kết quả thử, cho các kết quả thống kê [được đánh giá phù hợp với TCVN 6910-2 (ISO 5725-2)] nêu trong Bảng B. 1.
Bảng B.1 - Các kết quả của phép thử liên phòng thử nghiệm
| Mã số | PAH | Số phòng thử nghiệm | Trung bình | sr | RSD(r) | r | SR | RSD(R) | R |
| A | Phenatren | 15 | 39,95 | 4,96 | 12,4 % | 13,89 | 13,27 | 33,2 % | 37,15 |
| A | Antraxen | 15 | 31,60 | 3,47 | 11,0% | 9,71 | 10,56 | 33,4 % | 29,55 |
| A | Floranten | 13 | 49,70 | 3,57 | 7,2 % | 9,99 | 13,68 | 27,5 % | 38,31 |
| A | Pyren | 13 | 70,36 | 4,67 | 6,6% | 13,07 | 23,47 | 33,4 % | 65,71 |
| A | Bezo[a]antraxen | 15 | 30,64 | 2,21 | 7,2 % | 6,20 | 9,56 | 31,2% | 26,78 |
| A | Chrysen | 15 | 34,34 | 2,39 | 6,9 % | 6,68 | 10,23 | 29,8 % | 28,63 |
| A | Benzo[b]floranten | 15 | 26,00 | 2,25 | 8,7 % | 6,30 | 8,61 | 33,1 % | 24,11 |
| A | Benzo[k]floranten | 14 | 20,23 | 1,23 | 6,1 % | 3,44 | 6,76 | 33,4 % | 18,94 |
| A | Benzo[a]pyren | 12 | 18,19 | 1,23 | 6,8 % | 3,44 | 4,44 | 24,4 % | 12,42 |
| A | Dibenzo[a, h]antraxen | 15 | 18,78 | 2,46 | 13,1 % | 6,88 | 7,24 | 38,5 % | 20,27 |
| A | Benzo[g,h,i]perylen | 13 | 11,63 | 1,56 | 13,5% | 4,38 | 4,11 | 35,3 % | 11,51 |
| A | Indeno[1,2,3-c,d]pyren | 14 | 12,91 | 2,88 | 22,3 % | 8,06 | 5,93 | 45,9 % | 16,61 |
| B | Phenantren | 17 | 82,57 | 4,08 | 4,9 % | 11,42 | 13,94 | 16,9 % | 39,02 |
| B | Antraxen | 17 | 74,72 | 3,93 | 5,3 % | 10,99 | 14,30 | 19,1 % | 40,05 |
| B | Floranten | 17 | 83,18 | 3,43 | 4,1 % | 9,60 | 14,23 | 17,1 % | 39,83 |
| B | Pyren | 17 | 112,81 | 8,25 | 7,3 % | 23,09 | 18,82 | 16,7 % | 52,69 |
| B | Benzo[a]antraxen | 17 | 70,47 | 3,75 | 5,3 % | 10,51 | 11,62 | 16,5 % | 32,54 |
| B | Chrysen | 16 | 80,96 | 4,77 | 5,9 % | 13,35 | 13,97 | 17,3 % | 39,11 |
| B | Benzo[b]floranten | 17 | 68,95 | 4,04 | 5,9 % | 11,30 | 13,32 | 19,3 % | 37,30 |
| B | Benzo[k]floranten | 17 | 55,95 | 2,72 | 4,9 % | 7,62 | 9,80 | 17,5% | 27,45 |
| B | Benzo[a]pyren | 17 | 57,78 | 3,95 | 6,8 % | 11,07 | 12,61 | 21,8% | 35,30 |
| B | Dibenzo[a, h]antraxen | 17 | 48,92 | 3,46 | 7,1 % | 9,69 | 14,43 | 29,5 % | 40,40 |
| B | Benzo[g,h,i]perylen | 17 | 41,99 | 3.05 | 7,3 % | 8,53 | 16,01 | 38,1 % | 44,82 |
| B | lndeno[1,2,3-c,d]pyren | 15 | 45,11 | 5,77 | 12,8 % | 16,15 | 18,00 | 39,9 % | 50,39 |
| C | Phenantren | 17 | 7,67 | 0,72 | 9,4 % | 2,01 | 5,35 | 69,8 % | 14,98 |
| C | Antraxen | 15 | 3,59 | 0,58 | 16,1 % | 1,62 | 0.86 | 23,9 % | 2,40 |
| C | Floranten | 15 | 4,52 | 0,85 | 18,9% | 2,39 | 0,98 | 21,6% | 2,73 |
| C | Pyren | 15 | 6,12 | 0,80 | 13,0% | 2,23 | 1,19 | 19,4% | 3,33 |
| C | Benzo[a]antraxen | 16 | 3,79 | 0,53 | 13,9% | 1,47 | 0,77 | 20,4 % | 2,16 |
| C | Chrysen | 15 | 4,28 | 0,64 | 15,0% | 1,80 | 0,97 | 22,6 % | 2,71 |
| C | Benzo[b]floranten | 16 | 3,58 | 0,54 | 15,2 % | 1,52 | 1,00 | 27,8 % | 2,79 |
| C | Benzo[k]floranten | 14 | 2,55 | 0,41 | 16,2% | 1,16 | 0,46 | 18,1 % | 1,29 |
| C | Benzo[a]pyren | 17 | 3,21 | 0,40 | 12,3 % | 1,11 | 1,35 | 42,1 % | 3,78 |
| C | Dibenzo[a, h]antraxen | 16 | 2,25 | 0,36 | 16,0 % | 1,01 | 1,08 | 48,1 % | 3,03 |
| C | Benzo[g,h,i]perylen | 16 | 1,86 | 0,32 | 17,1 % | 0,89 | 0,86 | 48,3 % | 2,41 |
| C | Indeno[1,2,3-c,d]pyren | 15 | 1,98 | 0,34 | 17,3 % | 0,96 | 1,01 | 51,2 % | 2,84 |
| D | Phenantren | 18 | 5,48 | 1,77 | 32,3 % | 4,96 | 5,07 | 92,5 % | 14,20 |
| D | Antraxen | - | - | - | - | - | - | - | - |
| D | Floranten | 15 | 0,61 | 0,18 | 29,3 % | 0,50 | 0,40 | 65,6 % | 1,12 |
| D | Pyren | 16 | 0,88 | 0,25 | 28,8 % | 0,71 | 0,61 | 69,0 % | 1,70 |
| D | Benzo[a]antraxen | - | - | - | - | - | - | - | - |
| D | Chrysen | 13 | 0,22 | 0,04 |
|
|
|
|
|
| D | Benzo[b]floranten | - | - | - | - | - | - | - | - |
| D | Benzo[k]floranten | - | - | - | - | - | - | - | - |
| D | Benzo[a]pyren | - | - | - | - | - | - | - | - |
| D | Dibenzo[a, h]antraxen | 13 | 0,03 | 0,03 | 10,7 % | 0,09 | 0,37 | 123,8 % | 1,04 |
| D | Benzo[g,h,i]perylen | 12 | 0,10 | 0,10 | 35,7 | 0,27 | 0,59 | 216,9 % | 1,64 |
| D | lndeno[1,2,3-c,d]pyren | - | - | - | - | - | - | - | - |
| E | Phenantren | 16 | 14,55 | 1,60 | 11,0% | 4,48 | 6,09 | 41,8 % | 17,04 |
| E | Antraxen | 15 | 1,08 | 0,24 | 22,2% | 0,67 | 0,43 | 39,7 % | 1,20 |
| E | Floranten | 15 | 4,10 | 0,48 | 11,6 % | 1,33 | 1,19 | 28,9 % | 3,32 |
| E | Pyren | 15 | 3,69 | 0,51 | 13,9 % | 1,44 | 1,00 | 27,1 % | 2,80 |
| E | Benzo[a]antraxen | 15 | 0,41 | 0,13 | 30,5 % | 0,35 | 0,40 | 97,6 % | 1,12 |
| E | Chrysen | 15 | 1,17 | 0,13 | 11,0 % | 0,36 | 0,43 | 36,6 % | 1,20 |
| E | Benzo[b]floranten | 16 | 0,40 | 0,06 | 16,1 % | 0,18 | 0,31 | 77,7 % | 0,87 |
| E | Benzo[k]floranten | - | - | - | - | - | - | - | - |
| E | Benzo[a]pyren | 17 | 0,32 | 0,04 | 11,2 % | 0,10 | 0,30 | 94,9 % | 0,85 |
| E | Dibenzo[a, h]antraxen | - | - | - | - | - | - | - | - |
| E | Benzo[g,h,i]perylen | - | - | - | - | - | - | - | - |
| E | lndeno[1,2,3-c,d]pyren | - | - | - | - | - | - | - | - |
| F | Phenantren | 16 | 5,03 | 0,76 | 15,2 % | 2,14 | 5,42 | 107,7 % | 15,17 |
| F | Antraxen | 13 | 0,27 | 0,06 | 21,2 % | 0,16 | 0,31 | 116,4 % | 0,88 |
| F | Floranten | 13 | 1,63 | 0,36 | 22,1 % | 1,01 | 0,93 | 57,0 % | 2,60 |
| F | Pyren | 17 | 4,52 | 0,87 | 19,2 % | 2,43 | 4,32 | 95,6 % | 12,10 |
| F | Benzo[a]antraxen | 15 | 2,50 | 0,32 | 12,9 % | 0,90 | 2,79 | 111,6 % | 7,81 |
| F | Chrysen | 14 | 5,36 | 0,42 | 7,9 % | 1,18 | 4,86 | 90,7 % | 13,61 |
| F | Benzo[b]floranten | 11 | 0,64 | 0,13 | 20,1 % | 0,36 | 0,95 | 149,0 % | 2,67 |
| F | Benzo[k]floranten | 15 | 1,07 | 0,20 | 19,0 % | 0,57 | 1,15 | 107,8 % | 3,23 |
| F | Benzo[a]pyren | 12 | 0,36 | 0,08 | 21,8 % | 0,22 | 0,53 | 145,8 % | 1,47 |
| F | Dibenzo[a, h]antraxen | 16 | 1,26 | 0,71 | 56,7 % | 2,00 | 1,62 | 128,4 % | 4,53 |
| F | Benzo[g,h,i]perylen | 14 | 0,78 | 0,18 | 22,9 % | 0,50 | 0,97 | 124,1 % | 2,71 |
| F | lndeno[1,2,3-c,d]pyren | - | - | - | - | - | - | - | - |
| G | Phenantren | 14 | 3192 | 258 | 8,1 % | 721 | 948 | 29,7 % | 2653 |
| G | Antraxen | 14 | 413 | 58 | 14,1 % | 163 | 225 | 54,6 % | 631 |
| G | Floranten | 13 | 966 | 101 | 10,5 % | 284 | 324 | 33,5 % | 906 |
| G | Pyren | 15 | 903 | 86 | 9,5 % | 240 | 284 | 31,4 % | 794 |
| G | Benzo[a]antraxen | 14 | 247 | 23 | 9,1 % | 63 | 134 | 54,2 % | 375 |
| G | Chrysen | 12 | 441 | 16 | 3,7 % | 46 | 160 | 36,3 % | 448 |
| G | Benzo[b]floranten | 15 | 136 | 11 | 8,1 % | 31 | 43 | 31,3 % | 119 |
| G | Benzo[k]floranten | 15 | 42 | 5 | 11,9 % | 14 | 12 | 28,1 % | 33 |
| G | Benzo[a]pyren | 15 | 112 | 13 | 11,5 % | 36 | 33 | 29,7 % | 93 |
| G | Dibenzo[a, h]antraxen | 13 | 15 | 2 | 12,8 % | 5 | 12 | 79,9 % | 33 |
| G | Benzo[g,h,i]perylen | 14 | 68 | 11 | 16,3 % | 31 | 31 | 46,2 % | 88 |
| G | lndeno[1,2,3-c,d]pyren | 13 | 29 | 6 | 22,2 % | 18 | 31 | 108,4 % | 88 |
| H | Phenantren | 15 | 3,54 | 0,36 | 10,2 % | 1,01 | 2,70 | 76,2 % | 755 |
| H | Antraxen | 15 | 0,87 | 0,15 | 16,8 % | 0,41 | 0,25 | 29,1 % | 0,71 |
| H | Floranten | 13 | 1,10 | 0,13 | 12,0 % | 0,37 | 0,30 | 27,6 % | 0,85 |
| H | Pyren | 16 | 1,69 | 0,29 | 16,9 % | 0,80 | 0,90 | 53,3 % | 2,52 |
| H | Benzo[a]antraxen | 16 | 0,96 | 0,11 | 11,5 % | 0,31 | 0,36 | 37,6 % | 101 |
| H | Chrysen | 13 | 0,93 | 0,11 | 11,5 % | 0,30 | 0,23 | 24,2 % | 0,63 |
| H | Benzo[b]floranten | 17 | 0,95 | 0,13 | 13,2 % | 0,35 | 0,40 | 42,5 % | 1,13 |
| H | Benzo[k]floranten | 17 | 0,76 | 0,08 | 10,3 % | 0,22 | 0,38 | 50,3 % | 1,07 |
| H | Benzo[a]pyren | 15 | 0,64 | 0,07 | 10,6 % | 0,19 | 0,16 | 25,7 % | 0,46 |
| H | Dibenzo[a, h]antraxen | 17 | 0,50 | 0,08 | 15,7 % | 0,22 | 0,27 | 53,6 % | 0,75 |
| H | Benzo[g,h,i]perylen | 16 | 0,53 | 0,11 | 21,6 % | 0,32 | 0,38 | 70,8 % | 1,05 |
| H | lndeno[1,2,3-c,d]pyren | - | - | - | - | - | - | - | - |
| MẪU A: dầu dừa tinh luyện được thêm chuẩn bằng hỗn hợp PAH ở nồng độ trung bình (~ 50 (mg/kg) MẪU B: dầu oliu nguyên chất được thêm chuẩn bằng hỗn hợp PAH ở nồng độ cao (~100 (mg/kg) Mẫu C: dầu hạt hướng dương tinh luyện được thêm chuẩn bằng hỗn hợp PAH ở nồng độ thấp (~ 50 (mg/kg) Mẫu D: dầu hạt cải tinh luyện, không được thêm chuẩn Mẫu E: dầu oliu nguyên chất, không được thêm chuẩn Mẫu F: bã dầu oliu tinh luyện, không được thêm chuẩn Mẫu G: bã dầu oliu thô, không được thêm chuẩn Mẫu H: dầu hạt hướng dương tinh luyện được thêm chuẩn bằng hỗn hợp PAH ở nồng độ thấp (~ 1 mg/kg) Số phòng thử nghiệm: số lượng phòng thử nghiệm được giữ lại sau khi loại trừ các ngoại lệ Trung bình: Giá trị trung bình (mg/kg mẫu) sr: Độ lệch chuẩn lặp lại (mg/kg) sR: Độ lệch chuẩn tái lập (mg/kg) RSD(r): Độ lệch chuẩn tương đối lặp lại (%) RSD(R): Độ lệch chuẩn tương đối tái lập (%) r: Giới hạn lặp lại (2,8 x sr) R: Giới hạn tái lập (2,8 x sR) -: vượt quá 50 % dữ liệu ban đầu dưới giới hạn định lượng, nên các kết quả không được xử lý | |||||||||
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] TCVN 2625:2007 (ISO 5555:2001). Dầu mỡ động vật và thực vật - Lấy mẫu.
[2] TCVN 6910-1:2001 (ISO 5725-1:1994), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo - Phần 1: Định nghĩa và nguyên tắc chung.
[3] TCVN 6910-2:2001 (ISO 5725-2:1994), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo – Phần 2: Phương pháp cơ bản xác định độ lặp lại và độ tái lập của phương pháp đo tiêu chuẩn.
[4] TCVN 7150 (ISO 835), Dụng cụ thí nghiệm bằng thủy tinh - Pipet chia độ.
[5] TCVN 7153 (ISO 1042), Dụng cụ thí nghiệm bằng thủy tinh - Bình định mức.
[6] TCVN 8488 (ISO 4788), Dụng cụ thí nghiệm bằng thủy tinh - Ống đong chia độ.
[7] TCVN 7152 (ISO 7712), Dụng cụ thí nghiệm bằng thủy tinh - Pipet Pasteur sử dụng một lần.
1) Các thuốc thử có thể có được từ, ví dụ Baker.
Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn, còn tiêu chuẩn này không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu chúng cho kết quả tương đương.
2) Dung dịch này có thể có được từ, ví dụ Promochem.
3) Vật liệu này có thể có được từ, ví dụ Varian. Thông tin này đưa ra để tạo thuận lợi cho người sử dụng tiêu chuẩn, còn tiêu chuẩn này không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu chúng cho kết quả tương đương.
4) Thiết bị này có thể có được từ, ví dụ Vydac, ref 201 TP54.
5) Thiết bị này có thể có được từ, ví dụ Zymark, Zymark TurboVap LV evaporator.
6) Dụng cụ này có thể cỏ được từ, vi dụ Zymark, Zymark Rapid Trace.
Thông tin này được đưa ra tạo thuận tiện cho ngưởi sử dụng tiêu chuẩn, còn tiêu chuẩn này không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu chúng cho kết quả tương đương.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 9531:2012 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 9531:2012 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 9531:2012 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 9531:2012 DOC (Bản Word)