- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 8974:2011 Xác định vitamin K1 trong thực phẩm bằng sắc ký lỏng
| Số hiệu: | TCVN 8974:2011 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2011 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 8974:2011
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 8974:2011
TIÊU CHUẨN QUỐC GIA
TCVN 8974:2011
THỰC PHẨM - XÁC ĐỊNH VITAMIN K1 BẰNG SẮC KÝ LỎNG HIỆU NĂNG CAO (HPLC)
Foodstuffs - Determination of Vitamin K1 by high perfomance liquid chromatography (HPLC)
1. Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp xác định vitamin K1 trong thực phẩm bằng sắc ký lỏng hiệu năng cao (HPLC). Hàm lượng vitamin K1 được xác định bằng cách đo phylloquinon đã bị khử. Phương pháp này đã được đánh giá đối với sữa và thức ăn công thức dành cho trẻ sơ sinh, tuy nhiên kinh nghiệm của phòng thử nghiệm cho thấy phương pháp này cũng có thể áp dụng được cho các loại thực phẩm khác [10].
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm các sửa đổi, bổ sung (nếu có).
TCVN 4851 (ISO 3696), Nước dùng để phân tích trong phòng thí nghiệm - Yêu cầu kỹ thuật và phương pháp thử.
3. Nguyên tắc
Sau khi loại chất béo ra khỏi mẫu bằng phương pháp enzym, hàm lượng vitamin K1 có trong dung dịch mẫu thích hợp được xác định bằng sắc ký lỏng hiệu năng cao kết hợp với phản ứng khử sau cột, sau đó phát bằng đo huỳnh quang. Các đồng phân vitamin K1 được định lượng như một pic không phân giải cột C18 [1] đến [4].
4. Thuốc thử
4.1. Yêu cầu chung
Trong quá trình phân tích, chỉ sử dụng các thuốc thử loại tinh khiết phân tích và nước sử dụng là nước cất hoặc ít nhất là loại 1 của TCVN 4851 (ISO 3696), trừ khi có quy định khác.
4.2. Hóa chất và dung dịch
4.2.1. Metanol, w(CH3OH) ³ 99,8 % khối lượng.
4.2.2. Etanol, j (C2H5OH) ³ 99,8 % thể tích.
4.2.3. Thuốc thử ancol, (C2H2OH) = 95 %
Trộn 950 ml etanol (4.2.2) với 50 ml metanol (4.2.1).
4.2.4. Diclometan, w(C6H4) ³ 99,5 %.
4.2.5. n-Hexan, w(C6H14) ³ 97 %.
4.2.6. Dầu nhẹ, có điểm sôi trong dải từ 35 oC đến 60 oC, loại tinh khiết phân tích.
4.2.7. Kali hydroxit, w(KOH) ³ 85 %.
4.2.8. Dung dịch kali hydroxit, nồng độ chất c(KOH) = 10 mol/l.
4.2.9. Kali dihydro phosphat w(KH2PO4) ³ 99,5 %.
4.2.10. Kali cacbonat, w(K2CO3) ³ 99,9 %.
4.2.11. Natri axetat, khan, w(CH3COONa) ³ 99,5 %.
4.2.12. Axit axetic, w(CH3COOH) ³ 99,8 %.
4.2.13. Kẽm clorua, w(ZnCl2) ³ 98 %.
4.2.14. Kẽm dạng bột, cỡ hạt < 63 mm, w(Zn) ³ 97 %.
4.2.15. Dung dịch đệm phosphat, pH từ 7,9 đến 8,0
Hòa tan 54,0 g kali hydro phosphat (4.2.9) trong khoảng 350 ml nước, chỉnh pH 7,9 đến 8,0 bằng dung dịch kali hydroxit (4.2.8) và pha loãng đến 500 ml bằng nước.
4.2.16. Dung dịch kẽm chlorua-axetat
Cân 13,7 g kẽm clorua (4.2.13), 41 g natri axetat khan (4.2.11) và 30 g axit axetic (4.2.12) cho vào bình định mức 50 ml, hòa tan trong metanol (4.2.1) và thêm metanol đến 50 ml.
4.2.17. Lipaza loại VII
Ví dụ, sản phẩm từ Candida rugosa, có hoạt độ 1000 U/mg hoặc loại thay thế khác phù hợp[1]), các nguồn enzym khác từ các loài Pseudomoonas và Rhizopus nhưng cần xem xét đến hoạt độ của enzym.
4.2.18. Pha động dùng cho HPLC
Trộn 100 ml diclometan (4.2.4), 900 ml metanol (4.2.1) và 5 ml dung dịch kẽm clorua-axetat (4.2.16). Lọc qua bộ lọc cỡ lỗ 0,45 mm.
4.3. Chất chuẩn vitamin K1 (phyllochino, 3-phytylmenadion), w(C31H46O2) ³ 99 %
Vitamin K1 có thể có được từ các nhà cung cấp khác nhau. Độ tinh khiết của chất chuẩn phylloquinon có thể khác nhau. Vì vậy, cần phải xác định nồng độ của dung dịch hiệu chuẩn bằng đo phổ UV (xem phép thử nồng độ ở 4.4.4).
4.4. Dung dịch gốc
4.4.1. Chú ý
Vitamin K1 rất nhạy với ánh sáng. Do đó, khi đo cần chú ý bảo vệ chất chuẩn và dung dịch tương ứng trong suốt quá trình, ví dụ: sử dụng các dụng cụ thủy tinh màu nâu.
4.4.2 Dung dịch gốc I của vitamin K, nồng độ khối lượng r(C31H46O2) » 10 mg/ml
Cân chính xác khoảng 100 mg chất chuẩn vitamin K1 (4.3) cho vào bình định mức 100 ml, hòa tan trong metanol (4.2.1) và thêm metanol đến 100 ml. Dung dịch này có thể bền đến 3 tháng khi được bảo quản dưới dòng nitơ, ở nơi tối, nhiệt độ -20 oC.
CHÚ THÍCH Vitamin K1 có thể khó hòa tan trong metanol.
4.4.3. Dung dịch gốc II vitamin K1, r(C31H46O2) » 50,0 mg/ml
Dùng pipet lấy 5,0 ml dung dịch gốc I vitamin K1 (4.4.2) cho vào bình định mức 100 ml và pha loãng bằng metanol (4.2.1) đến vạch. Dung dịch này có thể bền đến 1 tháng khi được bảo quản dưới dòng nitơ ở nơi tối, nhiệt độ -20 oC.
4.4.4. Phép thử nồng độ
Làm bay hơi 5,0 ml dung dịch gốc II vitamin K1 (4.4.3) bằng máy cô quay dưới áp suất giảm hoặc dưới dòng nitơ. Hòa tan lại cặn trong 25,0 ml n-hexan (4.2.5) hoặc dầu nhẹ (4.2.6).
Dùng máy đo phổ (5.1) đo độ hấp thụ của dung dịch này trong cuvet 1 cm so với n-hexan hoặc dầu nhẹ ở bước sóng cực đại khoảng 248 mm. Tính nồng độ khối lượng vitamin K1, r, bằng microgam trên mililit dung dịch gốc II vitamin K1 (4.4.3) theo công thức (1):
![]() (1)
(1)
Trong đó:
A248 là độ hấp thụ của dung dịch ở bước sóng cực đại khoảng 248 nm;
419 là giá trị A![]() của vitamin K1 trong n-hexan (4.2.5) hoặc dầu nhẹ (4.2.6) ở bước sóng 248 nm [5];
của vitamin K1 trong n-hexan (4.2.5) hoặc dầu nhẹ (4.2.6) ở bước sóng 248 nm [5];
104 là hệ số chuyển đổi giá trị A![]() sang microgam trên mililit;
sang microgam trên mililit;
5 là bước pha loãng trong quá trình thay đổi dung môi từ metanol sang n-hexan.
4.5. Dung dịch chuẩn
4.5.1. Dung dịch chuẩn trung gian, vitamin K1 r(C31H46O2) » 2,5 mg/ml
Dùng pipet lấy 5,0 ml dung dịch gốc II vitamin K1 (4.4.3) cho vào bình định mức 100 ml và pha loãng đến vạch bằng metanol (4.2.1).
4.5.2 Dung dịch chuẩn vitamin K1 dùng cho HPLC, r(C31H46O2) » 25,0 ng/ml.
Dùng pipet lấy các thể tích thích hợp, ví dụ 1 ml dung dịch chuẩn trung gian vitamin K1 (4.5.1) cho vào các bình định mức màu nâu, ví dụ dung tích 100 ml và bổ sung metanol (4.2.1) để pha loãng đến vạch. Chuẩn bị dung dịch này trong ngày sử dụng.
5. Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm thông thường và cụ thể như sau:
5.1. Máy đo phổ UV
Máy đo phổ UV đo được độ hấp thụ ở các bước sóng xác định, dùng các cuvet thích hợp, ví dụ: 1 cm.
5.2. Hệ thống HPLC
Hệ thống HPLC, gồm có bơm, bộ bơm mẫu, detector huỳnh quang cài đặt được bước sóng kích thích ở 243 nm và bước sóng phát xạ ở 430 nm và hệ thống xử lý số liệu như máy tích phân.
5.3. Cột HPLC
Cột phân tích pha đảo, ví dụ đường kính từ 3,0 mm đến 4,6 mm, dài từ 100 mm đến 250 mm, được nhồi bằng hạt đại cỡ từ 3 mm đến 10 mm.
Có thể sử dụng cỡ hạt và kích thước cột khác với quy định trong tiêu chuẩn này. Các thông số tách phải phù hợp với vật liệu nhồi để đảm bảo các kết quả tương đương.
Có thể sử dụng các hệ thống khác (xem Phụ lục C) với điều kiện thỏa mãn việc tách phylloquinon ra khỏi các chất chiết cùng.
5.4. Bộ khử sau cột
Cột thép không gỉ hoặc cột thủy tinh được đặt vào giữa cột phân tích và detector huỳnh quang, ví dụ đường kính từ 2,0 mm đến 6,0 mm, dài từ 10 mm đến 150 mm, được nhồi bằng bột kẽm (4.2.14).
5.5. Dụng cụ lọc
Bộ lọc màng cỡ lỗ ví dụ 0,45 mm là thích hợp.
CHÚ THÍCH Việc lọc pha động cũng như dung dịch mẫu qua bộ lọc màng trước khi sử dụng hoặc bơm sẽ làm tăng thời gian sử dụng của cột.
6. Cách tiến hành
6.1. Chú ý
Vitamin K1 rất nhạy với ánh sáng. Do đó, khi đo cần chú ý bảo vệ mẫu và dung dịch tương ứng trong suốt quy trình, ví dụ: sử dụng các dụng cụ thủy tinh màu nâu.
6.2. Chuẩn bị mẫu thử
Đồng hóa mẫu thử. Nghiền mẫu bằng máy nghiền thích hợp và trộn đều lại. Cần có các biện pháp như làm lạnh sơ bộ để mẫu không tiếp xúc với nhiệt độ cao trong khoảng thời gian dài.
6.3. Chuẩn bị dung dịch mẫu
6.3.1. Chiết mẫu
Cân một lượng mẫu thích hợp, chính xác đến miligam, ví dụ 1 g mẫu dạng bột hoặc 10 g mẫu dạng lỏng cho vào ống nghiệm hoặc bình nón có thể đậy kín. Trộn mẫu dạng bột với 15 ml nước ở 40 oC, dùng máy vortex, đối với các mẫu dạng lỏng thêm 5 ml nước ở 40 oC. Cho chạy mẫu trắng với các thuốc thử nhưng không có mẫu thử (xem 6.5).
6.3.2. Xử lý bằng enzym
Thêm 5 ml đệm phosphat có pH 7,9 đến 8,0 (4.2.15) và trộn đều. Thêm 1,0 g lipaza (4.2.17), trộn bằng máy vortex, đậy nắp và lắc để phân tán trong khoảng từ 2 min đến 3 min. Ủ hỗn hợp ở nhiệt độ 37 oC ± 2 oC trong 2 h. Cứ sau một khoảng thời gian, ví dụ 20 min, thì lắc mạnh hỗn hợp bằng tay.
6.3.3. Chiết
Để nguội đến nhiệt độ phòng, thêm 10 ml thuốc thử ancol (4.2.3), 1,0 g kali cabonat (4.2.10) và trộn đều, thêm một lượng xác định VE của n-hexan (4.2.5), ví dụ 30 ml và lắc mạnh. Để yên cho tách pha ở nơi tối hoặc cho ly tâm, ví dụ ở 2 000 g trong 10 min. Dịch chiết n- hexan có thể bền qua đêm nếu được bảo quản ở nơi tối, nhiệt độ 4 oC dưới dòng nitơ.
6.3.4. Chuyển pha và pha loãng
Dùng pipet lấy một lượng dịch lỏng VA của pha n-hexan (6.3.3), ví dụ 0,5 ml mẫu đã bổ sung vitamin K1 hoặc 5,0 ml mẫu chưa bổ sung vitamin K1 vào trong lọ nhỏ. Loại bỏ dung môi dưới dòng nitơ và hòa tan phần còn lại trong thể tích V xác định của metanol (4.2.1), ví dụ 1,0 ml. Đây là dung dịch mẫu thử cuối cùng được dùng để phân tích HPLC.
6.4. Nhận biết
Nhận biết vitamin K1 bằng các so sánh thời gian lưu của pic trong các sắc đồ của dung dịch thử (6.3.4) và thời gian lưu của pic trong dung dịch chuẩn (4.5.2). Việc nhận biết pic cũng có thể thực hiện bằng cách thêm các lượng nhỏ của các dung dịch chuẩn thích hợp vào dung dịch thử.
Việc tách và định lượng đã được chứng minh là thỏa mãn nếu tuân thủ các điều kiện thử nghiệm sau đây (xem thêm Hình A.1 đến Hình A.3).Đối với các điều kiện HPLC thay thế, xem Bảng C.1.
| Pha tĩnh: | C18, ví dụ cột phân tách C18, cỡ hạt 5 mm, kích thước 150 mm x 3,9 mm |
| Pha động: | Trộn 100 ml diclometan (4.2.4), 900 ml metanol (4.2.1) và 5 ml dung dịch kẽm clorua axetat (4.2.16). |
| Tốc độ dòng: | 1,0 ml/min |
| Thể tích bơm: | 20 ml |
| Cột khử: | Cột bằng thép không gỉ kích thước 20 mm x 4 mm được nhồi bằng bột kẽm (4.2.14). |
| Detetor: | Huỳnh quang, bước sóng kích thích: 243 nm; bước sóng phát xạ: 430 nm |
CHÚ THÍCH 1 Các đồng phân vitamin K1 (cis và tran) được rửa giải vào một pic không phân giải, sử dụng các pha tĩnh của cột C18 [6, 7]. Thử nghiệm mới đây cho thấy, việc tách các đồng phân trong các mẫu thực phẩm có thể thực hiện được bằng cách dùng cột C30 [10]. Tuy nhiên, các đồng phân trong các chất chuẩn và các chất cô đặc có thể tách được bằng sắc ký pha thường, dùng detector UV [8, 9].
CHÚ THÍCH 2 Theo kinh nghiệm phòng thử nghiệm cho thấy, trong quá trình phân tích HPLC có thể làm nóng cột khử đến 40 oC để quá trình khử nhanh hơn.
6.5. Xác định
Bơm các thể tích thích hợp bằng nhau, ví dụ 20 ml dung dịch chuẩn (4.5.2) cũng như dung dịch mẫu thử (6.3.4) vào hệ thống HPLC.
Tiến hành xác định bằng phương pháp ngoại chuẩn, tích phân diện tích pic hoặc xác định chiều cao pic của mẫu và so sánh các kết quả với các giá trị tương ứng đối với chất chuẩn.
Nồng độ vitamin K1 trong dung dịch mẫu cuối cùng là rất thấp. Vì vậy cần sử dụng các dụng cụ thủy tinh sạch để tránh nhiễm bẩn. Thực hiện phép thử trắng, sử dụng cùng quy trình nhưng không dùng mẫu thử để khẳng định không có sự nhiễm bẩn.
7. Tính kết quả
Tính kết quả dựa vào đường chuẩn hoặc sử dụng các chương trình tích phân tương ứng hoặc theo công thức giản lược sau đây:
Tính phần khối lượng của vitamin K1, w, bằng microgam trên 100g mẫu, theo công thức (2):
![]() (2)
(2)
Trong đó:
As là diện tích pic hoặc chiều cao pic của vitamin K1 thu được từ dung dịch mẫu thử (6.3.4), tính bằng đơn vị diện tích hoặc đơn vị chiều cao;
AST là diện tích pic hoặc chiều cao pic của vitamin K1 thu được với dung dịch chuẩn (4.5.2), tính bằng đơn vị diện tích hoặc đơn vị chiều cao;
r là nồng độ vitamin K1 của dung dịch chuẩn (4.5.2), tính bằng nanogam trên mililit (ng/ml);
V là tổng thể tích của dung dịch mẫu thử (6.3.4), tính bằng mililit (ml);
VA là thể tích dịch lỏng của dịch chiết được dùng cho chuyển pha, tính bằng mililit (ml);
VE là thể tích của dịch chiết n-hexan (6.3.3), tính bằng mililit (ml);
m là khối lượng mẫu, tính bằng gam (g).
1000 là hệ số chuyển đổi từ nanogam sang microgam;
100 là hệ số chuyển đổi sang phần khối lượng trên 100 g.
Báo cáo kết quả vitamin K1, tính bằng microham trên 100 g.
8. Độ chụm
8.1. Yêu cầu chung
Dữ liệu về độ chụm đối với phép xác định vitamin K1 được thiết lập vào năm 1998 do một nghiên cứu phòng thử nghiệm tiến hành theo các hướng dẫn quốc tế AOAC trên các mẫu sửa đổi đã bổ sung và chưa bổ sung vitamin K1 khác nhau [4], nêu trong Phụ lục B. Dữ liệu thu được từ nghiên cứu cộng tác này có thể không áp dụng cho các dải nồng độ phân tích và các chất nền khác với các dải nồng độ phân tích và các chất nền đã nêu trong Phụ lục B.
8.2 Độ lặp lại
Chênh lệch tuyệt đối giữa các kết quả của hai phép thử đơn lẻ trên vật liệu thử giống hệt nhau, do một người thực hiện, sử dụng cùng thiết bị, thực hiện trong một khoảng thời gian ngắn, không được quá 5 % các trường hợp lớn hơn giới hạn lặp lại r.
Các giá trị đối với vitamin K1 là:
| Sữa dạng lỏng nguyên chất sữa tiệt trùng (UHT), chưa bổ sung vitamin K1 (1) |
| r = 0,12 mg/100g |
| Bột sữa cừu nguyên chất, chưa bổ sung vitamin K1 (2) |
| r = 0,60 mg/100g |
| Thức ăn công thức dành cho trẻ sơ sinh có sữa, có nhiều dầu thực vật, đã bổ sung vitamin K1 (3) |
| r = 14,01 mg/100g |
| Thức ăn công thức dành cho trẻ sơ sinh có whey, có một phần dầu thực vật, đã bổ sung vitamin K1 (4) |
| r = 4,31 mg/100g |
| Thức ăn công thức dành cho trẻ sơ sinh có đậu nành, có nhiều dầu thực vật, đã bổ sung vitamin K1 (5) |
| r = 5,71 mg/100g |
| Thức ăn công thức dành cho trẻ sơ sinh có whey, có nhiều dầu thực vật (6) |
| r = 7,11 mg/100g |
| Thức ăn công thức dành cho trẻ sơ sinh có whey, có một phần dầu thực vật, đã bổ sung vitamin K1 (7) |
| r = 11,32 mg/100g |
| NIST SRM 1846[2]), thức ăn công thức dành cho trẻ sơ sinh đã trộn, dạng khô (8) |
| r = 15,05 mg/100g |
Các số trong dấu ngoặc đơn liên quan đến mẫu trong Bảng B.1 (xem Phụ lục B).
8.3. Độ tái lập
Chênh lệch tuyệt đối giữa các kết quả của hai phép thử đơn lẻ, thu được khi tiến hành thử trên vật liệu giống nhau, do hai phòng thử nghiệm thực hiện, không được vượt quá 5 % các trường hợp lớn hơn giới hạn tái lập R.
Các giá trị đối với vitamin K1 là:
| Sữa dạng lỏng nguyên chất sữa tiệt trùng (UHT), chưa bổ sung vitamin K1 (1) |
| R = 0,15 mg/100g |
| Bột sữa cừu nguyên chất, chưa bổ sung vitamin K1 (2) |
| R = 1,08 mg/100g |
| Thức ăn công thức dành cho trẻ sơ sinh có sữa, có nhiều dầu thực vật, đã bổ sung vitamin K1 (3) |
| R = 18,19 mg/100g |
| Thức ăn công thức dành cho trẻ sơ sinh có whey, có một phần dầu thực vật, đã bổ sung vitamin K1 (4) |
| R = 5,98 mg/100g |
| Thức ăn công thức dành cho trẻ sơ sinh có đậu nành, có nhiều dầu thực vật, đã bổ sung vitamin K1 (5) |
| R = 9,53 mg/100g |
| Thức ăn công thức dành cho trẻ sơ sinh có whey, có nhiều dầu thực vật (6) |
| R = 10,65 mg/100g |
| Thức ăn công thức dành cho trẻ sơ sinh có whey, có một phần dầu thực vật, đã bổ sung vitamin K1 (7) |
| R = 11,50 mg/100g |
| NIST SRM 1846, thức ăn công thức dành cho trẻ sơ sinh đã trộn, dạng khô (8) |
| R = 17,95 mg/100g |
Các số trong dấu ngoặc đơn liên quan đến mẫu trong Bảng B.1 (xem phụ lục B).
9. Báo cáo thử nghiệm
Báo cáo thử nghiệm ít nhất phải bao gồm các thông tin sau đây:
a) mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
b) viện dẫn tiêu chuẩn này hoặc phương pháp thử đã sử dụng;
c) các kết quả và các đơn vị biểu thị kết quả;
d) ngày và quy trình lấy mẫu (nếu biết);
e) ngày nhận mẫu;
f) ngày thử nghiệm;
g) các điểm đặc biệt quan sát được trong khi tiến hành thử nghiệm;
h) mọi chi tiết thao tác không được quy định trong tiêu chuẩn này hoặc những điều được coi là tùy chọn có thể ảnh hưởng đến kết quả.
Phụ lục A
(tham khảo)
Các sắc đồ
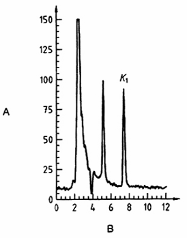
CHÚ DẪN
| A Cường độ tín hiệu, mV | B thời gian, min |
Hình A.1 - Ví dụ về việc tách vitamin K1 ra khỏi mẫu 1 bằng HPLC [sữa dạng lỏng nguyên chất tiệt trùng (UHT), chưa bổ sung vitamin K1]
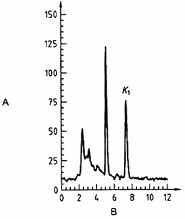
CHÚ DẪN
| A Cường độ tín hiệu, mV | B thời gian, min |
Hình A.2 - Ví dụ về việc tách vitamin K1 ra khỏi mẫu 1 bằng HPLC [bột sữa cừu nguyên chất, chưa bổ sung vitamin K1]
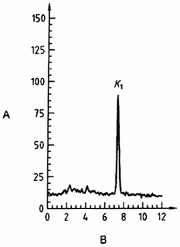
CHÚ DẪN
| A Cường độ tín hiệu, mV | B thời gian, min |
Hình A.3 - Ví dụ về việc tách vitamin K1 ra khỏi 5 mẫu bằng HPLC [Thức ăn công thức dành cho trẻ sơ sinh có đậu nành, nhiều thực vật, đã bổ sung vitamin K1]
| Pha tĩnh: | C18, ví dụ: cột phân tách C18, cỡ hạt 5 mm, kích thước 150 mm x 3,9 mm |
| Pha động: | Trộn đều 100 ml diclometan (4.2.4), 900 ml metanol (4.2.1) và 5 ml dung dịch kẽm clorua axetat (4.2.16). |
| Tốc độ dòng: | 1,0 ml/min |
| Thể tích bơm: | 20 ml |
| Cột khử: | Cột bằng thép không gỉ kích thước 20 mm x 4 mm được nhồi bằng bột kẽm (4.2.14). |
| Detetor: | Huỳnh quang, bước sóng kích thích: 243 nm; bước sóng phát xạ: 430 nm |
Bảng B
(tham khảo)
Dữ liệu về độ chụm
Các dữ liệu sau đây đã được xác định trong nghiên cứu cộng tác quốc tế [4].
Bảng B.1 - Dữ liệu về độ chụm
| Số lượng mẫu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Chất phân tích | Vitamin K1 | Vitamin K1 | Vitamin K1 | Vitamin K1 | Vitamin K1 | Vitamin K1 | Vitamin K1 | Vitamin K1 |
| Năm tiến hành phép thử liên phòng thử nghiệm | 1998 | 1998 | 1998 | 1998 | 1998 | 1998 | 1998 | 1998 |
| Số lượng phòng thử nghiệm | 33 | 34 | 34 | 34 | 34 | 34 | 34 | 34 |
| Số lượng mẫu | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| Số lượng các phòng thử nghiệm còn lại sau khi trừ ngoại lệ | 32 | 29 | 34 | 34 | 34 | 34 | 33 | 34 |
| Số lượng các phòng thử nghiệm ngoại lệ | 1 | 5 | 0 | 0 | 0 | 0 | 1 | 0 |
| Số lượng bộ dữ liệu | 62 | 56 | 66 | 66 | 66 | 66 | 64 | 66 |
| Giá trị trung bình, | 0,49 | 6,63 | 118,07 | 32,24 | 78,69 | 49,64 | 90,94 | 94,62 |
| Độ lệch chuẩn lặp lại sr, mg/100g | 0,04 | 0,21 | 5,00 | 1,54 | 2,04 | 2,54 | 4,04 | 5,38 |
| Độ lệch chuẩn tương đối lặp lại, RSDr % | 9,03 | 3,23 | 4,24 | 4,77 | 2,59 | 5,11 | 4,44 | 5,68 |
| Giới hạn lặp lại, r[r =2,8 x sr], mg/100g | 0,12 | 0,60 | 14,01 | 4,31 | 5,71 | 7,11 | 11,32 | 15,05 |
| Độ lệch chuẩn tái lập, sR, mg/100g | 0,05 | 0,39 | 6,50 | 2,14 | 3,40 | 3,80 | 4,14 | 6,41 |
| Độ lệch chuẩn tương đối tái lập, RSDr % | 10,94 | 5,81 | 5,50 | 6,63 | 4,33 | 7,66 | 4,56 | 6,78 |
| Giới hạn tái lập, R[R =2,8 x sR], mg/100g | 0,15 | 1,08 | 18,19 | 5,98 | 9,53 | 10,65 | 11,60 | 17,95 |
| Các mẫu: 1 Sữa dạng lỏng nguyên chất tiệt trùng (UHT), chưa bổ sung vitamin K1; 2 Bột sữa cừu nguyên chất, chưa bổ sung vitamin K1; 3 Thức ăn công thức dành cho trẻ sơ sinh có sữa, có nhiều dầu thực vật, đã bổ sung vitamin K1; 4 Thức ăn công thức dành cho trẻ sơ sinh có whey, có một phần dầu thực vật, đã bổ sung vitamin K1; 5 Thức ăn công thức dành cho trẻ sơ sinh có đậu nành, có nhiều dầu thực vật, đã bổ sung vitamin K1; 6 Thức ăn công thức dành cho trẻ sơ sinh có whey, có nhiều dầu thực vật; 7 Thức ăn công thức dành cho trẻ sơ sinh có whey, có một phần dầu thực vật, đã bổ sung vitamin K1; 8 NIST SRM 1846, thức ăn công thức dành cho trẻ sơ sinh đã trộn khô (94 ± 10) mg/100g. | ||||||||
Phụ lục C
(Tham khảo)
Các hệ thống HPLC thay thế
Việc tách định lượng đã được chứng minh là thỏa mãn nếu áp dụng [4] các điều kiện thử nghiệm sau đây.
| Pha tĩnh | Đường kính cột | Cột khử | Tốc độ dòng |
| Alltima® C18, 5 mm | 150 x 4,6 | 20 x 4 | 1,5 |
| Novapak® C18, 5 mm | 100 x 8,0 | 20 x 4 | 1,5 |
| Lichrospher® 100 RP18, 5 mm | 250 x 4,0 | 125 x 3b | 1,5 |
| Resolve® C18, 5 mm | 150 x 3,9 | 20 x 4 | 1,0 |
| L-Colum® ODS, 5 mm | 250 x 4,6 | 20 x 4 | 0,8 |
| L-Colum® ODS, 5 mm | 150 x 4,6 | 10 x 6 | 0,8 |
| Capcell Pak® C18, 5 mm | 250 x 4,6 | 20 x 2 | 1,0 |
| Econosphere® C18, 5 mm | 250 x 4,6 | 30 x 4,6 | 1,0 |
| Vydac® C18, 5 mm | 250 x 4,6 | 20 x 4 | 1,0 |
| Nucleosil® 120 C18, 5 mm | 250 x 4,6 | 30 x 4 | 1,3 |
| Spherisorb® ODS2, 5 mm | 250 x 4,6 | 20 x 4 | 1,5 |
| Varian® C18, 5 mm | 250 x 4,6 | 20 x 4,6 | 1,2 |
| Pickering® C18, 5 mm | 150 x 4,6 | 20 x 4 | 1,0 |
| Hypersil® BDS C18, 5 mm | 150 x 3,0 | 40 x 2 | 0,5 |
| ChromSpher® C18, 5 mm | 100 x 3,0 | 40 x 3 | 0,6 |
| Hypersil® ODS, 5 mm | 250 x 4,6 | 20 x 4 | 1,0 |
| Vydac® 201 TP54 C18, 5 mm | 250 x 4,6 | 50 x 2,1 | 0,8 |
| Partisil® ODS3, 5 mm | 250 x 4,6 | 20 x 4 | 1,0 |
| Supelco® C18, 5 mm | 250 x 4,6 | 30 x 4 | 1,5 |
| YMC Pack® ODS-AM, 5 mm | 250 x 4,6 | 150 x 4,6 | 1,3 |
| Zorbax® R x C18, 5 mm | 150 x 4,6 | 20 x 4 | 1,0 |
| Zorbax® ODS, 5 mm | 250 x 4,6 | 20 x 4 | 1,5 |
| mBondapak® C18, 5 mm | 300 x 3,9 | 20 x 4 | 1,0 |
| Prodigy® ODS3, 5 mm | 150 x 4,6 | 20 x 4 | 1,5 |
| YMC® C30, 5 mmd | 250 x 4,6 | 20 x 4 | 1,5 |
| a Thép không gỉ. b Thủy tinh c Thành phần của pha động được nêu trong phương pháp. d Cột này tách các đồng phân (cis và trans) vitamin K1. Các kết quả thu được bằng cột này đã được loại trừ từ các dữ liệu thống kê. | |||
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] Indyk, H.E., and Woollard, D.C.: Vitamin K in Milk and Infant Formulas: Determination of Phylloquione and Menaquione-4. Analyst 122, 1997, 465-469.
[2] Indyk, H.E., Littlejohn, V.C., Lawrence, J.L. and Woollard, D.C.: Liquid Chromatographic Determination of Vitamin K1 in Infant Formulas and Milk. J. AOAC intern. 78, 1995, 719-723. AOAC Official Methods of Analysis, 17th Ed, 2000, Method 999.15- Determination of Vitamin K1 by HPLC.
[3] Haroon, Y., Bacon, D. S., and Sadowski, J. A.: Chemical reduction system for the detection of phylloquione (vitamin K1) and menaquinones (vitamin K2).J. Chromatogr. 384, 1987, 382-389.
[4] Indyk, H. Ε and Woolard, D. C.: Vitamin K in Milk and Infant Formulas by Liquid of Chromatography: Collaborative study. J. AOAC intern. 83, 2000, 121-130.
[5] The Merck Index: Vitamin K1. 12th Ed.: 7536, ρ 1269 (1996).
[6] Ball, G. F. M, in G. F. M. Ball (Hrsg.): Fat-Soluble Vitamin Assays in Food Analysis: A Comprehensive Review. Elsevier Applied Science, London, 1988, 258-273.
[7] Eitermiller, R. R. and Landen, W. O.: Vitamin Analysis for the Health and Food Science. CRC Press, Boca Raton, London, New York, Washington, D.C., 1999, 149-184.
[8] Eropean Pharmacopoeia 1997: 1997: 1036; Phytomenadione. 1332-1334.
[9] Eropean Pharmacopoeia - Supplement 2000: 1999: 1036; Phytomenadione. 1060-1062.
[10] Woolard, D.C., Indyk H.E., Bertram, Y.F and Cook, K.K.: Determination of Vitamin K 1 Isomers in Food by liquid Chromatography with C 30 Bonded-Phase Colum, J. AOAC intern. 85, 2002, 682-691.
[1]) Ví dụ: L-1754; Sigma Chemical Co, Ρ.O. 14508, St. Louis, MO 63178, Mỹ. Thông tin này được dùng trong nghiên cứu phòng thử nghiệm. Thông tin này tạo thuận tiện cho người sử dụng tiêu chuẩn này không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương đương nếu cho kết quả tương tự.
[2]) Giá trị quy về (94 ± 10) mg/100g
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 8974:2011 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 8974:2011 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 8974:2011 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 8974:2011 DOC (Bản Word)