- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 8177:2009 Kỹ thuật đếm khuẩn lạc ở 37°C trong sữa chua
| Số hiệu: | TCVN 8177:2009 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2009 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 8177:2009
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 8177:2009
TIÊU CHUẨN QUỐC GIA
TCVN 8177:2009
ISO 7889:2003
SỮA CHUA – ĐỊNH LƯỢNG CÁC VI SINH VẬT ĐẶC TRƯNG – KỸ THUẬT ĐẾM KHUẨN LẠC Ở 37 0C
Yogurt – Enumeration of characteristic microorganisms – Colony-count technique at 37 0C
Lời nói đầu
TCVN 8177 : 2009 hoàn toàn tương đương với ISO 7889 : 2003;
TCVN 8177 : 2009 do Ban kỹ thuật Tiêu chuẩn TCVN/TC/F12 Sữa và sản phẩm sữa biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
SỮA CHUA – ĐỊNH LƯỢNG CÁC VI SINH VẬT ĐẶC TRƯNG – KỸ THUẬT ĐẾM KHUẨN LẠC Ở 37 0C
Yogurt – Enumeration of characteristic microorganisms – Colony-count technique at 37 0C
1. Phạm vi áp dụng
Tiêu chuẩn này qui định phương pháp định lượng các vi sinh vật đặc trưng trong sữa chua bằng kỹ thuật đếm khuẩn lạc ở 37 0C.
Phương pháp này có thể áp dụng cho sữa chua trong đó có mặt và sống cả hai loại vi sinh vật đặc trưng (Lactobacillus delbrueckii subsp, bulgaricus và Streptococcus thermophilus)
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 6232 (ISO 8261), Sữa và sản phẩm sữa – Hướng dẫn chung về chuẩn bị mẫu thử huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật.
TCVN 6404 (ISO 7218), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi – Yêu cầu chung và hướng dẫn kiểm tra vi sinh vật.
TCVN 6507-1 (ISO 688-1), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi – Chuẩn bị mẫu thử, dung dịch huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật – Phần 1: Các nguyên tắc chung để chuẩn bị huyền phù ban đầu và các dung dịch pha loãng thập phân.
3. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau đây:
3.1
Vi sinh vật đặc trưng trong sữa chua (characteristic microorgannisms in yogurt)
Lactobacillus delbrueckii subsp, bulgaricus và Streptococcus thermophilus được phát hiện dưới điều kiện được qui định trong tiêu chuẩn này.
3.2
Lactobacillus delbrueckii subsp, bulgaricus (Lactobacillus delbrueckii subsp, bulgaricus)
Vi sinh vật chịu nhiệt hình thành các khuẩn lạc hình hạt đậu, thường là hình tròn, có đường kính từ 1 mm đến 3 mm trên môi trường MRS đã axit hóa dưới các điều kiện qui định trong tiêu chuẩn này.
CHÚ THÍCH Dưới kính hiển vi những vi sinh vật này xuất hiện hình que có dạng ngắn nhưng thỉnh thoảng có dạng dài hơn. Chúng không sinh nha bào, Gram dương, không di động và catalaza âm tính.
3.3
Streptococcus thermophilus (Streptococcus thermophilus)
Vi sinh vật chịu nhiệt hình thành các khuẩn lạc hình hạt đậu, có đường kính từ 1 mm đến 3 mm trên môi trường M17 dưới các điều kiện qui định trong tiêu chuẩn này.
CHÚ THÍCH Dưới kính hiển vi các vi sinh vật này có hình cầu hoặc các tế bào dạng trứng (đường kính 0,7 mm đến 0,9 mm) kết thành cặp hoặc thành chuỗi dài. Chúng là các Gram dương tính và catalaza âm tính.![]()
4. Nguyên tắc
4.1 Các dung dịch pha loãng thập phân của mẫu thử được cấy vào:
a) môi trường MRS được axit hóa, sau đó được ủ yếm khí ở 37 0C ![]() 1 0C trong 72 h để đếm Latobacillus delbrueckii subsp. bulgaricus;
1 0C trong 72 h để đếm Latobacillus delbrueckii subsp. bulgaricus;
b) môi trường hoàn chỉnh (M 17), sau đó được ủ yếm khí ở 37 0C ![]() 1 0C trong 48 h để đếm Streptococcus thermophilus.
1 0C trong 48 h để đếm Streptococcus thermophilus.
4.2 Các khuẩn lạc được đếm và được khẳng định bằng các phép thử thích hợp.
4.3 Số lượng các vi sinh vật đặc trưng trên gam mẫu thử được tính từ số đếm các khuẩn lạc thu được trên các đĩa ở độ pha loãng sao cho thu được kết quả có ý nghĩa.
5. Thuốc thử, dịch pha loãng và môi trường nuôi cấy
Chỉ sử dụng các thuốc thử loại tinh khiết phân tích và nước sử dụng là nước cất hoặc nước đá loại khoáng hoặc nước có độ tinh khiết tương đương, trừ khi có qui định khác. Xem TCVN 6404 (ISO 7218) và TCVN 6263 (ISO 8261).
5.1 Dịch pha loãng
Xem TCVN 6404 (ISO 7218) và TCVN 6263 (ISO 8261).
5.2 Môi trường nuôi cấy
Chỉ sử dụng môi trường nuôi cấy vừa mới chuẩn bị (MRS và M 17) không được để tiếp xúc trực tiếp với ánh nắng.
Nếu môi trường nuôi cấy đã chuẩn bị mà chưa sử dụng ngay thì chúng phải được làm mát và được bảo quản từ 2 0C đến 4 0C trong không quá 1 tuần và dưới các điều kiện không làm thay đổi thành phần của môi trường, trừ khi có qui định khác.
Cũng như đối với các thuốc thử, xem các điều kiện bảo quản qui định trong TCVN 6404 (ISO 7218).
5.2.1 Môi trường MRS đã axit hóa
5.2.1.1 Thành phần
| Pepton 1 (sản phẩm thủy phân tryptic của casein) | 10,0 g |
| Chất chiết thịt | 10,0 g |
| Chất chiết nấm men (khô) | 5,0 g |
| Glucoza (C8H12O6) | 20,0 g |
| Tween 80 (sorbitan mono-oleat) | 1,0 ml |
| Dikali hydro orthophosphat (K2HPO4) | 2,0 g |
| Natri axetat ngậm ba phân tử nước (CH2CO2Na.3H2O) | 5,0 g |
| Diamoni xitrat [C6H6O7(NH4)2] | 2,0 g |
| Magie sulfat ngậm bảy phân tử nước (MgSO4.7H2O) | 0,2 g |
| Mangan sulfat ngậm bốn phân tử nước (MnSO4.4H2O) | 0,05 g |
| Thạch | 9,0 g đến 18,0 g 1) |
| Nước, đến | 1000 ml |
| 1) Tùy thuộc vào sức đông của thạch hoặc theo hướng dẫn của nhà sản xuất. | |
5.2.1.2 Chuẩn bị
Hòa tan các thành phần trên riêng rẽ trên nồi cách thủy (6.7) để sôi. Làm nguội trên nồi cách thủy khác (6.7) đến 50 0C. Chỉnh pH để sau khi khử trùng, pH là 5,4 ![]() 0,1 ở 25 0C
0,1 ở 25 0C ![]() 1 0C bằng cách thêm axit axetic (5.3.3) và kiểm tra bằng máy đo pH (6.8). Chuyển các lượng 100 ml môi trường này sang các lọ 150 ml (6.10) hoặc các lượng 200 ml sang các lọ 250 ml (6.10). Khử trùng bằng hấp (6.1) ở 121 0C
1 0C bằng cách thêm axit axetic (5.3.3) và kiểm tra bằng máy đo pH (6.8). Chuyển các lượng 100 ml môi trường này sang các lọ 150 ml (6.10) hoặc các lượng 200 ml sang các lọ 250 ml (6.10). Khử trùng bằng hấp (6.1) ở 121 0C ![]() 1 0C trong 15 min.
1 0C trong 15 min.
CHÚ THÍCH 1 Môi trường MRS rất nhạy với xử lý nhiệt mà có thể gây ra sự khác nhau theo nồi hấp áp lực được sử dụng
CHÚ THÍCH 2 Các phép thử so sánh cho thấy rằng các môi trường MRS có bán sẵn cho các số đếm thấp hơn môi trường MRS được chuẩn bị theo tiêu chuẩn này. Do đó, nếu sử dụng môi trường được chuẩn bị sẵn thì cần kiểm tra lại theo môi trường được chuẩn bị theo tiêu chuẩn này. Điều này có thể gây phiền hà cho các nhà sản xuất sữa chua và các cơ quan kiểm tra về số đếm tế bào tối thiểu trong các sản phẩm sữa chua.
Trước khi bắt đầu kiểm tra vi sinh vật, làm tan chảy hoàn toàn lượng môi trường yêu cầu trên nồi cách thủy (6.7) để ở nhiệt độ sôi hoặc bằng cách hấp vật chứa. Sau đó làm nguội trên một nồi cách thủy khác (6.7).
5.2.2 Môi trường M17 (xem [8])
5.2.2.1 Môi trường cơ bản
5.2.2.1.1 Thành phần
| Pepton 1 (sản phẩm thủy phân tryptic của casein) | 2,5 g |
| Pepton 2 (sản phẩm thủy phân peptic của thịt) | 2,5 g |
| Pepton 3 (sản phẩm thủy phân papain của đậu tương) | 5,0 g |
| Chất chiết nấm men (khô) | 2,5 g |
| Chất chiết thịt | 5,0 g |
|
| 19,0 g |
| Magie sulfat ngậm bảy phân tử nước (MgSO4.7H2O) | 0,25g |
| Axit ascorbic (C6H8O6) | 0,50 g |
| Thạch | 9,0 g đến 18,0 g 1) |
| Nước, đến | 950 ml |
| 1) Tùy thuộc vào sức đông của thạch hoặc theo hướng dẫn của nhà sản xuất. | |
5.2.2.1.2 Chuẩn bị
Hòa tan các thành phần trên riêng rẽ trên nồi cách thủy (6.7) đun sôi. Làm nguội trên nồi cách thủy khác (6.7) đến 50 0C. Chỉnh pH để sau khi khử trùng, pH là 6,8 ![]() 0,1 ở 25 0C
0,1 ở 25 0C ![]() 1 0C bằng cách sử dụng thuốc (5.3) và kiểm tra bằng máy đo pH (6.8). Chuyển các lượng 95 ml môi trường này sang các lọ 150 ml (6.10). Khử trùng bằng hấp (6.1) ở 121 0C
1 0C bằng cách sử dụng thuốc (5.3) và kiểm tra bằng máy đo pH (6.8). Chuyển các lượng 95 ml môi trường này sang các lọ 150 ml (6.10). Khử trùng bằng hấp (6.1) ở 121 0C ![]() 1 0C trong 15 min.
1 0C trong 15 min.
5.2.2.2 Dung dịch lactoza
5.2.2.2.1 Thành phần
| Lactoza (C12H22O11) | 10,0 mg |
| Nước | 100 ml |
5.2.2.2.2 Chuẩn bị
Hòa tan lactoza trong nước. Pha loãng bằng nước đến 100 ml. Khử trùng bằng hấp (6.1) ở 121 0C ![]() 1 0C trong 15 min.
1 0C trong 15 min.
5.2.2.3 Môi trường hoàn chỉnh (M 17)
5.2.2.3.1 Thành phần
| Môi trường cơ bản (5.2.2.1) | 95,0 ml |
| Dung dịch Lactoza (5.2.2.2) | 5,0 ml |
5.2.2.3.2 Chuẩn bị
Ngay trước khi sử dụng, làm tan chảy môi trường cơ bản trên nồi cách thủy (6.7) để sôi. Làm nguội trên nồi cách thủy khác (6.7) đến 50 0C. Làm nóng sơ bộ dung dịch lactoza trên nồi cách thủy (6.7) ở 50 0C. Cho dung dịch lactoza vào môi trường cơ bản và xoay bình để trộn. Làm nguội môi trường trên nồi cách thủy đến khoảng từ 44 0C đến 47 0C.
CHÚ THÍCH Môi trường M 17 có bán sẵn trên thị trường, nhưng vì các môi trường do các nhà cung cấp khác nhau, nên có thể cho các kết quả khác nhau đáng kể. Do đó, các môi trường này cần được kiểm tra dựa vào các môi trường được chuẩn bị theo tiêu chuẩn này. Điều này có thể gây phiền cho các nhà sản xuất sữa chua và các cơ quan kiểm tra khi đếm số tế bào tối thiểu trong các sản phẩm sữa chua
5.3 Thuốc thử để điều chỉnh pH
5.3.1 Dung dịch natri hydroxit, c(NaOH) = 0,1 mol/l.
5.3.2 Axit clohdric loãng, c(HCl) = 0,1 mol/l.
5.3.3 Axit axetic (CH3COOH), 100 % (băng).
5.4 Thuốc thử nhuộm màu, dung dịch xanh metylen trong etanol, 6 g/l.
5.5 Thuốc thử làm sạch bề mặt vật chứa, etanol 70 % (thể tích).
6 Thiết bị, dụng cụ
Khử trùng tất cả các dụng cụ tiếp xúc với mẫu thử, với dung dịch pha loãng, với dung dịch hoặc môi trường nuôi cấy phù hợp với yêu cầu của TCVN 6263 (ISO 8261). Các dụng cụ thủy tinh phải bền với việc khử trùng nhiều lần.
Sử dụng các thiết bị thông thường của phòng thử nghiệm vi sinh (xem TCVN 6404 (ISO 7218), chuẩn bị các mẫu thử và các dung dịch pha loãng theo TCVN 6263 (ISO 8261) và cụ thể như sau:
6.1 Tủ ấm, có khả năng duy trì nhiệt độ ở 37 0C ![]() 10C.
10C.
6.2 Tủ ấm yếm khí hoặc bình yếm khí, có khả năng duy trì nhiệt độ 37 0C ![]() 10C, có môi trường 90 % nitơ và 10 % cacbon dioxit.
10C, có môi trường 90 % nitơ và 10 % cacbon dioxit.
6.3 Bộ trộn, kiểu nhu động (túi) có các túi bằng chất dẻo hoặc bộ trộn quay, có tần số quay tối thiểu 20 000 min-1, có các ống ly tâm 200 ml đáy tròn, vô trùng bằng thủy tinh bền hoặc các vật chứa bằng kim loại có dung tích thích hợp.
6.4 Máy lắc trộn ống nghiệm, ví dụ: máy trộn Vortex.
6.5 Dụng cụ đếm khuẩn lạc, theo qui định trong TCVN 6404 (ISO 7218).
6.6 Thấu kính phóng đại, phóng đại được 8 lần hoặc 10 lần.
6.7 Nồi cách thủy, có khả năng duy trì 44 0C đến 47 0C, 45 0C ![]() 10C, và ở 50 0C
10C, và ở 50 0C ![]() 10C và có khả năng đun sôi.
10C và có khả năng đun sôi.
6.8 Máy đo pH, có bù nhiệt độ, có độ chính xác tới ![]() 0,1 đơn vị pH ở 25 0C
0,1 đơn vị pH ở 25 0C ![]() 10C [xem TCVN 6404 (ISO 7218)].
10C [xem TCVN 6404 (ISO 7218)].
6.9 Chai để pha loãng, dung dịch từ 50 ml đến 250 ml hoặc các ống nghiệm đường kính 18 mm và dài 180 mm, có nắp đậy hoặc có nút bằng cao su hoặc vật liệu tổng hợp.
6.10 Bình hoặc chai, dung tích 150 ml đến 250 ml, có nắp đậy hoặc nút bằng cao su.
6.11 Ống nghiệm, dung tích khoảng 20 ml, để đựng môi trường nuôi cấy, có nắp đậy hoặc nút bằng cao su.
6.12 Pipet chia độ, dùng cho vi sinh vật học, được khử trùng và hiệu chuẩn đến đỉnh, có thể phân phối được 1 ml ![]() 0,02 ml và 10 ml
0,02 ml và 10 ml ![]() 0.2 ml [xem TCVN 6507-1 (ISO 6887-1)].
0.2 ml [xem TCVN 6507-1 (ISO 6887-1)].
6.13 Đĩa Petri, bằng thủy tinh hoặc bằng chất dẻo trong suốt không màu, đường kính từ 90 mm đến 140 mm, sâu tối thiểu 10 mm. Đáy của đĩa phải bằng phẳng để không ảnh hưởng đến việc đếm khuẩn lạc.
6.14 Dao trộn, thủy tinh hoặc kim loại đã được tiệt trùng.
7. Lấy mẫu
Mẫu gửi đến phòng thử nghiệm phải là mẫu đại diện. Mẫu không bị hư hỏng hoặc thay đổi trong suốt quá trình vận chuyển hoặc bảo quản.
Việc lấy mẫu không qui định trong tiêu chuẩn này. Nên lấy mẫu theo TCVN 6400 (ISO 707).
8. Chuẩn bị mẫu thử
Chuẩn bị mẫu thử theo TCVN 6263 (ISO 8261).
Chú ý cẩn thận trước khi mở hộp đựng sữa chua. Làm sạch bề mặt ngoài ngay xung quanh vùng lấy mẫu, để loại bỏ chất có thể làm nhiễm bẩn mẫu. Vùng này có thể được lau sạch bằng etanol 70 % (5.5) để tránh nhiễm bẩn tiếp theo. Mở hộp một cách vô trùng.
9. Cách tiến hành
9.1 Chuẩn bị phần mẫu thử
9.1.1 Yêu cầu chung
Xem TCVN 6263 (ISO 8261).
9.1.2 Sữa chua không có chứa trái cây
Trộn kỹ lượng chứa trong hộp đựng mẫu 1 min bằng bộ trộn (6.3). Cân 10 g ![]() 0,1 g mẫu thử trong vật chứa thích hợp như trong 9.1.2.
0,1 g mẫu thử trong vật chứa thích hợp như trong 9.1.2.
9.2 Kiểm tra bằng kính hiển vi
Tiến hành kiểm tra sơ bộ một vài tiêu bản bôi mẫu thử (Điều 8), trước đó đã được nhuộm xanh metylen (5.4), để ước tính mật độ của hai loại vi khuẩn hình cầu và hình que và để chọn đúng dải pha loãng cần được sử dụng để đếm mỗi loại vi khuẩn.
9.3 Chuẩn bị dung dịch pha loãng ban đầu
Xem TCVN 6263 (ISO 8261).
Các thao tác trong 9.3 đến 9.6.4 không được thực hiện dưới ánh nắng trực tiếp.
Thêm dung dịch pha loãng (5.1) vào phần mẫu thử (9.1.1 hoặc 9.1.2) cho đến khi khối lượng của phần mẫu thử và dịch pha loãng là 50 g. Trộn trong 1 min bằng bộ trộn (6.3). Thêm dịch pha loãng đến 100 g để thu được dung dịch pha loãng 10-1.
9.4 Chuẩn bị các dung dịch pha loãng thập phân
Xem TCVN 6263 (ISO 8261).
9.5 Thời gian tiến hành
Xem TCVN 6263 (ISO 8261).
9.6 Nuôi cấy và ủ
9.6.1 Lấy hai đĩa Petri (6.13), dùng pipet vô trùng (6.12) cho vào mỗi đĩa 1 ml dung dịch pha loãng, lặp lại hai lần (đối với cả Lactobacillus delbrueckii subsp, bulgaricus và Streptococcus thermophilus).
9.6.2 Đối với Lactobacillus delbrueckii subsp. bulgaricus, rót 15 ml môi trường MRS đã axit hóa (5.2.1) được duy trì trên nồi cách thủy (6.7) ở 45 0C vào mỗi đĩa Petri (6.13).
9.6.3 Đối với Streptococcus thermophilus, rót 15 ml môi trường M 17 (5.2.2) được duy trì trên nồi cách thủy (6.7) từ 44 0C đến 47 0C vào mỗi đĩa Petri (6.13).
9.6.4 Ngay sau khi rót, trộn kỹ dung dịch cấy với môi trường bằng cách xoay các đĩa Petri (9.6.2 hoặc 9.6.3). Để hỗn hợp đông đặc bằng cách để đĩa Petri trên mặt phẳng nằm ngang, mát.
9.6.5 Ủ các đĩa đã chuẩn bị với tư thế lật úp. Không chồng các đĩa cao quá 6 lớp. Các chồng đĩa được để riêng, cách trần và thành tủ ấm (6.1).
9.6.6 Ủ các đĩa dùng để định lượng L. delbrueckii subsp. bulgaricus trong tủ ấm yếm khí hoặc trong bình yếm khí (6.2) để trong tủ ấm ở 37 0C trong 72 h.
9.6.7 Ủ các đĩa dùng để đếm S. thermophilus trong tủ ấm (6.1) ở 37 0C trong 48 h.
9.7 Đếm khuẩn lạc
9.7.1 Sau thời gian ủ qui định (9.6.6 hoặc 9.6.7), đếm khuẩn lạc cho thấy các điểm đặc trưng của từng vi sinh vật điển hình [Lactobacillus delbrueckii subsp. bulgaricus (3.2) và Streptococcus thermophilus (3.3)] trên các đĩa thạch có chứa từ 15 khuẩn lạc đến 300 khuẩn lạc (xem Phụ lục A).
CHÚ THÍCH Nếu gặp phải các vấn đề khi đếm L. delbrueckii subsp. bulgaricus sử dụng môi trường MRS, thì có thể sử dụng môi trường LBA do NIZO 2)xây dựng, xem Phụ lục A.
9.7.2 Kiểm tra các đĩa dưới ánh sáng đục. Để thuận tiện cho việc đếm, có thể sử dụng dụng cụ đếm thích hợp (6.5). Chú ý để không nhầm các hạt của mẫu không hòa tan hoặc các chất kết tủa với các khuẩn lạc nhỏ. Để kiểm tra sự nghi ngờ này, có thể dùng thấu kính (6.6) có độ phóng đại cao hơn để phân biệt được các khuẩn lạc với các chất lạ.
9.8 Khẳng định
Chọn các khuẩn lạc từ các đĩa được dùng để đếm sao cho số lượng được lấy bằng căn bậc hai của số đếm khuẩn lạc tổng số. Nhuộm màu các khuẩn lạc này bằng phương pháp Gram và khẳng định rằng chúng không sinh các bào tử, các vi khuẩn hình que Gram dương, catalaza âm (trong trường hợp các khuẩn lạc này phát triển trên môi trường MRS), các chuỗi vi khuẩn hình cầu hoặc khuẩn cầu đôi Gram dương, catalaza âm (trường hợp các khuẩn lạc này phát triển trên môi trường M 17) [xem TCVN 6404 (ISO 7218)].
Nhận biết các chủng nghi ngờ bằng cách kiểm tra theo ISO 9232.
10. Tính và biểu thị kết quả
10.1 Phương pháp tính
10.1.1 Sử dụng các đĩa có từ 15 khuẩn lạc đến 300 khuẩn lạc thu được trong 9.7.1 hoặc 9.7.2.
10.1.2 Tính số lượng khuẩn lạc của từng vi sinh vật đặc trưng trong mẫu thử, theo công thức sau:
N = 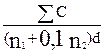
trong đó
N là số lượng vi sinh vật đặc trưng trên gam mẫu thử;
![]() là tổng số khuẩn lạc đếm được trên tất cả các đĩa được đếm (10.1.1);
là tổng số khuẩn lạc đếm được trên tất cả các đĩa được đếm (10.1.1);
n1 là số đĩa của độ pha loãng thứ nhất được đếm;
n2 là số đĩa của độ pha loãng thứ hai được đếm;
d là lượng mẫu chưa pha loãng có trong đĩa với dung dịch pha loãng thứ nhất, tính bằng gam (g).
VÍ DỤ Hệ số pha loãng 10 -2 nghĩa là 10 -2 g hoặc 10 -2 ml mẫu thử chưa pha loãng (trong trạng thái pha loãng) đã chuyển vào đĩa).
CHÚ THÍCH Dung dịch pha loãng thứ nhất là dung dịch có hàm lượng mẫu thử cao nhất.
Trong trường hợp có ba dung dịch pha loãng, thì tính số lượng của mỗi vi sinh vật đặc trưng trong mẫu thử theo công thức sau:
N = 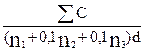
trong đó n3 là số đĩa được đếm sử dụng độ pha loãng thứ ba.
10.2 Biểu thị kết quả
10.2.1 Làm tròn kết quả thu được trong 10.1.2 đến hai chữ số có nghĩa. Đối với chữ số thứ ba, làm tròn chữ số thứ ba này đến zero gần nhất. Nếu chữ số thứ ba này là 5 thì làm tròn đến số thấp hơn nếu chữ số thứ hai là chẵn và làm tròn đến số cao hơn nếu chữ số thứ hai là số lẻ.
VÍ DỤ
| Làm tròn | 234 thành 230 |
|
| 235 thành 240 |
|
| 225 thành 220 |
|
| 245 thành 240 |
10.2.2 Nếu chỉ có số đếm nhỏ hơn 10, thì báo cáo kết quả như sau:
“ít hơn 10 x 1/d (d là giá trị tương ứng với độ pha loãng thấp nhất”
10.2.3 Nếu chỉ có các số đếm lớn hơn 300, thì tính số đếm ước lượng từ các đĩa có số đếm gần 300 khuẩn lạc và nhân với số nghịch đảo của giá trị ứng với độ pha loãng cao nhất. Báo cáo kết quả như sau:
“Số lượng vi sinh vật tối thiểu ước tính trên gam sản phẩm”
10.2.4 Kết quả được biểu thị bằng số từ 1,0 đến 9,9 nhân với lũy thừa tương ứng của 10.
10.2.5 Số lượng tổng số các vi sinh vật đặc trưng, N, trên gam mẫu bằng:
N = NL + NS
trong đó
NL là số lượng L. delbrueckii subsp. bulgaricus trên gam, tính được trong 10.1.2.
NS số lượng S.thermophilus trên gam, tính được trong 10.1.2.
10.3 Các ví dụ về cách tính
10.3.1 L.delbrueckii subsp. bulgaricus
Giả sử rằng số đếm L.delbrueckii subsp. bulgaricus cho các kết quả sau đây (hai đĩa Petri cho một độ pha loãng đã được ủ):
Độ pha loãng 10-5: 295 và 245 khuẩn lạc
Độ pha loãng 10-6: 33 và 40 khuẩn lạc
Khi đó
N = 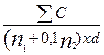 =
= ![]() =
= ![]() = 278,6 x 105
= 278,6 x 105
Làm tròn kết quả theo 10.2.1 thu được 280 x 105 trên gam. Khi đó số ước tính L.delbrueckii subsp. bulgaricus,được biểu thị theo 10.2.4 là 2,8 x 107 trên gam.
10.3.2 S.thermophllus
Tương tự, đối với S.thermophilus, thì số ước tính là 4,9 x 108 trên gam đối với sữa chua.
Do đó, số lượng tổng số của các vi sinh vật đặc trưng bằng:
N = (2,8 x 107) + (4,9 x 108) = 5,18 x 108 trên gam
Khi được làm tròn số theo 10.2.4 thì N = 5,2 x 108 trên gam mẫu thử.
11. Độ chụm
11.1 Yêu cầu chung
Sự phân bố Poisson của các vi sinh vật trong cơ chất, thì các giới hạn tin cậy của phương pháp này thay đổi theo số đếm các khuẩn lạc được kiểm tra từ ![]() 16 % đến
16 % đến ![]() 52 %. Trong thực tế, có thể cao hơn. Trong nhiều nghiên cứu liên phòng thử nghiệm phù hợp với IDF 135, thì độ lệch chuẩn lặp lại (sr) ở khoảng 0,20 log đơn vị và độ lệch chuẩn tái lặp (sR) ở khoảng 0,35 log đơn vị phù hợp với TCVN 6910-1 (ISO 5725-1) và TCVN 6901-2 (ISO 5725).
52 %. Trong thực tế, có thể cao hơn. Trong nhiều nghiên cứu liên phòng thử nghiệm phù hợp với IDF 135, thì độ lệch chuẩn lặp lại (sr) ở khoảng 0,20 log đơn vị và độ lệch chuẩn tái lặp (sR) ở khoảng 0,35 log đơn vị phù hợp với TCVN 6910-1 (ISO 5725-1) và TCVN 6901-2 (ISO 5725).
Thông tin thêm về giới hạn độ tin cậy về ước tính các số lượng nhỏ vi sinh vật được nêu trong TCVN 6404 (ISO 7218).
CHÚ THÍCH IDF 135 được dựa theo ISO 5725.
11.2 Độ lặp lại
Kinh nghiệm cho thấy rằng nếu hai phòng thử nghiệm độc lập trên cùng một mẫu thử thường cho kết quả cao hơn 30 % so với kết quả thấp hơn thì cần kiểm tra lại qui trình để tìm ra sai lỗi.
12. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải chỉ ra:
a) mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
b) phương pháp lấy mẫu đã sử dụng, nếu biết;
c) phương pháp thử đã sử dụng và viện dẫn tiêu chuẩn này;
d) tất cả các chi tiết thao tác không qui định trong tiêu chuẩn này, cùng với các chi tiết bất thường nào khác có thể ảnh hưởng tới kết quả;
e) kết quả thử nghiệm thu được, hoặc nếu độ lặp lại được kiểm tra thì nêu kết quả cuối cùng thu được.
Phụ lục A
(Tham khảo)
Các chú ý về quá trình
Cả hai môi trường nuôi cấy được khuyến cáo (MRS đã axit hóa và M 17) là môi trường chọn lọc.
Phần lớn các chủng S.thermophilus không hình thành các khuẩn lạc nhìn thấy được trên môi trường MRS trong các dung dịch pha loãng thường dùng để L.delbrueckii subsp. bulgaricus. Tuy nhiên, khi số lượng lactobacilii trong mẫu sữa chua là thấp đáng kể so với số lượng streptococci, các dung dịch thấp cần được sử dụng để đếm L.delbrueckii subsp. bulgaricus.
Dưới các điều kiện này, một số S.thermophilus có thể hình thành các khuẩn lạc rất nhỏ trên các đĩa đựng môi trường MRS đã axit hóa. Các khuẩn lạc này có thể dễ dàng phân biệt được bằng mắt thường với các khuẩn lạc của L.delbrueckii subsp. bulgaricus (có kích thước lớn hơn) và có thể được kiểm tra thêm bằng kính hiển vi. Ngoài ra, một số chủng L.delbrueckii subsp. bulgaricus cho thấy phát triển yếu hoặ không phát triển trên môi trường MRS và đôi khi cũng khó phân biệt được với S.thermophilus.
Khi các chủng S.thermophilus mọc rất chậm hoặc không thể mọc được, thì khuyến cáo một số điều kiện cụ thể như sau:
- nhiệt độ ủ cao hơn (ủ hiếu khí ở 39 0C đến 42 0C và 45 0C trong 24 h);
- giảm hàm lượng ![]() -glyxerophosphat;
-glyxerophosphat;
- thay đổi pH;
- hết sức chú ý khi quay trộn.
Khi các chủng L. delbrueckii subsp. bulgaricus mọc rất chậm hoặc không thể mọc được, thì khuyến cáo một số điều kiện cụ thể như sau:
- ủ thêm 3 ngày, lên đến 5 hoặc 6 ngày;
- nhiệt độ ủ cao hơn (ủ yếm khí ở 40 0C đến 42 0C và 45 0C trong 48 h);
- thay đổi pH;
- hết sức chú ý khi quay trộn;
- môi trường khí (tăng CO2, chỉ có CO2…)
L.delbrueckii subsp. bulgaricus khi mọc yếm khí trong sữa chua, thì không thể ước tính được trong môi trường MRS. Vấn đề này không gặp phải khi sử dụng môi trường LBA (xem chú thích trong 9.7.1) dưới các điều kiện yếm khí ở 50 0C ![]() 0,5 0C trong 72 h.
0,5 0C trong 72 h.
Mặt khác, hầu hết giống L. delbrueckii subsp. bulgaricus không hình thành các khuẩn lạc có thể thấy trên đĩa M17 với dung dịch pha loãng thường sử dụng để đếm S.thermophilus. Xác nhận này dễ dàng được tìm thấy (xem [8]).
Mặt khác, phần lớn L. delbrueckii subsp. bulgaricus có thể hình thành các khuẩn lạc nhỏ trên môi trường M 17, đặc biệt là trong các mẫu sữa chua có lượng lactobacilli cao hơn so với streptococci. Các khuẩn lạc thô nhỏ này thường có vẻ bề ngoài xù xì hoặc xoăn tít như bông và chúng có thể dễ dàng nhận biết được bằng mắt thường (và tốt nhất là dùng kính lúp) và được kiểm tra thêm bằng kính hiển vi, từ các khuẩn lạc L. delbrueckii subsp. bulgaricus hạt đậu trơn nhẵn có kích thước lớn.
Việc chọn môi trường, chuẩn bị mẫu thử, qui trình nuôi cấy và đếm là các phần quan trọng trong phép thử. Vì các kỹ thuật viên phải quen thuộc với phương pháp, độ chính xác cải thiện đáng kể.
Ngoài ra, không có các chủng thử nghiệm thích hợp được dùng để kiểm tra tính chọn lọc của các chủng, vì các chủng được sử dụng trong sữa chua có rất nhiều và khác so với các chủng được sử dụng trong các phép thử đến mức mà một số chủng của các loài nhất định (ví dụ: S.thermophilus) có thể mọc ngay cả trên môi trường chọn lọc của các loài khác (ví dụ: L. delbrueckii subsp. bulgaricus).
THƯ MỤC LIỆU THAM KHẢO
[1] TCVN 6400 (ISO 707), Sữa và sản phẩm sữa – Hướng dẫn lấy mẫu.
[2] TCVN 6901-1 (ISO 5725-1), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo. Phần 1: Nguyên tắc và định nghĩa chung.
[3] TCVN 6910-2 (ISO 5725-2), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo. Phần 2: Phương pháp cơ bản xác định độ lặp lại và độ tái lặp của phương pháp đo tiêu chuẩn.
[4] ISO 9232/IDF 146, Yogurt – Identification of characteristic microorganisms (Lactobacillus delbrueckii. Bulgaricus and Streptococcus thermophilus)
[5] TCVN 8128-1 : 2009 (ISO/TS 11133-1), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi – Hướng dẫn chuẩn bị và pha chế môi trường nuôi cấy – Phần 1: Hướng dẫn chung về đảm bảo chất lượng việc chuẩn bị môi trường nuôi cấy trong phòng thử nghiệm.
[6] IDF 135, Milk and milk products – Precision characteristics of analytical methods – Outline of collaborative study procedure
[7] De MAN, JK, ROGOSA. M. and SHARPE. M.E A medium for the cultivation of lactobacillt. J. Appl. Bactenoi. 23. 1960, pp 130- 135
[18] TER2AGHI. B.E and SANDINE, W.E Improved medium for lactic streptococci and their bacteriophages J Appl. Microbiol, 29, 1975, pp 807-813
[9] SHANKAR, P. A and DA VIES F.L Recent developments in yoghurt starters. Il A note on the suppression of Lactobacillus bulgaricus in media containing ^-glycerophosphate and application of such media to selective isolation of Streptococcus thermophilic from yoghurt. J. Soc Dairy Tcctmol., 30(1). 1997. pp. 28-30 (Annex 8).
2) Cơ quan nghiên cứu thực phẩm NIZO, Kernhemseweg 2, Postbus 20 6710 BA, Ede, Netheriand.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 8177:2009 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 8177:2009 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 8177:2009 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 8177:2009 DOC (Bản Word)