- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Việt Nam TCVN 6489:1999 Chất lượng nước - Đánh giá khả năng phân hủy sinh học hiếu khí
| Số hiệu: | TCVN 6489:1999 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Đang cập nhật | Lĩnh vực: | Tài nguyên-Môi trường |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
01/01/1999 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 6489:1999
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
TIÊU CHUẨN VIỆT NAM
TCVN 6489:1999
CHẤT LƯỢNG NƯỚC - ĐÁNH GIÁ KHẢ NĂNG PHÂN HỦY SINH HỌC HIẾU KHÍ "HOÀN TOÀN" CỦA CÁC CHẤT HỮU CƠ TRONG MÔI TRƯỜNG NƯỚC - PHƯƠNG PHÁP DỰA TRÊN SỰ PHÂN TÍCH CACBON DIOXIT ĐƯỢC GIẢI PHÓNG
Water quality - Evaluation in an aqueous medium of the "ultimate" aerobic biodegradability of organic compounds - Method by analysis of released carbon dioxitde
1. Phạm vi áp dụng
Tiêu chuẩn này qui định một phương pháp dựa trên phân tích cacbon dioxit được giải phóng để đánh giá khả năng phân hủy sinh học hiếu khí "hoàn toàn" các hợp chất hữu cơ ở nồng độ đã cho trong môi trường nước.
Phương pháp áp dụng cho các hợp chất hữu cơ:
a) tan trong các điều kiện thử;
b) không tan trong các điều kiện thử, trong trường hợp đó cần phải có phép đo đặc biệt để đạt được sự phân tán tốt của hợp chất.
c) không bay hơi hoặc có áp suất hơi có thể bỏ qua trong những điều kiện thử.
d) không ức chế các vi sinh vật thử ở nồng độ đã chọn cho phép thử. Hiệu ứng ức chế có thể xác định theo 8.3, hoặc dùng một phương pháp khác để xác định hiệu ứng ức chế của hợp chất lên vi khuẩn (ví dụ xem TCVN 6226 : 1996 (ISO 8192 : 1986))
2. Tiêu chuẩn trích dẫn
ISO 7827 : 1984 Chất lượng nước - Đánh giá khả năng phân hủy hiếu khí "hoàn toàn" các hợp chất hữu cơ trong môi trường nước. Phương pháp dựa trên sự phân tích cacbon hữu cơ hòa tan (DOC).
TCVN 6226 : 1996 (ISO 8192 : 1986) Chất lượng nước - Thử sự ức chế của tiêu thụ oxi bởi bùn hoạt hóa.
3. Định nghĩa
Tiêu chuẩn này dùng các định nghĩa sau:
3.1. Sự phân hủy sinh học hoàn toàn: mức phân hủy đạt được khi hợp chất thử được vi sinh vật sử dụng hoàn toàn để tạo ra cacbon dioxit, nước, muối vô cơ và tế bào mới (sinh khối).
3.2. Chất rắn lơ lửng (của bùn hoạt hóa): chất rắn được lấy ra bằng cách lọc hoặc ly tâm từ một thể tích bùn dưới những điều kiện riêng, và trong tiêu chuẩn này, sấy khô ở khoảng 100oC.
3.3. Sự tiếp xúc trước (hoặc sự làm phù hợp trước): sự ủ trước chủng cấy, khi có mặt hợp chất thử nhằm mục đích tăng khả năng của chủng cấy để phân hủy hợp chất thử.
3.4. Sự thích nghi trước (hoặc sự điều hòa trước): Sự ủ trước chủng cấy dưới điều kiện thử nhưng không có hợp chất thử, nhằm nâng cao hiệu quả của phép thử.
4. Nguyên tắc
Xác định phân hủy sinh học các hợp chất hữu cơ bởi vi sinh vật hiếu khí bằng cách dùng môi trường thử. Hợp chất hữu cơ là nguồn cacbon và năng lượng duy nhất trong môi trường. Mức độ phân hủy sinh học được xác định gián tiếp bằng cách đo cacbon dioxi được giải phóng trong suốt thời gian thử (28 ngày). Nồng độ của hợp chất được dùng phải có hàm lượng cacbon hữu cơ ban đầu là từ 10 mg/l đến 40 mg/l). Nếu cần có thể dùng trên 40 mg/l để có thêm thông tin. Nồng độ DOC ở cuối phép thử sẽ được xác định, đối với các tạp chất trong nước.
5. Môi trường thử
Sự ủ tiến hành ở trong bóng tối hoặc trong ánh sáng khuếch tán, ở nơi kín, nhiệt độ không đổi được giữ giữa 20oC đến 25oC (± 1oC) và không có hơi độc.
6. Thuốc thử
Chỉ dùng các thuốc thử tinh khiết phân tích.
6.1. Nước cất hoặc nước khử ion
Chứa ít hơn 10 % DOC đầu tiên gây ra do hợp chất hữu cơ đem thử.
6.2. Môi trường thử
6.2.1. Thành phần
6.2.1.1. Dung dịch a)
Kali dihidrophotphat khan (KH2PO4) 8,5 g
Dikali hidrophotphat khan (K2HPO4) 21,75 g
Dinatri hidrophotphat ngậm 2 phân tử nước (Na2HPO4.2H2O) 33,4 g
Amoni clorua (NH4Cl) 0,5 g
Nước (6.1) cần thiết để pha thành 1000 ml.
Giá trị pH của dung dịch này phải khoảng 7.4.
6.2.1.2. Dung dịch b)
Hòa tan 22,5 g magiê sunphat ngậm 7 phân tử nước (MgSO4.7H2O) trong 1000 ml nước (6.1).
6.2.1.3. Dung dịch c)
Hòa tan 27,5 g canxiclorua khan (CaCl2) hoặc 36,4 g canxi clorua ngậm 2 phân tử nước (CaCl2.2H2O) trong 1000 ml nước (6.1).
6.2.1.4. Dung dịch d)
Hòa tan 0,25 g sắt (III) clorua ngậm 6 phân tử nước (FeCl3).6H2O) trong 1000 ml nước (6.1). Chuẩn bị dung dịch này ngay khi dùng.
Chú thích - Nếu thêm 1 giọt HCl đặc hoặc EDTA 0,4 g/l thì không phải chuẩn bị dung dịch này ngay khi dùng
6.2.2. Chuẩn bị môi trường thử
Đối với 1 lít môi trường thử lấy 800 ml nước (6.1), ngay trước khi dùng thêm vào đó:
- 10 ml dung dịch a) và sau đó:
- 1 ml mỗi dung dịch b); c) và d) (để tránh tạo đục ở môi trường cuối cùng)
Thêm nước (6.1) đến 1000 ml.
7. Thiết bị, dụng cụ
Phải bảo đảm các dụng cụ thủy tinh được rửa cẩn thận, sạch chất hữu cơ và chất độc.
Các dụng cụ thông thường trong phòng thí nghiệm và
7.1. Bình thủy tinh, bình nón hoặc bình khác cho phép sục khí và khuấy từ (xem 8.3).
7.2. Hệ thống cấp không khí không chứa CO2: đảm bảo cấp cho mỗi bình thử ở tốc độ dòng từ 50 ml/phút đến 100 ml/phút, giữ không đổi khoảng 10 % (xem ví dụ về máy ở phụ lục A)
Kiểm tra để đảm bảo không có CO2 trong hệ không khí.
7.3. Máy để xác định CO2, máy phân tích cacbon dioxit hoặc thiết bị chuẩn độ để xác định tổng lượng CO2 bị hấp thụ hoàn toàn trong dung dịch kiềm (xem nguyên tắc hệ thống thử CO2 được giải phóng ở phụ lục A).
7.4. Thiết bị lọc, có màng lọc cỡ lỗ thích hợp (đường kính danh định từ 0,2 mm đến 0,45 mm), nó hấp phụ hợp chất hữu cơ hoặc cacbon hữu cơ giải phóng ra đến mức thấp nhất.
7.5. Máy dùng xác định nồng độ cacbon hữu cơ hòa tan.
7.6. Máy ly tâm
7.7. pH-mét
8. Tiến hành thử
8.1. Chuẩn bị các dung dịch thử
8.1.1. Dung dịch hợp chất thử
Chuẩn bị dung dịch gốc hợp chất thử trong môi trường thử (6.2). Pha loãng một lượng thích hợp dung dịch này trong môi trường đã sục khí trước (xem 8.3) để thu được nồng độ cuối cùng cacbon hữu cơ từ 10 mg/l đến 40 mg/l.
Chú thích - Hợp chất ít tan trong nước có thể thêm trực tiếp ở dạng rắn hoặc lỏng vào môi trường chứa trong bình thích hợp.
8.1.2. Dung dịch của chất đối chứng
Chuẩn bị một dung dịch gốc của chất đối chứng (một hợp chất hữu cơ đã biết khả năng phân hủy sinh học như là natri axêtat, natri benzoat, anilin) trong môi trường thử (6.2) tương tự như 8.1.1 để có được nồng độ cuối cùng của cacbon hữu cơ là 20 mg/l.
8.1.3. Dung dịch để kiểm tra sự ức chế
Nếu cần thiết thì chuẩn bị dung dịch trong môi trường thử (6.2) chứa chất thử và chất đối chứng với nồng độ tương ứng với 8.1.1 và 8.1.2.
8.2. Chuẩn bị chủng cấy
Chuẩn bị chủng cấy bằng cách dùng các nguồn hoặc hỗn hợp các nguồn sau đây để thu được một quần thể vi sinh vật cho hoạt tính phân hủy đủ mạnh. Kiểm tra khả năng này bằng hợp chất đối chứng (8.1.2).
Sự tạo ra cacbon dioxit trong dung dịch trắng phải ở trong khoảng 30 mg/l đến 40 mg/l và không được vượt quá 70 mg/l. Để giảm ảnh hưởng của dung dịch trắng người ta sục khí vào bùn một tuần lễ trước khi đem dùng (xem mục 10b).
Lượng cacbon hữu cơ hòa tan do chủng cấy cung cấp phải ít hơn 10% cacbon hữu cơ đầu tiên do chất thử gây ra.
Chú thích 3 - Trong một số trường hợp chủng được tiếp xúc trước có thể dùng nhưng cần nói rõ trong kết quả thử (ví dụ phần trăm phân hủy sinh học = x % dùng chủng tiếp xúc trước) và phương pháp tiếp xúc trước cần nói chi tiết trong báo cáo.
Sự tiếp xúc trước có thể nhận được từ những phép phân hủy ở phòng thí nghiệm dưới các điều kiện khác nhau (ví dụ thử Zahn-Wellensn và SCAS) hoặc từ những mẫu thu thập được ở những nơi mà điều kiện môi trường thích hợp (ví dụ trạm xử lý làm việc với hợp chất tương tự, các vùng ô nhiễm...).
8.2.1. Chủng cấy từ dòng thải thứ cấp
Lấy mẫu từ dòng thải thứ cấp của một trạm xử lý đang làm việc chủ yếu với nước thải sinh hoạt. Giữ mẫu này dưới điều kiện thoáng khí và dùng trong ngày lấy mẫu.
Từ mẫu này, ta chuẩn bị chủng cấy như sau:
- để mẫu lắng 1 giờ;
- lấy một thể tích thích hợp 1 ở phần nổi bên trên để làm chủng cấy, dùng trong ngày.
_________
1 Thể tích thích hợp nghĩa là
- đủ quần thể vi sinh vật để cho hoạt tính phân hủy đủ, đủ để tạo cho quần thể sinh vật hoạt động phân hủy sinh học thỏa đáng;
- phân hủy (các) hợp chất đối chứng theo phần trăm đã định;
- chứa 103 đến 105 tế bào hoạt động / ml;
- tạo ra CO2 trong dung dịch trắng không quá 70 mg/l (thông thường từ 30 mg/l đến 40 mg/l);
- tương đương 30 mg bùn hoạt hóa trong 1l trong hỗn hợp phản ứng cuối cùng.
8.2.2. Chủng cấy từ trạm bùn hoạt hóa
Lấy một thể tích thích hợp1 chủng cấy, ví dụ một mẫu bùn hoạt hóa từ bể sục khí của một trạm xử lý nước cống, chủ yếu là nước thải sinh hoạt.
Trộn kỹ, để thoáng khí và dùng trong ngày lấy mẫu.
Ngay trước khi dùng, xác định nồng độ chất rắn lơ lửng1. Nếu cần thì cô đặc lại bằng cách để lắng để sao cho thể tích của bùn đạt ít nhất 30 mg chất khô trong 1 lít.
8.2.3. Chủng cấy từ nước mặt hoặc từ hệ thống thải của một trạm xử lý nước thải sinh hoạt.
Lấy mẫu nước mặt thích hợp.
Mẫu này được giữ thoáng khí và được dùng trong ngày chuẩn bị.
Lấy thể tích thích hợp (xem ghi chú 1 mục 8.2.2) chủng cấy từ mẫu.
Nếu cần có thể cô đặc chủng cấy bằng lọc hoặc ly tâm.
8.3. Tiến hành thử
Chuẩn bị các bình thử (7.1) gồm các bình:
a) hai bình chứa chất thử (ký hiệu FT);
b) hai bình chứa dung dịch trắng (ký hiệu FB);
c) một bình để kiểm tra hoạt tính của chủng cấy (ký hiệu FC)
và nếu cần:
d) một bình để kiểm tra rằng sản phẩm không phải do sự phân hủy vô sinh (ký hiệu FS);
e) một bình để kiểm tra hiệu ứng ức chế (ký hiệu Fi);
Thêm một lượng thích hợp môi trường thử (6.2) và chủng cấy (8.2) vào mỗi bình như chỉ ra ở bảng 1. Lắc kỹ các bình và nối chúng vào hệ cung cấp không khí không chứa CO2 (xem 7.3 và phụ lục A).
Thổi khí không có CO2 trong vòng 24 giờ qua các bình để đuổi khí CO2. Sau thời gian thông khí, đưa dung dịch Ba(OH)2 hoặc NaOH vào bình hấp thụ CO2 (xem phụ lục A) và nối tiếp theo seri vào lối thoát của mỗi bình thử, hoặc nối tiếp vào hệ thống đo CO2.
Thêm dung dịch gốc chất thử (8.1.1) và chất đối chứng (8.1.2) vào các bình tương ứng theo bảng 1 và ủ ở nhiệt độ từ 20oC đến 25oC ± 1oC trong 28 ngày.
Kiểm tra xem tốc độ dòng khí có giống nhau không trong tất cả các bình và có đúng là từ 50 ml/phút đến 100 ml/phút không.
Bảng 1 - Sự phân phối cuối cùng môi trường thử và chủng cấy
| Bình | Dung dịch | Chủng cấy1 (8.2) | |||
| Môi trường thử (6.2) | Dung dịch chất thử (8.1.1) | Dung dịch chất đối chứng (8.1.2) | Dung dịch thử ức chế (8.1.3) | ||
| lít | ml | ||||
| Thử FT | 0 | 2,5 | 0 | 0 | n |
| Thử FT | 0 | 2,5 | 0 | 0 | n |
| Dung dịch trắng FB | 2,5 | 0 | 0 | 0 | n |
| Dung dịch trắng FB | 2,5 | 0 | 0 | 0 | n |
| Kiểm tra chủng cấy Fc | 0 | 0 | 2,5 | 0 | n |
| Kiểm tra phân hủy phi sinh học Fs (tùy chọn) | 0 | 2,52 | 0 | 0 | o |
| Kiểm tra ức chế Fi (tùy chọn) | 0 | 0 | 0 | 2,5 | n |
| 1) Thể tích chủng cấy (n ml) cần phải phù hợp với phép thử trắng (xem 10b) và thu được quần thể đủ vi sinh vật. 2) Thể tích của dung dịch chất thử (8.1.1) trong bình Fs được tiệt trùng bằng cách thêm 1ml dung dịch thủy ngân clorua (HgCl2) hoặc chất độc khác ngăn cản hoạt động vi sinh vật. | |||||
Đo lượng khí CO2 được giải phóng từ mỗi bình ở các khoảng thời gian đều đặn (ví dụ 1, 7, 14, 21 và 28 ngày). Nếu cần thì đo ở khoảng thời gian ngắn hơn và/hoặc kéo dài hơn 28 ngày.
Phụ lục B nêu phương pháp chuẩn độ để xác định CO2 khi thiết bị nêu ở phụ lục A được dùng.
Nếu mức độ phân hủy trở nên không đổi trước 28 ngày thì phép thử coi là hoàn thành.
Vào ngày cuối của phép thử (thường là ngày thứ 28) axit hóa các bình bằng 1 ml HCl đặc để phá cacbonat và hidro bicacbonat. Tiếp tục thổi khí 24 giờ và sau đó đo lượng CO2 được giải phóng ở mỗi bình.
Chú thích 4 - Vì dung lượng đệm của môi trường tương đối cao, cần axit hóa môi trường thử ở ngày lấy mẫu cuối cùng để đảm bảo đuổi hết CO2 hòa tan. Nếu DOC cần được đo để cung cấp thông tin bổ trợ về phân hủy sinh học thì lấy mẫu ở ngày 0 và ở ngày cuối của sự thử (trước khi axit hóa các bình) ở mỗi bình và xác định DOC.
9. Tính toán và biểu thị kết quả
9.1. Tính toán
9.1.1. Lượng CO2 sinh ra từ sự phân hủy lý thuyết của hợp chất.
Lượng CO2 lý thuyết (ThCO2) được tính bằng miligam theo công thức
ThCO2 = C x V x
Trong đó
C là nồng độ của hợp chất thử trong dung dịch thử, đo được hoặc tính từ nồng độ đo được trong dung dịch gốc của chất thử (8.1.1), có tính đến sự pha loãng, tính bằng miligam cacbon hữu cơ trong lít;
V là thể tích của dung dịch thử, tính bằng lít;
44 và 12 là khối lượng mol và nguyên tử của CO2 và C.
9.1.2. Mức phân hủy phần trăm
Xác định phần trăm phân hủy DT đối với bình thử FT, bình thử chủng cấy FC và bình thử ức chế Fi (nếu có làm) từ lượng CO2 được giải phóng trong mỗi khoảng thời gian bằng công thức sau:
DT = x 100
Trong đó
(CO2)T là lượng CO2 trung bình của tổng lượng CO2 được giải phóng trong bình FT từ đầu đến thời điểm t, tính bằng miligam;
(CO2)B là lượng CO2 trung bình của tổng lượng CO2 được giải phóng trong bình FB từ đầu đến thời điểm t, tính bằng miligam;
ThCO2 là lượng CO2 lý thuyết xác định theo 9.1.1, tính bằng miligam.
Chú thích:
5. Sự phân hủy sinh học (bình Fs) được tính tương tự, nhưng không chú ý đến CO2)13.
6. Có thể dùng việc xác định DOC để xác định mức phân hủy phần trăm cuối cùng Dt (xem ISO 7872).
9.2. Biểu thị kết quả
Lập bảng về phần trăm phân hủy cho mỗi lần xác định và cho mỗi bình. Nếu kết quả gần nhau giữa hai bình thử kép thì lấy trung bình và vẽ đường cong phân hủy theo thời gian (xem phụ lục C).
Ghi lượng CO2 được giải phóng trong bình thử (Fs) để kiểm tra sự phân hủy vô sinh (Fs) và kiểm tra bất kỳ ảnh hướng ức chế của hợp chất (Fi) nếu các bình này có trong các bình thử.
10. Sự chắc chắn của kết quả
Phép thử được xem là chắc chắn nếu
a) phần trăm phân hủy trong bình Fc để kiểm tra sự cấy là lớn hơn 50 % ở ngày thứ 14;
b) lượng CO2 sinh ra từ dung dịch trắng trong khi thử là có ý nghĩa: tổng lượng CO2 thoát ra từ dung dịch trắng ở cuối phép thử phải nằm trong khoảng 30 mg/ml đến 40 mg/ml, và không vượt quá 70 mg/l.
Nếu bình Fi (thử ức chế) nằm trong phép thử, có thể giả thiết rằng chất thử bị ức chế nếu phần trăm phân hủy trung bình ít hơn 25 % trong 28 ngày. Trong trường hợp này cần lặp lại dãy thử và giảm nồng độ chất thử.
11. Báo cáo kết quả
Báo cáo kết quả phải có các thông tin sau
a) trích dẫn Tiêu chuẩn này;
b) các thông tin cần thiết để nhận dạng chất thử;
c) tên và nồng độ chất đối chứng;
d) các kết quả thu được (dạng bảng) và đường cong phân hủy, bao gồm cả kết quả thử chủng cấy (bình Fc) và thử ức chế (bình Fi) và thử sự phân hủy vô sinh (bình Fs) nếu chúng nằm trong dãy thử.
e) những đặc điểm của máy phân tích cacbon đã dùng;
f) những đặc điểm của thiết bị dùng để xác định CO2;
g) lý do loại bỏ kết quả (xem mục 10);
h) mọi sự tiếp xúc trước và làm quen trước của chủng cấy;
i) nồng độ chất thử và lượng DOC trong nồng độ này;
j) nguồn, tính chất và lượng chủng cấy đã dùng;
k) những yếu tố khác ngoài phương pháp này.
Phụ lục A
(tham khảo)
Nguyên tắc của hệ thống thử nghiệm với CO2 được giải phóng
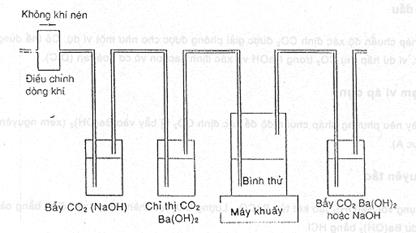
Không khí nén hoặc tổng hợp không chứa CO2 được cung cấp ở áp suất không đổi cho hệ thống thử.
Cacbon dioxit CO2 trong không khí được loại bằng cách cho qua dung dịch NaOH. Bẫy thứ hai chứa Ba(OH)2 để đảm bảo loại sạch CO2 trong dòng khí.
Không khí sau đó được sục qua bình thử. Nếu sự phân hủy sinh học xảy ra, CO2 tạo ra được hấp thụ vào bẫy chứa là NaOH hoặc Ba(OH)2. Trong trường hợp dùng NaOH, CO2 được xác định như cacbon vô cơ trong máy phân tích. Trường hợp thứ hai, dùng Ba(OH)2, CO2 được phân tích bằng phương pháp chuẩn độ như trong phụ lục B và cần một dãy ba bẫy.
Phụ lục B
(tham khảo)
Phương pháp chuẩn độ xác định CO2 được giải phóng
B.1. Mở đầu
Phương pháp chuẩn độ xác định CO2 được giải phóng được cho như một ví dụ. Có thể dùng phương pháp khác, ví dụ hấp thụ CO2 trong NaOH và xác định cacbon vô cơ hòa tan (DIC).
B.2. Phạm vi áp dụng
Phụ lục này nêu phương pháp chuẩn độ để xác định CO2 bị bẫy vào Ba(OH)2 (xem nguyên tắc thiết bị ở phụ lục A).
B.3. Nguyên tắc
CO2 tác dụng với Ba(OH)2 tạo kết tủa BaCO3. Lượng CO2 tạo thành được xác định bằng cách chuẩn độ lượng dư Ba(OH)2 bằng HCl.
B.4. Thiết bị dụng cụ
Mọi thiết bị thông thường trong phòng thí nghiệm.
B.5. Thuốc thử
B.5.1. Bari hidroxit dung dịch 0,0125 mol/l.
B.5.2. Axit clohidric dung dịch 0,05 mol/l.
B.5.3. Phenolphtalein, chất chỉ thị.
B.6. Tiến hành thử
Khi bắt đầu thử, lấy 100ml Ba(OH)2 (B.5.1) cho vào mỗi bình hấp thụ CO2 và nối chúng thành dãy 3 bình vào lối ra của mỗi bình thử.
Định kỳ (xem 8.3) và trước khi kết tủa BaCO3 ở bình hấp thụ thứ hai thì lấy bình hấp thụ thứ nhất ra để chuẩn độ. Chuyển hai bình hấp thụ gần lại bình thử và vị trí cuối cùng thì thay bằng một bình khác chứa 100ml Ba(OH)2 (B.5.1).
Chuẩn độ ngay lượng Ba(OH)2 còn lại bằng HCl (B.5.2) dùng phenolphtalein làm chỉ thị (B.5.3).
B.7. Tính toán
Lượng CO2 bị hấp thụ được tính toán như sau:
m = {100 x 2 x c[Ba(OH)2] - V x c(HCl)} x 22
Trong đó
m là khối lượng của CO2 trong bình hấp thụ, tính bằng miligam;
V là thể tích, của HCl (B.5.2) dùng cho chuẩn độ, tính bằng miligam;
c[Ba(OH)2] là nồng độ của Ba(OH)2, tính bằng mol trên lít;
c(HCl) là nồng độ của HCl, tính bằng mol trên lít;
Khi c[Ba(OH)2] = 0,0125 mol/l, c[HCl] = 0,05 mol/l thì
m = 1,1 (100 - V)
Phụ lục C
(tham khảo)
Thử sự tạo ra CO2
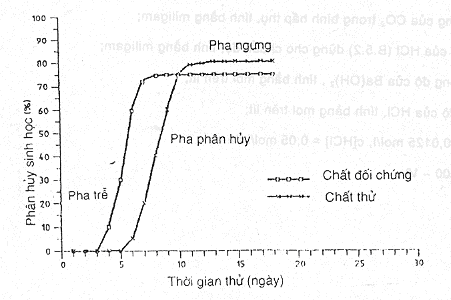
Hình C.1 - Thử sự tạo ra CO2 - Đường cong phân hủy sinh học
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 6489:1999 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 6489:1999 DOC (Bản Word)