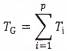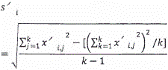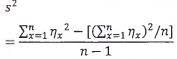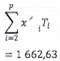- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 13452:2021 ISO/TS 12869:2019 Chất lượng nước - Phát hiện và định lượng Legionella spp. và/hoặc Legionella pneumophila bằng cô đặc và khuếch đại gen nhờ phản ứng định lượng chuỗi polymerase (QPCR)
| Số hiệu: | TCVN 13452:2021 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Tài nguyên-Môi trường |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
30/12/2021 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 13452:2021
Tiêu chuẩn Quốc gia TCVN 13452:2021: Phát hiện và định lượng Legionella spp. bằng qPCR
Tiêu chuẩn Quốc gia TCVN 13452:2021, được ban hành theo quy định của Tổng cục Tiêu chuẩn Đo lường Chất lượng, nhằm cung cấp phương pháp phát hiện và định lượng Legionella spp. và/hoặc Legionella pneumophila trong nước bằng kỹ thuật phản ứng định lượng chuỗi polymerase (qPCR). Tiêu chuẩn này hoàn toàn tương đương với ISO/TS 12869:2019 và có hiệu lực từ ngày 31 tháng 12 năm 2021.
TCVN 13452:2021 quy định các yêu cầu về phương pháp luận, đánh giá hiệu năng và kiểm soát chất lượng cho phép phát hiện và định lượng vi khuẩn Legionella trong nước. Các phương pháp này được áp dụng cho nhiều loại mẫu nước như nước nóng, nước lạnh và nước từ tháp làm mát. Việc phát hiện Legionella được thực hiện thông qua ba bước chính: cô đặc mẫu nước, tách chiết ADN và khuếch đại ADN bằng phương pháp qPCR.
Trong tiêu chuẩn, các yêu cầu về lấy mẫu cũng được đặc biệt chú trọng. Mẫu nước cần phải được thu thập trong các bình vô trùng và bảo quản ở nhiệt độ chính xác để đảm bảo độ tin cậy của kết quả. Cụ thể, mẫu được vận chuyển ở nhiệt độ từ 5 ± 3 °C trong vòng 24 giờ hoặc dưới -18 °C nếu lâu hơn.
Tiêu chuẩn này cũng đề xuất tổ chức phòng thí nghiệm phải tuân thủ các yêu cầu nghiêm ngặt về an toàn sinh học. Legionella spp. có thể gây nguy hiểm cho sức khỏe nếu không được xử lý đúng cách, do đó, chỉ những nhân viên đã qua đào tạo và có kinh nghiệm mới được phép thực hiện các phương pháp này trong môi trường phòng thí nghiệm an toàn.
Việc phát hiện và định lượng Legionella spp. được thực hiện với sự hỗ trợ của các thiết bị chính như máy chu trình nhiệt real-time PCR. Điều quan trọng là phải sử dụng các điều kiện thí nghiệm chính xác và thích hợp để đảm bảo độ chính xác của kết quả. Bên cạnh đó, tiêu chuẩn còn quy định rõ về các điều kiện thử nghiệm cũng như yêu cầu về hóa chất và thiết bị sử dụng trong quá trình phân tích.
Chính sách này không chỉ giữ vai trò quan trọng trong việc bảo vệ sức khỏe cộng đồng mà còn giúp các cơ sở nước, doanh nghiệp trong ngành nước nâng cao hiệu quả quản lý chất lượng, góp phần đảm bảo cung cấp nước sạch và an toàn cho người dân.
Tải tiêu chuẩn Việt Nam TCVN 13452:2021
TIÊU CHUẨN QUỐC GIA
TCVN 13452:2021
ISO/TS 12869:2019
CHẤT LƯỢNG NƯỚC - PHÁT HIỆN VÀ ĐỊNH LƯỢNG LEGIONELLA SPP. VÀ/HOẶC LEGIONELLA PNEUMOPHILA BẰNG CÔ ĐẶC VÀ KHUẾCH ĐẠI GEN NHỜ PHẢN ỨNG ĐỊNH LƯỢNG CHUỖI POLYMERASE (QPCR)
Water quality - Detection and quantification of Legionella spp. and/or Legionella pneumophila by concentration and genic amplification by quantitative polymerase chain reaction (qPCR)
Lời nói đầu
TCVN 13452:2021 hoàn toàn tương đương với ISO/TS 12869:2019;
TCVN 13452:2021 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC 147 Chất lượng nước biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
L. pneumophila hoặc Legionella spp. có trong mẫu nước được phát hiện và định lượng bằng cách khuếch đại các trình tự ADN (PCR) với các oligonucleotit cụ thể. Tính đặc hiệu của việc phát hiện được đảm bảo bằng cách sử dụng một đoạn dò được gắn nhãn huỳnh quang đặc hiệu trình tự đích. Việc tăng số lượng amplicon ADN có thể được đo và hiển thị bằng thiết bị PCR định lượng có các màng lọc đặc trưng fluorophore.
Đường chuẩn được sử dụng để định lượng. Các hướng dẫn, yêu cầu tối thiểu và đặc tính hiệu năng nhằm đảm bảo rằng các kết quả là đáng tin cậy và có độ tái lập giữa các phòng thử nghiệm.
Tiêu chuẩn này quy định phép xác định độ thu hồi của việc tách chiết ADN. Hiệu suất của quy trình tách chiết không được đề cập đầy đủ.
CHẤT LƯỢNG NƯỚC - PHÁT HIỆN VÀ ĐỊNH LƯỢNG LEGIONELLA SPP. VÀ/HOẶC LEGIONELLA PNEUMOPHILA BẰNG CÔ ĐẶC VÀ KHUẾCH ĐẠI GEN NHỜ PHẢN ỨNG ĐỊNH LƯỢNG CHUỖI POLYMERASE (QPCR)
Water quality - Detection and quantification of Legionella spp. and/or Legionella pneumophila by concentration and genic amplification by quantitative polymerase chain reaction (qPCR)
CẢNH BÁO - Legionella spp. phải được xử lý một cách an toàn bởi những người phân tích vi sinh có kinh nghiệm trong phòng thí nghiệm vi sinh thông thường đáp ứng mức an toàn 2. Sự lây nhiễm Legionella spp. là do hít phải sinh vật này; do đó cần phải đánh giá tất cả các kỹ thuật về khả năng chúng sinh rasol khí. Trong trường hợp nghi ngờ, thực hiện các thao tác trong tủ an toàn.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp phát hiện và định lượng Legionella spp.và L. pneumophila sử dụng phản ứng định lượng chuỗi polymerase (qPCR). Tiêu chuẩn này đưa ra các yêu cầu về phương pháp luận chung, các yêu cầu đánh giá hiệu năng và các yêu cầu kiểm soát chất lượng.
Các chi tiết kỹ thuật quy định trong tiêu chuẩn này chỉ nhằm cung cấp cho thông tin.Tất cả giải pháp kỹ thuật khác phù hợp với các yêu cầu về hiệu năng đều thích hợp.
CHÚ THÍCH 1: Đối với các yêu cầu về hiệu năng, xem Điều 9.
Tiêu chuẩn này để áp dụng trong điều tra vi khuẩn học của tất cả các loại mẫu nước (nước nóng hoặc nước lạnh, nước từ tháp làm mát, v.v...), trừ khi bản chất và/hoặc hàm lượng của chất lơ lửng và/hoặc hệ thực vật đi kèm gây ảnh hưởng đến cả giới hạn phát hiện và giới hạn định lượng.
CHÚ THÍCH 2: Đối với các yêu cầu đánh giá xác nhận, xem 9.7.
Kết quả được biểu thị bằng số lượng đơn vị gen Legionella spp.và/hoặc L. pneumophila trên một lít mẫu.
Phương pháp quy định trong tiêu chuẩn này có thể áp dụng cho tất cả các loại mẫu nước.Tuy nhiên, một số chất phụ gia, như hóa chất được sử dụng để xử lý nước, có thể cản trở và/hoặc ảnh hưởng đến độ nhạy của phương pháp.
Các phương pháp qPCR không cung cấp thông tin về trạng thái sinh lý của Legionella.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 8880 (ISO 19458)) Chất lượng nước - Lấy mẫu để phân tích vi sinh vật
3 Thuật ngữ, định nghĩa, ký hiệu và từ viết tắt
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau đây:
3.1 Thuật ngữ và định nghĩa
3.1.1
Legionella (Legionella)
<định nghĩa kiểu gen> chi vi khuẩn có thể được xác định bằng các trình tự ADN của các gen mã hóa rRNA 16S đặc hiệu của nó
CHÚ THÍCH 1: rARN là tên viết tắt của axit ribonucleic của ribosom.
3.1.2
Legionella pneumophila
<định nghĩa kiểu gen> các loài thuộc chi Legionella (3.1.1) có thể được xác định bằng các trình tự ADN đặc hiệu của nó.
CHÚ THÍCH 1: Sự khác biệt giữa Legionella spp.và L. pneumophila có thể được tạo ra trên cơ sở sự khác biệt giữa trình tự nucleotit trong gen khởi phát lây nhiễm của đại thực khuẩn (mip)
3.1.3
Mồi ngược (reverse primer)
Mồi xuôi (forward primer)
đoạn ADN sợi đơn (oligonucleotit) đóng vai trò là khuôn mẫu để sao chép ADN đặc hiệu
CHÚ THÍCH 1: Việc chọn các trình tự ADN của các cặp mồi xuôi và ngược quyết định đoạn ADN cần được sao chép. Chiều dài của đoạn mồi thường dao động từ 15 nucleotit đến 30 nucleotit
3.1.4
Đoạn dò (probe)
đoạn ADN sợi đơn, nhắm vào trình tự đích đặc hiệu, được đánh dấu bằng reporter và tác nhân dập tắt huỳnh quang.
CHÚ THÍCH 1: Trong khi đoạn dò không được gắn hoặc được gắn vào ADN khuôn mẫu và trước khi polymerase hoạt động, quencher làm giảm tác nhân dập tắt huỳnh quang từ reporter.
3.1.5
PCR định lượng (quantitative PCR)
qPCR
Quá trình hình thành các đoạn ADN đặc hiệu được theo dõi bằng tín hiệu huỳnh quang phát ra bởi mẫu dò được đánh dấu trong real time.
CHÚ THÍCH 1: Cường độ huỳnh quang là thước đo số lượng amplicon. Bằng cách so sánh với đường chuẩn, có thể xác định được nồng độ ban đầu của ADN mục tiêu.
3.1.6
Giá trị Ct (Ct value)
Chu trình ngưỡng (threshold cycle)
Số lượng các chu trình PCR (biến tính và khuếch đại) cần thiết để sao chép các bản sao ADN ban đầu có trong mẫu, sao cho nồng độ ADN vượt quá giới hạn phát hiện
CHÚ THÍCH 1: Giá trị Ct là điểm giao nhau của đường biểu thị nồng độ ADN của mẫu với đường huỳnh quang. Giá trị Ct tương đương với giá trị Cq tùy thuộc vào phần mềm được sử dụng
3.1.7
Đơn vị gen (Legionella spp. genome unit)
GU
Đơn vị biểu thị một bản sao ADN của hệ vi khuẩn Legionella spp.
3.1.8
Gen macrophage infectivity potentiator (macrophage infectivity potentiator gene)
Gen mip(mip gene)
Gen có trong Legionella spp. cần thiết cho sự lây nhiễm của vật chủ (động vật nguyên sinh) và đại thực bào (người)
CHÚ THÍCH 1: Trình tự đặc hiệu của gen mip L. pneumophila có thể được sử dụng để thiết kế các trình tự mồi và trình tự đoạn dò để phát hiện qPCR đặc hiệu của L. pneumophila.
3.1.9
Kiểm soát ức chế PCR (PCR inhibition control)
ADN đã hiệu chuẩn cần được đồng khuếch đại cùng với dịch chiết ADN mẫu sử dụng các đoạn mồi cần thiết cho Legionella spp. hoặc để phát hiện L. pneumophila
CHÚ THÍCH 1: Việc kiểm soát ức chế PCR cần phát hiện được sự có mặt của chất ức chế trong dịch chiết ADN mẫu.
CHÚ THÍCH 2: Chất kiểm soát có thể là plasmid, oligonucleotit hoặc ADN gen L. pneumophila. Phải sử dụng đoạn dò đặc hiệu để phát hiện kiểm soát ức chế.
3.1.10
Độ thu hồi (recovery)
Hiệu quả của phương pháp tách chiết ADN
3.1.11
Chuẩn gốc ADN của Legionella pneumophila (Legionella pneumophila ADN primary standard)
Dung dịch ADN đã hiệu chuẩn của L. pneumophila (WDCM 00107) với số lượng đơn vị gen và độ không đảm bảo liên quan đã biết
CHÚ THÍCH 1: Chất chuẩn được sử dụng để điều chỉnh các dung dịch ADN hiệu chuẩn làm việc.
CHÚ THÍCH 2: Đối với danh mục WDCM, xem Tài liệu tham khảo [3]
3.1.12
Mẫu chuẩn (reference material)
Dung dịch chuẩn ADN có sẵn để sử dụng được kết nối với chuẩn gốc ADN L. Pneumophila (3.1.13)
CHÚ THÍCH 1: Mẫu chuẩn phải được xử lý trong mỗi lần chạy PCR để kiểm tra độ chính xác của qPCR
3.1.13
Dãy khuếch đại (amplification series)
Bộ khuếch đại PCR chạy trong khi sử dụng cùng lô thuốc thử PCR, cùng vật liệu và trên cùng dụng cụ.
3.1.14
Dung dịch hiệu chuẩn làm việc (working calibration solutions)
Các dung dịch hiệu chuẩn ADN của L. pneumophila (WDCM 00107), so với dung dịch chuẩn gốc của ADN L. pneumophila, được sử dụng để dựng đường chuẩn
CHÚ THÍCH 1: Quy trình được quy định trong 7.4
3.1.15
Taq ADN polymerase (Taq ADN polymerase)
Enzym thu được từ vi sinh vật ưa nước ấm được sử dụng cho phản ứng tổng hợp ADN trong ống nghiệm (in vitro)
3.1.16
Đối chứng âm tính (negative control)
Kiểm soát để giám sát toàn bộ quá trình trong phương pháp này (từ lọc đến tách chiết đến qPCR)
3.1.17
MgCl2
Magie ở dạng cation hóa trị hai, là thành phần quan trọng trong hoạt độ của ADN polymerase
CHÚ THÍCH 1: Magie tạo thành một phức chất có thể hòa tan với dNTP
3.1.18
dNTP
eoxyribonucleotit triphosphat được sử dụng để tổng hợp ADN bằng ADN polymerase
- dATP: 2'-deoxyadenosine 5'-triphosphate;
- dTTP: 2'-deoxythymidine 5'-triphosphate;
- dCTP: 2'-deoxycytidine 5'-triphosphate;
- dGTP: 2'-deoxyguanosine 5'-triphosphate.
3.2 Ký hiệu và chữ viết tắt
LDqPCR (giới hạn phát hiện của qPCR) lượng thấp nhất của trình tự gen đích cho kết quả dương tính trong qPCR với độ tin cậy 90 %
LDmeth (giới hạn phát hiện của qPCR) lượng thấp nhất của trình tự gen đích có thể được phát hiện trong lượng mẫu đã được lọc
LQqPCR (giới hạn định lượng của qPCR) lượng thấp nhất của trình tự gen đích có thể được định lượng với độ chính xác nhỏ hơn hoặc bằng 0,15log10
LQmeth (giới hạn định lượng của qPCR) lượng thấp nhất của trình tự gen đích có thể được định lượng trong lượng mẫu đã được lọc
BSA albumin huyết thanh bê
DMSO dimetyl sulfoxit
4 Nguyên tắc
Việc phát hiện và định lượng Legionella spp. hoặc L. pneumophila bằng PCR được thực hiện trong ba giai đoạn:
- cô đặc mẫu nước bằng cách lọc;
- tách ADN ra khỏi màng lọc;
- khuếch đại, phát hiện và định lượng một hoặc nhiều trình tự ADN đặc hiệu thuộc giống Legionella và/hoặc các loài L. Pneumophila bằng qPCR real-time.
5 Lấy mẫu
Các mẫu phải được lấy cho vào các vật chứa vô trùng sử dụng tất cả các biện pháp phòng ngừa cần thiết. Các điều kiện lấy mẫu phải được nêu rõ trong báo cáo thử nghiệm, nếu biết. Tiến hành lấy mẫu, vận chuyển và bảo quản mẫu theo TCVN 8880 (ISO 19458). Chú ý không để mẫu tiếp xúc với các điều kiện nhiệt độ bất lợi (ví dụ: đóng băng hoặc quá nóng).
CHÚ THÍCH: Việc sử dụng các vật chứa cách nhiệt là cần thiết.
Tốt nhất là bắt đầu thử nghiệm sau khi lấy mẫu càng sớm càng tốt. Nếu mẫu được giao đến phòng thí nghiệm trong 24 h sau khi lấy mẫu, thì cần được vận chuyển ở (5 ± 3) °C hoặc ở nhiệt độ môi trường (20 ± 5) °C. Trong trường hợp thời gian bảo quản quá 24 h, thì cần vận chuyển mẫu ở nhiệt độ (5 ± 3) °C.
Cần đánh giá hiệu quả của việc bảo quản màng lọc hoặc mẫu trong thời gian lâu hơn hoặc ở nhiệt độ khác.
Ngoài ra, đối với các mẫu lấy từ nước được xử lý bằng chất diệt khuẩn oxy hóa, thì phải sử dụng vật chứa vô trùng, có chứa một lượng đủ natri thiosulat vô trùng để trung hòa chất oxy hóa.
Các chất diệt khuẩn khác (diệt khuẩn hoặc kìm hãm vi khuẩn) đôi khi được sử dụng, đặc biệt là trong các tháp làm mát. Sự có mặt của các chất này có thể dẫn đến đánh giá thấp kết quả thu được, do đó phải được công bố và chỉ rõ trong báo cáo thử nghiệm, nếu có. Tuy nhiên, không phải lúc nào cũng có thể trung hòa được các chất này.
6 Điều kiện thử nghiệm chung
6.1 Yêu cầu chung
PCR là một phương pháp phát hiện nhạy.Sol khí, bụi và các hạt khác là những chất mang ADN bị nhiễm. Do đó, cần phải phân tách các giai đoạn khác nhau của phân tích theo không gian và/hoặc thời gian. Đặc biệt, cần có các khu vực riêng biệt, vật liệu và thiết bị chuyên dụng riêng cho các giai đoạn trước và sau khuếch đại.
Các nguyên tắc được áp dụng như sau:
- Ưu tiên sử dụng đồ dùng một lần tương thích với các phương pháp PCR;
- Các quy trình để loại bỏ các vết ADN và các amplicon phải được áp dụng trong trường hợp cơ sở hoặc thiết bị bị lây nhiễm ngẫu nhiên;
- các biện pháp kiểm soát chất lượng thường xuyên phải được sử dụng để chứng minh tính hiệu quả của các quy trình bảo trì với mục tiêu đảm bảo rằng không có nhiễm ADN Legionella hoặc các sản phẩm PCR/amplicon (xem 10.4).
6.2 Nhân viên
Tất cả nhân viên thực hiện phương pháp này phải được đào tạo để làm việc với PCR và các khía cạnh vi sinh.
Nhân viên phải mặc trang phục phòng thí nghiệm riêng cho các hoạt động vi sinh liên quan đến các hoạt động nuôi cấy và sinh học phân tử. Găng tay được sử dụng cho mục đích này phải không có bột talc.
Trang phục phòng thí nghiệm phải được thay đổi giữa vùng có nồng độ ADN thấp (trước khuếch đại) và vùng có nồng độ ADN cao (sau khuếch đại). Khi áo khoác phòng thí nghiệm được sử dụng không phải là loại dùng một lần, thì phải được làm sạch và thay thế định kỳ. Chỉ những nhân viên được trang bị phù hợp mới được vào các phòng nơi đang thực hiện thử nghiệm.
Để biết thêm thông tin chi tiết, tham khảo Tài liệu tham khảo [4].
6.3 Cơ sở phòng thí nghiệm
Phòng thí nghiệm phải có ít nhất hai khu vực được ngăn cách về mặt vật lý (ví dụ: tủ PCR), khu vực bao gồm các hoạt động trước PCR [a) và b) dưới đây] và PCR [c) dưới đây]. Tốt nhất, cần có sẵn ba khu vực a), b) và c) được phân tách vật lý:
a) khu vực cô đặc mẫu và tách chiết ADN;
b) khu vực chuẩn bị thuốc thử PCR (hỗn hợp phản ứng);
c) khu vực khuếch đại PCR.
Nếu sử dụng thiết bị tự động, thì một số hoạt động nhất định có thể được nhóm lại với nhau trong cùng một khu vực. Trong tất cả các trường hợp, kiểm tra lây nhiễm bằng đối chứng âm tính (xem 10.4).
Bất kể hệ thống khuếch đại và phát hiện amplicon được sử dụng, không được mở ống sau khi khuếch đại trong các vùng a), b) và c).
6.4 Thiết bị và vật tư tiêu hao (không bao gồm thuốc thử)
6.4.1 Thiết bị
Sử dụng các thiết bị, dụng cụ của phòng thí nghiệm thông thường và cụ thể như sau.
6.4.1.1 Tủ an toàn sinh học (BSC II)
6.4.1.2 Máy ly tâm
6.4.1.3 Mô-đun khối gia nhiệt
6.4.1.4 Máy chu trình nhiệt real-time
Thiết bị được sử dụng để khuếch đại bằng PCR, sau mỗi chu trình trùng hợp, phát hiện và ghi lại tín hiệu huỳnh quang tỷ lệ với lượng sản phẩm khuếch đại (đơn vị gen).
6.4.2 Vật tư tiêu hao
Tất cả các vật tư tiêu hao đã qua sử dụng không được chứa ADN và ADNse.
VÍ DỤ Các phễu lọc có thể là:
- Được giao nhận vô trùng;
- Tiệt trùng trong tủ hấp hoặc tủ sấy;
- Nếu được làm bằng kim loại, thì đốt tiệt trùng trước khi sử dụng.
6.4.3 Cô đặc
Bộ lọc màng phải được làm bằng polycarbonat hoặc các hợp chất ít có khả năng hấp phụ protein hoặc ADN, có cỡ lỗ danh định là 0,45 μm hoặc nhỏ hơn. Không sử dụng màng lọc có chứa xenlulo hoặc sợi thủy tinh.
6.4.4 Tách chiết và PCR (phát hiện và định lượng)
6.4.4.1 Yêu cầu chung
Ngoài giai đoạn cô đặc, điều quan trọng là tránh để thiết bị tiếp xúc với mẫu nước để ngăn ngừa nhiễm chéo. Tránh nhiễm chéo bằng cách sử dụng dụng cụ dùng một lần.
Phải kiểm soát chất lượng để khẳng định tính hiệu quả của các quy trình khử nhiễm. Khi có thể, nên sử dụng vật tư tiêu hao thích hợp cho chẩn đoán phân tử
Cần xem xét cẩn thận thiết bị và vật tư tiêu hao quy định trong 6.4.1 và 6.4.2.
6.4.4.2 Micropipet
Để tránh nhiễm chéo do sol khí, nên sử dụng các đầu tip có lọc kỵ nước và/hoặc pipet pittong. Sử dụng bộ micropipet riêng biệt cho từng khu vực làm việc.
6.4.4.3 Các khối gia nhiệt, nên sử dụng để ngăn ngừa ô nhiễm bởi sol khí
6.4.4.4 BSC II, tốt nhất nhất là được trang bị đèn UV để đảm bảo khử nhiễm thiết bị được sử dụng.
6.5 Thuốc thử
6.5.1 Yêu cầu chung
Tất cả các thuốc thử được sử dụng phải vô trùng, không chứa nucleaza và chất ức chế PCR. Tốt nhất, chúng phải không chứa ADN.
Khi có thể, tất cả các thuốc thử phải được phân phối theo thể tích thích hợp để tránh sử dụng lại lượng thuốc thử. Điều này cải thiện độ lặp lại của phương pháp. Các quy trình thích hợp phải được sử dụng để đảm bảo khả năng truy xuất nguồn gốc của tất cả các thuốc thử.
Thực hiện theo các khuyến nghị của nhà cung cấp về bảo quản và xử lý thuốc thử.
Thực hiện kiểm soát để đảm bảo không có sự ô nhiễm ban đầu đối với mẻ thuốc thử được sử dụng để phân lập ADN và qPCR (như quy định trong 10.4).
6.5.2 Thuốc thử PCR
Ví dụ về thành phần hỗn hợp phản ứng PCR được nêu trong Bảng 1. Các sản phẩm hỗn hợp PCR master sẵn để sử dụng bao gồm các thành phần khác nhau, trừ mồi và đoạn dò, luôn có sẵn.
Thể tích phản ứng được xử lý trong quá trình thử nghiệm PCR thường từ 1 μL đến 100 μL.
Để tăng độ lặp lại của PCR trong khi giảm độ không đảm bảo liên quan đến các thể tích nhỏ, phải chuẩn bị đủ thể tích hỗn hợp phản ứng để có thể thực hiện ít nhất 10 PCR.
Bảng 1 - Ví dụ về hỗn hợp phản ứng PCR điển hình
| Thành phầna | Nhận xét |
| Nước pha loãng | Chất pha loãng |
| Dung dịch đệm PCR | Thành phần thay đổi rất nhiều tùy theo nhà cung cấp và có thể bổ sung các chất phụ gia khác nhau (albumin huyết thanh bê, dimethyl sulfoxide (DMSO), chất hoạt động bề mặt, v.v...] thích hợp với hoạt độ hoặc độ ổn định của ADN polymerase chịu nhiệt được sử dụng. |
| MgCl2 | Nồng độ cuối cùng của MgCl2 phụ thuộc vào dNTP, mồi, đoạn dò và nồng độ ADN đích, Điều này phải được tối ưu hóa: |
| dNTP | - dATP: 2'-deoxyadenosine 5'-triphosphate; |
|
| - dTTP: 2'-deoxythymidine 5'-triphosphate; |
|
| - dCTP: 2'-deoxycytidine 5'-triphosphate; |
|
| - dGTP: 2'-deoxyguanosine 5’-triphosphate |
|
| Có thể sử dụng hỗn hợp dTTP + dUTP (2'-deoxyuridine 5'- triphosphate) và enzym uracil-ADN N-glycosylase (UNG). Hệ thống này không bắt buộc đối với các phương pháp sử dụng hệ thống phát hiện real-time không yêu cầu mở ống sau khi khuếch đại. Bất kỳ hệ thống tương đương nào có thể phá hủy đặc biệt các amplicon từ PCR trước đó, trong hỗn hợp phản ứng, đều có thể được sử dụng |
| Mồi | Xem 7.3.2.2, 7.3.2.3, 7.3.2.5, 7.3.2.6. |
| ADN polymerase chịu nhiệt | Sử dụng hot-start Taq ADN polymerase nếu có thể, để tránh kết quả dương tính giả |
| Đoạn dò | Xem 7.3.2.4 và 7.3.2.7 |
| a Tùy thuộc vào nguồn của chúng, một số thành phần này trước đây có thể được trộn trong dung dịch đệm PCR. | |
6.5.3 Các thuốc thử khác
6.5.3.1 Chất đồng kết tủa ADN, được sử dụng để cải thiện năng suất kết tủa trong quá trình tách chiết ADN, không được chứa hoạt tính nuclease hoặc trình tự tương đồng với trình tự đích của các thử nghiệm PCR.
6.5.3.2 Dung dịch đệm TE, pH 8,0
| Tris (hydroxymethyl) aminomethane (C4H11NO3) | Tris | 10 mmol/L |
| Axit ethylenediaminetetraacetic (C10H16N2) | EDTA | 1 mmol/L |
| Nước không chứa ADNse và RNAse |
|
|
Hòa tan tris và EDTA trong nước không chứa ADNse và RNAse và chỉnh bằng HCl đến pH 8,0. Để pha loãng dung dịch đệm TE 10 lần, thì pha loãng dung dịch này với nước không có ADNse và RNAse.
6.6 Khử nhiễm thiết bị và cơ sở thí nghiệm
Sau khi nhiễm ngẫu nhiên hoặc không ngẫu nhiên, thì mọi thiết bị hoặc vật liệu có thể sử dụng lại đều phải được xử lý bằng cách nhúng hoặc ngâm trong, ví dụ, dung dịch thuốc tẩy chứa clo hoạt tính 1,7 % thể tích hoặc axit clohydric 1 % thể tích hoặc chất tẩy rửa.
Bức xạ cực tím cũng có thể được sử dụng để khử nhiễm vật liệu hoặc các thiết bị nhỏ, bề mặt bàn hoặc thậm chí toàn bộ phòng bổ sung cho việc khử nhiễm bằng dung dịch.
6.7 Xử lý và loại bỏ chất thải
Chất thải độc hại và lây nhiễm phải được lưu giữ, sử dụng và loại bỏ theo quy định. Khuyến cáo loại bỏ ngay các vật tư tiêu hao đã bị nhiễm các sản phẩm khuếch đại.
7 Cách tiến hành
7.1 Cô đặc
Lọc một lượng mẫu càng lớn càng tốt (ít nhất 50 ml) để cô đặc vi khuẩn. Ghi lại thể tích (V) của mẫu được lọc. Điều này được yêu cầu trong phần tính toán kết quả (xem Điều 8). Giới hạn phát hiện, LDmeth (xem 9.5) và giới hạn định lượng, LQmeth (xem 9.4.4), bị ảnh hưởng bất lợi bởi các lượng mẫu nhỏ và tăng tương ứng.
7.2 Tách chiết ADN
7.2.1 Yêu cầu chung
Quá trình tách chiết liên quan đến việc giải phóng ADN bằng cách phân giải vi sinh vật, sau đó (hoặc xảy ra đồng thời) tinh sạch ADN trong khi loại bỏ các thành phần khác càng nhiều càng tốt, đặc biệt là các chất ức chế PCR. Kiểm tra độ thu hồi ADN của dịch chiết (xem 9.6).
7.2.2 Quy trình
ADN có thể được tách chiết trực tiếp ra khỏi màng lọc. Nên xử lý toàn bộ phần cô đặc.
Để tách chiết ADN, có thể sử dụng một số phương pháp thích hợp như vật lý (ví dụ như chu trình cấp đông và rã đông, nghiền hạt), hóa học (ví dụ như đệm guanidine thiocyanat) hoặc sinh học (ví dụ: phân hủy bằng enzym).
Bước tinh sạch có thể được thực hiện sau hoặc đồng thời với bước tách chiết ADN. Bước tinh sạch này có thể được thực hiện, ví dụ, sử dụng cloroform và/hoặc bằng cách kết tủa phân đoạn, với các dung môi như etanol, isopropanol, và/hoặc hấp phụ trên nền rắn (ví dụ như nhựa resin, silica, thủy tinh, màng, hạt từ tính).
ADN đã tinh sạch phải được đưa trở lại dạng huyền phù trong dung dịch đảm bảo tính ổn định của ADN và chất lượng của PCR, ví dụ, dung dịch đệm có chứa chất tạo chelat magiê (EDTA) hoặc protein (albumin huyết thanh bò).
Phép PCR định lượng các đơn vị gen Legionella spp. và L. Pneumophila phải được thực hiện với cùng dịch chiết ADN.
7.2.3 Tính ổn định của dịch chiết ADN
Sau khi tách chiết ADN, dịch chiết ADN có thể được sử dụng để chạy PCR. Mặc dù được khuyến nghị thực hiện PCR trực tiếp sau khi tách chiết, nhưng có thể bảo quản dịch chiết ADN trong 24 h ở (5 ± 3) °C. Khi cần bảo quản lâu hơn ở nhiệt độ này thì cần phải đánh giá xác nhận.
Trong trường hợp dịch chiết ADN được lưu trữ lâu hơn hơn 24 h, thì bảo quản dịch chiết ADN ở (-18 ± 2) °C; các điều kiện bảo quản này phải được đánh giá xác nhận.
7.3 Khuếch đại ADN bằng PCR
7.3.1 Quy định chung
Điều này liên quan đến việc khuếch đại trình tự đích giới hạn theo hướng 5'- đến -3' trên mỗi sợi ADN được bắt đầu bởi hai mồi (mồi ngược và mồi xuôi).
Trong quá trình phát triển thử nghiệm PCR, các thông số khuếch đại (số chu trình, nhiệt độ lai) và thành phần hỗn hợp phản ứng (dNTP, magie, mồi và đệm) phải được xác định và tối ưu hóa. Khi các thông số này đã được thiết lập, hiệu năng của phương pháp phải được đánh giá (xem Điều 9).
Việc khuếch đại PCR phải bao gồm các đối chứng nêu trong Điều 10 (đối chứng âm tính và đối chứng dương tính, kiểm soát ức chế PCR và mẫu chuẩn).
7.3.2 Trình tự đích, mồi và đoạn dò
7.3.2.1 Yêu cầu chung
Có thể khuếch đại một hoặc nhiều trình tự để phát hiện và phân biệt ADN với vi khuẩn thuộc Legionella spp. và L. pneumoniaophila.
Tính đặc hiệu của mồi và các đoạn dò phải được kiểm tra:
a) Về mặt lý thuyết bằng nghiên cứu tính tương đồng sử dụng phần mềm thích hợp trong cơ sở dữ liệu chính như Ngân hàng gen NCBI (xem Tài liệu tham khảo [1]) hoặc cơ sở dữ liệu trình tự Nucleotit EMBL (xem Tài liệu tham khảo [2])
b) Bằng cách thử nghiệm trên các chủng Legionella, L. pneumophila và các chủng vi sinh vật có khả năng được tìm thấy trong cùng điều kiện sinh thái như Legionella.
Liên quan đến điểm b), cần kiểm tra một danh mục với số lượng tối thiểu các chủng được đưa ra trong 9.2. Đối với các chủng không thuộc giống Legionella, không có sản phẩm khuếch đại nào được phát hiện bởi real-time PCR. Tính đặc hiệu của các đoạn dò và mồi phải được đánh giá trên mỗi chủng Legionella mới. Đối với L. pneumoniaophila, các trình tự được mô tả dưới đây tương thích với danh mục các chủng cần kiểm tra tính đặc hiệu. Có thể sử dụng các trình tự khác miễn là chúng phù hợp các yêu cầu về loại trừ và tính bao gồm (xem danh mục trong 9.2).
Dưới đây là các ví dụ về mồi (7.3.2.2 và 7.3.2.3) và đoạn dò (7.3.2.4) được thiết kế để khuếch đại và định lượng L. pneumophila mảnh đặc hiệu của mip (7.3.2.5). Các trình tự và fluorofor được đưa ra để làm ví dụ.
Các chế phẩm này được đưa ra làm ví dụ và phải được đánh giá xác nhận theo Điều 9.
7.3.2.2 Ví dụ về mồi xuôi L. pneumophila: LpneuF có thành phần như sau:
Trình tự: 5'-CCGATGCCACATCATTAGC-3’[6];
Đệm TE (6.5.3.2): pha loãng 10 lần.
Ví dụ, LpneuF được chuẩn bị như sau: Chuẩn bị dung dịch gốc của mồi trong dung dịch đệm TE pha loãng 10 lần với nồng độ cuối cùng là 100 μmol/L. Bảo quản dung dịch gốc này dưới -18 °C. Pha loãng dung dịch gốc thành dung dịch làm việc có nồng độ 10 μmol/L. Để chuẩn bị cả dung dịch gốc và dung dịch làm việc, sử dụng dung dịch đệm TE pha loãng 10 lần. Bảo quản dung dịch làm việc này trong tối đa sáu tháng dưới -18 °C.
7.3.2.3 Ví dụ về mồi ngược L. pneumophila: LpneuR có thành phần như sau:
Trình tự: 5'-CCAATTGAGCGCCACTCATAG-3’[6];
Dung dịch đệm TE (6.3.3.2) được pha loãng 10 lần.
CHÚ THÍCH: Ví dụ, LpneuR được chuẩn bị theo cách tương tự như LpneuF (7.3.2.2).
7.3.2.4 Ví dụ về đoạn dò L. pneumophila: LpneuP có thành phần như sau:
Trình tự: 5'-TGCCTTTAGCCATTGCTTCCG-3’[6];
Label5’: Fluorophore (carboxyfluorescein, FAM):
Label 3': Quencher (black hole quencher 1, BHQ1);
Đệm TE (6.5.3.2).
CHÚ THÍCH: Ví dụ, LpneuP được chuẩn bị theo cách tương tự như LpneuF (7.3.2.2).
7.3.2.5 Ví dụ về mồi xuôi 16S gen rRNA gen mồi xuôi Legionella spp., có thành phần như sau:
Trình tự: 5'GGAGGGTTGATAGGTTAAGAGCT 3'[5]
Đệm TE (6.5.3.2): được pha loãng 10 lần.
Ví dụ về 16SrRNAgeneF được chuẩn bị như sau. Chuẩn bị dung dịch gốc của mồi trong dung dịch đệm TE pha loãng 10 lần với nồng độ cuối cùng là 100 μmol/l. Bảo quản dung dịch gốc này dưới -18 °C. Pha loãng dung dịch gốc thành dung dịch làm việc nồng độ 10 μmol/l. Để chuẩn bị cả dung dịch gốc và dung dịch làm việc, sử dụng dung dịch đệm TE pha loãng 10 lần. Bảo quản dung dịch làm việc này trong tối đa sáu tháng dưới -18 °C.
7.3.2.6 Ví dụ về mồi ngược gen 165 rRNA mồi ngược Legionella spp: 16SrRNAgeneR, với thành phần như sau:
Trình tự: 5'CCAACAGCTAGTTGACATCGTTT 3’[5];
Đệm TE (6.5.3.2): pha loãng 10 lần.
CHÚ THÍCH: 16SrRNAgeneR được chuẩn bị theo cách tương tự như LpneuF (7.3.2.5).
7.3.2.7 Ví dụ về đoạn dò genP rARN 16S của Legionella spp., có thành phần như sau:
Trình tự: 5'-AGTGGCGAAGGCGGCTACCT- 3'[5];
Label 5': Fluorophore (carboxyfluorescein, FAM);
Label 3': Quencher (black hole quencher 1, BHQI);
Đệm TE (6.5.3.2).
CHÚ THÍCH: 16SrRNAgeneP được chuẩn bị theo cách tương tự như LpneuF (7.3.2.5).
7.3.2.8 Trình tự ADN của mảnh mip của L. pneumophila.
Trình tự của mồi và đoạn dò được xác định bằng chữ in đậm (xem [5]).

7.3.2.9 Trình tự ADN của đoạn gen 165 rRNA của các loài Legionella.
Các trình tự mồi và các đoạn dò được xác định trong phần in đậm (xem [5]).

7.3.3 Chuẩn bị hỗn hợp khuếch đại
Tốt nhất, chuẩn bị ngay hỗn hợp phản ứng trước khi sử dụng. Nếu hỗn hợp phản ứng được bảo quản, thì độ ổn định của nó phải được xác nhận bằng cách thực hiện kiểm tra độ tuyến tính của hàm hiệu chuẩn sau khi bảo quản (xem 9.3). Việc đánh giá xác nhận này phải đáp ứng các tiêu chí xác định trong 9.3.4.
Hỗn hợp phản ứng và ADN tách chiết được phải được trộn ngay trước khi khuếch đại. Để ngăn ngừa hậu quả của việc lây nhiễm ngẫu nhiên, có thể thực hiện khuếch đại PCR từ dUTP để hoạt hoá UNG (uracil-ADN N-glycosylase) loại bỏ tất cả các dấu vết của amplicon trước khi có khuếch đại mới.
Ví dụ về thành phần của hỗn hợp phản ứng được nêu trong Bảng 2. Trộn các thành phần theo tỷ lệ được nêu trong Bảng 2.
7.4 Phát hiện định lượng
7.4.1 Yêu cầu chung
Phương pháp real-time PCR này phải có thể định lượng được các amplicon đặc hiệu đối với Legionella spp.và/hoặc L. Pneumophila. Nên thực hiện qPCR đối với Legionella spp. và L. Pneumophila trong hai giếng PCR riêng biệt. Tiêu chuẩn này không mô tả phát hiện nhiều thành phần. Việc phát hiện nhiều thành phần (Legionella spp. và L. pneumoniaophila trong cùng giếng PCR) không quy định trong tiêu chuẩn này.
Tính đặc hiệu của PCR định lượng phải được đảm bảo bằng cách sử dụng đoạn dò lai đặc hiệu
Để đảm bảo chất lượng của việc phát hiện định lượng, cần phải sử dụng a) và b).
a) Dải chuẩn ADN bên ngoài, tức là các dung dịch ADN L. pneumophila, thu được từ chất chuẩn gốc (xem 10.2).
b) Kiểm soát ức chế PCR, như dung dịch đã hiệu chuẩn của plasmid hoặc oligonucleotide hoặc đơn vị gen L. pneumophila, được đồng khuếch đại với ADN từ mẫu. Cách tiếp cận này được sử dụng để phát hiện sự có mặt của chất ức chế trong dịch chiết ADN mẫu (xem 10.6). Sự khuếch đại của kiểm soát ức chế PCR sẽ được phát hiện bằng cách sử dụng một đoạn dò đặc hiệu được thiết kế với reporter khác với đoạn dò đích.
Liên quan đến việc phát hiện (có mặt hay không có mặt) gen đích, kết quả được coi là dương tính (sự có mặt gen đích) khi giá trị Ct thấp hơn giá trị Ct tương ứng với 1 GU. Giá trị Ct này được ước tính (b) trong quá trình xác định đặc tính và đánh giá xác nhận phương pháp (xem 9.3.2) trong phương trình tuyến tính y = ax'+ b.
Cần phải khuếch đại các chất chuẩn đã được hiệu chuẩn bên ngoài và sự kiểm soát ức chế bằng cách sử dụng cùng các đoạn mồi được sử dụng để khuếch đại các trình tự đích của mẫu.
Số lượng của kiểm soát ức chế PCR phải thấp hơn 1000 cADN trên phản ứng.
Trong các phương pháp tiếp cận a) và b) việc định lượng được thực hiện bằng phép nội suy trong dải đáp ứng tuyến tính của phương pháp định lượng ADN. Dải nồng độ này phải được xác định trước trong quá trình xác định và đánh giá xác nhận phương pháp (9.3). Nếu cần, ADN được tách chiết có thể được pha loãng để thu được nồng độ nằm trong vùng đáp ứng tuyến tính này.
Quá trình khuếch đại phải được thực hiện bằng máy chu trình nhiệt real-time PCR real-time với đủ số chu trình. Số chu trình này không được nhỏ hơn giá trị ước tính của giá trị ngưỡng tín hiệu của trục tung (xem 9.3) tăng lên 5.
QUAN TRỌNG - Khi có thể, nên thực hiện một vài lần chạy sử dụng cùng dịch tách chiết ADN. Lặp lại các thử nghiệm và thu được kết quả trung bình giúp cải thiện độ chính xác.
Bảng 2 - Ví dụ về thành phần của hỗn hợp qPCR
| Thuốc thử | Thể tích/mẫu, ml | Nồng độ cuối cùng |
| BSA dùng để khuếch đại PCR | 5 | 0,4 μg/μL |
| Taq polymerasea | 1 | 0,1 U/μL |
| Đệm PCR (Bảng 1) | 5 | 1x |
| dNTPs (Bảng 1) | 1 | 400 nmol/L |
| MgCl2a (Bảng 1) | 3 | Theo các yêu cầu của Taq ADN polymerase |
| Mồi LpneuF (7.3.2.2) | 1 | 200 nmol/L |
| Mồi LpneuR (7.3.2.3) | 1 | 200 nmol/L |
| Đoạn dò LpneuP (7.3.2.4) | 1 | 200 nmol/L |
| Nước dùng để khuếch đại PCR | Lên đến 40 |
|
| Phải bổ sung kiểm soát ức chế PCR theo 9.6 a Thể tích yêu cầu phụ thuộc vào nồng độ của dung dịch gốc và có thể khác nhau giữa các nhà cung cấp. | ||
7.4.2 Quy trình PCR
7.4.2.1 Khái quát
Chương trình máy chu trình nhiệt trong Bảng 3 được chỉ ra làm ví dụ về việc phát hiện L. pneumophila cách sử dụng các trình tự mồi và đoạn dò được quy định trong 7.3.2.
Chương trình này phải được điều chỉnh theo model và kiểu của máy chu trình nhiệt và phải được đánh giá xác nhận theo các yêu cầu nêu trong Điều 9.
Bảng 3 - Ví dụ về chương trình nhiệt độ và thời gian của PCR
| Biến tính ADN và hoạt hoá hot-start Taq polymerase | 3 min ở 95 °C |
| Sao chép ADN | 20 s ở 95 °C |
|
| 60 s ở 60 °C |
| Số lượng chu trình | 43a |
| a Trong bảng này, số chu trình được xác định là điểm chặn của hàm hiệu chuẩn + 3 để có thể quan sát cấu hình khuếch đại thu được 1 GU. | |
Chương trình phải được thiết lập sao cho trong quá trình sao chép ADN, các tín hiệu huỳnh quang của đoạn dò đặc hiệu L. pneumophila và đoạn dò đặc hiệu đối chứng nội PCR đo được.
CHÚ THÍCH: Thời gian của bước hot-start phụ thuộc vào Taq ADN polymerase được sử dụng cho qPCR và được trong thông số kỹ thuật của máy từ nhà sản xuất.
7.4.2.2 Yêu cầu chung
Sử dụng cách tiếp cận sau đây để phát hiện hoặc định lượng các amplicon.
Việc theo dõi PCR dựa trên phép đo tín hiệu huỳnh quang do sự lai của ít nhất một đoạn dò dán nhãn huỳnh quang bên trong vào amplicon.
Dải hiệu chuẩn làm việc (bên ngoài) bao gồm ít nhất bốn mức (ví dụ, các dung dịch ở 25 GU, 250 GU, 2 500 GU và 25 000 GU của L. Pneumophila trên ống phản ứng) được chuẩn bị bằng cách sử dụng dung dịch hiệu chuẩn làm việc (dung dịch bán sẵn hoặc dung dịch được chuẩn bị theo Phụ lục A). Điểm đầu tiên của dải ADN phải bằng giới hạn định lượng LQqPCR.
Dung dịch hiệu chuẩn làm việc phải được kết nối với chất chuẩn gốc của ADN Legionella (xem 10.2). Ngày hết hạn của dung dịch này phải được thiết lập về các điều kiện bảo quản theo kế hoạch và được đánh giá xác nhận bằng cách nối với chuẩn gốc.
Ít nhất một lần trong mỗi dãy khuếch đại mẫu (cùng một mẻ thuốc thử PCR, cùng vật liệu), phải phân tích dải hiệu chuẩn làm việc này trong các điều kiện tương tự như được sử dụng đối với mẫu.
Tính ổn định của đường chuẩn và/hoặc việc sử dụng lại dải pha loãng phải được đánh giá xác nhận bằng cách đo mẫu chuẩn sau mỗi lần sử dụng máy chu trình nhiệt (xem 10.3).
7.4.2.3 Định lượng bằng máy real-time
Ngoài thực tế là máy chu trình nhiệt real-time có thể phát hiện tại chỗ các sản phẩm khuếch đại, chúng cũng đặc biệt thích hợp cho PCR định lượng. Các hệ thống phát hiện có thể hạn chế các hiệu ứng plateau bằng cách đo trực tiếp lượng amplicon được tổng hợp trong giai đoạn khuếch đại. Các quá trình này liên quan đến các hệ thống phát hiện và định lượng phát xạ huỳnh quang nhạy. Nguyên tắc hiện đang được sử dụng để hiệu chuẩn là dựa trên việc định lượng amplicon đặc hiệu sử dụng ít nhất một đoạn dò có đánh dấu huỳnh quang bên trong. Việc định lượng dựa trên việc xác định ngưỡng chu trình, Ct, tỷ lệ nghịch với logarit thập phân của số đơn vị gen có mặt ban đầu trong hỗn hợp phản ứng.
Phương pháp xác định Ct được đưa ra làm ví dụ trong Phụ lục B.
Có thể sử dụng các phương pháp toán học khác để xác định Ct. Trong trường hợp này, phương pháp được sử dụng phải được nêu rõ và ảnh hưởng của nó về độ chụm của phép đo phải được kiểm tra phù hợp với quy trình đánh giá đường chuẩn (xem 9.3).
7.5 Phát hiện định tính
Trong trường hợp phát hiện định tính, việc sử dụng hiệu chuẩn bên ngoài là không cần thiết.
Giá trị Ct sẽ được tính đến để xác định sự có mặt của gen đích (Legionella pneumophila hoặc Legionella spp.) mà có thể xác định được nếu có sẵn đường chuẩn với các ngưỡng tín hiệu, có thể sử dụng ngưỡng tín hiệu trung bình (tương ứng với Ct 1 GU xác định được trong 7.4), cao hơn giá trị này thì kết quả có thể được coi là âm tính.
Kết quả PCR có giá trị Ct nằm sau giá trị Ct của điểm chặn b (xem 9.3.4.1) được coi là âm tính.
Việc giải thích định tính có thể được chấp nhận đối với các phương pháp được đánh giá xác nhận là định lượng (bởi chính phòng thí nghiệm hoặc nhà cung cấp).
8 Biểu thị kết quả
Biểu thị kết quả theo Bảng 4 là số lượng đơn vị gen (GU) Legionella spp. và/hoặc L. pneumophila trên lít mẫu (có tính đến thể tích mẫu đã lọc) đến hai con số có nghĩa.
VÍ DỤ 1: 12 312 GU/L Legionella spp. được biểu thị là “12 000 GU/L Legionella spp.”
VÍ DỤ 2: 723 GU/L. pneumophila được biểu thị là “720 GU/L L. Pneumophila”.
Đối với việc biểu thị các kết quả phát hiện định tính, xem Bảng 5.
Bảng 4 - Biểu thị kết quả phát hiện định lượng
| Số lượng N GU/giếng PCR | Dung dịch ADN | Kết quả GU/L | Nhận xét |
| N< 1 | 1 |
| không phát hiện Legionellaa |
| d |
| ADN được pha loãng do có mặt các chất ức chế không phát hiện Legionellaa | |
| 1 <N< LQqPGR | 1 |
| phát hiện Legionellaa dưới giới hạn định lượng |
| d |
| Pha loãng ADN do có mặt các chất ức chế phát hiện Legionellaa dưới giới hạn định lượng | |
| N> LQqPGR | 1 |
| phát hiện Legionellaa trong giới hạn định lượng |
| d |
| Pha loãng ADN do có mặt các chất ức chế phát hiện Legionellaa trong giới hạn định lượng | |
| N > C | 0 |
| Legionellaa phát hiện được trên giới hạn định lượngb |
| d |
| Pha loãng ADN do có mặt các chất ức chế Legionellaa phát hiện được trên giới hạn định lượngb | |
| Trong đó: N là số lượng trung bình GU/giếng PCR; LDqpCR là giới hạn phát hiện xác định được trong 9.5; LQqPCR là giới hạn định lượng xác định được trong 9.4; C là giá trị nằm trên dải hiệu chuẩn xác định được trong 9.3; F là hệ số chuyển đổi (số lượng đơn vị gen trên giếng sang đơn vị gen trên phần mẫu thử); d là hệ số pha loãng ADN; V là thể tích mẫu được lọc, ml; a là chi đích nêu rõ Legionella spp. hoặc L. pneumophila; b trong trường hợp này, có thể định lượng được sau khi pha loãng ADN. | |||
Bảng 5 - Biểu thị kết quả phát hiện định lượng
| Số lượng N GU/giếng PCR | Dung dịch ADN | Kết quả GU/L | Nhận xét |
| N < 1 | 1 |
| không phát hiện được Legionellaa |
| d |
| Pha loãng ADN do có mặt các chất ức chế không phát hiện được Legionellaa | |
| N > 1 | 1 | không phát hiện được Legionellaa |
|
| d | không phát hiện được Legionellaa |
| |
| Trong đó: N là số lượng trung bình GU/giếng PCR; LDqPCR là giới hạn phát hiện xác định được trong 9.5; F là hệ số chuyển đổi (số lượng đơn vị gen trên giếng sang đơn vị gen trên phần mẫu thử); d là hệ số pha loãng ADN; V là thể tích mẫu được lọc, ml; a là chi đích nêu rõ Legionella spp. hoặc L. pneumophila; b trong trường hợp này, có thể định lượng được sau khi pha loãng ADN. | |||
9 Quy trình kỹ thuật để xác định đặc tính và đánh giá xác nhận phương pháp
9.1 Yêu cầu chung
Các tiêu chí kỹ thuật và các yêu cầu nêu trong điều này phải được sử dụng để xác định đặc tính kỹ thuật và đánh giá xác nhận (nội bộ/bên thứ ba hoặc ban đầu/thứ cấp) của tất cả các phương pháp được xây dựng mới hoặc sửa đổi (ví dụ: thay đổi bộ kit PCR, thay đổi phương pháp tinh sạch, thay đổi thành phần của bộ kit).
Mọi quy trình ứng dụng thông thường cũng phải được đánh giá xác nhận theo các yêu cầu được nêu chi tiết trong Điều 9 này.
Đối với các phương pháp thương mại đã được đánh giá xác nhận của bên thứ ba đáp ứng các yêu cầu nêu trong Điều 9, thì phải tuân thủ hoàn toàn các hướng dẫn của nhà sản xuất.
Đối với đánh giá xác nhận ban đầu, cần áp dụng tất cả các yêu cầu nêu trong Điều 9. Đối với việc kiểm tra xác nhận phương pháp (xác nhận thứ cấp), thì phải sử dụng các yêu cầu đơn giản hóa để xác nhận việc thực hiện đúng trong phòng thí nghiệm của mọi phương pháp được bên thứ ba đánh giá đầy đủ, như được quy định trong Phụ lục G.
Các phòng thử nghiệm chỉ sử dụng phương pháp phát hiện định tính thì phải đáp ứng các yêu cầu trong Điều 9, trừ 9.3 và 9.4.
9.2 Tính toàn diện và tính loại trừ của các đoạn dò và mồi
Mồi và mẫu dò được sử dụng phải cho các kết quả mong đợi đối với các loài và các nhóm huyết thanh dưới đây mà tất cả đã được phân lập trong môi trường hoặc từ trường hợp mẫu bệnh của người.
Các phép thử về tính toàn diện và tính loại trừ phải được thực hiện trên tất cả các loài được liệt kê dưới đây. Các dịch tách chiết ADN phải được lấy một phần từ WDCM và/hoặc các chủng sưu tập quốc gia và một phần từ các chủng môi trường. Tất cả các chủng môi trường được phân tích như một phần của việc đánh giá xác nhận này phải được lập thành văn bản bao gồm cả phương pháp thay thế được sử dụng để xác định chủng Legionella.
- Các phép thử tính bao gồm được thực hiện trên dịch chiết ADN có chứa khoảng 100 GU/giếng PCR. Liều thêm chuẩn này tránh cho kết quả dương tính giả.
- Các phép thử tính không bao gồm được thực hiện trên dịch chiết ADN có chứa ít nhất 10 000 GU/giếng PCR. Liều thêm chuẩn này tránh cho kết quả âm tính giả.
Nồng độ huyền phù vi khuẩn có thể được ước tính sử dụng mật độ quang của huyền phù ở 600 nm. (Mật độ quang 0,5 ở 600 nm tương ứng với 109 CFU/mL).
- Danh mục kiểm tra tính bao gồm (vi sinh vật để kiểm tra phương pháp Legionella spp.): L. anisa (ví dụ: WDCM 00106), L. birminghamensis, L. bozemanii 1 và 2, L. cherrii, L. cincinnattensis (ví dụ: CIP 103875), L. dumoffii, L. erythra 2, L. feeleii 7 và 2, L. gormanii, L. hackeliae serogroup1 (ví dụ CIP 103844) và serogroup 2, L. jordanis, L. lonsingensis (ví dụ ATCC 43751), L. longbeachae 1 và 2, L. maceachemii, L. micdadei (ví dụ ATCC 33218), L. oackridgensis, L. parisiensis (ví dụ CIP 103847), L. pneumophila serogroup1 đến 15 (ví dụ: Legionella pneumophila serogroup1 WDCM 00107; Legionella pneumonia serogroup6 ATCC 33215), L. sainthelensi 1 và 2, L. tucsonensis, L. wadsworthii (ví dụ CIP 103886).
- Danh mục kiểm tra tính bao gồm (vi sinh vật để kiểm tra phương pháp L. Pneumophila): 15 serogroup từ các loài.
- Danh mục kiểm tra tính không bao gồm (các vi sinh vật được thử nghiệm được công nhận là không thuộc chi Legionella và/hoặc gần giống về mặt phát sinh loài). Ít nhất danh mục sau đây phải được thử nghiệm: Aeromonas hydrophila, Alcaligenes faecalis (ví dụ CIP 60.80), Bacillus subtilis (ví dụ CCM 1999), Burkholderia cepocia , Clostridium spp., Enterobacter aerogenes, Escherichia coli (ví dụ: WDCM 00003), Flavobacterium spp., Klebsiella oxytoca (ví dụ: WDCM 00179), Listeria monocytogenes (ví dụ WDCM 00109 hoặc WDCM 00020), Proteus vulgaris, Pseudomonas aeruginosa, Pseudomonas fluorescens,Pseudomonasputida, Serratia marcescens, Stenotrophomonas maltophila.
- Danh mục kiểm tra tính không bao gồm (các vi sinh vật được thử nghiệm được công nhận là không thuộc loài L. Pneumophila): L. anisa (ví dụ: WDCM 00106), L. bozemanii, L. dunmofii, L. gormanii, L. jordanis, L. longbeachae, L. micdade (ví dụ: ATCC 33218)i, L. parisiensis (ví dụ CIP 103847), L. tucsonensis.
Tất cả các chủng được phân tích như một phần của việc đánh giá xác nhận này phải được lập thành văn bản kể cả phương pháp thay thế được sử dụng để xác định chủng là Legionella.
9.3 Kiểm tra hàm hiệu chuẩn của giai đoạn PCR định lượng
9.3.1 Yêu cầu chung
Việc hiệu chuẩn không thể dễ dàng áp dụng cho toàn bộ phương pháp. Chỉ hiệu chuẩn định lượng bằng PCR real-time (trên dải ADN) được mô tả sau đây. Điều này không loại trừ khả năng áp dụng các quy tắc đặc tính hàm hiệu chuẩn tương tự cho toàn bộ phương pháp, tức là các mẫu nước được làm nhiễm nhân tạo.
Hàm hiệu chuẩn phải được thực hiện với cả hai hệ thống PCR, tức là Legionella spp. và L. pneumophila.
Đối với phân tích thống kê, nồng độ của các đơn vị gen trên mỗi giếng PCR được biểu thị dưới dạng logarit thập phân.
9.3.2 Nguyên tắc xác nhận đường chuẩn
Kinh nghiệm cho thấy rằng các giá trị Ct trung bình thu được đối với các mức khác nhau của đại lượng đơn vị gen (được biểu thị bằng logarit thập phân) có thể được thể hiện theo mô hình hồi quy tuyến tính, tức là bằng công thức tuyến tính là y = ax'+ b.
Khi các thông số đã được xác định, sử dụng công thức này có thể tính số đơn vị gen Legionella có trong mẫu tương ứng với một phép đo Ct cụ thể.
Các thông số của đường chuẩn được xác định ban đầu theo quy trình đánh giá trong 9.3.3. Sau đó phân tích thống kê (xem 9.3.4) để:
a) Xác định công thức của đường chuẩn (xem 9.3.4.1);
b) Xác nhận mô hình hồi quy tuyến tính (xem 9.3.4.3).
9.3.3 Quy trình đánh giá đường chuẩn
Việc đánh giá các tính năng hiệu chuẩn phải được thực hiện trong các điều kiện độ chụm trung bình (ít nhất là vào các ngày khác nhau và/hoặc với những người khác nhau thực hiện) (ví dụ: từng ngày cho gia đoạn 5 ngày).
Chuẩn bị một dãy các mức p nồng độ của các đơn vị gen L. pneumophila [tốt nhất là được chuẩn bị từ chất chuẩn ban đầu và trong mọi trường hợp, được chuẩn bị từ L. Pneumophila (WDCM 00107)], p ít nhất bằng 4, ví dụ, 25, 250, 2500, 25000 đơn vị gen L. pneumophila trên mỗi giếng PCR. Điểm đầu tiên của dải phải bằng giới hạn định lượng (xem 9.4). Ở mỗi mức thực hiện k lần lặp lại phép đo, k ít nhất bằng 5. Ghi lại các giá trị yi,j thu được theo ví dụ nêu trong Bảng 6.
Thực hiện các phép tính như trong Bảng 6.
Bảng 6 - Định dạng kết quả và tính toán
| Mức xi | x1 = LQPCR | x2 = 10 LQPCR | x3 = 100 LQPCR | x4 = 1000 LQPCR | xp | Tổng số |
|
| x’1 | x’2 | x’3 | x’4 | x’p |
|
| yi,j (k lần lặp lại) | y1,1 | y2,1 | y3,1 | y4,1 | yp,1 |
|
| y1,2 | y2,2 | y3,2 | y4,2 | yp,2 |
| |
| y1,k | y2,k | y3,k | y4,k | yp,k |
| |
|
| T1 | T2 | T3 | T4 | Tp |
|
|
| m1 | m2 | m3 | m4 | mp |
|
|
|
|
|
|
|
|
|
| xi là số đơn vị gen L. pneumophila trên mỗi giếng PCR (các giá trị xi của các mức đưa ra là các ví dụ) x’i là logarit của xi; yi,j là phép đo giá trị Ct ở mức i (i = 1…p) và hàng j (j = 1...k); k là số lần lặp lại trên mỗi mức i (k ≥ 5); p là số mức (P ≥ 4). | ||||||
Tính tổng số các phép đo là N theo công thức (1):
N = kp (1)
Xem Phụ lục C để biết ví dụ tính toán đầy đủ.
9.3.4 Phân tích kết quả
9.3.4.1 Ước lượng đường hồi quy
Đường hồi quy được tính theo Công thức (2):
![]()
trong đó ![]() , là giá trị Ct trung bình.
, là giá trị Ct trung bình.
Vẽ các điểm có tọa độ (x’1, m1), (x’p, mp) trên đồ thị để xác nhận quan sát sự thẳng hàng của chúng dọc theo đường cong. Nếu kết quả kiểm tra này đạt yêu cầu, thì chuyển sang Công thức (3) và (4):
![]()
![]()
Thực hiện các phép tính sau đây để xác định độ dốc a. Phương sai của x’i, Vxi được cho trong Công thức (5):
![]()
và phương sai của x’y, σx’y, theo Công thức (6):
![]()
Ước tính độ dốc a theo Công thức (7):
![]()
Thực hiện các phép tính sau để cố định điểm cắt b.
Đường cong đi qua điểm trung bình có tọa độ trên trục hoành
![]()
Và trên trục tung
![]()
Dẫn đến
![]()
Và do đó:
![]()
9.3.4.2 Ước tính và xác nhận hiệu quả khuyếch đại
Hiệu suất đánh giá năng suất của phản ứng PCR.
Hiệu suất, e, được tính bằng Công thức (8):
![]()
Hiệu suất phải có giá trị trong khoảng từ 75 % đến 125 %. Do đó, giá trị của độ dốc, a, phải nằm trong khoảng -4,115 đến -2,839. Khoảng chấp nhận này đủ lớn để bao gồm tất cả các hệ thống qPCR trên tất cả các máy chu trình nhiệt. Đối với hệ thống qPCR xác định trên một máy chu trình nhiệt thường được sử dụng, thì giới hạn chấp nhận phải được ước tính theo phương pháp kiểm soát chất lượng sử dụng nghiên cứu thống kê hoặc biểu đồ chất lượng.
Nếu a nằm ngoài dải trên, thì hệ thống khuếch đại không được xác nhận.
9.3.4.3 Xác nhận hiệu năng hồi quy tuyến tính
Hồi quy tuyến tính phải thỏa mãn yêu cầu về độ chính xác sau đây đối với từng nồng độ của đường chuẩn (tiêu chí bao gồm độ chệch và độ chụm) như được chỉ ra trong Công thức (9):
Elin ≤ 0,15 (9)
trong đó Elin là độ chính xác của tuyến tính, được biểu thị dưới dạng lôgarit thập phân.
Để thực hiện việc này, thực hiện các phép tính nêu trong Bảng 7.
Nếu Elini ≤ 0,15, bất kể mức i nào, thì độ tuyến tính phải được xác nhận.
Nếu một trong các giá trị Elini nằm trên giá trị tới hạn của 0,15log10, thì mô hình không được xác nhận.
CHÚ THÍCH: Việc kiểm tra các giá trị độ chệch và độ lệch chuẩn cho thấy lỗi mô hình là do vấn đề độ chính xác (s’i quá cao) hoặc vấn đề độ chệch (![]() , quá cao) gây ra.
, quá cao) gây ra.
Bảng 7 - Độ chệch, độ chụm, độ chính xác và độ không đảm bảo của các phép tính tuyến tính
| Mức xi ước tính | x1 | x2 | x3 | x4 | xp |
| Mức x’i lý thuyết | x’1 | x’2 | x’3 | x’4 | x’p |
| x’i,j | x’1,1 | x’2,1 | x’3,1 | x’4,1 | x’P,1 |
| x’1,2 | x’2,2 | x’3,2 | x’4,2 | x’p,2 | |
| x’1,3 | x’2,3 | x’3,3 | x’4,3 | x’p,3 | |
| x’1,4 | x’2,4 | x’3,4 | x’4,4 | x’p,4 | |
| x’1,k | x’2,k | x’3,k | x’4,k | x’p,k | |
|
|
|
|
|
|
|
| Độ chệch |
|
|
|
|
|
|
| s’1 | s’2 | s’3 | s’4 | s’p |
|
| Elin1 | Elin2 | Elin3 | Elin4 | Elinp |
| Ulin i = Elin i tk - 2 | Ulin1 | Ulin2 | Ulin3 | Ulin4 | Ulinp |
| Theo lý thuyết x’i là giá trị tính được sử dụng công thức: x’i = log x’i; x’i,j là giá trị tính được sử dụng đường chuẩn từ giá trị đo yi,j;
s’i, là độ lệch chuẩn của các giá trị x’i,j với k-1 bậc tự do; Elin là độ chính xác của độ tuyến tính; Ulin là độ không đảm bảo mở rộng của độ tuyến tính; tk-2 là giá trị được cho bởi bảng Student cho k - 2 bậc tự do ở rủi ro 5 % (xem Phụ lục D). | |||||
9.3.5 Sử dụng đường chuẩn
Đối với mỗi phép đo y = Ct của mẫu, sử dụng công thức đường chuẩn, như trong Công thức (10), để thu được x' bằng cách hiệu chuẩn ngược:
![]()
trong đó các giá trị k của x’ thu được nếu lấy k các phép đo riêng biệt trên cùng một mẫu.
Tính giá trị trung bình ![]() và các độ lệch chuẩn liên quan, theo công thức nêu trong Bảng 7.
và các độ lệch chuẩn liên quan, theo công thức nêu trong Bảng 7.
CHÚ THÍCH: Nếu độ lệch chuẩn liên quan, s’, lớn hơn 0,15, thì độ không đảm bảo của phép đo mẫu là lớn hơn độ không đảm bảo ước tính được trong quá trình xác định đặc tính của phương pháp ban đầu.
Bằng phép biến đổi antilog, biểu thị kết quả dưới dạng là x GU/lít theo Công thức (11):
![]()
9.4 Xác nhận giới hạn định lượng PCR, LQqPGR
9.4.1 Nguyên tắc
Giới hạn định lượng thấp nhất có thể chấp nhận được là 25 GU (1,40log10 đơn vị) do phân bố lấy mẫu (phân phối Poisson) trên tất cả các thử nghiệm được thực hiện trên mẫu.
Giới hạn định lượng phải tương ứng với mức đầu tiên của dải hiệu chuẩn.
Giới hạn định lượng được xác nhận nếu thiếu độ chính xác ở giới hạn định lượng, ELQ, nhỏ hơn hoặc bằng giá trị tới hạn của 0,15log10 đơn vị.
CHÚ THÍCH: Giá trị 0,15lg10 đơn vị có được từ dữ liệu thực nghiệm.
9.4.2 Thiết kế thử nghiệm
Chuẩn bị k dung dịch pha loãng riêng biệt (k ≥ 10) tại giá trị LQqPCR mục tiêu từ dung dịch ADN của L. pneumophila thu được từ chất chuẩn gốc (xem 10.2). Định lượng từng độ pha loãng theo quy trình phòng thí nghiệm thông thường (đơn, lặp lại hai lần hoặc lặp lại ba lần) trong các điều kiện độ chụm trung gian này (ít nhất vào các ngày khác nhau và/hoặc do những người khác nhau thực hiện). Giá trị LQqPCR mục tiêu không được nhỏ hơn 25 GU cho một phép đo đơn lẻ, 15 GU cho phép đo lặp lại hai lần và 10 GU cho phép đo lặp lại ba lần.
9.4.3 Phân tích kết quả
Tính độ lệch chuẩn đối với các giá trị x’i thu được thông qua hiệu chuẩn ngược từ k phép đo như trong Công thức (12)
![]()
Trong đó
x’i là logarit thập phân của số đơn vị gen của L. Pneumophila, được tính bằng hiệu chuẩn ngược, từ các giá trị Ct và công thức đường chuẩn;
k là số lần đo.
Tính toán độ chệch theo Công thức (13):
![]()
Trong đó x là giá trị lý thuyết của LQqPCR mục tiêu.
Tính độ chính xác ở giới hạn định lượng, ELQ, theo Công thức (14):
![]()
Trong đó:
ELQ là độ chính xác ở giới hạn định lượng;
s là độ lệch chuẩn của các giá trị x’i thu được từ k lần đo.
Nếu ELQ ≤ 0,15, thì giới hạn định lượng đích cần được xác nhận. Nếu không, cần tìm nguyên nhân (giá trị tháp, các số lạc v.v...).
Tính độ không đảm bảo ở giới hạn định lượng (ULQ) sử dụng Công thức (15):
ULQ = ELQttab (15)
Trong đó:
ULQ là độ không đảm bảo ở giới hạn định lượng;
Ttab là giá trị bảng student (với rủi ro 5 %, đối với k - 1 bậc tự do).
Ví dụ về xác nhận LQqPCR đối với LQqPCR mục tiêu ở 25 GU, với 10 phép đo được nêu trong Bảng 8.
Bảng 8 - Ví dụ về xác nhận LQqPCR
| Phép thử số | x’i |
| 1 | 1,498 |
| 2 | 1,577 |
| 3 | 1,461 |
| 4 | 1,48 |
| 5 | 1,515 |
| 6 | 1,531 |
| 7 | 1,422 |
| 8 | 1,442 |
| 9 | 1,547 |
| 10 | 1,499 |
|
| 1,497 |
| Độ chệch | 0,099 |
| S | 0,048 |
| ELQ | 0,110 |
| ULQ | 0,249 |
Trong ví dụ ở Bảng 8 ELQ = 0,11, do đó ELQ ≤ 0,15 và giới hạn định lượng ở 25 GU được xác nhận.
9.4.4 Giới hạn định lượng lý thuyết của toàn bộ phương pháp
LQ lý thuyết của phương pháp hoặc LQmeth (biểu thị bằng đơn vị gen trên lít) thu được bằng cách sử dụng Công thức (16):
![]()
Trong đó:
F là hệ số chuyển đổi số đơn vị gen trên một giếng sang số đơn vị gen trên lít;
V là thể tích mẫu đã lọc.
CHÚ THÍCH: LQmeth này không tính đến sự phục hồi vốn có của các giai đoạn chuẩn bị.
9.5 Đánh giá xác nhận giới hạn phát hiện PCR (LDqPCR)
Giới hạn phát hiện tương ứng với số lượng đơn vị gen nhỏ nhất cho kết quả PCR dương tính ở ngưỡng 90 %.
Kiểm tra để đảm bảo rằng ít nhất 90 % giá trị LQqPCR mục tiêu là dương tính (ví dụ: 5 GU/giếng PCR) để hạn chế số lần thử nghiệm. Thực hiện ít nhất 10 phép đo đối với LQqPCR được chọn từ 10 dung dịch pha loãng riêng biệt được chuẩn bị từ dung dịch ADN L. Pneumophila được nối với chuẩn gốc (xem 10.2).
9.6 Phương pháp xác định độ thu hồi
9.6.1 Nguyên tắc
Nghiên cứu thu hồi phải được thực hiện trên các mẫu nước không chứa ADNse/RNAse (không có ADN Legionella) đã được gây nhiễm nhân tạo bằng các dung dịch pha loãng của huyền phù gốc được hình thành từ chủng L. Pneumophila (WDCM 00107).
Ít nhất hai mức thêm chuẩn (độ pha loãng) phải được thử nghiệm tương ứng, ví dụ, đến 1 000 GU/L và 100 000 GU/L. Hai mức này phải thu được từ các dung dịch pha loãng liên tiếp lặp lại khác nhau có nguồn gốc từ cùng một huyền phù gốc.
Đối với mỗi mức nồng độ, phải phân tích ít nhất 10 mẫu thêm chuẩn riêng rẽ với lượng từ 100 ml đến 1 L trong các điều kiện độ chụm trung gian (trong vài ngày, do những kỹ thuật viên khác nhau thực hiện, v.v...).
Tính độ thu hồi theo hiệu số logarit. Độ thu hồi phải nằm trong khoảng từ -0,6log10 đơn vị đến + 0,3log10 đơn vị.
9.6.2 Quy trình
Để thực hiện một loạt các phép thử, tạo huyền phù gốc từ các khuẩn lạc L. Pneumophila (WDCM 00107), sau đó cấy vô trùng các khuẩn lạc L. pneumophila (ví dụ: 5 khuẩn lạc), đã phát triển trong khoảng thời gian dưới 72 h, trong ống chứa 2 ml muối trypton để thu được huyền phù gốc (mẹ) về mặt lý thuyết chứa 109 GU/mL. Nên xác nhận nồng độ của huyền phù mẹ bằng cách đo mật độ quang ở 600 nm. Mật độ quang là 0,5 ở 600 nm tương ứng với nồng độ Legionella spp. là 109 sinh vật/mL. Đồng hóa mạnh huyền phù mẹ để ít nhất 30 s.
Đo nồng độ các đơn vị gen trong huyền phù mẹ bằng PCR từ ba dịch phân giải trực tiếp của huyền phù mẹ: áp dụng đồng thời quy trình ly trích của phương pháp (dung dịch phân giải và các điều kiện vật lý như nhiệt độ, thời gian, lắc trộn) cho ba phần mẫu thử của huyền phù gốc. Thể tích phần mẫu thử tối thiểu là 100 μL được đưa vào thể tích chuẩn của dung dịch phân giải (tỷ lệ giữa thể tích của dung dịch phân giải và thể tích phần mẫu thử phải ít nhất là 3). Khi kết thúc quá trình phân giải, thu được ba dịch chiết ADN chưa được tinh sạch, nếu cần, được pha loãng để loại bỏ mọi sự ức chế PCR liên quan đến thuốc thử phân giải và sau đó, được định lượng bằng PCR.
Cách khác để tạo ra huyền phù của vi khuẩn Legionella pneumophila cho các thực nghiệm xác định độ thu hồi là sử dụng các mẫu chuẩn có bán sẵn trên thị trường với một lượng đã được chứng nhận (được biểu thị bằng GU) Legionella pneumophila.
Tính giá trị trung bình, A, được biểu thị bằng logarit thập phân GU/ml, từ ba giá trị logarit thu được. Giá trị A này được tham chiếu cho phép tính độ thu hồi.
Đồng thời tạo ra các huyền phù thêm chuẩn từ huyền phù mẹ, để thu được các mức nồng độ mục tiêu, tức là chuẩn bị một dải các dung dịch pha loãng từ huyền phù mẹ (ví dụ: 10-1, 10-2, 10-3, 10-4 và 10-5 được ký hiệu là d1, d2, d3, d4 và d5). Dãy pha loãng phải được thực hiện ở độ pha loãng 10-1 trong muối trypton, 9 mL muối trypton được cho vào 1 mL huyền phù vi khuẩn. Mỗi ống phải được đồng nhất bằng cách lắc cơ học (khoảng 10 s). Các mức pha loãng 10-3 (d3) và 10-5 (d5) tương ứng với khoảng 106 GU/ml và 104 GU/mL. Chuẩn bị hai mẫu thêm chuẩn bằng cách cấy một thể tích tối thiểu là 100 μL (được ký hiệu là Vpe), của hai độ pha loãng đã chọn, ví dụ d3 hoặc d5, có thể thu được các lượng tương ứng của 105 GU và 103 GU trong một thể tích đã lọc (0,1 L đến 1 L), trong trường hợp này. Hai mẫu thêm chuẩn thu được này (hai mức khác nhau) phải tuân theo quy trình đo đầy đủ (lọc, chiết và đo) và phải cho kết quả B, được biểu thị dưới dạng logarit thập phân trên mỗi mẫu.
Việc định lượng PCR của huyền phù mẹ và các mẫu đã được thêm chuẩn phải được thực hiện trong cùng một ngày, trong cùng một dãy khuếch đại.
9.6.3 Tính toán
Tính toán độ thu hồi của mẫu được tính theo Công thức (17):
![]()
Trong đó:
log10ηx là logarit thập phân của độ thu hồi mẫu;
A là giá trị tham chiếu của nồng độ huyền phù gốc (mẹ), được biểu thị bằng logarit thập phân của số đơn vị gen trên mililít;
Vpe là thể tích của huyền phù thêm chuẩn, tính bằng microlit, μL;
B là giá trị được đo từ mẫu thêm chuẩn, được biểu thị bằng logarit thập phân của số đơn vị gen trên mỗi mẫu;
D là logarit thập phân của hệ số pha loãng giữa huyền phù mẹ và huyền phù thêm chuẩn, ví dụ: D là 3 đối với độ pha loãng 10-3.
Quy trình được mô tả ở trên phải được thực hiện ít nhất 10 lần đối với mỗi mức thêm chuẩn trong các điều kiện độ chụm trung gian (ít nhất vào các ngày khác nhau và/hoặc do những người khác nhau thực hiện). Tính độ thu hồi trung bình và độ lệch chuẩn từ 10 giá trị độ thu hồi riêng lẻ thu được.
Độ thu hồi trung bình đối với mỗi mức nằm trong khoảng từ -0,6log10 đơn vị đến + 0,3log10 đơn vị.
Các giá trị này có thể là các giá trị đầu tiên được sử dụng vào các biểu đồ kiểm soát.
Nếu giá trị thu được không nằm trong giới hạn dự kiến thì phải điều tra nguyên nhân.
Xem ví dụ trong Phụ lục E.
9.7 Độ vững
Trong trường hợp này, độ vững được xác định thông qua đặc tính của hiệu ứng nền. Độ thu hồi về cơ bản không bị ảnh hưởng bởi loại nền mẫu cần phân tích.
Để thực hiện điều này, ước tính độ thu hồi của từng loại nền mẫu (ví dụ: nước từ tháp làm mát, nước ăn uống, nước mặt, nước thải) và theo dõi theo thời gian (biểu đồ kiểm soát tùy chọn). Thực hiện theo quy trình trong 9.6, bằng cách thay nước vô trùng bằng nền mẫu không chứa L. pneumophila (thể tích lọc tối thiểu phải là 100 mL). Các giới hạn chấp nhận được giống như các giới hạn nêu trong 9.6.
9.8 Độ không đảm bảo tổng thể của phương pháp
Phép đo độ không đảm bảo tổng thể của phương pháp bao gồm cả độ chính xác và độ chụm trung bình.
Cách tiếp cận nêu trong tiêu chuẩn này dựa trên việc phân tích các giá trị độ thu hồi.
Độ chệch được ước tính bằng giá trị độ thu hồi trung bình cho tất cả các nền mẫu (9.6 và 9.7). Độ chụm này được ước tính thông qua phương sai thu hồi, sử dụng tất cả các giá trị thu được trong quá trình xác nhận ban đầu của phương pháp (9.6), nghiên cứu độ vững (9.7) và theo dõi độ thu hồi theo thời gian (10.4).
Chỉ độ thu hồi phân giải không được đưa vào đánh giá độ không đảm bảo. Khuyến cáo rằng quy trình ly trích trong phòng thí nghiệm được so sánh với các quy trình ly trích thương mại khác nhau để kiểm tra sự thiếu sót của giai đoạn này.
Phép đo độ thu hồi thu được từ hai phép đo PCR (phương pháp tổng thể và phương pháp phân giải trực tiếp). Đánh giá độ không đảm bảo do đó được đánh giá quá cao.
Tiến hành các phép tính nêu trong Bảng 9 (xem ví dụ trong Bảng F.1, Phụ lục F).
Bảng 9 - Tính độ không đảm bảo từ các giá trị độ thu hồi
| Mẫu số. | Nền mẫu | Mức thử nghiệm | Độ thu hồi mẫu |
| x = 1…n trong đó n là tổng số mẫu đối với tất cả các nền mẫu và tất cả các mức | Nước tinh khiết | Mức 1 (ví dụ 1 000 GU/L) | ηx |
| Mức 2 | |||
| Nước nóng làm vệ sinh | Mức 1 | ||
| Mức 2 | |||
| Nước từ tháp làm mát | Mức 1 | ||
| Mức 2 | |||
| v.v... | Mức 1 | ||
| Mức 2 | |||
| Độ thu hồi trung bình |
| ||
| Phương sai (s2) |
| ||
| Độ không không đảm bảo đo mở rộng tổng thể, Uoverall |
| ||
Một ước lượng khác về độ không đảm bảo có thể thực hiện được bằng nghiên cứu liên phòng thí nghiệm, xem Phụ lục H.
10 Kiểm soát chất lượng
10.1 Yêu cầu chung
Kiểm soát chất lượng đảm bảo tính đúng và chính xác của các phép đo do phòng thí nghiệm thực hiện. Các tần số đã nêu của các phép kiểm soát là tần số tối thiểu cần thiết khi thiết lập các kỹ thuật này. Việc tích lũy các kết quả có thể cho phép sửa đổi các tần số này.
Trong trường hợp phát hiện định tính, tất cả các kiểm soát chất lượng phải được thực hiện, trừ các kiểm soát nêu trong 10.2 và 10.3.
10.2 Liên kết dung dịch hiệu chuẩn và chất chuẩn với chuẩn gốc (chuẩn chính)
10.2.1 Nguyên tắc
Tính đúng của phép đo PCR real-time được đảm bảo bởi ba cấp chuẩn
a) Chuẩn gốc;
b) Các dung dịch hiệu chuẩn làm việc được sử dụng với mỗi loạt khuếch đại;
c) Mẫu chuẩn được kết nối với chất chuẩn gốc, được sử dụng không pha loãng như một chất kiểm tra chất lượng định lượng bên ngoài (xem 10.3).
Các dung dịch hiệu chuẩn làm việc (có hoặc không được cung cấp trong bộ kit thương mại) phải được nối với chất chuẩn gốc ít nhất mỗi năm một lần. Ngoài ra, nhà sản xuất bộ kít thương mại hoặc phòng thí nghiệm thiết kế phải thực hiện việc nối chuẩn này trong khi thực hiện các thay đổi đối với các dung dịch hiệu chuẩn.
Mẫu chuẩn phải được kết nối với chuẩn gốc (chính) và được lưu trữ trong các điều kiện đã được xác nhận để đảm bảo tính đồng nhất và ổn định của chúng. Mẫu chuẩn [dung dịch ADN L. Pneumophila (WDCM 00107)] được kết nối với chuẩn gốc, được sử dụng mà không cần pha loãng, có sẵn từ trung tâm chuẩn legionella quốc gia của Pháp.
10.2.2 Quy trình
Để thực hiện kết nối, dung dịch chuẩn làm việc phải được hiệu chuẩn với chất chuẩn gốc như sau.
Từ dung dịch hiệu chuẩn làm việc cần được kết nối, chuẩn bị ít nhất ba dải độc lập với bốn mức (tối thiểu) bằng các dung dịch pha loãng nối tiếp, bao trùm dải định lượng tuyến tính, trong dung dịch được sử dụng để phân tích mẫu trắng PCR. Thực hiện tương tự với chuẩn gốc. Các mức mục tiêu đối với hai dung dịch này phải tương đương nhau. Hai dãy này ba dải ADN độc lập phải được phân tích trong cùng một dãy PCR.
10.2.3 Phân tích dữ liệu
a) Xác nhận sự tương đương của các độ dốc (hiệu quả PCR).
Bằng hồi quy tuyến tính, thiết lập hàm hiệu chuẩn sử dụng các giá trị thu được đối với dải hiệu chuẩn của chuẩn gốc (được gọi là dải tham chiếu). Kiểm tra xác nhận rằng độ dốc a nằm trong khoảng từ -4,115 đến -2,839 tương ứng với hiệu suất khuếch đại với giá trị từ 75 % đến 125 % (xem 10.3).
Bằng cách hiệu chuẩn ngược, tính lại các giá trị đơn vị gen logarit thập phân với các giá trị Ct thu được, sử dụng hàm hiệu chuẩn đối với mỗi mức của dải hiệu chuẩn làm việc. Đối với mỗi cấp, tính độ lệch giữa giá trị mong đợi và giá trị được tính toán lại.Tính giá trị tuyệt đối của chênh lệch giữa giá trị tại điểm cao nhất và điểm thấp nhất.
Nếu giá trị này lớn hơn 0,20 và dẫn đến hiệu quả không tương đương. Không thể kết nối.
Nếu giá trị này nhỏ hơn hoặc bằng 0,20 thì hiệu quả là tương đương.
b) Điều chỉnh lại dung dịch hiệu chuẩn làm việc
Nếu các độ dốc là tương đương, thì tính giá trị trung binh của các độ lệch.
Nếu giá trị tuyệt đối của giá trị trung bình này lớn hơn 0,20 thì chuẩn bị dung dịch hiệu chuẩn chính xác khác (độ chệch bằng không) bằng cách pha loãng từ dung dịch gốc.
Nếu không, không cần chỉnh sửa. Kết nối đã đạt được.
Tiến hành theo cách tương tự để đánh giá giá trị của mẫu chuẩn hoặc sử dụng mẫu chuẩn có sẵn từ trung tâm chuẩn legionella quốc gia.
Ví dụ về kết nối của dung dịch hiệu chuẩn làm việc với chất chuẩn gốc được nêu trong Bảng 10.
c) Kiểm tra xác nhận sự tương đương của các độ dốc (hiệu quả PCR):
![]()
Độ dốc của hai dải là tương đương; có thể thực hiện việc kiểm tra xác nhận hiệu chuẩn
d) Chỉnh lại dung dịch hiệu chuẩn làm việc.
Sai số hiệu chuẩn trung bình nhỏ hơn 0,20log10, không cần hiệu chỉnh lại hiệu chuẩn đối với dung dịch hiệu chuẩn.
CHÚ THÍCH: Việc nối chuẩn của dung dịch hiệu chuẩn không thể ngoại suy theo phần dưới hoặc phần trên dải chuẩn được thiết lập bằng dung dịch chuẩn gốc.
Bảng 10 - Ví dụ về kết nối của dung dịch hiệu chuẩn làm việc với chất chuẩn gốc
| Dải chuẩn |
| |||||
| Mức thử nghiệm Log10(GU) | Cts (chu trình) thu được | |||||
| Log10(25) | 33,33 | 34,90 | 34,68 | |||
| Log10(250) | 31,64 | 31,05 | 31,18 | |||
| Log10(2500) | 27,92 | 27,99 | 27,80 | |||
| Log10(25000) | 24,64 | 24,71 | 24,60 | |||
| Độ dốc | -3,31 | |||||
| Điểm chặn | 39,10 | |||||
| Dung dịch hiệu chuẩn | ||||||
| Mức ước tính log10(GU) | Cts (chu trình) thu được | Ct trung bình trên mức | Số lượng thu được trên mức | Sai số hiệu chuẩn trên mức | ||
| log10(25) | 34,55 | 34,34 | 34,62 | 34,50 | 1,39 | -0,01 |
| log10(250) | 31,07 | 30,92 | 30,80 | 30,93 | 2,47 | 0,07 |
| log10(2500) | 27,02 | 27,70 | 27,73 | 27,48 | 3,51 | 0,11 |
| log10(25000) | 24,23 | 24,49 | 24,52 | 24,42 | 4,43 | 0,03 |
| Sai số hiệu chuẩn trung bình | 0,05 | |||||
10.3 Theo dõi hiệu năng
10.3.1 Hiệu năng của việc hiệu chuẩn
Những nội dung sau đây phải được theo dõi:
- giá trị của độ dốc đối với đường chuẩn (biểu đồ kiểm soát);
- giá trị của mẫu chuẩn (được định lượng bằng hiệu chuẩn ngược).
Giá trị tính toán phải tương ứng với giá trị tham chiếu ± 0,4 log10 đơn vị.
Kiểm soát này, được biểu thị bằng logarit thập phân của các đơn vị gen, phải được theo dõi theo thời gian (biểu đồ kiểm soát).
10.3.2 Theo dõi hiệu năng ở giới hạn định lượng
Đối với mỗi lần hiệu chuẩn: cần theo dõi độ lệch chuẩn tại điểm đầu tiên của đường chuẩn (LQPCR). Giá trị tuyệt đối của độ lệch phải nhỏ hơn 2 x 0,15. Các phòng thí nghiệm có thể siết chặt các giới hạn thiết lập bằng cách tăng số các điểm của dải.
10.4 Đối chứng dương tính và đối chứng âm tính của phương pháp
Đối với phép đối chứng dương tính, thực hiện đánh giá độ thu hồi ít nhất mỗi tháng một lần theo 9.6. Đối chứng dương tính định lượng này được sử dụng để theo dõi theo thời gian (sử dụng biểu đồ kiểm soát) độ thu hồi của phương pháp, được xác định ban đầu trong giai đoạn đánh giá hiệu năng (xem 9.6).
Việc đối chứng âm tính của phương pháp được thực hiện theo quy trình hoàn chỉnh trên thể tích mẫu từ 100 ml đến 1 L nước vô trùng không chứa ADN legionella. Việc đối chứng này phải được thực hiện sau mỗi dãy lọc. Mẫu đối chứng âm tính phải là mẫu cuối cùng sau khi lọc tất cả các mẫu khác trong dãy. Phép đối chứng âm tính của phương pháp được sử dụng để theo dõi toàn bộ quá trình (từ lọc đến tách chiết đến qPCR).
Đối với các phương pháp đã được bên thứ ba đánh giấc nhận đầy đủ, phải tuân thủ các hướng dẫn của nhà sản xuất về giải thích các đối chứng dương tính hoặc âm tính và NTC (xem 10.5).
Trong trường hợp phát hiện định tính, mẫu đối chứng dương tính là mẫu có thêm huyền phù Legionella pneumophila mà không cần bất kỳ yêu cầu định lượng nào.
10.5 Đối chứng không mẫu (NTC)
Đối với mỗi lần chạy khuếch đại PCR mẫu, chuẩn bị NTC để xác nhận rằng không có sự nhiễm ADN trong quá trình chạy PCR.
Đối chứng âm tính (10.4) có thể được sử dụng cho mục đích đó. Tuy nhiên, việc chuẩn bị mẫu trắng cụ thể cho bước PCR có thể được sử dụng để phát hiện sự nhiễm ở giai đoạn này. Điều này tránh việc điều tra không cần thiết đối với toàn bộ phương pháp nếu kết quả là dương tính.
Mẫu trắng dương tính chứng tỏ có sự ô nhiễm và phải đánh giá xác nhận đặc biệt về phép thử.
NTC có giá trị Ct lớn hơn giá trị Ct của điểm chặn thì không được coi là dương tính.
10.6 Kiểm soát ức chế
10.6.1 Yêu cầu chung
Điều cần thiết là phải đánh giá sự có mặt của chất ức chế PCR trong dịch chiết ADN.
Chất kiểm soát ức chế phải được bổ sung vào dịch chiết mẫu. Chất kiểm soát ức chế này có thể là chính chất đích (xem 10.6.2), hoặc plasmid hoặc oligonucleotit (xem 10.6.3).
10.6.2 Việc kiểm soát ức chế là chất cần kiểm tra
Thử nghiệm ít nhất một giếng với dịch chiết tử mẫu, một giếng kiểm soát ức chế PCR đơn thuần [2] và một giếng với dịch chiết mẫu và kiểm soát ức chế PCR [3].
Đường kiểm soát ức chế PCR là đường thu được với hỗn hợp phản ứng (6.5.2) mà trong đó một lượng ADN đích đã biết đã được thêm vào.
Thử nghiệm về sự có mặt của chất ức chế bao gồm so sánh đường cong của dịch chiết mẫu được thêm trình tự mục tiêu và đối chứng được thêm trình tự mục tiêu
Nếu các độ dốc không song song, có thể xảy ra sự ức chế. Pha loãng dịch chiết ADN mẫu để xác nhận có ức chế.
Nếu các độ dốc (tức là độ dốc của các tiếp tuyến với Ct) song song, thì thực hiện giải thích theo Bảng 11.
Bảng 11 - Diễn giải kiểm soát ức chế khi sự kiểm soát đó là chất cần kiểm tra
| Dịch chiết mẫu (1) | Đối chứng (2) | Dịch chiết mẫu + kiểm chứng (3) so với đối chứng (2) | Giải thích |
| Ct,1 | Ct,2 | Ct,3 ≤ Ct,3 | Có mặt ADN Legionella spp. hoặc Legionella pneumophila |
| Ct,1 | Ct,2 | Ct,3 > Ct,3 | Ức chế, dịch chiết ADN mẫu được pha loãng cho đến khi các giá trị Ct thu được thống nhất với liều lượng bổ sung |
| Không khếch đại | Ct,2 | Ct,3 = Ct,2 | Không có ADN Legionella spp. hoặc Legionella pneumophila ở ngưỡng phát hiện của phương pháp |
| Không khếch đại | Ct,2 | Ct,3 > Ct,2 | Ức chế, dịch chiết ADN mẫu được pha loãng cho đến khi các giá trị Ct thu được thống nhất với liều lượng bổ sung |
| Ct,1 Ngưỡng chu trình trong giếng chỉ có dịch chiết mẫu Ct,2 Ngưỡng chu trình trong giếng chỉ có chất đối chứng Ct,3 Ngưỡng chu trình trong giếng có cả mẫu lẫn chất đối chứng | |||
10.6.3 Chất kiểm soát ức chế là plasmid hoặc oligonucleotit
Chất kiểm soát ức chế là plasmid hoặc oligonucleotit sở hữu các trình tự bổ sung cho các đoạn mồi được sử dụng để khuếch đại Legionella spp. hoặc L. pneumophila đích. Do đó, nó được đồng khuếch đại với đích. Bảng 12 đưa ra cách giải thích định tính các kết quả kiểm soát ức chế.
Cần phân tích ADN pha loãng nếu quá trình tinh sạch ADN không đúng phụ thuộc vào chất ức chế.
Bảng 12 - Diễn giải kiểm soát ức chế khi kiểm soát đó là plasmid hoặc oligonucleotit
| Khuếch đại nhiều kiểu gen | Giải thích | |
| Trình tự Legionella spp. hoặc L. pneumophila đặc hiệu | Kiểm soát ức chế | |
| + | Phù hợp | Có mặt ADN Legionella spp. hoặc L. pneumophila |
| + | Không phù hợp | Có mặt ADN Legionella spp. hoặc L pneumophila Ức chế từng phần hoặc cạnh tranh, cùng một ADN dịch chiết mẫu phải được pha loãng cho đến khi thu được kiểm soát ức chế dương tính |
| - | Phù hợp | Không có ADN Legionella spp. hoặc L. pneumophila ở giới hạn phát hiện của phương pháp |
| - | Không phù hợp | Ức chế, ADN dịch chiết mẫu phải được pha loãng cho đến khi thu được đối chứng nội dương tính |
| a Kiểm soát ức chế (IC) không tuân thủ nếu giá trị Ct hoặc độ dốc của nó khác đáng kể so với giá trị được quan sát được trên kiểm soát ức chế mẫu được khuếch đại trong điểm gần nhất của dải hiệu chuẩn. Sự trôi Ct được coi là đáng kể nếu giá trị Ct của IC không nằm trong khoảng μct ± 3sCt (trong đó μCt và sCt, tương ứng, là giá trị trung bình và độ lệch chuẩn của các giá trị Ct của các kiểm soát ức chế bên trong của các dung dịch dải hiệu chuẩn khác nhau). Đối với phương pháp đã được bên thứ ba đánh giá xác nhận, phải tuân các hướng dẫn của nhà sản xuất. | ||
11 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm ít nhất các thông tin sau:
a) Phương pháp thử được sử dụng, viện dẫn tiêu chuẩn này;
b) Tất cả các thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
c) Ngày và điều kiện lấy mẫu;
d) Ngày phân tích;
e) Thể tích đã lọc của mẫu;
f) Các kết quả được nêu trong Điều 8;
g) Xử lý sau 24 h lấy mẫu hoặc mọi chi tiết không nêu trong tiêu chuẩn này mà có thể ảnh hưởng đến kết quả.
Phụ lục A
(Tham khảo)
Ví dụ về quy trình sản xuất dung dịch ADN chuẩn định lượng
Dịch cấy được chuẩn bị trong môi trường lỏng (BCYE) ở 37 °C ± 2 °C từ khuẩn lạc L. pneumophila (WDCM 00107) được phân lập trên môi trường chọn lọc.
Mật độ quang học được đo ở bước sóng 600 nm. Pha tăng trưởng theo cấp số nhân thu được đối với giá trị mật độ quang 0,5 ± 0,1.
ADN được tách chiết theo quy trình của phòng thí nghiệm.
Số lượng và chất lượng ADN L. pneumophila được đo sau khi tinh sạch ADN và xử lý với Rnase (để phân hủy RNA còn dư). Các giá trị này thu được bằng cách đọc mật độ quang ở bước sóng 260 nm và 280 nm.
Tỷ số giữa mật độ quang thu được ở bước sóng 260 nm với mật độ quang thu được ở bước sóng 280 nm phải nằm trong khoảng từ 1,7 đến 2,0 để cho thấy chất lượng của ADN tách chiết được đạt yêu cầu. Tỷ lệ mật độ quang nhỏ hơn 1,7 cho thấy độ tinh khiết của ADN được tách chiết không đạt yêu cầu và trên 2,0 cho thấy số lượng ADN được đánh giá quá cao do các vết của RNA: hoạt động RNase không hoàn toàn.
Ngoài ra, có thể kiểm tra chất lượng và số lượng ADN bằng cách điện di trong gel với dấu hiệu bán định lượng.
Nồng độ dung dịch ADN (đã tinh sạch), tính bằng microgam trên lít, được tính theo Công thức (A.1)
![]()
Trong đó:
[ADN] là nồng độ dung dịch ADN (đã tinh sạch) được biểu thị bằng miligam trên mililít;
A(260) là mật độ quang đo được ở bước sóng 260 nm.
Dịch chiết ADN được pha loãng để thu được điểm cao nhất trong khoảng (ví dụ: 160 000 GU/5 pl, tức là nồng độ ADN là 688 000 fg/5 μL.
Chuẩn bị các dung dịch pha loãng 10-1 đến giá trị LQ.
Dung dịch ADN được bảo quản ở -20 °C.
Phụ lục B
(Tham khảo)
Ví dụ về phương pháp xác định giới hạn ngưỡng của chu trình
Việc theo dõi PCR real-time được thực hiện bằng cách đọc tín hiệu phát xạ huỳnh quang ở mỗi chu trình. Tín hiệu này tỷ lệ thuận với số lượng đơn vị gen có trong giếng phản ứng. Nhiễu nền bị vượt quá sau một số chu trình (tương ứng với Ct) phụ thuộc vào số lượng đơn vị gen ban đầu.
Việc định lượng các mẫu chưa biết có được bằng cách sử dụng Ct của mẫu và hàm hiệu chuẩn
Trong ví dụ sau, các điểm dải xác định là 30 GU, 300 GU, 3 000 GU và 30 000 GU trong các giếng PCR
Ví dụ, khi kết thúc PCR, có thể thu được các cấu hình bên dưới (xem Hình B.1).
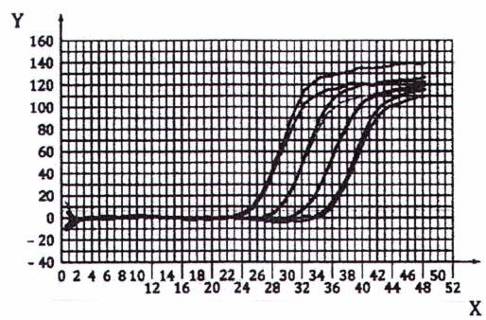
CHÚ DẪN:
X Chu trình
Y PCR đường cơ sở đã trừ RFU
CHÚ THÍCH: Trong ví dụ này, độ dốc là -3,26 và điểm chặn là 39,1.
Hình B.1- Sơ đồ thu được
Dữ liệu được xử lý lại sử dụng dải hiệu chuẩn. Để thực hiện việc này, xác định dải chu trình trong đó phép đo huỳnh quang không vượt quá nhiễu nền (trong ví dụ này là 22 chu trình đầu tiên) và vị trí của ngưỡng trên thang huỳnh quang (trong ví dụ này là giá trị 6) tại đáy của chu trình và trên nhiễu nền.
Ct tương ứng với giá trị của trục hoành của giao điểm của đường huỳnh quang và ngưỡng. Điều này tương ứng với số lượng chu trình.
Hàm số
![]()
trong đó niGU là số đơn vị gen ban đầu, có thể được xác định từ Ct của các điểm dải phạm vi. Công thức (B.1) thu được bằng hồi quy tuyến tính (xem thêm 9.3.4.1).
y = ax’ + b (B.1)
Trong đó:
y là giá trị Ct;
a là độ dốc của đường chuẩn từ đó tính được e là hiệu quả PCR;
b là điểm chặn (Ct theo lý thuyết tương ứng với một đơn vị gen, Ct,1GU);
x’ là log10niGU trong đó niGU (nicu = 10 [x’]) là số đơn vị gen ban đầu:
x’ = (y - b)/a (B.2)
Phụ lục C
(Tham khảo)
Ví dụ về nghiên cứu hàm hiệu chuẩn pha PCR định lượng
C.1 Bảng dữ liệu và tính toán
Các phép tính được nêu trong ví dụ này đã được làm tròn để tạo điều kiện thuận lợi cho việc thể hiện dữ liệu. Trong thực tế, các phép tính phải được thực hiện mà không làm tròn các giá trị.
Xem Bảng C.1.
Bảng C.1 - Dữ liệu và tính toán
| Mức xi | 30 | 300 | 3 000 | 30 000 | Tổng |
|
| 1,48 | 2,48 | 3,48 | 4,48 |
|
| yi,j, k = 5 lần lặp lại | 35,18 | 37,07 | 27,27 | 23,97 |
|
| 34,84 | 31,41 | 27,58 | 24,12 |
| |
| 34,80 | 31,15 | 27,36 | 24,06 |
| |
| 34,48 | 37,27 | 27,52 | 24,27 |
| |
| 34,80 | 37,42 | 27,55 | 24,77 |
| |
|
|
|
|
|
|
|
|
| 774,10 | 756,26 | 137,28 | 120,47 | TG = 588,11 |
|
| 34,82 | 31,25 | 27,46 | 24,09 |
|
|
| 257,17 | 387,52 | 477,34 | 539,36 |
|
| Trong đó: xi là số đơn vị gen của Legronella spp.hoặc L.neumophila trên mỗi ống phản ứng; x’i là logarit thập phân của xi; yi,j là phép đo giá trị Ct ở mức I (i= 1 ... p) và hàng j (j= 1 ... k); k là số lần lặp lại trên mỗi mức i, k = 5; p là số mức, P = 4. | |||||
N = kp = 5 x 4 = 20 theo Công thức (1).
C.2 Ước lượng đường hồi quy
C.2.1 Tính toán các yếu tố cần thiết
![]()
theo Công thức (3)
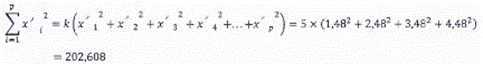
theo Công thức (4).
C.2.2 Tính toán độ dốc a
Phương sai x’i được tính theo:
![]()
theo Công thức (5). Phương sai của x’y được tính theo
![]()
theo Công thức (6). Do đó, độ dốc là
![]()
theo Công thức (7) “a” nằm trong khoảng từ -4,155 đến -2,839 và hệ thống khuếch đại được xác nhận.
C.2.3 Tính điểm chặn b
Đường cong đi qua điểm trung bình, có trục hoành là và trục tung là
![]()
và trục tung là
![]()
vì
![]()
và do đó
![]()
Công thức hồi quy được tính theo Công thức (2):
![]()
C.3 Kiểm tra tính hiệu quả
Hiệu suất e được tính theo Công thức (8):
![]()
trong đó e nằm trong khoảng từ 75 % đến 125 % và hiệu quả được xác nhận.
C.4 Ước tính hiệu suất tuyến tính
Hiệu suất của độ tuyến tính được ước tính sử dụng các phép tính nêu trong Bảng 6. Các giá trị thu được được thể hiện trong Bảng C.2.
Bảng C.2 - Độ chệch, độ chụm, độ chính xác và độ không đảm bảo của các phép tính tuyến tính
| Mức xi ước tính | 30 | 300 | 3000 | 30000 |
| x’i lý thuyết | 1,4771 | 2,4771 | 3,4771 | 4,4771 |
| x’i,j | 1,3967 | 2,5236 | 3,5655 | 4,4704 |
| 1,4899 | 2,4304 | 3,4805 | 4,4292 | |
| 1,5009 | 2,5017 | 3,5409 | 4,4457 | |
| 1,5886 | 2,4852 | 3,4970 | 4,4046 | |
| 1,5009 | 2,4276 | 3,4888 | 4,4320 | |
|
| 7,4770 | 12,3685 | 17,5727 | 22,1818 |
|
| 1,4954 | 2,4737 | 3,5145 | 4,4363 |
|
| 0,0183 | -0,0034 | 0,0374 | -0,0407 |
|
| 0,0680 | 0,0430 | 0,0368 | 0,02411 |
|
| 0,0704 | 0,0432 | 0,0525 | 0,0473 |
|
| 0,2241 | 0,1373 | 0,1670 | 0,1505 |
|
| 31 | 298 | 3270 | 27372 |
Vì Elini ≤ 0,15 đối với tất cả các mức, nên độ tuyến tính được xác nhận cho toàn bộ dải.
Phụ lục D
(Tham khảo)
Phân bố Student điển hình
Bảng D.1 cho thấy phân bố Student đối với mức rủi ro α = 5 % hoặc phép thử hai phía (1 - α/2)
Bảng D.1 - Phân bố student điển hình
| α | 0,05 |
| 1 - α/2 | 0,975 |
| 1 | 12,706 |
| 2 | 4,303 |
| 3 | 3,182 |
| 4 | 2,776 |
| 5 | 2,571 |
| 6 | 2,447 |
| 7 | 2,365 |
| 8 | 2,306 |
| 9 | 2,262 |
| 10 | 2,228 |
| 11 | 2,210 |
| 12 | 2,179 |
| 13 | 2,160 |
| 14 | 2,145 |
| 15 | 2,131 |
| 16 | 2,120 |
| 17 | 2,110 |
| 18 | 2,010 |
| 19 | 2,093 |
| 20 | 2,086 |
| 25 | 2,060 |
| 30 | 2,042 |
| 40 | 2,021 |
| 50 | 2,009 |
| 60 | 2,000 |
| 100 | 1,984 |
|
| 1,960 |
Phụ lục E
(Tham khảo)
Ví dụ về đánh giá độ thu hồi
Lấy 5 khuẩn lạc từ dịch nuôi cấy Legionella 72H và cấy vào ống đựng 9 ml muối trypton.
Lấy 250 μL mẫu huyền phù gốc và trộn với 1,25 mL dung dịch đệm phân giải (thể tích cuối cùng: 1,5 mL). Sau đó, dịch phân giải được pha loãng đến 10-2 và lấy 5 μL của dung dịch pha loãng này để phân tích PCR. Lặp lại ba lần để thu được ba dịch phân giải.
Các phép đo PCR được thực hiện trên ba dịch phân giải trực tiếp cho kết quả trung bình là 8300 GU/5 μL. Nồng độ tính theo log10GU/mL của huyền phù gốc là
![]()
Để tạo các dung dịch thêm chuẩn, nuôi cấy 250 μl các dãy pha loãng d3 (10-3) hoặc d5 (10-5) của huyền phù gốc. Ví dụ, định lượng PCR 1580 GU được cấy sẽ thu được mức 100 000 GU.
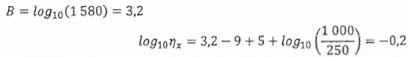
Theo Công thức (17).
Xem Bảng E.1.
Bảng E.1 - Ví dụ về bảng độ thu hồi trung bình thu được ở hai mức
| Mức | Độ thu hồi mẫu | Độ thu hồi trung bình | Độ lệch chuẩn |
| 100 000 GU | -0,24 | -0,09 | 0,17 |
| -0,02 | |||
| -0,22 | |||
| -0,18 | |||
| 0,09 | |||
| -0,10 | |||
| -0,29 | |||
| 0,20 | |||
| -0,25 | |||
| 0,07 | |||
| 1 000 GU | -0,09 | 0,12 | 0,16 |
| 0,18 | |||
| 0,33 | |||
| 0,08 | |||
| 0,37 | |||
| -0,12 | |||
| 0,14 | |||
| 0,26 | |||
| -0,19 | |||
| 0,26 |
Phụ lục F
(Tham khảo)
Ví dụ về đánh giá độ không đảm bảo tổng thể
Bảng F.1- Ví dụ về đánh giá độ không đảm bảo tổng thể
| Mức | Độ thu hồi mẫu | Độ thu hồi trung bình | Phương sai | ||
| Nước vô trùng | Nước vệ sinh nóng | Nước từ tháp làm mát | |||
| 100 000 GU | -0,24 | -0,37 | -0,30 | -0,218 | 0,105 |
| -0,02 | -0,68 | 0,14 | |||
| -0,22 | -0,77 | -0,61 | |||
| -0,18 | -0,45 | -0,81 | |||
| 0,09 | -0,13 | -0,07 | |||
| -0,10 | -0,59 | -0,38 | |||
| -0,29 | 0,74 | -0,40 | |||
| 0,20 | -0,66 | -0,38 | |||
| -0,25 | -0,58 | -0,20 | |||
| 0,07 | -0,67 | -0,27 | |||
| 1 000 GU | -0,09 | -0,41 | 0,18 | ||
| 0,18 | -0,42 | 0,55 | |||
| 0,33 | -0,40 | -0,61 | |||
| 0,08 | -0,48 | -0,64 | |||
| 0,37 | 0,27 | 0,27 | |||
| -0,12 | -0,56 | -0,46 | |||
| 0,14 | -0,09 | 0,21 | |||
| 0,26 | -0,20 | -0,15 | |||
| -0,19 | -0,18 | -0,47 | |||
| 0,26 | -0,07 | -0,24 | |||
![]()
Phụ lục G
(Quy định)
Đánh giá hiệu năng của phương pháp đã được bên thứ ba đánh giá xác nhận
G.1 Nguyên tắc
Quy trình đánh giá xác nhận phương pháp được mô tả trong phần dưới đây tương ứng với đánh giá xác nhận thứ cấp của phương pháp, có thể áp dụng cho mọi ứng dụng của phương pháp đã được bên thứ ba xác nhận trong phòng thí nghiệm.
Quy trình này có thể thay thế cho các yêu cầu nêu trong Điều 9 nếu:
- Phương pháp đã được bên thứ ba chứng nhận thỏa đáng hoặc đánh giá xác nhận trước (đánh giá xác nhận ban đầu, theo các yêu cầu nêu trong Điều 9);
- Phương pháp đã đánh giá được áp dụng toàn bộ trong phòng thí nghiệm (cùng một loại vật liệu, không thay đổi quy trình);
- Trong trường hợp sử dụng phương pháp để phát hiện định tính, nhà cung cấp (nhà sản xuất) phương pháp đã được bên thứ ba đánh giá xác nhận có thể cung cấp ngưỡng tín hiệu (b trong phương trình tuyến tính y = ax + b nêu trong 7.4) về sự có mặt/không có mặt.
G.2 Tiêu chí đánh giá xác nhận
Các tiêu chí đánh giá xác nhận bao gồm:
- Tính bao gồm/không bao gồm: không thể áp dụng. Dữ liệu đánh giá phải được nhà sản xuất cung cấp;
- Đánh giá đường chuẩn: ít nhất năm dải trong các điều kiện tái lập trung gian;
- Kiểm tra xác nhận LQqPCR: để xác nhận LQqPCR điểm đầu tiên của năm dải hiệu chuẩn được phân tích trong các điều kiện tái lập trung gian;
- Kiểm tra xác nhận LQqPCR: để để xác nhận trên một nồng độ đích (LD), ở 10 lần lặp lại trong 2 ngày (độ tái lập trung gian);
- Độ thu hồi: (xem độ vững);
- Độ vững: để hiện thực hóa theo các yêu cầu nêu trong 9.6 đối với mẫu nước vô trùng và nền mẫu phức tạp gặp phải trong phòng thí nghiệm (ví dụ: nước từ tháp làm mát có nguồn gốc từ nước mặt). Cần phải thực hiện nghiên cứu độ thu hồi trên các nền mẫu thường gặp trong phòng thử nghiệm, trên một lượng mẫu lớn hơn hoặc bằng 8;
- Trong trường hợp phát triển bộ kít thương mại, đã được bên thứ ba đánh giá xác nhận, thì chỉ phải kiểm tra xác nhận các thông số bị ảnh hưởng do việc sửa đổi;
- Trong phụ lục này, không kiểm tra xác nhận việc nối chuẩn giữa dung dịch hiệu chuẩn và mẫu chuẩn với chuẩn gốc.
Phụ lục H
(Tham khảo)
Nghiên cứu liên phòng thí nghiệm
Trong phụ lục này, độ chụm đã được đánh giá từ dữ liệu của 14 phép so sánh liên phòng (ILC) được thực hiện từ năm 2008 đến 2014 và được tổ chức bởi AGLAE (hiệp hội các phòng thí nghiệm của Pháp).
Các vật liệu tương tự như nước nóng làm vệ sinh đã được sử dụng. Các mẫu được chuẩn bị bằng cách sử dụng nguồn cung nước công cộng đã được trung hòa, sau đó được bổ sung các chủng vi khuẩn khác nhau. Một số chủng, đôi khi bao gồm cả chủng cấy hỗn hợp đã được sử dụng:
- Legionella pneumophila serogrup 1, Legionella pneumophila serogrup 6;
- Legionella micdadei, Legionella bozemanii, Legionella dumoffi, Legionella anisa;
- Vi sinh vật nền có thể có mặt trong các mẫu.
Số lượng phòng thí nghiệm tham gia dao động từ 33 đến 41.
Quá trình xử lý dữ liệu được thực hiện dưới sự đảm bảo chất lượng phù hợp với các yêu cầu của TCVN 6940-2 (ISO 5725-2) và đã được công nhận (xem Hình H.1 và H.2).
CHÚ DẪN
Y Cv,R%
X GU trên phần mẫu thử (đơn vị logt)
1 so sánh liên phòng từ năm 2008 đến 2014
2 mô hình tiến hóa
Hình H.1 - Thay đổi các giá trị của hệ số biến thiên độ tái lập (CR,V,%) phụ thuộc vào số lượng GU trên phần mẫu thử (đơn vị log) - Legionella spp.
CHÚ DẪN
Y CV,R%
X GU trên phần mẫu thử (đơn vị log)
1 so sánh liên phòng từ năm 2008 đến 2014
2 thử nghiệm mẫu
3 mô hình tiến hóa
Hình H.2 - Thay đổi các giá trị hệ số biến thiên độ tái lập CR,V,%) phụ thuộc vào số lượng GU trên phần mẫu thử (đơn vị log) - Legionella pneumophila
Bảng H.1- Ví dụ về độ chụm quan sát được trong phép so sánh liên phòng thí nghiệm được thực hiện vào tháng 9 năm 2013
|
| Giá trị trung bình quan sát được bởi các phòng thí nghiệm, ma | Khoảng tin cậy 95 % của giá trị trung bình | Độ lặp lại | Độ tái lậpb |
| Định lượng Legionella pneumophila | 1,98 x 105 | [1,52 x 105; 2,57 x 105] | 2,3 | 7,1 |
| a Số lượng GU trên 200 mL. Lưu ý rằng 200 ml tương ứng với thể tích đã lọc. Nếu 1 L được lọc, đơn vị sẽ tính bằng UG trên lít; độ lặp lại và độ tái lập sẽ không được sửa đổi. b Được biểu thị bằng tỷ lệ tối đa mong đợi (ở mức 95 %) giữa hai kết quả từ hai phòng thí nghiệm khác nhau. Nếu A và B là hai kết quả từ hai phòng thí nghiệm khác nhau (theo quy ước A < B); giá trị 7,1 nghĩa là có 95 % khả năng Độ lệch chuẩn của phân tán dữ liệu sau khi chuyển đổi log (slog) có thể được tính từ giá trị (v), sử dụng Công thức: Trong hình H.1, CR,V,% so với giá trị trung bình quan sát được bởi các phòng thí nghiệm được thể hiện bằng đồ thị (số GU trên phần mẫu thử theo phép tính sau: Khi đó, đối với ví dụ được cho thì, mlog = log(190 000) = 5,297 và | ||||
Thư mục tài liệu tham khảo
[1] NCBI Genbank database. Available (viewed 2012-10-12) at: http://www.ncbi.nlm.nih.gov/Genbank/GenbankSearch.html
[2] EMBL Nucleotide sequence database. Available (viewed 2012-10-12) at: http://www.ebi.ac.uk/embl
[3] WORLD DATA CENTER FOR MICROORGANISMS, Reference strain catalogue pertaining to organisms for performance testing culture media. Available (2012-10-12) at: http://www.wfcc.info/pdf/WDCM_Reference_Strain_Catalogue.pdf
[4] Quality Assurance/Quality Control Guidance for Laboratories Performing PCR Analyses on Environmental Samples October 2004. Available at: https://www.epa.gov/sites/production/files/2015-07/documents/epa-qaqc-pcr.pdf
[5] Wellinghausen N., Frost C., Marre R., (2001) Detection of Legionellae in hospital water samples by quantitative real-time LightCycler PCR. Appl Environ Microbiol 67, pp. 3985-3993
[6] Wullings BA, Bakker G, van der Kooij D, (2011) Concentration and diversity of uncultured Legionella spp. in two unchlorinated drinking water supplies with different concentrations of natural organic matter. Appl Environ Microbiol. 77, pp. 634-41
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 13452:2021 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 13452:2021 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 13452:2021 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 13452:2021 DOC (Bản Word)