- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 13442:2021 ISO 22190:2020 Chất lượng đất - Sử dụng các dịch chiết để đánh giá khả năng sử dụng sinh học của các nguyên tố lượng vết trong đất
| Số hiệu: | TCVN 13442:2021 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Tài nguyên-Môi trường |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
28/12/2021 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 13442:2021
Tiêu chuẩn Quốc gia TCVN 13442:2021 ISO 22190:2020: Quy định về đánh giá khả năng sử dụng sinh học của các nguyên tố lượng vết trong đất
Tiêu chuẩn TCVN 13442:2021 ISO 22190:2020 được Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC 190 biên soạn và Bộ Khoa học và Công nghệ công bố, có hiệu lực từ ngày ban hành. Tiêu chuẩn này hướng dẫn việc sử dụng các phương pháp hóa học để xác định khả năng sử dụng sinh học của các nguyên tố lượng vết trong đất, nhằm hỗ trợ các quyết định liên quan đến môi trường và sức khỏe cộng đồng.
Tiêu chuẩn này khẳng định rằng các sinh vật chỉ phản ứng với phần chất ô nhiễm có khả năng sử dụng sinh học, chứ không phải với tổng nồng độ ô nhiễm trong đất. Do đó, việc đánh giá rủi ro phải dựa trên nồng độ chất ô nhiễm thực sự có sẵn cho sinh vật, từ đó giúp đưa ra các quyết định chính xác hơn về tác động của ô nhiễm đối với sức khỏe con người và môi trường.
Điểm nổi bật trong tiêu chuẩn là việc phân loại các phương pháp chiết xuất để đánh giá khả năng sử dụng sinh học, cho phép sử dụng các dung dịch trung tính hoặc axit tùy vào mục đích thử nghiệm khác nhau. Các phương pháp đánh giá gồm:
- Chiết xuất trung tính (vd. CaCl2 0,001 mol/L) được sử dụng để ước lượng nồng độ nguyên tố lượng vết trong nước mao quản, giúp phản ánh đúng điều kiện tự nhiên hơn.
- Chiết xuất axit mạnh (vd. HNO3 0,43 mol/L) dùng để đánh giá khả năng sử dụng tiềm năng của nguyên tố lượng vết, nhưng không phản ánh được tình trạng tự nhiên trong điều kiện đất thực tế.
Để tối ưu hóa quy trình đánh giá, tiêu chuẩn khuyến nghị một cách tiếp cận phân tầng, trong đó các tầng thử nghiệm được thực hiện để có cái nhìn sâu sắc về tính khả dụng của môi trường. Cách tiếp cận này bắt đầu từ việc đo khả năng sử dụng tiềm năng và thực tế, sau đó đánh giá từng bổ sung và điều kiện cụ thể cho từng loại đất và sinh vật.
Tiêu chuẩn này còn chú trọng đến việc đưa ra các thuật ngữ về khả năng sử dụng sinh học, khả năng sử dụng tiềm năng và khả năng môi trường, tạo điều kiện cho việc giao tiếp thống nhất giữa các chuyên gia trong lĩnh vực đánh giá chất lượng đất.
Qua đó, TCVN 13442:2021 không chỉ giúp cải thiện quy trình quản lý đất và các chất ô nhiễm mà còn bảo vệ sức khỏe cộng đồng và môi trường sống tốt hơn. Tiêu chuẩn này đóng vai trò quan trọng trong việc cải thiện chất lượng đất và hỗ trợ hành động bảo vệ môi trường hiệu quả.
Tải tiêu chuẩn Việt Nam TCVN 13442:2021
TIÊU CHUẨN QUỐC GIA
TCVN 13442:2021
ISO 22190:2020
CHẤT LƯỢNG ĐẤT - SỬ DỤNG CÁC DỊCH CHIẾT ĐỂ ĐÁNH GIÁ KHẢ NĂNG SỬ DỤNG SINH HỌC CỦA CÁC NGUYÊN TỐ LƯỢNG VẾT TRONG ĐẤT
Soil quality - Use of extracts for the assessment of bioavailability of trace elements in soils
Lời nói đầu
TCVN 13442:2021 hoàn toàn tương đương với ISO 22190:2020;
TCVN 13442:2021 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC 190 Chất lượng đất biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Như được đề cập trong ISO 17402, các nghiên cứu trong phòng thí nghiệm và thực địa đã chứng minh được các tác động sinh học không liên quan đến tổng nồng độ của chất ô nhiễm trong đất. Thay vào đó, một sinh vật chỉ phản ứng với phần sinh học có sẵn (khả năng sử dụng sinh học) cho sinh vật đó. Trong cách tiếp cận thận trọng để đánh giá mức độ phơi nhiễm trong bối cảnh luật định, giả định rằng tổng nồng độ của các chất ô nhiễm có trong đất hoặc vật liệu giống đất có sẵn mà các sinh vật, kể cả con người hấp thụ vào sẽ bị đánh giá quá cao các rủi ro. Do đó, việc đánh giá rủi ro có thể được tối ưu hóa bằng cách sử dụng cách tiếp cận dựa trên mức phơi nhiễm ước tính đại diện cho nồng độ hữu hiệu của các chất ô nhiễm và trên dữ liệu độc tính nội tại (hiện có).
Trong việc tiêu chuẩn hóa các phương pháp đánh giá khả năng sử dụng sinh học của các nguyên tố lượng vết, sử dụng khung phân loại tiêu chuẩn dưới đây (xem Hình 1). Bắt đầu là ISO 17402, trong đó các phương pháp hóa học và sinh học được phân biệt và đưa ra hướng dẫn lựa chọn các phương pháp có liên quan. Nếu phương pháp hóa học được sử dụng để thiết lập tính sẵn có của môi trường, thì có những khả năng sau:
a) Việc tách chiết được dựa trên trạng thái cân bằng. Đối với cách tiếp cận này, đã có sẵn các tiêu chuẩn hoặc các tiêu chuẩn đang được xây dựng.
b) Phương pháp dựa trên trạng thái không cân bằng. Đối với cách tiếp cận này, các tiêu chuẩn vẫn chưa được xây dựng. Khi các tiêu chuẩn thì các tiêu chuẩn đó sẽ được đưa vào tiêu chuẩn này (nét đứt trong Hình 1).
Tất cả các phương pháp được đề cập trong tiêu chuẩn này đều dựa trên việc tách chiết. Việc tách chiết có thể được coi là mô hình mô phỏng nồng độ nước mao quản. Các phương pháp tách chiết cho kết quả có thể được sử dụng trong đánh giá và tiêu chuẩn này đưa ra hướng dẫn cho việc sử dụng đó.
Phương pháp tiếp cận sinh học ở người (ISO 17924) không được thể hiện trong Hình 1. Đây là phương pháp tách chiết mô phỏng hệ thống đường ruột của người và dành riêng cho việc đánh giá rủi ro đối với con người.
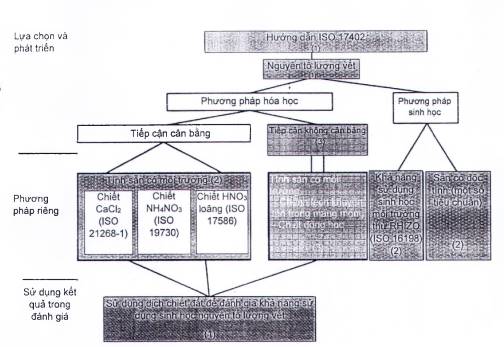
CHÚ DẪN:
(1) Màu đỏ: tiêu chuẩn này
(2) Màu xám: các tiêu chuẩn hiện có
(3) Màu xanh lá cây: chưa có - sẽ được xây dựng
Hình 1 - Sơ đồ phân loại các tiêu chuẩn đánh giá khả năng sử dụng sinh học của các nguyên tố lượng vết (trường hợp tháng 4 năm 2018)
Trong nghiên cứu khoa học về khả năng sử dụng sinh học, một số lượng lớn các định nghĩa và khái niệm đã được sử dụng, phản ánh việc thảo luận. Tuy nhiên, để quản lý, cần có cách tiếp cận rõ ràng và đơn giản hơn. Trong bối cảnh luật định, các chất ô nhiễm có khả năng sử dụng sinh học hoặc không có khả năng sử dụng sinh học. Để hỗ trợ các quyết định, cả hai đều cần phải đo được.
Như được trình bày trong Hình 2, phần khả năng sử dụng sinh học có thể được đo bằng phương pháp quy định trong tiêu chuẩn này.
CHẤT LƯỢNG ĐẤT - SỬ DỤNG CÁC DỊCH CHIẾT ĐỂ ĐÁNH GIÁ KHẢ NĂNG SỬ DỤNG SINH HỌC CỦA CÁC NGUYÊN TỐ LƯỢNG VẾT TRONG ĐẤT
Soil quality - Use of extracts for the assessment of bioavailability of trace elements in soils
1 Phạm vi áp dụng
Tiêu chuẩn này đưa ra hướng dẫn về việc sử dụng các phương pháp hóa học thiết lập khả năng sử dụng sinh học của các nguyên tố lượng vết trong đất và các vật liệu giống đất và để mô phỏng việc sử dụng khả năng sử dụng sinh học trong đánh giá. Các phương pháp hóa học này không phải là đối tượng của tiêu chuẩn này.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 6495 (ISO 11074), Chất lượng đất - Từ vựng
ISO 17402, Soil quality - Requirements and guidance for the selection and application of methods for the assessment of bioavailability of contaminants in soil and soil materials (Chất lượng đất - Yêu cầu và hướng dẫn lựa chọn áp dụng các phương pháp đánh giá khả năng sử dụng sinh học của các chất ô nhiễm trong đất và vật liệu đất)
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau:
3.1
Khả năng sử dụng sinh học (bioavailability)
Mức độ mà các chất hóa học có trong đất có thể được hấp thụ hoặc chuyển hóa bởi con người hoặc các cơ quan cảm ứng sinh thái hoặc có sẵn để tương tác với các hệ thống sinh học.
CHÚ THÍCH 1: Khái niệm khả năng sử dụng sinh học được giải thích thêm trong ISO 17402.
CHÚ THÍCH 2: Tiêu chuẩn này tuân theo cách tiếp cận của Tài liệu tham khảo [20] như được nêu trong Hình 2, trong đó tất cả các phần xác định đều có thể đo được như được giải thích thêm trong Điều 4.
CHÚ THÍCH 3: Trong ISO 17924, định nghĩa cụ thể về sự hấp thụ của con người thông qua việc tiêu hóa được xác định là phần chất có trong đất mà có thể đi vào hệ tuần hoàn (mạch máu).
[NGUỒN: ISO 11074: 2015, 5.2.2, đã được sửa đổi - Đã bổ sung Chú thích 2 và các chú thích sau đó được đánh số lại].
3.2
Khả dụng môi trường (environmental availability)
Phần chất ô nhiễm lý-hóa do các quá trình giải hấp phụ có thể có sẵn cho các sinh vật.
[NGUỒN: ISO 17402: 2008, 3.3]
3.3
Khả dụng sinh học môi trường (environmental bioavailability)
Phần hợp chất có sẵn trong môi trường mà một sinh vật tiếp nhận thông qua các quá trình sinh lý.
[NGUỒN: ISO 17402:2008, 3.5]
3.4
Khả dụng sinh học độc học (toxicological bioavailability)
Nồng độ nội tại của chất ô nhiễm tích tụ và/hoặc liên quan đến hiệu ứng độc hại.
3.5
Khả dụng thực tế (actual availability)
Nồng độ chất có trong nước mao quản của đất mà sinh vật tiếp xúc trực tiếp.
CHÚ THÍCH 1: Định nghĩa này đề cập đến nồng độ nội tại ở người, động vật có vú và các sinh vật khác.
[NGUỒN: ISO 17402: 2008, 3.18]
3.6
Khả dụng tiềm năng (potential availability)
Lượng chất có trong mẫu đất (mg/kg) có thể được giải phóng từ pha rắn vào nước mao quản trong một khung thời gian cụ thể.
3.7
Tiếp cận sinh học (bioaccessibility)
Phần chất trong đất hoặc vật liệu giống đất được giải phóng trong dịch tiêu hóa (của sinh vật) và do đó có sẵn để hấp thụ hoặc lượng chất có sẵn để đi qua màng tế bào của sinh vật từ môi trường nếu sinh vật đó tiếp cận được với hóa chất
CHÚ THÍCH 1: Xem TCVN 5979 (ISO 10390) để biết thêm thông tin về hóa chất.
[NGUỒN: ISO 17924:2018, 3.2, đã được sửa đổi - Định nghĩa đã được sửa đổi bằng cách thêm cụm từ "hoặc số lượng có thể đi qua màng tế bào của sinh vật từ môi trường nếu sinh vật đó tiếp cận được với hóa chất" và đã bổ sung Chú thích 1].
4 Khái quát
4.1 Yêu cầu chung
4.1.1 Sự có mặt các nguyên tố lượng vết trong nền đất
Do tổng các sinh vật tiếp xúc phụ thuộc vào thời gian, khả năng sử dụng không phải là phần cố định, mà cần được chia thành nhiều phần hoặc được coi là chuỗi liên tục. Việc giải phóng các chất ô nhiễm phụ thuộc vào điều kiện môi trường cục bộ (ví dụ: pH). Cách tiếp cận đơn giản nhất xác định:
a) phần khả dụng thực tế hoặc lượng hòa tan thực tế ở điều kiện môi trường xung quanh;
b) phần khả dụng có thể có, là lượng tối đa có thể giải phóng vào nước mao quản của đất trong các trường hợp xấu nhất (được xác định trước). Điều này cũng có thể được biểu thị dưới dạng phần phản ứng;
c) phần không khả dụng
Tất cả các chất thể hiện theo nồng độ tổng số. Đối với môi trường, thường chấp nhận lượng đo được bằng nước cường toan xem TCVN 6649 (ISO 11466) thể hiện nồng độ tổng số của các chất. Trong Hình 2, thể hiện tổng nồng độ chất có thể tách chiết được. Nồng độ tổng số “thực tế” cũng bao gồm lượng chất trong nền mẫu silica. Để đo được lượng này, cần bao gồm việc chiết bằng HF (xem ISO 14869-3).

CHÚ THÍCH: Các ô màu ở bên trái của màng sinh học thể hiện sự phân bổ các phân tử chất ô nhiễm trong bốn lớp (Trong cấu trúc silica, liên kết chặt chẽ, khả dụng tiềm năng có và khả dụng thực tế) trong đất và trầm tích. Trong sơ đồ ở Hình 2, hóa chất khả dụng sinh học được biểu thị bằng các nồng độ khả dụng thực tế tiềm năng Các phương pháp hóa học có thể đo chất ô nhiễm có trong từng phần cụ thể được nêu trong các hộp màu xám. Ô màu xanh lá cây bên phải của màng tế bào thể hiện các quá trình xảy ra trong cơ thể sinh vật tiếp xúc với chất ô nhiễm. Các quá trình sinh học này cũng có thể là cơ sở cho các phương pháp chuẩn được sử dụng để đo khả năng sử dụng sinh học.
Hình 2 - Đo khả năng sử dụng sinh học: khung khái niệm đơn giản (Nguồn: Sửa đổi từ TCVN 6634 (ISO 8245)[1])
Sự chia nhỏ về khả năng sử dụng sinh học hòa tan/thực tế và khả dụng tiềm năng là rất quan trọng, vì nó mở rộng vai trò của nước mao quản. Khả năng sử dụng sinh học không chỉ là lượng trong nước mao quản, mà còn có thể bao gồm lượng chất giải hấp trong thời gian sinh vật tiếp xúc với đất. Đối với các sinh vật, một vùng "chịu ảnh hưởng sinh học" có thể được xác định[3]. Vùng này bao gồm nước mao quản và phụ thuộc vào sinh vật, các bộ phận của nền đất. Do đó, lượng khả dụng có thể có các giá trị khác nhau. Vì vậy, có thể có nhiều khả năng sử dụng sinh học phụ thuộc vào loại sinh vật đích và thang thời gian và do đó, có thể có nhiều cách xác định cụ thể.
Khả năng sử dụng sinh học của các nguyên tố lượng vết đối với một vài sinh vật (hệ thực vật và hệ động vật) được điều chỉnh bởi nồng độ và đặc điểm của các nguyên tố lượng vết trong pha nước và pha rắn của đất (khả dụng môi trường). Theo quan điểm hóa học, nồng độ này có thể được biểu thị (xem ISO 17402) bằng:
a) Nồng độ hòa tan và đặc điểm hóa học của nó ở điều kiện môi trường xung quanh, có thể được đặc trưng theo
1) Ion tự do (hoạt độ);
2) Tổng nồng độ hòa tan, bao gồm các phức chất vô cơ và hữu cơ
b) Lượng liên kết với pha rắn của đất có thể cung cấp lại nồng độ hòa tan khi lượng chất hòa tan bị suy giảm trong quá trình hấp thụ lặp đi lặp lại và liên tục của sinh vật, ví dụ: lượng tối đa có thể được giải phóng trong các điều kiện trường hợp xấu nhất (được xác định trước).
Tiêu chuẩn này đề cập đến các phương pháp tách chiết từ đất, dựa trên cách tiếp cận cân bằng. Do đó, khoảng thời gian của các phương pháp tách chiết khác nhau thường đủ dài để đạt được trạng thái cân bằng giữa các nguyên tố lượng vết trong pha rắn và pha nước của đất. Do đó, các phương pháp này chỉ phù hợp để đánh giá khả năng sử dụng sinh học của môi trường khi có sự cân bằng của đất mà không bị ràng buộc động học (phương pháp tiếp cận không cân bằng).
4.1.2 Các chất tách chiết trung tính để đo tính khả dụng thực tế (ISO 21268-1)
Đối với các mục đích quy định, cần có các phương pháp đơn giản, chi phí thấp và việc tách chiết đơn giản mô phỏng chất lượng nước mao quản là tốt nhất. Có thể sử dụng dung dịch nước trung tính (nghĩa là hạn chế sự thay đổi pH của đất trong quá trình tách chiết càng nhiều càng tốt) cho mục đích này. Nồng độ của nguyên tố lượng vết đo được trong dịch chiết trung tính được giả định là phản ánh nồng độ trong nước mao quản (cũng như nồng độ ion, nhiệt độ, pH, DOC (cacbon hữu cơ hòa tan). Những đặc tính này có thể cho thấy sự thay đổi trong năm và có thể bị ảnh hưởng bởi các yếu tố bên ngoài (ví dụ: mưa, hạn hán, bón phân). Việc chiết mẫu đất bằng nước đã loại khoáng có thể có tác động đến đất. Để ước tính khả dụng thực tế của các nguyên tố lượng vết, tốt nhất là giảm ảnh hưởng của các yếu tố bên ngoài và thu được dữ liệu độc lập ít phụ thuộc vào thời gian lấy mẫu. Các quy trình tách chiết đã được xây dựng sử dụng các dung dịch nước chứa nồng độ cố định của một muối cụ thể (dịch chiết trung tính) để mô phỏng nước mao quản của đất.
Chất chiết tách càng mạnh (cường độ ion cao), thì lượng nguyên tố lượng vết giải phóng khỏi pha rắn của đất càng cao. Mặt khác, nồng độ của DOC chiết được cũng phụ thuộc vào việc chọn chất chiết trung tính, đặc biệt là nồng độ của các cation hóa trị hai (Ca2+) ảnh hưởng đến DOC. Tỷ lệ đất/dịch chiết cũng ảnh hưởng đến nồng độ DOC[4]. Với lượng DOC tách chiết càng cao, thì lượng nguyên tố lượng vết tách chiết dự kiến càng cao, đặc biệt là các nguyên tố lượng vết có ái lực liên kết cao với DOC (ví dụ: Cu, Pb, Cr).
Ban đầu, CaCl2 0,01mol/L đã được sử dụng làm chất chiết trung tính. Đối với một số loại đất, phương pháp này phản ánh nồng độ của nước mao quản. Nồng độ đo được trong CaCl2 0,01mol/L thường cao hơn mức có thể đo được trong nước mao quản và do đó CaCI2 0,01 mol/L có thể làm giảm nồng độ DOC trong nước mao quản thực tế, do đó làm ảnh hưởng đến lượng các nguyên tố lượng vết hòa tan.
Trong tiêu chuẩn này, dịch chiết CaCI2 0,001 mol/L (ISO 21268-1) được chấp nhận là phương pháp chiết đất phù hợp nhất hiện nay, cho phép ước tính nồng độ nguyên tố lượng vết trong pha nước với kết quả gần với nồng độ nước mao quản thực tế. Các kết quả từ cách tách chiết này cũng có thể được sử dụng làm mô hình địa hóa của các loại nguyên tố lượng vết khả năng sử dụng sinh học cụ thể trong các tầng đánh giá rủi ro tiếp theo, như trong 4.2.
Mặc dù dịch chiết CaCI2 0,001 mol/L được sử dụng trong tiêu chuẩn này làm quy trình chung để mô phỏng nồng độ các nguyên tố lượng vết trong nước mao quản, tuy nhiên các dung dịch trung tính khác cũng được chứng minh là phù hợp cho các mục đích cụ thể (xem Phụ lục A).
CHÚ THÍCH: Việc sử dụng nồng độ muối cao amoni nitrat 1 mol/L như trong ISO 19730 và CaCI2 0,01 mol/L cho thấy có sự đánh giá cao hơn về đến độ tái lập và độ lặp lại (xem đánh giá xác nhận trong ISO 19730). Tuy nhiên, các kết quả có độ tin cậy thấp hơn do nồng độ muối cao không mô phỏng được thành phần nước mao quản.
4.1.3 Dịch chiết bằng axit để đo tính khả dụng tiềm năng (ISO 17586)
Có thể sử dụng các axit mạnh như HNO3 để ước tính phần khả dụng tiềm năng. Rõ ràng là việc tách chiết bằng axit có ảnh hưởng rất lớn đến thành phần của dung dịch. Dung dịch thu được không còn liên quan đến nước mao quản nữa. Axit mạnh là một dung môi mạnh và sẽ bị hấp thụ lên CEC, cũng như các nguyên tố lượng vết trong các muối hòa tan trong axit, là lượng có thể trở thành khả dụng tiềm năng. Ở pH 0,5, phần khả dụng tiềm năng được ước tính và pH này giống như với HNO3 0,43 mol/L. Các nguyên tố lượng vết không khả dụng tiềm năng trong nền đất không được tách chiết ở pH 0,5. Các nguyên tố này chỉ tách chiết được bằng phương pháp cho tổng nồng độ giống như nước cường toan. Sự khác biệt giữa nước cường toan và tách chiết bằng axit là các nguyên tố lượng vết không khả dụng và do đó nước cường toan không thích hợp để ước tính các nguyên tố lượng vết có sẵn.
4.2 Phương pháp tiếp cận phân tầng dựa trên khả năng sử dụng sinh học
Hệ thống phân tầng trong thử nghiệm (cách tiếp cận phân tầng) được đề xuất, trong đó các phép thử và tính toán thực tế và phức tạp hơn từng bước được sử dụng để xác định tính khả dụng của môi trường trong khuôn khổ đánh giá tác động, ở các tầng cao hơn, cần có thêm thông tin cụ thể về địa điểm. Cách tiếp cận theo tầng sau đây được khuyến cáo khi khả năng sử dụng sinh học của các nguyên tố lượng vết được đưa vào đánh giá về đất và địa điểm. Theo cách tiếp cận này, các kết quả từ tầng trước đó luôn có thể được sử dụng trong các tầng sau:
a) Tầng thứ nhất: Đo tính khả dụng môi trường tiềm năng bằng cách sử dụng HNO3 0,43 mol/L, (ISO 17586). Ở tầng thứ nhất này cũng đo các tính chất cơ bản của đất như cấp hạt sét, chất hữu cơ và pH, giúp cho việc dự đoán về tính khả dụng môi trường thực tế ở giai đoạn đầu tiên này
CHÚ THÍCH 1: Thông thường, cần đến một lượng (giới hạn) các phép đo tổng nồng độ (nước cường toan) để kiểm tra sự tuân thủ với các giá trị giới hạn quy định. Các dữ liệu này không thích hợp để đánh giá khả năng sử dụng sinh học và do đó, cần hoàn thiện các phép đo tính khả dụng tiềm năng.
b) Tầng thứ hai: Đo tính khả dụng môi trường thực tế bằng cách sử dụng CaCl2 0,001 mol/L (ISO 21268-1) và nếu cần, áp dụng phép thử sinh học chung. Nếu các rủi ro được quy định rõ hơn, có thể ưu tiên sử dụng NH4NO3 1 mol/L (xem ISO 19730) để dự đoán sự hấp thụ của thực vật, các phép thử ngâm chiết để dự đoán tính di động hoặc sử dụng các phép thử sinh học cụ thể như ISO 16198 về sự hấp thụ của thực vật. Mô hình là một phần của tầng này và có thể yêu cầu các phép đo cụ thể. Quy trình ngâm chiết hạn như bộ ISO 12782 và bộ ISO 21268 có thể được đưa vào đánh giá.
CHÚ THÍCH 2: Quy trình EPA LEAF[11] của Hoa Kỳ sử dụng các quy trình ngâm chiết và cách tiếp cận tầng đất tương tự.
c) Tầng thứ ba: Đo địa điểm cụ thể và lập mô hình cụ thể cho địa điểm. Phép đo khả năng sử dụng sinh học của con người có thể là một phần của tầng này.
CHÚ THÍCH 3: Không có sự phân tách rõ ràng giữa tầng thứ hai và tầng thứ ba. Tùy thuộc vào các rủi ro, mà phương pháp có thể là một phần của tầng thứ hai hoặc tằng thứ ba.
Trong cách tiếp cận này, khái niệm khả năng sử dụng sinh học đã được sử dụng ở tầng thứ nhất. Có thể lập mô hình trong giai đoạn sớm hơn. Tuy nhiên, đánh giá rủi ro yêu cầu các giá trị giới hạn đối với các phần khả dụng tiềm năng hoặc có thể tiếp cận được. Khi thực hiện được điều này, thì giá trị giới hạn đối với phần khả dụng thực tế sẽ nhỏ.
5 Quy trình chung sử dụng phần chất chiết
Các phương pháp được đề cập trong tiêu chuẩn này phù hợp với các loại đất tiếp xúc với không khí. Các phương pháp này không áp dụng cho các vật liệu khử mạnh như trầm tích.
CHÚ THÍCH 1: Nếu các phương pháp được áp dụng cho đất và trầm tích khử hoặc đất kỵ khí, thì quy trình này có ảnh hưởng đến thành phần, ví dụ như do oxy hóa sunfua, do đó thường làm tăng nồng độ cần đo.
Các bước sau được tiêu chuẩn hóa:
- Xử lý sơ bộ: Áp dụng các quy trình tách chiết đối với đất chưa được xử lý (xem TCVN 8884 (ISO 14507)). Trong quá trình xử lý sơ bộ, được phép loại bỏ các hạt không mang tính đại diện. Phần mẫu thử được chuẩn bị phải có cỡ hạt nhỏ hơn hoặc bằng 2 mm. Không được nghiền mịn vật liệu thử. Nếu mẫu phòng thử nghiệm không thể nghiền hoặc sàng vì ẩm ướt, thì chỉ được giảm hàm lượng nước cho đến khi mẫu phòng thử nghiệm có thể sàng được. Nhiệt độ làm khô không được vượt quá nhiệt độ môi trường hoặc quá 30 °C. Nhiệt độ làm khô cao hơn sẽ làm tăng DOC và do đó một số nguyên tố lượng vết bị hòa tan [4].
- Quy trình tách chiết: Một lượng đất cụ thể và chất chiết được lắc trộn trong một khoảng thời gian cố định.
- Đo: Nồng độ các nguyên tố trong dung dịch chiết được xác định bằng các phương pháp phân tích thích hợp.Vì các chất ô nhiễm thường có mặt ở nồng độ thấp, nên cần sử dụng các mẫu trắng.
Điều kiện tiên quyết quan trọng trong ISO 17402 là phương pháp cần có cơ sở. Tương tác hóa học là cơ chế quan trọng ảnh hưởng đến nồng độ trong pha nước. Do đó, chỉ đo nguyên tố lượng vết liên quan là không đủ. Các thông số sau cũng rất quan trọng:
- Đất:
- pH (xem TCVN 5979 (ISO 10390));
- cấp hạt sét (xem ISO 11277);
- chất hữu cơ (xem TCVN 6642 (ISO 10694) và TCVN 12248-4 (ISO 12782-4));
- Oxit Fe/AI (xem ISO 12782-1, ISO 12782-2 và ISO 12782-3).
- Tách chiết bằng CaCI2:
- pH (xem TCVN 5979 ISO 10390);
- chất hữu cơ hòa tan (xem TCVN 6634 (ISO 8245), ISO 12782-5);
- thành phần của các thông số vĩ mô (xem các tiêu chuẩn ISO cụ thể);
- cường độ ion;
CHÚ THÍCH 2: Trong hầu hết các trường hợp, muối trong dịch chiết lòng xác định cường độ ion. Đất mặn có thể ảnh hưởng đến thành phần ion và cường độ ion.
- tất cả các hợp chất khác có thể tạo phức với các nguyên tố lượng vết và được biết là có trong mẫu đất.
Các thông số của đất pH, cấp hạt sét và chất hữu cơ đã được đo ở tầng thứ nhất. Đặc điểm kỹ thuật của chất hữu cơ và các oxit Fe-/AI- là phần của tầng thứ hai. Các thông số trong dịch chiết CaCl2 chỉ có thể được đo nếu dịch chiết có sẵn và do đó là phần của tầng thứ hai.
Khi có các thông số này, thì có thể dự đoán tính khả dụng thực tế từ tính khả dụng tiềm năng khi sử dụng các hàm số chuyển đổi (xem Phụ lục B) hoặc mô hình địa hóa. Việc áp dụng và sử dụng các thông số khác nhau trong mô hình địa hóa được nêu trong Tài liệu tham khảo [13] và ISO 17402.
Kết quả của các phương pháp này cũng hữu ích cho việc có được các tiêu chuẩn chất lượng của đất và các hướng dẫn bảo vệ đất[16].
6 Báo cáo
Kết quả có thể được báo cáo dưới dạng nồng độ đo được (mg/L) hoặc dựa trên khối lượng đất ban đầu (mg/kg).
Đối với các dịch chiết trung tính, tổng lượng tách chiết được phụ thuộc vào tỷ lệ đất/dịch chiết. Do đó, kết quả của các dịch chiết trung tính phải được báo cáo dưới dạng nồng độ đo được trong chất chiết (mg/L).
Dịch chiết bằng axit mạnh hơn và tách chiết được lượng khả dụng tiềm năng. Do đó, kết quả của dịch chiết bằng axit phải dựa trên khối lượng của mẫu đất ban đầu (mg/kg).
Các công thức cần thiết để tính toán được đưa ra trong các tiêu chuẩn cụ thể.
7 Hiệu chuẩn
7.1 Giới thiệu
Việc tách chiết hóa học mô tả trong tiêu chuẩn này được sử dụng để thiết lập khả năng sử dụng sinh học của các nguyên tố lượng vết. Khả năng sử dụng sinh học thực sự được đặc trưng bởi sự hấp thu các nguyên tố lượng vết phản ánh trong quá trình tích lũy sinh học hoặc hiệu ứng độc hại. Để sử dụng cho các nguyên tố lượng vết cụ thể và các sinh vật cụ thể, thì mối tương quan giữa khả năng sử dụng sinh học cần được đo sử dụng dịch chiết bằng hóa học và tác động lên sinh vật cụ thể phải được thể hiện (hiệu chuẩn).
7.2 Khả năng ứng dụng của các dịch chiết từ đất
Các mẫu hiệu chuẩn sử dụng HNO3 0,43 mol/L, NH4NO3 1 mol/L và CaCI2 được nêu trong Phụ lục A. Tiêu chuẩn này khuyến nghị sử dụng CaCI2 0,001 mol/L (ISO 21268-1) để đo khả năng sử dụng sinh học thực tế và tách chiết bằng HNO3 0,43 mol/L (ISO 17586) để đo khả năng sử dụng sinh học tiềm năng. Việc sử dụng CaCI2 0,001 mol/L và tách chiết bằng axit phù hợp với khung lý thuyết như được mô tả trong tiêu chuẩn này. Có thể sử dụng NH4NO31 mol/L (xem ISO 19730) để đo tính khả dụng môi trường thực tế để dự đoán sự hấp thụ các nguyên tố lượng vết của thực vật.
Số lượng các cuộc khảo sát sử dụng CaCI2 0,001 mol/L (không phải là 0,01mol/L) vẫn còn hạn chế. Các nhà nghiên cứu được khuyến khích sử dụng phương pháp nêu trong tài liệu, cung cấp kết quả hiệu chuẩn và cải thiện khả năng áp dụng của phương pháp.
CHÚ THÍCH: Kết quả hiệu chuẩn đối với CaCI2 0,01 mol/L, được nêu trong Phụ lục A.
7.3 Hạn chế của việc sử dụng dịch chiết đất để ước khả năng sử dụng sinh học của nguyên tố lượng vết
Mặc dù tách chiết từ đất là phương pháp đơn giản và ít tốn kém để ước khả năng sử dụng sinh học của nguyên tố lượng vết, nhưng các phương pháp này không thể tích hợp tất cả các quá trình liên quan đến việc kiểm soát khả năng sử dụng sinh học của nguyên tố lượng vết đối với sinh vật đất.
Giải thích tiềm năng về sự khác biệt trong dự đoán khả năng sử dụng sinh học của các nguyên tố lượng vết từ các dịch chiết từ đất có thể là:
a) Khả năng sử dụng sinh học của nguyên tố lượng vết từ các quá trình không cân bằng (tức là sự ràng buộc động học) trong đất và yêu cầu sử dụng phương pháp tiếp cận không cân bằng để ước khả năng sử dụng sinh học của nguyên tố lượng vết (ví dụ: Tài liệu tham khảo [17]);
b) Như được mô tả trong ISO 17402, khả năng sử dụng sinh học có thể bị thay đổi bởi các sinh vật đất trong vùng ảnh hưởng sinh học (nghĩa là vùng rễ (rhizosphere) thực vật hoặc vùng đào bới của giun đất (drilosphere)), dẫn đến khả năng sử dụng sinh học của nguyên tố lượng vết thực tế khác biệt đáng kể so với ước tính của các dịch chiết từ đất được thực hiện trên đất rời (tức là không bị ảnh hưởng sinh học). Đối với khả năng sử dụng sinh học của con người (khả năng tiếp cận sinh học) dịch chiết được sử dụng để mô phỏng hệ đường ruột;
c) Khả năng sử dụng sinh học của các nguyên tố lượng vết đối với sinh vật có thể rất khác nhau giữa các loài hoặc thậm chí các loài phụ hoặc giống cây trồng đối với loại đất bị ô nhiễm nhất định (xem Tài liệu tham khảo [20] và [21]), mà một dịch chiết từ đất đơn lẻ không thể đại diện cho tất cả.
Do đó, các dịch chiết từ đất không thể tương quan với sự hấp thụ nguyên tố lượng vết của các sinh vật trong đất trong một loạt các nghiên cứu. Các tình huống cho các kết quả đo của các dịch chiết đất không phải là dự báo đúng về khả năng sử dụng sinh học của nguyên tố lượng vết mô tả về sự tích lũy trong thực vật (xem Tài liệu tham khảo [19], [22] và [23] và tích lũy trong các sinh vật của đất (xem Tài liệu tham khảo [24] , [25] và [26]).Trong những trường hợp này, cần sử dụng các phương pháp sinh học để đánh giá trực tiếp hơn về khả năng sử dụng sinh học của nguyên tố lượng vết.
Phụ lục A
(tham khảo)
Hiệu chuẩn đối với các mục tiêu sinh học
Việc tách chiết hóa học được mô tả trong tiêu chuẩn này được sử dụng để thiết lập khả năng sử dụng sinh học của các nguyên tố lượng vết. Khả năng sử dụng sinh học thực sự được đặc trưng bởi sự hấp thụ các nguyên tố lượng vết phản ánh trong quá trình tích lũy sinh học hoặc hiệu ứng độc hại. Để sử dụng cho các nguyên tố lượng vết cụ thể và các sinh vật cụ thể, thì mối tương quan giữa khả năng sử dụng sinh học cần được đo bằng dịch chiết hóa học và tác động lên sinh vật cụ thể phải được thể hiện (hiệu chuẩn).
Trong quá trình chiết với muối trung tính, thành phần của dung dịch chiết phải phản ánh thành phần của nước mao quản. Trong tình huống lý tưởng, cường độ ion, thành phần ion và hàm lượng và thành phần chất hữu cơ phải giống nhau. Điều này không thực tế đối với một phương pháp tiêu chuẩn để ước tính tính khả dụng của môi trường thực tế. Cần chọn một thành phần cố định để sử dụng cho tất cả các loại đất.
Như đã đề cập ở trên, CaCI2 0,01 mol/L đã được sử dụng và phương pháp này có thể dự đoán nồng độ trong pha nước (xem Tài liệu tham khảo [6], [7], [8] và [27]). Điều này đúng nếu nước mao quản ban đầu có cường độ ion cao hơn. Trong thực tế, nồng độ đo được trong CaCI2 0,01mol/L thường quá cao, vì thành phần nước mưa là điểm khởi đầu.
Việc chọn nồng độ cố định có nghĩa là nồng độ này có thể sẽ quá cao hoặc quá thấp đối với hầu hết các loại đất. Nồng độ được chọn quá cao thì muối trong dung dịch chiết cho sự trao đổi với các nguyên tố lượng vết trên phức trao đổi cation, tạo ra nồng độ nguyên tố lượng vết quá cao hoặc sẽ làm giảm hàm lượng chất hữu cơ, do đó làm giảm nồng độ các nguyên tố lượng vết tạo phức bởi chất hữu cơ (ví dụ Cu). Nồng độ được chọn quá thấp sẽ ảnh hưởng đến sự trao đổi cation nhỏ hơn và cũng làm giảm chất hữu cơ hòa tan.Trong các loại đất giàu canxi, sự hòa tan canxi cacbonat và/hoặc canxi sulfat sẽ bù cho nồng độ thấp.
Do đó, việc chọn phương pháp chuẩn về nồng độ thấp hơn tốt hơn là nồng độ cao. Mặc dù điều này ảnh hưởng đến nồng độ kim loại lượng vết, kết quả hiệu chuẩn bằng NH4NO3 1 mol/L, CaCI20,01mol/L, có thể được tìm trong tài liệu nêu ở Bảng A.1. Để đánh giá các loại đất giống nhau, có thể sử dụng các hiệu chuẩn này.
Bảng A.1 - Kết quả hiệu chuẩn dịch chiết NH4NO3I mol/L, CaCI20,001 mol/L, CaCI2 0,01 mol/L và HNO3 0,43 mol/L
| Dung dịch chiết | Các thành phần* | Đối tượng sinh học | Điểm cuối được xem xét để hiệu chuẩn | Lưu ý | Tài liệu tham khảo |
| NH4NO3 | Zn | Củ cải (Raphanus sativus L.) | Khả năng sử dụng sinh học môi trường Hấp thụ |
| [28] |
| NH4NO3 | Cd, TI, Zn, Ni | Cải xoăn (TI, Zn), lúa mì (tất cả), cà rốt (Zn, TI), rau (Cd, Ni, TI), lá củ cải đường (Zn) và rau diếp (Cd, TI, Zn) | Khả năng sử dụng sinh học môi trường Hấp thụ |
| [29] |
| HNO3 | Cd, Zn, Cu | Cỏ, ngô, khoai tây, lúa mì | Khả năng sử dụng sinh học môi trường Hấp thụ | Đáng tin cậy nhất cho Cd và Zn. Bao gồm pH và CEC | [21] |
| HNO3 | Cd, Cu Pb và Zn | Tiếp xúc với con người | Phương pháp SBET khả năng tiếp cận sinh học của con người |
| [30] |
| HNO3 | Ag | Tiếp xúc với con người | Phương pháp SBET khả năng tiếp cận sinh học của con người |
| [31] |
| HNO3 | Cd | Gạo | Khả dụng sinh học môi trường Cây lúa hấp thụ | Bao gồm các tính chất của đất | [32] |
| HNO3 và CaCI2 0,01 mol/L | Cd và Zn | Thlaspi caerulescens | Khả dụng sinh học môi trường Hấp thụ |
| [33] |
| HNO3 và CaCI2 0,01 mol/L | Cd, Zn, Pb, Cu, Hg, As, Co, Ba, B, Cr, Mo, Ni, Sb, U | Nông nghiệp | Khả dụng sinh học môi trường Hấp thụ | Không liên quan đến B, Cr, Mo, Ni, Sb, U | [34] |
| HNO3 và CaCI2 0,01 mol/L | As, Cd, Ba, Cr, Cu, Ni, Pb, Zn | Nông nghiệp | Khả dụng sinh học môi trường Hấp thụ |
| [35] |
| CaCI2 0,001 mol/L | Zn | Ức chế sự phát triển của chồi đại mạch | Độc tố |
| [63] |
| CaCI2 0,01 mol/L | Cu | Nấm men | Khả dụng sinh học môi trường Hấp thụ | Bao gồm pH | [36] |
| CaCI2 0,01 mol/L | Ni | Avena sativa | Khả dụng sinh học độc học Sự nẩy chồi |
| [37] |
| CaCl2 0,01 mol/L | Cd | 12 kiểu gen trên ruộng lúa nước | Khả dụng sinh học độc học Tích lũy sinh học ở rễ và hạt | Các mẫu đất được lấy trên các cánh đồng đã rút nước trước khi thu hoạch | [32] |
| CaCl2 0,01 mol/L | Zn | Côn trùng đuôi bật | Khả dụng sinh học độc học |
| [38] |
| CaCl2 0,01 mol/L | Cd, Pb | Ốc sên | Khả dụng sinh học độc học Nồng độ trong gan tụy | Bao gồm pH và vật liệu hữu cơ. 0 ngày đến 28 ngày phơi nhiễm với đất thêm chuẩn | [39] |
| CaCl2 0,01 mol/L | Cd | Giun đất | Khả dụng sinh học môi trường Hấp thụ | Đệm ở pH 7,2 | [40] |
| CaCl2 0,01 mol/L | Cd, Cu và ở mức độ nhỏ hơn As, Pb | Giun đất (Eisenia Andrei) | Khả dụng sinh học độc học Tích lũy sinh học | 3 tuần phơi nhiễm, trạng thái cân bằng giữa đất và nồng độ cơ thể giả định | [24] |
| CaCl2 0,01 mol/L | As, Cd, Pb | Giun đất (Eisenia Andrei) | Khả dụng sinh học độc học Tích lũy sinh học (nồng độ bên ngoài trong giun đất ở trạng thái tiềm sinh) | 0 ngày đến 63 ngày | [25] |
| CaCl2 0,01 mol/L | Cd, Pb | Oligochaeta (Enchytraeus crypticus) | Khả dụng sinh học động học Tích lũy sinh học | 0 ngày đến 35 ngày phơi nhiễm | [26] |
| CaCl2 0,01 mol/L | Zn | Isopod (Oniscus asellus) | Khả dụng sinh học độc học Tổng nồng độ cơ thể | 1 ngày đến 14 ngày | [41] |
Phụ lục B
(tham khảo)
Ví dụ về các hàm số chuyển đổi
Hàm chuyển:
![]()
Trong đó:
csolution là nồng độ khả dụng thực tế trong pha nước;
Qsoil là nồng độ chất có thể chiết được bằng HNO3 0,43 mol/L;
INT là điểm chặn của hồi quy tuyến tính đa biến;
[SOM] hàm lượng chất hữu cơ dạng rắn, %;
[clay] hàm lượng cấp hạt sét, %;
[DOC] cacbon hữu cơ hòa tan, miligam trên lít (mg/l);
a, b, c là các hệ số thu được bằng hồi quy tuyến tính đa biến;
n là số hạng phi tuyến tính.
Đối với các hàm số chuyển đổi các nguyên tố lượng vết sau đây có sẵn[42]. Các hàm số chuyển đổi được hiệu chuẩn dùng cho đất ở Hà Lan, nhưng ứng dụng đáng tin cậy cũng được thực hiện ở Đài Loan.
Bảng B.1 - Các giá trị chặn thu được bằng hồi quy tuyến tính đa biến (INT), a, b, c, d và n trong các hàm số chuyển đổi
| Nguyên tố lượng vết | INT | a [SOM] | b [cấp hạt sét] | c [pH] | d [DOC] | n | R2 |
| Cd | -4,75 | 0,61 | 0,26 | 0,29 | -0,05 | 0,54 | 0,80 |
| Cu | -2,61 | 0,60 | 0,12 | 0,23 | -0,27 | 0,59 | 0,65 |
| Pb | -2,38 | 0,95 | 0,22 | 0,07 | -0,23 | 0,73 | 0,59 |
| Zn | -4,23 | 0,47 | 0,43 | 0,37 | -0,14 | 0,75 | 0,82 |
Sử dụng các hàm tương đương có thể tạo ra mối tương quan trực tiếp với tác động, như sự hấp thụ các nguyên tố lượng vết của thảm thực vật, do đó việc dự đoán khả năng sử dụng sinh học của môi trường được nêu trong Điều 7.
Thư mục tài liệu tham khảo
[1] TCVN 6634 (ISO 8245), Chất lượng nước - Hướng dẫn xác định cacbon hữu cơ tổng số (TOC) và cacbon hữu cơ hoà tan (DOC)
[2] TCVN 5979 (ISO 10390), Chất lượng đất - Xác định pH
[3] TCVN 6642 (ISO 10694), Chất lượng đất - Xác định hàm lượng cacbon hữu cơ và cacbon tổng số sau khi đốt khô (phân tích nguyên tố)
[4] TCVN 6862 (ISO 11277), Chất lượng đất - Xác định thành phần cấp hạt trong đất khoáng - Phương pháp rây và sa lắng
[5] TCVN 6649 (ISO 11466), Chất lượng đất - Chiết các nguyên tố vết tan trong nước cường thủy
[6] TCVN 12248-1 (ISO 12782-1), Chất lượng đất - Các thông số từ quá trình chiết dùng để lập mô hình địa hóa các thành phần và sự tồn tại của các quá trình trong đất và vật liệu. Phần 1: Chiết oxit và hydroxit sắt vô định hình bằng axit ascorbic
[7] TCVN 12248-2 (ISO 12782-2), Chất lượng đất - Các thông số từ quá trình chiết dùng để lập mô hình địa hóa các thành phần và sự tồn tại của các quá trình trong đất và vật liệu. Phần 2: Chiết oxit và hydroxit sắt tinh thể bằng dithionit
[8] TCVN 12248-3 (ISO 12782-3), Chất lượng đất - Các thông số từ quá trình chiết dùng để lập mô hình địa hóa các thành phần và sự tồn tại của các quá trình trong đất và vật liệu. Phần 3: Chiết oxit và hydroxit nhôm bằng amoni oxalat/axit oxalic
[9] TCVN 12248-4 (ISO 12782-4), Chất lượng đất - Các thông số từ quá trình chiết dùng để lập mô hình địa hóa các thành phần và sự tồn tại của các quá trình trong đất và vật liệu. Phần 4: Chiết các chất mùn từ mẫu thể rắn
[10] TCVN 12248-5 (ISO 12782-5), Chất lượng đất - Các thông số từ quá trình chiết dùng để lập mô hình địa hóa các thành phần và sự tồn tại của các quá trình trong đất và vật liệu. Phần 5: Chiết các chất mùn từ mẫu nước
[11] TCVN 8884 (ISO 14507), Chất lượng đất - Xử lý sơ bộ mẫu để xác định chất ô nhiễm hữu cơ
[12] ISO 14869-3, Soil quality — Dissolution for the determination of total element content — Part 3: Dissolution with hydrofluoric, hydrochloric and nitric acids using pressurised microwave technique
[13] ISO 16198, Soil quality — Plant-based test to assess the environmental bioavailability of trace elements to plants
[14] ISO 17586, Soil quality — Extraction of trace elements using dilute nitric acid
[15] ISO 17924, Soil quality — Assessment of human exposure from ingestion of soil and soil material — Procedure for the estimation of the human bioaccessibility/bioavailability of metals in soil
[16] ISO 19648, Soil quality — Parameters for geochemical modelling of the leaching and speciation of constituents in soils and materials — Guidance for the application of ISO 12782. (under development)
[17] ISO 19730, Soil quality — Extraction of trace elements from soil using ammonium nitrate solution
[18] ISO 21268-1, Soil quality — Leaching procedures for subsequent chemical and ecotoxicological testing of soil and soil-like materials — Part 1: Batch test using a liquid to solid ratio of 2 l/kg dry matter
[19] ISO/TS 21268-2, Soil quality — Leaching procedures for subsequent chemical and ecotoxicological testing of soil and soil materials — Part 2: Batch test using a liquid to solid ratio of 10 l/kg dry matter
[20] ISO/TS 21268-3, Soil quality — Leaching procedures for subsequent chemical and ecotoxicological testing of soil and soil materials — Part 3: Up-flow percolation test
[21] ISO/TS 21268-4, Soil quality — Leaching procedures for subsequent chemical and ecotoxicological testing of soil and soil materials — Part 4: Influence of pH on leaching with initial acid/base addition
[22] Ortega-Calvo J.J., Harmsen J., Parsons J.R., Semple K.T., Aitken M.D., Ajao C., Eadsforth C., Galay-Burgos M., Naidu R., Oliver R., Peijnenburg W.J.G.M., Rombke J., streck G., Versonnen B., From Bioavailability Science to Regulation of Organic Chemicals. Environ. Sci. Technol. 2015, 49, pp. 10255-10264, 2015
[23] Semple K.T., Doick K.J., Jones K.C., Craven A., Burauel P., Harms H., Defining bioavailability and bioaccessibility of contaminated soil and sediment is complicated. Environmental Science and Technology 38, pp. 228A-231A, 2004
[24] Alexander M., Chaney R., Cunningham S.J., Harmsen J., Hughes J.B., Chemical Measures of bioavailability. In Lanno R., (Ed), Contaminated soils: from soil-chemical interaction to ecosystem management. SETAC-publication, pp. 345-362, 2003
[25] Koopmans G.F., Groenenberg J.E., Effects of soil oven-drying on concentrations and speciation of trace metals and dissolved organic matter in soil solution extracts of sandy soils. Geoderma, 161, pp. 147-158, 2011
[26] Weng L., Temminghoff E.J.M., Lofts S., Tipping E., van Riemsdijk W.H., Complexation with dissolved organic matter and solubility control of heavy metals in a sandy soil. Environ. Sci. Technol., 36, pp. 4804-4810, 2002
[27] Janssen R.P.T., Peijnenburg W. J.G.M., Posthuma L., Van den Hoop M.A.G.T., Equilibrium partitioning of heavy metals in Dutch field soils. I Relationship between metal partition coefficients and soil characteristics. Environmental Toxicology and Chemistry 16, pp. 2470-2478, 1997b
[28] Degryse F., Broos K., Smolders E. et al., Soil solution concentration of Cd and Zn can be predicted with a CaCI2 soil extract European Journal of Soil Science 54, pp. 149-157, 2003
[29] Schröder TJ, Hiemstra T., Vink JPM, Van der Zee S.E.A.T.M., Modeling of the solid-solution partitioning of heavy metals and arsenic in embanked flood plain soils of the rivers Rhine and Meuse Environmental Science & Technology 39, pp. 7176-7184, 2005
[30] Temminghoff E.J.M., Van der Zee S.E.A.T.M., De Haan F.A., Effects of dissolved organic matter on the mobility of copper in a contaminated sandy soil. European Journal of Soil Science, 49, pp. 617-628, 1998
[31] Kördel W., Bernardt C., Derz K., Hund-Rinke K., Harmsen J., Peijenburg W., Comans R., Terrytze K., Incorporating availability/bioavailability in risk assessment and decision making of polluted sites, using Germany as an example. J. Hazard. Mater.261, pp. 854-862, 2013
[32] A.C., D.S. Kosson, H.A. van der Sloot, F. Sanchez and O. Hjelmar, 2010. Background Information for the Leaching Environmental Assessment Framework (LEAF) Test Methods” Garrabrants EPA/600/R-10/170, U.S. EPA Office of Research and Development — Air Pollution Control Division, December 2010
[33] Rodrigues S.M., Henriques B., da Silva E.F., Pereira M.E., Duarte A.C., Groenenberg J.E., Römkens P.F.A.M., Evaluation of an approach for the characterization of reactive and available pools of 20 potentially toxic elements in soils: Part II - Solid-solution partition relationships and ion activity in soil solutions (2010) Chemosphere, 81 (11), pp. 1560-1570
[34] Groenenberg J.E., Dijkstra J.J., Bonten L.T.C., de Vries w., Comans R.N.J., Evaluation of the Performance and Limitations of Empirical Partition-Relations and Process Based Multisurface Models to Predict Trace Element Solubility in Soils. Environmental Pollution 166, pp. 98-107, 2012
[35] Groenenberg J.E., Römkens P.F.A.M., Zomeren A.V., Rodrigues S.M., Comans R.N.J., Evaluation of the Single Dilute (0.43 M) Nitric Acid Extraction to Determine Geochemically Reactive Elements in Soil (2017) Environmental Science and Technology, 51 (4), pp. 2246-2253
[36] Römkens P.F.A.M., Brus D.J., Guo H.Y., Chu C.L., Chiang C.M., Koopmans G.F., Impact of model uncertainty on soil quality standards for cadmium in rice paddy fields (2011) Science of the Total Environment, 409 (17), pp. 3098-3105
[37] Rodrigues S.M., Pereira M.E., Duarte A.C., Römkens P.F.A.M., Soil-plant-animal transfer models to improve soil protection guidelines: A case study from Portugal (2012) Environment International, 39 (1), pp. 27-37
[38] Tian Y., Wang X., Luo J., Yu H., Zhang H., Evaluation of holistic approaches to predicting the concentrations of metals in field-cultivated rice. Environ. Sci. Technol., 42, pp. 7649-7654,. 2008
[39] Bravin M.N., Michaud A.M., Larabi B., Hinsinger p., RHIZO test: a plant-based biotest to account for rhizosphere processes when assessing copper bioavailability. Environ. Pollut. 158, pp. 3330-3337.
[40] Pinel F., Leclerc-Cessac E., Staunton S., Relative contributions of soil chemistry, plant physiology and rhizosphere induced changes in speciation on Ni accumulation in plant shoots. Plant Soil, 255, pp. 619-629, 2003
[41] Römkens P.F.A.M., Guo H.Y., Chu C.L., Liu T.S., Chiang C.F., Koopmans G.F., Prediction of cadmium uptake by brown rice and derivation of soil-plant transfer models to improve soil protection guidelines. Environ. Pollut.157, pp. 2435-2444, 2008
[42] Menzies M.W., Donn M.J., Kopittke P.M., Evaluation of extractant for estimation of the phytoavailable trace metals in soils. Environ. Pollut., 145, pp. 121-130, 2007
[43] Tipping E., Rieuwerts J., Pan G., Ashmore M.R., Lofts S., Hill M.T.R., Farago M.E., Thornton I., The solid-solution partitioning of heavy metals (Cu, Zn, Cd, Pb) in upland soils of England and Wales. Environ. Pollut., 125, pp. 213-225, 2003
[44] Janssen R.P.T., Posthuma L., Baerselman R., Den Flollander H.A., Van Veen R.P.M., Peijnenburg W.J.G.M., Equilibrium partitioning of heavy metals in dutch field soils. II. Prediction of metal accumulation in earthworms. Environ. Toxicol. Chem., 16, pp. 2479-2488, 1997a
[45] Peijnenburg W.J.G.M., Baerselman R., de Groot A.C., JagerT., Posthuma L., Van Veen R.P.M., Relating environmental availability to bioavailability: soil - type - dependent metal accumulation in the oligochaete Eisenia andrei. Ecotoxicol. Environ. Saf., 44, pp. 294-310, 1999a
[46] Peijnenburg W.J.G.M., Posthuma L., Zweers P.G.P.C., Baerselman R., de Groot A.C., Van Veen R.P.M., Jager T., Prediction of metal bioavailability in Dutch field soils for the oligochaete Enchytraeus crypticus. Ecotoxicol. Environ. Saf., 43, pp. 170-186, 1999b
[47] Gooddy D.C., Shand P., Kinniburgh D.G., Field-based partition-coefficients for trace-elements in soil solutions. European Journal of Soil Science 46, pp. 265-285, 1995
[48] Davies B.E., Inter-relationships between soil properties and the uptake of cadmium, copper lead and zinc from contaminated soil by radish (Raphanus sativus L.). Water, Air, and Soil Pollution 63, pp. 331-342, 1992
[49] Gryschko R., Kuhnle R., Terytze K., Breuer J., stahr K., Soil Extraction of Readily Soluble Fleavy Metals and As with 1 M NH4NO3-Solution Evaluation of DIN 19730. J Soils & Sediments 5 (2), pp. 101- 106, 2005
[50] Rodrigues S.M., Cruz N., Coelho C., Henriques B., Carvalho L., Duarte A.C., Pereira E., Römkens P.F., Risk assessment for Cd, Cu, Pb and Zn in urban soils: chemical availability as the central concept. Environmental pollution (Barking, Essex : 1987), 183, pp. 234-242, 2013
[51] Cruz N., Rodrigues S.M., Tavares D., Monteiro R.J.R., Carvalho L., Trindade T., Duarte A.C., Pereira E., Römkens P.F.A.M., Testing single extraction methods and in vitro tests to assess the geochemical reactivity and human bioaccessibility of silver in urban soils amended with silver nanoparticles. Chemosphere, 135, pp. 304-311, 2015
[52] Römkens P.F.A.M., Koopmans G.F., Guo H.Y., Chu C.L., Liu T.S., Chiang C.F., Prediction of Cadmium uptake by brown rice and derivation of soil-plant transfer models to improve soil protection guidelines. Environ. Pol. 157, pp. 2435-2444, 2009
[53] Koopmans G.F., Römkens P.F.A.M., Fokkema M.J., Song J., Luo Y.M., Japenga J., Zhao F.J., Feasibility of phytoextraction to remediate cadmium and zinc contaminated soils. Environmental Pollution 156, pp. 905-914, 2008
[54] Rodrigues S.M., Pereira E., Duarte A.C., Römkens P.F.A.M., Derivation of soil to plant transfer functions for metals and metalloids: Impact of contaminant's availability. Plant and Soil, 361 (1-2), pp.329-341, 2012
[55] Cruz N., Rodrigues S.M., Coelho C., Carvalho L., Duarte A.C., Pereira E., Römkens P.F.A.M., Urban agriculture in Portugal: Availability of potentially toxic elements for plant uptake. Applied Geochemistry, 44, pp. 27-37, 2014
[56] Van der Zee S.E.A.T.M., Temminghoff E.J.M., Marinussen M.P.J.C., Competition effects for copper between soil, soil solution and yeast in bioassay for Folsomia Candida Willem. Environ. Toxicol. Chem. 23, pp. 1743-1750, 2004
[57] Semezin E., Temminghoff E.J.M., Marcomini A., Improving ecological risk assessment by including bioavailability into species sensitivity distributions: An example for plants exposed to nickel in soil. Environ. Pollut. (2007), doi:10.1016/j.envpol.2006.11.019
[58] Smit C.E., van Beelen P., van Gestel C.A.M., Development of zinc bioavailability and toxicity for the springtail Folsomia Candida in an experimentally contaminated field plot. Environ. Pollut.98, pp. 73-80, 1997
[59] Gimbert F., Pauget B., Coeurdassier M., Scheifler R., Badot P.M., de Vaufleury A., From environmental availability to bioavailability: soil-type dependent metal toxicokinetics in snail. SETAC Europe 18th Annual Meeting: World under stress: scientific and applied issues in environmental toxicology and chemistry. 25-29 may, Warsaw, Poland, pp. 77-78, 2008
[60] Osté L.A., Dolfing J., Ma W.M., Lexmond T.L., Cadmium uptake by earthworms as related to the availability in the soil and the intestine. Environ. Toxicol. Chem. 20, pp. 1785-1791, 2001
[61] Koster M., Reijnders L., van Oost N.R., Peijnenburg W.J.G.M., Comparison of the method of diffusive gels in thin films with conventional extraction techniques for evaluating zinc accumulation in plants and isopods. Env.Poll.133, pp. 103-116. 2005
[62] Römkens P.F.A.M., Groenenberg J.E., Bonten L.T.C., de Vries W., Bril J., Derivation of partition relationships to calculate Cd, Cu, Ni, Pb and Zn solubility and activity in soil solution samples. Alterra report 305, Alterra, Wageningen, the Netherlands, 2004
[63] Hamels F., Malevé J., Sonnet P., Kleja D.B., Smolders E., Phytotoxicity of trace metals in spiked and field-contaminated soils: linking soil-extractable metals with toxicity. Environmental Toxicology and Chemistry 33, pp. 2479-2487, 2014.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 13442:2021 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 13442:2021 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 13442:2021 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 13442:2021 DOC (Bản Word)