- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 6831-2:2010 Xác định ảnh hưởng mẫu nước đến Vibrio fischeri
| Số hiệu: | TCVN 6831-2:2010 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Tài nguyên-Môi trường |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2010 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 6831-2:2010
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 6831-2:2010
TIÊU CHUẨN QUỐC GIA
TCVN 6831-2:2010
ISO 11348-2:2007
CHẤT LƯỢNG NƯỚC - XÁC ĐỊNH ẢNH HƯỞNG ỨC CHẾ CỦA MẪU NƯỚC ĐẾN SỰ PHÁT QUANG CỦA VI KHUẨN VIBRIO FISCHERI (PHÉP THỬ VI KHUẨN PHÁT QUANG) - PHẦN 2: PHƯƠNG PHÁP SỬ DỤNG VI KHUẨN KHÔ-LỎNG
Water quality - Determination of the inhibitory effect of water samples on the light emission of Vibrio fischeri (Luminescent bacteria test)- Part 2 : Method using liquid-dried bacteria
Lời nói đầu
TCVN 6831-2:2010 thay thế TCVN 6831-2:2001 (ISO 11348-2:1998).
TCVN 6831-2:2010 hoàn toàn tương đương ISO 11348-2:2007.
TCVN 6831-2:2010 do Ban kỹ thuật Tiêu chuẩn quốc gia TCVN/TC 146 Chất lượng nước biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
Bộ tiêu chuẩn TCVN 6831 Chất lượng nước - Xác định ảnh hưởng ức chế của mẫu nước đến sự phát quang của vi khuẩn Vibrio fischeri (phép thử vi khuẩn phát quang) gồm các tiêu chuẩn sau:
- TCVN 6831-1:2010 (ISO 11348-1:2007), Phần 1: Phương pháp sử dụng vi khuẩn mới nuôi cấy;
- TCVN 6831-2:2010 (ISO 11348-2:2007), Phần 2: Phương pháp sử dụng vi khuẩn khô lỏng;
- TCVN 6831-3:2010 (ISO 11348-3:2007), Phần 3: Phương pháp sử dụng vi khuẩn đông khô.
Lời giới thiệu
Phép đo quy định trong bộ TCVN 6831 (ISO 11348) có thể tiến hành sử dụng vi khuẩn mới nuôi cấy, cũng như vi khuẩn đông khô hoặc khô lỏng.
Công việc tiêu chuẩn hóa do DIN Normenausschuss Wasserwesen và ISO/TC 147/SC 5/WG 1 tiến hành đã cho thấy, trong trường hợp đặc biệt, các kỹ thuật khác nhau này có thể cho kết quả khác nhau, đặc biệt khi có mặt kim loại nặng.
Độ nhạy thay đổi là do sự khác nhau trong thành phần môi trường sử dụng để chuẩn bị vi khuẩn đông khô hoặc khô lỏng. Các môi trường bảo vệ này ảnh hưởng đến tính có sẵn sinh học của các chất độc và/hoặc sự phát quang của vi khuẩn phát quang. Điều này có nghĩa là nguồn gốc và phương pháp chuẩn bị vi khuẩn cần được xem xét khi biểu thị kết quả. Đôi khi, việc này có thể khó khăn, vì vi khuẩn đông khô và khô lỏng có thể do các nhà cung cấp khác nhau. Do vậy, việc này có nghĩa là thành phần chi tiết không được biết và do vậy người sử dụng không thể diễn giải được.
Vì lý do này, ngoài phép đo độc tính dùng vi khuẩn mới nuôi cấy TCVN 6831-1 (ISO 11348-1) và vi khuẩn đông khô TCVN 6831-3 (ISO 11348-3), quy trình dùng vi khuẩn khô lỏng được mô tả trong tiêu chuẩn này, tính năng thực hiện của quy trình có thể do người sử dụng diễn giải trong từng chi tiết.
Phòng thí nghiệm chịu trách nhiệm về kết quả có cơ hội để lựa chọn kỹ thuật phù hợp nhất dựa trên các lời khuyên của chuyên gia và thông tin về mẫu nước thử nghiệm.
CHẤT LƯỢNG NƯỚC - XÁC ĐỊNH ẢNH HƯỞNG ỨC CHẾ CỦA MẪU NƯỚC ĐẾN SỰ PHÁT QUANG CỦA VI KHUẨN VIBRIO FISCHERI (PHÉP THỬ VI KHUẨN PHÁT QUANG) - PHẦN 2: PHƯƠNG PHÁP SỬ DỤNG VI KHUẨN KHÔ-LỎNG
Water quality - Determination of the inhibitory effect of water samples on the light emission of Vibrio fischeri (Luminescent bacteria test)- Part 2: Method using liquid-dried bacteria
CẢNH BÁO - Người sử dụng tiêu chuẩn này cần phải thành thạo với các thực hành trong phòng thí nghiệm thông thường. Tiêu chuẩn này không đề cập tới mọi vấn đề an toàn liên quan đến người sử dụng. Trách nhiệm của người sử dụng là phải xác lập độ an toàn, bảo đảm sức khỏe phù hợp với các quy định của quốc gia.
QUAN TRỌNG - Điều chủ yếu là phép thử theo tiêu chuẩn này cần được tiến hành bởi những nhân viên được đào tạo phù hợp.
1. Phạm vi áp dụng
TCVN 6831:2010 (ISO 11348:2007) quy định ba phương pháp xác định sự ức chế phát quang của vi khuẩn biển Vibrio fischeri (NRRL B-11177). TCVN 6831-2:2010 (ISO 11348-2) quy định phương pháp sử dụng vi khuẩn khô-lỏng.
Tiêu chuẩn này áp dụng cho:
- Nước thải;
- Dịch chiết và dịch ngâm chiết bằng nước;
- Nước sạch (nước mặt và nước ngầm);
- Nước mặn và nước lợ;
- Dịch rửa giải của trầm tích (nước ngọt, nước lợ và nước biển);
- Nước giếng khoan;
- Các chất ô nhiễm đơn, được pha loãng trong nước.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 7325 (ISO 5814), Chất lượng nước - Xác định oxy hòa tan - Phương pháp đầu đo điện hóa.
ISO 5667-16, Water quality - Sampling - Part 16: Guidance on biotesting of samples (Chất lượng nước - Hướng dẫn thử sinh học các mẫu).
3. Nguyên tắc
Sự ức chế phát quang do cấy vi khuẩn Vibrio fischeri được xác định bằng cách thử nghiệm theo từng mẻ. Điều đó được thực hiện bằng việc kết hợp các thể tích quy định của mẫu thử hoặc mẫu thử đã pha loãng với huyền phù vi khuẩn phát quang đựng trong ống thử.
Chuẩn cứ của phép thử là sự giảm độ phát quang mẫu thử trong suốt thời gian tiếp xúc, cường độ phát quang trong mẫu sẽ được đo sau thời gian phản ứng là 15 min và 30 min hoặc có thể đo thêm sau 5 min, tùy chọn, có tính đến hệ số hiệu chính (¦kt). Ảnh hưởng ức chế của mẫu nước có thể được xác định bằng LID (xem Phụ lục B) hoặc là các giá trị-EC20 và/hoặc giá trị-EC20 thông qua các dãy pha loãng (EC là nồng độ ảnh hưởng).
4. Các chất gây nhiễu
Các chất không tan, ít tan hoặc dễ bay hơi hoặc các chất có phản ứng với nước pha loãng hoặc với huyền phù, hoặc làm thay đổi trạng thái của chúng trong quá trình thử, có thể ảnh hưởng đến kết quả hoặc làm giảm độ tái lập của kết quả thử.
Trong trường hợp nước quá đục hoặc đậm màu, có thể xảy ra sự mất phát quang do việc hấp thụ ánh sáng hoặc tán xạ ánh sáng gây ra. Sự gây nhiễu này đôi khi có thể khắc phục được bằng cách xử lý độ đục của mẫu (7.2) hoặc, ví dụ, bằng cách sử dụng cuvet hiệu chính hấp thụ hai ngăn (xem Phụ lục A).
Vì sự phát quang sinh học[6] cần đến oxy, nên các mẫu có nhu cầu oxy cao (và/hoặc có nồng độ oxy thấp) có thể sẽ gây ra sự thiếu hụt oxy và mẫu sẽ bị ức chế.
Các chất dinh dưỡng dễ phân hủy sinh học trong mẫu có thể làm giảm sự tự ô nhiễm trong việc phát quang sinh học[1].
Mẫu có pH nằm ngoài khoảng từ 6,0 đến 8,5 sẽ ảnh hưởng đến sự phát quang của vi khuẩn[6], [7]. Cần phải điều chỉnh pH của mẫu nếu ảnh hưởng độc của pH là không mong muốn.
Vì vi khuẩn thử nghiệm Vibrio fishcheri là vi khuẩn biển, nên việc thử nghiệm các mẫu nước mặn theo quy trình chuẩn thường dẫn đến các hiệu ứng kích thích phát quang sinh học mà có thể che hiệu ứng ức chế (xem Phụ lục D).
Nồng độ muối trong mẫu ban đầu vượt quá 30 g/l NaCI, hoặc hàm lượng các thành phần khác có độ thẩm thấu tương đương, cùng với lượng muối cần phải thêm vào khi thử có thể gây ra các hiệu ứng siêu thẩm thấu. Để tránh ảnh hưởng này, nồng độ muối cuối cùng có trong mẫu thử sẽ không được vượt quá độ thẩm thấu của dung dịch NaCI là 35 g/l.
5. Thuốc thử và các vật liệu
Sử dụng các hóa chất đạt chất lượng tinh khiết phân tích. Dùng nước cất hoặc nước có độ tinh khiết tương đương.
5.1. Vi khuẩn thử
Sử dụng chủng vi khuẩn phát quang thuộc loại Vibrio fischeri NRRL B- 11177. Huyền phù vi khuẩn được dùng cho các phép đo độc tính được chuẩn bị từ các thuốc thử khô-lỏng có sẵn ngoài thị trường. Bảo quản vi khuẩn khô-lỏng ở nhiệt độ ≤ -18 °C và xem xét các khuyến nghị của nhà cung cấp. Vi khuẩn bắt đầu phát triển ngay sau khi khôi phục và sẵn sàng để sử dụng cho phép thử.
5.2. Dung dịch natri clorua, làm chất pha loãng
Hoà tan 20 g natri clorua (NaCI) trong nước và thêm nước đến 1 lít.
5.3. Dung dịch natri hydroxit, ví dụ c(NaOH) = ví dụ 1 mol/l
5.4. Axit clohydric, ví dụ c(HCI) = ví dụ 1 mol/l.
Để điều chỉnh pH có thể cần sử dụng các axit hoặc các bazơ nồng độ thấp hơn hoặc cao hơn.
5.5. Dung dịch dùng cho vi khuẩn khô-lỏng
8,0 g D(+)- Glucoza ngậm nước (C6H12O6.H2O)
20,0 g Natri clorua (NaCI)
2,035 g Magie clorua ngậm sáu nước (MgCI2.6H2O)
0,30 g Kali clorua (KCI)
11,9 g N- (2- Hydroxyetyl) piperazin-N- (2- axit etanesunfonic) (HEPES)
Hòa tan các thành phần trên trong nước, khuấy đều trong 30 min và điều chỉnh pH đến 7,0 ± 0,2 bằng dung dịch natri hydroxit (5.3) hoặc bằng axit clohydric (5.4). Thêm nước đến 1 lít
Dung dịch này có thể bảo quản từng phần và ở nhiệt độ -18 °C tới - 20 °C.
5.6. Chất chuẩn
Chuẩn bị riêng rẽ các dung dịch chuẩn gốc, pha loãng bằng dung dịch natri clorua (5.2) mà không cần điều chỉnh pH:
219,8 mg/l Kẽm sunfat ngậm bảy nước (ZnSO4.7H2O)
9 mg/l 3,5-dichlorophenol (C6H4OCl2) (Độ tinh khiết ≥ 99 %)
22,6 mg/l Kali dicromat (K2Cr2O7)
Các nồng độ này xấp xỉ gấp hai lần giá trị EC50 mong đợi đối với các chất chuẩn tương ứng trong tiêu chuẩn này. Thể tích yêu cầu phụ thuộc vào yêu cầu thử nghiệm.
CHÚ THÍCH Có thể sử dụng các dung dịch có sẵn ngoài thị trường có nồng độ ZnSO4 và K2Cr2O7(titrisol) xác định để chuẩn bị dung dịch gốc của các chất chuẩn.
6. Thiết bị, dụng cụ
6.1. Tủ lạnh sâu, để bảo quản các vi khuẩn cần bảo quản.
6.2. Hộp kiểm soát nhiệt độ, để duy trì mẫu thử ở nhiệt độ 15 °C ± 1 °C. Trong mỗi lần thử nghiệm nhiệt độ chỉ được dao động tối đa ± 0,3 °C.
6.3. Máy đo độ phát quang, ngăn đo đo được duy trì ở nhiệt độ 15 °C ± 1 °C, có trang bị các cuvet phù hợp.
6.4. Cuvet thử, làm bằng chất liệu trơ về hóa học, thích hợp để sử dụng với ngăn đo độ phát quang đã chọn và có dung tích tạo thuận lợi để đọc hết bề mặt lớn nhất có thể và phù hợp với hộp kiểm soát nhiệt độ(6.2)
6.6. Đồng hồ tính giờ.
6.7. Pipet pittông hoặc bơm tiêm nhựa, 100 ml, 500 ml và 1 000 ml.
6.8. Pipet pittông, có dung tích có thể thay đổi, từ 10 ml đến 200 ml và 200 ml đến 5 000 ml.
6.9. Bể điều nhiệt, có khả năng duy trì nhiệt độ ở 20 °C ± 2 °C.
6.10. Nồi cách thủy hoặc hộp ổn định nhiệt, để duy trì dung dịch có thể tích 12 ml được chuẩn bị trong 5.5 (ví dụ bình thuốc thử) ít nhất ở nhiệt độ 15 °C ± 1 °C
6.11. Máy đo độ dẫn.
6.12. Đầu đo oxy, Theo TCVN 7325 (ISO 5814).
7. Lấy mẫu và xử lý sơ bộ mẫu
7.1. Lấy mẫu
Mẫu phải được đựng trong các vật chứa sạch, trơ về hóa học như quy định trong ISO 5667-16. Nạp đầy mẫu vào vật chứa và gắn kín. Thử nghiệm mẫu càng sớm càng tốt ngay sau khi lấy mẫu. Nếu cần, bảo quản mẫu ở nhiệt độ từ 2 °C đến 5 °C trong vật chứa ở nơi tối không quá 48 h. Nếu phải bảo quản mẫu đến hai tháng thì để mẫu ở nhiệt độ ≤ -18 °C. Không được sử dụng hóa chất để bảo quản mẫu. Cần chỉnh-pH và thêm muối trước khi thử.
7.2. Chuẩn bị mẫu
Đo nồng độ oxy trong tất cả các mẫu. Nồng độ oxy cần phải > 3 mg/l đối với thử nghiệm này. Nếu nồng độ oxy của mẫu chưa pha loãng nhỏ hơn 3 mg/l, thì phải sử dụng phương pháp làm đủ oxy cho mẫu, ví dụ sục khí hoặc khuấy.
Đo pH của tất cả các mẫu. Nếu pH nằm trong khoảng 6,0 đến 8,5 thì không cần phải điều chỉnh. Tuy nhiên, việc chỉnh giá trị-pH có thể làm biến đổi bản chất của mẫu. Mặt khác, pH của mẫu và pH của mẻ thử có thể khác nhau do khả năng đệm của môi trường thử. Có thể cần phải thực hiện thử nghiệm trên cả hai mẫu: mẫu đã điều chỉnh pH và mẫu chưa điều chỉnh-pH.
Nếu cần, điều chỉnh-pH của mẫu bằng cách thêm axit clohydric (5.4) hoặc dung dịch natri hydroxit (5.3). Tùy thuộc vào mục đích của phép thử có thể điều chỉnh pH đến 7,0 ± 0,2 hoặc giới hạn trên (8,5 ± 0,2) và giới hạn dưới (6,0 ± 0,2). Lựa chọn nồng độ của axit clohydric hoặc dung dịch natri hydroxit sao cho thể tích thêm vào không lớn hơn 5 % tổng thể tích.
Cho thêm 20 g natri clorua trên lít vào mẫu nước hoặc vào mẫu nước đã trung hòa.
Đối với mẫu có nồng độ muối cao thì đo độ muối và nếu cần thêm lượng muối để điều chỉnh độ thẩm thấu tới NaCI 20 g/l.
Nếu mẫu chứa từ 20 g/l đến 50 g/l NaCI tương đương, không cần thêm muối. Nồng độ muối tạo nên trong mẫu thử không được vượt quá độ thẩm thấu 35 g/l dung dịch natri clorua
Phụ lục D cung cấp thêm các thông tin đối với những mẫu nước mặn
Các mẫu quá đục cần đục để lắng trong 1 h hoặc cho ly tâm, ví dụ trong 10 min ở 5000 g hoặc lọc. Sử dụng chất nổi hoặc cái lọc cho phép thử.
8. Cách tiến hành
Chuẩn bị các mẫu chuẩn theo 5.6. Thử mỗi mẻ vi khuẩn sau khi tiến hành với cả ba mẫu chuẩn. Thử ít nhất một trong ba mẫu chuẩn song song với mỗi cuvet dung dịch huyền phù gốc đã hoàn nguyên cho mỗi phép thử.
Chuẩn bị mẫu theo 7.2.
Làm tan bằng vi khuẩn khô-lỏng (huyền phù gốc) trong bể điều nhiệt ở nhiệt độ 20 °C ± 2 °C. Các huyền phù gốc đã làm lạnh có thể chỉ sử dụng cho thử nghiệm ban đầu.
Chuẩn bị huyền phù thử từ huyền phù gốc theo hai bước:
- Thêm 0,5ml dung dịch (5.5) (cho từng 100 ml huyền phù gốc vào cuvet thử), duy trì ở nhiệt độ 15 °C ± 1 °C và làm đồng nhất bằng cách lắc nhẹ cuvet thử.
- Chờ khoảng 15 min.
Dùng pipet hút dung dịch huyền phù này rồi cho vào bình định mức (dung tích khoảng 20 ml) và thêm 11,5 ml dung dịch (5.5), duy trì ở nhiệt độ 15 °C ± 1 °C, và làm đồng nhất bằng cách lắc nhẹ bình thuốc thử.
Chờ khoảng 15 min.
Chuẩn bị vào một bộ cuvet thử đầu tiên (6.4) dãy dung dịch pha loãng mẫu, mẫu chuẩn (5.6) và mẫu kiểm tra (5.2) yêu cầu.
Quy trình thông thường để chuẩn bị dãy pha loãng được mô tả trong Phụ lục B. Tùy thuộc vào mục đích của thử nghiệm và các yêu cầu thống kê liên quan đến kết quả phép thử, các thiết kế dãy pha loãng có nồng độ dãy hình học hoặc logarit có thể cũng phù hợp. Vì hỗn hợp các thể tích bằng nhau của mẫu/mẫu đã pha loãng và huyền phù thử nghiệm, nên nồng độ mẫu cao nhất trong phép thử chiếm 50% mẫu thử như là một quy luật. Đối với phép thử mẫu nước gần như không pha loãng (80 % mẫu), thì cần thêm mẻ kiểm tra (xem B.2 và Bảng 1).
Duy trì các cuvet thử có chứa dung dịch natri clorua (5.2) để kiểm soát, mẫu chuẩn (5.6), mẫu (7.2) và các mẫu của dãy pha loãng (Bảng B.1) ở 15 °C ± 1 °C.
Chọn điều kiện thử nghiệm đảm bảo độ lệch nhiệt độ tối đa trong bể điều nhiệt trong một phép thử là không quá ± 0,3 °C.
Đối với các phép thử có thể tích huyền phù cần thử và mẫu thử bằng nhau, dùng pipet hút vào ống đo thứ hai, tương ứng với cuvet thử (6.4) 500 ml huyền phù cần thử, duy trì ở nhiệt độ 15 °C ± 1 °C trong tủ ấm, trong các khoảng thời gian bằng nhau (từ 5 s đến 20 s) như đối với các phép đo cường độ sau này.
Tiến hành phép xác định song song đối với mỗi mức pha loãng ở nhiệt độ thử 15 °C ± 1 °C.
Điều chỉnh dụng cụ đo huỳnh quang sao cho thuận tiện và gần với mức cực đại.
Xác định và ghi cường độ phát quang, I0, của các huyền phù thử bằng máy đo phát quang.
Vì thời gian tiếp xúc đối với tất cả các mẫu phải bằng nhau, nên sử dụng đồng hồ tính giờ (6.6) để đo cường độ phát quang ở các khoảng thời gian đo bằng nhau. Khoảng thời gian đo thích hợp là 5 s đến 20 s.
Đo tất cả các huyền phù thử, bởi vì độ phát quang có thể khác nhau do huyền phù thử không được đồng nhất.
Ngay sau khi đo độ phát quang của huyền phù thử ban đầu, làm đầy huyền phù thử này tới 1 ml bằng mẫu (7.2), mẫu đã pha loãng (Phụ lục B), mẫu chuẩn (5.6) hoặc dung dịch natri clorua (5.2), nếu thích hợp. Việc này được thực hiện bằng cách dùng pipet lấy 500 ml mỗi dung dịch mẫu (7.2), mẫu đã pha loãng (Phụ lục B), mẫu chuẩn (5.6) hoặc dung dịch natri clorua (5.2), đã được chuẩn bị trong dãy cuvet thử thứ nhất, cho vào huyền phù thử cần thử trong mỗi cuvet thử của dãy ống đo thứ hai tương ứng. Trộn đều bằng tay, bắt đầu bấm giờ và đặt các ống nghiệm trở lại hộp ổn nhiệt tại nhiệt độ 15 °C ± 1 °C.
Lặp lại với tất cả các cuvet thử khác, để cùng khoảng thời gian giữa những lần thêm vào.
Đo và ghi cường độ phát quang trong tất cả các cuvet, kể cả mẫu kiểm soát, cứ sau 15min và sau 30min (I15, I30), có thể đo sau 5 min (I5), tùy chọn, để khoảng thời gian đo từ 5 s đến 20 s.
Ghi lại sự điều chỉnh dụng cụ.
9. Đánh giá
9.1. Ảnh hưởng ức chế lên vi khuẩn phát quang
Sử dụng Công thức (1) để tính hệ số hiệu chính (giá trị ¦kt) từ cường độ phát quang đo được. Hệ số này dùng để hiệu chính giá trị ban đầu I0 của tất cả các mẫu thử trước khi chúng được dùng làm giá trị chuẩn để xác định độ giảm phát quang do nước.
¦kt = Ikt / I0 (t = 5 min, 15 min, 30 min) (1)
Trong đó
¦kt là hệ số hiệu chính đối với thời gian tiếp xúc 5 min, 15 min, 30 min;
Ikt là cường độ phát quang trong mẫu kiểm tra sau thời gian tiếp xúc 5 min, 15 min hoặc 30 min, tính bằng đơn vị phát quang tương ứng;
I0 là cường độ phát quang của huyền phù thử kiểm tra ngay trước khi cho thêm chất pha loãng (5.2), tính bằng đơn vị phát quang tương ứng;
Tính hệ số hiệu chính trung bình ![]() và độ lệch của các giá trị riêng từ giá trị trung bình tính bằng phần trăm, (lấy một chữ số có nghĩa):
và độ lệch của các giá trị riêng từ giá trị trung bình tính bằng phần trăm, (lấy một chữ số có nghĩa):
![]() (2)
(2)
Trong đó:
¦kti là giá trị riêng của một trong hai hệ số hiệu chính và ![]() là giá trị trung bình.
là giá trị trung bình.
Dùng Công thức (3) để tính Ict:
Ict = I0 x ![]() (3)
(3)
Trong đó
![]() là giá trị trung bình của ¦kti ;
là giá trị trung bình của ¦kti ;
I0 là cường độ phát quang của huyền phù mẫu thử, ngay trước khi thêm vào mẫu (7.2) hoặc mẫu đã pha loãng (Phụ lục B), tính bằng đơn vị phát quang tương ứng;
Ict là giá trị đã hiệu chính của I0 đối với các cuvet đựng mẫu thử ngay trước khi cho mẫu thử vào.
Dùng công thức (4) để tính ảnh hưởng ức chế của mẫu thử:
Ht = [(Ict - It) / Ict x 100] (4)
Trong đó
Ht là ảnh hưởng ức chế của mẫu thử sau thời gian tiếp xúc 5 min, 15 min hoặc 30 min, tính bằng phần trăm;
Ict xem Công thức (3);
It là cường độ phát quang của mẫu thử sau thời gian tiếp xúc 5 min, 15 min hoặc 30 min, tính bằng đơn vị phát quang tương ứng.
Tính giá trị trung bình của ảnh hưởng ức chế Ht cho mỗi mức pha loãng, tính bằng phần trăm.
Tính chênh lệch số học của phép xác định song song của Hti từ trung bình tương ứng ![]() , tính bằng điểm phần trăm (một chữ số có nghĩa):
, tính bằng điểm phần trăm (một chữ số có nghĩa):
![]() (%) - Hti (%)
(%) - Hti (%)
Trong đó:
Hti là một trong hai giá trị hiệu ứng ức chế của mẫu thử ![]() là giá trị trung bình.
là giá trị trung bình.
9.2. Xác định các giá trị-EC
Tính toán mối tương quan ảnh hưởng của nồng độ đối với từng thời gian tiếp xúc sử dụng tuyến tính chuẩn thích hợp hoặc phân tích hồi qui phi tuyến tính[8].
Để đánh giá ảnh hưởng của nồng độ sử dụng kỹ thuật hồi quy tuyến tính, ước lượng giá trị gamma cho từng mức pha loãng (tỷ lệ của độ giảm phát quang với tổng lượng ánh sáng còn lại tại thời điểm t) sử dụng Công thức (5):
Gt = [![]() / (100 -
/ (100 - ![]() )] (5)
)] (5)
Trong đó
Gt là giá trị gamma của mẫu thử sau thời gian tiếp xúc 5 min, 15 min hoặc 30 min;
![]() là giá trị trung bình của Ht xem Công thức (4).
là giá trị trung bình của Ht xem Công thức (4).
CHÚ THÍCH Khi một nồng độ thử nhất định cho 0 % hoặc 100 % độ ức chế phát quang sinh học, thì không thể tính được giá trị gamma. Do đó, chỉ có những giá trị Ht nằm trong khoảng 10 % và 90 % được dùng để tính tương quan của nồng độ
Mối tương quan về ảnh hưởng nồng độ tại thời điểm tiếp xúc đã cho thường có thể được mô tả bằng phương trình tuyến tính sau:
lg ct = b LG Gt + lg a (6)
Trong đó
ct là phần mẫu nước có trong mẫu thử, tính bằng phần trăm;
Gt xem Công thức (5);
b là giá trị của độ dốc của đường tuyến tính;
lg a là giá trị của phần bị chắn/giao cắt của đường tuyến tính.
Bằng phương pháp thống kê hồi qui bình phương tối thiểu chuẩn, tính các giá trị EC20 và EC50 với các giới hạn tin cậy tương ứng, trong đó:
ct = EC20,t ở Gt = 0,25;
ct = EC50,t ở Gt = 1,00.
Đối với phân tích hồi qui phi tuyến tính, các mô hình khác nhau có sẵn trong phần mềm đồ họa chuẩn hoặc phần mềm thống kê. Các phần mềm này được dựa trên hàm phân bố chuẩn (nghĩa là phân tích Probit), phân bố logistic (nghĩa là phân tích Logit), hoặc phân bố Weibull (nghĩa là phân tích Weibull). Ảnh hưởng ức chế đã tính (Ht) có thể được dùng trực tiếp để ước lượng thông số ảnh hưởng nồng độ phi tuyến tính, từ đó, giá trị EC đối với từng mức có thể tính được tiếp sau [8].
Nếu khoảng của cặp giá trị không khớp với đường cong, thì các giá trị EC có thể được ước lượng theo hình học sử dụng hệ thống tọa độ logarit kép.
10. Biểu thị kết quả
Báo cáo kết quả theo mẫu trong Bảng 1.
Báo cáo khoảng thời gian thử (5 min, 15 min hoặc 30 min).
Nếu xác định được, báo cáo giá trị LIDlb, (xem trong Phụ lục B).
Nếu xác định được, báo cáo giá trị EC20 và EC50 và phương pháp để tính độ lệch của các giá trị này.
Báo cáo cách chuẩn bị vi khuẩn đã sử dụng.
Bảng 1 - Ví dụ về đánh giá thử nghiệm - Mẫu: nước thải sau xử lý của trạm xử lý nước thải
| Thí nghiệm đối chứng | |||||||||||||
| Số mẻ kiểm tra | Mức pha loãng D | Giá trị đo được | Ik30 / I0 |
| Thí nghiệm tính đúng đắn Độ lệch từ giá trị trung bình | ||||||||
| I0 | Ik30 | ||||||||||||
| 1 2 | 1a | 93 91 | 76 74 | 0,8172 0,8132 | 0,8152 | ± 0,3 | |||||||
| 3 4 | ≥ 2 | 92 95 | 79 80 | 0,8587 0,8421 | 0,8504 | ± 1,0 | |||||||
| Thí nghiệm thử | |||||||||||||
| Số mẻ thử | Mức pha loãng D | Giá trị đo được | I c 30 | H 30 % |
% | Thí nghiệm tính đúng đắn. Độ lệch so với giá trị trung bình, tính bằng % c | G 30 | ||||||
| I0 | Ik30 | ||||||||||||
| 1 2 | 1 | 92 93 | 25 27 | 75,0 75,8 | 66,7 64,4 | 65,53 | ± 1,1 | 1,901 | |||||
| 3 4 | 2 | 86 90 | 43 43 | 73,1 76,5 | 41,2 43,8 | 42,51 | ± 1,3 | 0,740 | |||||
| 5 6 | 3 | 91 89 | 60 58 | 77,4 75,7 | 22,5 23,4 | 22,92 | ± 0,5 | 0,297 | |||||
| 7 8 | 4 | 95 94 | 72 70 | 80,8 79,9 | 12,4 10,9 | 11,65 | ± 0,8 | 0,132 | |||||
|
| Chất chuẩn |
|
|
|
|
|
|
| |||||
| 9 | 3,4 mg/l DCP, hoặc 2,2 mg/l Zn, hoặc 18,7 mg/l Cr | 91 | 32 | 77,4 | 58,7 | 57,85 | ± 0,9 | 1,372 | |||||
| 10 |
| 93 | 34 | 79,1 | 57,0 |
|
|
| |||||
| a Xem Phụ lục B. b Đối với mẻ kiểm tra, độ lệch so với giá trị trung bình c Đối với mẻ thử, độ lệch của giá trị H 30 (tính bằng phần trăm) của các lần xác định song song so với giá trị trung bình của chúng được tính như chênh lệch số học của từng giá trị H 30 (tính bằng phần trăm) so với giá trị trung bình Giá trị LID trong ví dụ này LIDlb = 4 Giá trị-EC20 trong ví dụ này = 31,9 %, Giá trị-EC50 = 58,8 % (thống kê bình phương tối thiểu chuẩn). | |||||||||||||
11. Chuẩn cứ về tính đúng đắn của phép thử
Phép thử được coi là đúng nếu
- Giá trị ![]() khi ủ trong 15 min hoặc 30 min nằm trong phạm vi từ 0,6 đến 1,3;
khi ủ trong 15 min hoặc 30 min nằm trong phạm vi từ 0,6 đến 1,3;
- Kết quả của các phép xác định song song không chênh lệch so với giá trị trung bình của chúng quá 3 % đối với các mẫu kiểm tra;
- Đối với các mẫu thử mà xác định giá trị-LIDlb hoặc giá trị EC20/EC50 tương ứng, độ lệch so với giá trị trung bình của chúng “điểm phần trăm” không quá 3 % (xem Chú thích c trong Bảng 1).
- Đối với mẻ vi khuẩn đã làm tan, cả ba chất chuẩn (5.6) (các dung dịch không được trung hòa, kiểm tra riêng rẽ) gây ức chế từ 20 % đến 80 % sau thời gian tiếp xúc 30 min ở các nồng độ sau trong huyền phù thử cuối cùng:
4,5 mg/l 3,5-diclorophenol
25 mg/l Zn(ll) (tương đương 109,9 mg/l kẽm sunfat ngậm bẩy nước)
4 mg/l Cr(VI) (tương đương 11,3 mg/l kali dicromat)
- Một trong ba mẫu chuẩn (5.6) (các dung dịch không được trung hòa), được thử trong phép thử song song từng ống thử dung dịch huyền phù gốc đã rã đông cho phép thử thực sự (xem Điều 8) gây ra ức chế 20 % đến 80 % sau thời tiếp xúc 30 min.
12. Độ chính xác
Trong chương trình thử nghiệm liên phòng cấp quốc gia có 22 phòng thí nghiệm tham gia, được tiến hành trong suốt mùa thu năm 1991 đã xác định các số liệu về độ chính xác. Các kết quả được tóm tắt trong Phụ lục C.
13. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải viện dẫn tiêu chuẩn này TCVN 6831-2:2010 (ISO 11348-2). Tài liệu cần phải bao gồm các thông tin sau:
a) Nhận dạng mẫu nước, kể cả việc lấy mẫu, thời gian lưu giữ và điều kiện bảo quản;
b) pH và nồng độ oxy của mẫu nước gốc, tính bằng mg/l hoặc % sự bão hòa;
c) Ngày thử nghiệm;
d) Phương pháp xử lý sơ bộ mẫu, nếu cần, ví dụ pH sau khi hiệu chính;
e) Nguồn gốc vi khuẩn, số mẻ; ngày bắt đầu và kết thúc;
f) Nhiệt độ bảo quản vi khuẩn;
g) Biểu thị kết quả theo Điều 10 và Bảng 1;
h) Mọi sai lệch so với phương pháp này và thông tin về các tình huống có thể ảnh hưởng đến kết quả;
i) Kết quả thử so với các chất chuẩn đối với mẻ vi khuẩn và phép thử thực tế.
Phụ lục A
(tham khảo)
Phương pháp hiệu chính màu
A.1. Phạm vi áp dụng
Việc giảm độ phát quang do hấp thụ ánh sáng có thể xảy ra khi mẫu trong các dãy pha loãng quan sát thấy rõ màu, đặc biệt những màu từ đỏ đến nâu. Nếu quan sát thấy màu ở nồng độ EC20, thì nên thực hiện quy trình sau đây để kiểm tra nếu cần phải hiệu chính màu. Trong mọi trường hợp, khi nồng độ của mẫu thử gần với giá trị-EC50 thì nên hiệu chính màu.
A.2. Dụng cụ bổ sung
A.2.1. Cuvet hiệu chính-màu: cuvet-hai lớp, lắp vừa với máy đo độ phát quang.
A.2.2. Pipet Pasteur.
A.3. Cách tiến hành
Thực hiện toàn bộ quy trình hiệu chính màu ở nhiệt độ 15 °C ± 1 °C trong tủ ủ kiểm soát được nhiệt độ.
Chuẩn bị một dung dịch pha loãng mẫu thử (5.2) có nồng độ gần giá trị EC20,t (Ck). Nếu giá trị-EC20t chênh lệch nhiều thì Ck phải gần với giá trị EC20,t thấp hơn.
CHÚ THÍCH - Không cần phải chọn Ck khác nhau cho mỗi khoảng thời gian tiếp xúc (5 min, 15 min, 30 min).
Cho 2,0 ml dung dịch natri clorua 2 % (5.2) vào khoang ngoài của ống hiệu chính-màu.
Chuẩn bị huyền phù vi khuẩn đặc biệt.
Với vi khuẩn khô-lỏng, thì dùng 1,0 ml huyền phù vi khuẩn gốc.
Trộn kỹ huyền phù trước khi dùng pipet Paster để chuyển vào khoang trong của ống hiệu chính màu. Thêm huyền phù cho bằng với mức dung dịch có trong khoang ngoài của cuvet hiệu chính màu. Đo mức ánh sáng (B0) sau ít nhất 15 min, và bật đồng hồ bấm giờ.
Từ thời điểm này trở đi, vị trí của cuvet hiệu chính màu trong khoảng đo phải được giữ nguyên cho tất cả các số đọc.
Dùng pipet lấy hết dung dịch natri clorua từ khoang ngoài và thay vào đó bằng 2,0 ml mẫu thử đã pha loãng (Phụ lục B) và làm lạnh trước đến 15 °C ± 1 °C.
Đo mức ánh sáng (I5)5 min sau lần đo đầu.
Dùng pipet lấy hết mẫu thử đã pha loãng từ khoang ngoài và thay vào đó bằng 2,0 ml dung dịch natri clorua.
Đo mức ánh sáng (B10) 10 min sau lần đo đầu.
CHÚ THÍCH 2 Quy trình này có thể đơn giản hóa bằng cách dùng hai ống hiệu chính màu giống hệt nhau. Khoang ngoài của ống thứ nhất chứa đầy nước, khoang ngoài của cuvet thứ hai chứa đầy mẫu đã pha loãng. Sau 15 min, có thể đo mức ánh sáng B0 và I0. Những giá trị này khi đó có thể thay cho những giá trị B5 và I5 để tính toán trong A.4.
A.4. Tính toán kết quả
Các tính toán thừa nhận rằng cường độ màu của mẫu phù hợp với định luật Beer-Lambert, đó là trường hợp thông thường.
Tính B5 theo Công thức (A. 1):
![]() (A.1)
(A.1)
Tính độ hấp thụ (At) của nồng độ EC20,t chưa hiệu chính với thời điểm tiếp xúc (t) theo công thức (A.2):
![]() (A.2)
(A.2)
Trong đó
Ck là nồng độ của mẫu hoặc của hóa chất có trong nồng độ thử (màu);
k là hằng số hệ thống thu được theo thực nghiệm.
![]() là độ hấp thụ của dịch pha loãng cần thử trong cuvet hiệu chính màu.
là độ hấp thụ của dịch pha loãng cần thử trong cuvet hiệu chính màu.
Tính độ truyền qua tương ứng (Tt) theo Công thức (A.3):
![]() (A.3)
(A.3)
Tính những giá trị gamma đã hiệu chính (Gc) theo Công thức (A.4):
cGt = (5Tt) - 4 (A.4)
Và theo Công thức (A.5):
Gc = cGt x G0 (A.5)
Trong đó
cGt là hệ số hiệu chính cho giá trị gamma ở thời điểm tiếp xúc đã định (t);
G0 là giá trị gamma gốc.
Tiến hành tính lai kết quả thử với giá trị đã được hiệu chính.
Với thời gian tiếp xúc đã định, có thể tính được độ hấp thụ (At) và độ truyền qua (Tt) đối với mỗi nồng độ thử, và từ đó tính được giá trị gamma chưa hiệu chính theo Công thức (A.6):
Gc = Tt (1 + G0) - 1 (A.6)
Hệ số hiệu chính là giống nhau đối với mỗi giá trị gamma, khi thừa nhận độ dốc của đồ thị gốc là đúng. Do đó, điều này đủ để tính hệ số hiệu chính chỉ đối với một giá trị gamma. Trong phép xác định này, áp dụng giá trị gamma tương ứng với nồng độ EC20,t chưa hiệu chính (G = 0,25). Công thức (A.7) tính hệ số hiệu chính được rút gọn như sau:
![]() (A.7)
(A.7)
Trong đó
Tt là giá trị phát quang sinh học đo được ở thời điểm tiếp xúc đã định (t);
cGt là hệ số hiệu chính cho các giá trị gamma ở thời điểm tiếp xúc đã định (t);
G0 là giá trị gamma gốc;
Gc là giá trị gamma đã được hiệu chính.
A.5. Ví dụ
Bảng A.1 - Ví dụ
| Số liệu hiệu chính màu | ||||||||||
| Ck = 10,0 % phần thể tích | B5 = 81 | I0 = 78 | k = 3,1 | |||||||
| Tính hiệu chính màu | ||||||||||
| C = phần thể tích | 5 min | 15 min | 30 min | |||||||
|
|
| cG5 = 0,708 | CG15 = 0,670 | cG30 = 0,657 | ||||||
|
| I0 | I5 | G0 | Gc | I15 | G0 | Gc | I30 | G0 | Gc |
| Mẫu trắng | 100 | 90 |
|
| 80 |
|
| 70 |
|
|
| 5,625 | 98 | 82 | 0,076 | 0,054 | 74 | 0,059 | 0,040 | 65 | 0,055 | 0,036 |
| 11,250 | 94 | 63 | 0,343 | 0,243 | 60 | 0,253 | 0,170 | 53 | 0,242 | 0,159 |
| 22,500 | 96 | 45 | 0,920 | 0,651 | 42 | 0,829 | 0,556 | 38 | 0,768 | 0,505 |
| 45,000 | 97 | 15 | 4,820 | 3,412 | 17 | 3,565 | 2,389 | 17 | 2,994 | 1,967 |
| Công thức gốc: | lnG= 1,96 x In C- 5,96 | lnG= 1,95 x In C- 6,16 | lnG= 1,90 x In C- 6,12 | |||||||
| Công thức đã hiệu chính: | InG= 1,96 x In C- 6,30 | lnG= 1,95 x In C- 6,56 | lnG= 1,90 x In C- 6,53 | |||||||
| EC20,t gốc | 10,3 | 11,6 | 12,1 | |||||||
| EC20,t đã hiệu chính | 12,3 | 14,3 | 15,1 | |||||||
Phụ lục B
(tham khảo)
Mức pha loãng D - Chuẩn bị các dãy pha loãng
B.1. Nguyên tắc
Khi thử nước thải bằng cách pha loãng dần (D) mẻ thử có nồng độ đậm đặc nhất mà ở nồng độ này không có ức chế, hoặc chỉ có ít ảnh hưởng ức chế mà không vượt quá độ biến đổi đặc trưng thử nghiệm, được gọi là “Độ pha loãng không ảnh hưởng thấp nhất (LID)”. Độ pha loãng này được biểu thị bằng giá trị nghịch đảo của phần thể tích nước thải trong mẻ thử [ví dụ, nếu hàm lượng nước thải là 1 trong 4 (25 % phần thể tích) thì mức pha loãng là D = 4].
Trong phép thử vi khuẩn phát quang, thường trộn các thể tích huyền phù thử đúng bằng với thể tích của mẫu nước hoặc thể tích của mẫu đã pha loãng. Do đó, các mức pha loãng trong các dãy pha loãng theo thông lệ là D ≥ 2 (nồng độ mẫu cao nhất trong phép thử: 50 % mẫu).
B.2. Chuẩn bị mẫu
Chuẩn bị mẫu theo 7.2
Mẫu nước thải phải làm đồng nhất bằng cách lắc bằng tay hoặc trộn bằng khuấy từ.
Thêm 20 g dung dịch natri clorua vào mỗi lít mẫu nước hoặc mẫu nước đã điều chỉnh-pH. Đối với mẫu nước có nồng độ muối cao, đo độ muối và tính lượng NaCI (nếu cần) cần để điều chỉnh độ thẩm thấu. Nồng độ muối thu được trong mẫu thử không được vượt quá độ thẩm thấu của dung dịch natri clorua 35 g/l.
Chuẩn bị dãy pha loãng trong dãy cuvet thử thứ nhất. Nên dùng dãy pha loãng theo Bảng B.1. Dãy pha loãng được chuẩn bị bằng cách pha loãng dần và kết hợp hai pha loãng hình học (D = 2, 4, 8, 16,... và D = 3, 6, 12, 24,...). Đối với các phép xác định song song, thể tích mẫu hoặc mẫu đã pha loãng hoặc mẫu kiểm tra bằng 1 500 ml là đủ.
Bảng B.1 - Chuẩn bị dãy pha loãng
|
| Mức pha loãng D | Thành phần của dãy pha loãng mẫu (Thể tích tổng của phép xác định song song: 1 500 ml) | |
| Mẫu nước (7.2) ml | Nước pha loãng (5.2) ml | ||
|
| Đối với D = 1 |
|
|
| Mẻ kiểm tra |
| 0 | 1 500 |
| Mẻ thử | 1 | 1 500 | 0 |
|
| Đối với D ≥ 2 |
|
|
| Mẻ kiểm tra |
| 0 | 1 500 |
| Mẻ thử | 2 | 1 500 | 0 |
|
| 3 | 1 000 | 500 |
|
| 4 | 750 | 750 |
|
| 6 | 500 | 1 000 |
|
| 8 | 375 | 1 125 |
|
| 12 | 250 | 1 250 |
|
| 16 | 187,5 | 1 312,5 |
|
| 24 | 125 | 1 375 |
|
| 32 | 93,75 | 1 406,25 |
| Mẻ chuẩn (Nồng độ xem trong 5.6) |
| 1 500 | 0 |
Cách dễ nhất để chuẩn bị dãy pha loãng này là tạo hai dung dịch pha loãng gốc trong các ống nghiệm riêng rẽ (xem Hình B.1)
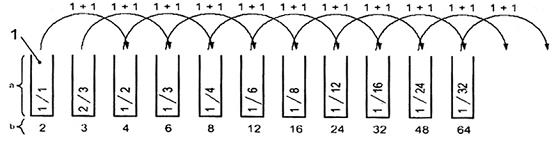
CHÚ DẪN
1 mẫu
a Mẫu pha loãng để tạo dãy thử thứ nhất.
b Mức pha loãng cuối cùng D sau khi thêm huyền phù thử.
Hình B.1 - Sơ đồ pha loãng
Pha loãng 1 trong 1, 3 000 ml mẫu chưa pha loãng (độ pha loãng cuối cùng trong phép thử sau khi trộn với các thể tích bằng nhau huyền phù thử sẽ là 1 trong 2).
Pha loãng 2 trong 3, ví dụ 2 000 ml mẫu + 1 000 ml dung dịch 5.2 (độ pha loãng cuối cùng trong phép thử sau khi trộn với các thể tích huyền phù thử bằng nhau sẽ là 1 trong 3).
Đối với những chuẩn bị pha loãng hơn nữa, chuyển 1 500 ml mẫu /mẫu đã pha loãng vào 1 500 ml dung dịch 5.2 trong các ống thử, trộn đều sau từng lần chuyển.
Trong phép thử vi khuẩn phát quang, thường 500 ml mẫu nước hoặc mẫu đã pha loãng được chuẩn bị trong dãy thử thứ nhất được trộn với 500 ml huyền phù thử (xem Điều 8) được chuẩn bị trong dãy ống thử thứ hai, sau khi đo cường độ ánh sáng ban đầu của huyền phù thử. Do vậy, mức pha loãng thu được D trong mẻ thử đối với phép đo sự ức chế phát quang là gấp đôi độ pha loãng của mẫu hoặc mẫu đã pha loãng.
Nếu cần thử mẫu nước gần như chưa pha loãng, có thể thêm 800 ml mẫu nước chưa pha loãng (7.2) vào 200 ml huyền phù thử. Độ pha loãng của mẫu là 1 trong 1,25 (nồng độ mẫu cuối cùng trong phép thử: 80 % mẫu). Giá trị D tương ứng có thể được coi như D = 1. Huyền phù thử đối với D = 1 được chuẩn bị bằng cách thêm 4,5 ml dung dịch (5.5) vào vi khuẩn đã được tạo huyền phù lại, thay cho 11,5ml. Đối với giá trị này, cần có một mẻ kiểm tra thêm để tính toán hệ số hiệu chính phục vụ cho việc hiệu chính giá trị ban đầu. Mẻ kiểm tra được làm bằng cách thêm 800 ml dung dịch natri clorua (5.2) vào 200 ml huyền phù thử.
B.3. Cách tiến hành
Thực hiện phép thử theo Điều 8.
Thực hiện phép xác định kép đối với từng mức pha loãng.
Xác định và ghi lại cường độ phát quang trong tất cả các ống thử, kể cả ống thử kiểm tra, sau 15 min và 30 min(I30), tùy chọn.
B.4. Đánh giá
Tính giá trị trung bình của ảnh hưởng ức chế ![]() đối với từng mức pha loãng, tính bằng phần trăm (xem 9.1).
đối với từng mức pha loãng, tính bằng phần trăm (xem 9.1).
Tính độ lệch của phép xác định song song H30 so với giá trị trung bình của chúng tương ứng cho phép xác định kép H30 (%) (trung bình) - H30 (%) tính bằng điểm phần trăm, (một chữ số có nghĩa) và theo phần trăm của trung bình cho kiểm tra. (hệ số hiệu chính, xem 9.1).
B.5. Biểu thị kết quả
Biểu thị kết quả theo Điều 10
Giá trị D thấp nhất được thử tại mức mà hiệu ứng ức chế trung bình ![]() là < 20 %, được gọi là LIDlb.
là < 20 %, được gọi là LIDlb.
B.6. Báo cáo thử nghiệm
Xem Điều 13.
Ngoài các số liệu được yêu cầu trong tiêu chuẩn này, báo cáo thử nghiệm phải bao gồm thông tin về độ trong của nước thải, điều chỉnh độ muối và phương pháp xử lý sơ bộ (lắng, lọc, ly tâm, sục khí).
Phụ lục C
(tham khảo)
Số liệu độ đúng
Đối với chương trình thử nghiệm liên phòng, dung dịch chưa trung hòa gồm 3,5-diclorophenol, kẽm sunfat ngậm bảy nước, kali dicromat và xetyltrimethyammonium bromua được pha bằng nước cất hoặc nước có độ tinh khiết tương đương. Những giá trị EC được xác định như nêu trong 9.2, và các kết quả được đưa ra trong Bảng C.1.
CHÚ THÍCH Do một số phòng thí nghiệm cho kết quả ức chế lớn hơn 20 % ở nồng độ thử thấp nhất hoặc kết quả ức chế nhỏ hơn 50 % ở nồng độ thử cao nhất nên các giá trị l đôi khi có sự khác nhau đối với EC20 và EC50.
Bảng C.1 - Số liệu độ chính xác đối với vi khuẩn khô-lỏng
|
|
| l = n | nAP % |
mg/l | sR mg/l | CVR % |
| 1 | 3,5-diclorophenol EC20 EC50 |
20 20 |
4,8 4,8 |
4,69 7,61 |
1,03 1,31 |
22,0 17,2 |
| 2 | Kẽm sunfat ngậm 7 nước a EC20 EC50 |
19 20 |
5,0 0,0 |
15,0 26,3 |
3,6 6,1 |
23,8 23,2 |
| 3 | Kali dicromat a EC20 EC50 |
18 19 |
0,0 0,5 |
1,22 3,50 |
0,5 1,15 |
46,2 32,8 |
| 4 | Cetyltrimethylamoni EC20 EC50 |
14 16 |
0,0 5,9 |
0,745 1,199 |
0,416 0,346 |
55,9 28,9 |
| Các chữ viết tắt trong các bảng C.1 biểu thị: l: Số lượng phòng thí nghiệm tham gia; n: Số lượng các bộ dữ liệu; nAP: Số lượng ngoại lệ;
sR: Độ lệch chuẩn của độ tái lập; CVR: Hệ số biến thiên của độ tái lập; EC20: Nồng độ ảnh hưởng gây ra ức chế phát quang 20 %; EC50: Nồng độ ảnh hưởng gây ra ức chế phát quang 50 % | ||||||
| a Nồng độ Zn(ll) hoặc Cr(VI) tương ứng | ||||||
Phụ lục D
(Tham khảo)
Thử mẫu nước mặn với phép thử vi khuẩn phát quang dùng vi khuẩn khô-lỏng
D.1. Thông tin chung
Sinh vật thử Vibrio fischeri là vi khuẩn biển. Thử mẫu nước mặn bằng quy trình chuẩn thường dẫn tới những ảnh hưởng kích thích mà có thể gây cản trở những hiệu ứng ức chế[2]. Sự kích thích đó có thể do các ion của kim loại kiềm và kim loại kiềm thổ[2], [3]. Với những cải tiến này của quy trình thử, sự phát quang sinh học trong kiểm tra được tối ưu hóa bằng cách sử dụng nước biển nhân tạo hoặc nước lợ nhân tạo khi kiểm tra và pha loãng. Do vậy, những hiệu ứng kích thích được giảm bớt và phương pháp này có thể áp dụng cho mẫu nước biển, nước lợ và nước lọc tương ứng.
D.2. Định nghĩa
D.2.1. Độ muối (Salinity)
Độ muối thực tế (practical sanility)
S
Đại lượng không thứ nguyên, dùng để kiểm tra chất lượng nước, được xem như sự ước lượng về nồng độ của muối hòa tan trong nước biển, tính bằng gam trên kilogram; Nó cũng được định nghĩa theo toán học, là tỷ số (K15) giữa độ dẫn điện của mẫu nước, tại 15 °C và 1 atm*, và độ dẫn điện của dung dịch kali clorua xác định (32,4366 g/kg mẫu) ở cùng nhiệt độ và áp suất.
CHÚ THÍCH Chấp nhận từ TCVN 8184-2:2009 (ISO 6107-2:2006), định nghĩa 85.
D.2.2. Mẫu nước mặn (salt water sample)
Mẫu nước mặn hoặc lợ có độ muối trong khoảng từ 5 đến 35.
D.2.3. Nước chiết của trầm tích biển hoặc lợ (Eluates of marine or brackish sediments).
Dịch chiết lỏng của trầm tích biển hoặc nước lợ có nước lợ/biển nhân tạo hoặc tự nhiên như môi trường rửa giải.
D.2.4. Trầm tích nước biển hoặc nước lợ (Pore water of marine or brackish sediment particles)
Nước nằm giữa các hạt trầm tích biển và trầm tích lợ.
D.3. Vật liệu
D.3.1. Chất chuẩn
- 3,5-dichlorophenol;
- Kẽm sunfat ngậm bảy nước (ZnSO4.7H2O).
D.3.2. Nước biển nhân tạo (ASW) và nước lợ nhân tạo (ABW)
Sử dụng nước đã loại ion để chuẩn bị nước biển nhân tạo (ASW) và nước lợ nhân tạo (ABW) với các thành phần được nêu trong Bảng D 1. Tất cả thuốc thử phải ở cấp độ tinh khiết.
Bảng D.1 - Nước mặn nhân tạo (ASW) (như quy định trong ISO 10253[5]) và nước lợ nhân tạo (ABW)
|
| Nước mặn nhân tạo (ASW) | Nước lợ nhân tạo (ABW) |
| Độ muối (g/l) |
|
|
| NaCI | 22,0 | 14,19 |
| MgCI2.6H2O | 9,7 | 6,26 |
| Na2SO4(anhydris) | 3,7 | 2,39 |
| CaCl2 (anhydris) | 1,0 | 0,65 |
| KCI | 0,65 | 0,42 |
| NaHCO3 | 0,20 | 0,13 |
| H3BO3 | 0,023 | 0,015 |
| Độ dẫn điện (mS/cm) (20 °C) | 47,000 ± 1,000 | 31,000 ± 1,000 |
| Độ muối nhân tạo (20 °C) | 31 ± 1 | 20 ±1 |
| Giá trị pH | 7,5 ± 0,2 | 7,5 ± 0,2 |
D.4. Cách tiến hành
D.4.1. Khái quát
Hoàn nguyên vi khuẩn theo một quy trình chuẩn. Tùy thuộc vào độ muối của mẫu, sử dụng nước biển nhân tạo (ASW) hoặc nước lợ nhân tạo (ABW) làm mẫu kiểm tra âm, nước pha loãng cho dãy pha loãng mẫu và nước pha loãng cho chất chuẩn thay cho dung dịch natri clorua 2 % (S 20) (xem tóm tắt trong Bảng D.2).
Bảng - D.2 - So sánh quy trình chuẩn và quy trình cải biến
|
| Quy trình chuẩn TCVN 6831-2:2010 | Nước lợ cải biến | Nước mặn cải biến |
| Độ muối của mẫu (S) | X < 5 | 5 ≤ x ≤ 20 | 20 ≤ x ≤ 35 |
| Chất chuẩn hòa tan trong | Dung dịch NaCI (S 20) | ABW (s 20) | ASW (s 20) |
| Mẫu kiểm tra | Dung dịch NaCI (S 20) | ABW (s 20) | ASW (s 20) |
| Nước pha loãng | Dung dịch NaCI (S 20) | ABW (s 20) | ASW (s 20) |
D.4.2. Mẫu với độ muối 5 ≤ x ≤ 20 (Nước lợ cải biến)
Đo và lập tài liệu về độ muối của mẫu. Mẫu có độ muối S < 20 thì cần phải tăng độ muối lên S = 20 bằng natri clorua. Đo giá trị pH của mẫu. Nếu pH nằm trong khoảng 7,0 đến 8,5, thì sự điều chỉnh là không cần thiết. Nếu cần, điều chỉnh pH của mẫu tới 7,5 ± 0,2 bằng cách thêm axit clohydric hoặc dung dịch natri hydroxit; Chọn nồng độ của axit clohydric hoặc dung dịch natri hydroxit để hạn chế thể tích thêm vào không quá 5 % tổng thể tích.
Sử dụng nước lợ nhân tạo (ABW) (D.3.2)
- Làm mẫu kiểm tra,
- Dùng cho dãy pha loãng của mẫu,
- Dùng cho dung dịch gốc của chất chuẩn cũng và cho dãy pha loãng của dung dịch gốc.
D.4.3. Mẫu với độ muối 20 < x ≤ 35 (Nước biển cải biến)
Đo và lập tài liệu về độ muối của mẫu. Đo giá trị pH của mẫu. Nếu pH nằm trong khoảng từ 7,0 đến 8,5 thì sự điều chỉnh thường là không cần thiết. Nếu cần, điều chỉnh pH của mẫu tới 7,4 ± 0,2 bằng cách thêm axit clohydric hoặc dung dịch natri hydroxit; chọn nồng độ của axit clohydric hoặc dung dịch natri hydroxit để hạn chế thể tích thêm vào không quá 5 % tổng thể tích.
Sử dụng nước biển nhân tạo (ASW)(D.3.2)
Đo và lập tài liệu về độ muối của mẫu. Đo giá trị pH của mẫu. Nếu pH nằm trong khoảng từ 7,0 đến 8,5 thì sự điều chỉnh thường là không cần thiết. Nếu cần, điều chỉnh pH của mẫu tới 7,4 ± 0,2 bằng cách thêm axit clohydric hoặc dung dịch natri hydroxit; chọn nồng độ của axit clohydric hoặc dung dịch natri hydroxit để hạn chế thể tích thêm vào không quá 5 % tổng thể tích.
D.5. Số liệu độ đúng
Giá trị-EC50 trong Bảng D.3 xác định được trong phòng thí nghiệm đối với chất chuẩn 3,5- dichlorophenol (D.3.1). Các tài liệu liên quan tới Kẽm sunfat ngậm bảy nước thì bị giới hạn và không thu được kết quả trong các thử nghiệm tại phòng thí nghiệm. Chỉ được thể hiện dưới dạng thông tin bắt buộc.
CHÚ THÍCH Ngoại lệ không tính đến độ lệch của giá trị trung bình và nhược điểm dữ liệu của quy trình chuẩn trong quy trình chuyển đổi.
Bảng D.3 - Số liệu đúng đối với vi khuẩn khô-lỏng (TCVN 6831-2 (ISO 11348-2))
| Chất chuẩn | Phép thử | l | n | nAP % |
mg/l | sR mg | CVR % |
| 3.5-dichlorophenol | Tiêu chuẩn | 15 | 17 | 23,5 | 4,67 | 0,37 | 7,9 |
| Nước lợ | 11 | 13 | 0,0 | 4,83 | 0,42 | 8,7 | |
| Nước biển | 11 | 13 | 0,0 | 4,02 | 0,16 | 3,9 | |
| Zn(ll) | Tiêu chuẩn | 1 | 2 | - | 24,78 | 2,28 | 9,2 |
| Nước lợ | 2 | 3 | - | 35,96 | 1,27 | 22,1 | |
| Nước biển | 2 | 2 | - | 43,65 | 9,66 | 3,6 | |
| Giải thích các ký hiệu: l Số phòng thí nghiệm tham gia; n Số bộ dữ liệu; nAP Số lượng ngoại lệ;
sR Độ lệch chuẩn của độ tái lập; CVR Hệ số phương sai của độ tái lập. | |||||||
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] TCVN 8184-2:2009 (ISO 6107-2:2006), Chất lượng nước-Thuật ngữ-Phần 2
[2] ISO/TS 20281, Water quality - Guidance on statistical interpretation of ecotoxicity data
[3] ISO 10253, Water quality - Marine algal growth inhibition test with Skeletonema costatum and Phaeodactylum tricornutum (Chất lượng nước - Thử ức chế phát triển của tảo biển bằng Skeletonema costatum và Phaeodactylum tricomutum)
[4] GRABERT, E., KOSSLER, F. About the nutrients on the luminescent bacteria test (Về chất dinh dưỡng trong phép thử vi khuẩn phát quang). In: Hastings J.W., Kricka L.J., Stanley P.E., editors. Bioluminescence and Chemiluminescence, Molecular Reporting with Photons. Chichester: John Wiley & Sons Ltd, 1996, pp. 291-294
[5] KLEIN, B. (1992): Die Rolle des Kaliums bei Toxizitatstests mit Leuchtbakterien (incl. abstract in English: The role of potassium in toxicity tests using luminescent bacteria). Z.f.Angew.Zool., Vol.4, pp. 199-219
[6] KREBS, F. (1992): Gewasseruntersuchung mit durch Alkali- und Erdalkalionen-Zugabe optimierten DIN-Leuchtbakterientest, dargestellt am Beispiel der Saar (incl. abstract in English: River water analysis with luminescent bacteria test according to DIN, optimized by the addition of alkaline and alkaline-earth ions, with the River Saar as an exsample (Phân tích nước sông bằng phép thử vi khuẩn phát quang theo DIN, bằng cách thêm các ion kiềm và kiềm thổ, lấy ví dụ nước sông Saar)) In: Steinhauser, K.G & Hansen, P. D. (Eds.). Biologische Testverfahren. Stuttgart. Germany. Gustav Fischer Verlag. Schr.-Reihe Verein WaBolu. Pp. 657-673
[7] POSTMA, J.F. et al (2002). Confounding factors in bioassays with freshwater and marine organisms. Ecotoxicol. Environ. Safety, 53 (2), pp. 226-237
[8] KREBS, F. (1993). Toxizitatstest mit gefriergetrockneten Leuchtbakterien. Gewasserschutz, Water, Abwasser, 63, pp. 173-230.
* Theo quy định hợp pháp, atm được chuyển thành Pa: 1 atm = 101 325 Pa.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 6831-2:2010 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 6831-2:2010 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 6831-2:2010 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 6831-2:2010 DOC (Bản Word)