- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
TCVN 6489:2009 Phép thử sự giải phóng cacbon dioxit trong môi trường nước
| Số hiệu: | TCVN 6489:2009 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Tài nguyên-Môi trường |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2009 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 6489:2009
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 6489:2009
TIÊU CHUẨN QUỐC GIA
TCVN 6489:2009
ISO 9439:1999
CHẤT LƯỢNG NƯỚC – ĐÁNH GIÁ KHẢ NĂNG PHÂN HUỶ SINH HỌC HIẾU KHÍ HOÀN TOÀN CỦA CÁC HỢP CHẤT HỮU CƠ TRONG MÔI TRƯỜNG NƯỚC – PHÉP THỬ SỰ GIẢI PHÓNG CACBON DIOXIT
Water quality – Evaluation of ultimate aerobic biodegradability of organic compounds in aqueous medium – Carbon dioxide evolution test
Lời nói đầu
TCVN 6489 : 2009 thay thế TCVN 6489 : 1999;
TCVN 6489 : 2009 hoàn toàn tương đương với ISO 9439 : 1999;
TCVN 6489 : 2009 do Ban kỹ thuật Tiêu chuẩn TCVN/TC147 Chất lượng nước biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Các diều kiện mô tả trong tiêu chuẩn này không luôn luôn tương ứng với các điều kiện tối ưu để cho phép xảy ra mức phân huỷ sinh học tối đa. Với hệ thống thử nghiệm này, đo cacbon dioxit (CO2) do vi sinh vật phân huỷ trong các bẫy khi sục khí qua các bình thử. Một số CO2 còn lại trong môi trường trong bình thử như cacbon vô cơ hoà tan (DIC), nồng độ của chúng có thể tăng lên do quá trình phân huỷ sinh học. Do cacbon hữu cơ gần như hoàn toàn bị loại bỏ, nén nồng độ của DIC dần dần giảm và có xu hướng đạt đến “không” khi kết thúc quá trình ủ. Do vậy, cần phải axit hoá môi trường tại thời điểm cuối cùng của phép thử để đo CO2 được tạo ra hoàn toàn do sinh vật phân huỷ. Phép đo CO2 trong bẫy ngoài có thể khác với lượng CO2 tạo ra thực sự và tỉ lệ động học có thể cũng thấp hơn so với tỉ lệ dựa trên phép đo DOC bị loại bỏ. Các phân tích tiếp sau có thể là đồ thị phân huỷ sinh học dựa trên lượng CO2 bị bẩy có thể không đại diện đầy đủ cho tỉ lệ động học vi sinh vật. Đối với các phương pháp phân huỷ sinh học khác, xem ISO 15462 và ISO 14593 được dựa trên lượng CO2 tạo ra cũng như không có các nhược điểm này.
CHẤT LƯỢNG NƯỚC – ĐÁNH GIÁ KHẢ NĂNG PHÂN HUỶ SINH HỌC HIẾU KHÍ HOÀN TOÀN CỦA CÁC HỢP CHẤT HỮU CƠ TRONG MÔI TRƯỜNG NƯỚC – PHÉP THỬ SỰ GIẢI PHÓNG CACBON DIOXIT
Water quality – Evaluation of ultimate aerobic biodegradability of organic compounds in aqueous medium – Carbon dioxide evolution test
CẢNH BÁO – Bùn hoạt hoá và nước có thể chứa các loài vi sinh vật gây bệnh tiềm ẩn. Cần thực hiện các biện pháp phòng ngừa thích hợp khi xử lý chúng. Các hợp chất thử có tính độc và các đặc tính chưa biết của nó cần được xử lý một cách cẩn trọng.
1. Phạm vi áp dụng
Tiêu chuẩn này qui định phương pháp dựa trên xác định cacbon dioxit để đánh giá khả năng phân huỷ sinh học hiếu khí “hoàn toàn” các hợp chất hữu cơ ở nồng độ đã cho trong môi trường nước do các loài vi sinh vật hiếu khí.
Phương pháp này áp dụng cho các hợp chất hữu cơ:
a) Tan trong nước dưới các điều kiện thử, trong trường hợp đó có thể được xác định lượng DOC giải phóng như thông tin bổ sung (xem Phụ lục D);
b) Ít tan trong nước dưới các điều kiện thử, trong trường hợp đó cần phải có phép đo đặc biệt để đạt được sự phân tán tốt của hợp chất (ví dụ, xem ISO 10634);
c) Không bay hơi hoặc có áp suất hơi có thể bỏ qua trong những điều kiện thử.
CHÚ THÍCH Đối với hợp chất bay hơi, ví dụ sử dụng ISO 9408 hoặc ISO 14593.
d) Không ức chế các vi sinh vật thử ở nồng độ đã chon cho phép thử.
CHÚ THÍCH Hiệu ứng ức chế có thể xác định theo qui định nêu trong 8.3, hoặc dùng một phương pháp khác để xác định hiệu ứng ức chế của hợp chất lên vi khuẩn [ví dụ xem TCVN 6226 (ISO 8192)].
2. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này áp dụng các thuật ngữ và định nghĩa sau:
2.1
Sự phân huỷ sinh học hiếu khí hoàn toàn (ultimate aerobic biodegradation)
Sự phá vỡ một hợp chất hoá học hoặc chất hữu cơ do vi sinh vật khi có oxy để tạo cacbon dioxit, nước, muối khoáng của bất kỳ nguyên tố nào có mặt (sự khoáng hoá) và tạo ra sinh khối mới.
2.2
Sự phân huỷ sơ cấp (primary biodegradation)
Sự thay đổi cấu trúc (sự biến đổi) của hợp chất hoá học do vi sinh vật dẫn đến mất đi một đặc tính cụ thể
2.3
Bùn hoạt hoá (activated sludge)
Sinh khối được tạo ra trong quá trình xử lý nước thải bằng phương pháp hiếu khí do sự phát triển của vi khuẩn và các loài vi sinh vật khác trong điều kiện có oxy hoà tan.
2.4
Nồng độ chất rắn lơ lửng (concentration of suspended solids)
<bùn hoạt hoá> lượng chất rắn thu được bằng cách lọc hoặc ly tâm một thể tích bùn hoạt hoá đã biết và sấy khô ở khoảng 1050C đến khối lượng không đổi.
2.5
Cacbon hữu cơ hoà tan (dissolved organic carbon)
DOC
Phần cacbon hữu cơ trong mẫu nước không thể loại bỏ được bằng sự tách pha nhất định.
CHÚ THÍCH Ví dụ, bằng cách ly tâm tại 40 000 m.s2 trong 15 min hoặc bằng cách lọc qua màng lọc có đường kính lỗ 0,2 μm đến 0,45 μm.
2.6
Cacbon vô cơ tổng số (total inorganic carbon)
TIC
Tất cả cacbon vô cơ trong nước được chuyển hoá từ cacbon dioxit và cacbonat.
2.7
Cacbon vô cơ hoà tan (dissolved inorganic carbon)
DIC
Phần cacbon vô cơ trong nước mà không thể loại bỏ được bằng sự tách pha nhất định.
CHÚ THÍCH Ví dụ, bằng cách ly tâm tại 40 000 m.s2 trong 15 min hoặc bằng cách lọc qua màng lọc có đường kính lỗ 0,2 μm đến 0,45 μm.
2.8
Lượng cacbon dioxit được tạo thành theo lý thuyết (theoretical amount of formed carbon dioxide)
ThCO2
Lượng cacbon dioxit tối đa theo lý thuyết được tạo thành sau khi oxy hoá hoàn toàn một hợp chất hoá học
CHÚ THÍCH Có thể tính được từ công thức phân tử và trong trường hợp này thể hiện theo miligam cacbon dioxit trên miligam (hoặc gam) hợp chất thử.
2.9
Pha trễ (lag phase)
Khoảng thời gian từ khi bắt đầu một phép thử đến khi thích nghi và/hoặc lựa chọn loài vi sinh vật phân huỷ, khoảng thời gian này tương ứng với mức độ phân huỷ sinh học của một chất hoá học hoặc chất hữu cơ đã đạt khoảng 10% mức phân huỷ sinh học tối đa.
CHÚ THÍCH Thông thường được tính theo ngày
2.10
Mức phân hủy sinh học tối đa (maximum level of biodegradation)
Mức độ phân hủy sinh học tối đa của một hợp chất hóa học hoặc chất hữu cơ trong một phép thử, mà trên mức đó không còn sự phân hủy sinh học nữa xảy ra trong quá trình thử.
CHÚ THÍCH Thông thường được tính theo phần trăm.
2.11
Pha phân huỷ sinh học (biodegradation phase)
Thời gian từ khi kết thúc pha trễ của phép thử đến khi đạt được khoảng 90% mức phân huỷ sinh học tối đa.
CHÚ THÍCH Thông thường được tính theo ngày
2.12
Pha plato (plateau phase)
Thời gian từ khi kết thúc pha phân huỷ sinh học đến khi kết thúc phép thử.
CHÚ THÍCH Thông thường được tính theo ngày.
2.13
Phơi nhiễm trước (pre-exposure)
Ủ trước một chủng cấy, với sự có mặt hợp chất hoá học thử hoặc hợp chất hữu cơ, nhằm mục đích tăng khả năng của chủng cấy để phân huỷ các chất thử qua quá trình thích nghi và/hoặc lựa chọn các loài vi sinh vật.
2.14
Làm thích nghi trước (preconditioning)
Ủ trước chủng cấy dưới điều kiện thử nhưng không có hợp chất hoá học thử hoặc hợp chất hữu cơ, nhằm mục đích nâng cao hiệu quả của phép thử bằng cách cho các loài vi sinh vật thích nghi với điều kiện thử.
3. Nguyên tắc
Sự phân huỷ sinh học các hợp chất hữu cơ do vi sinh vật hiếu khí được xác định bằng cách dùng hệ thống thử nước tĩnh. Hỗn hợp thử có chứa môi trường vô cơ, hợp chất hữu cơ là nguồn cacbon và năng lượng duy nhất có nồng độ cacbon hữu cơ từ 10 mg/l đến 40 mg/l và chủng cấy hỗn hợp thu được từ trạm xử lý nước thải hoặc từ nguồn khác trong môi trường . Hỗn hợp này được khuấy trong bình thử và được sục không khí chứa CO2 trong khoảng 28 ngày (ví dụ xem Phụ lục A). CO2 tạo thành trong quá trình phân huỷ vi sinh vật được bẫy vào các bình bên ngoài, được xác định bằng phương pháp phân tích thích hợp (ví dụ xem Phụ lục B), và so sánh với lượng theo lý thuyết (ThCO2) và tính bằng phần trăm.
Đối với các hợp chất tan trong nước, DOC giải phóng có thể được đo để biết thêm thông tin về độ phân huỷ sinh học hoàn toàn. Việc này có thể thực hiện trong phương pháp của tiêu chuẩn này, nhưng qui trình thuận tiện được mô tả trong Phụ lục D cho phép sử dụng nồng độ chất thử và chủng cấy cao hơn, do vậy cải thiện được khả năng phân huỷ sinh học của phép thử. Nếu đã có phương pháp phân tích chất đặc thù thì có thể thu được thông tin về độ phân huỷ sơ cấp.
4. Môi trường thử
Quá trình ủ nên tiến hành ở trong bóng tối hoặc trong ánh sáng khuếch tán, nhiệt độ được giữ trong khoảng 200C đến 250C và không được thay đổi quá ± 20C trong quá trình thử.
5. Thuốc thử
Chỉ dùng các thuốc thử tinh khiết phân tích.
5.1 Nước, nước cất hoặc nước đã loại ion, có chứa nhỏ hơn 1 mg/l DOC.
5.2 Môi trường thử
5.2.1 Thành phần
a) Dung dịch a)
Hoà tan
kali dihydrophosphat khan (KH2PO4) 8,5 g
dikali dihydrophosphat khan (K2HPO4) 21,75 g
dinatri hidrophosphat ngậm hai nước (Na2HPO4.2H2O) 33,4 g
amoni clorua (NH4Cl) 0,5 g
trong nước (5.1) lượng cần thiết để pha thành 1 000 ml,
Để kiểm tra dung dịch đệm này, cần phải đo pH. Giá trị pH của dung dịch này phải khoảng 7,4. Nếu không đạt được, chuẩn bị dung dịch mới.
b) Dung dịch b)
Hoà tan 22,5 g magiê sunphat ngậm bảy nước (MgSO4.7H2O) trong nước (5.1.) và thêm lượng nước cần thiết để thành 1 000 ml.
c) Dung dịch c)
Hoà tan 36,4 g canxi clorua ngậm hai nước(CaCl2.2H2O) trong nước (5.1.) và thêm lượng nước cần thiết để thành 1 000 ml.
d) Dung dịch d)
Hoà tan 0,25 g sắt (III) clorua ngậm sáu nước (FeCl3.6H2O) trong nước (5.1) và thêm lượng nước cần thiết để thành 1 000 ml. Để tránh kết tủa, chuẩn bị dung dịch này ngay trước khi dùng hoặc thêm một giọt axit clohydric (HCl) đặc.
5.2.2 Chuẩn bị môi trường thử
Để có 1 000 ml môi trường thử, lấy 800 ml nước (5.1), thêm vào đó:
- 10 ml dung dịch a):
- 1 ml mỗi dung dịch b): c) và d)
Thêm nước (5.1) đến 1 000 ml.
6. Thiết bị, dụng cụ
Phải đảm bảo các dụng cụ thuỷ tinh được rửa cẩn thận, không chứa chất hữu cơ và chất độc.
6.1 Bình thử Bình thuỷ tinh (ví dụ bình Erlenmer hoặc chai) cho phép sục được khí, lắc và khuấy bao gồm cả ống không thấm khí CO2. Đặt bình trong phòng có nhiệt độ không đổi hoặc trong môi trường kiểm soát được nhiệt (ví dụ nồi cách thuỷ).
6.2 Hệ thống cấp không khí không chứa CO2, có khả năng cấp cho mỗi bình thử ở tốc độ dòng từ 50ml/min cho 3 l môi trường , giữ không đổi (xem ví dụ về lắp ráp bình thử ở Phụ lục A).
6.3 Thiết bị phân tích để xác định CO2
Mọi thiết bị hoặc kỹ thuật phù hợp có đủ độ chính xác, ví dụ máy hoặc thiết bị phân tích CO2- hoặc DIC- để xác định chuẩn độ sau khi hấp thụ hoàn toàn trong dung dịch kiềm (xem ví dụ trong Phụ lục B)
6.4 Thiết bị phân tích để đo cacbon hữu cơ hoà tan (DOC) (tuỳ chọn).
6.5 Máy ly tâm hoặc dụng cụ để lọc, có màng lọc (đường kính lỗ 0,2 μm đến 0,45 μm) với độ hấp phụ hoặc giải phóng cacbon hữu cơ ở mức tối thiểu.
6.6 pH-mét.
7. Cách tiến hành
7.1 Chuẩn bị các dung dịch thử
7.1.1 Hợp chất thử
Chuẩn bị dung dịch gốc hợp chất thử tan trong nước (5.1) hoặc môi trường thử (5.2) và thêm một lượng thích hợp dung dịch này để thu được dung dịch có nồng độ cacbon hữu cơ trong môi trường thử cuối cùng nằm trong khoảng từ 10 mg/l đến 40 mg/l. Tuỳ thuộc vào đặc tính của hợp chất thử (ví dụ tính độc) và mục đích của phép thử, có thể sử dụng các nồng độ khác. Hợp chất ít tan trong nước có thể thêm trực tiếp vào bình thử. Xác định chính xác lượng thêm vào.
CHÚ THÍCH Thông tin chi tiết về cách xử lý các hợp chất ít tan trong nước xem ISO 10634.
7.1.2 Hợp chất đối chứng
Sử dụng hợp chất hữu cơ đã biết khả năng phân huỷ sinh học nhu anilin, natri benzoat làm hợp chất đối chứng. Chuẩn bị dung dịch gốc của chất đối chứng trong môi trường thử (5.2) tương tự như đối với hợp chất thử tan trong nước (7.1.1) để có được nồng độ cuối cùng của cacbon hữu cơ là 20 mg/l hoặc nồng độ tương đương với nồng độ hợp chất thử.
7.1.3 Dung dịch để kiểm tra sự ức chế
Nếu cần thiết (ví dụ khi chưa có thông tin về tính độc của hợp chất thử) thì chuẩn bị dung dịch trong môi trường thử (5.2) chứa hợp chất thử (7.1.1) và hợp chất đối chứng (7.1.2) thích hợp với nồng độ cacbon hữu cơ tương ứng là 20 mg/l.
7.2 Chuẩn bị chủng cấy
7.2.1 Khái quát
Chuẩn bị chủng cấy dùng bùn hoạt hoá (7.2.2) hoặc các nguồn nêu trong 7.2.3 và 7.2.4 hoặc hỗn hợp các nguồn này để thu được một quần thể vi sinh vật cho hoạt tính phân huỷ sinh học đủ mạnh. Kiểm tra khả năng của chủng cấy bằng hợp chất đối chứng (7.1.2 và Điều 9). CO2 được tạo ra trong mẫu trắng phải đáp ứng được chuẩn mực phù hợp (xem Điều 9). Để giảm ảnh hưởng của mẫu trắng, có thể làm thích nghi trước chủng cấy, ví dụ bằng cách rửa, sục môi trường (5.2.2) từ 1 ngày đến 7 ngày trước khi sử dụng. Dùng một thể tích phù hợp để cấy (xem chú thích 2 dưới đây).
CHÚ THÍCH 1 Thông thường, chủng cấy được cấy tăng sinh trước với chất thử để cho phép có thể dự đoán khái quát về sự phân huỷ trong môi trường. Trong một số trường hợp, tuỳ thuộc vào mục đích của phép thử, có thể sử dụng các chủng cấy đã được cấy tăng sinh trước, nhưng cần ghi rõ trong báo cáo thử nghiệm (ví dụ, phần trăm phân huỷ sinh học = x % dùng chủng đã được cấy tăng sinh trước) và phương pháp cấy tăng sinh trước cần ghi chi tiết trong báo cáo thử nghiệm. Có thể có được chủng cấy tăng sinh qua phép thử phân huỷ sinh học trong phòng thí nghiệm dưới các điều kiện khác nhau (ví dụ phép thử Zahn – Wellensn TCVN 7439 (ISO 9888) và phép thử SCAS ISO 9887) hoặc từ những mẫu được lấy ở những nơi có điều kiện môi trường tương ứng (ví dụ trạm xử lý các hợp chất tương tự hoặc các vùng bị nhiễm bẩn).
CHÚ THÍCH 2 Dựa trên thực nghiệm, thể tích thích hợp nghĩa là:
- Đủ quần thể vi sinh vật để cho hoạt tính phân huỷ sinh học;
- Phân huỷ hợp chất đối chứng theo phần trăm đã định (xem Điều 9);
- Chứa 103 đến 109 đơn vị khuẩn lạc tạo ra trên mỗi mililit trong hỗn hợp cuối cùng;
- Chứa không quá tương đương 30 mg/l chất rắn lơ lửng của bùn hoạt tính trong hỗn hợp cuối cùng;
- Lượng cacbon hữu cơ hoà tan do chủng cấy tạo ra phải ít hơn 10% nồng độ cacbon hữu cơ đầu tiên do hợp chất thử đưa vào;
- Nói chung, 1ml đến 10 ml chủng cấy là đủ cho 1 000 ml dung dịch thử.
7.2.2 Chủng cấy từ công trình xử lý bùn hoạt hoá
Lấy mẫu bùn hoạt hoá từ bể sục khí của một trạm xử lý nước cống hoặc trạm xử lý nước thải thí nghiệm xử lý chủ yếu là nước thải sinh hoạt. Trộn kỹ và xác định nồng độ chất rắn lơ lửng của bùn hoạt hoá (ví dụ dùng ISO 11923). Nếu cần loại bỏ các hạt thô bằng cách lọc qua sàng và làm đặc lại bằng cách để lắng sao cho thể tích của bùn cho vào phép thử là nhỏ nhất. Giữ mẫu trong điều kiện thoáng khí và tốt nhất, dùng trong ngày lấy mẫu. Sử dụng thể tích hợp để đạt được 30 mg/l chất rắn lơ lửng trong hỗn hợp cuối cùng.
7.2.3 Chủng cấy từ nước thải
Lấy mẫu từ dòng thải hoặc nước thải một trạm xử lý nước cống hoặc trạm xử lý nước thải thí nghiệm xử lý chủ yếu là nước thải sinh hoạt. Nếu cần loại bỏ các hạt thô bằng cách lọc và làm đặc mẫu, ví dụ bằng ly tâm. Trộn kỹ, giữ mẫu trong điều kiện thoáng khí và nên dùng trong ngày lấy mẫu. Trước khi dùng, để mẫu lắng trong 1h và lấy một thể mẫu thích hợp ở phần nổi phía trên để làm chủng cấy.
7.2.4 Chủng cấy từ nước mặt
Lấy mẫu nước mặt thích hợp. Nếu cần làm đặc mẫu bằng cách lọc dùng giấy lọc thô hoặc ly tâm. Giữ mẫu trong điều kiện thoáng khí và nên dùng trong ngày lấy mẫu. Sử dụng một thể tích thích hợp làm chủng cấy.
7.3 Tiến hành thử
Chuẩn bị đủ số bình thử (6.1) để có:
- Ít nhất hai bình thử (ký hiệu F1) chứa chất thử (7.1.1);
- Ít nhất hai bình trắng (ký hiệu Fa) chứa môi trường thử và chất cấy;
- Ít nhất một bình để kiểm tra qui trình (ký hiệu Fc) có chứa hợp chất đối chứng (7.1.2);
- nếu cần, một bình để kiểm tra hiệu ứng ức chế có thể của hợp chất thử (ký hiệu FI) chứa dung dịch 7.1.3;
- nếu cần, một bình để kiểm tra khả năng phân huỷ phi sinh học (ký hiệu Fs) có chứa hợp chất thử (7.1.1) nhưng không có chủng cấy, khử trùng bằng cách hấp hoặc thêm hợp chất độc vô cơ thích hợp để ngăn cản hoạt động của vi sinh vật. Ví dụ, dùng 1 ml/l dung dịch chứa 10 g/l thuỷ ngân (II) clorua (HgCl2). Thêm cùng một lượng chất độc sau khi bắt đầu phép thử hai tuần.
Thêm một lượng thích hợp môi trường thử (5.2) và chủng cấy (7.2) vào mỗi bình như Bảng 1 để thu được thể tích thử cuối cùng, ví dụ 3 I. Có thể dùng các thể tích thử khác, trong trường hợp này thì điều chỉnh tất cả các thông số tương ứng và cách tính toán kết quả thử nghiệm. Nối các bình vào hệ thống tạo ra khí không chứa CO2 (xem Phụ lục A). Ủ ở nhiệt độ theo yêu cầu của phép thử (xem Điều 4) và thổi khí không chứa CO2 trong vòng 24h vào hệ thống. Khuấy kỹ dung dịch thử bằng khuấy từ. Nếu quan sát thấy xuất hiện quá nhiều bọt, thì thay sục khí vào dung dịch bằng sục khí vào không gian phía trên. Sau giai đoạn thông khí sơ bộ, nối đường khí ra của mỗi bình với bẫy CO2 hoặc hệ thống đo CO2.
Thêm mẫu thử (7.1.1) và hợp chất đối chứng (7.1.2) có nồng độ yêu cầu vào các bình tương ứng theo Bảng 1 và bắt đầu thử bằng cách sục không khí không chứa CO2 vào các bình có chứa 3 I môi trường với tốc độ dòng khoảng 50 ml/min đến 100 ml/min.
Đo lượng khí CO2 được giải phóng từ mỗi bình ở các khoảng thời gian đều đặn, tuỳ thuộc vào tốc độ giải phóng khí CO2, sử dụng phương pháp phù hợp có đủ độ chính xác (xem Phụ lục B). Nếu đạt được mức độ tạo CO2 gần như không đổi (pha platô) và dự đoán không có sự phân huỷ sinh học nữa, thì phép thử được coi như hoàn thành. Thông thường thời gian thử tối đa không quá 28 ngày. Phạm vi phép thử từ một đến hai tuần, nếu sự phân huỷ hoàn toàn bắt đầu nhưng đạt được pha platô.
Vào ngày cuối cùng của phép thử, đo pH, axit hoá các bình bằng 1 ml đến 10 ml axit clohydric đặc để phá cacbonnat và bicacbonat và loại bỏ CO2. Tiếp tục sục khí trong khoảng 24 h và sau đó đo lượng CO2 được giải phóng ở mỗi bình.
CHÚ THÍCH Trong khi xử lý mẫu để đo CO2 trong bẫy, đặc biệt trong trường hợp xác định DIC không thể loại trừ một lượng nhỏ CO2 có trong không khí được thêm vào trong quá trình thử. Thông thường điều này không ảnh hưởng đến kết quả thử so với giá trị CO2 trong các bình trắng, nếu cùng xảy ra được trừ đi. Tuy nhiên, trong trường hợp kiểm tra sự loại trừ phi sinh học (bình (FS) điều này dẫn đến sự phân huỷ rõ ràng và phi lý. Do vậy, nên xác định sự giải phóng CO2 từ bình FS khi kết thúc phép thử.
CHÚ THÍCH 2 Nếu DOC cần được đo để cung cấp thêm các thông tin về phân huỷ sinh học của hợp chất thử tan trong nước, hoặc nếu dùng phương pháp phân tích chất đặc trưng để xác định sự phân huỷ sinh học sơ cấp, thì sử dụng thông tin trong Phụ lục D.
Bảng 1 – Sự phân phối cuối cùng môi trường thử và chủng cấy
| Bình | Môi trường thử (5.2) | Hợp chất thử (7.1.1) | Hợp chất đối chứng (7.1.2) | Chủng cấy (7.2) |
| Hợp chất thử FT Hợp chất thử FT | + + | + + | - - | + + |
| Dung dịch trắng FB Dung dịch trắng FB | + + | - - | - - | + + |
| Kiểm tra chủng cấy FC | + | - | + | + |
| Kiểm tra ức chế F1 (tuỳ chọn) | + | + | + | + |
| Kiểm tra phân huỷ phi sinh học FS (tuỳ chọn) | + | + | - | - |
8. Tính toán
8.1 Lượng cacbon dioxit CO2 sinh ra theo lý thuyết của hợp chất thử
Lượng cacbon dioxit sinh ra theo lý thuyết (ThCO2) trong các bình thử được tính bằng miligam theo công thức (1)
ThCO 1 = p1 x V1 x ![]() (1)
(1)
Trong đó
pc nồng độ cacbon hữu cơ của hợp chất thử trong bình thử, đo được hoặc tính từ nồng độ đo được trong dung dịch gốc của hợp chất thử (7.1.1), tính bằng miligam trên lít:
VL thể tích của dung dịch thử trong bình thử, tính bằng lít;
44 và 12 khối lượng mol và nguyên tử của CO2 và C tương ứng, để tính lượng CO2 từ cacbon hữu cơ đo được.
Tính toán tương tự cách tính ThCO2, đối với hợp chất đối chứng và dung dịch thử sự ức chế (7.1.3).
8.2 Phần trăm phân huỷ sinh học
Tính phần trăm phân huỷ sinh học Dm (%) đối với từng bình thử FT trong mỗi khoảng thời gian sử dụng công thức (2):
Dm =![]() (2)
(2)
Trong đó
![]() là lượng CO2 được giải phóng từ bình FT từ khi bắt đầu phép thử đến thời điểm t, tính bằng miligam;
là lượng CO2 được giải phóng từ bình FT từ khi bắt đầu phép thử đến thời điểm t, tính bằng miligam;
![]() là lượng CO2 trung bình của tổng lượng CO2 được giải phóng trong bình trắng từ khi bắt đầu phép thử đến thời điểm t, tính bằng miligam;
là lượng CO2 trung bình của tổng lượng CO2 được giải phóng trong bình trắng từ khi bắt đầu phép thử đến thời điểm t, tính bằng miligam;
Tính toán tương tự đối với mức phân huỷ sinh học của hợp chất đối chứng trong bình kiểm tra chủng cấy FC, và của hỗn hợp và hợp chất đối chứng trong bình kiểm tra sự ức chế Fl không trừ dung dịch trắng, của hợp chất thử trong bình kiểm tra sự loại trừ phi sinh học FS nếu các bình này có trong các bình thử.
CHÚ THÍCH Nếu DOC loại bỏ và sự phân huỷ sinh học sơ cấp bằng phân tích các chất đặc thù tính được, nên tính toán kết quả theo Phụ lục D.
8.3 Biểu thị kết quả
Lập bảng lượng CO2 giải phóng (![]() và
và ![]() ) và phần trăm phân huỷ sinh học (Dm) cho mỗi khoảng thời gian đo và từng bình thử. Vẽ đồ thị phân huỷ sinh học tính bằng phần trăm theo thời gian, và chỉ ra pha trễ và pha phân huỷ. Cách khác, vẽ đồ thị lượng CO2 giải phóng thực sự theo thời gian. Nếu kết quả so sánh của hai bình thử kép FT (khác nhau < 20%), vẽ đồ thị giá trị trung bình, mặt khác vẽ đồ thị cho từng bình (xem Phụ lục C). Vẽ đồ thị tương tự đối với đồ thị phân huỷ sinh học của hợp chất đối chứng FC và đồ thị của kiểm tra sự loại trừ phi sinh học FS và kiểm tra sự ức chế F1 nếu các bình này có trong các bình thử.
) và phần trăm phân huỷ sinh học (Dm) cho mỗi khoảng thời gian đo và từng bình thử. Vẽ đồ thị phân huỷ sinh học tính bằng phần trăm theo thời gian, và chỉ ra pha trễ và pha phân huỷ. Cách khác, vẽ đồ thị lượng CO2 giải phóng thực sự theo thời gian. Nếu kết quả so sánh của hai bình thử kép FT (khác nhau < 20%), vẽ đồ thị giá trị trung bình, mặt khác vẽ đồ thị cho từng bình (xem Phụ lục C). Vẽ đồ thị tương tự đối với đồ thị phân huỷ sinh học của hợp chất đối chứng FC và đồ thị của kiểm tra sự loại trừ phi sinh học FS và kiểm tra sự ức chế F1 nếu các bình này có trong các bình thử.
Xác định giá trị trung bình của phần trăm phân huỷ sinh học trong pha plateu hoặc sử dụng giá trị lớn nhất, ví dụ nếu đồ thị đi xuống trong pha platô và chỉ rõ mức phân huỷ sinh học tối đa là “mức phân huỷ sinh học của hợp chất thử” trong báo cáo thử nghiệm.
Thông tin về tính độc của các hợp chất thử có thể hữu ích trong việc diễn giải kết quả thử nghiệm cho thấy mức phân huỷ sinh học thấp. Nếu trong bình F1 phần trăm phân huỷ sinh học là < 25 % và mức phân huỷ của hợp chất thử đủ quan sát, thì cho rằng hợp chất thử là có sự ức chế. Trong trường hợp này, cần phải lặp lại phép thử nhưng sử dùng nồng độ chất thử thấp hơn hoặc chủng cấy khác. Nếu trong bình FS (kiểm tra sự loại trừ phi sinh học, nếu có) lượng CO2 giải phóng quan sát thấy đáng kể (> 10 %), thì qui trình phân huỷ phi sinh học có thể đã xảy ra.
9. Xác định tính đúng đắn của kết quả
9.1 Chuẩn mực đúng
Phép thử được xem là có giá trị nếu
a) Phần trăm phân huỷ trong bình Fc (kiểm tra chủng cấy) là lớn hơn 60% ở ngày thứ 14;
b) Nồng độ CO2 thoát ra từ bình chứa dung dịch trắng FB ở cuối phép thử với thể tích thử là 3 I khoảng 40 mg/ml nhưng không vượt quá 70 mg/l;
c) Lượng DIC khi bắt đầu phép thử < 5 % lượng cacbon hữu cơ của hợp chất thử.
Nếu a) và b) không thoả mãn, thì phép thử cần phải làm lại với chủng cấy khác hoặc chủng cấy được cấy tăng sinh trước tốt hơn. Nếu c) cũng không được thoả mãn, thì kiểm tra xác nhận lại xem không khí sục vào các bình có thực sự là không chứa CO2.
9.2 Sự ức chế
Nếu bình F1 (kiểm tra sự ức chế) cũng có trong phép thử, thì hợp chất thử được cho là bị ức chế nếu phần trăm phân huỷ của hợp chất đối chứng trong bình F1 nhỏ hơn 40 % tại điểm cuối của phép thử. Trong trường hợp này, nên lặp lại phép thử với nồng độ chất thử thấp hơn.
9.3 Giá trị pH
Nếu giá trị pH tại điểm cuối của phép thử nằm ngoài khoảng từ 6 đến 8,5 và nếu phần trăm phân huỷ sinh học của hợp chất nhỏ hơn 60 % thì nên làm lại phép thử với nồng độ hợp chất thử thấp hơn hoặc sử dụng những thay đổi thử nghiệm được mô tả trong Phụ lục D của phương pháp này.
10. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải ít nhất có các thông tin sau:
a) viện dẫn tiêu chuẩn này và Phụ lục nếu có thay đổi;
b) tất cả các thông tin cần thiết để nhận dạng hợp chất thử;
c) tất cả dữ liệu thu được (ví dụ theo dạng bảng) và biểu đồ phân huỷ
d) nồng độ của hợp chất thử được dùng và lượng ThCO2, trong trường hợp hợp chất thử tan trong nước, lượng DOC trong nồng độ này;
e) tên của hợp chất đối chứng được dùng và sự phân huỷ thu được của hợp chất này;
f) nguồn gốc, đặc tính, nồng độ hoặc thể tích của chủng cấy đã dùng và thông tin về việc xử lý sơ bộ;
g) những tính năng chính của hệ thống phân tích CO2 đã dùng;
h) nhiệt độ ủ của phép thử;
i) nếu có, phần trăm lượng DOC loại bỏ hoặc phần trăm phân huỷ sinh học sơ cấp;
j) nếu có, phần trăm phân huỷ sinh học trong bình FI (kiểm tra sự ức chế) và những công bố về tính độc của hợp chất thử;
l) lý do trong trường hợp loại bỏ phép thử;
m) mọi sự thay đổi của qui trình tiêu chuẩn hoặc mọi tình huống có thể ảnh hưởng đến kết quả thử nghiệm.
Phụ lục A
(tham khảo)
Nguyên tắc của hệ thống thử nghiệm đo cacbon dioxit (ví dụ)
Lắp đặt dãy các bình như nêu ở hình A.1 và nối các bình với hệ thống ống không thấm khí. Sục không khí không chứa CO2 vào hệ thống thử nghiệm ở tốc dòng 50 ml/min đến 10 ml/min và áp suất không đổi. Đếm các bọt không khí hoặc sử dụng bộ kiểm soát dòng khí phù hợp để kiểm tra tốc độ dòng. Sử dụng không khí tổng hợp không chứa CO2 hoặc khí nén. Trong trường hợp sau, loại bỏ CO2 bằng cách cho không khí qua một bình có vôi sôda hoặc qua ít nhất hai bình rửa khí có chứa ví dụ 500 ml dung dịch NaOH (c = 10 mol/l). Bình thứ hai chứa 100 ml dung dịch Ba(OH)2 (c = 0,0125 mol/l) được dùng để xem có khí CO2 trong không khí hay không bằng chỉ thị độ đục của dung dịch. Một bình trống đặt ở giữa bình chỉ thị và bình thử sau ngăn cản chất lỏng không bị chuyển sang. Trong bình thử, nếu sự phân huỷ sinh học xảy ra và CO2 được tạo ra bị hấp thụ trong các bình hấp thụ tiếp sau như trình bày trong Phụ lục B.
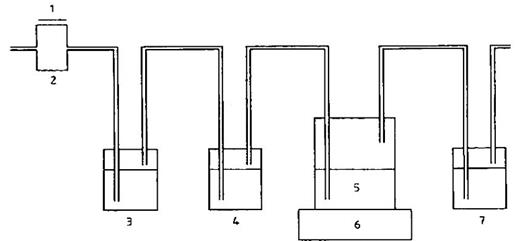
CHÚ GIẢI
1. Không khí nén
2. Bộ kiểm soát dòng
3. Bẫy cacbon dioxit (NaOH)
4. Chỉ thị cacbon dioxit [Ba(OH)2]
5. Các bình thử
6. Bộ khuấy
7. Bẫy cacbon dioxit [Ba(OH)2 hoặc (NaOH)]
Hình A.1
Phụ lục B
(tham khảo)
Ví dụ về xác định cacbon dioxit được thoát ra
B.1 Xác định CO2 bằng đo DIC
CO2 được giải phóng bị hấp thụ vào dung dịch natri hydroxit (NaOH) và được xác định như là cacbon vô cơ hoà tan (DIC) ví dụ dùng máy phân tích DOC không có lò đốt hoặc bộ phận oxy hoá.
Chuẩn bị dung dịch NaOH (c= 0,05 mol/l) trong nước đã loại ion. Đo DIC của dung dịch này và xem xét giá trị trắng này (ps) khi tính toán lượng CO2 tạo ra. Nối hai bình hấp thụ trong dãy bình với bình thử, mỗi bình chứa ít nhất 100 ml dung dịch NaOH. Đóng lối ra của bình cuối cùng bằng xiphông nhỏ để ngăn cản sự đưa thêm CO2 từ không khí vào dung dịch NaOH. Vào ngày xác định CO2, chuyển bình kín đến gần bình thử và lấy đủ mẫu để đo DIC (ví dụ 10 ml). Thay bình này bằng bình thứ hai và thêm một bình mới có chứa dung dịch NaOH mới được chuẩn bị. Đo DIC trong cả hai bình vào ngày cuối cùng, sau khi axit hoá dung dịch thử.
Tính toán lượng CO2 được sinh ra dùng công thức (B.1):
![]()
![]() (B.1)
(B.1)
Trong đó
mTl là khối lượng CO2 được thoát ra trong bình FT từ khi bắt đầu phép thử đến thời điểm t, tính bằng miligam;
pT là nồng độ DIC đo được bị hấp thụ vào dung dịch NaOH trong bình FT tại thời điểm t, tính
bằng miligam trên lít;
pB là nồng độ DIC đo được bị hấp thụ vào dung dịch NaOH bình mẫu trắng FB tại thời điểm t, tính
bằng miligam trên lít;
3,67 là tỉ số khối lượng phân tử tương đối/khối lượng nguyên tử CO2/C (44/12);
10 là hệ số hiệu chỉnh đối với 100 ml dung dịch NaOH, tính theo nghịch đảo của lít. Hệ số này cũng được chấp nhận nếu dùng thể tích khác.
B.2 Phương pháp chuẩn độ dùng dung dịch bari hydroxit
CO2 được tạo thành tác dụng với bari hydroxit [Ba(OH)2.8H2O] và tạo kết tủa bari cacbonat (BaCO3) [công thức (B.2)]. Lượng CO2 được giải phóng được xác định bằng cách chuẩn độ lượng dư Ba(OH)2 bằng dung dịch axit clohydric (HCl) ) [công thức (B.3)].
CO2 + Ba(OH)2 → BaCO3 + H2O (B.2)
Ba(OH)2 + 2HCl→ BaCl2 + 2H2O (B.3)
Hoà tan 4,0 g Ba(OH)2.8H2O trong 1000 ml nước đã loại ion hoặc nước cất để thu được dung dịch 0,0125 mol/l. Nên chuẩn bị một lượng đủ ví dụ 5 I tại thời điểm khi xác định dãy thử nghiệm. Lọc sạch các chất rắn và xác định nồng độ chính xác bằng cách chuẩn độ bằng dung dịch HCl tiêu chuẩn để tính toán kết quả. Bảo quản trong bình gắn kín như là dung dịch sạch để tránh sự hấp thụ CO2 trong không khí.
Pha loãng 50 ml dung dịch HCl (c = 1 mol/l) (36,5 g/l) trong 1 000 ml nước đã loại ion hoặc nước cất để có được dung dịch 0,05 mol/l. Dùng phenolphtalein là chỉ thị hoặc máy chuẩn độ tự động để xác định điểm cuối.
Tại thời điểm bắt đầu phép thử, chia chính xác vào ba bình hấp thụ, mỗi bình 100 ml dung dịch Ba(OH)2. Tuỳ thuộc vào đặc tính và lượng hợp chất thử, sử dụng phương pháp cải tiến cho thể tích dùng để bẩy. Định kỳ, vào từng ngày đo, lấy bình gần nhất với bình thử để chuẩn độ. Điều này cần phải thực hiện vì sự cần thiết, ví dụ nếu bình hấp thụ thứ nhất bị đục do kết tủa BaCO3 và trước khi quan sát thấy dung dịch trong bình thứ hai đục. Thông thường, tại lúc bắt đầu phép thử, có thể yêu cầu phải chuẩn độ từng ngày khác và năm ngày một lần nếu pha plaute đạt được. Sau khi loại bỏ bình hấp thụ, ngay lập tức đóng kín bình bằng một cái nút để tránh cho CO2 trong không khí đi vào bình. Di chuyển hai bình còn lại đến vị trí gần nhất với bình thử và thay vị trí cuối cùng của dãy bằng bình mới đã nạp đầy dung dịch Ba(OH)2 mới chuẩn bị. Xử lý tất cả các bình có chứa hợp chất thử, hợp chất đối chứng, dung dịch trắng, kiểm tra sự ức chế và kiểm tra chủng cấy chính xác theo cùng một cách.
Ngay sau khi chuyển bình, chuẩn độ toàn bộ (100 ml) hai hoặc ba phần lượng dung dịch Ba(OH)2 bằng dung dịch HCl. Chú ý đến thể tích dung dịch HCl cần để trung hoà.
Nồng độ CO2 bị bẩy trong bình hấp thụ được tính theo công thức (B.4):
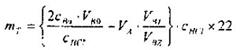 (B.4)
(B.4)
Trong đó
mT khối lượng của CO2 bị bẫy trong bình hấp thụ FT , tính bằng miligam;
C(HCl ) nồng độ chính xác của HCl, tính bằng mol trên lít;
CBa nồng độ chính xác của dung dịch Ba(OH)2, tính bằng mol trên lít ;
VBa thể tích của dung dịch Ba(OH)2 tại thời điểm bắt đầu phép thử, tính bằng mililit;
VBT thể tích của dung dịch Ba(OH)2 tại thời điểm t trước khi lọc, tính bằng mililit;
VBz thể tích của dung dịch Ba(OH)2 được dùng cho chuẩn độ, tính bằng mililit;
VA thể tích dung dịch HCl được sử dụng cho chuẩn độ dung dịch Ba(OH)2, tính bằng mililit;
22 một phần hai phân tử CO2
Nếu các điều kiện sau được áp dụng :
- thể tích của dung dịch Ba(OH)2 trước và sau khi hấp thụ chính xác 100 ml và dung dịch hoàn toàn được dùng để chuẩn độ (VBa = VBT = VBZ);
- nồng độ dung dịch Ba(OH)2 là chính xác cBa =0,0125 mol/l;
- nồng độ dung dịch HCl là chính xác CHCl = 0,05 mol/l;
Thì sử dụng công thức (B.5):
mT = 1,1(50-VA) (B.5)
Phụ lục C
(tham khảo)
Ví dụ về đồ thị phân huỷ sinh học
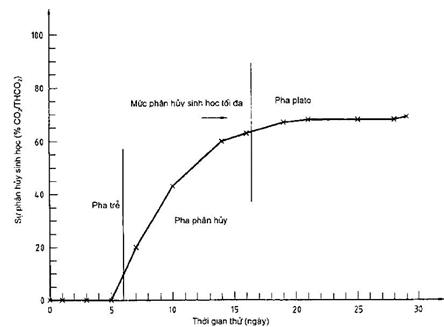
Hình C.1 – Sự phân huỷ sinh học của anilin trong phép thử CO2 thoát ra
Phụ lục D
(tham khảo)
Xác định kết hợp cacbon dioxit và DOC
D.1 Phạm vi và nguyên tắc
Sự thay đổi phép thử xác định sự thoát ra của CO2 kết hợp với hai thông số khác nhau không phụ thuộc trong hệ thống đơn lẻ, loại bỏ DOC và tạo ra CO2 : sau đó là một thông số rõ ràng cho sự phân huỷ sinh học và do vậy cung cấp nhiều thông tin đáng tin cậy. Sự thay đổi của phép thử này có thể được chỉ được dùng cho các hợp chất thử đủ tan trong nước và đặc biệt nên dùng nếu yêu cầu thế phân huỷ cao hơn do phép thử cho phép nồng độ của chủng cấy và hợp chất thử cao hơn. Phương pháp này cũng nên dùng để xác định sự phân huỷ sinh học và không chỉ sự phân huỷ phi sinh học đối với các hợp chất hấp thụ thay cho phép thử chỉ dựa trên lượng DOC bị loại bỏ nhưng TCVN 7439 (ISO 9888).
Nếu sử dụng cùng nguyên tắc đo CO2, nhưng xác định thêm lượng DOC tại thời điểm bắt đầu và kết thúc phép thử, hoặc trong các mẫu thông thường trong quá trình ủ, lượng DOC bị loại bỏ được tính.
Nếu đã có phương pháp phân tích các chất đặc thù, có thể sử dụng để xác định sự phân huỷ sinh học sơ cấp của hợp chất thử nếu được đo thay cho DOC.
Nếu sử dụng phép thử cải tiến xác định CO2 giải phóng thì phải ghi rõ trong báo cáo thử nghiệm.
D.2 Thuốc thử
Nếu sử dụng nồng độ hợp chất thử và chủng cấy cao hơn, được đề nghị trong phụ lục này, cần phải tăng khả năng đệm và các chất dinh dưỡng của môi trường vô cơ. Trong trường hợp này, sử dụng môi trường thử tối ưu như sau:
a) Dung dịch a)
Hoà tan
Kali dihydro phosphat khan (KH2PO4) 13,6 g
Dinatri hydro phosphat ngậm hai nước Na2HPO4.2H2O) 26,9g
Amoni clorua 2,0 g
trong nước (5.1), thêm nước cần thiết để pha thành 1 000 ml
b) Dung dịch b)
Hoà tan 22,5 g magiê sulphat ngậm bảy nước (MgSO4.7H2O) trong nước (5.1), thêm lượng nước cần thiết để pha thành 1 000 ml.
c) Dung dịch c)
Hoà tan 36,4 g canxi clorua ngậm hai nước (CaCl2.2H2O) trong nước (5.1)và thêm lượng nước cần thiết để pha thành 1 000 ml.
d) Dung dịch d)
Hoà tan 0,25 g sắt (III) clorua ngậm sáu nước (FeCl3.6H2O) trong nước (5.1) và thêm lượng nước cần thiết để pha thành 1 000 ml. Axit hóa bằng một axit clohydric đậm đặc để tránh tạo kết tủa.
e) Dung dịch e) (Dung dịch nguyên tố vết, tuỳ chọn)
Hoà tan vào 10 ml dung dịch axit clohydric (HCl) (25 %, 7,7 mol/l) các chất sau: 70 mg ZnCl2, 100 mg MnCl2.4H2O, 6 mg H3BO3, 190 mg CoCl2.6H2O, 3 mg CuCl2.2H2O, 240 mg NiCl2.6H2O, 36 mg Na2MoO4.2H2O, 33 mg Na2WO4.2H2O, 26 mg Na2SeO3.5H2O và làm pha loãng đến 1 000 ml bằng nước (5.1).
Cho 1 lít môi trường thử, thêm vào khoảng 800 ml nước (5.1) 100 ml dung dịch a) và 1 ml mỗi dung dịch từ b) đến e). Pha loãng đến 1 000 ml bằng nước (5.1) và đo pH.
D.3 Chủng cấy
Sử dụng cùng chủng cấy như trong 7.2. Tuy nhiên , nồng độ của bùn hoạt tính có thể tăng lên đến 150 mg/l chất rắn lơ lửng. Trong trường hợp này sử dụng môi trường thử đã được tối ưu hoá.
D.4 Qui trình thử
Lấy đủ môi trường thử vào các bình thử thích hợp như mô tả trong 7.3 (xem Điều 4). Sử dụng các bình như trong 6.1 phù hợp với que khuấy từ. Nếu mẫu được lấy trong quá trình thử, thì đặt các van vào cổ của từng bình để lấy mẫu dùng cho phân tích DOC hoặc các chất đặc thù. Trong trường hợp này, không nên lắc. Nối các bình ủ với bình hấp thụ như mô tả trong Phụ lục B.
Thêm chuẩn hoặc môi trường thử đã tối ưu hoá và chủng cấy. Thông thường, thêm hợp chất thử (7.1.1) hoặc hợp chất đối chứng (7.1.2) có nồng độ cacbon hữu cơ 40 mg/l. Dùng thể tích thử cuối cùng ví dụ 1500 ml. Bắt đầu ủ có sục khí và khuấy hỗn hợp. Trong trường hợp nồng độ chất rắn lơ lửng là 150 mg/l. Sục không khí không chứa CO2 với tốc độ từ 150 ml/h đến 300 ml/h như mô tả trong Phụ lục A.
Đối với từng khoảng thời gian đều đặn, như mô tả trong 7.3, lấy đủ thể tích mẫu (ví dụ 15 ml) và xác định DOC ít nhất hai lần (ví dụ áp dụng TCVN 6634 [ISO 8245]). Xác định lượng CO2 giải phóng ra như mô tả trong 7.3 và Phụ lục B. Nếu các mẫu được lấy để phân tích DOC hoặc phân tích các chất đặc thù, xem xét sự thay đổi của ThCO2 trong bình thử vào từng ngày lấy mẫu. Trong trường hợp này, chấp nhận công thức (1) (8.1) với thể tích mới.
Nếu lượng DOC bị loại bỏ không được xác định trong quá trình thử, chỉ lấy mẫu tại thời điểm bắt đầu và kết thúc (trước khi axit hoá) và xác định DOC. Trong trường hợp này, không yêu cầu bình thử đặc biệt.
Nếu đã có phương pháp thử phân tích chất đặc thù phù hợp và sự phân huỷ sinh học sơ cấp cần được xác định, thì đo nồng độ của hợp chất thử trong các mẫu đã lấy để phân tích DOC.
D.5 Tính toán sự phân huỷ sinh học dựa trên sự giải phóng ra CO2
Tính toán kết quả phép thử như trong 8.1.
D.6 Tính toán lượng DOC bị loại bỏ
Tính phần trăm sự loại trừ cacbon hữu cơ hoà tan Dc trong từng bình thử dùng công thức (8):
Dc = 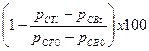 (8)
(8)
Trong đó
pCT0 là nồng độ DOC tại thời điểm 0, trong bình thử FT, tính bằng miligam trên lít;
pCB0 là nồng độ DOC tại thời điểm 0, trong bình dung dịch trắng FB, tính bằng miligam trên lít;
pCTl là nồng độ DOC tại thời điểm t, trong bình thử FT, tính bằng miligam trên lít;
pCBt là nồng độ DOC tại thời điểm t, trong bình dung dịch trắng FB, tính bằng miligam trên lít;
Trong trường hợp các chất hấp thụ điều quan trọng là cần xác định p0 trước khi chủng cấy được thêm vào và bỏ qua trong trường pCB0.
Tính toán tương tự độ phân huỷ sinh học đối với hợp chất chứng Fc và bình kiểm tra sự loại trừ phi sinh học, kiểm tra sự ức chế F1, nếu các bình này bao gồm trong phép thử.
D.7 Tính độ phân huỷ sơ cấp
Nếu phân tích đặc thù các chất thử được thực hiện, tính phần trăm độ phân huỷ sơ cấp DS của hợp chất thử sử dụng công thức (9).
DS= ![]() (9)
(9)
Trong đó
pT là nồng độ của hợp chất thử trong bình FT tại thời điểm t, tính bằng miligam trên lít;
ps là nồng độ của hợp chất thử trong bình Fs tại thời điểm t, tính bằng miligam trên lít;
D.8 Biểu thị kết quả
Lập và xử lý dữ liệu, ví dụ vẽ đồ thị sự loại trừ, như mô tả trong 8.3.
D.9 Chuẩn mực có giá trị
Xem 9.1 nếu sử dụng nồng độ chủng cấy cao hơn (150 mg/l chất khô, xem D.3), thì nồng độ CO2 trong mẫu trắng tại thời điểm kết thúc phép thử cần phải khoảng 150mg/l.
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] TCVN 6621 (ISO 7827). Chất lượng nước – Đánh giá sự phân huỷ sinh học hiếu khí “cuối cùng” của các hợp chất hữu cơ trong môi trường nước – Phương pháp phân tích cacbon hữu cơ hoà tan (DOC).
[2] TCVN 6226 (ISO 8192). Chất lượng nước – Thử sự ức chế khả năng tiêu thụ oxy của bùn hoạt hoá
[3] TCVN 6634 (ISO 8245). Chất lượng nước – Hướng dẫn xác định cacbon hữu cơ tổng số (TOC) và cacbon hữu cơ hoà tan (DOC).
[4] TCVN 6827 (ISO 9408). Chất lượng nước – Đánh giá sự phân huỷ sinh học hiếu khí hoàn toàn các hợp chất hữu cơ trong môi trường nước bằng cách xác định nhu cầu oxi trong máy đo hô hấp kín.
[5] TCVN 6917 (ISO 9888). Chất lượng nước – Đánh giá sự phân huỷ sinh học ưa khí cuối cùng của các hợp chất hữu cơ trong môi trường nước – Phép thử tĩnh (phương pháp Zahn-Wellens)
[6] TCVN (ISO 10634). Chất lượng nước – Hướng dẫn chuẩn bị và xử lý hợp chất hữu cơ ít tan trong nước để đánh giá sự phân huỷ sinh học trong môi trường nước.
[7] TCVN 6625 (ISO 11923). Chất lượng nước – Xác định chất rắn lơ lửng bằng cách lọc qua cái lọc sợi thuỷ tinh.
[8] ISO 9887, Water quality – Evaluation of the aerobic biodegradability of organic compounds in an aqueous medium – Semi-continuous activated sludge method (SCAS).
[9] ISO 14593, Water quality – Evaluation of the ultimate aerobic biodegradability of organic compounds in aqueous medium – Method by analysis of released inorganic carbon in sealed flasks.
[10] ISO 15462, Water quality – Selection of tests for biodegradability.
[11] Birch, R.R. and Fletcher, R.J. The application of dissolved inorganic carbon measurements to the study of aerobic biodegradability. Chemosphere, 23. 1991, pp. 507-524.
[12] OECD Guidelines for the Testing of Chemicals, 301 B CO2 Evolution Test. Organisation for Economic Cooperation and Development, Paris, 1993.
[13] Strotmann U., Schwarz H. and Pagga U. The CO2/DOC-combination test – A new method to determine the biodegradability of chemical compounds, Chemosphere. 30. 1995. pp.525-538.
[11] Woytjens D,. van Ginneken I. and Painter H.A. The recovery of carbon dioxide in the Sturm test for ready biodegradability. Chemosphere. 28. 1994, pp. 801-812.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 6489:2009 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 6489:2009 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 6489:2009 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 6489:2009 DOC (Bản Word)