- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 12848:2020 Nông sản có nguồn gốc thực vật - Xác định đa dư lượng thuốc bảo vệ thực vật sử dụng sắc ký khí và sắc ký lỏng sau khi xử lý mẫy bằng phương pháp Quechers
| Số hiệu: | TCVN 12848:2020 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
03/07/2020 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 12848:2020
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 12848:2020
TIÊU CHUẨN QUỐC GIA
TCVN 12848:2020
NÔNG SẢN CÓ NGUỒN GỐC THỰC VẬT - XÁC ĐỊNH ĐA DƯ LƯỢNG THUỐC BẢO VỆ THỰC VẬT SỬ DỤNG SẮC KÝ KHÍ VÀ SẮC KÝ LỎNG SAU KHI XỬ LÝ MẪU BẰNG PHƯƠNG PHÁP QUECHERS
Agricultural products of plant origin - Multimethod for the determination of pesticide residues using GC - and LC - based analysis following preparation sample by QuEChERS - method
Lời nói đầu
TCVN 12848:2020 do Cục Bảo vệ thực vật biên soạn, Bộ Nông nghiệp và Phát triển Nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
NÔNG SẢN CÓ NGUỒN GỐC THỰC VẬT - XÁC ĐỊNH ĐA DƯ LƯỢNG THUỐC BẢO VỆ THỰC VẬT SỬ DỤNG SẮC KÝ KHÍ VÀ SẮC KÝ LỎNG SAU KHI XỬ LÝ MẪU BẰNG PHƯƠNG PHÁP QUECHERS
Agricultural products of plant origin - Multimethod for the determination of pesticide residues using GC - and LC - based analysis following preparation sample by QuEChERS - method
CẢNH BÁO - Việc áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, vận hành và thiết bị nguy hiểm. Tiêu chuẩn này không yêu cầu giải quyết tất cả các vấn đề an toàn liên quan đến việc sử dụng nó. Người sử dụng tiêu chuẩn này có trách nhiệm thiết lập các thực hành an toàn và sức khỏe phù hợp và xác định khả năng áp dụng các giới hạn quy định trước khi sử dụng.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp phân tích dư lượng thuốc bảo vệ thực vật (BVTV) trong nông sản có nguồn gốc thực vật, như quả (bao gồm cả quả sấy khô), rau (bao gồm cả rau sấy khô), ngũ cốc và nhiều loại sản phẩm chế biến của chúng bằng sắc ký khí (GC), sắc ký khí ghép khối phổ (GC-MS(/MS)) và/hoặc sắc ký lỏng ghép khối phổ (LC-MS(/MS)).
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi.
CEN/TS 17061:2017 Foodstuffs-Guidelines for the calibration and quantitative determination of pesticide residues and organic contaminants using chromatographic methods (Thực phẩm-Hướng dẫn đường chuẩn và định lượng dư lượng thuốc BVTV và những chất ô nhiễm hữu cơ bằng phương pháp sắc ký).
3 Nguyên tắc
Mẫu đã đồng nhất được chiết bằng axetonitril. Đối với mẫu có hàm lượng nước thấp (nhỏ hơn 80 %) phải thêm nước trước khi chiết để có tổng lượng nước khoảng 10 g. Sau khi thêm magie sulfat khan, sodium clorua và muối đệm citrat, hỗn hợp được lắc mạnh và ly tâm để tách pha. Một phần của pha hữu cơ được làm sạch bằng chiết phân tán pha rắn (d-SPE) với các loại chất hấp phụ kết hợp với magie sulfat khan để loại nước. Sau khi làm sạch bằng chất hấp phụ amin (Ví dụ: PSA) và graphit cacbon (GCB) hoặc octadecylsilan nếu cần thiết, dịch chiết được axit hóa với một lượng nhỏ axit formic để tăng độ bền của những thuốc BVTV nhạy với bazơ. Dịch chiết sau cùng được xác định trực tiếp bằng GC và LC. Những detector thích hợp cho GC là detector chọn lọc khối phổ (MS hoặc MS/MS) với độ phân giải đơn vị hoặc độ phân giải cao hoặc những detector GC khác như: detector quang hóa ngọn lửa, FPD và detector bắt giữ điện tử, ECD. Để phân tích với LC, kết nối với MS/MS (LC-MS/MS) hoặc khối phổ có độ phân giải cao là đặc biệt thích hợp. Định lượng bằng phương pháp nội chuẩn, dung dịch nội chuẩn được thêm vào phần mẫu thử trước bước chiết đầu tiên, nhưng điều này không bắt buộc. Chi tiết về đường chuẩn xem trong CEN/TS 17061.
4 Chuẩn bị và bảo quản mẫu thử
4.1 Yêu cầu chung
Quy trình xử lý và bảo quản mẫu không được làm ảnh hưởng đến dư lượng thuốc BVTV có trong mẫu thử (còn được gọi là mẫu phân tích). Quy trình xử lý mẫu cần đảm bảo mẫu thử đồng nhất. Nếu một phần mẫu thử không đại diện cho mẫu phân tích thì phải dùng phần mẫu thử lớn hơn hoặc các mẫu lặp lại để thu được kết quả đúng. Việc nghiền nhỏ mẫu sẽ chiết được dư lượng tốt hơn.
4.2 Mẫu phòng thử nghiệm
Khi mẫu đã bị hỏng không thực hiện phân tích. Nên tiến hành chuẩn bị mẫu ngay khi phòng thử nghiệm nhận được, trước khi có sự thay đổi đáng kể về lý hóa. Nếu không thể chuẩn bị mẫu ngay thì phải bảo quản mẫu trong các điều kiện thích hợp để giữ được độ tươi của mẫu và tránh suy giảm chất lượng. Mẫu đã sấy hoặc đã xử lý tương tự cần được phân tích trong thời hạn sử dụng đã công bố.
4.3 Mẫu thử được xử lý sơ bộ
Để chuẩn bị mẫu thử, chỉ lấy phần mẫu phòng thử nghiệm (PTN) áp dụng mức dư lượng tối đa. Có thể loại bỏ các phần còn lại của mẫu.
Việc rút gọn mẫu PTN phải thực hiện sao cho thu được phần mẫu đại diện (ví dụ: chia bốn và chọn những phần chéo đối diện nhau). Nếu mẫu là các đơn vị nhỏ (ví dụ: những loại quả nhỏ, đậu đỗ, ngũ cốc,...) phải trộn đều mẫu trước khi cân phần mẫu thử. Nếu mẫu là các đơn vị lớn hơn lấy các phần hình rẻ quạt (ví dụ: dưa hấu) hoặc là những phần cắt ngang (ví dụ: dưa chuột) gồm cả lớp vỏ từ mỗi đơn vị mẫu [1]
4.4 Mẫu thử
Từ mỗi mẫu thử đã xử lý sơ bộ, loại ra các phần khó đồng nhất (ví dụ: đối với quả hạch cần loại bỏ hạt cứng) để thu được phần mẫu thử. Ghi lại khối lượng phần mẫu đã loại ra. Cần chú ý để tránh hao hụt phần thịt hoặc phần nước. Tính dư lượng theo khối lượng ban đầu của mẫu thử (bao gồm cả hạt).
Nếu mẫu khó đồng nhất hoặc khó chiết dư lượng thuốc BVTV do kích thước mẫu lớn nên nghiền nhỏ mẫu bằng biện pháp thích hợp. Thực hiện ở nhiệt độ phòng nếu sự tách phần thịt và phần nước hoặc sự suy giảm thuốc BVTV xảy ra không đáng kể. Nghiền mẫu ở trạng thái đông lạnh làm giảm đáng kể sự thất thoát các chất phân tích không ổn định về tính chất hóa học, thường cho cỡ hạt nhỏ và đạt được độ đồng đều cao. Cắt thô mẫu (ví dụ: 3 cm x 3 cm) và đặt vào tủ đông (ví dụ: để qua đêm ở nhiệt độ âm 18 °C) trước khi nghiền. Quá trình xử lý cũng có thể tốt hơn và hiệu quả hơn bằng cách nghiền đông lạnh (dùng đá khô hoặc nitơ lỏng) giữ ở nhiệt độ dưới 0 °C. Đặc biệt đối với rau và quả có vỏ mỏng (ví dụ: cà chua, nho), việc nghiền đông lạnh thường cho sản phẩm nghiền đồng nhất hơn so với khi nghiền ở nhiệt độ thường. Khi mẫu thử được xử lý ở nhiệt độ thấp, cần tránh sự ngưng tụ do độ ẩm cao. Lượng cacbon dioxit còn dư cần được phân tán sao cho lượng có trong mẫu là không đáng kể.
4.5 Phần mẫu thử
Từ mẫu thử đã nghiền lấy ra các phần mẫu thử riêng lẻ đủ cho một phép phân tích. Các phần mẫu thử này cần được phân tích ngay. Nếu không được phân tích ngay thì bảo quản đông lạnh mẫu thử. Lưu ý rằng nếu sự đồng nhất của mẫu không đảm bảo trong quá trình bảo quản, mẫu thử nên được trộn đều trước khi lấy phần mẫu thử để đảm bảo tính đồng nhất
5 Cách tiến hành
Quá trình chiết mẫu được chỉ rõ qua các quy trình từ E1 đến E9. Quá trình chiết thường được theo sau bởi quá trình làm sạch dịch chiết thô đã thu được dùng quy trình từ C1 đến C5. Bước làm sạch có thể được bỏ qua nếu ảnh hưởng của nền mẫu trong quá trình phân tích bằng các phương pháp sắc ký được diễn tả trong các quy trình từ D1 đến D6 không rõ ràng. Trong một số trường hợp, làm sạch có thể được thay thế bằng cách pha loãng dịch chiết thô (quy trình C0). Trước khi xác định thường ổn định dịch chiết (quy trình S1). Tất cả quy trình được mô tả chi tiết trong Phụ lục A. Những thông tin bổ sung được nêu trong Phụ lục B.
Bảng 1 đến Bảng 4 mô tả ngắn gọn các quy trình cũng như những ghi chú ứng dụng và những ví dụ sử dụng. Việc tính toán nồng độ dư lượng trong dịch chiết mẫu, đường chuẩn và phương pháp định lượng được mô tả trong các mục từ Q1 đến Q7 (Bảng 5). Kết hợp những quy trình liên quan đến chiết mẫu và làm sạch dịch chiết thô được nêu trong Bảng 6 cho rất nhiều loại thực phẩm (thô và chế biến).
Bảng 1 - Chiết mẫu (E)
| Quy trình | Mô tả | Ứng dụng | Ví dụ |
| Chiết không thủy phân | |||
| E1 | 10 g phần mẫu thử không thêm nước được chiết với axetonitril | Nguyên liệu thực vật và thực phẩm chứa hàm lượng nước cao (lớn hơn hoặc bằng 80 %) | Rau quả, nước ép |
| E2 | 10 g phần mẫu thử được chiết với 10 ml axetonitril sau khi thêm 0,6 ml hoặc 0,2 ml dung dịch sodium hydroxit | Nguyên liệu thực vật và thực phẩm chứa hàm lượng nước cao (lớn hơn hoặc bằng 80 %) và hàm lượng axit cao | (a) chanh, nho đỏ (b) quả mâm xôi |
| E3 | 10 g phần mẫu thử được thêm 2,5 ml nước hoặc 4,5 ml nước sau đó được chiết với axetonitril | Nguyên liệu thực vật và thực phẩm chứa hàm lượng nước trung bình (lớn hơn 40 % và nhỏ hơn 80 %) | (a) chuối, rau ăn củ (khoai tây, khoai mỡ,...) (b) bánh mì, chà là tươi, hạt dẻ |
| E4 | Mẫu thử được đồng nhất với nước và 13,5 g phần mẫu thử được chiết với axetonitrii | Nguyên liệu thực vật và thực phẩm chứa hàm lượng nước thấp (15 % đến 40 %) | Quả sấy khô và những thực phẩm tương tự |
| E5 | 5 g phần mẫu thử được thêm 10 ml nước sau đó được chiết với axetonitril | Nguyên liệu thực vật và thực phẩm chứa hàm lượng nước thấp (nhỏ hơn 15 %) và mật ong | Ngũ cốc, sản phẩm ngũ cốc và mật ong |
| E6 | 5 g phần mẫu thử được thêm 6 ml nước sau đó được chiết với axetonitril | Nguyên liệu thực vật và thực phẩm chứa hàm lượng nước trung bình (lớn hơn 40 % đến 80 %) và phần mẫu nhiều hoặc hàm lượng dầu cao (lớn hơn 5 %) | Tỏi, quả bơ |
| E7 | 2 g phần mẫu thử được thêm 10 ml nước sau đó được chiết với axetonitrii | Nguyên liệu thực vật và thực phẩm chứa hàm lượng nước thấp (nhỏ hơn 15 %) và phần mẫu nhiều cũng như sản phẩm đông khô | Gia vị, cà phê, thuốc lá, chè, đậu lăng, quả đông khô |
| Chiết và thủy phân | |||
| E8 | Thủy phân ester và liên hợp của thuốc BVTV axit trong hỗn hợp 10 g mẫu trong axetonitril sau đó chiết với axetonitril (đề xuất tham khảo phương pháp thử cho thủy phân kiềm) | Nguyên liệu thực vật và thực phẩm với pH trung tính hoặc axit và hàm lượng nước cao (lớn hơn hoặc bằng 80 %) | Rau quả, nước ép, chanh |
| E9 | Thủy phân ester và liên hợp của thuốc BVTV axit trong hỗn hợp 2 g đến 5 g mẫu trong axetonitril sau đó chiết với axetonitril (đề xuất tham khảo phương pháp thử cho thủy phân kiềm) | Nguyên liệu thực vật và thực phẩm với hàm lượng nước thấp | Ngũ cốc và sản phẩm ngũ cốc, tỏi, gia vị, cà phê, thuốc lá, chè, đậu lăng, quả đông khô |
Bảng 2 - Làm sạch
| Quy trình | Mô tả | Ứng dụng | Ví dụ |
| C0 | Không làm sạch | Những thuốc BVTV nhạy với bazơ và có tính axit (pKa nhỏ hơn 5) tương tác với chất hấp phụ amin (PSA) được sử dụng trong quy trình từ C2 đến C5, phân tích dịch chiết với phần mẫu ít. | Dưa leo, táo, dịch chiết thô được pha loãng đủ. |
| C1 | Đông lạnh | Loại chất béo cộng chiết (ngay cả khi kết hợp với các bước làm sạch tiếp theo, ví dụ: C2, C3, C5) | Cam, chanh, ngũ cốc |
| C2 | Chiết phân tán pha rắn với chất hấp phụ amin (PSA) | Làm sạch dịch chiết thô trước khi xác định thuốc BVTV bazơ và trung tính | Quy trình chuẩn cho bất kỳ thực phẩm nào không được nêu riêng |
| C3 | Chiết phân tán pha rắn với lượng chất hấp phụ amin (PSA) lớn hơn | Làm sạch dịch chiết thô của thực phẩm có nguồn gốc thực vật với phần mẫu nhiều trước khi xác định thuốc BVTV bazơ và trung tính | Dịch chiết thô từ quy trình E5 (ví dụ: ngũ cốc và sản phẩm ngũ cốc) và E7 (ví dụ: cà phê, chè, thảo mộc khô, gia vị) |
| C4 | Chiết phân tán pha rắn với hỗn hợp chất hấp phụ amin và chất hấp phụ pha đảo trên nền silica (PSA/ODS) | Đồng thời làm sạch dịch chiết thô và loại chất béo cộng chiết | Quả có múi, ngũ cốc và sản phẩm ngũ cốc, quả bơ, oliu |
| C5 | Chiết phân tán pha rắn với hỗn hợp chất hấp phụ amin và graphit carbon (PSA/GCB) | Làm sạch dịch chiết thô có màu đậm trước khi xác định thuốc BVTV bazơ và trung tính | Rau xà lách, rau diếp,... |
Bảng 3 - Ổn định dịch chiết (S)
| Quy trình | Mô tả | Ứng dụng | Ví dụ |
| S0 | Không ổn định dịch chiết | Những chất phân tích dễ phân hủy bởi axit | Flazasulfurone, Mesosulfurone, Tribenurone, Triflusulfurone |
| S1 | Ổn định dịch chiết với axit formic | Những chất phân tích phân hủy bởi bazơ và ổn định với axit | Đa số chất phân tích |
Bảng 4 - Phát hiện (D)
| Quy trình | Mô tả | Ứng dụng | Ví dụ |
| D1 | LC-MS/MS | Dịch chiết từ quy trình E1 đến E9 sau đó làm sạch với quy trình từ C0 đến C5 | Chất phân tích trong dịch chiết của bất kỳ loại thực phẩm nào ion hóa bởi ESI/APCI |
| D2 | LC-HR-MS | Dịch chiết từ quy trình E1 đến E9 sau đó làm sạch với quy trình từ C0 đến C5 | Chất phân tích trong dịch chiết của bất kỳ loại thực phẩm nào ion hóa bởi ESI/APCI |
| D3 | GC-MS/MS | Dịch chiết từ quy trình E1 đến E7 sau đó làm sạch với quy trình từ C0 đến C5 | Chất phân tích trong dịch chiết của bất kỳ loại thực phẩm nào ion hóa bởi EI/PCI/NCI |
| D4 | GC-MS (bao gồm ITD và TOF) | Dịch chiết từ quy trình E1 đến E7 sau đó làm sạch với quy trình từ C0 đến C5 | Chất phân tích trong dịch chiết với phần mẫu ít ion hóa bởi EI/PCI/NCI |
| D5 | GC-FPD | Dịch chiết từ quy trình E1 đến E7 sau đó làm sạch với quy trình từ C0 đến C5 | Hợp chất lân hữu cơ và hợp chất chứa lưu huỳnh |
| D6 | GC-ECD | Dịch chiết từ quy trình E1 đến E7 sau đó làm sạch với quy trình từ C0 đến C5 | Hợp chất chlor hữu cơ |
Xác định bằng sắc ký khí với detector khối phổ một lần (mode SIM), detector bẫy ion và thời gian bay (không phụ thuộc vào độ phân giải MS) thích hợp cho tất cả các chất phân tích. Phân tích GC-MS không làm sạch chỉ khi dịch chiết đã pha loãng (quy trình C0).
Bảng 5 - Định lượng
| Quy trình | Mô tả | Ứng dụng | Ví dụ |
| Q1 | Định lượng dùng ngoại chuẩn trong dung môi | Xác định khi ảnh hưởng của nền mẫu không đáng kể | Xem CEN/TS 17061:2017, từ 4.4.2 đến 4.4.5 |
| Q2 | Định lượng dùng ngoại chuẩn trong nền mẫu | Xác định khi ảnh hưởng của nền mẫu đáng kể | Xem CEN/TS 17061:2017, 4.3 và từ 4.4.2 đến 4.4.5 |
| Q3 | Định lượng bằng cách sử dụng nội chuẩn và chuẩn trong dung môi | Xác định khi ảnh hưởng của nền mẫu không đáng kể | Xem CEN/TS 17061:2017, 4.5.2 |
| Q4 | Định lượng dùng phương pháp thêm chuẩn vào dịch chiết sau cùng | Xác định khi ảnh hưởng của nền mẫu đáng kể và không có mẫu trắng phù hợp | Xem CEN/TS 17061:2017, 4.6.2 |
| Q5 | Định lượng bằng cách sử dụng nội chuẩn và chuẩn trong nền mẫu hoặc nội chuẩn đồng vị | Xác định khi ảnh hưởng của nền mẫu đáng kể để bù vào hiệu suất thu hồi thấp | Xem CEN/TS 17061:2017, 4.3, 4.5.2 và 4.5.3 |
| Q6 | Định lượng dùng phương pháp thêm chuẩn vào mẫu | Xác định khi ảnh hưởng nền mẫu đáng kể mà không có sẵn mẫu trắng (mẫu kiểm soát) hoặc quá trình chiết chất phân tích không hoàn toàn. | Xem CEN/TS 17061:2017, 4.6.3 |
| Q7 | Định lượng bằng đường chuẩn | Xác định khi ảnh hưởng nền mẫu đáng kể hoặc quá trình chiết chất phân tích không hoàn toàn. | Xem CEN/TS 17061:2017, 4.7 |
Bảng 6 - Kết hợp của chiết và làm sạch của một số thực phẩm cụ thể
| Thực phẩm | Chiết (E) | Mô tả (E) a | Làm sạch (C) | Mô tả (C) b | Làm sạch (thay thế C) | Mô tả (thay thế C) b |
| Nước táo | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Bột táo nghiền | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Táo | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Táo khô | E4 | 500 g/850 ml | C2 | PSA 25 | — | — |
| Mơ | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Mơ khô | E4 | 500 g/ 850 ml | C2 | PSA 25 | — | — |
| Nước mơ | E1 | 10 g /0 ml | C2 | PSA 25 | — | — |
| Măng tây | E1 | 10 g /0 ml | C2 | PSA 25 | — | — |
| Cả tím | E1 | 10 g /0 ml | C2 | PSA 25 | — | — |
| Quả bơ | E6 | 5 g / 6 ml | C1 và C2 | Đông lạnh và PSA 25 | C4 | PSA 25 và C18 25 |
| Chuối | E3a | 10 g /2,5 ml | C2 | PSA 25 | — | — |
| Chuối, đông khô | E7 | 2 g /10 ml | C2 | PSA 25 | — | — |
| Húng quế | E1 | 10 g /0 ml | C5b | PSA 25 và GCB 7,5 | — | — |
| Đậu hạt tươi | E3a | 10 g / 2,5 ml | C2 | PSA 25 | — | — |
| Đậu khô | E5 | 5 g / 10 ml | C2 | PSA 25 | — | — |
| Củ cải đường | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Mâm xôi | E2b | 10 g / NaOH 2 | C2 | PSA 25 | — | — |
| Mâm xôi, đông khô | E7 | 2 g / 10 ml | C2 | PSA 25 | C3a | PSA 50 |
| Việt quất | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Việt quất, khô (14 % nước) | E4 | 500 g / 850 ml | C2 | PSA 25 | — | — |
| Việt quất, đông khô | E7 | 2 g / 10 ml | C2 | PSA 25 | C3a | PSA 50 |
| Bánh mì (34 % đến 43 % nước) | E3b | 10 g / 4,5 ml | C2 | PSA 25 | — | — |
| Mít (70 % nước) | E3a | 10 g / 2,5 ml | C2 | PSA 25 | — | — |
| Bông cải xanh | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Cà rốt | E1 | 10 g / 0 ml | C5a | PSA 25 và GCB 2,5 | — | — |
| Cà rốt, đông khô | E7 | 2 g / 10 ml | C2 | PSA 25 | C5a | PSA 25 và GCB 2,5 |
| Súp lơ | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Cần tây/ Rễ cần tây | E1 | 10 g / 0 ml | C2 | PSA 25 | C5a | PSA 25 và GCB 2,5 |
| Cần tây | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Cần tây, đông khô | E7 | 2 g / 10 ml | C2 | PSA 25 | C5b | PSA 25 và GCB 7,5 |
| Bột ngũ cốc | E5 | 5 g / 10 ml | C1 và C3a | Đông lạnh và PSA 50 | C4 | PSA 25 và C18 25 |
| Hạt ngũ cốc | E5 | 5 g / 10 ml | C1 và C3a | Đông lạnh và PSA 50 | C4 | PSA 25 và C18 25 |
| Ngũ cốc ngũ cốc | E5 | 5 g / 10 ml | C1 và C3a | Đông lạnh và PSA 50 | C4 | PSA 25 và C18 25 |
| Ngũ cốc mảnh | E5 | 5 g / 10 ml | C1 và C3a | Đông lạnh và PSA 50 | C4 | PSA 25 và C18 25 |
| Anh đào | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Hạt dẻ (45 % đến 52 % nước) | E3b | 10 g / 4,5 ml | C2 | PSA 25 | — | — |
| Cải bắp Trung Quốc | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Hẹ | E1 | 10 g / 0 ml | C5b | PSA 25 và GCB 7,5 |
|
|
| Hẹ, đông khô | E7 | 2 g / 10 ml | C2 | PSA 25 | C5b | PSA 25 và GCB 7,5 |
| Dừa, tươi | E6 | 5 g / 6 ml | C2 | PSA 25 | — | — |
| Hạt cà phê | E7 | 2 g / 10 ml | C3b | PSA 75 | — | — |
| Rau mùi | E1 | 10 g / 0 ml | C5b | PSA 25 và GCB 7,5 | — | — |
| Ngô, đông khô | E7 | 2 g / 10 ml | C2 | PSA 25 | — | — |
| Ngô, tươi | E3a | 10 g / 2,5 ml | C2 | PSA 25 | — | — |
| Bí xanh | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Cải xoong | E1 | 10 g / 0 ml | C5b | PSA 25 và GCB 7,5 | — | — |
| Dưa chuột | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Phúc bồn tử | E2a | 10 g / NaOH 1 | C2 | PSA 25 | — | — |
| Phúc bồn tử, đông khô | E7 | 2 g / 10 ml | C2 | PSA 25 | — | — |
| Nước ép phúc bồn tử | E2a | 10 g / NaOH 1 | C2 | PSA 25 | — | — |
| Chà là, sấy khô | E4 | 500 g / 850 ml | C2 | PSA 25 | — | — |
| Chá là, tươi (50 % đến 60 % nước) | E3b | 10 g / 4,5 ml | C2 | PSA 25 | — | — |
| Quả sầu riêng | E6 | 5 g / 6 ml | C1 và C2 | Đông lạnh và PSA 25 | C4 | PSA 25 và C18 25 |
| Rau diếp | E1 | 10 g / 0 ml | C5a | PSA 25 và GCB 2,5 | — | — |
| Quả sung, sấy khô | E4 | 500 g / 850 ml | C2 | PSA 25 | — | — |
| Nấm trồng | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Nấm, sấy khô | E5 | 5 g / 10 ml | C2 | PSA 25 | — | — |
| Tỏi (59 % nước) | E6 | 5 g / 6 ml | C2 | PSA 25 | — | — |
| Gừng (79 % nước) | E6 | 5 g / 6 ml | C2 | PSA 25 | — | — |
| Hạt bạch quả (55 % nước) | E3b | 10 g /4,5 ml | C2 | PSA 25 | — | — |
| Atisô | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Phúc bồn tử | E2b | 10 g / NaOH 2 | C2 | PSA 25 | — | — |
| Lá nho | E3a | 10 g / 2,5 ml | C2 | PSA 25 | — | — |
| Lá nho | E1 | 10 g / 0 ml | C5b | PSA 25 và GCB 7,5 | — | — |
| Bưởi | E1 | 10 g / 0 ml | C1 và C2 | Đông lạnh và PSA 25 | — | — |
| Nho | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Họ bắp cải | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Xà lách | E1 | 10 g / 0 ml | C5a | PSA 25 và GCB 2,5 | — | — |
| Mật ong | E5 | 5 g / 10 ml | C2 | PSA 25 | — | — |
| Dưa ngọt | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Cải ngựa | E3a | 10 g / 2,5 ml | C2 | PSA 25 | — | — |
| Mít (74 % nước) | E3a | 10 g / 2,5 ml | C2 | PSA 25 | — | — |
| Cải xoăn | E1 | 10 g / 0 ml | C5b | PSA 25 và GCB 7,5 | — | — |
| Quả kiwi | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Cải củ | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Rau diếp cừu | E1 | 10 g / 0 ml | C5b | PSA 25 và GCB 7,5 | — | — |
| Tỏi tây | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Tỏi tây, đông khô | E7 | 2 g / 10 ml | C2 | PSA 25 | — | — |
| Sả, tươi (71 % nước) | E6 | 5 g / 6 ml | C2 | PSA 25 | — | — |
| Nước chanh | E2a | 10 g / NaOH 1 | C2 | PSA 25 | — | — |
| Chanh | E2a | 10 g / NaOH 1 | C1 và C2 | Đông lạnh và PSA 25 | — | — |
| Đậu lăng, sấy khô | E5 | 5 g / 10 ml | C2 | PSA 25 | — | — |
| Nước ép chanh | E2a | 10 g / NaOH 1 | C2 | PSA 25 | — | — |
| Chanh | E2a | 10 g / NaOH 1 | C1 và C2 | Đông lạnh và PSA 25 | — | — |
| Củ sen (79 % nước) | E3a | 10 g / 2,5 ml | C2 | PSA 25 | — | — |
| Hạt sen | E3a | 10 g / 2,5 ml | C2 | PSA 25 | — | — |
| Hạt sen, sấy khô (14 % nước) | E5 | 5 g / 10 ml | C2 | PSA 25 | — | — |
| Quýt | E1 | 10 g / 0 ml | C1 và C2 | Đông lạnh và PSA 25 | — | — |
| Quả xoài | E1 | 10 g / 0 ml | C5a | PSA 25 và GCB 2,5 | — | — |
| Xoài, đông khô | E7 | 2 g / 10 ml | C2 | PSA 25 | C5b | PSA 25 và GCB 7,5 |
| Quả mận vàng | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Mật hoa | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Quả ô liu | E6 | 5 g / 6 ml | C1 và C2 | Đông lạnh và PSA 25 | C4 | PSA 25 và C18 25 |
| Hành | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Những quả cam | E1 | 10 g / 0 ml | C1 và C2 | Đông lạnh và PSA 25 | — | — |
| Đu đủ | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Mùi tây | E1 | 10 g / 0 ml | C5b | PSA 25 và GCB 7,5 | — | — |
| Rau mùi tây | E3a | 10 g / 2,5 ml | C2 | PSA 25 | — | — |
| Quả đào | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Đào, đông khô | E7 | 2 g / 10 ml | C2 | PSA 25 | — | — |
| Quả lê | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Đậu Hà Lan, sấy khô | E5 | 5 g / 10 ml | C2 | PSA 25 | — | — |
| Đậu Hà Lan, đông khô | E7 | 2 g / 10 ml | C2 | PSA 25 | — | — |
| Hạt tiêu, đông khô | E7 | 2 g / 10 ml | C2 | PSA 25 | C5b | PSA 25 và GCB 7,5 |
| Tiêu, xanh, vàng | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Tiêu, đỏ | E1 | 10 g / 0 ml | C5b | PSA 25 và GCB 7,5 | — | — |
| Bạc hà, tươi | E3a | 10 g / 2,5 ml | C5b | PSA 25 và GCB 7,5 | — | — |
| Bạc hà, tươi (78 % nước) | E6 | 5 g / 6 ml | C2 | PSA 25 | — | — |
| Dứa | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Dứa, đông khô | E7 | 2 g / 10 ml | C2 | PSA 25 | — | — |
| Chuối | E3a | 10 g / 2,5 ml | C2 | PSA 25 | — | — |
| Mận | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Mận, sấy khô | E4 | 500 g / 850 ml | C2 | PSA 25 | — | — |
| Khoai tây | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Khoai tây | E3a | 10 g / 2,5 ml | C2 | PSA 25 | — | — |
| Bí ngô | E1 | 10 g / 0 ml | C5a | PSA 25 và GCB 2,5 | — | — |
| Quả mộc quả | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Củ cải | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Nho khô | E4 | 500 g / 850 ml | C2 | PSA 25 | — | — |
| Quả mâm xôi | E2b | 10 g / NaOH 2 | C2 | PSA 25 | — | — |
| Bắp cải đỏ | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Cây đại hoàng | E2b | 10 g / NaOH 2 | C2 | PSA 25 | — | — |
| Nước đại hoàng | E2b | 10 g / NaOH 2 | C2 | PSA 25 | — | — |
| Xà lách Rocket | E1 | 10 g / 0 ml | C5b | PSA 25 và GCB 7,5 | — | — |
| Rau diếp lá dài | E1 | 10 g / 0 ml | C5a | PSA 25 và GCB 2,5 | — | — |
| Hương thảo (68 % nước) | E6 | 5 g / 6 ml | C2 | PSA 25 | — | — |
| Hương thảo, tươi | E3a | 10 g / 2,5 ml | C2 | PSA 25 | — | — |
| Cây xô thơm, tươi | E6 | 5 g / 6 ml | C2 | PSA 25 | — | — |
| Cây xô thơm, tươi | E3a | 10 g / 2,5 ml | C5b | PSA 25 và GCB 7,5 | — | — |
| Cây củ hạ | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Bắp cải xoăn | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Hẹ | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Hẹ, đông khô | E7 | 2 g / 10 ml | C2 | PSA 25 | — | — |
| Bạc hà | E1 | 10 g / 0 ml | C5b | PSA 25 và GCB 7,5 | — | — |
| Gia vị | E7 | 2 g / 10 ml | C2 | PSA 25 | — | — |
| Rau bina | E1 | 10 g / 0 ml | C5b | PSA 25 và GCB 7,5 | — | — |
| Dâu tây | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Dâu tây, đông khô | E7 | 2 g / 10 ml | C2 | PSA 25 | C3a | PSA 50 |
| Khoai lang | E3a | 10 g / 2,5 ml | C2 | PSA 25 | — | — |
| Quả me (31 % nước) | E4 | 500 g / 850 ml | C2 | PSA 25 | — | — |
| Khoai môn | E3a | 10 g / 2,5 ml | C2 | PSA 25 | — | — |
| Chè | E7 | 2 g / 10 ml | C3b | PSA 75 | — | — |
| Húng tây, sấy khô | E7 | 2 g /10 ml | C2 | PSA 25 | C5b | PSA 25 và GCB 7,5 |
| Húng tây, tươi | E3a | 10 g / 2,5 ml | C5b | PSA 25 và GCB 7,5 | — | — |
| Húng tây, tươi (65 % nước) | E6 | 5 g / 6 ml | C2 | PSA 25 | — | — |
| Cà chua | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Cà chua, sấy khô (14,5 % nước) | E4 | 500 g / 850 ml | C2 | PSA 25 | — | — |
| Rau | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Đậu tằm (có vỏ quả) | E3a | 10 g / 2,5 ml | C2 | PSA 25 | — | — |
| Mầm lúa mì (47 % nước) | E3b | 10 g / 4,5 ml | C2 | PSA 25 | — | — |
| Rượu vang | E1 | 10 g / 0 ml | C2 | PSA 25 | — | — |
| Củ mỡ | E3a | 10 g / 2,5 ml | C2 | PSA 25 | — | — |
| CHÚ THÍCH a Thể tích tính bằng ml có nghĩa là nước thâm vào; NaOH 1 có nghĩa là thêm 0,6 ml NaOH (5 mol /l); NaOH 2 có nghĩa là thêm 0,2 ml NaOH (5 mol /l) b Các con số đề cập đến khối lượng tính bằng mg của PSA (Chất hấp thụ amin bậc 1 và bậc 2) và / hoặc GCB (Than đen than chì) trên mỗi ml dịch chiết | ||||||
6 Đánh giá kết quả
6.1 Định tính và định lượng
Các thông số xác định sự có mặt của chất phân tích trong dịch chiết mẫu, bao gồm:
- Thời gian lưu của chất phân tích (Rt) hoặc tỷ lệ thời gian lưu với chất nội chuẩn (Rt(A))/RT(ISTD)) thu được cùng một lần chạy;
- Trường hợp phát hiện bằng MS hoặc MS-MS, cường độ tương đối lần lượt của mảnh khối hoặc bước chuyển thường được ghi nhận (nhìn chung yêu cầu 2 bước chuyển SRM trong MS/MS và 3 ion trong MS), xem thêm [2], [3], [4];
- Hlnh dạng pic của chất phân tích.
Các thông số thu được của chất phân tích cần xác định trong dịch chiết mẫu được so sánh với những thông số thu được của thuốc BVTV trong dung dịch chuẩn. Để tăng mức độ khẳng định của chất phân tích, các phép đo khác có thể cần thiết như sử dụng điều kiện tách sắc ký khác hoặc đánh giá thêm m/z hoặc bước chuyển SRM. Để biết thêm thông tin về tiêu chuẩn xác nhận (ví dụ: độ lệch tối đa cho phép đối với tỷ lệ ion dùng những kỹ thuật MS khác nhau) xem hướng dẫn kiểm soát chất lượng EU được nêu trong tài liệu SANTE/11813/2017 [5]. Bảng A.1 đưa ra danh sách các chất nội chuẩn có thể sử dụng. Việc sử dụng nhiều hơn một nội chuẩn sẽ cung cấp một số thông tin dự phòng.
Sử dụng dung dịch chuẩn để kiểm tra độ tuyến tính và xác định phương trình đường chuẩn đối với từng chất phân tích. Việc dùng dung dịch chuẩn phù hợp nền mẫu sẽ được ưu tiên. Tuy nhiên, khi ước tính mức dư lượng của thuốc BVTV trong thực phẩm hoặc cho thấy không có sự hiện diện của chúng thì dung dịch chuẩn trong dung môi có thể được sử dụng. Dung dịch chuẩn trong dung môi cũng được sử dụng để định lượng nếu các thực nghiệm ban đầu cho thấy mọi hiệu ứng tăng hoặc giảm không có bất kỳ ảnh hưởng nào đáng kể đến kết quả thu được. Ngay khi phát hiện được các nồng độ dư lượng có liên quan (ví dụ, nghi ngờ vượt quá MRL), tốt nhất là sử dụng phép xác định chính xác hơn như: dùng chuẩn trong nền mẫu hoặc phương pháp thêm chuẩn.
CHÚ THÍCH: Hiệu ứng nền ảnh hưởng đến sự đáp ứng của các chất phân tích trong dịch chiết mẫu được so sánh với sự đáp ứng của dung dịch chuẩn trong dung môi tinh khiết.
Khoảng đường chuẩn nên phù hợp với các nồng độ dư lượng cần định lượng. Do đó, có thể cần phải xây dựng nhiều đường chuẩn từ các kết quả đo.
Tiêu chuẩn này bao gồm việc tùy chọn sử dụng chất chuẩn nội (ISTD) để định tính và định lượng. Tuy nhiên vẫn có thể định lượng không sử dụng ISTD. Khi không sử dụng ISTD, thể tích của pha axetonitril chính là thể tích của axetonitril được thêm vào trong mẫu (10 ml).
6.2 Hiệu chuẩn
Phương pháp phân tích được hiệu chuẩn theo CEN/TS 17061 hoặc hướng dẫn kiểm soát chất lượng của EU được nêu trong SANTE/11813/2017 [5]. Một quy trình hiệu chuẩn thích hợp nên được chọn từ một trong các tùy chọn định lượng Q1 đến Q7 trong A.7.
6.3 Tính toán nồng độ dư lượng
Phần khối lượng wA của mỗi chất phân tích phụ thuộc vào nồng độ khối lượng của mẫu trong dịch chiết sau cùng ![]() sau khi làm sạch (quy trình C0 đến C5) và nồng độ của chất trong dịch chiết này pA (xác định theo một trong các tùy chọn từ Q1 đến Q7 được nêu trong A.7). Diễn tả bằng mg/kg và được tính theo công thức (1).
sau khi làm sạch (quy trình C0 đến C5) và nồng độ của chất trong dịch chiết này pA (xác định theo một trong các tùy chọn từ Q1 đến Q7 được nêu trong A.7). Diễn tả bằng mg/kg và được tính theo công thức (1).

Với:
pA: nồng độ khối lượng của chất phân tích trong dịch chiết mẫu (tùy chọn Q, xem A.7.1.3, A.7.2.3, A.7.3.3 và A.7.5.3), μg/ml;
![]() : nồng độ khối lượng của mẫu trong dịch chiết sau cùng (quy trình C, xem A.4.1.3, A.4.2.3, A.4.3.3,...), g/ml.
: nồng độ khối lượng của mẫu trong dịch chiết sau cùng (quy trình C, xem A.4.1.3, A.4.2.3, A.4.3.3,...), g/ml.
6.4 Xác nhận giá trị sử dụng của phương pháp
Hiệu suất thu hồi thu được từ các thử nghiệm (các mức thêm chuẩn 0,01 mg/kg đến 0,25 mg/kg) thường từ 70 % đến 110 %.
Các nghiên cứu xác nhận giá trị sử dụng của phương pháp liên phòng đã bao gồm nhiều chất phân tích trên các thực phẩm đại diện (thường là dưa chuột, chanh, bột mì và nho khô). Hơn nữa, việc xác nhận giá trị sử dụng của phương pháp đã mở rộng ở nhiều phòng thí nghiệm. Tất cả dữ liệu đánh giá bởi những phòng thí nghiệm được xuất bản trong “Data Pool of the European Union Reference Laboratories” [6].
Hiệu lực của phương pháp được xác nhận cho bất kỳ sự kết hợp giữa loại thực phẩm và thuốc BVTV cụ thể nào nếu ít nhất hai phòng thí nghiệm tiến hành nghiên cứu đánh giá kiểm chứng độc lập với nền mẫu giống nhau ở 2 mức nồng độ giống nhau với ít nhất 5 lần lặp lại cho mỗi mức và thu được hiệu suất thu hồi từ 70 % đến 120 %. Hơn nữa độ lệch chuẩn phải nhỏ hơn hoặc bằng 20 % cho cả 2 mức thu hồi ở mỗi phòng thí nghiệm.
Bảng 7 đưa ra dữ liệu đánh giá được xác nhận của phương pháp cho những chất phân tích và nhóm thực phẩm đặc trưng.
Bảng 7 - Dữ liệu xác nhận giá trị sử dụng của phương pháp
| STT | Chất phân tích | CAS | Nhóm thực phẩm (xem [5]) | |||
| Hàm lượng nước cao | Hàm lượng nước và axit cao | Hàm lượng nước thấp và tinh bột cao | Hàm lượng nước thấp và lượng đường cao | |||
| 1. | 2,4-D | 94-75-7 | x | x | x | x |
| 2. | Acephate | 30 560-19-1 | x | x | x | x |
| 3. | Acetamiprid | 135 410-20-7 | x | x | x | x |
| 4. | Acetochlor | 34256-82-1 | x | x | x | x |
| 5. | Acrinathrin | 101 007-06-1 | x | x | x | x |
| 6. | Alachlor | 15972-60-8 | x | x | x | x |
| 7. | Aldicarb | 116-06-3 | x | x | x | x |
| 8. | Aldicarb sulfone | 1646-88-4 | x | x | x | x |
| 9. | Aldicarb sulfoxide | 1646-87-3 | x | x | x | x |
| 10. | Aldrin | 309-00-2 | x | x | x | x |
| 11. | Ametoctradin | 865318-97-4 | x | x | x | x |
| 12. | Ametryl | 834-12-8 | x | x | x | x |
| 13. | Amisulbrom | 348635-87-0 | x | x | x | x |
| 14. | Amitraz | 33089-61-1 | x | x | x | x |
| 15. | Anilofos | 64249-01-0 | x | x | x | x |
| 16. | Atrazine | 1912-24-9 | x | x | x | x |
| 17. | Avermectin B1a | 65 195-55-3 | x | x | x | x |
| 18. | Azadirachtin | 11141-17-6 | x | x | x | x |
| 19. | Azinphos-methyl | 86-50-0 | x | x | x | x |
| 20. | Azoxystrobin | 131 860-33-8 | x | x | x | x |
| 21. | Benalaxyl | 71 626-11-4 | x | x | x | x |
| 22. | Bensulfuron methyl | 83055-99-6 | x | x | x | x |
| 23. | Bifenthrin | 82 657-04-3 | x | x | x | x |
| 24. | Biphenyl | 92-52-4 | x | x | x | x |
| 25. | Bitertanol | 70 585-36-3 | x |
|
|
|
| 26. | Boscalid | 188 425-85-6 | x | x | x | x |
| 27. | Bromopropylate | 18 181-80-1 | x | x | x | x |
| 28. | Bromoxynil | 1 689-84-5 | x | x | x | x |
| 29. | Bromuconazole | 116 255-48-2 | x | x | x | x |
| 30. | Bupirimate | 41 483-43-6 | x | x | x | x |
| 31. | Buprofezin | 69 327-76-0 | x | x | x | x |
| 32. | Butachlor | 23184-66-9 | x | x | x | x |
| 33. | Captan | 133-06-2 | x | x | x | x |
| 34. | Carbaryl | 63-25-2 | x | x | x | x |
| 35. | Carbendazim | 10 605-21-7 | x | x | x | x |
| 36. | Carbofuran | 1 563-66-2 | x | x | x | x |
| 37. | Carbofuran, 3-hydroxy- | 16 655-82-6 | x | x | x | x |
| 38. | Carboxin | 5 234-68-4 | x | x | x | x |
| 39. | Carpropamid | 104030-54-8 | x | x | x | x |
| 40. | Carvacrol | 499-75-2 | x | x | x | x |
| 41. | Chlorantraniliprole | 500008-45-7 | x | x | x | x |
| 42. | Chlordane | 57-74-9 | x | x | x | x |
| 43. | Chlorfenapyr | 122 453-73-0 | x | x | x | x |
| 44. | Chlorfenvinphos | 470-90-6 | x |
|
|
|
| 45. | Chlorfluazuron | 71422-67-8 | x | x | x | x |
| 46. | Chlorimuron ethyl | 90982-32-4 | x | x | x | x |
| 47. | Chlorpropham | 101-21-3 | x |
|
|
|
| 48. | Chlorpyrifos (ethyl) | 2 921-88-2 | x | x |
|
|
| 49. | Chlorpyrifos-methyl | 5 598-13-0 | x | x | x | x |
| 50. | Chlorthal-dimethyl | 1 861-32-1 | x | x | x | x |
| 51. | Chromafenozide | 143807-66-3 | x | x | x | x |
| 52. | Clofentezine | 74 115-24-5 | x | x | x | x |
| 53. | Clomazone | 81 777-89-1 | x | x | x | x |
| 54. | Clothianidin | 210 880-92-5 | x | x | x | x |
| 55. | Cyantraniliprole | 736994-63-1 | x | x | x | x |
| 56. | Cyazofamid | 120 116-88-3 | x | x | x | x |
| 57. | Cyclosulfamuron | 136849-15-5 | x | x | x | x |
| 58. | Cyflufenamid | 180409-60-3 | x | x | x | x |
| 59. | Cyflumetofen | 400882-07-7 | x | x | x | x |
| 60. | Cyfluthrin | 68 359-37-5 | x | x |
|
|
| 61. | Cyhalofop- butyl | 122008-85-9 | x | x | x | x |
| 62. | Cyhalothrin, lambda- | 91 465-08-6 | x | x |
|
|
| 63. | Cymoxanil | 57 966-95-7 | x | x | x | x |
| 64. | Cypermethrin | 52 315-07-8 | x | x |
|
|
| 65. | Cyproconazole | 94 361-06-5 | x | x | x | x |
| 66. | Cyprodinil | 121 552-61-2 | x | x | x | x |
| 67. | DDD, p,p- | 72-54-8 | x |
|
|
|
| 68. | DDE, p,p- | 72-55-9 | x |
|
|
|
| 69. | DDT | 50-29-3 | x | x | x | x |
| 70. | DDT, o,p' | 789-02-06 | x | x | x | x |
| 71. | DDT, p,p' | 50-29-3 | x | x | x | x |
| 72. | Deltamethrin | 52 918-63-5 | x |
|
|
|
| 73. | Demeton-S-methyl sulphon | 17 040-19-6 | x | x | x | x |
| 74. | Diazinon | 333-41-5 | x |
|
|
|
| 75. | Dichlorprop-P | 15 165-67-0 | x | x | x | x |
| 76. | Dichlorvos | 62-73-7 | x | x | x | x |
| 77. | Dicloran | 99-30-9 | x | x | x | x |
| 78. | Dicofol | 115-32-2 | x | x | x | x |
| 79. | Dicrotophos | 3 735-78-3 | x | x | x | x |
| 80. | Dieldrin | 60-57-1 | x | x | x | x |
| 81. | Diethofencarb | 87 130-20-9 | x | x | x | x |
| 82. | Difenoconazole | 119 446-68-3 | x | x | x | x |
| 83. | Diflubenzuron | 35 367-38-5 | x | x | x |
|
| 84. | Diflufenican | 83164-33-4 | x | x | x | x |
| 85. | Dimethoate | 60-51-5 | x | x | x | x |
| 86. | Dimethomorph | 110 488-70-5 | x | x | x |
|
| 87. | Diniconazole | 83 657-24-3 | x | x | x | x |
| 88. | Dinotefuran | 165252-70-0 | x | x | x | x |
| 89. | Diphenylamine | 122-39-4 | x | x |
| X |
| 90. | Disulfoton | 298-04-4 | x | x | x | x |
| 91. | Diuron | 330-54-1 | x | x | x | x |
| 92. | Edifenphos | 17109-49-8 | x | x | x | x |
| 93. | Emamectin benzoate | 119791-41-2 | x | x | x | x |
| 94. | Endosulfan sulfate | 1 031-07-8 | x | x | x | x |
| 95. | Endosulfan, alpha- | 33 213-66-0 | x | x | x | x |
| 96. | Endosulfan, beta- | 33 213-65-9 | x | x | x | x |
| 97. | Endrin | 72-20-8 | x | x | x | x |
| 98. | Epoxiconazol | 133 855-98-8 | x | x | x | x |
| 99. | Ethaboxam | 162650-77-3 | x | x | x | x |
| 100. | Ethion | 563-12-2 | x | x | x | x |
| 101. | Ethiprole | 181587-01-9 | x | x | x | x |
| 102. | Ethofumesate | 26 225-79-6 | x | x | x | x |
| 103. | Ethoprophos | 13 194-48-4 | x | x | x | x |
| 104. | Etofenprox | 80 844-07-1 | x | x | x | x |
| 105. | Etoxazole | 153233-91-1 | x | x | x | x |
| 106. | Etridiazol | 2 593-15-9 | x | x | x | x |
| 107. | Famoxadone | 131 807-57-3 | x | x | x | x |
| 108. | Fenamidone | 161 326-34-7 | x | x | x | x |
| 109. | Fenamiphos | 22224-92-6 | x | x | x | x |
| 110. | Fenamiphos sulfone | 31972-44-8 | x | x | x | x |
| 111. | Fenarimol | 60 168-88-9 | x | x | x | x |
| 112. | Fenazaquin | 120 928-09-8 | x | x | x | x |
| 113. | Fenbuconazole | 114 369-43-6 | x | x | x | x |
| 114. | Fenhexamid | 126 833-17-8 | x | x | x | x |
| 115. | Fenitrothion | 122-14-5 | x | x | x | x |
| 116. | Fenobucarb | 3766-81-2 | x | x | x | x |
| 117. | Fenoxanil | 115852-48-7 | x | x | x | x |
| 118. | Fenoxycarb | 79 127-80-3 | x | x | x | x |
| 119. | Fenpropathrin | 64 257-84-7 | x | x | x | x |
| 120. | Fenpropidin | 67 306-00-7 | x | x | x | x |
| 121. | Fenpropimorph | 67 306-03-0 | x | x | x | x |
| 122. | Fenpyroximate | 111 812-58-9 | x | x | x | x |
| 123. | Fenthion | 55-38-9 | x | x | x | x |
| 124. | Fenvalerate | 51 630-58-1 | x | x | x | x |
| 125. | Fipronil | 120 068-37-3 | x | x | x | x |
| 126. | Fipronil sulfone | 120068-36-2 | x | x | x | x |
| 127. | Flonicamid | 158 062-67-0 | x | x | x | x |
| 128. | Fluazifop | 69 335-91-7 | x | x | x | x |
| 129. | Fluazifop-P | 83 066-88-0 | x | x | x | x |
| 130. | Fluazinam | 79622-59-6 | x | x | x | x |
| 131. | Flucetosulfuron | 412928-75-7 | x | x | x | x |
| 132. | Flucythrinate | 70124-77-5 | x | x | x | x |
| 133. | Fludioxonil | 131 341-86-1 | x | x | x | x |
| 134. | Flufenoxuron | 101 463-69-8 | x | x | x | x |
| 135. | Fluometuron | 2164-17-2 | x | x | x | x |
| 136. | Fluopicolid | 239 110-15-7 | x | x | x | x |
| 137. | Fluopyram | 658066-35-4 | x | x | x | x |
| 138. | Fluoxastrobin | 361377-29-9 | x | x | x | x |
| 139. | Fluquinconazole | 136 426-54-5 | x |
|
|
|
| 140. | Flusilazole | 85 509-19-9 | x | x | x | x |
| 141. | Flutolanil | 66 332-96-5 | x | x | x | x |
| 142. | Flutriafol | 76 674-21-0 | x | x | x | x |
| 143. | Fluvalinate | 69 409-94-5 | x |
|
|
|
| 144. | Folpet | 133-07-3 | x | x | x | x |
| 145. | Forchlorfenuron | 68157-60-8 | x | x | x | x |
| 146. | Formetanate | 22 259-30-9 | x | x | x | x |
| 147. | Fosthiazate | 98886-44-3 | x | x | x | x |
| 148. | Fuberidazole | 3878-19-1 | x | x | x | x |
| 149. | Halosulfuron methyl | 100784-20-1 | x | x | x | x |
| 150. | Haloxyfop-P | 95 977-29-0 | x | x | x | x |
| 151. | HCH | 608-73-1 | x | x | x | x |
| 152. | HCH, alpha | 319-84-6 | x | x | x | x |
| 153. | HCH, beta | 319-85-7 | x | x | x | x |
| 154. | HCH, gamma | 58-89-9 | x | x | x | x |
| 155. | Heptachlor | 76-44-8 | x | x | x | x |
| 156. | Hexachlorobenzene (HCB) | 118-74-1 | x |
|
|
|
| 157. | Hexaconazole | 79 983-71-4 | x | x | x | x |
| 158. | Hexythiazox | 78 587-05-0 | x | x | x | x |
| 159. | Imazalil | 35 554-44-0 | x | x | x | x |
| 160. | Imibenconazole | 86598-92-7 | x | x | x | x |
| 161. | Imidacloprid | 138 261-41-3 | x | x | x | x |
| 162. | Indaziflam | 950782-86-2 | x | x | x | x |
| 163. | Indoxacarb | 173 584-44-6 | x | x | x | x |
| 164. | Ipconazole | 125225-28-7 | x | x | x | x |
| 165. | Iprobenfos | 26087-47-8 | x | x | x | x |
| 166. | Iprodione | 36 734-19-7 | x | x | x | x |
| 167. | Iprovalicarb | 140 923-17-7 | x | x | x | x |
| 168. | Isofenphos-methyl | 99 675-03-3 | x | x | x | x |
| 169. | Isoprocarb | 2631-40-5 | x | x | x | x |
| 170. | Isoprothiolane | 50512-35-1 | x | x | x | x |
| 171. | Isoxaben | 82558-50-7 | x | x | x | x |
| 172. | Isoxathion | 18854-01-8 | x | x | x | x |
| 173. | Kresoxim-methyl | 143 390-89-0 | x | x |
|
|
| 174. | Lenacil | 2164-08-1 | x | x | x | x |
| 175. | Linuron | 330-55-2 | x | x | x | x |
| 176. | Lufenuron | 103 055-07-8 | x | x |
|
|
| 177. | Malaoxon | 1 634-78-2 | x | x | x | x |
| 178. | Malathion | 121-75-5 | x | x | x | x |
| 179. | Mandipropamid | 374 726-62-2 | x | x | x | x |
| 180. | Matrine | 519-02-8 | x | x | x | x |
| 181. | MCPA | 94-74-6 | x | x | x | x |
| 182. | Mepanipyrim | 110 235-47-7 | x | x | x | x |
| 183. | Metaflumizone | 139968-49-3 | x | x | x | x |
| 184. | Metalaxyl | 57 837-19-1 | x | x | x | x |
| 185. | Metalaxyl-M | 70630-17-0 | x | x | x | x |
| 186. | Metamitron | 41 394-05-2 | x | x | x | x |
| 187. | Metazachlor | 67129-08-2 | x | x | x | x |
| 188. | Metazosulfuron | 868680-84-6 | x | x | x | x |
| 189. | Metconazole | 125116-23-6 | x | x | x | x |
| 190. | Methabenzthiazuron | 18691-97-9 | x | x | x | x |
| 191. | Methacrifos | 62610-77-9 | x | x | x | x |
| 192. | Methamidophos | 10 265-92-6 | x | x | x | x |
| 193. | Methidathion | 950-37-8 | x | x | x | x |
| 194. | Methiocarb | 2 032-65-7 | x | x | x | x |
| 195. | Methiocarb-sulfone | 2 179-25-1 | x |
| x | x |
| 196. | Methiocarb-sulfoxid | 2 635-10-1 | x | x | x | x |
| 197. | Methomyl | 16 752-77-5 | x | x | x | x |
| 198. | Methoxyfenozide | 161 050-58-4 | x | x | x | x |
| 199. | Metolachlor (S-) | 51 218-45-2 | x | x | x | x |
| 200. | Metolcarb | 1129-41-5 | x | x | x | x |
| 201. | Metrafenone | 220 899-03-6 | x | x | x | x |
| 202. | Metribuzin | 21 087-64-9 | x | x | x | x |
| 203. | Molinate | 2212-67-1 | x | x | x | x |
| 204. | Monocrotophos | 6 923-22-4 | x | x | x | x |
| 205. | Monolinuron | 1746-81-2 | x | x | x | x |
| 206. | Monuron | 150-68-5 | x | x | x | x |
| 207. | Myclobutanil | 88 671-89-0 | x | x |
|
|
| 208. | Napropamide | 15299-99-7 | x | x | x | x |
| 209. | Nitenpyram | 150824-47-8 | x | x | x | x |
| 210. | Novaluron | 116714-46-6 | x | x | x | x |
| 211. | Omethoate | 1 113-02-6 | x | x | x | x |
| 212. | Orthosulfamuron | 213464-77-8 | x | x | x | x |
| 213. | Oxadiargyl | 39807-15-3 | x | x | x | x |
| 214. | Oxadiazon | 19 666-30-9 | x |
|
|
|
| 215. | Oxadixyl | 77 732-09-3 | x | x | x | x |
| 216. | Oxamyl | 23 135-22-0 | x | x | x | x |
| 217. | Oxycarboxin | 5259-88-1 | x | x | x | x |
| 218. | Oxydemeton -methyl | 301-12-2 | x | x | x | x |
| 219. | Oxyfluorfen | 42874-03-3 | x | x | x | x |
| 220. | Paclobutrazol | 76738-62-0 | x | x | x | x |
| 221. | Paraoxon-methyl | 950-35-6 | x | x | x | x |
| 222. | Parathion | 56-38-2 | x |
|
|
|
| 223. | Parathion-methyl | 298-00-0 | x |
|
|
|
| 224. | Penconazole | 66 246-88-6 | x | x | x | x |
| 225. | Pencycuron | 66 063-05-6 | x | x | x | x |
| 226. | Pendimethalin | 40 487-42-1 | x | x | x | x |
| 227. | Penoxsulam | 219714-96-2 | x | x | x | x |
| 228. | Permethrin | 52 645-53-1 | x |
|
|
|
| 229. | Phenmedipham | 13 684-63-4 | x | x | x | x |
| 230. | Phenthoate | 2597-03-7 | x | x | x | x |
| 231. | Phenylphenol, 2- | 90-43-7 | x | x | x | x |
| 232. | Phosalone | 2 310-17-0 | x |
|
|
|
| 233. | Phosmet | 732-11-6 | x |
|
|
|
| 234. | Phosphamidon | 13171-21-6 | x | x | x | x |
| 235. | Phoxim | 14 816-18-3 | x | x | x | x |
| 236. | Picolinafen | 137641-05-5 | x | x | x | x |
| 237. | Piperonyl butoxide | 51-03-6 | x | x | x | x |
| 238. | Pirimicarb | 23 103-98-2 | x | x | x | x |
| 239. | Pirimicarb, desmethyl- | 30 614-22-3 | x | x | x | x |
| 240. | Pirimiphos-methyl | 29 232-93-7 | x | x | x | x |
| 241. | Prochloraz | 67747-09-5 | x | x | x | x |
| 242. | Procymidone | 32 809-16-8 | x | x |
|
|
| 243. | Profenofos | 41 198-08-7 | x | x | x | x |
| 244. | Profoxydim | 139001-49-3 | x | x | x | x |
| 245. | Propachlor | 1918-16-7 | x | x | x | x |
| 246. | Propamocarb hydrocloride | 24 579-73-5 | x | x | x | x |
| 247. | Propanil | 709-98-8 | x | x | x | x |
| 248. | Propaquizafop | 111479-05-1 | x | x | x | x |
| 249. | Propargite | 2 312-35-8 | x | x | x | x |
| 250. | Propiconazole | 60 207-90-1 | x | x | x | x |
| 251. | Propisochlor | 86763-47-5 | x | x | x | x |
| 252. | Propoxur | 114-26-1 | x | x | x | x |
| 253. | Propyrisulfuron | 570415-88-2 | x | x | x | x |
| 254. | Propyzamide | 23 950-58-5 | x | x | x | x |
| 255. | Prosulfocarb | 52 888-80-9 | x | x | x | x |
| 256. | Prothiofos | 34 643-46-4 | x |
|
|
|
| 257. | Pymetrozine | 123 312-89-0 |
|
| x | x |
| 258. | Pyraclofos | 89784-60-1 | x | x | x | x |
| 259. | Pyraclostrobin | 175 013-18-0 | x | x | x | x |
| 260. | Pyrazosulfuron- ethyl | 93697-74-6 | x | x | x | x |
| 261. | Pyrethrin I | 121-21-1 | x | x | x | x |
| 262. | Pyrethrin II | 121-29-9 | x | x | x | x |
| 263. | Pyridaben | 96 489-71-3 | x | x |
|
|
| 264. | Pyridalyl | 179101-81-6 | x | x | x | x |
| 265. | Pyridaphenthion | 119-12-0 | x | x | x | x |
| 266. | Pyrifenox | 88 283-41-4 | x | x | x | x |
| 267. | Pyrimethanil | 53 112-28-0 | x | x | x | x |
| 268. | Pyriproxyfen | 95 737-68-1 | x | x | x | x |
| 269. | Quinalphos | 13 593-03-8 | x | x | x | x |
| 270. | Quinclorac | 84087-01-4 | x | x | x | x |
| 271. | Quinoxyfen | 124 495-18-7 | x | x | x | x |
| 272. | Quintozene (PCNB) | 82-68-8 | x | x | x | x |
| 273. | Quizalofop ethyl | 13593-08-3 | x | x | x | x |
| 274. | Rotenone | 83-79-4 | x | x | x | x |
| 275. | Sethoxydim | 74051-80-2 | x | x | x | x |
| 276. | S-Metolachior | 87392-12-9 | x | x | x | x |
| 277. | Spinetoram | 187166-40-1 | x | x | x | x |
| 278. | Spinosad | 168316-95-8 | x | x | x | x |
| 279. | Spinosyn A | 131 929-60-7 | x | x | x | x |
| 280. | Spinosyn D | 131 929-63-0 | x | x | x | x |
| 281. | Spirodiclofen | 148 477-71-8 | x | x | x | x |
| 282. | Spiromesifen | 283594-90-1 | x | x | x | x |
| 283. | Spirotetramat | 203313-25-1 | x | x | x | x |
| 284. | Spiroxamine | 118 134-30-8 | x | x | x | x |
| 285. | Sulfoxaflor | 946578-00-3 | x | x | x | x |
| 286. | Tebuconazole | 107 534-96-3 | x | x | x | x |
| 287. | Tebufenozide | 112 410-23-8 | x | x | x | x |
| 288. | Tebufenpyrad | 119 168-77-3 | x | x | x | x |
| 289. | Tebuthiuron | 34014-18-1 | x | x | x | x |
| 290. | Teflubenzuron | 83 121-18-0 | x |
|
|
|
| 291. | Tefluthrin | 79 538-32-2 | x | x | x | x |
| 292. | Tepraloxydim | 149 979-41-9 | x | x | x | x |
| 293. | Terbuthylazine | 5915-41-3 | x | x | x | x |
| 294. | Tetraconazole | 112 281-77-3 | x | x | x | x |
| 295. | Tetradifon | 116-29-0 | x | x | x | x |
| 296. | Tetramethrin | 51 384-90-4 | x |
|
|
|
| 297. | Thiabendazole | 148-79-8 | x | x | x | x |
| 298. | Thiacloprid | 111 988-49-9 | x | x | x | x |
| 299. | Thiamethoxam | 153 719-23-4 | x | x | x | x |
| 300. | Thiobencarb | 28249-77-6 | x | x | x | x |
| 301. | Tolclofos-methyl | 57 018-04-9 | x | x | x | x |
| 302. | Tolylfluanid | 731-27-1 | x | x |
| x |
| 303. | Triadimefon | 43 121-43-3 | x | x | x | x |
| 304. | Triadimenol | 55 219-65-3 | x |
|
| x |
| 305. | Triasulfuron | 82097-50-5 | x | x | x | x |
| 306. | Triazophos | 24 017-47-8 | x |
|
|
|
| 307. | Trichlorfon | 52-68-6 | x | x | x | x |
| 308. | Tricyclazole | 41 814-78-2 | x |
|
|
|
| 309. | Trifloxystrobin | 141 517-21-7 | x | x | x | x |
| 310. | Triflumizole | 68 694-11-1 | x | x | x | x |
| 311. | Triflumuron | 64 628-44-0 | x | x | x | x |
| 312. | Trifluralin | 1 582-09-8 | x |
|
|
|
| 313. | Triticonazole | 131983-72-7 | x | x | x | x |
| 314. | Uniconazole | 83657-22-1 | x | x | x | x |
| 315. | Vinclozolin | 50 471-44-8 | x | x | x | x |
| 316. | Zoxamide | 156 052-68-5 | x | x | x | x |
7 Phép thử khẳng định
Để khẳng định kết quả định lượng, cần phân tích lần 2 nếu nghi ngờ kết quả lần 1 quá lớn. Thông tin thêm về việc xác nhận được nêu trong [5].
8 Độ chụm
Chi tiết về thử nghiệm liên phòng của độ chính xác của phương pháp được tóm tắt trong CEN/TR 17063. Các giá trị thu được từ thử nghiệm liên phòng có thể không áp dụng được cho các khoảng nồng độ thuốc BVTV và những nền mẫu khác với CEN/TR.17063.
9 Báo cáo thử nghiệm
Báo cáo thử nghiệm nên chứa ít nhất các thông tin sau đây:
- mọi thông tin cần thiết để nhận biết về mẫu thử;
- tham khảo tiêu chuẩn này;
- kết quả và các đơn vị trong đó kết quả đã được thể hiện;
- ngày và phương pháp lấy mẫu (nếu có thể);
- ngày nhận mẫu ở phòng thí nghiệm;
- ngày thử nghiệm;
- bất kỳ quan sát cụ thể nào được thực hiện trong quá trình thử nghiệm;
- tất cả các chi tiết không quy định trong tiêu chuẩn này hoặc những điều được coi là tùy chọn có thể ảnh hưởng đến kết quả.
Phụ lục A
(Quy định)
Mô tả các quy trình
A.1 Thuốc thử dùng trong các mô đun chiết (E), làm sạch (C) và ổn định (S)
A.1.1 Yêu cầu chung và yêu cầu về an toàn
Chỉ sử dụng các thuốc thử thuộc loại tinh khiết phân tích, trừ khi có quy định khác. Tránh làm nhiễm bẩn nước, dung môi và các muối vô cơ,...
A.1.2 Dung dịch nội chuẩn và chuẩn kiểm soát chất lượng trong axetonitril (nồng độ p 10 µg/ml đến 50 µg/ml)
Bảng A.1 liệt kê danh sách các chất nội chuẩn (ISTD) và chuẩn kiểm soát chất lượng (QC) có thể được sử dụng trong tiêu chuẩn này. Các giá trị nồng độ gợi ý (CISTD) được liệt kê đề cập đến các dung dịch ISTD cần được thêm vào ở bước chiết đầu tiên. Dung dịch này cần được pha loãng thích hợp ![]() để sử dụng cho việc chuẩn bị các dung dịch chuẩn
để sử dụng cho việc chuẩn bị các dung dịch chuẩn
A.1.3 Axetonitril, C2H3N, loại dùng cho HPLC.
A.1.4 Magie sulfat khan, MgSO4, dạng hạt.
Loại bỏ Phthalat bằng cách nung trong lò nung ở nhiệt độ 550 °C (qua đêm).
A.1.5 Sodium clorua, NaCl.
A.1.6 Disodium hydrogencitrat sesquihydrat, HOC(COOH)(CH2COONa)2.1,5H2O.
A.1.7 Trisodium citrat dihydrat, HOC(COONa)(CH2COONa)2.2H2O.
A.1.8 Hỗn hợp muối đệm cho quá trình chiết và phân bố thứ 2:
Cân (4 ± 0,2) g magie sulfat khan (A.1.4), (1 ± 0,05) g sodium clorua (A.1.5), (1 ± 0,05) g trisodium citrat dihydrat (A.1.7) và (0,5 ± 0,03) g disodium hydrogencitrat sesquihydrat (A.1.6) vào trong ống ly tâm (A.2.4). Khối lượng này dùng cho khoảng 10 ml nước trong mẫu. Có thể sử dụng các hỗn hợp thương mại cùng thành phần
CHÚ THÍCH: Nên chuẩn bị đủ số lượng hỗn hợp muối-đệm trước để quá trình chiết có thể được thực hiện nhanh chóng mà không bị gián đoạn.
A.1.9 Dung dịch sodium hydroxit, NaOH, nồng độ 5 mol/l:
Hòa tan 2 g sodium hydroxit trong khoảng 5 ml nước và pha loãng thành 10 ml.
A.1.10 Nước lạnh (nhiệt độ nhỏ hơn 4 °C).
A.1.11 Đá khô.
A.1.12 Nitơ lỏng.
A.1.13. Axit sulfuric, nồng độ 2,5 mol/l (5 N):
Hòa tan 25 g axit sulfuric đậm đặc (18 mol/l) trong 50 ml nước và pha loãng thành 100 ml.
A.1.14 Magie sulfat khan, MgSO4, dạng bột.
Loại bỏ Phthalat bằng cách nung trong lò nung ở nhiệt độ 550 °C (qua đêm).
Bảng A.1 - Các chất nội chuẩn (ISTD) và chuẩn kiểm soát chất lượng (QC) có thể được sử dụng
| Tên hợp chất | Log P (hệ số phân bố octanol-nước) | Số nguyên tử clo | Nồng độ CISTD (µg/ml)a | GC | LC | ||||
| ECD | NPD | FPD | MS/MS or MSD EI (+) | MS/MS ESI (+) | MS/MS ESI (-) | ||||
| Nội chuẩn | |||||||||
| PCB 18 c,d | 5,55 | 3 | 50 | +++ | - | - | ++ | - | - |
| PCB 28 c,d | 5,62 | 3 | 50 | +++ | - | - | ++ | - | - |
| PCB 52 c,d | 6,09 | 4 | 50 | +++ | - | - | ++ | - | - |
| Triphenylphosphate d | 4,59 | - | 20 | - | +++ | +++ | +++ | +++ | - |
| Tris-(1,3-dichlorisopropyl)-phosphate | 3,65 | 6 | 50 | +++ | +++ | +++ | +++ | +++ | + |
| Triphenylmethane4 | 5,37 | - | 10 | - | - | - | +++ | - | - |
| 2,4-D 13C6 (vòng) | Phụ thuộc pH | 2 | 10 | - | - | - | - | - | +++ |
| Chlorpyrifos D10 (diethyl D10) 4 | 4,7 | 3 | 10 | +++ | +++ | +++ | +++ | +++ | - |
| Diuron D6 (dimethyl D6) | 2,9 | 2 | 10 | - | - | - | - | +++ | - |
| Diazinon D10 (diethyl D10) | 3,8 | - | 20 | ++ | +++ | +++ | +++ | +++ | - |
| Metalaxyl D6 (dimethyl D6) | 1,65 | 0 | 10 | - | ++ | - | +++ | +++ | - |
| N,N'-Bis-4-nitrophenyl) urea (BNPU)e | 3,76 | - | 10 | - | - | - | - | - | +++ |
| Chuẩn QC (có thể được pha cùng hỗn hợp với các chất ISTD khác hoặc thêm vào các giai đoạn phân tích khác nhau để phát hiện và xác định nguyên nhân gây sai lệch) | |||||||||
| PCB 138 d,f | 6,83 | 6 | 50 | +++ | - | - | +++ | - | - |
| PCB 153 d,f | 7,75 | 6 | 50 | + ++ | - | - | +++ | - | - |
| Anthracen (or D10 Anthracen) g | 4,45 | - | 100 | - | - | - | - | - | - |
| CHÚ THÍCH: a hệ số phân bố octanol-nước b nồng độ đề xuất; dung môi: axetonitril c không thích hợp nếu GCB được dùng làm sạch d không thích hợp khi chiết nông sản có hàm lượng dầu cao dùng quy trình E6 e thành phần của nicarbazin f Tỉ lệ hiệu suất thu hồi của PCB 138 và 153 giảm khi hàm lượng dầu trong mẫu cao. Nếu hiệu suất thu hồi của những nội chuẩn này lớn hơn 70 %, thì không xảy ra mất các thuốc BVTV tan trong dầu. g Nếu hiệu suất thu hồi của anthracen lớn hơn 70 %, thì không xảy ra mất các thuốc BVTV khi làm sạch với GCB +++ phát hiện rất tốt ++ phát hiện tốt + phát hiện kém - không áp dụng | |||||||||
A.1.15 Chất hấp phụ amin bậc 1 và bậc 2.
Những chất hấp phụ amin khác có thể được sử dụng, nhưng cần nghiên cứu để đảm bảo sự tương đương, đặc biệt liên quan đến sự mất mát của chất phân tích và giá trị pH của dịch chiết sau cùng.
A.1.16 Chất hấp phụ C18, chất hấp phụ pha đảo C18.
A.1.17 Chất hấp phụ graphit carbon (GCB).
Những chất hấp phụ graphit carbon khác có thể được sử dụng, nhưng cần nghiên cứu để đảm bảo sự tương đương, đặc biệt liên quan đến sự mất mát của chất phân tích.
A.1.18 Dung dịch axit formic trong axetonitril, 5 ml axit formic/ 100 ml:
Pha loãng 0,5 ml axit formic (lớn hơn hoặc bằng 95 %) đến 10 ml với axetonitrile.
A.1.19 Nước, H2O, loại 1 theo TCVN 4851:1989 (ISO 3696-1987) Nước dùng để phân tích trong phòng thí nghiệm - Yêu cầu kỹ thuật và phương pháp thử.
A.2 Dụng cụ dùng trong các mô đun chiết (E), làm sạch (C) và ổn định (S)
Sử dụng các dụng cụ của phòng thử nghiệm thông thường cụ thể sau:
A.2.1 Ống ly tâm có nắp vặn, 50 ml:
Ví dụ: a) ống ly tâm 50 ml làm bằng poly-tetrafluoroethylen với nắp vặn hoặc b) ống ly tâm polypropylen 50 ml dùng một lần với nắp vặn.
A.2.2 Bộ phân phối dung môi 10 ml dùng cho axetonitril, được dùng để định lượng dung môi chiết.
A.2.3 Pipet tự động, thích hợp cho việc lấy các thể tích 10 µl đến 100 µl, 200 µl đến 1000 µl và 1 ml đến 10 ml, hoặc pipet thủy tinh chia độ 10 ml.
A.2.4 Ống ly tâm dùng một lần polypropylen với nắp vặn, 10 ml hoặc 12 ml.
A.2.5 Máy lắc, máy lắc ngang, dọc, quỹ đạo, ít nhất 200 vòng/min.
A.2.6 Máy ly tâm, thích hợp với các ống ly tâm được sử dụng trong quy trình (A.2.1, A.2.4) và có khả năng đạt tốc độ tối thiểu 3 000 vòng/min.
A.2.7 Thiết bị phân tán tốc độ cao, đường kính của các bộ phận phân tán phải vừa với các lỗ của ống ly tâm (A.2.1) được sử dụng.
A.2.8 Máy nghiền mẫu.
A.2.9 Máy lắc nhiệt, ví dụ: bể nước lắc hoặc AGTTAX SR1 CP571.
A.2.10 Tủ đông, hoạt động ở nhiệt độ âm 18 °C đến âm 25 °C.
A.2.11 Vial, 1,5 ml, thích hợp cho bơm mẫu tự động GC và LC, nếu cần thiết dùng micro - insert.
A.2.12 Lọ thủy tinh có nắp vặn, 10 ml hoặc 20 ml, dùng để lưu giữ lượng dư dịch chiết sau cùng, nếu cần thiết.
A.2.13 Máy lắc vortex.
A.3 Mô tả các quy trình chiết (E)
A.3.1 Quy trình E1: Chiết 10 g mẫu thử không thêm nước dùng axetonitril
A.3.1.1 Nguyên tắc
Quy trình chiết xuất này được sử dụng cho nguyên liệu thực vật và thực phẩm chứa lớn hơn 80 % nước, như quả, rau và nước ép. Bảng 6 nêu ra các thực phẩm được chiết xuất tốt nhất với quy trình chiết này.
Mẫu đã đồng nhất được chiết trong điều kiện đông lạnh (nếu có thể) với axetonitril. Sau khi thêm magie sulfat khan, sodium clorua và muối đệm citrat (pH 5 đến pH 5,5), hỗn hợp này được lắc mạnh và ly tâm để tách pha. Lớp dung dịch của pha hữu cơ được tách và làm sạch theo quy trình làm sạch (quy trình C) nếu cần thiết.
A.3.1.2 Cách tiến hành
A.3.1.2.1 Phần mẫu thử
Chuyển một phần mẫu thử đại diện cho mẫu (10 ± 0,1) g (mmẫu) đã được đồng nhất vào ống ly tâm 50 ml (A.2.1).
A.3.1.2.2 Thêm nội chuẩn (ISTD)
Thêm một thể tích nhỏ xác định của dung dịch ISTD (A.1.2) (![]() ví dụ: 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
ví dụ: 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
A.3.1.2.3. Bước chiết mẫu đầu tiên
Thêm 10 ml axetonitril (A.1.3) (Vchiết). Đóng chặt nắp của ống ly tâm và lắc mạnh mẫu ở nhiệt độ phòng từ 1 min đến 3 min hoặc 15 min đối với mẫu đông lạnh, dùng máy lắc (A.2.5) nếu cần thiết.
Mẫu nên được chiết ở trạng thái đông lạnh hoặc đang tan. Nếu mẫu được chiết ở nhiệt độ môi trường, cần đảm bảo rằng không có sự phân hủy đáng kể của những thuốc BVTV phân tích. Thời gian chiết có thể kéo dài nếu không có sự ảnh hưởng đáng kể đến hiệu suất thu hồi.
Nếu mức độ đồng nhất của mẫu không đủ, việc chiết xuất có thể được hỗ trợ bởi thiết bị phân tán tốc độ cao (A.2.7).Trong trường hợp này việc thêm ISTD trước bước phân tán là bắt buộc. Bộ phận phân tán được nhúng vào trong mẫu/hỗn hợp axetonitril và nghiền mẫu khoảng 2 min ở tốc độ cao. Bộ phận phân tán phải được làm sạch hoàn toàn trước khi sử dụng cho mẫu tiếp theo để tránh nhiễm bẩn.
A.3.1.2.4 Bước chiết và phân bổ thứ hai
Thêm hỗn hợp muối đệm (A.1.8) vào phần dung dịch thu được từ A.3.1.2.3. Đóng chặt nắp, lắc mạnh ngay trong 1 min bằng tay hoặc 3 min bằng máy lắc (A.2.5) và ly tâm trong 5 min ở tốc độ lớn hơn 3 000 vòng/min.
Không để chậm trễ tách lớp axetonitril phía trên và chuyển dịch chiết thô thu được sang các quy trình làm sạch C.
Khi có nước, magie sulfat có khuynh hướng vón cục và cứng rất nhanh. Điều này có thể tránh được bằng cách lắc mạnh trong vài giây ngay sau khi thêm hỗn hợp muối vào ống ly tâm. Bước chiết 1 min hoặc 3 min còn lại có thể được tiến hành song song sau khi muối được thêm vào tất cả các mẫu.
A.3.1.3 Tính toán
Nồng độ khối lượng của mẫu trong dịch chiết thô ![]() cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết.
cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. ![]() thường được cho bằng g/ml và được tính bởi công thức A.1:
thường được cho bằng g/ml và được tính bởi công thức A.1:
![]() (A.1)
(A.1)
Trong đó:
mmẫu: khối lượng phần mẫu thử, g;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
Tính nồng độ khối lượng của ISTD ![]() trong dịch chiết thô với công thức A.2:
trong dịch chiết thô với công thức A.2:
![]() (A.2)
(A.2)
Trong đó:
![]() : nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
: nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
![]() : thể tích ISTD thêm vào mẫu, ml;
: thể tích ISTD thêm vào mẫu, ml;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
A.3.1.4 Sơ đồ của quy trình E1

A.3.2 Quy trình 2: Chiết 10 g mẫu thử không thêm nước sau khi thêm 0,6 ml hoặc 0,2 ml dung dịch sodium hydroxit 5 mol/l dùng axetonitril
A.3.2.1 Nguyên tắc
Quy trình chiết xuất này được sử dụng cho nguyên liệu thực vật có tính axit và thực phẩm có tính axit chứa hơn 80 % nước. Đối với thực phẩm có tính axit cao (pH nhỏ hơn 3) như chanh dùng 0,6 ml dung dịch sodium hydroxit 5 mol/l, đối với thực phẩm ít axit hơn như quả mâm xôi dùng 0,2 ml dung dịch sodium hydroxit 5 mol/l. Bảng 6 nêu ra các thực phẩm được chiết xuất tốt nhất với quy trình chiết này.
Mẫu đã đồng nhất được chiết trong điều kiện đông lạnh (nếu có thể) với axetonitril. Sau khi thêm magie sulfat khan, sodium clorua và muối đệm citrat (pH 5 đến pH 5,5), hỗn hợp này được lắc mạnh và ly tâm để tách pha. Lớp dung dịch của pha hữu cơ được tách và làm sạch theo quy trình làm sạch (quy trình C) nếu cần thiết.
A.3.2.2 Cách tiến hành
A.3.2.2.1 Phần mẫu thử
Chuyển một phần mẫu thử đại diện cho mẫu (10 ± 0,1) g (mmẫu) đã được đồng nhất vào ống ly tâm 50 ml (A.2.1).
A.3.2.2.2 Thêm nội chuẩn (ISTD)
Thêm một thể tích nhỏ xác định của dung dịch ISTD (A.1.2) (![]() ,ví dụ: 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
,ví dụ: 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
A.3.2.2.3 Bước chiết mẫu đầu tiên
Thêm 10 ml axetonitril (A.1.3) (Vchiết) và 0,6 ml dung dịch sodium hydroxit 5 mol/l (A.1.9) (quy trình E2a) hoặc 0,2 ml dung dịch sodium hydroxit 5 mol/l (A.1.9) (quy trình E2b). Đóng chặt nắp của ống ly tâm và lắc mạnh mẫu ở nhiệt độ phòng từ 1 min đến 3 min hoặc 15 min đối với mẫu đông lạnh, dùng máy lắc (A.2.5) nếu cần thiết.
Mẫu nên được chiết ở trạng thái đông lạnh hoặc đang tan. Nếu mẫu được chiết ở nhiệt độ môi trường, cần đảm bảo rằng không có sự phân hủy đáng kể của những thuốc BVTV phân tích. Thời gian chiết có thể kéo dài nếu không có sự ảnh hưởng đáng kể đến hiệu suất thu hồi.
Nếu mức độ đồng nhất của mẫu không đủ, việc chiết xuất có thể được hỗ trợ bởi thiết bị phân tán tốc độ cao (A.2.7).Trong trường hợp này việc thêm ISTD trước bước phân tán là bắt buộc. Bộ phận phân tán được nhúng vào trong mẫu/hỗn hợp axetonitril và nghiền mẫu khoảng 2 min ở tốc độ cao. Bộ phận phân tán phải được làm sạch hoàn toàn trước khi sử dụng cho mẫu tiếp theo để tránh nhiễm bẩn.
A.3.2.2.4 Bước chiết và phân bố thứ hai
Thêm hỗn hợp muối đệm (A.1.8) vào phần dung dịch thu được từ A.3.2.2.3. Đóng chặt nắp, lắc mạnh ngay trong 1 min bằng tay hoặc 3 min bằng máy lắc (A.2.5) và ly tâm trong 5 min ở tốc độ lớn hơn 3 000 vòng/min.
Không để chậm trễ tách lớp axetonitril phía trên và chuyển dịch chiết thô thu được sang các quy trình làm sạch C.
Khi có nước, magie sulfat có khuynh hướng vón cục và cứng rất nhanh. Điều này có thể tránh được bằng cách lắc mạnh trong vài giây ngay sau khi thêm hỗn hợp muối vào ống ly tâm. Bước chiết 1 min hoặc 3 min còn lại có thể được tiến hành song song sau khi muối được thêm vào tất cả các mẫu.
A.3.2.3 Tính toán
Nồng độ khối lượng của mẫu trong dịch chiết thô ![]() cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết,
cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết, ![]() thường được cho bằng g/ml và được tính bởi công thức A.3:
thường được cho bằng g/ml và được tính bởi công thức A.3:
![]() (A.3)
(A.3)
Trong đó:
mmẫu: khối lượng phần mẫu thử, g;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
Tính nồng độ khối lượng của ISTD ![]() trong dịch chiết thô với công thức A.4
trong dịch chiết thô với công thức A.4
![]() (A.4)
(A.4)
Trong đó:
![]() : nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
: nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
![]() : thể tích ISTD thêm vào mẫu, ml;
: thể tích ISTD thêm vào mẫu, ml;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
A.3.2.4 Sơ đồ của quy trình E2

A.3.3 Quy trình 3: Chiết 10 g mẫu thử sau khi thêm 2,5 ml hoặc 4,5 ml nước dùng axetonitril
A.3.3.1 Nguyên tắc
Quy trình chiết xuất này được sử dụng cho nguyên liệu thực vật và thực phẩm chứa từ 40 % đến 80 % nước như chuối và chà là tươi. Bảng 6 nêu ra các thực phẩm được chiết xuất tốt nhất với quy trình chiết này.
Nước được thêm vào mẫu đã đồng nhất để thu được tổng lượng nước khoảng 10 g trong phần chiết. Mẫu được chiết trong điều kiện đông lạnh (nếu có thể) với axetonitril. Sau khi thêm magie sulfat khan, sodium clorua và muối đệm citrat (pH 5 đến pH 5,5), hỗn hợp này được lắc mạnh và ly tâm để tách pha. Lớp dung dịch của pha hữu cơ được tách và làm sạch theo quy trình làm sạch (quy trình C) nếu cần thiết.
A.3.3.2 Cách tiến hành
A.3.3.2.1 Phần mẫu thử và thêm nước
Chuyển một phần mẫu thử đại diện cho mẫu (10 ± 0,1) g (mmẫu) đã được đồng nhất vào ống ly tâm 50 ml (A.2.1).
Đối với mẫu chứa từ 40 % đến 80 % nước, một lượng nước lạnh vừa đủ (A.1.10) được thêm vào mẫu để thu được tổng lượng nước khoảng 10 g trong phần chiết. Thêm 2,5 ml (quy trình E3a) hoặc 4,5 ml (quy trình E3b) nước phụ thuộc vào loại thực phẩm (xem Bảng 6).
A.3.3.2.2 Thêm nội chuẩn (ISTD)
Thêm một thể tích nhỏ xác định của dung dịch ISTD (A.1.2) (![]() ví dụ: 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
ví dụ: 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
A.3.3.2.3 Bước chiết mẫu đầu tiên
Thêm 10 ml axetonitril (A.1.3) (Vchiết). Đóng chặt nắp của ống ly tâm và lắc mạnh mẫu ở nhiệt độ phòng từ 1 min đến 3 min hoặc 15 min đối với mẫu đông lạnh, dùng máy lắc (A.2.5) nếu cần thiết.
Mẫu nên được chiết ở trạng thái đông lạnh hoặc đang tan. Nếu mẫu được chiết ở nhiệt độ môi trường, cần đảm bảo rằng không có sự phân hủy đáng kể của những thuốc BVTV phân tích. Thời gian chiết có thể kéo dài nếu không có sự ảnh hưởng đáng kể đến hiệu suất thu hồi.
Nếu mức độ đồng nhất của mẫu không đủ, việc chiết xuất có thể được hỗ trợ bởi thiết bị phân tán tốc độ cao (A.2.7).Trong trường hợp này việc thêm ISTD trước bước phân tán là bắt buộc. Bộ phận phân tán được nhúng vào trong mẫu/hỗn hợp axetonitrii và nghiền mẫu khoảng 2 min ở tốc độ cao. Bộ phận phân tán phải được làm sạch hoàn toàn trước khi sử dụng cho mẫu tiếp theo để tránh nhiễm bẩn.
A.3.3.2.4 Bước chiết và phân bố thứ hai
Thêm hỗn hợp muối đệm (A.1.8) vào phần dung dịch thu được từ A.3.3.2.3. Đóng chặt nắp, lắc mạnh ngay trong 1 min bằng tay hoặc 3 min bằng máy lắc (A.2.5) và ly tâm trong 5 min ở tốc độ lớn hơn 3 000 vòng/min.
Không để chậm trễ tách lớp axetonitril phía trên và chuyển dịch chiết thô thu được sang các quy trình làm sạch C.
Khi có nước, magie sulfat có khuynh hướng vón cục và cứng rất nhanh. Điều này có thể tránh được bằng cách lắc mạnh trong vài giây ngay sau khi thêm hỗn hợp muối vào ống ly tâm. Bước chiết 1 min hoặc 3 min còn lại có thể được tiến hành song song sau khi muối được thêm vào tất cả các mẫu.
A.3.3.3 Tính toán
Nồng độ khối lượng của mẫu trong dịch chiết thô ![]() cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết.
cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. ![]() thường được cho bằng g/ml và được tính bởi công thức A.5:
thường được cho bằng g/ml và được tính bởi công thức A.5:
![]() (A.5)
(A.5)
Trong đó:
mmẫu: khối lượng phần mẫu thử, g;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
Tính nồng độ khối lượng của ISTD ![]() trong dịch chiết thô với công thức A.6
trong dịch chiết thô với công thức A.6
![]() (A.6)
(A.6)
Trong đó:
![]() : nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
: nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
![]() : thể tích ISTD thêm vào mẫu, ml;
: thể tích ISTD thêm vào mẫu, ml;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
A.3.3.4 Sơ đồ của quy trình E3

A.3.4 Quy trình 4: Đồng nhất mẫu cùng với lượng nước được thêm vào, chiết 13,5 g mẫu đã đồng nhất với axetonitril
A.3.4.1 Nguyên tắc
Quy trình chiết xuất này được sử dụng cho nguyên liệu thực vật và thực phẩm chứa từ 15 % đến 40 % nước như quả khô và những sản phẩm tương tự. Bảng 6 nêu ra các thực phẩm được chiết xuất tốt nhất với quy trình chiết này.
Mẫu được đồng nhất sau khi thêm nước. Mẫu đã đồng nhất được chiết trong điều kiện đông lạnh (nếu có thể) với axetonitril. Sau khi thêm magie sulfat khan, sodium clorua và muối đệm citrat (pH 5 đến pH 5,5), hỗn hợp này được lắc mạnh và ly tâm để tách pha. Lớp dung dịch của pha hữu cơ được tách và làm sạch theo quy trình làm sạch (quy trình C) nếu cần thiết.
A.3.4.2 Cách tiến hành
A.3.4.2.1 Đồng nhất và phần mẫu thử
Thêm 850 g nước lạnh (A.1.10) vào trong 500 g mẫu khô đông lạnh và đồng nhất hỗn hợp này (nếu có thể thêm đá khô (A.1.11)) bằng máy nghiền mẫu (A.2.8).
Chuyển một phần mẫu thử đại diện cho mẫu (13,5 ± 0,1) g (tương ứng với 5 g của phần mẫu thử (mmẫu) đã được đồng nhất vào ống ly tâm 50 ml (A.2.1).
A.3.4.2.2 Thêm nội chuẩn (ISTD)
Thêm một thể tích nhỏ xác định của dung dịch ISTD (A.1.2) (![]() , ví dụ: 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
, ví dụ: 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
A.3.4.2.3 Bước chiết mẫu đầu tiên
Thêm 10 ml axetonitril (A.1.3) (Vchiết). Đóng chặt nắp của ống ly tâm và lắc mạnh mẫu ở nhiệt độ phòng từ 1 min đến 3 min hoặc 15 min đối với mẫu đông lạnh, dùng máy lắc (A.2.5) nếu cần thiết.
Mẫu nên được chiết ở trạng thái đông lạnh hoặc đang tan. Nếu mẫu được chiết ở nhiệt độ môi trường, cần đảm bảo rằng không có sự phân hủy đáng kể của những thuốc BVTV phân tích. Thời gian chiết có thể kéo dài nếu không có sự ảnh hưởng đáng kể đến hiệu suất thu hồi.
Nếu mức độ đồng nhất của mẫu không đủ, việc chiết xuất có thể được hỗ trợ bởi thiết bị phân tán tốc độ cao (A.2.7). Trong trường hợp này việc thêm ISTD trước bước phân tán là bắt buộc. Bộ phận phân tán được nhúng vào trong mẫu/hỗn hợp axetonitril và nghiền mẫu khoảng 2 min ở tốc độ cao. Bộ phận phân tán phải được làm sạch hoàn toàn trước khi sử dụng cho mẫu tiếp theo để tránh nhiễm bẩn.
A.3.4.2.4 Bước chiết và phân bố thứ hai
Thêm hỗn hợp muối đệm (A.1.8) vào phần dung dịch thu được từ A.3.4.2.3. Đóng chặt nắp, lắc mạnh ngay trong 1 min bằng tay hoặc 3 min bằng máy lắc (A.2.5) và ly tâm trong 5 min ở tốc độ lớn hơn 3 000 vòng/min.
Không để chậm trễ tách lớp axetonitril phía trên và chuyển dịch chiết thô thu được sang các quy trình làm sạch C.
Khi có nước, magie sulfat có khuynh hướng vón cục và cứng rất nhanh. Điều này có thể tránh được bằng cách lắc mạnh trong vài giây ngay sau khi thêm hỗn hợp muối vào ống ly tâm. Bước chiết 1 min hoặc 3 min còn lại có thể được tiến hành song song sau khi muối được thêm vào tất cả các mẫu.
A.3.4.3 Tính toán
Nồng độ khối lượng của mẫu trong dịch chiết thô ![]() cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết.
cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. ![]() thường được cho bằng g/ml và được tính bởi công thức A.7:
thường được cho bằng g/ml và được tính bởi công thức A.7:
![]() (A.7)
(A.7)
Trong đó:
mmẫu: khối lượng phần mẫu thử, g;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
Tính nồng độ khối lượng của ISTD ![]() trong dịch chiết thô với công thức A.8
trong dịch chiết thô với công thức A.8
![]() (A.8)
(A.8)
Trong đó:
![]() : nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
: nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
![]() : thể tích ISTD thêm vào mẫu, ml;
: thể tích ISTD thêm vào mẫu, ml;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
A.3.4.4 Sơ đồ của quy trình E4

A.3.5 Quy trình 5: Chiết 5 g phần mẫu thử sau khi thêm 10 ml nước với axetonitril
A.3.5.1 Nguyên tắc
Quy trình chiết xuất này được sử dụng cho nguyên liệu thực vật và thực phẩm chứa ít hơn 15 % nước như sản phẩm ngũ cốc và mật ong. Bảng 6 nêu ra các thực phẩm được chiết xuất tốt nhất với quy trình chiết này.
10 ml nước được thêm vào mẫu đã đồng nhất được chiết bằng axetonitril. Sau khi thêm magie sulfat khan, sodium clorua và muối đệm citrat (pH 5 đến pH 5,5), hỗn hợp này được lắc mạnh và ly tâm để tách pha. Lớp dung dịch của pha hữu cơ được tách và làm sạch theo quy trình làm sạch (quy trình C) nếu cần thiết.
A.3.5.2 Cách tiến hành
A.3.5.2.1 Phần mẫu thử và thêm nước
Chuyển một phần mẫu thử đại diện cho mẫu (5 ± 0,05) g (mmẫu) đã được đồng nhất vào ống ly tâm 50 ml (A.2.1) và thêm 10 ml nước lạnh (A.1.10). Ảnh hưởng của thời gian phồng lên kéo dài nên được kiểm tra.
A.3.5.2.2 Thêm nội chuẩn (ISTD)
Thêm một thể tích nhỏ xác định của dung dịch ISTD (A.1.2) (![]() , ví dụ: 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
, ví dụ: 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
A.3.5.2.3 Bước chiết mẫu đầu tiên
Thêm 10 ml axetonitril (A.1.3) (Vchiết). Đóng chặt nắp của ống ly tâm và lắc mạnh mẫu trong 15 min, dùng máy lắc (A.2.5) nếu cần thiết, nếu không có máy lắc thì lắc mạnh 1 min bằng tay sau khi ngâm mẫu 15 min và lắc lại trong 1 min.
Nếu mẫu được chiết ở nhiệt độ môi trường, cần đảm bảo rằng không có sự phân hủy đáng kể của những thuốc BVTV phân tích. Thời gian chiết có thể kéo dài nếu không có sự ảnh hưởng đáng kể đến hiệu suất thu hồi.
Nếu mức độ đồng nhất của mẫu không đủ, việc chiết xuất có thể được hỗ trợ bởi thiết bị phân tán tốc độ cao (A.2.7). Trong trường hợp này việc thêm ISTD trước bước phân tán là bắt buộc. Bộ phận phân tán được nhúng vào trong mẫu/hỗn hợp axetonitril và nghiền mẫu khoảng 2 min ở tốc độ cao. Bộ phận phân tán phải được làm sạch hoàn toàn trước khi sử dụng cho mẫu tiếp theo để tránh nhiễm bẩn.
A.3.5.2.4 Bước chiết và phân bố thứ hai
Thêm hỗn hợp muối đệm (A.1.8) vào phần dung dịch thu được từ A.3.4.2.3. Đóng chặt nắp, lắc mạnh ngay trong 1 min bằng tay hoặc 3 min bằng máy lắc (A.2.5) và ly tâm trong 5 min ở tốc độ lớn hơn 3 000 vòng/min.
Không để chậm trễ tách lớp axetonitril phía trên và chuyển dịch chiết thô thu được sang các quy trình làm sạch C.
Khi có nước, magie sulfat có khuynh hướng vón cục và cứng rất nhanh. Điều này có thể tránh được bằng cách lắc mạnh trong vài giây ngay sau khi thêm hỗn hợp muối vào ống ly tâm. Bước chiết 1 min hoặc 3 min còn lại có thể được tiến hành song song sau khi muối được thêm vào tất cả các mẫu.
A.3.5.3 Tính toán
(Nồng độ khối lượng của mẫu trong dịch chiết thô ![]() cho tỉ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết.
cho tỉ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. ![]() thường được cho bằng g/ml và được tính bởi công thức A.9:
thường được cho bằng g/ml và được tính bởi công thức A.9:
![]() (A.9)
(A.9)
Trong đó:
mmẫu: khối lượng phần mẫu thử, g;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
Tính nồng độ khối lượng của ISTD ![]() trong dịch chiết thô với công thức A.10
trong dịch chiết thô với công thức A.10
![]() (A.10)
(A.10)
Trong đó:
![]() : nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
: nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
![]() : thể tích ISTD thêm vào mẫu, ml;
: thể tích ISTD thêm vào mẫu, ml;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10ml), ml.
A.3.5.4 Sơ đồ của quy trình E5

A.3.6 Quy trình 6: Chiết 5 g phần mẫu thử sau khi thêm 6 ml nước với axetonitril
A.3.6.1 Nguyên tắc
Quy trình chiết xuất này được sử dụng cho nguyên liệu thực vật và thực phẩm chứa từ 45 % đến 80 % nước và phần mẫu nhiều hoặc hàm lượng chất béo cao (lớn hơn 5 %), như tỏi và quả bơ. Bảng 6 nêu ra các thực phẩm được chiết xuất tốt nhất với quy trình chiết này.
6 ml nước được thêm vào mẫu đã đồng nhất (5 g) để thu được tổng lượng nước khoảng 10 g trong phần chiết. Mẫu được chiết trong điều kiện đông lạnh (nếu có thể) với axetonitril. Sau khi thêm magie sulfat khan, sodium clorua và muối đệm citrat (pH 5 đến pH 5,5), hỗn hợp này được lắc mạnh và ly tâm để tách pha. Lớp dung dịch của pha hữu cơ được tách và làm sạch theo quy trình làm sạch (quy trình C) nếu cần thiết.
A.3.6.2 Cách tiến hành
A.3.6.2.1 Phần mẫu thử và thêm nước
Chuyển một phần mẫu thử đại diện cho mẫu (5 ± 0,05) g (mmẫu) đã được đồng nhất vào ống ly tâm 50 ml (A.2.1) và thêm 6 ml nước lạnh (A.1.10).
A.3.6.2.2 Thêm nội chuẩn (ISTD)
Thêm một thể tích nhỏ xác định của dung dịch ISTD (A.1.2) (![]() , ví dụ: 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
, ví dụ: 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
A.3.6.2.3 Bước chiết mẫu đầu tiên
Thêm 10 ml axetonitril (A.1.3) (Vchiết). Đóng chặt nắp của ống ly tâm và lắc mạnh mẫu ở nhiệt độ phòng từ 1 min đến 3 min hoặc 15 min đối với mẫu đông lạnh, dùng máy lắc (A.2.5) nếu cần thiết.
Mẫu nên được chiết ở trạng thái đông lạnh hoặc đang tan. Nếu mẫu được chiết ở nhiệt độ môi trường, cần đảm bảo rằng không có sự phân hủy đáng kể của những thuốc BVTV phân tích. Thời gian chiết có thể kéo dài nếu không có sự ảnh hưởng đáng kể đến hiệu suất thu hồi.
Nếu mức độ đồng nhất của mẫu không đủ, việc chiết xuất có thể được hỗ trợ bởi thiết bị phân tán tốc độ cao (A.2.7). Trong trường hợp này việc thêm ISTD trước bước phân tán là bắt buộc. Bộ phận phân tán được nhúng vào trong mẫu/hỗn hợp axetonitril và nghiền mẫu khoảng 2 min ở tốc độ cao. Bộ phận phân tán phải được làm sạch hoàn toàn trước khi sử dụng cho mẫu tiếp theo để tránh nhiễm bẩn.
A.3.6.2.4 Bước chiết và phân bố thứ hai
Thêm hỗn hợp muối đệm (A.1.8) vào phần dung dịch thu được từ A.3.4.2.3. Đóng chặt nắp, lắc mạnh ngay trong 1 min bằng tay hoặc 3 min bằng máy lắc (A.2.5) và ly tâm trong 5 min ở tốc độ lớn hơn 3 000 vòng/min.
Không để chậm trễ tách lớp axetonitril phía trên và chuyển dịch chiết thô thu được sang các quy trình làm sạch C.
Khi có nước, magie sulfat có khuynh hướng vón cục và cứng rất nhanh. Điều này có thể tránh được bằng cách lắc mạnh trong vài giây ngay sau khi thêm hỗn hợp muối vào ống ly tâm. Bước chiết 1 min hoặc 3 min còn lại có thể được tiến hành song song sau khi muối được thêm vào tất cả các mẫu.
A.3.6.3 Tính toán
Nồng độ khối lượng của mẫu trong dịch chiết thô ![]() cho tỉ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết.
cho tỉ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. ![]() thường được cho bằng g/ml và được tính bởi công thức A.11:
thường được cho bằng g/ml và được tính bởi công thức A.11:
![]() (A.11)
(A.11)
Trong đó:
mmẫu: khối lượng phần mẫu thử, g;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
Tính nồng độ khối lượng của ISTD ![]() trong dịch chiết thô với công thức A.12
trong dịch chiết thô với công thức A.12
![]() (A.12)
(A.12)
Trong đó:
![]() : nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
: nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
![]() : thể tích ISTD thêm vào mẫu, ml;
: thể tích ISTD thêm vào mẫu, ml;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
A.3.6.4 Sơ đồ của quy trình E6

A.3.7 Quy trình 7: Chiết 2 g phần mẫu thử sau khi thêm 10 ml nước với axetonitril
A.3.7.1 Nguyên tắc
Quy trình chiết xuất này được sử dụng cho nguyên liệu thực vật và thực phẩm với hàm lượng nước rất thấp (nhỏ hơn 10 %) và phần mẫu nhiều như gia vị, cà phê, thuốc lá hoặc chè. Bảng 6 nêu ra các thực phẩm được chiết xuất tốt nhất với quy trình chiết này.
10 ml nước được thêm vào mẫu đã đồng nhất (2 g) được chiết với axetonitrile. Sau khi thêm magie sulfat khan, sodium clorua và muối đệm citrat (pH 5 đến pH 5,5), hỗn hợp này được lắc mạnh và ly tâm để tách pha. Lớp dung dịch của pha hữu cơ được tách và làm sạch theo quy trình làm sạch (quy trình C) nếu cần thiết.
A.3.7.2 Cách tiến hành
A.3.7.2.1 Phần mẫu thử và thêm nước
Chuyển một phần mẫu thử đại diện cho mẫu (2 ± 0,02) g (mmẫu) đã được đồng nhất vào ống ly tâm 50 ml (A.2.1) và thêm 10 ml nước lạnh (A.1.10). Ảnh hưởng của thời gian phồng lên kéo dài nên được kiểm tra.
A.3.7.2.2 Thêm nội chuẩn (ISTD)
Thêm một thể tích nhỏ xác định của dung dịch ISTD (A.1.2) (![]() , ví dụ: 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
, ví dụ: 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
A.3.7.2.3 Bước chiết mẫu đầu tiên
Thêm 10 ml axetonitril (A.1.3) (Vchiết). Đóng chặt nắp của ống ly tâm và lắc mạnh mẫu trong 15 min, dùng máy lắc (A.2.5) nếu cần thiết, nếu không có máy lắc thì lắc mạnh 1 min bằng tay sau khi ngâm mẫu 15 min và lắc lại trong 1 min.
Nếu mẫu được chiết ở nhiệt độ môi trường, cần đảm bảo rằng không có sự phân hủy đáng kể của những thuốc BVTV phân tích. Thời gian chiết có thể kéo dài nếu không có sự ảnh hưởng đáng kể đến hiệu suất thu hồi.
Nếu mẫu không đồng nhất, việc chiết xuất có thể được hỗ trợ bởi thiết bị phân tán tốc độ cao (A.2.7). Trong trường hợp này việc thêm ISTD trước bước phân tán là bắt buộc. Bộ phận phân tán được nhúng vào trong mẫu/hỗn hợp axetonitril và nghiền mẫu khoảng 2 min ở tốc độ cao. Bộ phận phân tán phải được làm sạch hoàn toàn trước khi sử dụng cho mẫu tiếp theo để tránh nhiễm bẩn.
A.3.7.2.4 Bước chiết và phân bố thứ hai
Thêm hỗn hợp muối đệm (A.1.8) vào phần dung dịch thu được từ A.3.7.2.3. Đóng chặt nắp, lắc mạnh ngay trong 1 min bằng tay hoặc 3 min bằng máy lắc (A.2.5) và ly tâm trong 5 min ở tốc độ lớn hơn 3 000 vòng/min.
Không để chậm trễ tách lớp axetonitril phía trên và chuyển dịch chiết thô thu được sang các quy trình làm sạch C.
Khi có nước, magie sulfat có khuynh hướng vón cục và cứng rất nhanh. Điều này có thể tránh được bằng cách lắc mạnh trong vài giây ngay sau khi thêm hỗn hợp muối vào ống ly tâm. Bước chiết 1 min hoặc 3 min còn lại có thể được tiến hành song song sau khi muối được thêm vào tất cả các mẫu.
A.3.7.3 Tính toán
Nồng độ khối lượng của mẫu trong dịch chiết thô ![]() cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết.
cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. ![]() thường được cho bằng g/ml và được tính bởi công thức A.13:
thường được cho bằng g/ml và được tính bởi công thức A.13:
![]() (A.13)
(A.13)
mmẫu: khối lượng phần mẫu thử, g;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
Tính nồng độ khối lượng của ISTD ![]() trong dịch chiết thô với công thức A.14
trong dịch chiết thô với công thức A.14
![]() (A.14)
(A.14)
![]() : nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
: nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
![]() : thể tích ISTD thêm vào mẫu, ml;
: thể tích ISTD thêm vào mẫu, ml;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
A.3.7.4 Sơ đồ của quy trình E7

A.3.8 Quy trình 8: Chiết 10 g mẫu thử không cần thêm nước bằng cách thủy phân kiềm đồng thời các ester không bền kiềm và các liên hợp với axetonitril
A.3.8.1 Nguyên tắc
Quy trình chiết xuất này được sử dụng để xác định các thuốc BVTV có tính axit, trong đó định nghĩa dư lượng bao gồm axit tự do, cũng như ester và liên hợp, có thể hoặc phải được thủy phân trong môi trường kiềm theo phân tích dư lượng cho việc thiết lập MRL. Quy trình chiết này đưa ra điều kiện thủy phân mặc định của các liên hợp và ester của 2,4-D, 2,4-DB, clopyralid, dichlorprop(-P), fluazifop(-P), fluroxypyr, haloxyfop và MCPA/MCPB. Hầu hết các ester có liên quan của các hợp chất đã cho thực tế bị thủy phân định lượng trong các điều kiện nhất định. Quy trình chiết này thực sự không áp dụng được trên các liên hợp 6-OH và 8-OH bentazone, dicamba và pyridate. Quy trình chiết này sử dụng cho nguyên liệu thực vật và thực phẩm mà theo Bảng 6 các quy trình chiết E1, E2a hoặc E2b thường được sử dụng.
Mẫu đã đồng nhất được chiết ở nhiệt độ 40 °C với axetonitril sau khi thêm 1 mmol sodium hydroxit đối với 1 g mẫu đối với thực phẩm rất axit (thường chiết bằng quy trình E2a, như chanh) hoặc 0,5 mmol sodium hydroxit đối với 1 g mẫu đối với tất cả các thực phẩm khác. Sau khi thêm axit sulfuric (cho việc trung hòa), magie sulfat khan, sodium clorua và muối đệm citrat (pH 5 đến pH 5,5), hỗn hợp này được lắc mạnh và ly tâm để tách pha. Lớp dung dịch của pha hữu cơ được tách và làm sạch theo quy trình làm sạch (quy trình C) nếu cần thiết.
A.3.8.2 Cách tiến hành
A.3.8.2.1 Phần mẫu thử
Chuyển một phần mẫu thử đại diện cho mẫu (10 ± 0,1) g (mmẫu) đã được đồng nhất vào ống ly tâm 50 ml (A.2.1).
Vì hàm lượng axit của chanh phải được xem xét để trung hòa, nên phần mẫu thử của các thực phẩm có tính axit chỉ có thể giảm nếu thể tích dung dịch sodium hydroxit giảm theo tỷ lệ.
A.3.8.2.2 Thêm nội chuẩn (ISTD)
Thêm một thể tích nhỏ xác định của dung dịch ISTD (A.1.2) (![]() , VD 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
, VD 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
A.3.8.2.3 Thủy phân và bước chiết mẫu đầu tiên
Thêm 10 ml axetonitril (A.1.3) (Vchiết). Thêm 2,0 ml dung dịch sodium hydroxit 5 mol/l (A.1.9) đối với thực phẩm rất axit (thường chiết bằng quy trình E2a, như chanh) hoặc 1,0 ml dung dịch sodium hydroxit 5 mol/l (A.1.9) đối với tất cả các thực phẩm khác. Đóng chặt nắp của ống ly tâm và lắc mạnh trong 30 min ở nhiệt độ 40 °C dùng máy lắc nhiệt (A.2.9). Để trung hòa thêm 1,4 ml axit sulfuric 2,5 mol/l (A.1.13) đối với thực phẩm rất axit hoặc 1,0 ml axit sulfuric 2,5 mol/l (A.1.13) đối với các thực phẩm khác.
Nếu mức độ đồng nhất của mẫu không đủ, việc chiết xuất có thể được hỗ trợ bởi thiết bị phân tán tốc độ cao (A.2.7).Trong trường hợp này việc thêm ISTD trước bước phân tán là bắt buộc. Bộ phận phân tán được nhúng vào trong mẫu/hỗn hợp axetonitril và nghiền mẫu khoảng 2 min ở tốc độ cao. Bộ phận phân tán phải được làm sạch hoàn toàn trước khi sử dụng cho mẫu tiếp theo để tránh nhiễm bẩn.
A.3.8.2.4 Bước chiết và phân bố thứ hai
Thêm hỗn hợp muối đệm (A.1.8) vào phần dung dịch thu được từ A.3.8.2.3. Đóng chặt nắp, lắc mạnh ngay trong 1 min bằng tay hoặc 3 min bằng máy lắc (A.2.5) và ly tâm trong 5 min ở tốc độ lớn hơn 3 000 vòng/min. Không để chậm trễ tách lớp axetonitril phía trên và chuyển dịch chiết thô thu được sang các quy trình làm sạch C.
Khi có nước, magie sulfat có khuynh hướng vón cục và cứng rất nhanh. Điều này có thể tránh được bằng cách lắc mạnh trong vài giây ngay sau khi thêm hỗn hợp muối vào ống ly tâm. Bước chiết 1 min hoặc 3 min còn lại có thể được tiến hành song song sau khi muối được thêm vào tất cả các mẫu.
A.3.8.3 Tính toán
Nồng độ khối lượng của mẫu trong dịch chiết thô ![]() cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết.
cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. ![]() thường được cho bằng g/ml và được tính bởi công thức A.15:
thường được cho bằng g/ml và được tính bởi công thức A.15:
![]() (A.15)
(A.15)
Trong đó:
mmẫu: khối lượng phần mẫu thử, g;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
Tính nồng độ khối lượng của ISTD ![]() trong dịch chiết thô với công thức A.16
trong dịch chiết thô với công thức A.16
![]() (A.16)
(A.16)
Trong đó:
![]() : nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
: nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
![]() : thể tích ISTD thêm vào mẫu, ml;
: thể tích ISTD thêm vào mẫu, ml;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
A.3.8.4 Sơ đồ của quy trình E8

A.3.9 Quy trình 9: Chiết 2 g hoặc 5 g mẫu thử sau khi thêm nước bằng cách thủy phân kiềm đồng thời các ester không bền kiềm và các liên hợp với axetonitril
A.3.9.1 Nguyên tắc
Quy trình chiết xuất này được sử dụng để xác định các thuốc BVTV có tính axit, trong đó định nghĩa dư lượng bao gồm bao gồm axit tự do, cũng như ester và liên hợp, có thể hoặc phải được thủy phân dưới điều kiện kiềm theo phân tích dư lượng cho việc thiết lập MRL Quy trình chiết này đưa ra điều kiện thủy phân mặc định của các liên hợp và ester của 2,4-D, 2,4-DB, clopyralid, dichlorprop(-P), fluazifop(-P), fluroxypyr, haloxyfop và MCPA/MCPB. Hầu hết các ester có liên quan của các hợp chất đã cho thực tế bị thủy phân định lượng trong các điều kiện nhất định. Quy trình chiết này thực sự không áp dụng được trên các liên hợp 6-OH và 8-OH bentazone, dicamba và pyridate. Quy trình chiết này sử dụng cho nguyên liệu thực vật và thực phẩm mà theo Bảng 6 các quy trình chiết E5, E6 hoặc E7 thường được sử dụng.
Mãu đã đồng nhất được chiết ở nhiệt độ 40 °C với axetonitril sau khi thêm 1 mmol sodium hydroxit đối với 1 g mẫu cho 5 g phần mẫu thử hoặc 2,5 mmol sodium hydroxit đối với 1 g mẫu cho 2 g phần mẫu thử. Sau khi thêm axit sulfuric (cho việc trung hòa), magie sulfat khan, sodium clorua và muối đệm citrat (pH 5 đến pH 5,5), hỗn hợp này được lắc mạnh và ly tâm để tách pha. Lớp dung dịch của pha hữu cơ được tách và làm sạch theo quy trình làm sạch (quy trình C) nếu cần thiết. Các quy trình C2, C3, C4 và C5 có thể không được sử dụng, vì chất hấp phụ amin bậc 1 và bậc 2 có thể làm mất các axit tự do.
A.3.9.2 Cách tiến hành
A.3.9.2.1 Phần mẫu thử
Đối với những thực phẩm thường được chiết bằng quy trình E5 hoặc E6, chuyển một phần mẫu thử đại diện cho mẫu (5 ± 0,05) g và (2 ± 0,02) g (mmẫu) đối với thực phẩm bằng quy trình E7 đã được đồng nhất vào ống ly tâm 50 ml (A.2.1).
Vì hàm lượng axit của chanh phải được xem xét để trung hòa, nên phần mẫu thử của các thực phẩm có tính axit chỉ có thể giảm nếu thể tích dung dịch sodium hydroxit giảm theo tỉ lệ.
A.3.9.2.2 Thêm nội chuẩn (ISTD)
Thêm một thể tích nhỏ xác định của dung dịch ISTD (A.1.2) (![]() , ví dụ: 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
, ví dụ: 100 µl) chứa một hoặc một vài chất được nêu trong Bảng A1 ở những nồng độ được đề nghị (CISTD).
A.3.9.2.3 Thủy phân và bước chiết mẫu đầu tiên
Thêm 10 ml nước (A.1.10) cho những thực phẩm thường được chiết bằng bằng quy trình E5 hoặc E7, hoặc 6 ml nước (A.1.10) cho những thực phẩm thường được chiết bằng quy trình E6.
Thêm 10 ml axetonitril (A.1.3) (Vchiết) và 1,0 ml dung dịch sodium hydroxit 5 mol/I (A.1.9). Đóng chặt nắp của ống ly tâm và lắc mạnh trong 30 min ở nhiệt độ 40 °C dùng máy lắc nhiệt (A.2.9). Để trung hòa thêm 1,0 ml axlt sulfuric 2,5 mol/l (A.1.13).
Nếu mức độ đồng nhất của mẫu không đủ, việc chiết xuất có thể được hỗ trợ bởi thiết bị phân tán tốc độ cao (A.2.7). Trong trường hợp này việc thêm ISTD trước bước phân tán là bắt buộc. Bộ phận phân tán được nhúng vào trong mẫu/hỗn hợp axetonitril và nghiền mẫu khoảng 2 min ở tốc độ cao. Bộ phận phân tán phải được làm sạch hoàn toàn trước khi sử dụng cho mẫu tiếp theo để tránh nhiễm bẩn.
A.3.9.2.4 Bước chiết và phân bố thứ hai
Thêm hỗn hợp muối đệm (A.1.8) vào phần dung dịch thu được từ A.3.8.2.3. Đóng chặt nắp, lắc mạnh ngay trong 1 min bằng tay hoặc 3 min bằng máy lắc (A.2.5) và ly tâm trong 5 min ở tốc độ lớn hơn 3 000 vòng/min. Không để chậm trễ tách lớp axetonitril phía trên và chuyển dịch chiết thô thu được sang các quy trình làm sạch C0 hoặc C1.
Khi có nước, magie sulfat có khuynh hướng vón cục và cứng rất nhanh. Điều này có thể tránh được bằng cách lắc mạnh trong vài giây ngay sau khi thêm hỗn hợp muối vào ống ly tâm. Bước chiết 1 min hoặc 3 min còn lại có thể được tiến hành song song sau khi muối được thêm vào tất cả các mẫu.
A.3.9.3 Tính toán
Nồng độ khối lượng của mẫu trong dịch chiết thô ![]() cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết.
cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. ![]() thường được cho bằng g/ml và được tính bởi công thức A.17:
thường được cho bằng g/ml và được tính bởi công thức A.17:
![]() (A.17).
(A.17).
Trong đó:
mmẫu: khối lượng phần mẫu thử, g;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
Tính nồng độ khối lượng của ISTD ![]() trong dịch chiết thô với công thức A.18
trong dịch chiết thô với công thức A.18
![]() (A.18).
(A.18).
![]() : nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
: nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
![]() : thể tích ISTD thêm vào mẫu, ml;
: thể tích ISTD thêm vào mẫu, ml;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml.
A.3.9.4 Sơ đồ của quy trình E9

A.4 Mô tả các quy trình làm sạch (C)
A.4.1 Quy trình C0: Không làm sạch
A.4.1.1 Nguyên tắc
Quy trình làm sạch này dùng cho dịch chiết thu được bởi các quy trình từ E1 đến E9 để xác định các thuốc BVTV dễ phân hủy kiềm và axit (pKa nhỏ hơn 5), các thuốc BVTV này có thể kết hợp với chất hấp phụ amin bậc 1 và bậc 2 dùng trong các quy trình từ C2 đến C5. Quy trình làm sạch này cũng có thể dùng để phân tích những thực phẩm có phần mẫu ít. Các quy trình làm sạch được đề xuất cho các nền mẫu khác được đưa ra trong Bảng 6.
Dịch chiết thô thu được từ các quy trình từ E1 đến E9 không làm sạch và không ổn định dịch chiết (quy trình S), nhưng có thể được pha loãng nếu có.
A.4.1.2 Cách tiến hành
Để giảm ảnh hưởng của nền mẫu, một phần của dịch chiết thô (V1) có thể được pha loãng với một thể tích xác định của dung môi thích hợp (V2) để tạo ra tổng thể tích (V1+V2) nếu đủ độ nhạy của hệ thống. Nếu cần ổn định dịch chiết, dịch chiết đã được pha loãng được chuyển đến quy trình S1.
A.4.1.3 Tính toán
Nồng độ khối lượng của mẫu trong dịch chiết thô ![]() cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. Thường
cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. Thường ![]() thường được cho bằng g/ml và được tính bởi công thức A.19:
thường được cho bằng g/ml và được tính bởi công thức A.19:
![]() (A.19)
(A.19)
Trong đó:
![]() : nồng khối lượng của dịch chiết thô, g/ml;
: nồng khối lượng của dịch chiết thô, g/ml;
V1: thể tích dịch chiết thô sử dụng, ml;
V2: thể tích thêm vào của dung môi thích hợp, ml.
Tính nồng độ khối lượng của ISTD ![]() trong dịch chiết sau cùng với công thức A.20
trong dịch chiết sau cùng với công thức A.20
![]() (A.20)
(A.20)
Trong đó:
![]() : nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
: nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
![]() : thể tích ISTD thêm vào mẫu, ml;
: thể tích ISTD thêm vào mẫu, ml;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml;
V1: thể tích dịch chiết thô sử dụng, ml;
V2: thể tích thêm vào của dung môi thích hợp, ml.
A.4.1.4 Sơ đồ của quy trình C0
| Pha loãng (nếu thích hợp) và dùng trong quy trình S |
A.4.2 Quy trình C1: Làm sạch bằng cách đông lạnh chất béo, sáp thực vật, đường cộng chiết
A.4.2.1 Nguyên tắc
Quy trình làm sạch này dùng cho dịch chiết thu được bởi các quy trình E2, E5, E6, E8 và E9 để giảm lượng chất béo trong dịch chiết có hàm lượng chất béo cao. Nó có thể được sử dụng kết hợp với những quy trình làm sạch khác (C2, C3 và C5). Các quy trình làm sạch được đề xuất cho các nền mẫu khác được đưa ra trong Bảng 6.
Dịch chiết thô thu được từ các quy trình E2, E5, E6, E8 và E9 được tách chất béo bằng cách đông lạnh. Dịch chiết thu được có thể được làm sạch bằng các quy trình khác hoặc sử dụng để ổn định dịch chiết (quy trình S).
A.4.2.2 Cách tiến hành
Chuyển 8 ml dung dịch của pha axetonitril thu được từ các quy trình E2, E5 và E6 vào trong ống ly tâm (A.2.4) và để qua đêm trong tủ đông (A.2.10) (đối với bột ml, 2 h là đủ) trong đó những phần chính của chất béo và sáp thực vật sẽ đóng rắn lại và kết tủa. Sau khi ly tâm ngắn (khi cần thiết), 6 ml dịch chiết vẫn còn lạnh được lấy để làm sạch thêm bởi các quy trình C2, C3 hoặc C5 hoặc để ổn định dịch chiết (quy trình S).
CHÚ THÍCH: Việc đông lạnh cũng giúp loại bỏ một phần một số chất cộng chiết trong mẫu với độ tan giới hạn trong dung môi axetonitril như đường.
Để giảm ảnh hưởng của nền mẫu, một phần của dịch chiết thô (V1) có thể được pha loãng với một thể tích xác định của dung môi thích hợp (V2) để tạo ra tổng thể tích (V1+V2) nếu đủ độ nhạy của hệ thống.
Nếu cần ổn định dịch chiết, dịch chiết đã được pha loãng được chuyển đến quy trình S1.
A.4.2.3. Tính toán
Nồng độ khối lượng của mẫu trong dịch chiết thô ![]() cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. Thường
cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. Thường ![]() thường được cho bằng g/ml và được tính bởi công thức A.21:
thường được cho bằng g/ml và được tính bởi công thức A.21:
![]() (A.21)
(A.21)
Trong đó:
![]() : nồng độ khối lượng của dịch chiết thô, g/ml;
: nồng độ khối lượng của dịch chiết thô, g/ml;
V1: thể tích dịch chiết thô sử dụng, ml;
V2: thể tích thêm vào của dung môi thích hợp, ml.
Tính nồng độ khối lượng của ISTD ![]() trong dịch chiết sau cùng với công thức A.22
trong dịch chiết sau cùng với công thức A.22
![]() (A.22)
(A.22)
Trong đó:
![]() : nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
: nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
![]() : thể tích ISTD thêm vào mẫu, ml;
: thể tích ISTD thêm vào mẫu, ml;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml;
V1: thể tích dịch chiết thô sử dụng, ml;
V2: thể tích thêm vào của dung môi thích hợp, ml.
A.4.2.4 Sơ đồ của quy trình C1

A.4.3 Quy trình C2: Làm sạch bằng cách chiết phân tán SPE với chất hấp phụ amin (PSA)
A.4.3.1 Nguyên tắc
Quy trình làm sạch này dùng cho dịch chiết thu được bởi các quy trình từ E1 đến E4 và E6 cho việc xác định các thuốc BVTV trung tính và kiềm trong tất cả các thực phẩm không được đề cập thêm. Nó cũng được sử dụng cho dịch chiết quả có múi sau khi làm sạch bằng quy trình C1. Các quy trình làm sạch được đề xuất cho các nền mẫu khác được đưa ra trong Bảng 6.
Dịch chiết thô thu được từ các quy trình E1 đến E4 và E6 được làm sạch bằng chiết phân tán pha rắn dùng chất hấp phụ PSA. Dịch chiết đã làm sạch được dùng để ổn định dịch chiết (quy trình S).
A.4.3.2 Cách tiến hành
6 ml dung dịch của pha axetonitril thu được từ các quy trình E1 đến E4 và E6 được chuyển vào ống ly tâm dùng một lần polypropylen (A.2.4) có chứa 150 mg PSA (A.1.15) và 900 mg magie sulfat khan (A.1.14). Đóng chặt nắp, lắc mạnh trong 30 s bằng máy lắc (A.2.5) nếu cần thiết và ly tâm trong 5 min ở tốc độ lớn hơn 3 000 vòng/min. Tách và axit hóa dịch chiết đã làm sạch ngay như mô tả trong quy trình S nếu cần thiết.
Đối với 1 ml dịch chiết dùng 150 mg magie sulfat khan và 25 mg PSA nếu cần thiết.
CHÚ Ý: Rất hữu ích khi cho vào các ống ly tâm với chất hấp phụ chiết phân tán SPE cần cho một lô mẫu trước khi bắt đầu quá trình chiết.
Để giảm ảnh hưởng của nền mẫu, một phần của dịch chiết thô (V1) có thể được pha loãng với một thể tích xác định của dung môi thích hợp (V2) để tạo ra tổng thể tích (V1+V2) nếu đủ độ nhạy của hệ thống.
Nếu cần ổn định dịch chiết, dịch chiết đã được pha loãng được chuyển đến quy trình S1.
A.4.2.3 Tính toán
Nồng độ khối lượng của mẫu trong dịch chiết thô ![]() cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. Thường
cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. Thường ![]() thường được cho bằng g/ml và được tính bởi công thức A.23:
thường được cho bằng g/ml và được tính bởi công thức A.23:
![]() (A.23)
(A.23)
Trong đó:
![]() : nồng độ khối lượng của dịch chiết thô, g/ml;
: nồng độ khối lượng của dịch chiết thô, g/ml;
V1: thể tích dịch chiết thô sử dụng, ml;
V2: thể tích thêm vào của dung môi thích hợp, ml.
Tính nồng độ khối lượng của ISTD ![]() trong dịch chiết sau cùng với công thức A.24
trong dịch chiết sau cùng với công thức A.24
![]() (A.24)
(A.24)
Trong đó:
![]() : nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
: nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
![]() : thể tích ISTD thêm vào mẫu, ml;
: thể tích ISTD thêm vào mẫu, ml;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml;
V1: thể tích dịch chiết thô sử dụng, ml;
V2: thể tích thêm vào của dung môi thích hợp, ml.
A.4.3.4 Sơ đồ của quy trình C2

A.4.4 Quy trình C3: Làm sạch bằng cách chiết phân tán SPE với lượng lớn hơn chất hấp phụ amin (PSA): 50 mg PSA/ml dịch chiết hoặc 75 mg PSA/ml dịch chiết.
A.4.4.1 Nguyên tắc
Quy trình làm sạch này dùng cho dịch chiết thu được bởi quy trình E5 ( ví dụ: ngũ cốc, sản phẩm ngũ cốc, lúa mì) và E7 (ví dụ: cà phê, chè, thảo dược khô, gia vị) đặc biệt cho việc xác định các thuốc BVTV trung tính và kiềm trong nguyên liệu thực vật và thực phẩm với hàm lượng nước thấp. Các quy trình làm sạch được đề xuất cho các nền mẫu khác được đưa ra trong Bảng 6.
Dịch chiết thô thu được từ các quy trình E5 và E7 được làm sạch bằng chiết phân tán pha rắn dùng một lượng tăng chất hấp phụ PSA. Dịch chiết đã làm sạch được dùng để ổn định dịch chiết (quy trình S).
A.4.4.2 Cách tiến hành
6 ml dung dịch của pha axetonitril thu được từ các quy trình E5 và E7 được chuyển vào ống ly tâm dùng một lần polypropylen (A.2.4) có chứa 300 mg PSA (A.1.15) (quy trình C3a) hoặc 450 mg PSA (A.1.15) (quy trình C3b) và 900 mg magie sulfat khan (A.1.14). Đóng chặt nắp, lắc mạnh trong 30 s bằng máy lắc (A.2.5) nếu cần thiết và ly tâm trong 5 min ở tốc độ lớn hơn 3 000 vòng/min. Tách và axit hóa dịch chiết đã làm sạch ngay như mô tả trong quy trình S nếu cần thiết.
Đối với 1 ml dịch chiết dùng 150 mg magie sulfat khan và 50 mg PSA hoặc 75 mg PSA nếu cần thiết.
CHÚ Ý: Rất hữu ích khi cho vào các ống ly tâm với chất hấp phụ chiết phân tán SPE cần cho một lô mẫu trước khi bắt đầu quá trình chiết.
Để giảm ảnh hưởng của nền mẫu, một phần của dịch chiết thô (V1) có thể được pha loãng với một thể tích xác định của dung môi thích hợp (V2) để tạo ra tổng thể tích (V1+V2) nếu đủ độ nhạy của hệ thống.
Nếu cần ổn định dịch chiết, dịch chiết đã được pha loãng được chuyển đến quy trình S1.
A.4.4.3 Tính toán
Nồng độ khối lượng của mẫu trong dịch chiết thô ![]() cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. Thường
cho tỷ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. Thường ![]() thường được cho bằng g/ml và được tính bởi công thức A.25:
thường được cho bằng g/ml và được tính bởi công thức A.25:
![]() (A.25)
(A.25)
Trong đó:
![]() : nồng độ khối lượng của dịch chiết thô, g/ml;
: nồng độ khối lượng của dịch chiết thô, g/ml;
V1: thể tích dịch chiết thô sử dụng, ml;
V2: thể tích thêm vào của dung môi thích hợp, ml.
Tính nồng độ khối lượng của ISTD ![]() trong dịch chiết sau cùng với công thức A.26
trong dịch chiết sau cùng với công thức A.26
![]() (A.26)
(A.26)
Trong đó:
![]() : nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
: nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
![]() : thể tích ISTD thêm vào mẫu, ml;
: thể tích ISTD thêm vào mẫu, ml;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml;
V1: thể tích dịch chiết thô sử dụng, ml;
V2: thể tích thêm vào của dung môi thích hợp, ml.
A.4.4.4 Sơ đồ của quy trình C3
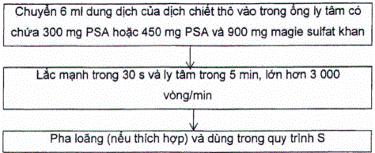
A.4.5 Quy trình C4: Làm sạch bằng cách chiết phân tán SPE với hỗn hợp chất hấp phụ amin (PSA) và chất hấp phụ pha đảo trên nền silica (C18)
A.4.5.1 Nguyên tắc
Quy trình làm sạch này dùng cho dịch chiết thu được bởi quy trình E2, E5 hoặc E6 để giảm lượng chất béo và làm sạch trong 1 bước. Nó có thể được sử dụng thay thế cho sự kết hợp tuần tự của các quy trình làm sạch C1 và C2, ví dụ: quả có múi, ngũ cốc, sản phẩm ngũ cốc, quả bơ và dầu oliu. Các quy trình làm sạch được đề xuất cho các nền mẫu khác được đưa ra trong Bảng 6.
Dịch chiết thô thu được từ các quy trình E2, E5 và E6 được làm sạch bằng chiết phân tán pha rắn dùng hỗn hợp chất hấp phụ amin bậc 1 và bậc 2 (PSA) và chất hấp phụ pha đảo C18. Dịch chiết đã làm sạch được dùng để ổn định dịch chiết (quy trình S).
A.4.4.2 Cách tiến hành
6 ml dung dịch của pha axetonitril thu được từ các quy trình E2, E5 hoặc E6 được chuyển vào ống ly tâm dùng một lần polypropylen (A.2.4) có chứa 150 mg PSA (A.1.15), 150 mg C18 (A.1.16) và 900 mg magie sulfat khan (A.1.14). Đóng chặt nắp, lắc mạnh trong 30 s bằng máy lắc (A.2.5) nếu cần thiết và ly tâm trong 5 min ở tốc độ lớn hơn 3 000 vòng/min. Tách và axit hóa dịch chiết đã làm sạch ngay như mô tả trong quy trình S nếu cần thiết.
Đối với 1 ml dịch chiết dùng 150 mg magie sulfat khan 25 mg PSA và 25 mg C18 nếu cần thiết.
CHÚ Ý: Rất hữu ích khi cho vào các ống ly tâm với chất hấp phụ chiết phân tán SPE cần cho một lô mẫu trước khi bắt đầu quá trình chiết.
Để giảm ảnh hưởng của nền mẫu, một phần của dịch chiết thô (V1) có thể được pha loãng với một thể tích xác định của dung môi thích hợp (V2) để tạo ra tổng thể tích (V1+V2) nếu đủ độ nhạy của hệ thống.
Nếu cần ổn định dịch chiết, dịch chiết đã được pha loãng được chuyển đến quy trình S1.
A.4.5.3 Tính toán
Nồng độ khối lượng của mẫu trong dịch chiết thô ![]() cho tỉ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. Thường
cho tỉ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. Thường ![]() thường được cho bằng g/ml và được tính bởi công thức A.27:
thường được cho bằng g/ml và được tính bởi công thức A.27:
![]() (A.27)
(A.27)
Trong đó:
![]() : nồng độ khối lượng của dịch chiết thô, g/ml;
: nồng độ khối lượng của dịch chiết thô, g/ml;
V1: thể tích dịch chiết thô sử dụng, ml;
V2: thể tích thêm vào của dung môi thích hợp, ml.
Tính nồng độ khối lượng của ISTD ![]() trong dịch chiết sau cùng với công thức A.28
trong dịch chiết sau cùng với công thức A.28
![]() (A.28)
(A.28)
Trong đó:
![]() : nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
: nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
![]() : thể tích ISTD thêm vào mẫu, ml;
: thể tích ISTD thêm vào mẫu, ml;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml;
V1: thể tích dịch chiết thô sử dụng, ml;
V2: thể tích thêm vào của dung môi thích hợp, ml.
A.4.5.4 Sơ đồ của quy trình C4

A.4.6 Quy trình C5: Làm sạch bằng cách chiết phân tán SPE với hỗn hợp chất hấp phụ amin (PSA) và graphit carbon
A.4.6.1 Nguyên tắc
Quy trình làm sạch này dùng cho dịch chiết thu được bởi quy trình E1 hoặc E7 đặc biệt cho việc xác định thuốc BVTV trung tính và kiềm trong dịch chiết mẫu với hàm lượng carotenoid hoặc diệp lục cao. Các quy trình làm sạch được đề xuất cho các nền mẫu khác được đưa ra trong Bảng 6.
Dịch chiết thô thu được từ các quy trình E1 hoặc E7 được làm sạch bằng chiết phân tán pha rắn (SPE) dùng hỗn hợp chất hấp phụ amin bậc 1 và bậc 2 (PSA) và graphit carbon (GCB). Dịch chiết đã làm sạch được dùng để ổn định dịch chiết (quy trình S).
A.4.6.2 Cách tiến hành
6 ml dung dịch của pha axetonitril thu được từ các quy trình E1 hoặc E7 được chuyển vào ống ly tâm dùng một lần polypropylen (A.2.4) có chứa 150 mg PSA (A.1.15), 900 mg magie sulfat khan (A.1.14) và 15 mg GCB (A.1.17) (quy trình C5a) hoặc 45 mg GCB (A.1.7) (quy trình C5b). Đóng chặt nắp, lắc mạnh trong 30 s bằng máy lắc (A.2.5) nếu cần thiết và ly tâm trong 5 min ở tốc độ lớn hơn 3 000 vòng/min. Tách và axit hóa dịch chiết đã làm sạch ngay như mô tả trong quy trình S nếu cần thiết.
Đối với 1 ml dịch chiết dùng 150 mg magie sulfat khan, 25 mg PSA và 2,5 mg GCB hoặc 7,5 mg GCB tùy thộc vào mẫu nếu cần thiết.
CHÚ Ý: Rất hữu ích khi cho vào các ống ly tâm với chất hấp phụ chiết phân tán SPE cần cho một lô mẫu trước khi bắt đầu quá trình chiết.
Để giảm ảnh hưởng của nền mẫu, một phần của dịch chiết thô (V1) có thể được pha loãng với một thể tích xác định của dung môi thích hợp (V2) để tạo ra tổng thể tích (V1+V2) nếu đủ độ nhạy của hệ thống.
Nếu cần ổn định dịch chiết, dịch chiết đã được pha loãng được chuyển đến quy trình S1.
A.4.5.3 Tính toán
Nồng độ khối lượng của mẫu trong dịch chiết thô ![]() cho tỉ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. Thường
cho tỉ lệ của lượng mẫu, từ dư lượng được chiết và thể tích chiết. Thường ![]() thường được cho bằng g/ml và được tính bởi công thức A.29:
thường được cho bằng g/ml và được tính bởi công thức A.29:
![]() (A.29)
(A.29)
Trong đó:
![]() : nồng độ khối lượng của dịch chiết thô, g/ml;
: nồng độ khối lượng của dịch chiết thô, g/ml;
V1: thể tích dịch chiết thô sử dụng, ml;
V2: thể tích thêm vào của dung môi thích hợp, ml.
Tính nồng độ khối lượng của ISTD ![]() trong dịch chiết sau cùng với công thức A.30
trong dịch chiết sau cùng với công thức A.30
![]() (A.30)
(A.30)
Trong đó:
![]() : nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
: nồng độ khối lượng của dung dịch ISTD thêm vào, µg/ml;
![]() : thể tích ISTD thêm vào mẫu, ml;
: thể tích ISTD thêm vào mẫu, ml;
Vchiết: thể tích pha hữu cơ sau khi chiết (thường là 10 ml), ml;
V1: thể tích dịch chiết thô sử dụng, ml;
V2: thể tích thêm vào của dung môi thích hợp, ml.
A.4.6.4 Sơ đồ của quy trình C5
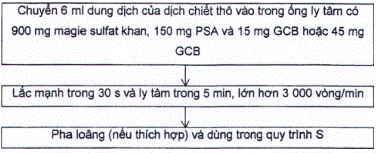
A.5 Mô tả các quy trình ổn định dịch chiết (S)
A.5.1 Quy trình S0: Không ổn định dịch chiết
A.5.1.1 Nguyên tắc
Quy trình này dùng cho dịch chiết thu được bởi các quy trình từ C0 đến C5, dùng xác định các thuốc BVTV nhạy với axit (như: flazasulfuron, mesosulfuron, tribenuron, triflusulfuron).
Dịch chiết thu được bởi các quy trình từ C0 đến C5 được chuyển đến các quy trình phát hiện (quy trình D) mà không cần xử lý.
A.5.1.2 Cách tiến hành
Dịch chiết thu được bởi các quy trình từ C0 đến C5 được chuyển đến các quy trình phát hiện (quy trình D) mà không cần xử lý. Chuyển dịch chiết vào vial (A.2.11) và dùng cho phân tích sắc ký khí và lỏng (quy trình D). Giữ dịch chiết còn lại trong tủ lạnh để dùng khi cần thiết.
A.5.1.3 Lược đồ của quy trình S0
| Chuyển dịch chiết vào vial (A.2.11) và dùng cho phân tích sắc ký khí và lỏng (quy trình D) |
A.5.2 Quy trình S1: Ổn định dịch chiết với axit formic
A.5.2.1 Nguyên tắc
Quy trình này dùng cho dịch chiết thu được bởi các quy trình từ C0 đến C5, dùng xác định các thuốc BVTV nhạy ổn định với axit.
Đối với các dịch chiết thu được bởi các quy trình từ C0 đến C5, thêm 10 µl dung dịch axit formic 5 % trong axetonitril/ ml và sau đó chuyển đến các quy trình phát hiện (quy trình D).
A.5.2.2 Cách tiến hành
Chuyển 5 ml dịch chiết thu được bởi các quy trình từ C0 đến C5 vào lọ có nắp vặn (A.2.12), cẩn thận để tránh các hạt chất hấp phụ bị lẫn vào và axit hóa nhẹ bằng cách thêm 50 µl dung dịch axit formic 5 % trong axetonitril (A.1.18) và lắc. Chuyển dịch chiết đã điều chỉnh pH vào vial (A.2.11) và sử dụng cho phân tích sắc ký khí và sắc ký lỏng (quy trình D). Giữ dịch chiết còn lại trong tủ lạnh để dùng khi cần thiết.
Đối với 1 ml dịch chiết cần dùng 10 µl dung dịch axit formic (A.1.18).
Ảnh hưởng của sự pha loãng gây ra bởi quá trình ổn định dịch chiết không được tính đến trong nồng độ khối lượng của mẫu trong dịch chiết sau cùng.
A.5.2.3 Lược đồ của quy trình S1
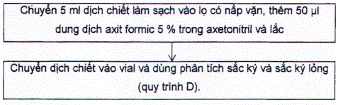
A.6 Mô tả quy trình phát hiện
A.6.1 Quy trình D1: Xác định bằng sắc ký lỏng với detector khối phổ hai lần (LC-MS/MS)
A.6.1.1 Nguyên tắc
Sắc ký lỏng detector khối phổ hai lần phù hợp với tất cả các chất phân tích được chiết bởi các quy trình từ E1 đến E9, những chất này có thể ion hóa ở áp suất khí quyển. Nên làm sạch bằng cách sử dụng một trong các quy trình từ C1 đến C5, nhưng không cần thiết trong mọi trường hợp vì độ chọn lọc cao của detector khối phổ hai lần.
A.6.1.2 Cách tiến hành
Bơm những dung dịch từ quy trình S0 hoặc S1 vào hệ thống sắc ký lỏng, được nối với detector khối phổ hai lần thông qua buồng ion hóa phun điện tử hoặc ion hóa hóa học ở áp suất khí quyển APCI.
A.6.1.3 Thiết bị
Phép đo có thể sử dụng nhiều loại thiết bị, thông số thiết bị và cột. Một số thông số thiết bị và cột được liệt kê trong quy trình này. Các điều kiện hoạt động của LC-MS/MS sau đây đã cho thấy là thích hợp, nhưng chỉ là ví dụ về các điều kiện thí nghiệm trên những thiết bị đã nêu. Sự thay đổi của những điều kiện này không phải là sự sai lệch so với phương pháp.
A.6.1.4 Ví dụ về những điều kiện thích hợp
A.6.1.4.1 Hệ thống HPLC 1
Với hầu hết các hợp chất dễ dàng phân tích được bằng LC
| Chương trình bơm | Hút 5 µl pha động A1 |
|
| Hút 1 µl mẫu |
|
| Rửa kim bơm với axetonitril |
|
| Hút 2 µl pha động A1 |
|
| Hút 1 µl mẫu |
|
| Rửa kim bơm với axetonitril |
|
| Hút 2 µl pha động A1 |
|
| Hút 1 µl mẫu |
|
| Rửa kim bơm với axetonitril |
|
| Hút 2 µl pha động A1 |
|
| Hút 1 µl mẫu |
|
| Rửa kim bơm với axetonitril |
|
| Hút 5 µl pha động A1 |
| Cột | Phenomenex Aqua 5 µ C18 125 A, 50 mm x 2 mm |
| Pha động A1 | Metanol/nước 2+8 (thể tích) có hàm lượng amoni format 5 mmol/l |
| Pha động B1 | Metanol/nước 9+1 (thể tích) có hàm lượng amoni format 5 mmol/l |
| Nhiệt độ cột | 20 °C |
Bảng A.2 - Tốc độ dòng và gradient rửa giải
| Thời gian | Tốc độ dòng | Pha động A1 | Pha động B1 |
| min | µl/min | % | % |
| 0 | 200 | 100 | 0 |
| 11 | 200 | 0 | 100 |
| 23 | 200 | 0 | 100 |
| 25 | 200 | 100 | 0 |
| 33 | 200 | 100 | 0 |
A.6.1.4.2 Hệ thống HPLC 2
Với hầu hết các hợp chất dễ dàng phân tích được bằng LC
| Cột | Waters Acquity UPLC BEH C18, 50 mm x 2,1 mm, kích thước hạt 1,7 µm |
| Pha động A1 | Metanol/nước 2+8 (thể tích) có hàm lượng amoni format 5 mmol/l |
| Pha động B1 | Metanol/nước 9+1 (thể tích) có hàm lượng amoni format 5 mmol/l |
| Nhiệt độ cột | 20 °C |
| Thể tích bơm | 3 µl |
Bảng A.3 - Tốc độ dòng và gradient rửa giải
| Thời gian min | Tốc độ dòng µl/min | Pha động A1 % | Pha động B1 % |
| 0 | 400 | 100 | 0 |
| 6,1 | 400 | 0 | 100 |
| 12,7 | 400 | 0 | 100 |
| 13,8 | 400 | 100 | 0 |
| 18,2 | 400 | 100 | 0 |
A.6.1.4.3 Hệ thống HPLC 3
Với các hợp chất acid:
| Cột | ZorbaxXDB C18,150mmx2,1 mm, kích thước hạt 3,5µm |
| Pha động A2 | Dung dịch axit axetic trong nước, 0,1 ml axit axetic pha thành 1000 ml bằng nước |
| Pha động B2 | Dung dịch axit axetic trong axetonitril, 0,1 ml axit axetic pha thành 1000 ml bằng axetonitril |
| Nhiệt độ cột | 40 °C |
| Thể tích bơm | 5 µl |
Bảng A.4 - Tốc độ dòng và gradient rửa giải
| Thời gian min | Tốc độ dòng µl/min | Pha động A2 % | Pha động B2 % |
| 0 | 300 | 80 | 20 |
| 20 | 300 | 0 | 100 |
| 22 | 300 | 0 | 100 |
| 22,1 | 300 | 80 | 20 |
| 30 | 300 | 80 | 20 |
A.6.1.4.4 Hệ thống MS/MS 1
| Thiết bị MS/MS | AB Sciex QTRAP 5500 |
| Nguồn ion | Turbo Ion Spray (ESI) |
Bảng A.5 - Nguồn ion và các thông số chung
| Khí chắn (curtain gas) | Nitơ, 40 psi | Nhiệt độ khí 2 | 400 °C |
| Khí va chạm (collision gas) | Nitơ, 2 đơn vị | Độ phân giải MS1/MS2 0,7 aum (FWHMa) | |
| Điện áp phun | 5 500 V | Thời gian quét lớn hơn hoặc bằng 3 ms (tùy thuộc độ nhạy MRM) | |
| Khí 1 | Nitơ, 40 psi | ||
| Khí 2 | Nitơ, 40 psi | ||
| a FWHM = Bề rộng tại nửa độ cao đỉnh (khối phổ) | |||
A.6.1.4.5 Hệ thống MS/MS 2
| Thiết bị MS/MS | Agilent 6460A |
| Nguồn ion | Jet Stream Source (ESI) |
Bảng A.6 - Nguồn ion và các thông số chung
| Tốc độ dòng khí làm khô | 6 l/min | Nhiệt độ khí bay hơi (sheath gas) | 400 °C |
| Nhiệt độ khí làm khô (drying gas) | 325 °C | Điện áp phun (nozzle voltage) | tắt |
| Áp suất khí phun (nebulizer gas) | 35 psi | Độ phân giải MS1/MS2 | đơn vị |
| Điện áp mao quản | 4 000 V | Thời gian quét lớn hơn hoặc bằng 3 ms (tùy thuộc độ nhạy MRM) | |
| Tốc độ dòng khí bay hơi (sheath gas) | 12 l/min | ||
A.6.1.4.6 Hệ thống MS/MS 3
| Thiết bị MS/MS | Waters Xevo TQS |
| Nguồn ion | Electrospray |
Bảng A.7- Nguồn ion và các thông số chung
| Khí chắn (curtain gas) | Nitơ, 150 l/h | Nhiệt độ solvat hóa | 500-600 °C |
| Khí va chạm (collision gas) | Argon, 0,15 ml/min | Độ phân giải MS1/MS2 0,7 amu (FWHMa) | |
| Điện áp phun ion | 800 V | Thời gian quét lớn hơn hoặc bằng 3 ms (tùy thuộc độ nhạy MRM) | |
| Khí 1 (phun sương) | 7 bar | ||
| Khí 2 (solvat hóa) | 800-1000 l/h | ||
| a FWHM = Bề rộng tại nửa độ cao đỉnh (khối phổ) | |||
A.6.1.5 Nhận xét
Để biết các điều kiện thí nghiệm phù hợp của phương pháp phân tích bằng LC-MS/MS, xem CEN/TR 15641:2007, Determination of pesticide residues by LC-MS/MS - Collection of mass spectrometric parameters (Xác định dư lượng thuốc BVTV bằng LC-MS/MS - Tập hợp các thông số khối phổ). Tuy nhiên, hiệu chỉnh riêng cho từng hợp chất trên thiết bị phân tích thường cho độ nhạy cao hơn.
Đối phương pháp phân tích LC-MS/MS, cột sắc kí pha đảo có tỷ lệ nước cao trong quá trình rửa giải đặc biệt phù hợp.
Việc sử dụng kết hợp gradient/cột cho các hợp chất phân cực cao cần pha loãng dịch chiết với nước hoặc pha động A để hình dạng pic và độ phân giải sắc ký đồ tốt. Trong những trường hợp này, cần phải xem xét việc tăng hàm lượng nước có thể gây ra sự kết tủa của các hợp chất ưa dầu, gây ra mất mát trong quá trình lọc. Do đó, nên pha loãng tự động các dung dịch bằng thiết bị bơm (xem A.6.1.4.1.).
Mặc dù tính chọn lọc cao của detector MS/MS, nên xem xét ít nhất hai lần phân mảnh của mỗi chất phân tích để xác định chắc chắn. Cần phải xem xét trong việc lựa chọn số lần phân mảnh đồng thời để số lượng điểm đo cho một pic ít nhất là 10. Do đó, nên sử dụng thuật toán tự động (như “scheduled MRM” or “triggered MRM”) để thu được sự phân mảnh điển hình của chất phân tích xung quanh thời gian lưu dự kiến của chất phân tích.
Trong một chuỗi dung dịch chuẩn phải được bơm thường xuyên, xem thêm các yêu cầu của Quy trình kiểm soát chất lượng của EU [5].
A.6.2 Quy trình D2: Xác định bằng sắc ký lỏng ghép khối phổ phân giải cao (LC-khối phổ phân giải cao)
A.6.2.1 Nguyên tắc
Sắc ký lỏng detector khối phổ chính xác phù hợp với tất cả các chất phân tích được chiết bởi quy trình từ E1 đến E9, những chất có thể ion hóa ở áp suất khí quyển. Nên làm sạch bằng cách sử dụng một trong các quy trình từ C1 đến C5, nhưng không cần thiết trong mọi trường hợp vì độ chọn lọc cao của detector khối phổ hai lần.
A.6.2.2 Cách tiến hành
Bơm những dung dịch từ quy trình S0 hoặc S1 vào hệ thống sắc ký lỏng, được nối với detector khối phổ chính xác thông qua buồng ion hóa phun điện tử hoặc ion hóa hóa học ở áp suất khí quyển APCI.
A.6.2.3 Thiết bị
Phép đo có thể sử dụng nhiều loại thiết bị, thông số thiết bị và cột. Một số thông số thiết bị và cột được liệt kê trong quy trình này. Các điều kiện hoạt động của LC-khối phổ phân giải cao sau đây đã cho thấy là thích hợp, nhưng chỉ là ví dụ về các điều kiện thí nghiệm trên những thiết bị đã nêu. Sự thay đổi của những điều kiện này không phải là sự sai lệch so với phương pháp.
A.6.2.4 Ví dụ về những điều kiện thích hợp
A.6.2.4.1 Hệ thống LC1
Với hầu hết các hợp chất dễ dàng phân tích được bằng LC
| UHPLC | Agilent 1290 Infinity |
| Thể tích bơm | 3 µl |
| Cột | Agilent Zorbax Eclipse Plus Rapid Resolution HD, 1,8µm,100mm x 2,1 mm |
| Pha động A3 | Nước có hàm lượng amoni format 5 mmol/l và axit formic 0,1 % |
| Pha động B3 | Metanol có hàm lượng amoni format 5 mmol/l và axit formic 0,1 % |
| Nhiệt độ cột | 30 °C |
Bảng A.8 - Tốc độ dòng và gradient rửa giải
| Thời gian min | Tốc độ dòng µl/min | Pha động A3 % | Pha động B3 % |
| 0 | 300 | 80 | 20 |
| 2 | 300 | 80 | 20 |
| 15 | 300 | 0 | 100 |
| 17 | 300 | 0 | 100 |
| 17,1 | 300 | 80 | 20 |
| 19 | 300 | 80 | 20 |
A.6.2.4.2 Hệ thống LC2
Với hầu hết các hợp chất dễ dàng phân tích được bằng LC
| Bơm HPLC | DIONEX Ultimate 3000 RS |
| Bộ lấy mẫu tự động | DIONEX Ultimate 3000 RS |
| Thể tích bơm | 10 µl |
| Cột | Thermo Scientific Acclaim RSLC 120 C18, 2,2 µm -120 A -100 mm x 2,1 mm |
| Cột bảo vệ | WATERS Vanguard Acquity UPLC BEH C18 1,7 µm - 2,1 x 5 mm |
| Pha động A4 | Metanol/nước 1+9 (thể tích) có hàm lượng amoni format 5 mmol/l và axit formic 0,1 % |
| Pha động B4 | Metanol có hàm lượng amoni format 5 mmol/l và axit formic 0,1 % |
| Nhiệt độ cột | 30 °C |
Bảng A.9 - Tốc độ dòng và gradient rửa giải
| Thời gian min | Tốc độ dòng µl/min | Pha động A4 % | Pha động B4 % |
| 0 | 200 | 99 | 1 |
| 0,1 | 200 | 99 | 1 |
| 1 | 200 | 99 | 1 |
| 3 | 200 | 61 | 39 |
| 14 | 400 | 0,1 | 99,9 |
| 16 | 480 | 0,1 | 99,9 |
| 16,1 | 480 | 99 | 1 |
| 19 | 480 | 99 | 1 |
| 19,1 | 200 | 99 | 1 |
| 20 | 200 | 99 | 1 |
A.6.2.4.3 Hệ thống LC3
| Bơm HPLC | Dionex Ultimate 3000 binary pump HPG-3400RS |
| Bộ lấy mẫu tự động | Dionex Ultimate 3000 RS |
| Cột | Thermo Scientific Accucore aQ C18,100 mm x 2,1 mm, kích thước hạt 2,6 µm |
| Pha động A3 | Nước có hàm lượng amoni format 5 mmol/l và axit formic 0,1 % |
| Pha động B3 | Metanol có hàm lượng amoni format 5 mmol/l và axit formic 0,1 % |
| Nhiệt độ cột | 40 °C |
Bảng A.10 - Tốc độ dòng và gradient rửa giải
| Thời gian min | Tốc độ dòng µl/min | Pha động A3 % | Pha động B3 % |
| 0 | 400 | 80 | 20 |
| 1 | 400 | 80 | 20 |
| 10,5 | 400 | 2 | 98 |
| 14,5 | 400 | 2 | 98 |
| 15 | 400 | 80 | 20 |
| 19 | 400 | 80 | 20 |
A.6.2.4.4 Hệ thống LC4
| UPLC | Agilent 1290 Infinity |
| Thể tích bơm | 5 µl |
| Cột | Dionex Acclaim RSLC 120 C18 (2,2 µm; 120 A; 2,1 mm x 100 mm) |
| Pha động A5 | Nước có hàm lượng amoni hydroxit 5 mmol/l |
| Pha động B5 | Axetonitril có hàm lượng axit formic 0,1% |
| Nhiệt độ cột | 30 °C |
Bảng A.11 - Tốc độ dòng và gradient rửa giải
| Thời gian min | Tốc độ dòng µl/min | Pha động A5 % | Pha động B5 % |
| 0 | 0,2 | 90 | 10 |
| 1 | 0,2 | 90 | 10 |
| 3 | 0,2 | 60 | 40 |
| 14 | 0,4 | 10 | 90 |
| 16 | 0,2 | 10 | 90 |
| 16,1 | 0,2 | 90 | 10 |
| 20 | 0,2 | 90 | 10 |
A.6.2.4.5 Hệ thống LC5
| HPLC | ACQUITT UPLC I-Class BSM |
| Bộ lấy mẫu tự động | ACQUITT I-Class FTN |
| Thể tích bơm | 5 µl |
| Cột | WatersAcquityUPLCBEHC18, 100mmx2,1 mm, kích thước hạt 1,7µm |
| Pha động A6 | Nước có hàm lượng amoni format 10 mmol/l |
| Pha động B6 | Metanol có hàm lượng amoni format 10 mmol/l |
| Nhiệt độ cột | 45 °C |
Bảng A.12 - Tốc độ dòng và gradient rửa giải
| Thời gian min | Tốc độ dòng µl/min | Pha động A6 % | Pha động B6 % |
| 0 | 0,45 | 98 | 2 |
| 0,25 | 0,45 | 98 | 2 |
| 12,25 | 0,45 | 1 | 99 |
| 13 | 0,45 | 1 | 99 |
| 13,01 | 0,45 | 98 | 2 |
| 17 | 0,45 | 98 | 2 |
A.6.2.4.6 Hệ thống khối chính xác 1
| Thiết bị khối phổ phân giải cao | ABSciexTripleTOF5600+ |
| Nguồn ion | DuoSpray IonSource (ESI) |
Bảng A.13 - Nguồn ion và các thông số chung
| Khí nguồn ion 1 | Nitơ, 30 l/min |
| Khí nguồn ion 2 | Nitơ, 30 l/min |
| Khí chắn (curtain gas) | 20 |
| Nhiệt độ | 400 °C |
| Điện áp dòng phun ion | 5 000 V |
A.6.2.4.7 Hệ thống khối chính xác 2
| Thiết bị khối phổ phân giải cao | BRUKER IMPACT II |
| Nguồn ion | Turbo Ion Spray (ESI) |
Bảng A.14 - Nguồn ion
| End plate offset | 500 |
| Điện áp mao quản | 2500 V |
| Phun sương (nebulizer) | 31 psi |
| Khí làm khô (DryGas) | 8 l/min |
| Nhiệt độ khí làm khô | 200 °C |
A.6.2.4.8 Hệ thống khối chính xác 3
| Thiết bị khối phổ phân giải cao | Thermo Scientific Q-Exactive |
| Nguồn ion | Heated Electrospray Ionization Source (HESI II) ion hóa dương |
Bảng A.15 - Các thông số nguồn ion
| Tốc độ dòng khí bay hơi (sheath gas) | Nitơ, 45 l/min | Nhiệt độ mao quản | 250 °C |
| Tốc độ dòng khí bổ trợ (Aux gas) | Nitơ, 4 l/min | S-lens RF level | 50 |
| Tốc độ dòng khí quét (Sweep gas) | Nitơ, 2 l/min | Nhiệt độ khí bổ trợ | 230 °C |
| Điện áp phun | 3,80 (kV) |
|
|
A.6.2.4.9 Hệ thống khối chính xác 4
| Thiết bị khối phổ phân giải cao | 6550 iFunnel QTOF LC/MS, Agilent Technologies |
| Nguồn ion | Agilent Jet stream ESI |
Bảng A.16 - Nguồn ion và các thông số chung
| Khí làm khô (Drying gas) | Nitơ, 13 l/min | Nhiệt độ khí bay hơi (sheath gas) | 400 °C |
| Tốc độ dòng khí bay hơi (sheath gas) | Nitơ, 12 l/min | Khí va chạm (Collision gas) | Nitơ, 2 đơn vị |
| Điện áp phun ion | 4 000 V |
| |
A.6.2.4.10 Hệ thống khối chính xác 5
| Thiết bị khối phổ phân giải cao | Xevo G2-S QTof (TDA172) |
| Nguồn ion | Z-Spray (ESI) |
Bảng A.17 - Nguồn ion và các thông số chung
| G2-S QTof | ||
| Kiểu ion hóa | ESI (+) | ESI (-) |
| Kiểu phân tích | Sensitivity | Sensitivity |
| Mao quản | 1,0 kV | 1,5 kV |
| Nhiệt độ nguồn ion hóa | 120 °C | 120 °C |
| Khí côn (Nitơ) | 50 l/h | 10 l/h |
| Điện thế côn (sample cone) | 40 V | 40 V |
| Nhiệt đô solvat hóa | 550 °C | 350 °C |
| Khí solvat hóa | 1000 l/h | 900 h |
A.6.2.5 Nhận xét
Đối với LC-khối phổ phân giải cao, cột sắc kí pha đảo có tỷ lệ nước cao trong quá trình rửa giải đặc biệt phù hợp.
Việc sử dụng kết hợp gradient/cột cho các hợp chất phân cực cao cần pha loãng dịch chiết với nước hoặc pha động A để hình dạng pic và độ phân giải sắc ký đồ tốt. Trong những trường hợp này, cần phải xem xét việc tăng hàm lượng nước có thể gây ra sự kết tủa của các hợp chất ưa dầu, gây ra mất mát trong quá trình lọc. Do đó, nên pha loãng tự động các dung dịch bằng thiết bị bơm.
Mặc dù tính chọn lọc cao của detector MS/MS, nên xem xét ít nhất hai lần phân mảnh của mỗi chất phân tích để xác định chắc chắn. Cần phải xem xét trong việc lựa chọn số lần phân mảnh đồng thời để số lượng điểm đo cho một pic ít nhất là 10. Do đó, nên sử dụng thuật toán tự động (như “scheduled MRM” or “triggered MRM”) để thu được sự phân mảnh điển hình của chất phân tích xung quanh thời gian lưu dự kiến của chất phân tích.
Nên thực hiện đồng thời SCAN và MS/MS. Để phát hiện và xác định hai hoặc nhiều ion (tốt nhất là bao gồm ion phân tử) với khối phổ chính xác tốt hơn yêu cầu lớn hơn 5 ppm. Nếu mảnh ion được lấy ở chế độ MS/MS thì độ chính xác khối lượng chấp nhận được là nhỏ hơn 10 ppm. Để định lượng, có thể sử dụng số khối trong khoảng rộng hơn.
Trong một chuỗi dung dịch chuẩn phải được bơm thường xuyên, xem thêm các yêu cầu của Quy trình kiểm soát chất lượng của EU [5].
A.6.3 Quy trình D3: Xác định bằng thiết bị sắc ký khí ghép khối phổ hai lần (GC-MS/MS)
A.6.3.1 Nguyên tắc
Thiết bị sắc ký khí ghép khối phổ hai lần phù hợp với tất cả các chất phân tích được chiết bởi các quy trình từ E1 đến E7, những chất có thể bay hơi mà không bị phân hủy. Nên làm sạch bằng cách sử dụng một trong các quy trình từ C1 đến C5, nhưng không cần thiết trong mọi trường hợp vì độ chọn lọc cao của detector khối phổ hai lần.
A.6.3.2 Cách tiến hành
Bơm những dung dịch từ quy trình S0 hoặc S1 vào hệ thống sắc ký khí, được nối với detector khối phổ hai lần thông qua buồng va chạm electron. Phép đo có thể sử dụng nhiều loại thiết bị GC-MS/MS, thông số thiết bị và cột.
A.6.3.3 Thiết bị
Các điều kiện hoạt động sau của GC-MS/MS cho thấy là thích hợp, nhưng chỉ là ví dụ về các điều kiện thí nghiệm trên những thiết bị đã nêu. Sự thay đổi của những điều kiện này không phải là sự sai lệch so với phương pháp.
A.6.3.4 Ví dụ về những điều kiện thích hợp
A.6.3.4.1 Thiết bị 1
| Thiết bị | ThermoFischerScientific;TSQQuantumXLS, TraceGC Ultrawith PTV |
| Khí mang | Heli, 1,0 ml/min, đẳng dòng |
| Bộ phận bơm mẫu | Hóa hơi theo chương trình nhiệt độ (PTV) với Siltek baffled liner 2 mmID |
| Kĩ thuật bơm mẫu | Không chia dòng, chương trình PTV |
| Thể tích bơm | 1 µl, dịch chiết trong aceton/hexan (1/1, thể tích) (xem B.10) |
| Chương trình nhiệt độ bơm mẫu | Giữ ở 70 °C trong 0,02 min, tăng 72 °C/min đến 280 °C, giữ ở 280 °C trong 1,2 min, tăng 84 °C/min đến đạt 320 °C, giữ 6 min |
| Injector purge | 0,0 min đến 1,3 min không purge, 1,3 min đến 6,0 min 80 ml/min (dòng làm sạch), sau 6,0 min 50 ml/min chia dòng |
| Cột | Cột mao quản 5 % phenyl / 95 % dimethylsiloxan, chiều dài 20 m, đường kính trong 0,18 mm, độ dày lớp phủ 0,18 µm (ví dụ Restek RXi-5SiI MS) |
| Nhiệt độ cột | Giữ ở 80 °C trong 1,5 min, tăng 30 °C/min đến 210 °C, tăng 20 °C/min đến 320 °C, giữ ở 320 °C trong 2 min. |
| Nhiệt độ giao diện ghép nối sắc ký-khối phổ | 280 °C |
| Độ trễ của dung môi (solvent delay) | 3,5 min |
| Ion hóa | EI, 70 eV, 25 µA |
| Nhiệt độ nguồn ion hóa | 250 °C |
| Độ phân giải MS1/MS2 | 0,7 đơn vị |
| Khí va chạm | Argon, 1,4 x 10 -3 Torr |
| Những điều kiện này được đưa ra trong Thermo Application Note 52027 [9] | |
| A.6.3.4.2 Thiết bị 2 |
|
| Thiết bị | Agilent GC 6890N, Kodiak 800 MS/MS |
| Khí mang | Heli, 21 psi, đẳng áp |
| Bộ phận bơm mẫu | Hóa hơi theo chương trình nhiệt độ (PTV) |
| Kĩ thuật bơm mẫu | Chương trình PTV với solvent delay |
| Thể tích bơm mẫu | 3 µl |
| Chương trình nhiệt độ bơm mẫu | Giữ ở nhiệt độ 40 °C trong 0,8 min, tăng 72 °C/min đến khi đạt 300 °C, giữ trong 5 min |
| Injector purge | 0,0 min đến 0,5 min 10 ml/min (vent flow), 0,5 min đến 2,5 min không purge, sau 2,5 min 50 ml/min purge flow |
| Cột | Cột mao quản 5 % phenyl / 95 % dimethylsiloxane, chiều dài 30 m, đường kính trong 0,25 mm, độ dày lớp phủ 0,25 µm (ví dụ J&W HP5MS) |
| Nhiệt độ cột | Giữ ở 70 °C trong 2 min, tăng 25 °C/min đến 150 °C, tăng 3 °C/min đến 180 °C, tăng 20 °C/min đến 280 °C giữ ở 280 °C trong 2 min. |
| Nhiệt độ giao diện ghép nối sắc ký-khối phổ | 250 °C |
| Solvent delay | 6,5 min |
| Ion hóa | EI, 70 eV |
| Nhiệt độ nguồn ion hóa | 200 °C |
| Độ phân giải MS1/MS2 | 0,7 đơn vị |
| Khí va chạm (collision gas) | Argon, 1,4 x 10-3 Torr |
A.6.3.4.3 Thiết bị 3
Các tham số sau đây là một ví dụ cho việc sử dụng kĩ thuật ngược dòng (backflush)
| Thiết bị | Agilent GC 6890N, Triplequad 7000 |
| Khí mang | Heli |
| Chương trình khí mang | Khóa thời gian lưu chlorpyrifos-methyl ở 16,5 min |
| Chương trình backflush | Sau 41,87 min: áp suất đầu vào 1 psi, áp suất backflush 30 psi |
| Bộ phận bơm mẫu | Hóa hơi theo chương trình nhiệt độ (PTV) |
| Kĩ thuật bơm mẫu | Không chia dòng |
| Thể tích bơm mẫu | 2 µl |
| Chương trình nhiệt độ bơm mẫu | Giữ ở 70 °C trong 2 min, tăng 25 °C/min đến 150 °C, tăng 3 °C/min đến 180 °C, tăng 20 °C/min đến 280 °C giữ ở 280 °C trong 10 min, giữ ở 280°C trong 3 min (backflush) |
| Injector purge | 0,0 min đến 0,75 min dòng septum purge 3 ml/min, 0,75 min đến 2,0 min dòng purge flow đến split vent 30 ml/min, sau 2,0 min Gas saver 20 ml/min |
| Cột | Cột mao quản với 5 % phenyl/95 % dimethylsiloxane, chiều dài 30 m, đường kính trong 0,25 mm, độ dày lớp phủ 0,25 µm (ví dụ: DB5 MS) |
| Nhiệt độ cột | 70 °C đẳng nhiệt trong 2 min, tăng ở 25 °C/min đến 150 °C, tăng ở 3 °C / min đến 180 °C, tăng ở 20 °C / min đến 280 °C, đẳng nhiệt ở 280 °C trong 10 min, post run (backflush) 3 min ở 280 °C |
| Nhiệt độ đường truyền | 280 °C |
| Solvent delay | 3,75 min |
| Ion hóa | EI, 70 eV |
| Nhiệt độ nguồn ion hóa | 300 °C |
| Độ phân giải MS1/MS2 | 1,2 đơn vị |
| Khí khử | Heli, 2,25 ml / min |
| Khí va chạm | Nitơ, 1,5 ml / min |
| Time filterpeak width | 0,7 s |
A.6.3.5 Nhận xét
Để biết các điều kiện thí nghiệm phù hợp của phương pháp phân tích bằng GC-MS/MS, xem CEN/TR 16699 Foodstuffs - Determination of pesticide residues by GC-MS/MS - Tandem mass spectrometric parameters (Thực phẩm-Xác định dư lượng thuốc BVTV bằng GC-MS/MS - Thông số khối phổ 2 lần)[3]. Tuy nhiên, hiệu chỉnh riêng cho từng hợp chất trên thiết bị phân tích thường cho độ nhạy cao hơn.
Đối phương pháp phân tích GC-MS/MS, cột sắc kí không phân cực đặc biệt phù hợp, ví dụ: 100 % methylsiloxane hoặc 5 % phenyl và 95 % methylsiloxane.
Khi bộ phận bơm mẫu hoặc đầu cột bị nhiễm bẩn có thể gây ra sự phân hủy một phần của một số chất phân tích và thay đổi thời gian lưu. Để tránh trường hợp này, hỗn hợp bảo vệ chất phân tích phù hợp để sử dụng bao gồm D-sorbitol (99,5 %), glucono-delta-lactone, axit Shikimi và 3-ethoxy-1,2-propandiole. Hỗn hợp chất bảo vệ được pha như sau: cân 2 g 3-ethoxy-1,2-propandiole trong bình định mức 10 ml, sau đó thêm 2 ml dung dịch glucono-delta-lactone 5 %, 1 ml dung dịch D-sorbitol 5 % và 1 ml dung dịch axit Shikimi 5 %. Định mức đến 10 ml bằng dung môi acetonitril/nước (60/40, thể tích). 30 µl hỗn hợp chất bảo vệ chất phân tích được thêm vào 1 ml dịch chiết sau cùng.
Chức năng backflush được khuyến khích sử dụng. Khi sử dụng chức năng backflush, dòng bị đảo ngược sau khi rửa giải hết các chất phân tích cần quan tâm, do đó, các hợp chất ít bay hơi còn lại trên cột được thổi ngược qua cột và thoát qua qua ngã chia dòng. Do đó, việc thay đổi thời gian lưu và nhiễm bẩn nguồn ion có thể được giảm thiểu.
Mặc dù tính chọn lọc cao của detector MS/MS, nên xem xét ít nhất hai lần phân mảnh của mỗi chất phân tích để xác định chắc chắn. Cần phải xem xét trong việc lựa chọn số lần phân mảnh đồng thời để số lượng điểm đo cho một pic ít nhất là 10. Do đó, nên sử dụng thuật toán tự động (như “scheduled MRM” or “triggered MRM”) để thu được sự phân mảnh điển hình của chất phân tích xung quanh thời gian lưu dự kiến của chất phân tích.
Trong một chuỗi dung dịch chuẩn phải được bơm thường xuyên, xem thêm các yêu cầu của Quy trình kiểm soát chất lượng của EU [5].
A.6.4 Phương pháp D4: Xác định bằng sắc ký khí với detector khối phổ (GC-MS)
A.6.4.1 Nguyên tắc
Sắc ký khí với detector khối phổ tứ cực (được ưu tiên trong chế độ SIM), detector bẫy ion và detector thời gian bay (không phụ thuộc vào độ phân giải MS) phù hợp với tất cả các phân tích chiết được bằng các quy trình từ E1 đến E7, dễ bay hơi mà không bị phân hủy sau khi làm sạch bằng một trong các quy trình từ C1 đến C5. Phân tích GC-MS mà không làm sạch chỉ có thể áp dụng nếu các dịch chiết được pha loãng nhiều lần (phương pháp C0).
A.6.4.2 Cách tiến hành
Bơm những dung dịch từ quy trình S0 hoặc S1 vào hệ thống sắc ký khí, với detector khối phổ. Phép đo có thể sử dụng nhiều loại thiết bị GC-MS, thông số thiết bị và cột.
A.6.4.3 Thiết bị
Các điều kiện hoạt động sau của GC-MS cho thấy là thích hợp, nhưng chỉ là ví dụ về các điều kiện thí nghiệm trên những thiết bị đã nêu. Sự thay đổi của những điều kiện này không phải là sự sai lệch so với phương pháp.
A.6.4.4 Ví dụ về các điều kiện thích hợp
A.6.4.4.1 Thiết bị 1
| Thiết bị | Agilent GC 6890B GC/5973N MSD |
| Khí mang | Heli, 2,0 ml/min, đẳng dòng |
| Bộ phận bơm mẫu | Hệ thống bơm lạnh KAS (CIS/PTV) |
| Kĩ thuật bơm mẫu | Hệ thống bơm lạnh delay dung môi |
| Thể tích bơm mẫu | 3 µl |
| Chương trình nhiệt độ bơm mẫu | Giữ ở 50 °C trong 0,8 min, tăng 72 °C/min đến 280 °C, giữ trong 5 min ở 280 °C, tăng 72 °C/min đến 300 °C, giữ trong 5 min ở 300 °C |
| Injector purge | 0,0 min đến 0,5 min 20 ml/min (vent flow), 0,5 min đến 2,0 min không purge, 2,0 min đến 6,0 min 47,4 ml/min (purge flow), after 6,0 min Gas saver 20 ml/min |
| Cột | Cột mao quản 5 % phenyl/95 % dimethylsiloxane, chiều dài 30 m đường kính trong 0,25 mm, độ dày lớp phủ 0,25 μm (ví dụ: DB5 MS) |
| Nhiệt độ cột | Giữ ở nhiệt độ 40 °C trong 2,0 min, tăng 30 °C/min đến 220 °C, , tăng 5 °C/min đến 260 °C, tăng 20 °C/min đến 280 °C, giữ trong 15 min ở 280 °C |
| Nhiệt độ giao diện ghép nối sắc ký-khối phổ | 280 °C |
| Solvent delay | 4,0 min |
| Ion hóa | EI, 70 eV |
| Nhiệt độ nguồn ion hóa | 230 °C |
| A.6.4.4.2 Thiết bị 2 |
|
| Thiết bị | Agilent GC 6890B GC/5973N MSD |
| Khí mang | Heli, 1,0 ml/min, đẳng dòng |
| Bộ phận bơm mẫu | Split/splitless |
| Kĩ thuật bơm mẫu | Pulsed splitless, 200 kPa, pulse time 1,0 min |
| Thể tích bơm mẫu | 1 µl |
| Chương trình nhiệt độ bơm mẫu | 240 °C |
| Injector purge | 1,5 min sau khi bơm (thời gian purge) dòng purge tới van chia dòng 50 ml/min |
| Cột | Cột mao quản 5 % phenyl/95 % dimethylsiloxane, chiều dài 30 m, đường kính trong 0,25 mm, độ dày lớp phủ 0,25 µm (ví dụ: DB5 MS) |
| Nhiệt độ cột | Giữ ở 70 °C trong 2,0 min, tăng 25 °C/min đến 170 °C, , tăng 3 °C/min đến 210 °C, tăng 30 °C/min đến 290 °C, giữ trong 9 min ở 290 °C. |
| Nhiệt độ dòng | 280 °C |
| Solvent delay | 6,0 min |
| Ion hóa | EI, 70 eV |
| Nhiệt độ nguồn ion hóa | 230 °C |
A.6.4.5 Nhận xét
Để biết thời gian lưu và các mảnh ion đặc trưng, xem CEN/TR 16468, Food analysis - Determination of pesticide residues by GC-MS - Retention times and mass spectrometric parameters (Phân tích thực phẩm - Xác định dư lượng thuốc BVTV bằng GC-MS-Thời gian lưu và các thông số khối phổ)[4].
Đối với phương pháp phân tích GC-MS, cột sắc kí không phân cực đặc biệt phù hợp, ví dụ: 100 % methylsiloxane hoặc 5 % phenyl và 95 % methylsiloxane. Để xác nhận những chất phân cực sử dụng cột có độ phân cực cao hơn, ví dụ: 50 % phenyl- và 50 % methylsiloxane hoặc 14 % cyanopropylphenyl- và 86 % methylsiloxane.
Khi bộ phận bơm mẫu hoặc đầu cột bị nhiễm bẩn có thể gây ra sự phân hủy một phần của một số chất phân tích và thay đổi thời gian lưu. Để tránh trường hợp này, hỗn hợp bảo vệ chất phân tích phù hợp để sử dụng bao gồm D-sorbitol (99,5 %), glucono-delta-lactone, axit Shikimi và 3-ethoxy-1,2-propandiole. Hỗn hợp chất bảo vệ được pha như sau: cân 2 g 3-ethoxy-1,2-propandiole trong bình định mức 10 ml, sau đó thêm 2 ml dung dịch glucono-delta-lactone 5 %, 1 ml dung dịch D-sorbitol 5 % và 1 ml dung dịch axit Shikimi 5 %. Định mức đến 10 ml bằng dung môi acetonitril/nước (60/40, thể tích). 30 µl hỗn hợp chất bảo vệ chất phân tích được thêm vào 1 ml dịch chiết sau cùng.
Chức năng backflush được khuyến khích sử dụng. Khi sử dụng chức năng backflush, dòng bị đảo ngược sau khi rửa giải hết các chất phân tích cần quan tâm, do đó, các hợp chất ít bay hơi còn lại trên cột được thổi ngược qua cột và thoát qua qua ngã chia dòng. Do đó, việc thay đổi thời gian lưu và nhiễm bẩn nguồn ion có thể được giảm thiểu.
Để xác định các hợp chất sử dụng khối phổ một lần chọn lọc ion (SIM) nhạy hơn quét toàn dãy phổ. Trong chế độ SIM, yêu cầu ít nhất 3 ion khối lượng để định danh chắc chắn chất phân tích. Cần phải xem xét trong việc lựa chọn số lần phân mảnh đồng thời để số lượng điểm đo cho một pic ít nhất là 10.
Nếu việc đánh giá định lượng của một pic chất phân tích bị ảnh hưởng của những pic của những hợp chất cộng chiết thì dung dịch chuẩn của chất phân tích trong cùng nền mẫu không có dư lượng nên được đo để so sánh.
Trong một chuỗi dung dịch chuẩn phải được bơm thường xuyên, xem thêm các yêu cầu của Quy trình kiểm soát chất lượng của EU [5].
A.6.5 Phương pháp D5: Xác định bằng sắc ký khí với detector quang hóa ngọn lửa (GC-FPD)
A.6.5.1 Nguyên tắc
Sắc ký khí với detector quang hóa ngọn lửa phù hợp với tất cả các phân tích có chứa phospho và lưu huỳnh chiết được bằng các quy trình từ E1 đến E7, dễ bay hơi mà không bị phân hủy sau khi làm sạch bằng một trong các quy trình từ C1 đến C5. Phân tích GC-FPD mà không làm sạch chỉ có thể áp dụng nếu các dịch chiết được pha loãng nhiều lần (phương pháp C0).
A.6.5.2 Cách tiến hành
Bơm những dung dịch từ quy trình S0 hoặc S1 vào hệ thống sắc ký khí quang hóa ngọn lửa. Phép đo có thể sử dụng nhiều loại thiết bị GC và cột.
A.6.5.3 Thiết bị
Các điều kiện hoạt động sau của GC cho thấy là thích hợp, nhưng chỉ là ví dụ về các điều kiện thí nghiệm trên những thiết bị đã nêu. Sự thay đổi của những điều kiện này không phải là sự sai lệch so với phương pháp.
A.6.5.4 Ví dụ về các điều kiện thích hợp
A.6.5.4.1 Thiết bị 1
| Thiết bị | Agilent GC 5890 |
| Khí mang | Heli, 8,0 ml/min, đẳng dòng |
| Bộ phận bơm mẫu | Chia dòng/không chia dòng |
| Kĩ thuật bơm mẫu | 60 giây không chia dòng, sau đó chia dòng tỷ lệ 1:10 |
| Thể tích bơm mẫu | 3 µl |
| Nhiệt độ bơm mẫu | 250 °C |
| Cột | Cột mao quản 14 % cyanoproplyphenyl/86 % dimethylploysiloxane, chiều dài 15 m, đường kính trong 0,53 mm, độ dày lớp phủ 1,0 µm (ví dụ: DB 1701) |
| Nhiệt độ cột | Giữ ở 60 °C trong 2,0 min, tăng 10 °C/min đến 260 °C, giữ ở 260 °C trong 10 min. |
| Detector | FPD với bộ lọc phospho hoặc lưu huỳnh |
| Nhiệt độ detector | 240 °C |
| Detector gas | 14 ml/min Heli, 75 ml/min hydro, 120 ml/min không khí |
| A.6.5.4.2 Thiết bị 2 |
|
| Thiết bị | Fisons MEGA 5300 |
| Khí mang | Heli, 3,0 ml/min, đẳng dòng |
| Bộ phận bơm mẫu | Chia dòng/không chia dòng |
| Kĩ thuật bơm mẫu | 90 giây không chia dòng, sau đó chia dòng tỉ lệ 1:20 |
| Thể tích bơm mẫu | 2 µl |
| Nhiệt độ bơm mẫu | 250 °C |
| Cột | Cột mao quản 50 % phenyl/50 % dimethylsiloxane, chiều dài 30 m, đường kính trong 0,32 mm, độ dày lớp phủ 0,25 µm (ví dụ: DB-17) |
| Nhiệt độ cột | Giữ ở 70 °C trong 2,0 min, tăng 30 °C/min đến 130 °C, tăng 50 °C/min đến 250 °C, tăng 1 °C/min đến 260 °C giữ ở 260 °C trong 12 min. |
| Detector | FPD với bộ lọc phospho hoặc lưu huỳnh |
| Nhiệt độ detector | 130 °C |
| Khí detector | 25 ml/min Heli, 100 ml/min hydro, 25 ml/min oxy |
Phân tích GC-FPD được sử dụng cho các hợp chất hữu cơ chứa phospho có độ phân cực trung bình. Detector FPD cũng được áp dụng cho các chất phân tích có chứa lưu huỳnh hoặc thiếc. Sử dụng FPD để định lượng các chất phân tích có chứa lưu huỳnh, phải xem xét rằng không có mối quan hệ tuyến tính giữa nồng độ và tín hiệu.
Đối với bơm không chia dòng, nhiệt độ bắt đầu của buồng bơm mẫu nên thấp hơn khoảng 20 °C so với điểm sôi của dung môi của dịch chiết sau cùng.
Khi bộ phận bơm mẫu hoặc đầu cột bị nhiễm bẩn có thể gây ra sự phân hủy một phần của một số chất phân tích và thay đổi thời gian lưu. Việc sử dụng hỗn hợp chất bảo vệ chất phân tích trong GC với các cột có độ phân cực trung bình cho đến nay vẫn chưa được biết đến.
Trong một chuỗi dung dịch chuẩn phải được bơm thường xuyên, xem thêm các yêu cầu của Quy trình kiểm soát chất lượng của EU [5].
Chức năng backflush được khuyến khích sử dụng. Khi sử dụng chức năng backflush, dòng bị đảo ngược sau khi rửa giải hết các chất phân tích cần quan tâm, do đó, các hợp chất ít bay hơi còn lại trên cột được thổi ngược qua cột và thoát qua qua ngã chia dòng. Do đó, việc thay đổi thời gian lưu và nhiễm bẩn nguồn ion có thể được giảm thiểu.
A.6.6 Phương pháp D6: Xác định bằng sắc ký khí với detector cộng kết điện tử (GC-ECD)
A.6.6.1 Nguyên tắc
Sắc ký khí với detector cộng kết điện tử phù hợp với các hợp chất clo hữu cơ và pyrethroid chiết xuất được bằng quy trình từ E1 đến E7, dễ bay hơi mà không bị phân hủy sau khi làm sạch bằng cách sử dụng một trong các quy trình từ C1 đến C5. Chuyển dung môi của chiết xuất cuối cùng là rất khuyến khích.
A.6.6.2 Cách tiến hành
Bơm những dung dịch từ quy trình sau khi chuyển dung môi (ví dụ: trong toluene) vào hệ thống sắc ký khí, với detector bắt giữ điện tử. Phép đo có thể sử dụng nhiều loại thiết bị GC và cột.
A.6.6.3 Thiết bị
Các điều kiện hoạt động sau của GC cho thấy là thích hợp, nhưng chỉ là ví dụ về các điều kiện thí nghiệm trên những thiết bị đã nêu. Sự thay đổi của những điều kiện này không phải là sự sai lệch so với phương pháp.
A.6.6.4 Ví dụ về các điều kiện thích hợp
A.6.6.4.1 Thiết bị 1
| Thiết bị | Agilent GC 6890 |
| Khí mang | Heli, 1,0 ml/min, đẳng dòng |
| Bộ phận bơm mẫu | Chia dòng/không chia dòng |
| Kĩ thuật bơm mẫu | Pulsed slitless, 200 kPa, pulse time 1,0 min |
| Thể tích bơm mẫu | 1 µl |
| Nhiệt độ bơm mẫu | 240 °C |
| Injector purge | 1,5 min sau khi bơm (thời gian xung) dòng purge tới van chia dòng 50 ml/min |
| Cột | Cột mao quản 5 % phenyl/95 % dimethylsiloxane, chiều dài 30 m, đường kính trong 0,25 mm, độ dày lớp phủ 0,25 µm (ví dụ: HP5 MS) |
| Nhiệt độ cột | Giữ ở 70 °C trong 2,0 min, tăng 25 °C/min đến 170 °C, tăng 3 °C/min đến 210 °C, tăng 30 °C/min đến 290 °C giữ ở 290 °C trong 9 min. |
| Detector | 63Ni-ECD |
| Nhiệt độ detector | 300 °C |
| Khí bổ trợ ECD | Nitơ, 70 ml/min |
| Khí purge anod ECO | Nitơ, 6 ml/min |
A.6.6.4.2 Thiết bị 2
| Thiết bị | Agilent GC 7890A |
| Khí mang | Heli, tốc độ trung bình 35 cm/s ở 80 °C |
| Bộ phận bơm mẫu | Chia dòng/không chia dòng |
| Kĩ thuật bơm mẫu | Không chia dòng |
| Thể tích bơm mẫu | 1 µl |
| Nhiệt độ bơm mẫu | 250 °C |
| Injector purge | 0,5 min sau khi bơm (thời gian purge) dòng purge tới van chia dòng 60 ml/min |
| Cột | Retention gap (ống mao quản silica khử hoạt tính) dài 5 m, đường kính trong 0,32 mm nối với cột mao quản 35 % phenyl/65 % dimethylsiloxane, chiều dài 30 m, đường kính trong 0,32 mm, độ dày lớp phủ 0,25 µm (ví dụ: HP5 MS) |
| Nhiệt độ cột | Giữ ở 80 °C trong 0,5 min, tăng 26 °C/min đến 175 °C, tăng 6,5 °C/min đến 235 °C, tăng 15 °C/min đến 300 °C giữ ở 300 °C trong 6 min. |
| Detector | µECD |
| Nhiệt độ detector | 340 °C |
| Khí bổ trợ | Nitơ, 30 ml/min |
Những điều kiện này được đưa ra trong Agilent Application Note 5990-9735EN (xem http://www.chem.agilent.com/Library/applications/5990-9735EN.pdf)
Để biết thời gian lưu và tín hiệu tương đối của các thuốc BVTV, xem CEN/TR 16468 Food analysis - Determination of pesticide residues by GC-MS - Retention times and mass spectrometric parameters (Phân tích thực phẩm - Xác định dư lượng thuốc BVTV bằng GC-MS - Thời gian lưu và các thông số khối phổ)[4].
Đối với bơm không chia dòng, nhiệt độ bắt đầu của buồng bơm mẫu nên thấp hơn khoảng 20 °C so với điểm sôi của dung môi của dịch chiết sau cùng.
Khi bộ phận bơm mẫu hoặc đầu cột bị nhiễm bẩn có thể gây ra sự phân hủy một phần của một số chất phân tích và thay đổi thời gian lưu. Việc sử dụng hỗn hợp chất bảo vệ chất phân tích trong GC với các cột có độ phân cực trung bình cho đến nay vẫn chưa được biết đến.
Trong một chuỗi dung dịch chuẩn phải được bơm thường xuyên, xem thêm các yêu cầu của Quy trình kiểm soát chất lượng của EU [5].
Chức năng backflush được khuyến khích sử dụng. Khi sử dụng chức năng backflush, dòng bị đảo ngược sau khi rửa giải hết các chất phân tích cần quan tâm, do đó, các hợp chất ít bay hơi còn lại trên cột được thổi ngược qua cột và thoát qua qua ngã chia dòng. Do đó, việc thay đổi thời gian lưu và nhiễm bẩn nguồn ion có thể được giảm thiểu.
A.7 Các phương pháp định lượng
A.7.1 Phương pháp 1: Định lượng bằng ngoại chuẩn trong dung môi
A.7.1.1 Nguyên tắc
Việc xác định nồng độ của chất phân tích trong dịch chiết sau cùng được thực hiện bằng cách so sánh với chuẩn trong dung môi đã biết trước nồng độ. Các nhận xét chung về quy trình và tính toán đường chuẩn được đưa ra trong CEN/TS 17061:2017, 4.1 và 4.2)
Phương pháp định lượng này được áp dụng nếu không có sự thay đổi cường độ tín hiệu xảy ra trong một chuỗi các mẫu phân tích, nếu không sai số trong quá trình chiết, làm sạch, sai số trong phép đo và có thể loại trừ ảnh hưởng từ nền mẫu (xem Bảng 5).
A.7.1.2 Cách tiến hành
Các dung dịch chuẩn có nồng độ khác nhau được tạo ra bằng cách pha loãng dung dịch chuẩn gốc trong dung môi thích hợp. Các dung dịch này được phân tích bằng sắc ký cùng với dịch chiết của mẫu. Diện tích pic (hoặc chiều cao) của chất phân tích trong dung dịch chuẩn và dịch chiết mẫu được xác định. Sau khi lập đường chuẩn (xem CEN/TS 17061:2017, 4.4.2 đến 4.4.5), nồng độ của chất phân tích trong dịch chiết mẫu pA được tính toán.
A.7.1.3 Tính toán
Việc tính toán dư lượng chất phân tích trong mẫu dựa trên pA như phần 6.3 đã trình bày.
A.7.2 Phương pháp 2: Định lượng bằng ngoại chuẩn trong nền mẫu
A.7.2.1 Nguyên tắc
Việc xác định nồng độ chất phân tích trong dịch chiết sau cùng được thực hiện bằng cách so sánh với các dung dịch chuẩn trong nền mẫu không chứa chất dư lượng và đã biết trước nồng độ. Các nhận xét chung về quy trình và tính toán đường chuẩn được đưa ra trong CEN/TS 17061:2017, 4.1, 4.2 và 4.3 (để kiểm tra ảnh hưởng của nền).
Phương pháp định lượng này sẽ được áp dụng nếu không có sự thay đổi cường độ tín hiệu xảy ra trong một chuỗi các mẫu phân tích, không mất mát trong quá trình chiết, làm sạch, sai số trong phép đo và không thể loại trừ các ảnh hưởng từ nền mẫu.
A.7.2.2 Cách tiến hành
Các dung dịch chuẩn có nồng độ khác nhau được tạo ra bằng cách pha loãng dung dịch chuẩn gốc bằng dung dịch chiết sau cùng của mẫu không chứa chất phân tích. Một cách khác để chuẩn bị các dung dịch chuẩn trong nền là bay hơi cho đến khi khô một thể tích dịch chiết của mẫu không chứa dư lượng dưới dòng nitơ nhẹ và định mức lại với cùng một thể tích của chuẩn trong dung môi. Các dung dịch này được phân tích bằng sắc ký cùng với dịch chiết của mẫu. Diện tích pic (hoặc chiều cao) của chất phân tích trong các dung dịch chuẩn và dịch chiết mẫu được xác định. Sau đó lập đường chuẩn (xem CEN/TS 17061:2017, 4.4.2 đến 4.4.5) nồng độ của chất phân tích trong dịch chiết mẫu pA được tính toán.
A.7.2.3 Tính toán
Việc tính toán dư lượng chất phân tích trong mẫu dựa trên pA như phần 6.3 đã trình bày.
A.7.3 Phương pháp 3: Định lượng bằng nội chuẩn và chuẩn trong dung môi
A.7.3.1 Nguyên tắc
Việc xác định nồng độ của chất phân tích trong dịch chiết sau cùng được thực hiện bằng cách so sánh với các dung dịch chuẩn trong dung môi đã biết trước nồng độ và chứa một lượng nội chuẩn nhất định. Các nhận xét chung về quy trình và tính toán đường chuẩn bằng cách sử dụng nội chuẩn được đưa ra trong CEN/TS 17061:2017, 4.5.
Phương pháp định lượng này sẽ được áp dụng nếu có sai số trong quá trình chiết và làm sạch hoặc sai số trong phép đo và có thể loại trừ các ảnh hưởng nền.
A.7.3.2 Cách tiến hành
Các dung dịch chuẩn phân tích có nồng độ khác nhau được tạo ra bằng cách pha loãng các thể tích dung dịch chuẩn gốc khác nhau và thể tích dung dịch chuẩn nội không đổi thành một thể tích xác định bằng dung môi thích hợp. Các dung dịch này được phân tích bằng sắc ký cùng với dịch chiết của các mẫu. Diện tích pic (hoặc chiều cao) của chất phân tích trong dung dịch chuẩn và dịch chiết mẫu được xác định. Tính nồng độ chất phân tích trong dịch chiết mẫu pA sau khi chọn đường chuẩn thích hợp theo CEN/TS 17061: 2017, 4.5.1.
A.7.3.3 Tính toán
Việc tính toán dư lượng chất phân tích trong mẫu dựa trên pA như phần 6.3 đã trình bày.
A.7.4 Phương pháp 4: Định lượng bằng phương pháp thêm chuẩn vào dịch chiết sau cùng
A.7.4.1 Nguyên tắc
Việc xác định nồng độ chất phân tích trong dịch chiết sau cùng được thực hiện bằng cách so sánh tín hiệu chất phân tích trong dịch chiết sau cùng với tín hiệu chất phân tích của dịch chiết sau cùng đã thêm lượng chất phân tích đã biết. Các nhận xét chung về quy trình và tính toán đường chuẩn được đưa ra trong CEN/TS 17061:2017, 4.6.3.
Phương pháp định lượng này sẽ được áp dụng nếu chỉ có ảnh hưởng nền và không có sẵn mẫu không có dư lượng. Việc áp dụng phương pháp này giả định mối quan hệ tuyến tính giữa nồng độ chất phân tích và tín hiệu phát hiện bởi hệ thống.
A.7.4.2 Cách tiến hành
Thêm một lượng chất phân tích xác định vào phần của dịch chiết sau cùng. Tất cả các phần mẫu được định mức đến cùng một thể tích bằng dung môi. Các dung dịch cuối cùng thu được có nồng độ khác nhau được thực hiện sắc ký cùng với dung dịch chiết không thêm chuẩn của mẫu. Các diện tích pic (hoặc chiều cao) của các chất phân tích trong dịch chiết không thêm chuẩn và có thêm chuẩn được xác định (xem CEN/TS 17061:2017, 4.6.2). Sử dụng đường hồi quy có thể xác định được khối lượng của chất phân tích trong dịch chiết.
A.7.4.3 Tính toán
Việc tính toán dư lượng của chất phân tích trong mẫu có thể được thực hiện như trong CEN/TS 17061:2017, 4.6.2.
A.7.5 Phương pháp 5: Định lượng bằng nội chuẩn và chuẩn trong nền hoặc nội chuẩn là đồng vị
A.7.5.1 Nguyên tắc
Việc xác định nồng độ của chất phân tích được xác định trong dịch chiết sau cùng được thực hiện bằng cách so sánh với các dung dịch chuẩn nồng độ đã biết trong nền mẫu không chứa chất phân tích, có chứa một lượng nội chuẩn không đổi. Nhận xét chung về quy trình và tính toán được đưa ra trong CEN/TS 17061:2017, 4.5.
Việc sử dụng một nội chuẩn là đồng vị, chỉ khác ở đồng vị với phân tử chất phân tích, là một trường hợp đặc biệt. Ảnh hưởng nền nói chung được loại bỏ tốt do đó không cần thiết phải sử dụng nền mẫu không chứa chất phân tích.
Phương pháp định lượng này sẽ được áp dụng nếu tổn thất trong quá trình chiết và làm sạch hoặc sai số trong phép đo hoặc không loại bỏ được ảnh hưởng nền.
A.7.5.2 Cách tiến hành
Các dung dịch chuẩn phân tích có nồng độ khác nhau được tạo ra bằng cách pha loãng các thể tích dung dịch chuẩn gốc khác nhau và thể tích dung dịch chuẩn nội không đổi thành thể tích xác định bằng dịch chiết nền mẫu không chứa chất phân tích. Các dung dịch này được thực hiện sắc ký cùng với chiết xuất của các mẫu. Diện tích pic (hoặc chiều cao) của chất phân tích trong dung dịch chuẩn và dịch chiết mẫu được xác định. Sau khi chọn đường chuẩn thích hợp (xem CEN/TS 17061:2017, 4.5.1) nồng độ chất phân tích trong dịch chiết mẫu wA có thể được tính toán.
Nếu các nội chuẩn là đồng vị được sử dụng, một thể tích không đổi của dung dịch nội chuẩn là đồng vị và thể tích thay đổi của dung dịch chuẩn gốc trong dung môi được định mức đến một thể tích xác định.
A.7.5.3 Tính toán
Việc tính toán dư lượng chất phân tích trong mẫu có thể được thực hiện trên cơ sở pA như được nêu trong 6.3.
Nếu sử dụng các nội chuẩn là đồng vị, việc tính toán được đơn giản hóa theo cách mà kiến thức về thể tích dung môi chiết, các yếu tố pha loãng, ảnh hưởng nền mẫu,...thì không cần thiết. Phần khối lượng của chất phân tích wA có thể được lấy trực tiếp từ đường chuẩn bằng khối lượng mẫu đã biết. Một thể tích không đổi của dung dịch chuẩn nội có đồng vị và thể tích thay đổi của dung dịch phân tích gốc trong dung môi được định mức đến một thể tích xác định. Việc tính toán dư lượng của chất phân tích trong mẫu có thể được thực hiện như trong CEN/TS 17061: 2017, 4.5.2 và 4.5.3.
A.7.6 Phương pháp 6: Định lượng bằng phương pháp thêm chuẩn vào mẫu
A.7.6.1 Nguyên tắc
Việc xác định nồng độ chất phân tích trong mẫu được thực hiện bằng cách so sánh tín hiệu chất phân tích trong dịch chiết sau cùng của mẫu với tin hiệu chất phân tích của dịch chiết sau cùng của cùng mẫu đã thêm lượng chất phân tích đã biết. Trong trường hợp này, lượng chất phân tích đã biết được thêm vào mẫu trước khi chiết. Nhận xét chung về quy trình và tính toán được đưa ra trong CEN/TS 17061: 2017, 4.6.1.
Việc áp dụng phương pháp này giả định mối quan hệ tuyến tính giữa nồng độ chất phân tích và tín hiệu trong hệ thống phát hiện. Phương pháp định lượng này sẽ được áp dụng khi xảy ra sự mất mát của chất phân tích trong quá trình chiết và làm sạch hoặc nếu có sự thay đổi trong phép đo phải được bù và nếu không có nền mẫu không chứa chất phân tích.
A.7.6.2 Cách tiến hành
Trước khi chiết, lượng đã biết của chất phân tích được thêm vào phần mẫu thử. Sau đó, các phần thử nghiệm không thêm chuẩn và thêm chuẩn của mẫu được thực hiện theo toán bộ quy trình phân tích. Các diện tích pic (hoặc chiều cao) của các chất phân tích trong các mẫu không thêm chuẩn và thêm chuẩn được xác định và vẽ (xem CEN/TS 17061:2017, 4.6.3). Sử dụng đường hồi quy có thể xác định được lượng chất phân tích trong mẫu.
A.7.6.3 Tính toán
Việc tính toán dư lượng của chất phân tích trong mẫu có thể được thực hiện như được đưa ra trong CEN/TS 17061:2017, 4.6.3.
A.7.7 Phương pháp 7: Định lượng bằng cách hiệu chuẩn toàn bộ quy trình
A.7.7.1. Nguyên tắc
Việc xác định nồng độ chất phân tích được xác định trong dịch chiết sau cùng được thực hiện bằng cách so sánh tín hiệu chất phân tích trong dịch chiết sau cùng của mẫu với tín hiệu chất phân tích của dịch chiết sau cùng của mẫu hiệu chuẩn. Các mẫu và mẫu hiệu chuẩn được thực hiện theo toàn bộ quy trình phân tích. Nhận xét chung về quy trình và tính toán được đưa ra trong CEN/TS 17061:2017, 4.7.
Phương pháp định lượng này sẽ được áp dụng nếu các kết quả chính hoặc thấp hơn có hệ thống phải được bù, nếu hiệu ứng ma trận phải được bù và nếu không có sẵn mẫu không có dư lượng.
A.7.7.2 Cách tiến hành
Trước khi chiết, thêm lượng chất phân tích vào các phần thử của mẫu hiệu chuẩn. Sau đó, các mẫu và các phần thử nghiệm đã thêm chuẩn của các mẫu hiệu chuẩn được thực hiện theo toàn bộ quy trình phân tích. Diện tích pic (hoặc chiều cao) của các chất phân tích trong các mẫu và mẫu hiệu chỉnh đã thêm chuẩn được xác định. Sau khi chọn đường chuẩn thích hợp (xem CEN/TS 17061:2017, 4.4.3 đến 4.4.4) nồng độ của chất phân tích trong trích xuất mẫu pA có thể được tính.
A.7.7.3 Tính toán
Việc tính toán dư lượng chất phân tích trong mẫu có thể được thực hiện trên cơ sở pA như được nêu trong 6.3.
Phụ lục B
(Tham khảo)
Thông tin bổ sung
B.1 Tổng quát
Phương pháp này (QuEChERS) được xuất bản lần đầu tiên bởi M. Anastassiades và các cộng sự [7] vào năm 2003 và sau đó được sửa đổi thành quy trình tự hiện tại để mở rộng phổ của chất phân tích và nền mẫu.
B.2 Chuẩn bị hỗn hợp muối-đệm (A.1.8)
Nếu không sử dụng các hỗn hợp muối-đệm có sẵn trên thị trường, việc chuẩn bị một số phần của hỗn hợp này rất hữu ích khi sử dụng một bộ chia mẫu.
B.3 Thuốc thử để làm sạch
Nếu không sử dụng các ống ly tâm có sẵn thuốc thử dùng làm sạch, thì nên chuẩn bị tất cả các ống ly tâm cần thiết để làm sạch trước khi chiết. Việc sử dụng một bộ chia mẫu là hữu ích trong trường hợp đó.
B.4 Kéo dài thời gian chiết
Thời gian chiết kéo dài lên 15 min hoặc hơn để đạt được hiệu quả chiết tốt hơn. Khi sử dụng thời gian chiết được đề xuất ban đầu (lắc) là 1 min cho các mẫu đông lạnh, người ta nhận thấy rằng một số loại thuốc BVTV cho hiệu suất chiết thấp. Nên tránh thời gian chiết lớn hơn 60 min để giảm phân hủy chất phân tích kém bền.
B.5 Phân tích không nội chuẩn
Để làm rõ mức độ giảm thể tích và ảnh hưởng của các nền mẫu đến sự tách pha, ba phòng thí nghiệm với những thí nghiệm đặc biệt đã được tiến hành. Mười lăm loại thực phẩm khác nhau có nguồn gốc thực vật (bao gồm cả chè và bột mì) đã được nhiễm 20 loại thuốc BVTV. Các dung dịch chiết được phân tích bởi LC-MS/MS mà không cần làm sạch, sau khi đã pha loãng đủ để loại trừ các ảnh hưởng nền. Hiệu suất thu hồi không phụ thuộc vào thể tích của pha axetonitril (dao động từ 7,0 ml đến 10,5 ml). Giữa pha axetonitril và nước có chứa các phần thực vật rắn lớn hơn 5 ml trong một số trường hợp (ví dụ như bơ, chanh, chè, bột mì). Tuy nhiên, hiệu suất thu hồi trung bình của tất cả các loại thuốc BVTV trong một nền mẫu của một phòng thí nghiệm dao động trong khoảng 77 % đến 114 %. Xem xét giá trị trung bình của cả ba phòng thí nghiệm, ngoại trừ hai nền (bơ, chè) hiệu suất thu hồi trung bình là trong khoảng 97 % đến 103 %. Các thí nghiệm đã chứng minh rằng việc sử dụng nội chuẩn không cần phải có thể tích chiết chính xác là 10 ml.
B.6 Tỷ lệ
Trong các quy trình chiết, khối lượng của phần mẫu thử được cố định (ví dụ 10 g, 5 g hoặc 2 g). Lượng này đủ để chuẩn bị 6 ml dịch chiết thô được sử dụng trong quy trình làm sạch. Các bước chiết và làm sạch có thể mở rộng theo mong muốn, miễn là lượng thuốc thử được sử dụng vẫn giữ nguyên tỷ lệ. Tuy nhiên, cần lưu ý rằng lượng mẫu sử dụng càng nhỏ thì sai số của mẫu sẽ càng cao. Do đó, trong quá trình xác nhận giá trị sử dụng của phương pháp mỗi phòng thí nghiệm nên nghiên cứu sự thay đổi mẫu đạt được khi những thiết bị có sẵn, sử dụng các mẫu đại diện có chứa dư lượng phát sinh.
B.7 Điều chỉnh giá trị pH
Bằng cách thêm các muối đệm citrate (A.1.8) trong quá trình chiết, hầu hết các mẫu đều đạt được giá trị pH trong khoảng từ 5 đến 5,5. Phạm vi pH này thích hợp để chiết và định lượng thuốc diệt cỏ có tính axit, các hợp chất không bền trong môi trường kiềm (ví dụ captan, folpet, tolylfluanid) cũng như không bền trong môi trường acid (ví dụ như các hợp chất pymetrozine, dioxacarb)..
Sau khi tiếp xúc với PSA (A.1.15), độ pH của dịch chiết tăng lên lớn hơn 8. Điều này có thể làm giảm tính ổn định của thuốc BVTV nhạy với baz (ví dụ: captan, folpet, dichlofluanid, tolylfluanid, pyridate, methiocarb sulfon, chlorothalonil). Nếu các chất chiết xuất được axit hóa nhanh chóng đến pH 5, sự phân hủy của các hợp chất đó sẽ giảm đáng kể để có thể lưu trữ trong nhiều ngày. Ở pH này, thuốc BVTV không bền axit (ví dụ như pymetrozine, dioxacarb, thiodicarb) cũng đủ ổn định trong vài ngày.
Chỉ một số loại thuốc diệt cỏ sulfonyl urea rất nhạy, carbosulfan và benfuracarb đã được chứng minh là không được bảo vệ đầy đủ ở pH 5. Tuy nhiên, các hợp chất này đã được chứng minh là ổn định ở pH của dịch chiết không axit (sau khi chiết phân tán SPE) trong vài ngày Nếu các hợp chất này nằm trong phạm vi phân tích, nên sử dụng một phần của dịch chiết không axit hóa để đo. Nếu phép đo có thể được thực hiện nhanh chóng, thì cũng có thể sử dụng dịch chiết ở pH 5. Tuy nhiên cần chú ý sulfonylurea có tính axit nhất có thể bị mất trong quá trình làm sạch PSA. Chúng có thể được phân tích cùng với thuốc BVTV có tính axit trực tiếp từ dịch chiết xuất thô (6.3 và A.4).
B.8 Nghiên cứu hiệu suất thu hồi
Đối với các nghiên cứu hiệu suất thu hồi ví dụ: 10 g mẫu được thêm 100 µl dung dịch thuốc BVTV trong axetonitril hoặc axeton. Lắc nhanh bằng máy trộn Vortex (A.2.13) có thể giúp phân tán dung môi và thuốc BVTV tốt trong mẫu. Phải tránh sử dụng thể tích dung dịch chuẩn lớn hơn (ví dụ: lớn hơn 200 µl). Nếu không có thể, thể tích này được bù bằng mẫu trắng dùng để chuẩn bị dung dịch chuẩn trong nền mẫu, để tránh sự khác biệt về nồng độ của nền trong dịch chiết sau cùng.
B.9 Làm sạch với GCB
Cần phải tính đến, một số thuốc BVTV và ISTD có ái lực mạnh với cấu trúc phẳng của GCB. Nhưng các nghiên cứu hiệu suất thu hồi cho thấy không có sự mất mát đáng kể nào xảy ra nếu dịch chiết, sau khi phân tán SPE với GCB, vẫn duy trì một lượng chlorophyl hoặc carotinoid. Anthracene (hoặc d10-Anthracen) có thể được sử dụng như chuẩn QC (xem Bảng 1). Nếu lượng anthracen thu hồi trên 70 %, điều này cũng đúng đối với những thuốc BVTV cấu trúc phẳng có ái lực cao nhất đối với carbon.
B.10 Nồng độ của dịch chiết sau cùng và thay đổi dung môi
Nếu không bơm thể tích lớn (3 µl trở lên) và giới hạn phát hiện mong muốn của các hợp chất phân tích không thể đạt được, cần phải quan tâm đến nồng độ của các dịch chiết sau cùng và thay đổi dung môi nếu cần thiết. Nếu sử dụng GC/MSD, dịch chiết làm giàu 4 lần là đủ. Để đạt được điều này, ví dụ 4 ml chiết axit (pH 5) được chuyển vào một ống nghiệm và giảm xuống còn khoảng 1 ml ở nhiệt độ 40 °C sử dụng dòng nitơ nhẹ. Cần thay đổi dung môi nếu hiệu năng của GC khi sử dụng acetonitril không đạt yêu cầu hoặc nếu NPD được sử dụng (không có PTV-injector). Thực hiện bằng cách, hóa hơi dịch chiết đến gần khô ở nhiệt độ 40 °C sử dụng dòng khí nitơ nhẹ và hòa tan trong 1 ml dung môi thích hợp (một vài giọt dodecan có thể giúp giảm mất những hợp chất dễ bay hơi). Dịch chiết mẫu trắng (cần thiết cho việc chuẩn bị các dung dịch đường chuẩn) cần được xử lý cùng một cách.
Phụ lục C
(Tham khảo)
Các chữ viết tắt
Các chữ viết tắt sử dụng trong tài liệu này được liệt kê và giải thích trong Bảng C.1
Bảng C.1 - Danh sách các chữ viết tắt
| Chữ viết tắt | Nghĩa |
| APCI | Ion hóa hóa học ở áp suất khí quyển |
| c | Nồng độ chất |
| C18 | octadecyl-silyl-modified silica gel |
| CISTD | Nồng độ nội chuẩn |
| ccal mix ISTD | Pha loãng dung dịch nội chuẩn để tạo hỗn hợp đường chuẩn |
| D-SPE | Chiết phân tán pha rắn |
| ECD | Detector bắt giữ điện tử |
| EI | Ion hóa bằng bắn phá điện tử |
| ESI | Ion hóa phun điện tử |
| FPD | Detector quang hóa ngọn lửa |
| FWHM | Bề rộng tại nửa độ cao đỉnh (khối phổ) |
| g | 9,81 ms-2 |
| GC | Sắc ký khí |
| GCB | Chất hấp phụ graphit cacbon black |
| GC-MS | Sắc ký khí khối phổ |
| GC-MS/MS | Sắc ký khí khối phổ hai lần |
| HPLC | Sắc ký lỏng hiệu năng cao |
| ID | Đường kính trong |
| ISTD | Nội chuẩn |
| ITD | Detector bẫy ion |
| LC-HR-MS | Sắc ký lỏng khối phổ phân giải cao |
| LC-MS | Sắc ký lỏng khối phổ |
| LC-MS/MS | Sắc ký lỏng khối phổ hai lần |
| Log P | Logarit hệ số phân bố octanol/nước |
| MRL | Mức dư lượng tối đa cho phép |
| MRM | Chế độ kiểm soát đa/nhiều phản ứng |
| MS | Khối phổ |
| MS/MS | Khối phổ hai lần |
| MSD | Detector khối phổ |
| NaOH | Sodium hydroxit |
| NCI | Ion hóa hóa học âm |
| NPD | Detector nito photpho |
| ODS | Octadecylsilan |
| PCI | Ion hóa hóa học tạo ion dương |
| pKa | pK hằng số phân ly axit (Bảng 2, C0) |
| PSA | Chất hấp phụ amin bậc 1 và bậc 2 |
| PTV | Chương trình nhiệt độ hóa hơi |
| QC | Kiểm soát chất lượng |
| Rt | Thời gian lưu |
| Rt(A) | Thời gian lưu của chất phân tích |
| Rt(ISTD) | Thời gian lưu của nội chuẩn |
| SIM | Chế độ phân tích chọn lọc ion |
| SPE | Chiết pha rắn |
| SRM | Chế độ phân tích chọn lọc phản ứng |
| TOF | Thời gian bay |
| UHPLC | Sắc ký lỏng siêu hiệu năng |
| UPLC-MS/MS | Sắc ký lỏng siêu hiệu năng khối phổ hai lần |
| w | Phần khối lượng |
| wA | Phần khối lượng của hoạt chất được xác định |
| p | Nồng độ khối lượng |
| A | Nồng độ khối lượng của hoạt chất rong dịch chiết sau cùng |
| φ | Phần thể tích |
| 1 | Dung dịch dịch chiết thô sử dụng |
| 2 | Thể tích nước hoặc axetonitril/nước thêm vào |
Thư mục tài liệu tham khảo

[2] CEN/TR 15641, Food analysis - Determination of pesticide residues by LC-MS/MS - Tandem mass spectrometric parameters
[3] CEN/TR 16699, Foodstuffs - Determination of pesticide residues by GC-MS/MS - Tandem mass spectrometric parameters
[4] CEN/TR16468, Food analysis - Determination of pesticide residues by GC-MS - Retention times, mass spectrometric parameters and detector response information
[5] DG-SANTE, Guidance document on analytical quality control and method validation procedures for pesticide residues and analysis in food and feed, Document SANTE/11813/2017, 21 - 22 November 2017
[6] DATA POOL OF THE EU REFERENCE LABORATORIES FOR RESIDUES OF PESTICIDES, online resources: http://www.eurl-pesticides-datapool.eu
[7] ANASTASSIADES M., LEHOTAT S.J., STAJNBAHER D., SCHENCK F.J. Fast and Easy Multiresidue Method Employing Axetonitril Extraction/Partitioning and “Dispersive Solid-Phase Extraction” for the Determination of Pesticide Residues in Produce. J. AOAC Int. 2003, 86 (2) pp. 412-431
[8] CEN/TR17063:2017, Foods of plant origin - Multimethod for the determination of pesticide residues using GC- or LC-based analysis following axetonltril extraction/partitioning and cleanup by dispersive SPE - Validation data of the modular QuEChERS-method
[9] http://www.thermofisher.com.au/Uploads/file/Scientific/Applications/Scientific-lnstruments-Automation/Fast-GC-MSMS-Pesticide-Analysis-AN52072.pdf)
1 AGTTAX là sản phẩm được cung cấp bởi hãng Cirtalab (Tây Ban Nha). Thông tin này được cung cấp để thuận tiện cho người sử dụng tiêu chuẩn này. Các sản phẩm tương đương có thể được sử dụng nếu chúng cho kết quả tương đương.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 12848:2020 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 12848:2020 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 12848:2020 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 12848:2020 DOC (Bản Word)