- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn quốc gia TCVN 13838:2023 Cà phê và sản phẩm cà phê – Xác định acrylamid
| Số hiệu: | TCVN 13838:2023 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
24/10/2023 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 13838:2023
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 13838:2023
TIÊU CHUẨN QUỐC GIA
TCVN 13838:2023
ISO 18862:2016
CÀ PHÊ VÀ SẢN PHẨM CÀ PHÊ - XÁC ĐỊNH ACRYLAMID - PHƯƠNG PHÁP SẮC KÝ LỎNG HIỆU NĂNG CAO-HAI LẦN KHỐI PHỔ (HPLC-MS/MS) VÀ SẮC KÝ KHÍ-KHỐI PHỔ (GC-MS) SAU KHI TẠO DẪN XUẤT
Coffee and coffee products - Determination of acrylamide - Methods using HPLC-MS/MS and GC-MS after derivatization
Lời nói đầu
TCVN 13838:2023 hoàn toàn tương đương với ISO 18862:2016;
TCVN 13838:2023 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F16 Cà phê và sản phẩm cà phê biên soạn, Viện Tiêu chuẩn Chất lượng Việt Nam đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Khi áp dụng tiêu chuẩn nảy, cần tuân thủ tất cả các quy định an toàn hiện hành.
CÀ PHÊ VÀ SẢN PHẨM CÀ PHÊ - XÁC ĐỊNH ACRYLAMID - PHƯƠNG PHÁP SẮC KÝ LỎNG HIỆU NĂNG CAO-HAI LẦN KHỐI PHỔ (HPLC-MS/MS) VÀ SẮC KÝ KHÍ-KHỐI PHỔ (GC-MS) SAU KHI TẠO DẪN XUẤT
Coffee and coffee products - Determination of acrylamide - Methods using HPLC-MS/MS and GC-MS after derivatization
CẢNH BÁO - Khi áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác gây nguy hiểm. Tiêu chuẩn này không đưa ra được hết tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Người sử dụng tiêu chuẩn này cần thiết lập các thao tác an toàn thích hợp và đáp ứng các yêu cầu quy định trước khi sử dụng tiêu chuẩn này.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định các phương pháp xác định acrylamid trong cà phê và sản phẩm cà phê bằng cách chiết với nước, làm sạch bằng chiết pha rắn sau đó xác định bằng sắc ký lỏng hiệu năng cao-hai lần khối phổ (HPLC-MS/MS) và sắc ký khí-khối phổ (GC-MS).
Phương pháp này đã được xác nhận giá trị sử dụng trên cà phê rang, cà phê hòa tan, chất thay thế cà phê và các sản phẩm cà phê có hàm lượng acrylamid từ 53 μg/kg đến 612,1 μg/kg.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 4851 (ISO 3696), Nước dùng trong phòng thí nghiệm phân tích - Yêu cầu kỹ thuật và phương pháp thử
3 Thuật ngữ và định nghĩa
Tiêu chuẩn này không đưa ra các thuật ngữ và định nghĩa.
4 Nguyên tắc
Mẫu cà phê được chiết bằng nước hoặc đối với sản phẩm hòa tan, mẫu được hòa tan trong nước. Làm sạch bằng chiết pha rắn để loại bỏ các hợp chất nền gây nhiễu. Có thể sử dụng một trong hai phương pháp để xác định: phương pháp HPLC-MS/MS hoặc sau khi brom hóa acrylamid, phương pháp GC-MS. Cả hai phương pháp này đều dùng các dung dịch nội chuẩn được gắn đồng vị.
5 Thuốc thử
CẢNH BÁO - Do các nguy cơ về sức khỏe khi làm việc với acrylamid, phải thực hiện các biện pháp phòng ngừa và bảo vệ thích hợp, ví dụ sử dụng tủ hút, chỉ dùng pipet để lấy dung dịch có chứa acrylamid và tránh tiếp xúc với da, mắt hoặc hít phải hơi có chứa acrylamid.
Phải sử dụng thuốc thử “loại dùng để phân tích dư lượng” hoặc “loại thuốc thử phân tích”, nếu sẵn có. Mức tạp chất trong thuốc thử có trong mẫu trắng phải nhỏ không đáng kể. Mẫu trắng phải được kiểm tra thường xuyên.
5.1 Nước, phù hợp với loại 1 trong TCVN 4851 (ISO 3696), khuyến cáo loại dùng cho MS.
5.2 Khí có độ tinh khiết cao, phù hợp với GC và khối phổ theo hướng dẫn của nhà sản xuất.
5.3 Dung môi, ví dụ metanol, etyl axetat, axetonitril, n-hexan, khuyến cáo loại dùng cho MS
5.4 Acrylamid (C3H5NO), độ tinh khiết > 98 %, loại chất chuẩn.
5.4.1 Dung dịch gốc acrylamid, nồng độ khối lượng ρ = 1 000 μg/ml
Cân (0,10 ± 0,001) g acrylamid cho vào bình định mức một vạch 100 ml và lắc trong 30 ml nước để hòa tan acrylamid. Thêm nước đến vạch và trộn đều. Dung dịch gốc bền ít nhất 3 tháng khi được bảo quản tránh ánh sáng ở nhiệt độ tối đa 6 °C.
Ngoài ra, có thể sử dụng dung dịch bán sẵn trên thị trường có nồng độ khối lượng ρ =1 000 μg/ml. Phải tuân thủ thông tin của nhà sản xuất về tính ổn định của dung dịch.
5.4.2 Dung dịch hiệu chuẩn acrylamid, ρ = 10 μg/ml
Dùng pipet chuyển (1,0 ± 0,001) ml dung dịch gốc acrylamid (5.4.1) vào bình định mức một vạch 100 ml và thêm nước đến vạch. Dung dịch này phải được bảo quản tránh ánh sáng ở nhiệt độ tối đa 6 °C và phải được chuẩn bị mới trong ngày làm việc. Tùy thuộc vào dải làm việc, có thể cần nhiều bước pha loãng hơn.
5.5 Dung dịch nội chuẩn D3-acrylamid (acrylamid-2,3,3-d3), C3H2D3NO, độ tinh khiết > 98 %, loại chất chuẩn.
5.5.1 Dung dịch gốc D3-acrylamid (dung dịch nội chuẩn)
Cân (0,10 ± 0,001) g D3-acrylamid cho vào bình định mức một vạch 100 ml và lắc trong 30 ml nước để hòa tan D3-acrylamid. Thêm nước đến vạch và trộn đều. Dung dịch gốc bền ít nhất 3 tháng khi được bảo quản tránh ánh sáng ở nhiệt độ tối đa 6 °C.
Ngoài ra, có thể sử dụng dung dịch bán sẵn trên thị trường có nồng độ khối lượng ρ = 1 000 μg/ml. Phải tuân thủ yêu cầu của nhà sản xuất về tính ổn định của dung dịch.
5.5.2 Dung dịch nội chuẩn D3-acrylamide
Dùng pipet chuyển (1,0 ± 0,001) ml dung dịch gốc D3-acrylamid (5.5.1) vào bình định mức một vạch 100 ml và thêm nước đến vạch. Dung dịch này phải được bảo quản tránh ánh sáng ở nhiệt độ tối đa 6 °C và phải được chuẩn bị mới trong ngày làm việc. Tùy thuộc vào dải làm việc, có thể cần nhiều bước pha loãng hơn.
CHÚ THÍCH 1: Đối với HPLC-MS/MS, có thể chuẩn bị các dung dịch theo 5.4.1 đến 5.5.2, sử dụng chất rửa giải HPLC làm dung môi. Tính ổn định của các dung dịch này phụ thuộc vào pha động được sử dụng và phải được xác nhận giá trị sử dụng.
Khi sử dụng GC-MS, tất cả các dung dịch chuẩn theo 5.4.2 và 5.5.2 phải qua bước tạo dẫn xuất theo 8.5.1.
CHÚ THÍCH 2: Thay vì sử dụng D3-acrylamid, cũng có thể sử dụng acrylamid 13C3 để chuẩn bị dung dịch nội chuẩn. Tuy nhiên, cách tiến hành và tính kết quả chỉ đề cập đến D3-acrylamid.
5.6 Nước cất với brom bão hòa
Bão hoà nước cất với brom trong bình định mức một vạch 100 ml (có nắp thủy tinh) cho đến khi hình thành pha brom ở đáy bình (khoảng 3,5 % brom ở 4 °C). Axit hóa nước brom đến pH ≈ 1, sử dụng axit hydrobromic đặc (HBr, có khối lượng riêng 1,48 g/cm3).
Nếu được bảo quản ở nhiệt độ 4 °C và tránh ánh sáng, dung dịch này có thể bền trong khoảng 4 tuần.
5.7 Kali bromua, KBr.
5.8 Natri thiosulfat (ngậm năm phân tử nước), Na2S2O3.5H2O.
5.9 Trietylamin, (C2H5)3N.
5.10 Natri sulfat (Na2SO4), khan, dạng hạt.
5.11 Dung dịch carrez I
Hòa tan 10,6 g kali hexacyanoferrat ngậm ba phân tử nước (II) K4[Fe(CN)6].3H2O trong 100 ml nước. Nếu được bảo quản ở 4 °C và tránh ánh sáng, dung dịch này bền trong 6 tháng.
5.12 Dung dịch Carrez II
Hòa tan 21,9 g kẽm axetat ngậm hai phân tử nước Zn(CH3COO)2.2H2O trong 100 ml nước. Nếu được bảo quản ở 4 °C và tránh ánh sáng, dung dịch này bền trong 6 tháng.
5.13 Dung dịch đệm Borat, pH 8,6
Trộn đều 68 ml dung dịch natri borat 0,1 mol (20,12 g Na2B4O7 trong một lít nước) và 32 ml axit clohydric 0,1 mol, c(HCl) = 0,1 mol/l, trong bình định mức một vạch 100 ml.
6 Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ thông thường của phòng thử nghiệm và các thiết bị, dụng cụ theo 6.1 đến 6.14.
Thiết bị, dụng cụ và các bộ phận của thiết bị, dụng cụ tiếp xúc với mẫu và dịch chiết không được chứa tạp chất. Tốt nhất sử dụng thiết bị hoặc dụng cụ thủy tinh bằng thép không gỉ hoặc PTFE (polytetrafluoroethylen).
6.1 Cân phân tích, có thể cân chính xác đến 0,1 mg.
6.2 Máy xay cà phê, thích hợp để xay hạt cà phê rang.
6.3 Dụng cụ thủy tinh, để thu nhận và bảo quản các dịch chiết, tốt nhất bằng thủy tinh màu hổ phách, như vial đựng mẫu để sử dụng thủ công hoặc tự động, được trang bị nắp kín, trơ về mặt hoá học (ví dụ: lọ có septum phủ PTFE).
6.4 Bể siêu âm, có khả năng duy trì ở 40 °C.
6.5 Máy ly tâm phòng thử nghiệm, thích hợp cho các ống ly tâm 15 ml, 50 ml và có gia tốc tối thiểu 2 000 g.
6.6 Ống ly tâm, 15 ml và 50 ml.
6.7 Bình định mức một vạch, 20 ml và 100 ml.
6.8 Pipet thủy tinh hoặc pipet tự động, thích hợp cho phạm vi đo thể tích của dung dịch chuẩn và dịch chiết mẫu.
6.9 Cột thủy tinh hoặc cột polypropylen, có chất hấp phụ để chiết pha rắn (SPE) và làm sạch các dịch chiết trong 8.3.2 và 8.5.1 (các ví dụ được nêu trong Bảng B.1).
6.10 Máy sắc ký lỏng hiệu năng cao (dùng cho quy trình thử nghiệm theo 8.4) được trang bị ion hóa phun điện tử (ESI) và detector khối phổ (HPLC-MS/MS); nguồn cấp khí theo quy định của nhà sản xuất.
6.11 Cột HPLC (dùng cho quy trình thử nghiệm theo 8.4) thích hợp chạy sắc ký acrylamid (ví dụ được nêu trong Bảng C.1).
6.12 Máy sắc ký khí (dùng cho quy trình thử nghiệm theo 8.5) được trang bị detector khối phổ (GC- MS) và nguồn cấp khí (5.2) theo quy định của nhà sản xuất.
6.13 Cột GC, (dùng cho quy trình thử nghiệm theo 8.5), cột mao quản, thích hợp cho sắc ký acrylamid (các ví dụ được nêu trong Bảng C.2).
6.14 Bộ lọc màng, bộ lọc xyranh (ví dụ bộ lọc cellulose axetat cỡ lỗ 0,45 μm) thích hợp để lọc dịch rửa giải mẫu thu được sau chiết pha rắn và trước khi bơm vào sắc ký.
7 Lấy mẫu
Việc lấy mẫu không phải là một phần của phương pháp quy định trong tiêu chuẩn này. Quy trình lấy mẫu phải theo thỏa thuận của các bên liên quan. Phải sử dụng mẫu đại diện, được trộn đều kỹ, không bị hư hỏng hoặc bị tạp nhiễm trong quá trình vận chuyển hoặc bảo quản.
Để tránh các thay đổi về mức acrylamid, cần phân tích ngay sau khi nhận được mẫu. Các mẫu phải được bảo quản ở điều kiện lạnh dưới 6 °C tối đa 6 tháng, tránh ánh sáng và đưa về nhiệt độ phòng khi phân tích.
Ngày nhận mẫu, cũng như ngày rang mẫu hoặc hạn sử dụng tốt nhất phải được ghi lại cùng với ngày phân tích.
8 Cách tiến hành
8.1 Yêu cầu chung
Để tránh hao hụt chất phân tích, mẫu cần được bảo vệ tránh ánh sáng trong quá trình chiết và chuẩn bị tiếp theo. Vì lý do này, luôn phải sử dụng dụng cụ thủy tinh màu hổ phách. Cách khác, dùng lá nhôm bọc bình đựng mẫu để tránh ánh sáng.
8.2 Chuẩn bị dịch chiết mẫu
Nghiền mẫu trong máy xay cà phê (6.2) và đồng hoá kỹ, nếu cần.
Dùng cân phân tích (6.1) cân 2 g, chính xác đến 1 mg, mẫu cà phê rang, cà phê hòa tan hoặc chất thay thế cà phê hoặc 5 g đồ uống cà phê dạng lỏng đã đồng nhất và chuyển vào ống ly tâm 50 ml (6.6).
Thêm 2 ml n-hexan vào mẫu thử và lắc nhanh. Sau đó, bổ sung dung dịch nội chuẩn D3-acrylamid vào mẫu thử có nồng độ tương ứng với mức acrylamid dự kiến có trong mẫu.
VÍ DỤ Cân 2 g cà phê và thêm 100 μl dung dịch nội chuẩn (/7=10 μg/ml), tương đương với phần khối lượng acrylamid 500 μg/kg trong mẫu cà phê.
Thêm 20 ml nước cất, lắc nhanh, mạnh rồi siêu âm (6.4) 15 min ở khoảng 40 °C.
Để yên vài phút nhằm tạo kết tủa và trong trường hợp mẫu không lắng cặn thì ly tâm (6.5) 15 min ở 2000 g để tách chất rắn lơ lửng. Trước khi thực hiện sắc ký lỏng (8.4) hoặc tạo dẫn xuất và tách bằng sắc ký khí (8.5) lấy 10 ml từ pha nước phía dưới, để làm sạch tiếp theo trong 8.3. Dùng pipet lấy pha nước phía dưới qua pha hexan phía trên mà không lấy pha hexan. Cũng có thể loại pha hexan bằng pipet Pasteur, nếu cần.
8.3 Làm sạch chất chiết
8.3.1 Tạo kết tủa Carrez
Làm sạch chất chiết mẫu đã được chuẩn bị theo 8.2 bằng cách tạo kết tủa Carrez. Thêm 1 000 μl dung dịch Carrez I (5.11) và lắc. Thêm 1000 μl dung dịch Carrez II (5.12) và lắc lại. Sau thời gian tiếp xúc ngắn, ly tâm 4 min ở 2 000 g. Gạn dịch nổi phía trên, rửa phần cặn bằng 2 ml đến 3 ml nước, ly tâm và gạn lại. Kết hợp cả hai dung dịch pha nước.
8.3.2 Chiết pha rắn
Làm sạch dịch chiết mẫu sau khi tạo kết tủa Carrez (8.3.1) bằng chiết pha rắn (SPE), sử dụng hai cột tuần tự có vật liệu hấp phụ (ví dụ được nêu trong Bảng B.1). Cột thứ nhất chứa 500 mg vật liệu C18, cột thứ hai chứa 500 mg chất trao đổi ion. Các cột có thể được sử dụng nối tiếp. Có thể sử dụng cột ghép, nếu thích hợp.
Ổn định cả hai cột SPE theo hướng dẫn của nhà sản xuất bằng metanol và nước cất. Cho toàn bộ dịch chiết mẫu (8.3.1) lên đỉnh cột SPE phía trên (thứ nhất), để cho thấm và thêm từ 2 ml đến 3 ml nước. Thu lấy dịch rửa giải cho đến khi cột khô. Cho dịch rửa giải lên đỉnh cột thứ hai hoặc ở phía thấp hơn cột, thêm từ 2 ml đến 3 ml nước và thu lấy dịch rửa giải. Có thể thu được dịch rửa giải hoàn toàn bằng cách sử dụng chân không hoặc áp lực nhẹ. Thu lấy dịch rửa giải bao gồm cả nước rửa vào bình định mức một vạch dung tích 20 ml và thêm nước đến 20 ml.
8.4 Đo bằng HPLC-MS/MS
8.4.1 Sắc ký lỏng hiệu năng cao (HPLC)
Trước khi phân tích bằng HPLC-MS/MS, cho dung môi hữu cơ vào dịch chiết đã làm sạch (8.3.2) để tạo thành phần rửa giải mong muốn và lọc qua màng lọc (6.14) trước khi bơm một lượng thích hợp (ví dụ từ 10 μl đến 100 μl tùy thuộc vào cột được sử dụng) vào cột HPLC.
Tối ưu hóa các thông số thiết bị của hệ thống HPLC theo hướng dẫn của nhà sản xuất. Các điều kiện sắc ký phải được điều chỉnh cho phù hợp với cột được chọn (các ví dụ được nêu trong Bảng C.1).
Các giai đoạn làm sạch theo 8.3.1 và 8.3.2 là cần thiết để tách sắc ký của các pic chất phân tích ra khỏi các pic gây nhiễu. Ví dụ về sắc ký đồ được nêu trong Hình C.1 và C.2.
8.4.2 Nhận biết và định lượng bằng sắc ký lỏng hiệu năng cao với đo khối phổ (HPLC-MS/MS)
Phát hiện acrylamid bằng MS/MS ở chế độ ion hóa dương (ion hoá phun điện tử, ESI).
Để nhận biết, sử dụng chuyển khối m/z = 72 → 55. Acrylamid được coi là có mặt nếu xuất hiện tín hiệu khối lượng của ion con (m/z 55) xuất hiện trong sắc ký đồ MS/MS và sai lệch thời gian lưu so với thời gian lưu của chất chuẩn, được phân tích trong cùng điều kiện HPLC, nhỏ hơn 5 %.
Sự chuyển khối ion dương có thể xảy ra đối với acrylamid và D3-acrylamid được nêu trong Bảng 1.
Định lượng chất phân tích bằng cách so sánh cường độ tín hiệu các ion mẹ-con của acrylamid với dung dịch nội chuẩn được gắn đồng vị bằng cách sử dụng các chuyển khối 72 → 55 (acrylamid) và 75 → 58 (D3-acrylamid).
Có thể sử dụng các chuyển khối thứ ba 72 → 54 để khẳng định thêm về kết quả. Việc đánh giá các chuyển khối này không phải là một phần của nghiên cứu liên phòng thử nghiệm (Phụ lục A).
Bảng 1 - Sự chuyển khối được sử dụng để nhận biết và định lượng acrylamid
| Chất chuẩn | Các chuyển khối được; chọn để nhận biết và định lượng acrylamid, sử dụng MS/MS m/z |
| Acrylamid | 72 → 55 Nhận biết và định lượng 72 → 44 Nhận biết (tham khảo, định tính) |
| D3-acrylamid | 75 → 58 Nhận biết và định lượng 75 → 44 Nhận biết (tham khảo, định tính) |
8.5 Đo bằng GC-MS
8.5.1 Tạo dẫn xuất và chuẩn bị mẫu cho sắc ký khí
Cho 3,5 g kali bromua (5.7) vào dung dịch mẫu (8.3.2). Thêm 2,5 ml nước brom bão hòa (5.6) và để phản ứng 2 h nơi tối ở nhiệt độ phòng. Thêm vài giọt dung dịch natri thiosulfat (5.8) để khử brom dư. Khi dùng dung dịch 1 mol thì nhỏ vài giọt là đủ để khử màu nâu của brom. Nên tránh dùng quá liều natri thiosulfat.
Cho hết chất chiết vào cột nhựa polyme (hàm lượng 500 mg) có đặc tính trao đổi cation mạnh và phân cực (ví dụ, xem Bảng B.2), đã được ổn định trước theo hướng dẫn của nhà sản xuất. Trong quá trình này và trong các bước rửa tiếp theo, cần đảm bảo cột không bị chảy đến khô. Sau đó, rửa cột bằng 3 ml nước, 1 ml dung dịch đệm borat có pH 8,6 (5.13) và rửa thêm một lần nữa bằng 0,5 ml nước. Sau đó hút khô cột tiếp theo rửa giải chất phân tích bằng 2 ml etyl axetat với thời gian tiếp xúc trên cột từ 1 min đến 2 min.
CHÚ THÍCH 1: Có thể rửa giải bằng nhiều lượng etyl axetat hơn để cải thiện độ thu hồi. Tuy nhiên, điều này có thể làm tăng ảnh hưởng của chất gây nhiễu.
Làm khô dịch chiết bằng cách bổ sung lượng natri sulfat (5.10) ít nhất có thể để đảm bảo rằng dịch chiết không chứa nước và sau đó thêm 50 μl trjetylamin (5.9). Dung dịch này có thể được sử dụng trực tiếp để phân tích GC.
CHÚ THÍCH 2: Để kiểm tra mức độ hoàn toàn của phản ứng chuyển hóa, có thể bổ sung metacrylamid (ví dụ 100 μl dung dịch pha nước 0,5 μg/ml) vào dung dịch mẫu trước bước brom hóa. Đối với dẫn xuất metacrylamid, nếu độ thu hồi đáp ứng, thì xem như acrylamid đã được brom hóa hoàn toàn.
CHÚ THÍCH 3: Bằng cách bổ sung trietylamin, dibromopropionamid không bền được chuyển thành monobromopropenamid bền, được phát hiện bằng GC-MS. Nếu không có sự chuyển đổi này, việc khử HBr không kiểm soát được có thể xảy ra trong quá trình phân tích tiếp theo (ví dụ tại các vị trí hoạt động trong bơm), cho kết quả không tái lập.
8.5.2 Sắc ký khí
Pha loãng dịch chiết đã tinh sạch (8.5.1) bằng etyl axetat (5.3) theo nồng độ chất phân tích dự kiến và lọc qua màng lọc (6.14) trước khi phân tích GC/MS, nếu cần.
Máy sắc ký khí (6.12) phải được cài đặt theo hướng dẫn của nhà sản xuất và các thông số của thiết bị phải được tối ưu hóa. Việc cài đặt sắc ký phải được điều chỉnh cho phù hợp với cột đã chọn. Các ví dụ được nêu trong Bảng C.2 và C.5 và ví dụ về sắc ký đồ được nêu trong Hình C.3, C.4 và C.5.
8.5.3 Nhận biết và định lượng bằng khối phổ
Các chất phân tích được chuyển về các ion dương (ion phân tử) và các ion phân mảnh đặc trưng bằng quá trình ion hóa điện tử (El). Sử dụng các ion này để nhận biết và định lượng.
Định lượng bằng cách so sánh diện tích pic của các ion thu được từ bromopropenamid với diện tích từ dung dịch nội chuẩn được gắn đồng vị (xem Bảng 2).
Bảng 2 - Các ion quan sát được
| Hợp chất ban đầu | Các ion quan sát được m/z | |
| Bromopropenamid | 149:[C3H479BrON]+ | Nhận biết và định lượng |
|
| 106:[C2H379Br]+ | Nhận biết |
| Bromopropenamid-D2 | 153:[C32 H21H281BrON]+ | Nhận biết và định lượng |
|
| 110:[C2 2H21H181Br]+ | Nhận biết |
| CHÚ THÍCH: Do sự phân bố đồng vị tự nhiên của brom, sự xuất hiện của các ion có m/z 151 và m/z 108 không dùng để đánh giá | ||
9 Hiệu chuẩn
9.1 Yêu cầu chung
Trước khi áp dụng phương pháp GC, tất cả các dung dịch hiệu chuẩn phải tuân theo quy trình tạo dẫn xuất theo 8.5.1.
Để hiệu chuẩn chính xác quy trình thử nghiệm theo 8.4, cần xác định thời gian lưu của acrylamid (LC-MS/MS) hoặc đối với quy trình theo 8.5 thì xác định thời gian lưu của bromopropenamid (GC-MS). Nhận biết thời gian lưu bằng cách sử dụng dung dịch pha nước của chất chuẩn ở các điều kiện sắc ký quy định.
9.2 Xác định độ tuyến tính và xác định dải làm việc
Xác định độ tuyến tính và dải làm việc bằng cách phân tích các dung dịch acrylamid (5.4.2) ở các mức nồng độ khác nhau được bổ sung D3-acrylamid ở cùng mức như đã cho trong 8.2, ví dụ: 0,5 μg/ml. Những dữ liệu này được áp dụng nhằm thiết lập hàm hiệu chuẩn để tính dải tuyến tính đối với acrylamid (dải làm việc).
9.3 Hiệu chuẩn bằng dung dịch nội chuẩn
Thêm một lượng xác định dung dịch nội chuẩn (5.5.2) vào một vài phần mẫu thử của mẫu cà phê được chọn ở các mức nồng độ khác nhau bao trùm dải làm việc. Sau đó tiến hành quy trình phân tích (8.2). Sử dụng dữ liệu được xác định để tính hàm hiệu chuẩn phụ thuộc nền mẫu có dung dịch nội chuẩn. Thực hiện phép xác định riêng rẽ đối với từng loại nền mẫu (chất chiết cà phê, chất thay thế cà phê).
CHÚ THÍCH: Phép xác định hàm lượng chất phân tích trong các mẫu thử thường dựa trên các đặc tính của nền mẫu và mẫu cụ thể bằng cách sử dụng dung dịch nội chuẩn được bổ sung vào mỗi mẫu trước khi phân tích (xem 8.2 và 10.2).
9.4 Xác định độ thu hồi cụ thể trong phòng thử nghiệm
Thêm một lượng xác định dung dịch hiệu chuẩn acrylamid (5.4.2) vào một vài phần mẫu thử của mẫu cà phê ở các mức nồng độ khác nhau. Sau đó thực hiện quá trình phân tích (8.2). Xác định tỷ lệ thu hồi trung bình của phòng thử nghiệm bằng cách sử dụng các giá trị thu được. Độ thu hồi có thể được xác định bằng cách phân tích mẫu chuẩn có hàm lượng acrylamid đã được chứng nhận hoặc đã biết, nếu sẵn có. Nên sử dụng vật liệu như vậy làm mẫu thu hồi trong phép phân tích thông dụng.
10 Đánh giá
10.1 Tiêu chí nhận biết
Xem Bảng 1 và Bảng 2.
10.2 Tính toán và kết quả cuối cùng
Sử dụng các bộ mẫu hiệu chuẩn đã được chuẩn bị theo 9.2 để dựng đồ thị tỷ lệ pic acrylamid với pic dung dịch nội chuẩn theo tỷ lệ nồng độ acrylamid của dung dịch nội chuẩn và thực hiện phép hồi quy tuyến tính.
Tính tỷ lệ pic acrylamid với pic của dung dịch nội chuẩn đối với pic acrylamid của mẫu. Tỷ lệ nồng độ acrylamid của dung dịch nội chuẩn trong mẫu thử có thể được tính bằng phương trình tuyến tính tổng quát. Tính phần khối lượng của acrylamid, w, trong mẫu, biểu thị bằng microgam trên kilogam (μg/kg), sử dụng Công thức (1). Kết quả được tự động hiệu chính theo tỷ lệ thu hồi.
|
| (1) |
Trong đó
| w | là phần khối lượng acrylamid của mẫu tính bằng microgam trên kilogam (μg/kg); |
| K | là nồng độ khối lượng đích của dung dịch nội chuẩn trong mẫu thử, tính bằng microgam trên mililit (μg/ml); |
| yi | là diện tích pic của acrylamid chia cho diện tích pic của dung dịch nội chuẩn trong mẫu thử; |
| a | là độ dốc gradient đường hồi quy của tỷ lệ diện tích pic với tỷ lệ nồng độ; |
| b | là giao điểm đường hồi quy của tỷ lệ diện tích pic với tỷ lệ nồng độ; |
| V | là thể tích cuối cùng của việc chuẩn bị mẫu, tính bằng mililit (ml); |
| m | là khối lượng mẫu, tính bằng gam (g). |
Ngoài ra, có thể sử dụng phương pháp tính đơn giản hơn. Với phương pháp này, giả định rằng độ đáp ứng của pic D3-acrylamid của mẫu tương ứng với nồng độ dung dịch nội chuẩn là 500 mg/kg (xem ví dụ trong 8.2). Nồng độ tương ứng của acrylamid có thể tính được từ độ đáp ứng pic acrylamid sẵn có bằng cách sử dụng quy tắc ba và kết quả có thể nhân với hệ số 0,974 (khối lượng phân tử của acrylamid/khối lượng phân tử của D3-acrylamid). Khi áp dụng phương pháp này, khuyến cáo rằng, trong mỗi dãy phân tích có ít nhất một mẫu đã biết hàm lượng acrylamid để đảm bảo chức năng cơ bản của thiết bị đo.
11 Độ chụm
11.1 Yêu cầu chung
Chi tiết về phép thử liên phòng thử nghiệm về độ chụm của phương pháp được tóm tắt trong Bảng 3 và Bảng A.1 Các giá trị thu được từ phép thử liên phòng thử nghiệm có thể không áp dụng được cho các dải nồng độ chất phân tích và/hoặc chất nền khác với các giá trị nêu trong Bảng 3 và Bảng A.1.
11.2 Độ lặp lại
Chênh lệch tuyệt đối giữa hai kết quả thử nghiệm đơn lẻ thu được trên vật liệu thử giống hệt nhau do một người thực hiện sử dụng cùng một thiết bị trong khoảng thời gian ngắn nhất không được quá 5 % các trường hợp lớn hơn giới hạn lặp lại r.
11.3 Độ tái lập
Chênh lệch tuyệt đối giữa hai kết quả thử nghiệm đơn lẻ thu được trên vật liệu thử giống hệt nhau do hai phòng thử nghiệm thực hiện không được quá 5% các trường hợp lớn hơn giới hạn tái lập R.
Bảng 3 - Dữ liệu về độ chụm để xác định acrylamid trong cà phê
| Mẫu |
μg/kg | r μg/kg | R μg/kg |
| Mẫu A (chất chiết cà phê) | 612,1 | 51,86 | 328,44 |
| Mẫu B (chất chiết thay thế cà phê) | 204,1 | 34,80 | 141,26 |
| Mẫu C (cà phê rang) | 53,74 | 12,13 | 38.576 |
| Mẫu D (cà phê rang) | 217,1 | 26,49 | 109,20 |
11.4 Độ thu hồi
Đối với phương pháp HPLC, độ thu hồi phải nằm trong khoảng từ 80 % đến 120 %. Đối với phương pháp GC, độ thu hồi phải nằm trong khoảng từ 70 % đến 120 %.
12 Độ không đảm bảo đo
Độ không đảm bảo đo cụ thể của phòng thử nghiệm phải được xác định riêng cho từng nền mẫu.
13 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm các dữ liệu theo TCVN ISO/IEC 17025 và bao gồm ít nhất các thông tin sau đây:
a) mọi thông tin cần thiết để nhận biết đầy đủ về mẫu (loại mẫu, nguồn gốc và tên gọi của mẫu);
b) viện dẫn tiêu chuẩn này;
c) ngày và kiểu quy trình lấy mẫu (nếu biết);
d) ngày nhận mẫu;
e) ngày thử nghiệm;
f) kết quả và đơn vị biểu thị kết quả;
h) các thao tác không quy định trong tiêu chuẩn này hoặc các tùy chọn khác có thể ảnh hưởng đến kết quả thử nghiệm.
Phụ lục A
(Tham khảo)
Đặc tính hiệu năng
Một nghiên cứu liên phòng thử nghiệm do Ban công tác NA 057-05-09 Kaffee thuộc ban tiêu chuẩn sản phẩm nông nghiệp và thực phẩm của DIN thực hiện với sự tham gia của các phòng thử nghiệm khác nhau. Nghiên cứu này được thực hiện theo các hướng dẫn được mô tả trong tiêu chuẩn này trong thời gian phân tích không quá 10 ngày. Độ chụm của phương pháp phù hợp với các yêu cầu của TCVN 6910-1 (ISO 5725-1) và TCVN 6910-2 (ISO 5725-2). Các kết quả được nêu trong Bảng A.1.
Bảng A.1 - Kết quả nghiên cứu liên phòng thử nghiệm
(cho cả hai phương pháp: HPLC và GC)a
| Thông số | Mẫu A | Mẫu B | Mẫu C | Mẫu D |
| Năm tiến hành phép thử liên phòng thử nghiệm | 2009 | 2009 | 2009 | 2009 |
| Số lượng phòng thử nghiệm tham gia | 13 | 13 | 13 | 13 |
| Số lượng phòng thử nghiệm được giữ lại sau khi trừ ngoại lệ | 10 | 11 | 11 | 11 |
| Số lượng kết quả được chấp nhận | 30 | 33 | 32 | 33 |
| Số lượng phòng thử nghiệm ngoại lệ | 7 | 4 | 5 | 4 |
| Giá trị trung bình, | 612,1 | 204,1 | 53,74 | 217,1 |
| Độ lệch chuẩn lặp lại, sr (μg/kg) | 18,52 | 12,43 | 4,333 | 9,46 |
| Độ lệch chuẩn tương đối lặp lại RSDr (%) | 3,0 | 6,1 | 8,1 | 4,4 |
| Giới hạn lặp lại r (2,8.sR) (μg/kg) | 51,86 | 34,80 | 12.132 | 26,49 |
| Độ lệch chuẩn tái lập, SR (μg/kg) | 117,30 | 50,45 | 13,777 | 39,00 |
| Độ lệch chuẩn tương đối tái lập RSDR (%) | 19,2 | 24,7 | 25,6 | 18,0 |
| Giới hạn tái lập, R (2,8.SR) (μg/kg) | 328,44 | 141,26 | 38,576 | 109,20 |
| Độ tái lập theo giá trị Horwitz RHorr | 294,79 | 116,01 | 37,317 | 122,18 |
| Giá trị Horrat R/RHorr | 1,12 | 1,22 | 1,03 | 0,90 |
| a Một đánh giá thống kê riêng biệt về kết quả HPLC-MS/MS và các kết quả GC-MS cho thấy không có sự khác biệt đáng kể giữa các dải giá trị đo được. | ||||
Phụ lục B
(Tham khảo)
Ví dụ về các vật liệu hấp phụ
Bảng B.1 - Ví dụ về chất hấp phụ phù hợp để làm sạch bằng SPE (HPLC và GC; xem 8.3)
| Sản phẩm (hoặc nhà sản xuất)a | Chất hấp phụ (mô tả) | Chức năng |
| Chromabond ABC18 500 mg | Octadecyl silica có chức năng trao đổi ion | Cột ghép (Combined cartridge) |
| lsolute® Multimod 500 mg | Chế độ hỗn hợp chứa các nhóm chức không phân cực (C18), trao đổi cation mạnh (-SO3-) và trao đổi anion mạnh (-NR3+) | Cột ghép (Combined cartridge) |
| Bond Elut 500 mg | Chất hấp phụ silica kỵ nước C18 | C18 |
| Strata C18E 500 mg | Chất hấp phụ silica kỵ nước C18, đầu khoá đuôi | C18 |
| Strata™ -X-C 33u 500 mg | Chất trao đổi cation polyme biến tính bằng axit benzen sulfonic dùng cho SPE | Trao đổi ion mạnh |
| Cromabond HR-XC 500 mg | Chất trao đổi cation polyme biến tính bằng axit benzen sulfonic dùng cho SPE | Trao đổi ion mạnh |
| a Các vật liệu được nêu tên là ví dụ về các sản phẩm thích hợp có bán sẵn. Thông tin này tạo thuận tiện cho người sử dụng và không ấn định phải sử dụng sản phẩm này. | ||
Bảng B.2 - Ví dụ về chất hấp phụ thích hợp để làm sạch bằng SPE
của dịch chiết GC (xem 8.5.1 )
| Sản phẩm (hoặc nhà sản xuất)a | Chất hấp phụ (mô tả) | Chức năng |
| Strata™ -X-C 33u 500 mg | Chất trao đổi cation polyme biến tính bằng axit benzen sulfonic dùng cho SPE | Trao đổi ion mạnh |
| Cromabond HR-XC 500 mg | Chất trao đổi cation polyme biến tính bằng axit benzen sulfonic dùng cho SPE | Trao đổi ion mạnh |
| a Các vật liệu được nêu tên là ví dụ về các sản phẩm thích hợp có bán sẵn. Thông tin này tạo thuận tiện cho người sử dụng và không ấn định phải sử dụng sản phẩm này. | ||
Phụ lục C
(Tham khảo)
Ví dụ về cột và các điều kiện phân tích
C.1 Cột sắc ký phù hợp thông thường
Cột sắc ký với các điều kiện phân tích tương ứng được nêu trong Bảng C.1 và C.2. Các kích thước cột khác nhau có thể được sử dụng sau khi chỉnh tốc độ dòng.
Bảng C.1 - Điều kiện phân tích cho các cột HPLC được chọn
| Cột HPLCa | Chiều dài mm | Đường kính trong mm | Cài đặt sắc ký | |
| Chất rửa giải | Tốc độ dòng ml/min | |||
| Synergi™Hydro-RPA | 250 | 4,6 | axit axetic, loãng, pH 2,6 | 1,0 |
| Phenomenex Luna C18, 3 μm | 150 | 3 | nước : metanol 9:1 (phần thể tích), với axit formic 0,1 % | 0,4 |
| LiChrospher® 100 CN, 5 μm | 250 | 4 | axetonitril:axit axetic 1 % 1:1 (phần thể tích) | 0,7 |
| Phenomenex Luna Phenyl-Hexyl | 250 | 4,6 | metanol:axit formic 1 % | 0,8 |
| Shodex RSpak DE-413,4 μm | 150 | 4,6 | A: Nước, axit formic 0,01 %, B: metanol Gradient: 0 min, 90 % A; 5 min, 60 % A, 6 min, 10 % A, 12 min 10 % A, 16 min 90 % A | 0,6 |
| Hypercarb®, 3 μm | 100 | 2,1 | nước: axit formic 1 % | 0,15 |
| a Các vật liệu được nêu tên là ví dụ về các sản phẩm thích hợp có bán sẵn. Thông tin này tạo thuận tiện cho người sử dụng và không ấn định phải sử dụng sản phẩm này. | ||||
Bảng C.2 - Cột mao quản GC
| Cột GCa | Vật liệu | Chiều dài m | Đường kính trong mm | Độ dày màng μm |
| Optima WAX | Polyetylen glycol 20 000 Da | 30 | 0,25 | 0,25 |
| RTX-200 | Crossbond® tritluoropropylmethyl polysiloxan | 60 | 0,25 | 0,25 |
| a) Các vật liệu được nêu tên là ví dụ về các sản phẩm thích hợp có bán sẵn. Thông tin này tạo thuận tiện cho người sử dụng và không ấn định phải sử dụng sản phẩm này. | ||||
C.2 Ví dụ về phương pháp và thời gian lưu gần đúng đối với HPLC-MS/MS
C.2.1 Ví dụ A
Bơm 20 μl dung dịch mẫu lên cột Phenomenex Luna Phenyl-Hexyl1) (xem Bảng C.1; 5 μm, 250 mm × 4,6 mm) ở các điều kiện sắc ký nêu trong Bảng C.3 .
Bảng C.3 - Các điều kiện sắc ký cho ví dụ A
| Chất rửa giải | Chất rửa giải A 1 % | Chất rửa giải B | Tốc độ dòng 0,8 ml/min |
| Gradient | (0 đến 3) min, 95 % A; (5 đến 8) min, 2 % A | ||
| Chạy mẫu | 8 min | ||
| Thời gian lưu | 4,7 min | ||
C.2.2 Ví dụ B
Bơm 20 μl dung dịch mẫu lên cột1) LiChrosphert® 100 CN (xem Bảng C.1) bằng tiền cột LiChrospher® 100 RP-18 (4 mm × 4 mm) ở các điều kiện sắc ký nêu trong Bảng C.4 .
Bảng C.4 - Các điều kiện sắc ký nêu trong ví dụ B
| Dung dịch rửa giải | Dung dịch rửa giải A axetonitril | Dung dịch rửa giải B axit axetic 1 % | Tốc độ dòng 0,7 ml/min |
| Gradient | (0 đến 5) min, 50 % A; (6 đến 9) min, 100 % A, (10 đến 20) min, 50 % A | ||
| Thời gian phân tích | 20 min | ||
| Nhiệt độ của bộ lấy mẫu tự động | 20 °C | ||
| Nhiệt độ lò cột | 25 °C | ||
| Chia dòng | khoảng 1:5 | ||
| Thời gian lưu acrylamid | 3,7 min | ||
C.3 Ví dụ về các điều kiện thích hợp và thời gian lưu gần đúng để phân tích GC-MS
Bơm 2 μl dung dịch mẫu ở “chế độ xung chia dòng” trên cột Optima WAX 1) (xem Bảng C.2 ) ở các điều kiện sắc ký nêu trong Bảng C.5 dưới đây.
Bảng C.5 - Phương pháp GC: Ví dụ về các điều kiện thích hợp và thời gian lưu gần đúng đối với GC-MS
| Bơm | 250 °C | - |
| Chương trình nhiệt độ | 50 °C | Giữ 1 min |
|
| 15°C/min | 240 °C |
|
| Giữ 11 min | - |
| Dòng khí | 1,0 ml/min | (đẳng dòng) |
| Thời gian lưu bromopropenamid (xấp xỉ) | 4,4 min | - |
C.4 Ví dụ về sắc ký đồ đối với HPLC-MS/MS
Sắc ký đồ nêu trong Hình C.1 đến Hình C.5 thu được từ phép phân tích các mẫu cà phê rang xay có hàm lượng acrylamid xấp xỉ 240 μg/kg. Nồng độ của D3-acrylamid được bổ sung là 500 μg/kg (GC) và 1 000 μg/kg (HPLC).
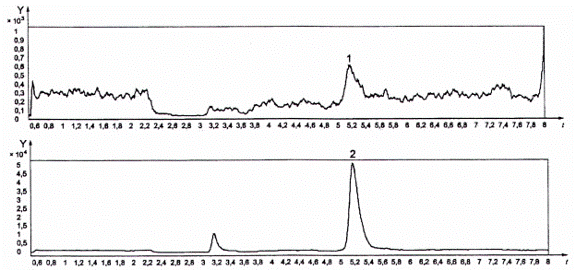
CHÚ GIẢI
Y cường độ tín hiệu
t thời gian tính bằng phút
1 ở t = 5,2 min MRM 75,0 → 44,0 (ion định tính)
2 ở t = 5,2 min MRM 75,0 → 58,0 (ion định lượng)
Hình C.1 - D3-acrylamid
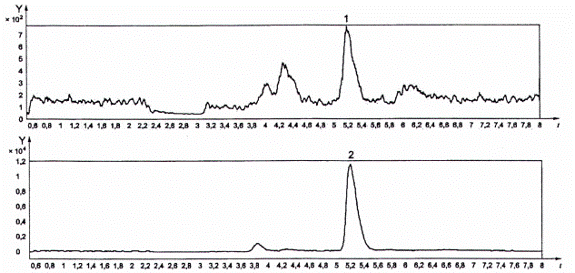
CHÚ GIẢI
Y cường độ tín hiệu
t thời gian tính bằng min
1 ở t = 5,2 min MRM 72,0 → 44,0 (ion định tính)
2 ở t = 5,2 min MRM 72,0 → 55,0 (ion định lượng)
Hình C.2 - D3-acrylamid, sẵn có
C.5 Ví dụ về sắc ký đồ đối với GC-MS
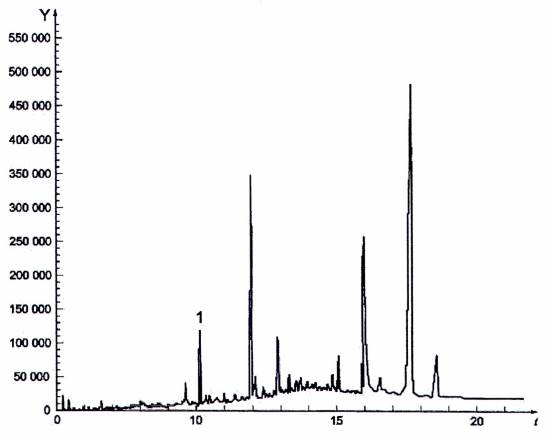
CHÚ GIẢI
Y cường độ tín hiệu
t thời gian tính bằng phút
1 bromopropenamid
Hình C.3 - Sắc ký đồ của ion tổng số (chế độ quét)
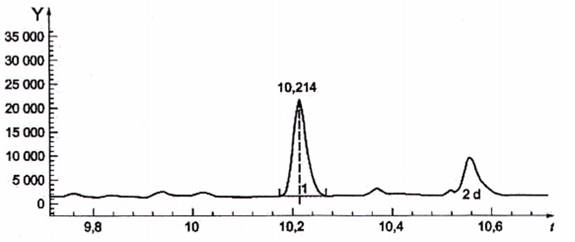
CHÚ GIẢI
Y cường độ tín hiệu
t thời gian tính bằng phút
1 ở t = 10,214 min, khối lượng bromopropenamid = 149 [C3H479Br]+
2d tạp chất
Hình C.4 - Ion được chiết, số khối 149 (ion định tính)
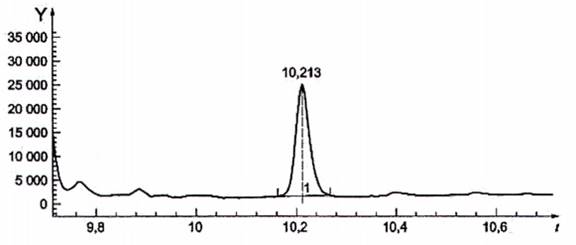
CHÚ GIẢI
Y cường độ tín hiệu
t thời gian tính bằng phút
1 ở t = 10,213 min, khối lượng bromopropenamid = 106 [C3H479Br]+
Hình C.5 - Ion được chiết, số khối 106 (ion định lượng)
Thư mục tài liệu tham khảo
[1] TCVN 6910-1 (ISO 5725-1), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo - Phần 1: Nguyên tắc và định nghĩa chung
[2] TCVN 6910-2 (ISO 5725-2), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo - Phần 2: Phương pháp cơ bản xác định độ lặp lại và độ tái lập của phương pháp đo tiêu chuẩn
[3] TCVN ISO/IEC 17025, Yêu cầu chung về năng lực của phòng thử nghiệm và hiệu chuẩn
1) Các vật liệu được nêu tên là ví dụ về các sản phẩm thích hợp có bán sẵn. Thông tin này tạo thuận tiện cho người sử dụng và không ấn định phải sử dụng sản phẩm này.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 13838:2023 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 13838:2023 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 13838:2023 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 13838:2023 DOC (Bản Word)