- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn quốc gia TCVN 13614:2022 Phân bón - Phương pháp định lượng Bacillus megaterium
| Số hiệu: | TCVN 13614:2022 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
30/12/2022 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 13614:2022
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 13614:2022
TIÊU CHUẨN QUỐC GIA
TCVN 13614:2022
PHÂN BÓN - PHƯƠNG PHÁP ĐỊNH LƯỢNG BACILLUS
MEGATERIUM - KỸ THUẬT ĐẾM KHUẨN LẠC
Fertilizers - Horizontal method for the enumeration of Bacillus megaterium - Colony count technique
Lời nói đầu
TCVN 13614:2022 do Viện Thổ nhưỡng Nông hóa biên soạn, Bộ Nông nghiệp và Phát triển Nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
PHÂN BÓN - PHƯƠNG PHÁP ĐỊNH LƯỢNG BACILLUS MEGATERIUM - KỸ THUẬT ĐẾM KHUẨN LẠC
Fertilizers - Horizontal method for the enumeration of Bacillus megaterium - Colony count technique
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp định lượng Bacillus megaterium trong phân bón hay nguyên liệu sản xuất phân bón bằng kỹ thuật đếm khuẩn lạc trên môi trường thạch.
2 Tài liệu viện dẫn
Tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thi áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 6404:2016 (ISO 7218:2007 with amendment 1:2013), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Yêu cầu chung và hướng dẫn kiểm tra vi sinh vật.
TCVN 8128:2015 (ISO 11133:2014), Vi sinh vật trong thực phẩm, thức ăn chăn nuôi và nước - chuẩn bị, sản xuất, bảo quản và thử hiệu năng của môi trường nuôi cấy.
3 Thuật ngữ, định nghĩa
Trong tiêu chuẩn này sử dụng thuật ngữ, định nghĩa sau.
3.1
Bacillus megaterium (Bacillus megaterium)
Vi khuẩn có khả năng phân giải phốt phát khó tan và/hoặc đối kháng vi khuẩn/nấm gây bệnh cây trồng và/hoặc sinh hoạt chất kích thích sinh trưởng thực vật, ...; là thành phần của phân bón hoặc nguyên liệu sản xuất phân bón;
Hình thành khuẩn lạc đặc trưng trên bề mặt môi trường thạch HiCromeTM Bacillus; có các đặc điểm hình thái và phép thử sinh hóa được mô tả khi tiến hành các thử nghiệm theo tiêu chuẩn này.
CHÚ THÍCH 1: Môi trường thạch HiCromeTM Bacillus là sản phẩm đang bán sẵn trên thị trường. Thông tin này đưa ra nhằm tạo thuận lợi cho người dùng tiêu chuẩn và không phải sự ấn định của tiêu chuẩn phải sử dụng sản phẩm này. Thành phần cụ thể của môi trường được nêu tại 5.2.1 của tiêu chuẩn này
3.2
Định lượng Bacillus megaterium (Bacillus megaterium enumeration)
Việc xác định số lượng Bacillus megaterium (3.1) trong một khối lượng hoặc thể tích cụ thể của phân bón, nguyên liệu sản xuất phân bón khi tiến hành các thử nghiệm theo tiêu chuẩn này.
4 Nguyên tắc
Định lượng Bacillus megaterium trong phân bón, nguyên liệu sản xuất phân bón bằng phương pháp đếm số lượng đơn vị khuẩn lạc đặc trưng phát triển trên môi trường thạch HiCromeTM Bacillus và được khẳng định thông qua đặc điểm hình thái và phép thử sinh hóa.
5 Môi trường và dung dịch pha loãng
5.1 Yêu cầu chung
Chuẩn bị, sản xuất và thử hiệu năng của môi trường nuôi cấy theo TCVN 8128:2015 (ISO 11133:2014).
Ưu tiên sử dụng các thành phần cơ bản khô, hoặc các môi trường hoàn chỉnh khô để chuẩn bị môi trường, thuốc thử; thực hiện theo hướng dẫn của nhà sản xuất.
Các hóa chất sử dụng phải đạt chất lượng phân tích và thích hợp để phân tích vi sinh vật.
Nước sử dụng phải là nước cất hoặc có chất lượng tương đương [xem TCVN 6404:2016 (ISO 7218:2007 with amendment 1:2013)].
5.2 Môi trường thạch HiCromeTM Bacillus
5.2.1 Thành phần
| Pepton | 10,0 g |
| Cao thịt | 1,0 g |
| D-Mannitol (C6H14O6) | 10,0 g |
| Natri clorua (NaCI) | 10,0 g |
| Chromogenic hỗn hợp | 3,2 g |
| Phenol đỏ (C19H14O5S) | 0,025 g |
| Thạch | 15,0 g |
| Nước cất | 1 000 mL |
| pH 7,1 ± 0,2 ở 25 °C |
|
5.2.2 Chuẩn bị
Cân và hòa tan các thành phần trong nước theo thứ tự đã liệt kê tại 5.2.1.
Phân phối môi trường thạch HiCromeTM Bacillus với lượng thích hợp vào các bình thủy tinh (6.2.1). Không vặn chặt nắp bình thủy tinh. Khử trùng 15 min, trong nồi hấp áp lực (6.1.2) ở 121 °C;
Điều chỉnh pH sao cho sau khi khử trùng, dung dịch có pH là 7,1 ± 0,2 ở 25 °C, nếu cần;
Sau khi khử trùng, làm nguội đến 44 °C - 47 °C; Phân phối lượng khoảng từ 18 mL đến 20 mL môi trường vào các đĩa Petri (6.2.6) đã được chuẩn bị như nêu tại 8.1.1 và để cho đông đặc. Các thao tác được tiến hành trong tủ cấy vô trùng (6.1.1);
Khi môi trường đã đông đặc, làm khô bề mặt thạch trước khi sử dụng (đảm bảo không có các giọt nước trên bề mặt môi trường) bằng cách lật úp các đĩa thạch và để trong tủ ấm (6.1.4) ở nhiệt độ từ 25 °C đến 35 °C trong 25 min đến 30 min hoặc để qua đêm.
5.3 Môi trường TSA (Tryptone Soy Agar)
5.3.1 Thành phần
| Trypton | 15,0 g |
| Natri clorua (NaCI) | 5,0 g |
| Pepton từ đậu tương | 5,0 g |
| Thạch | 15g |
| Nước cất | 1 000 mL |
| pH 7,0 ± 0,2 ở 25 °C |
|
5.3.2 Chuẩn bị
Cân và hòa tan các thành phần trong nước theo thứ tự đã liệt kê tại 5.3.1;
Phân phối môi trường TSA với lượng thích hợp vào các bình thủy tinh (6.2.1). Không vặn chặt nắp bình thủy tinh. Khử trùng 15 min, trong nồi hấp áp lực (6.1.2) ở 121 °C;
Điều chỉnh pH sao cho sau khi khử trùng, dung dịch có pH là 7,0 ± 0,2 ở 25 °C, nếu cần;
Sau khi khử trùng, làm nguội đến 44 °C - 47 °C; Phân phối lượng khoảng từ 18 mL đến 20 mL môi trường TSA vào các đĩa Petri (6 2.6) đã được chuẩn bị như nêu tại 8.1.1 và để cho đông đặc. Các thao tác được tiến hành trong tủ cấy vô trùng (6.1.1);
Khi môi trường đã đông đặc, làm khô bề mặt thạch trước khi sử dụng (đảm bảo không có các giọt nước trên bề mặt môi trường) bằng cách lật úp các đĩa thạch và để trong tủ ấm (6.1.4) ở nhiệt độ từ 25 °C đến 35 °C trong 25 min đến 30 min hoặc để qua đêm.
5.4 Dung dịch pha loãng (dung dịch muối pepton)
5.4.1 Thành phần
| Pepton từ casein | 1,0 g |
| Natri clorua (NaCI) | 8,5 g |
| Nước cất | 1 000 mL |
pH: 7,0 ± 0,2 ở 25 °C
5.4.2 Chuẩn bị
Cân và hòa tan các thành phần trong nước cất theo thứ tự đã liệt kê tại 5.4.1; đun nóng nhẹ, nếu cần. Điều chỉnh pH sao cho sau khi khử trùng, dung dịch có pH là 7,0 ± 0,2 ở 25 °C, nếu cần;
Phân phối dung dịch pha loãng với lượng cần thiết vào các bình thủy tinh (6.2.1) hoặc ống nghiệm (6.2.2) có dung tích thích hợp sao cho sau khi khử trùng trong mỗi bình thủy tinh chứa 90,0 mL, mỗi ống nghiệm chứa 9,0 mL. Sai số cho phép đo của thể tích cuối cùng sau khi khử trùng không được vượt quá ± 0,2 %;
Đậy nắp bình thủy tinh hoặc ống nghiệm; Khử trùng 15 min trong nồi hấp áp lực (6.1.2) ở 121 °C.
6 Thiết bị, dụng cụ
Có thể sử dụng các dụng cụ dùng một lần thay cho các dụng cụ sử dụng nhiều lần nếu các thông số kỹ thuật tương tự.
Sử dụng các thiết bị dụng cụ của phòng thử nghiệm vi sinh thông thường [xem TCVN 6404:2016 (ISO 7218:2007 with amendment 1:2013)] và cụ thể như sau:
6.1 Thiết bị
6.1.1 Tủ cấy vô trùng (Box cấy), đạt an toàn sinh học cấp 2, luồng không khí thổi theo chiều dọc.
6.1.2 Nồi hấp áp lực, có nhiệt độ hơi nước bão hòa trong buồng có khả năng duy trì nhiệt độ ở 121 °C ± 3 °C tương ứng áp suất tối thiểu 101,3 kPa.
6.1.3 Tủ sấy, thông gió đối lưu, có khả năng duy trì nhiệt độ từ 160 °C đến 180 °C, độ chính xác đến 1 °C.
6.1.4 Tủ ấm, thông gió đối lưu, có thể duy trì ở nhiệt độ từ 25 °C đến 37 °C, độ chính xác đến 1 °C.
6.1.5 Máy lắc, tốc độ đạt 150 r/min.
6.1.6 Cân kỹ thuật, có độ chính xác đến 0,01 g.
6.1.7 Máy trộn Vortex, tốc độ lắc đạt 1 000 r/min, lắc tròn.
6.1.8 Kính hiển vi quang học, có độ phóng đại 1 000 X, sử dụng vật kính soi dầu.
6.1.9 Máy đo pH, có độ chính xác đến ± 0,1 đơn vị pH ở 25 °C.
6.2 Dụng cụ
6.2.1 Bình thủy tinh có nắp vặn, có dung tích thích hợp
6.2.2 Ống nghiệm có nắp vặn, có dung tích thích hợp.
6.2.3 Que cấy vòng, đầu que cấy bằng chất liệu Volfram.
6.2.4 Que dàn mẫu, bằng thủy tinh hoặc bằng chất dẻo hoặc bằng thép.
6.2.5 Micropipet, có dung tích danh định 10 mL, 1 mL, 0,1 mL; sử dụng đầu tip vô trùng.
6.2.6 Đĩa Petri, đường kính 90 mm.
6.2.7 Lam kính, bằng thủy tinh.
6.2.8 Lamen, bằng thủy tinh.
6.2.9 Cốc thủy tinh, có dung tích thích hợp.
6.2.10 Phễu lọc, có màng lọc vô trùng, cỡ lỗ 0,45 μm.
7 Lấy mẫu
Tiêu chuẩn này không quy định việc lấy mẫu, nên lấy mẫu theo TCVN 12105:2018.
Mẫu gửi đến phòng thử nghiệm phải là mẫu đại diện và không bị hư hỏng hoặc biến đổi trong suốt quá trình vận chuyển và bảo quản.
8 Cách tiến hành
8.1 Chuẩn bị
8.1.1 Dụng cụ
Các dụng cụ sử dụng trong nuôi cấy vi sinh vật phải được tiệt trùng bằng 1 trong 2 cách sau:
- tiệt trùng khô ở nhiệt độ (170 ± 10) °C không ít hơn 1 h trong tủ sấy (6.1.3) hoặc;
- tiệt trùng hơi nước ở nhiệt độ (121 ± 3) °C không ít hơn 15 min trong nồi hấp áp lực (6.1.2).
8.1.2 Chuẩn bị mẫu
Dùng cân kỹ thuật (6.1.6) cân 10 g mẫu hoặc dùng micropipet với đầu típ vô trùng (6.2.5) hút 10 mL mẫu cho vào bình thủy tinh (6.2.1) chứa 90 mL dung dịch pha loãng đã chuẩn bị như nêu tại 5.4. Tránh chạm micropipet vào dung dịch pha loãng. Lắc trên máy lắc (6.1.5) từ 5 min đến 10 min sao cho vi sinh vật trong dung dịch phân bố đồng đều. Để cho các phần tử nặng lắng xuống trong thời gian không nhiều hơn 3 min, nếu cần. Dung dịch phía trên được gọi là dung dịch huyền phù ban đầu;
Dùng micropipet với đầu tip vô trùng (6.2.5) hút 1 mL dịch huyền phù ban đầu cho vào ống nghiệm (6.2.2) chứa 9 mL dung dịch pha loãng đã chuẩn bị như nêu tại 5.4. Tránh chạm đầu típ vào dung dịch pha loãng. Trộn kỹ trên máy trộn Vortex (6.1.7) từ 5 s đến 10 s để có dung dịch mẫu, nồng độ 10-2. Lấy dung dịch mẫu, nồng độ 10-2 pha loãng 10 lần để thu được dung dịch mẫu, nồng độ 10-3. Lặp lại qui trình để thu được dung dịch mẫu ở các nồng độ pha loãng thập phân tiếp theo. Thường sử dụng nồng độ pha loãng 10-5, 10-6, 10-7 đối với phân bón vi sinh và nồng độ pha loãng 10-3, 10-4, 10-5 đối với các phân bón khác có chứa vi sinh vật.
CHÚ THÍCH 2: Hoạt hóa mẫu (nếu có) theo hướng dẫn của nhà sản xuất để đảm bảo kết quả chính xác.
8.2 Cấy và ủ
Dùng micropipet với đầu tip vô trùng (6.2.5) lấy 0,1 mL dung dịch mẫu cho vào mỗi đĩa Petri chứa môi thạch HiCromeTM Bacillus đã chuẩn bị như nêu tại 5.2. Lặp lại qui trình với các dung dịch mẫu ở các nồng độ pha loãng thập phân tiếp theo; mỗi nồng độ thực hiện 2 đĩa;
Dùng que dàn mẫu (6.2.4) dàn đều dịch cấy trên bề mặt dĩa thạch càng nhanh càng tốt mà không chạm vào thành đĩa Petri. Sử dụng một que dàn mẫu cho mỗi đĩa Petri. Đậy nắp đĩa Petri và để yên trong khoảng 15 min ở nhiệt độ phòng để dịch cấy hấp thụ vào bề mặt thạch;
Nuôi trong tủ ấm (6.1.4) ở (30 ± 1) °C từ 20 h đến 24 h.
8.3 Đếm khuẩn lạc
Đếm các khuẩn lạc Bacillus megaterium giả định ở hai độ pha loãng liên tiếp, trên các đĩa Petri có chứa không nhiều hơn 150 khuẩn lạc;
Trên môi trường thạch HiCromeTM Bacillus, khuẩn lạc Bacillus megaterium giả định có màu vàng nhạt, dạng tròn, bóng, hơi lồi, mép trơn (xem Hình 1).
Khuẩn lạc Bacillus megaterium giả định được khẳng định thông qua phép thử khẳng định.
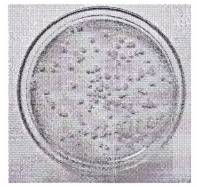
Hình 1. Khuẩn lạc Bacillus megaterium trên môi trường thạch HiCromeTM Bacillus sau 24 h.
CHÚ THÍCH 3:
1) Đọc kết quả sau 24 h màu sắc khuẩn lạc có thể bị thay đổi.
2) Trên môi trường thạch HiCromeTM Bacillus, khuẩn lạc Saccharomyces cerevisiae, Staphylococus spp. có thể xuất hiện có màu sắc, hình dạng tương tự như Bacillus megaterium giả định. Các khuẩn lạc này có thể nhận diện và loại trừ bằng phép thử khẳng định.
8.4 Phép thử khẳng định
Từ mỗi đĩa Petri đã chọn (8.3), lấy nấm khuẩn lạc Bacillus megaterium giả định để thực hiện phép thử khẳng định. Nếu trên đĩa Petri có ít hơn năm khuẩn lạc thì lấy tất cả các khuẩn lạc có mặt;
Cấy ria riêng rẽ các khuẩn lạc giả định lên các đĩa thạch HiCromeTM Bacillus, nuôi trong tủ ấm (6.1.4) ở (30 ± 1) °C từ 18 h đến 24 h. Lặp lại bước này từ 2 đến 3 lần, nếu cần để thu khuẩn lạc thuần. Chọn trên mỗi đĩa ít nhất một khuẩn lạc Bacillus megaterium giả định;
Dùng que cấy vòng (6.2.3), lấy một phần sinh khối vi khuẩn sau khi làm thuần cấy vạch trên đĩa Petri chứa môi trường TSA đã chuẩn bị như nêu tại 5.3, nuôi trong tủ ấm (6.1.4) ở (30 ± 1) °C từ 18 h đến 24 h;
Thử khẳng định (xem phụ lục A). Nếu khác khuẩn lạc thu được kết quả như sau được xác định là Bacillus megaterium
| Phép thử | Kết quả |
| Nhuộm gram | Gram dương |
| Hình dạng tế bào | Tế bào hình que |
| Hình thành bào tử | Dương tính |
| Vị trí bào tử, dạng bào tử | Tập trung ở phần giữa tế bào, nội bào tử dạng u lồi |
| Catalase | Dương tính |
| Phân giải tinh bột tan | Dương tính |
| Urease | Dương tính |
| Voges proskauer | Âm tính |
| Sử dụng xìtrat làm nguồn các bon | Dương tính |
9 Tính và biểu thị kết quả
Số lượng khuẩn lạc Bacillus megaterium trên mỗi đĩa Petri theo các tiêu chí xác định được tính theo công thức (1):
|
| (1) |
Trong đó
b số lượng khuẩn lạc Bacillus megaterium giả định cho thấy có đặc điểm như phép thử khẳng định của tiêu chuẩn;
A số lượng khuẩn lạc Bacillus megaterium giả định đã qua phép thử khẳng định;
C tổng số khuẩn lạc Bacillus megaterium giả định đếm được trên đĩa Petri.
Làm tròn kết quả tính được đến số nguyên gần nhất.
Số lượng Bacillus megaterium trong một đơn vị kiểm tra được tính bằng đơn vị hình thành khuẩn lạc (CFU) trên gam hay mililit, theo công thức (2):
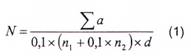
trong đó:
| N | số lượng Bacillus megaterium trong một đơn vị kiểm tra, được tính bằng đơn vị hình thành khuẩn lạc trên gam hay mililit (CFU/g (mL)); |
| Σa | tổng số khuẩn lạc Bacillus megaterium đếm được trên tất cả các đĩa Petri được giữ lại ở hai độ pha loãng liên tiếp; |
| 0,1 | thể tích mẫu cấy trên mỗi đĩa Petri, tính bằng mililit (mL); |
| n1 | số đĩa Petri được giữ lại ở độ pha loãng thứ nhất; |
| n2 | số đĩa Petri được giữ lại ở độ pha loãng thứ hai; |
| d | độ pha loãng tương ứng với dung dịch pha loãng thứ nhất được giữ lại. |
Làm tròn kết quả tính được đến một chữ số sau dấu phẩy. Biểu thị kết quả bằng cách lấy một trong các giá trị từ 1,0 đến 9,9 nhãn với 10x, trong đó x là số mũ của 10.
Biểu thị kết quả trong trường hợp số đếm thấp hoặc trường hợp đặc biệt theo quy định trong TCVN 6404 (ISO 7218).
10 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm ít nhất các thông tin sau:
- mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
- phương pháp lấy mẫu đã sử dụng, nếu biết;
- phương pháp thử nghiệm đã dùng hoặc viện dẫn tiêu chuẩn này;
- các thao tác không quy định trong tiêu chuẩn này, cùng với các chi tiết của sự cố bất kỳ có thể ảnh hưởng đến kết quả;
- các kết quả thử nghiệm thu được.
Phụ lục A
(Quy định)
Các phép thử khẳng định Bacillus megaterium
A.1 Nhuộm Gram
A.1.1 Thuốc nhuộm
Ưu tiên sử dụng thuốc nhuộm thương mại có sẵn. Trong trường hợp này, phải tuân theo hướng dẫn của nhà sản xuất.
A.1.1.1 Dung dịch tím tinh thể (Crystal violet)
A.1.1.1.1 Thành phần
| Tím tinh thể | 2,0 g |
| Etanol 95 % | 20,0 ml |
| Amoni oxalat (C2H8N2O4) | 0,8 g |
| Nước cất | 80,0 mL |
A.1.1.1.2 Chuẩn bị
Hòa tan tím tinh thể trong ethanol 95 % thu được dung dịch (a). Hòa tan amoni oxalat trong nước cất thu được dung dịch (b);
Trộn dung dịch (a) và (b), thu được dung dịch tím tinh thể; để yên hỗn hợp 24 h trước khi sử dụng.
A.1.1.2 Dung dịch iốt
A.1.1.2.1 Thành phần
| Iốt (I2) | 1,0 g |
| Kali iodua (KI) | 2,0 g |
| Nước cất | 100 mL |
A.1.1.2.2 Chuẩn bị
Hòa tan kali iodua trong 10 mL nước, thêm từng phần nhỏ iốt, khuấy cho tan hết, thêm nước cho đủ 100 mL. Bảo quản trong lọ tối, sử dụng trong vòng 1 tháng.
A.1.1.3 Dung dịch Safranin
A.1.1.3.1 Thành phần
| Safranin | 0,25 g |
| Etanol 95 % | 10,0 mL |
| Nước cất | 100 mL |
A.1.1.3.2 Chuẩn bị
Hòa tan Safranin trong dung dịch etanol 95 %, sau đó bổ sung nước cất. Pha trước khi dùng.
A.1.2 Tiến hành
Nhỏ 1 giọt dung dịch pha loãng (5.4) lên lam kính (6.2.7); dùng que cấy vòng (6.2.3) lấy một phần sinh khối vi sinh vật từ các khuẩn lạc đã lựa chọn trong phép thử khẳng định (8.4) hòa vào giọt dịch pha loãng;
Hơ nhanh vết bôi trên ngọn lửa đèn cồn;
CHÚ THÍCH 1: Lưu ý kiểm tra độ nóng (nóng nhẹ vừa phải trên mu bàn tay) để mẫu khô vừa đủ; nếu nóng quá, hoặc hơ lâu, vi sinh vật sẽ biến dạng.
Phủ lên lam kính dung dịch tím tinh thể (A. 1.1.1). Để cho phản ứng xảy ra trong 1 min. Tráng nhẹ lam kính để ở tư thế nghiêng bằng nước, thấm khô;
Phủ lên lam kính dung dịch Iốt (A.1.1.2), để phản ứng xảy ra trong 1 min. Tráng nhẹ lam kính để ở tư thế nghiêng bằng nước trong vài giây;
Rót một cách nhẹ nhàng và liên tục một lớp mỏng dung dịch etanol 95 % lên lam kính, để nghiêng trong khoảng thời gian không nhiều hơn 30 s cho đến khi không còn màu tím;
Tráng nhẹ lam kính để ở tư thế nghiêng bằng nước để loại etanol. Phủ lên lam kính bằng dung dịch safranin (A.1.1.3) trong 10 s. Tráng nhẹ lam kính để ở tư thế nghiêng bằng nước; Làm khô lam kính; Đậy lamen (6.2.8) lên trên lam kính;
Quan sát hình dạng và màu sắc tế bào bằng kính hiển vi quang học (6.1.8).
A.1.3 Đọc kết quả
Gram dương (Gram +): các tế bào vi khuẩn có màu xanh lam hoặc tím;
Gram âm (Gram -): các tế bào vi khuẩn có màu từ hồng thẫm đến đỏ.
CHÚ THÍCH 2: Các tế bào vón đặc có thể cho hình ảnh không đặc trưng.
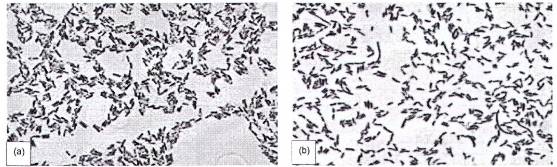
Hình A.1. (a) Gram dương; (b) Gram âm
A.2 Nhuộm bào tử
A.2.1 Dung dịch xanh malachite (Malachite green)
A.2.1.1 Thành phần
Xanh malachite 1 g
Nước cất 20 mL
A.2.1.2 Chuẩn bị
Hòa tan xanh malachite trong nước. Bảo quản trong lọ tối, thời hạn sử dụng 1 tháng.
A.2.2 Tiến hành
Nhỏ 1 giọt dung dịch pha loãng (5.4) lên lam kính (6.2.8); dùng que cấy vòng (6.2.3 ) lấy một phần sinh khối vi sinh vật từ các khuẩn lạc đã lựa chọn trong phép thử khẳng định (8.4) hòa vào giọt dung dịch pha loãng; Hơ nhanh vết bôi trên ngọn lửa đèn cồn;
CHÚ THÍCH 3: Chú ý kiểm tra độ nóng (nóng nhẹ vừa phải trên mu bàn tay); nếu nóng quá, hoặc hơ lâu, vi khuẩn sẽ biến dạng.
Phủ lên lam kính dung dịch xanh malachite (A.2.1). Để cho phản ứng xảy ra trong 10 min. Tráng nhẹ lam kính để ở tư thế nghiêng bằng nước trong vài giây;
Phủ lên lam kính dung dịch safranin (A.1.1.3). Để cho phản ứng xảy ra trong 30 s. Tráng nhẹ lam kính để ở tư thế nghiêng bằng nước trong vài giây, thấm khô;
Quan sát bào tử bằng kính hiển vi quang học (6.1.8).
A.2.3 Đọc kết quả
Nội bào tử có màu xanh; dạng u lồi, tập trung ở phần giữa tế bào.
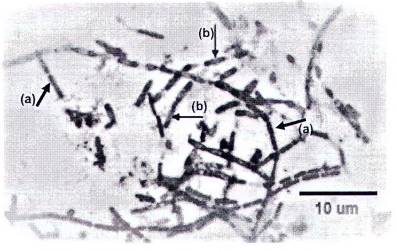
Hình A.2. (a) Tế bào sinh dưỡng; (b) Nội bào tử
A.3 Thử nghiệm catalase
A.3.1 Thuốc thử
Dung dịch H2O2 3% pha sẵn hoặc pha loãng dung dịch 30% tỷ lệ 1:10 bằng nước cất trước khi sử dụng.
A.3.2 Cách tiến hành
Dùng que cấy vòng (6.2.3) lấy một phần sinh khối vi sinh vật từ các khuẩn lạc đã lựa chọn trong phép thử khẳng định (8.4) bôi lên trên bề mặt lam kính (6.2.7);
Nhỏ từ 150 μL đến 200 μL dung dịch H2O2 3% lên trên vết bôi chứa sinh khối vi sinh vật; lấy que cấy hòa đều sinh khối vi sinh vật trong dịch vết bôi. Đọc kết quả trong vòng 20 s.
A.3.4 Đọc kết quả
Thử nghiệm Catalase dương tính: Xuất hiện bọt khí trên phần sinh khối vi sinh vật hòa tan.
Thử nghiệm Catalase âm tính: Không xuất hiện bọt khí hoặc xuất hiện ít trên phần sinh khối vi sinh vật hòa tan.
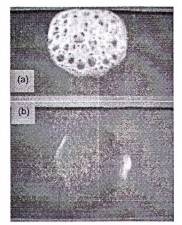
Hình A.3. (a) Thử nghiệm catalase dương tính; (b) Thử nghiệm catalase âm tính
A.4 Khả năng phân giải tinh bột
A.4.1 Môi trường nuôi cấy
A.4.1.1 Thành phần
| Pepton | 5,0 g |
| Natri clorua (NaCI) | 5,0 g |
| Cao nấm men | 1,5 g |
| Cao thịt bò | 1,5 g |
| Tinh bột tan ((C6H10O5)n) | 2,0 g |
| Thạch | 15,0 g |
| Nước cất | 1 000 mL |
pH: 7,0 ± 0,2 ở 25 °C
A.4.1.2 Chuẩn bị
Cân và hòa tan các thành phần trong nước theo thứ tự đã liệt kê tại A.4.1.1. Điều chỉnh pH sao cho sau khi khử trùng, dung dịch có pH là 7,0 ± 0,2 ở 25 °C, nếu cần;
Phân phối môi trường với lượng thích hợp vào các bình thủy tinh (6.2.1). Không vặn chặt nắp bình thủy tinh. Khử trùng 15 min, trong nồi hấp áp lực (6.1.2) ở 121 °C;
Sau khi khử trùng, làm nguội đến 44 °C - 47 °C. Phân phối lượng khoảng từ 18 mL đến 20 mL môi trường vào các đĩa Petri (6.2.6) đã chuẩn bị như nêu tại 8.1.1; để cho đông đặc. Các thao tác tiến hành trong tủ cấy vô trùng (6.1.1);
Khi môi trường đã đông đặc, làm khô bề mặt thạch trước khi sử dụng (đảm bảo không có các giọt nước trên bề mặt môi trường) bằng cách lật úp các đĩa thạch và để trong tủ ấm (6.1.4) ở nhiệt độ từ 25 °C đến 35 °C trong 25 min đến 30 min hoặc để qua đêm.
A.4.2 Tiến hành
Dùng que cấy vòng (6.2.3) lấy một vòng sinh khối vi sinh vật từ các khuẩn lạc đã lựa chọn trong phép thử khẳng định (8.4) cấy vạch vào giữa đĩa Petri đã chuẩn bị như nêu tại A.4.1, nuôi trong tủ ấm (6.1.4) ở nhiệt độ (30 ± 1) °C trong 48 h;
Dùng micropipet (6.2.5) với đầu tip vô trùng cho dung dịch iốt (A.1.1.2) ngập bề mặt đĩa Petri đã cấy vi sinh vật, giữ trong 30 s, loại bỏ dung dịch iốt dư.
A.4.3 Đọc kết quả
Có khả năng phân giải tinh bột: Xuất hiện quầng trong suốt xung quanh vạch cấy vi sinh vật.
Không có khả năng phân giải tinh bột: Môi trường có màu xanh, tím hoặc đen (tùy thuộc vào nồng độ iốt), không xuất hiện quầng trong suốt xung quanh vạch cấy vi sinh vật.

Hình A.4. Có khả năng phân giải tinh bột
A.5 Thử nghiệm urease
A.5.1 Môi trường thạch Christensen’s Urea
A.5.1.1 Thành phần
| Urê (CH4N2O) | 20,0 g |
| Natri clorua (NaCI) | 5,0 g |
| Kali dihydro photphat (KH2PO4) | 2,0 g |
| Pepton | 1,0 g |
| Glucoza (C6H12O6) | 1,0 g |
| Phenol đỏ (C19H14O5S) | 0,012 g |
| Thạch | 15,0 g |
| Nước cất | 1 000 mL |
| pH: 6,8 ±0,2 ở 25 °C. |
|
A.5.1.2 Chuẩn bị
Cân và hòa tan các thành phần môi trường (trừ thạch) theo thứ tự đã liệt kê tại (A.5.1.1) trong 100 mL nước cất. Lọc qua phễu lọc (6.2.10). Dung dịch thu được gọi là dung dịch (a);
Cân và hòa tan thạch trong 900 mL nước cất. Phân phối lượng thích hợp vào bình thủy tinh (6.2.1). Không vặn chặt nắp bình thủy tinh. Khử trùng 15 min trong nồi hấp áp lực (6.1.2) ở 121 °C. Dung dịch thu được gọi là dung dịch (b);
Sau khi khử trùng, làm nguội dung dịch (b) đến 50 °C - 55 °C; bổ sung toàn bộ dung dịch (a) và lắc đều. Phân phối lượng khoảng 4 mL đến 5 mL môi trường vào các ống nghiệm (6.2.2). Không vặn chặt nắp ống nghiệm và đặt nghiêng ống nghiệm khoảng 45 °. Các thao tác tiến hành trong tủ cấy vô trùng (6.1.1);
Khi môi trường đã đông đặc, làm khô bề mặt thạch trước khi sử dụng (đảm bảo không có các giọt nước trên bề mặt môi trường) bằng cách để ống nghiệm trong tủ ấm (6.1.4) ở nhiệt độ từ 25 °C đến 35 °C trong 25 min đến 30 min hoặc để qua đêm.
A.5.2 Cách tiến hành
Dùng que cấy vòng (6.2.3) lấy một vòng sinh khối vi sinh vật từ các khuẩn lạc đã lựa chọn trong phép thử khẳng định (8.4) cấy lên bề mặt môi trường thạch nghiêng đã chuẩn bị như nêu tại A.5.1;
Nuôi trong tủ ấm (6.1.4) ở 35 °C đến 37 °C trong 1 ngày đến 7 ngày; quan sát sự thay đổi màu sắc của môi trường.
A.5.3 Đọc kết quả
Thử nghiệm urease dương tính: Màu của môi trường chuyển sang màu hồng;
Thử nghiệm urease âm tính: Màu của môi trường màu vàng.
CHÚ THÍCH 4: Sự xuất hiện màu hồng của môi trường được coi là một phản ứng dương. Thời gian nuôi cấy kéo dài có thể dẫn đến kết quả dương tính giả do sự thủy phân của protein trong môi trường.

Hình A.5. (a) thử nghiệm urease dương tính; (b) thử nghiệm urease âm tính
A.6 Thử nghiệm Voges Proskauer
A.6.1 Môi trường canh thang MR - VP (Methyl-red VOGES-PROSKAUER Broth)
A.6.1.1 Thành phần
Ưu tiên sử dụng môi trường thương mại có sẵn, môi trường có thành phần như sau:
| Pepton* | 7,0 g |
| Dextroza (C6H12O6) | 5,0 g |
| Dikali hydro photphat (K2HPO4) | 5,0 g |
| Nước cất | 1 000 mL |
pH: 6,9 ± 0,2 ở 25 °C.
* Có thể thay thế 7,0 g pepton bằng 3,5 g cazein (thủy phân tuyến tụy) và 3,5 g pepton (mô động vật)
A 6.1.2 Chuẩn bị
Cân và hòa tan các thành phần trona nước cất theo thứ tự đã liệt kê tại A.6.1.1;
Phân phối lượng khoảng 4 mL đến 5 mL môi trường canh thang MR - VP cho vào các ống nghiệm (6.2.2). Không vặn chặt nắp ống nghiệm, khử trùng 15 min trong nồi hấp áp lực (6.1.2) ở 121 °C.
A.6.2 Thuốc thử
A.6.2.1 Alpha naphthol 5 %
Hòa tan 5 g alpha-naphthol trong 100 mL cồn tuyệt đối. Sử dụng trong vòng 24 h.
A.6.2.2 Kali hydroxit 40 %
Hòa tan 40 g kali hydroxit trong 100 mL nước cất. Sử dụng trong vòng 24 h.
A.6.2.3 Creatine 0,5 %
Hòa tan 0,5 g creatine trong 100 mL nước cất. Sử dụng trong vòng 24 h.
A.6.3 Cách tiến hành
Dùng que cấy vòng (6.2.3) lấy một vòng sinh khối vi sinh vật từ các khuẩn lạc đã lựa chọn trong phép thử khẳng định (8.4) cấy vào ống nghiệm chứa môi trường canh thang MR - VP đã chuẩn bị như nêu tại A.6.1; nuôi trong tủ ấm (6.1.4) ở 35 °C trong 18 h đến 24 h;
Thêm 0,5 mL creatine 0,5 % (A.6.2.3) vào ống nghiệm chứa môi trường canh thang MR - VP đã cấy sinh khối vi sinh vật, lắc nhẹ ống nghiệm;
Bổ sung 1,2 mL alpha-naphthol 5% (A.6,2.1) và 0,8 mL kali hydroxit 40 % (A.6.2.2); Lắc nhẹ ống nghiệm để môi trường tiếp xúc với oxy trong khí quyển và để ống nghiệm đứng yên trong 10 min đến 15 min.
CHÚ THÍCH 5: Cần thực hiện theo đúng thứ tự trên, việc đảo ngược thứ tự các thuốc thử được thêm vào có thể dẫn đến phản ứng dương tính yếu hoặc âm tính giả.
A.6.4 Đọc kết quả
Thử nghiệm Voges Prokauer dương tính: Dịch vi sinh vật trong ống nghiệm có màu đỏ;
Thử nghiệm Voges Prokauer âm tính: Dịch vi sinh vật trong ống nghiệm không đổi màu.
CHÚ THÍCH 6: Không đọc kết quả sau 1 h vì alpha-naphthol và KOH có thể phản ứng khả với nhau dẫn đến một kết quả dương tính giả.

Hình A.6. (a) thử nghiệm Voges Proskauer dương tính; (b) thử nghiệm Voges Proskauer âm tính
A.7 Khả năng sử dụng xitrat làm nguồn các bon
A.7.1 Môi trường thạch Simmon xitrat (Simmon’s citrate agar)
| Amoni dihydro photphat (NH4H2PO4) | 1,0 g |
| Dikali hydro photphat (K2HPO4) | 1,0 g |
| Natri clorua (NaCI) | 5,0 g |
| Natri citrat (Na3C6H5O7) | 2,0 g |
| Magie sunphat ngậm bảy phân tử nước (MgSO4.7H2O) | 0,2 g |
| Thạch | 15,0 g |
| Bromthymol blue | 0,08 g |
| Nước cất | 1 000 mL |
pH: 6,9 ± 0,2 ở 25 °C.
A.7.2 Chuẩn bị môi trường
Cân và hòa tan các thành phần môi trường trong nước cất theo thứ tự đã liệt kê tại A.7.1. Rót 5 mL môi trường vào ống nghiệm (6.2.2). Không vặn chặt nắp ống nghiệm, khử trùng 15 min trong nồi hấp áp lực (6.1.2) ở 121 °C. Điều chỉnh pH sao cho sau khi khử trùng, dung dịch có pH là 6,9 ± 0,2 ở 25 °C, nếu cần;
Làm nguội đến 44 °C - 47 °C, đặt nghiêng ống nghiệm theo góc khoảng 45 °, để môi trường đông đặc, làm khô bề mặt thạch trước khi sử dụng.
A.7.3 Cách tiến bành
Dùng que cấy vòng (6.2.3) lấy một vòng sinh khối vi khuẩn từ các khuẩn lạc đã lựa chọn (8.4) cấy lên bề mặt môi trường thạch nghiêng đã chuẩn bị như nêu tại A.7.2;
Nuôi trong tủ ấm ở 37 °C trong 5 ngày đến 7 ngày. Quan sát sự thay đổi màu sắc của môi trường.
A.7.4 Đọc kết quả
Có khả năng sử dụng xitrat làm nguồn các bon; Màu của môi trường chuyển sang xanh lam.
Không có khả năng sử dụng xitrat làm nguồn các bon: Không thay đổi màu của môi trường (vẫn giữ màu xanh lá).
CHÚ THÍCH 7: Sự xuất hiện màu xanh lam của môi trường được coi là một phản ứng dương.
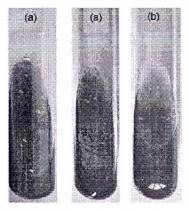
Hình A.7. (a) thử nghiệm sử dụng xitrat làm nguồn các bon dương tính; (b), thử nghiệm sử dụng xitrat làm nguồn các bon âm tính
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] TCVN 6507-1:2019. Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 1: Các nguyên tắc chung để chuẩn bị huyền phù ban đầu và các dung dịch pha loãng thập phân.
[2] TCVN 12105:2018. Phân bón vi sinh vật-Lấy mẫu.
[3] Adriana M- Alippi. 2019. Data associated with the characterization and presumptive identification of Bacillus and related species isolated from honey samples by using HiCrome Bacillus agar. Journal homepage: www.elsevier.com/locate/dib.
[4] BS EN 15784:2009. Animal feeding stuffs - Isolation and enumeration of presumptive Bacillus spp.
[5] Narendra Kumar Sura and Lingayya Hiremath. 2019, Isolation of Bacillus megaterium and its commercial importance. International journal ofchem tech research, Vol. 12 No.04, pp 30-36.
[6] Paul De Vos, George M. Garrity, Dorothy Jones, Noel R. Krieg, Wolfgang Ludwig, Fred A. Rainey, Karl-Heinz Schleifer and William B. Whitman. 2012. Bergey’s manual of systematic bacteriology. Second edition. Volume three.
[7] https://www.atcc.org/resources/culture-guides/introduction-to-microbiology.
[8] http://www.identax.org/matrices.php.
[9] https://www.studocu.com/en-us/document/texas-tech-university/biology-ii/bergeys-manual- pdf/1407525. Bergey's manual of determinative bacteriology - Identification flow charts.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 13614:2022 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 13614:2022 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 13614:2022 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 13614:2022 DOC (Bản Word)