Quy chuẩn kỹ thuật Quốc gia QCVN 01-173:2014/BNNPTNT Quy trình giám định bệnh khô cành cam quýt Phoma tracheiphila (Pertri) Kantachveli & Gikachvili là dịch hại kiểm dịch thực vật của Việt Nam
Quy chuẩn Việt Nam QCVN 01-173:2014/BNNPTNT
| Số hiệu: | QCVN 01-173:2014/BNNPTNT |
| Loại văn bản: | Quy chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Nông nghiệp và Phát triển nông thôn |
| Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
| Ngày ban hành: | 05/06/2014 |
| Hiệu lực: | |
| Người ký: | |
| Tình trạng hiệu lực: | Đã biết Vui lòng đăng nhập tài khoản gói Tiêu chuẩn hoặc Nâng cao để xem Tình trạng hiệu lực. Nếu chưa có tài khoản Quý khách đăng ký tại đây! |
tải Quy chuẩn Việt Nam QCVN 01-173:2014/BNNPTNT
QCVN 01 - 173 : 2014/BNNPTNT
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ QUY TRÌNH GIÁM ĐỊNH BỆNH KHÔ CÀNH CAM QUÝT PHOMA TRACHEIPHILA (PERTRI) KANTACHVELI & GIKACHVILI LÀ DỊCH HẠI KIỂM DỊCH THỰC VẬT CỦA VIỆT NAM
National technical regulation on Procedure for identification of Mal secco (Phoma tracheiphila (Pertri) Kantachveli & Gikachvili) - Plant quarantine pest of Vietnam
Lời nói đầu
QCVN 01 - 173 : 2014/BNNPTNT do Trung tâm Giám định Kiểm dịch thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ QUY TRÌNH GIÁM ĐỊNH BỆNH KHÔ CÀNH CAM QUÝT PHOMA TRACHEIPHILA (PERTRI) KANTACHVELI & GIKACHVILI LÀ DỊCH HẠI KIỂM DỊCH THỰC VẬT CỦA VIỆT NAM
National technical regulation on Procedure for identification of Mal secco (Phoma tracheiphila (Pertri) Kantachveli & Gikachvili) - Plant quarantine pest of Vietnam
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định quy trình giám định bệnh khô cành cam quýt Phoma tracheiphila (Pertri) Kantachveli & Gikachvili - là dịch hại kiểm dịch thực vật nhóm I của Việt Nam
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng đối với các tổ chức, cá nhân Việt Nam hoặc nước ngoài có hoạt động liên quan đến lĩnh vực bảo vệ và kiểm dịch thực vật thực hiện giám định bệnh khô cành cam quýt Phoma tracheiphila (Pertri) Kantachveli & Gikachvili - là dịch hại kiểm dịch thực vật (KDTV) nhóm I thuộc Danh mục dịch hại KDTV của Việt Nam.
1.3. Giải thích từ ngữ
Trong quy chuẩn này, các từ ngữ dưới đây được hiểu như sau:
1.3.1. Dịch hại kiểm dịch thực vật (plant quarantine pest)
Là loài dịch hại có nguy cơ gây hại nghiêm trọng tài nguyên thực vật trong một vùng mà ở đó loài sinh vật này chưa xuất hiện hoặc xuất hiện có phân bố hẹp và phải được kiểm soát chính thức.
1.3.2. Thực vật (plant)
Là cây và những bộ phận của cây còn sống, kể cả hạt giống và sinh chất có khả năng làm giống.
1.3.3. Mẫu (sample)
Là khối lượng thực vật, sản phẩm thực vật hoặc tàn dư của sản phẩm thực vật được lấy ra theo một qui tắc nhất định.
1.3.4. Tiêu bản (specimen)
Là mẫu vật điển hình tiêu biểu của dịch hại được xử lý để dùng cho việc định loại, nghiên cứu, giảng dạy, phổ biến kỹ thuật và trưng bày thành các bộ sưu tập.
1.3.5. Phản ứng chuỗi trùng hợp hoặc phản ứng khuếch đại gen (Polymerase Chain Reaction - PCR)
Là một kỹ thuật phổ biến trong sinh học phân tử nhằm khuếch đại (tạo ra nhiều bản sao) một đoạn DNA mà không cần sử dụng các sinh vật sống
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp thu thập và bảo quản mẫu
2.1.1. Thu thập mẫu
Đối với hàng xuất, nhập khẩu, quá cảnh hoặc vận chuyển, bảo quản trong nước: Tiến hành lấy mẫu theo tiêu chuẩn Việt Nam TCVN 4731:891 "Kiểm dịch thực vật - phương pháp lấy mẫu", quy chuẩn kỹ thuật quốc gia QCVN 01-22:2010/BNNPTNT1 "Phương pháp kiểm tra cây xuất nhập khẩu và quá cảnh".
Đối với cây trồng ngoài đồng ruộng: Lấy mẫu theo Quy chuẩn kỹ thuật quốc gia QCVN 01-38/2010/BNNPTNT1 "Phương pháp điều tra phát hiện dịch hại cây trồng".
2.1.2. Bảo quản mẫu
Các bộ phận tươi có triệu chứng bệnh (cành, lá, thân) chứa trong các túi ni-lông có lỗ thông khí bảo quản trong tủ lạnh ở nhiệt độ 3 - 5oC.
Các tiêu bản lam của nấm được dán nhãn, để trong hộp chuyên dụng đựng tiêu bản lam và bảo quản ở nhiệt độ phòng.
2.2. Thiết bị dụng cụ, hóa chất
Kính lúp soi nổi có độ phóng đại 10 - 40 lần, kính hiển vi có độ phóng đại 40 - 1.000 lần.
Máy ly tâm, máy lắc, tủ sấy, tủ định ôn, cân điện, máy trộn dịch, máy PCR, máy điện di, buồng tối và máy chụp ảnh
Bộ dao, kim giải phẫu, panh, kéo, bộ piptet, găng tay, đèn cồn, đĩa petri, ống hút, lam, lamen, bình tam giác, cốc đong, ống ly tâm 1,5ml.
Cồn 70o, cồn tuyệt đối, parafin, lactophenol blue, acid acetic, nước cất vô trùng.
Nitơ lỏng, NaCI, phenol:chloroform:isoamylalcohol (25:24:1), chloroform, isopropanol, Proteinase K, Tris-HCI, EDTA, SDS.
MgCI2 ,KCI, dNTP, mồi, Taq DNA polymerase, agarose.
2.3. Phương pháp phát hiện và giám định bệnh
2.3.1. Phát hiện và thu thập mẫu bệnh
Khi lá bị nhiễm bệnh gân lá trở nên trong (gân chính hoặc gân phụ), lá cong và biến vàng, chồi non cũng bị biến vàng. Sau đó lá rụng còn lại cuống lá, cành bị héo và bị chết ngọn (hình 1 đến hình 4, phụ lục 1). Đôi khi trên lá rụng các gân chính hoặc gân phụ có thể biến thành màu đỏ.
Cành bị bệnh có màu nâu hoặc màu nâu nhạt và bị nứt ra bệnh nặng đoạn thân và cành khô, có màu xám tro, trên mặt vết bệnh có các hạt nhỏ màu đen (hình 5, phụ lục 1)
Trên thân cây nhiễm bệnh, khi cắt ngang các mô cây hóa màu hồng hoặc nâu với các mô già (hình 6, phụ lục 1).
2.3.2. Phương pháp giám định bằng đặc điểm hình thái nấm gây bệnh
2.3.2.1. Phương pháp kiểm tra trực tiếp
Bào tử và các quả cành của nấm P. tracheiphila có thể quan sát trực tiếp dưới kính hiển vi quang học. Để quan sát rõ cấu trúc của bào tử và quả cành có thể nhuộm bằng lactophenol blue.
Dùng kim khêu nấm khêu bào tử nấm và quả cành trực tiếp từ các bộ phận bị phần nghi ngờ nhiễm bệnh hoặc có triệu chứng điển hình, đặt lên lam đã có 01 giọt lactophenol và đậy lamen. Đặt lam lên kính hiển vi và quan sát đặc điểm hình thái, đo kích thước bào tử nấm và so sánh với đặc điểm bào tử của nấm P. tracheiphila (phụ lục 1).
2.3.2.2. Phương pháp để ẩm
Các cành khô, các mẫu thân có triệu chứng bệnh (trên cành có các vùng khô màu xám chì hoặc xám tro, các thân cây mà mạch dẫn hóa màu hồng) để ẩm trong 12-24 giờ. Sau đó dùng kim khêu nấm khêu bào tử trực tiếp từ các phần nghi ngờ nhiễm bệnh, đặt lên lam đã có 01 giọt lactophenol. Đặt lam lên kính hiển vi và tìm, quan sát đặc điểm hình thái, đo kích thước bào tử nấm.
Quan sát trên kính hiển vi so sánh với đặc điểm bào tử của nấm P. tracheiphila (phụ lục 1)
2.3.2.3. Phương pháp phân lập nấm từ vật liệu nhiễm bệnh
Cắt ở phần rìa vết bệnh một đoạn thân, cành khoảng 20-100mm và nhúng vào cồn tuyệt đối. Sau đó, đốt đoạn thân trên đèn cồn. Khi lửa tắt dùng dao khử trùng cắt ngang hoặc dọc đoạn thân, cành thành những lát mỏng.
Nuôi cấy các lát mỏng trên môi trường PDA hoặc CPA ở 22-24oC. Sau 3-5 ngày, kiểm tra sắc tố nấm tiết ra trên đĩa môi trường bằng cách soi đĩa lên ánh sáng (hình 9, phụ lục 1). Tiếp theo, cấy truyền làm thuần nấm.
Khêu mẫu nấm đã thuần từ môi trường nuôi cấy đưa lên lam và quan sát dưới kính hiển vi. Quan sát đặc điểm hình thái của bào tử nấm thu được.
So sánh với đặc điểm hình thái của bào tử nấm P. tracheiphila (phụ lục 1)
2.3.3. Phương pháp giám định PCR
Sử dụng phương pháp PCR để giám định nấm P. tracheiphila (Pertri) Kantachveli & Gikachvili gây bệnh khô cành cam quýt.
Quy trình chi tiết như phụ lục 2.
III. THẨM ĐỊNH KẾT QUẢ GIÁM ĐỊNH VÀ BÁO CÁO
Sau khi khẳng định kết quả giám định bệnh khô cành cam quýt Phoma tracheiphila (Pertri) Kantachveli & Gikachvili- là dịch hại kiểm dịch thực vật của Việt Nam, đơn vị giám định phải gửi báo cáo về Cục Bảo vệ thực vật kèm theo phiếu kết quả giám định (phụ lục 4).
Tất cả các đơn vị thuộc hệ thống Bảo vệ và KDTV phải lưu giữ, quản lý và khai thác dữ liệu về kết quả điều tra, báo cáo và giám định bệnh khô cành cam quýt.
Đối với đơn vị lần đầu tiên giám định và phát hiện được bệnh khô cành cam quýt Phoma tracheiphila (Pertri) Kantachveli & Gikachvili phải gửi mẫu hoặc tiêu bản về Trung tâm Giám định kiểm dịch thực vật để thẩm định.
Đơn vị giám định phải đảm bảo thời gian lưu mẫu theo quy định hiện hành.
IV. TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm phổ biến; tổ chức, hướng dẫn và kiểm tra việc thực hiện Quy chuẩn này trong hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật cũng như các tổ chức, cá nhân khác có liên quan;
Các tổ chức, cá nhân có hoạt động liên quan đến điều tra, thu thập mẫu, xử lý và bảo quản mẫu bệnh khô cành cam quýt Phoma tracheiphila (Pertri) Kantachveli & Gikachvili tại Việt Nam phải tuân theo quy định của quy chuẩn này cũng như các quy định của pháp luật có liên quan hiện hành.
Phụ lục 1.
Thông tin về dịch hại
1. Phân bố và ký chủ
1.1. Phân bố
Trong nước: Bệnh chưa có ở Việt Nam
Trên thế giới: Châu Á (Armenia, Georgia, Iraq, Lebanon, Syria, Israel, Thổ Nhĩ Kì, Yemen), Châu Phi (Tunisia, Ai Cập, Libya, Algeria), Châu Âu (Hy Lạp, Albania, Hy Lạp, Italy, Liên Bang Nga, Cyprus, Pháp, Bỉ, Hà Lan)
1.2. Ký chủ: Hầu hết các loài thuộc họ Citrus đều mẫn cảm với bệnh nhưng chanh (Citrus limon) là loài bị hại nặng nhất. Các loài kí chủ khác là Phật thủ (Citrus medica), Citrus bergamia, Quýt (Citrus reticulata), Cam chua (Citrus aurantium), Citrofortunella microcarpa, Citrus aurantiifolia, Citrus jambhiri, Citrus latifolia, Citrus limonia, Citrus macrophylla, Citrus sinensis, Citrus unshiu, Citrus x paradisi, Quất (Fortunella), Poncirus trifoliata
2. Tên khoa học và vị trí phân loại
Tên tiếng Việt: Bệnh khô cành cam quýt
Tên khoa học: Phoma tracheiphila (Pertri) Kantachveli & Gikachvili
Tên khác:
Bakerophoma tracheiphila (Petri) Cif.
Deuterophoma tracheiphila Petri
Vị trí phân loại:
Lớp: Dothideomycetes
Bộ: Pleosporales
Họ: Pleosporaceae
3. Triệu chứng bệnh khô cành cam quýt

Hình 1: Triệu chứng trên lá của bệnh khô cành cam quýt P. tracheiphila (Nguồn: PaDIL, 2012) | Hình 2: Lá rụng còn lại cuống do bệnh khô cành cam quýt P. tracheiphila (Nguồn: PaDIL, 2012) |

Hình 3: Cành héo do bệnh khô cành cam quýt P. tracheiphila (Nguồn: PaDIL, 2012) | Hình 4: Chết ngọn do bệnh khô cành cam quýt P. tracheiphila (Nguồn: PaDIL, 2012) |

Hình 5: Vết bệnh có chứa các quả cành nấm P. tracheiphila (Nguồn: PaDIL, 2012) | Hình 6: Triệu chứng bó mạch hóa hồng của bệnh khô cành cam quýt (Nguồn: PaDIL, 2012) |
4. Đặc điểm hình thái bào tử nấm P. tracheiphila
Quả cành hình cầu, hơi kéo dài thành một cổ ngắn có miệng nhỏ, màu đen đường kính 60-165x45-150mm (hình 7, phụ lục 1). Các bào tử phân sinh nằm trong quả cành dạng đơn bào, kích thước 0,5-1,5x2-4mm.
Bào tử phân sinh được sinh ra từ các tế bào sinh bào tử. Bào tử phân sinh (phialoconidia) đơn bào thường có 1 đến 3 giọt dầu màu trong suốt, dạng thẳng hoặc cong, đầu bào tử tròn kích thước 1,5-3x3-8mm thường được sản sinh bởi các tế bào sinh bào tử ở trên các sợi nấm tự do phát triển ở vùng gỗ trên thân lộ ra ngoài, phần mô bị thương hoặc trong mạch dẫn (hình 8, phụ lục 1).
Bào tử đính dạng chồi (blastoconidia) có dạng trứng hoặc dạng quả lê được sinh ra từ mạch dẫn cây kí chủ và trên môi trường nuôi cấy nhân tạo lỏng.

Hình 7: Quả cành của nấm P. tracheiphila
(Nguồn: S. Grasso,1992)
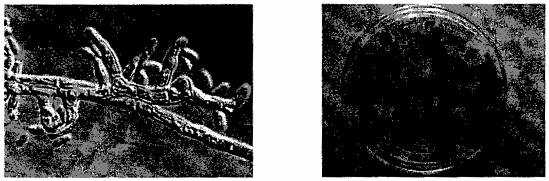
Hình 8: Bào tử (phialoconidia) của P. tracheiphila (Nguồn: EPPO,2004) | Hình 9: Sắc tố đỏ trên đĩa khi đặt các lát cành nhiễm bệnh khô cành trên môi trường PDA (Nguồn: PaDIL, 2009) |
Phụ lục 2.
(quy định)
Quy trình giám định bệnh khô cành cam quýt bằng PCR
1. Tách chiết DNA tổng số
1.1. Tách chiết DNA tổng số từ mô cây (mô gỗ, cành, lá)
Nghiền 500mg mô cây bằng chày và cối sứ trong nitơ lỏng. Chuyển 100mg mô nghiền vào ống eppendorf chứa 450ml dịch chiết cây.Trộn đều bằng máy trộn dịch. Ủ ở 65oC trong 1 giờ.Thêm vào ống 300ml NaCI 6M và trộn đều bằng máy trộn dịch. Ly tâm 12.000 vòng/phút trong 15 phút và thu dịch nổi vào ống mới. Thêm phenol:chloroform:isoamylalcohol (25:24:1) vào ống với một thể tích tương đương và trộn đều bằng máy trộn dịch. Ly tâm 12.000 vòng/phút trong 15 phút thu dịch nổi. Thêm chloroform vào ống với một thể tích tương đương và trộn đều bằng máy trộn dịch. Ly tâm 12.000 vòng/phút trong 15 phút thu dịch nổi. Thêm isopropanol vào ống một thể tích tương đương. Ly tâm 12.000 vòng/phút trong 15 phút thu tủa DNA loại bỏ dịch. Thêm vào ống 100ml Ethanol 70% để rửa tủa DNA. Loại bỏ Ethanol để tủa DNA khô tự nhiên trong 10 phút. Hòa tan tủa DNA trong 100ml TE pH8 bảo quản ở 4oC.
1.2. Tách chiết DNA tổng số từ sợi nấm nuôi cấy trên môi trường.
Dùng kim khêu nấm vô trùng chuyển sợi nấm từ đĩa nuôi cấy vào ống eppendorf. Nghiền nhỏ nấm bằng chày nhựa vô trùng trong nitơ tỏng. Chuyển hỗn hợp nghiền vào ống eppendorf mới đã chứa 400ml dịch chiết nấm. Trộn đều bằng máy trộn dịch. Thêm vào ống 8ml Proteinase K 20mg/ml lắc nhẹ. Ủ ở 65oC trong 2 giờ hoặc qua đêm.Thêm vào 300ml NaCI 6M trộn bằng máy trộn dịch trong 30 giây. Ly tâm 13.000 vòng/phút trong 30 phút thu dịch phía trên. Thêm isopropanol vào ống với một thể tích tương đương lắc nhẹ. Ủ ở -20oC trong 1 giờ hoặc lâu hơn. Ly tâm 13.000 vòng/phút trong 15 phút thu tủa DNA loại bỏ dịch. Thêm vào 100ml Ethanol 70% để rửa tủa DNA. Loại bỏ ethanol, để tủa DNA khô tự nhiên trong 10 phút. Hòa tan tủa DNA trong 100ml TE pH8 bảo quản ở 4oC.
2. Nhân gen bằng máy PCR.
Đoạn mồi sử dụng
Pt-FOR2 (5'-GGATGGGCGCCAGCCTTC-3')
Pt-REV2 (5'-GCACAAGGGCAGTGGACAAA-3')
Master mix: 25ml mỗi phản ứng
1.5 mM MgCI2,
50 mM KCl;
200 mM mỗi loại dATP, dCTP, dGTP và dTTP
1.0 mM mỗi mồi
10 ng DNA tách chiết
0.8 ml Taq DNA polymerase
3. Chu trình nhiệt
94oC trong 5 phút | |
94oC trong 30 giây | Lặp lại 30 chu kì |
65oC trong 60 giây | |
72oC trong 90 giây | |
72oC trong 5 phút | |
4. Đọc kết quả
Sản phẩm nhân gen được điện di trong gel agarose 1,5% trong 2,5 giờ hiệu điện thế 3,3 V/cm trong dung môi TAE. Nhuộm gel bằng ethidium bromide và quan sát dưới đèn UV
Mẫu dương tính cho ra đoạn gen kích thước 378bp
5. Thành phần dịch chiết dùng cho PCR
5.1. Thành phần dịch chiết cây
0,4 M NaCI; 10 mM Tris-HCI pH 8,0; 2,0 mM EDTA pH 8,0; 400 mg/mL proteinase K; 2% SDS
5.2. Thành phần dịch chiết nấm
400 mM NaCI; 10 mM Tris-CI pH 8,0; 2 mM EDTA; 20 g/l SDS
Phụ lục 3.
Một số loại môi trường nuôi cấy nấm
1. Môi trường PDA
Cân 200g khoai tây
Cắt thành những hình lập phương 1x1x1 cm
Đun trong 1 giờ.
Lọc qua vải lọc thu nước trong.
Thêm 20g dextrose.
Thêm 15 g Agar.
Thêm nước cất cho đủ 1 lít.
2. Môi trường CPA
Rửa sạch mài nhuyễn hoặc nghiền nhỏ cà rốt và khoai tây.
Lấy mỗi loại 20g đun trong nước cất khoảng 1 giờ
Lọc qua vải lọc chỉ thu lại phần nước trong
Thêm vào 15g agar
Thêm nước cất cho đủ 1 lít
Phụ lục 4.
(quy định)
Mẫu phiếu kết quả giám định
Cơ quan Bảo vệ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| ……….. ngày …. tháng …. năm 20….. |
PHIẾU KẾT QUẢ GIÁM ĐỊNH
Bệnh khô cành cam quýt Phoma tracheiphila (Pertri) Kantachveli & Gikachvili- là dịch hại kiểm dịch thực vật của Việt Nam
1. Tên hàng hóa | : | |
2. Nước xuất khẩu | : | |
3. Xuất xứ | : | |
4. Phương tiện vận chuyển | : | Khối lượng: |
5. Địa điểm lấy mẫu | : | |
6. Ngày lấy mẫu | : | |
7. Người lấy mẫu | : | |
8. Tình trạng mẫu | : | |
9. Ký hiệu mẫu | : | |
10. Số mẫu lưu | : | |
11. Người giám định | : | |
12. Phương pháp giám định: Theo quy chuẩn kỹ thuật quốc gia QCVN 01 - 173 : 2014/BNNPTNT về "Quy trình giám định bệnh khô cành cam quýt Phoma tracheiphila (Pertri) Kantachveli & Gikachvili- là dịch hại kiểm dịch thực vật của Việt Nam".
13. Kết quả giám định
Tên khoa học: Phoma tracheiphila (Pertri) Kantachveli & Gikachvili
Lớp: Dothideomycetes
Bộ: Pleosporales
Họ: Pleosporaceae
Là dịch hại kiểm dịch thực vật thuộc danh mục dịch hại kiểm dịch thực vật của Việt Nam.
TRƯỞNG PHÒNG KỸ THUẬT | THỦ TRƯỞNG ĐƠN VỊ |
1 Trường hợp các văn bản viện dẫn trong quy chuẩn này sửa đổi, bổ sung hoặc thay thế thì thực hiện theo quy định của văn bản mới.
Lược đồ
Vui lòng Đăng nhập tài khoản gói Tiêu chuẩn hoặc Nâng cao để xem Lược đồ.
Chưa có tài khoản? Đăng ký tại đây
 Pháp lý doanh nghiệp
Pháp lý doanh nghiệp