- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 10944:2015 ISO 16187:2013 Giày dép và các chi tiết của giày dép-Phương pháp đánh giá hoạt tính kháng khuẩn
| Số hiệu: | TCVN 10944:2015 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Công nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2015 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 10944:2015
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 10944:2015
TIÊU CHUẨN QUỐC GIA
TCVN 10944:2015
ISO 16187:2013
GIẦY DÉP VÀ CÁC CHI TIẾT CỦA GIẦY DÉP - PHƯƠNG PHÁP ĐÁNH GIÁ HOẠT TÍNH KHÁNG KHUẨN
Footwear and footwear components - Test method to assess antibacterial activity
Lời nói đầu
TCVN 10944:2015 hoàn toàn tương đương với ISO 16187:2013.
TCVN 10944:2015 do Ban kỹ thuật Tiêu chuẩn quốc gia TCVN/TC 216 Giầy dép biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
GIẦY DÉP VÀ CÁC CHI TIẾT CỦA GIẦY DÉP - PHƯƠNG PHÁP ĐÁNH GIÁ HOẠT TÍNH KHÁNG KHUẨN
Footwear and footwear components - Test method to assess antibacterial activity
THẬN TRỌNG - Phương pháp thử trong tiêu chuẩn này yêu cầu sử dụng vi khuẩn. Phương pháp thử này chỉ được thực hiện trong điều kiện thuận lợi với các kỹ thuật lưu giữ vi sinh vật sử dụng và thực hiện bởi những người được đào tạo, có kinh nghiệm trong việc sử dụng các kỹ thuật vi sinh. Phải có các cảnh báo an toàn phù hợp, có xem xét đến các quy định cụ thể của quốc gia.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp định lượng để đánh giá hoạt tính kháng khuẩn của giầy dép và các chi tiết của giầy dép.
Tiêu chuẩn này có thể áp dụng cho tất cả các loại giầy dép và các chi tiết có sử dụng phương pháp xử lý kháng khuẩn không khuếch tán.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 4851 (ISO 3696), Nước dùng để phân tích trong phòng thí nghiệm - Yêu cầu kỹ thuật và phương pháp thử
ISO 19952, Footwear - Vocabulary (Giầy dép - Từ vựng).
3 Thuật ngữ và định nghĩa
Tiêu chuẩn này áp dụng các thuật ngữ, định nghĩa trong ISO 19952 và các thuật ngữ, định nghĩa sau:
3.1
Hoạt tính kháng khuẩn (antibacterial activity)
Hiệu quả của vật liệu hoặc lớp trau chuốt được sử dụng để ngăn hoặc giảm sự phát triển các vi khuẩn, để giảm số lượng các vi khuẩn hoặc để giết chết các vi khuẩn.
3.2
Mẫu đối chứng (control sample)
Vật liệu giống với vật liệu thử nhưng không được xử lý kháng khuẩn.
4 An toàn
Khi sử dụng các vi sinh vật có các nguy hiểm tiềm ẩn thì cần có trình độ năng lực kỹ thuật cao và tuân thủ các quy định hiện hành. Chỉ những người được đào tạo về các kỹ thuật vi sinh mới được thực hiện các phép thử trong tiêu chuẩn này. Cách thức thực hành diệt khuẩn, khử trùng và vệ sinh cá nhân phải được theo dõi nghiêm ngặt.
CHÚ THÍCH: Những người thực hiện nên tham khảo thêm IEC 60068-2-10, Phụ lục A "Sự nguy hiểm đối với con người", và ISO 7218.
5 Thiết bị, dụng cụ và vật liệu
5.1 Quy định chung
Thiết bị, dụng cụ phòng thí nghiệm thông thường và các thiết bị, dụng cụ sau:
5.2 Tủ an toàn sinh học
5.3 Tủ ấm, có khả năng duy trì nhiệt độ (37 ± 2) °C.
5.4 Nồi hấp
5.5 Buồng tạo ẩm, có khả năng duy trì nhiệt độ (37 ± 2) °C và độ ẩm tương đối không nhỏ hơn 90 %.
5.6 Đèn tử ngoại
5.7 Các bình miệng rộng, có nắp, 100 ml, có thể sử dụng cùng với nồi hấp (5.4).
5.8 Màng phủ không làm ảnh hưởng đến sự phát triển vi khuẩn hoặc hấp thụ nước, màng này có thể làm từ polyetylen, polypropylen hoặc polyeste [poly (etylen terephtalat)]. Nên dùng màng dày từ 0,05 mm đến 0,10 mm. Ví dụ, túi dùng một lần là phù hợp để sử dụng cùng với nồi hấp (5.4).
5.9 Máy trộn Vortex
5.10 Máy lắc đa chiều, hai chiều hoặc ba chiều, có khả năng điều chỉnh đến 50 vòng/phút.
5.11 Tủ ấm lắc, có khả năng duy trì nhiệt độ (37 ± 2) °C và tần số lắc (120 ± 10) vòng/phút.
6 Thuốc thử và môi trường cấy
6.1 Nguyên tắc
Sự chuẩn bị và phép thử phải được chuẩn bị mới để bảo đảm chất lượng cấy.
CHÚ THÍCH: Điều này có thể thực hiện theo ISO/TS 11133-1, ISO/TS 11133-2, hoặc theo các tiêu chuẩn quốc gia hoặc quy chuẩn quốc gia.
Thuốc thử sử dụng trong phép thử phải là chuẩn phân tích và/hoặc phù hợp với mục đích vi sinh.
Chỉ sử dụng nước loại 3 theo TCVN 4851 (ISO 3696).
6.2 Canh thang dinh dưỡng (NB)
6.2.1 Thành phần
Chất chiết từ thịt bò, 3,0 g.
Pepton, 5,0 g.
Natri clorua (NaCI), 5,0 g.
Nước, 1 000 ml.
6.2.2 Chuẩn bị
Khuấy và điều chỉnh pH đến (7,2 ± 0,2) (ở nhiệt độ phòng). Làm nóng kèm theo khuấy trên bếp điện hoặc thiết bị cách thủy đang sôi cho đến khi các thành phần tan hoàn toàn. Khử trùng bằng nồi hấp (5.4) ở (121 ± 2) °C trong 15 min.
6.3 Thạch agar dinh dưỡng (NA)
6.3.1 Thành phần
Chất chiết từ thịt bò, 5,0 g.
Pepton, 10,0 g.
Natri clorua (NaCI), 5,0 g.
Thạch agar, 15,0 g.
Nước, 1 000 ml.
CHÚ THÍCH: Nếu không đủ đông đặc, có thể sử dụng từ 15 g đến 18 g thạch agar.
6.3.2 Chuẩn bị
Khuấy và điều chỉnh pH đến (7,2 ± 0,2) (ở nhiệt độ phòng). Làm nóng kèm theo khuấy trên bếp điện hoặc thiết bị cách thủy đang sôi cho đến khi các thành phần tan hoàn toàn. Khử trùng bằng nồi hấp (5.4) ở (121 ± 2) °C trong 15 min. Để nguội và lắc đều dung dịch, sau đó đổ vào các đĩa Petri.
6.4 Canh thang thủy phân casein đậu tương với môi trường lexitin và polyoxyetylen (SCDLP)
6.4.1 Thành phần
Pepton, sản phẩm thủy phân casein, 17,0 g.
Pepton, sản phẩm thủy phân đậu tương, 3,0 g.
Natri clorua (NaCI), 5,0 g.
Kali dihydrogen photphat, 2,5 g.
Đường gluco, 2,5 g.
Lexitin, 1,0 g.
Polysorbate 80, 7,0 g.
Nước, 1 000 ml.
Nếu không đủ độ trung hòa, có thể điều chỉnh hàm lượng polysorbate 80 hoặc lexitin, hoặc có thể thêm chất làm trung hòa khác. Khi đó phải ghi lại việc sử dụng chất trung hòa này cùng với tên và nồng độ.
CHÚ THÍCH: Thông tin về sự lựa chọn và đánh giá các chất trung hòa kháng khuẩn thay thế có thể tìm thấy ở ASTM E 1054 và EN 1040.
6.4.2 Chuẩn bị
Sau khi lắc đều, điều chỉnh pH đến (7,2 ± 0,2) (ở nhiệt độ phòng) và khử trùng bằng nồi hấp (5.4) ở (121 ± 2) °C trong 15 min.
6.5 Dung dịch natri clorua (muối sinh lý)
6.5.1 Thành phần
Natri clorua (NaCI), 8,5 g.
Nước, 1 000 ml.
6.5.2 Chuẩn bị
Sau khi lắc đều, điều chỉnh pH đến (6,9 ± 0,2) (ở nhiệt độ phỏng) và khử trùng ở (121 ± 2) °C trong 15 min.
7 Vi sinh vật thử
7.1 Chủng vi khuẩn thử
Các loài sau phải được sử dụng trong tất cả các phép thử hoạt tính kháng khuẩn.
a) Staphylococcus aureus AS 1.89 hoặc ATCC 6538.
b) Klebsiella pneumoniae AS 1.1736 hoặc ATCC 4352.
CHÚ THÍCH 1: Nếu có yêu cầu, có thể sử dụng các loài hoặc chủng vi khuẩn khác. Tuy nhiên, các sinh vật được lựa chọn phải chứa ít nhất một gam sinh vật dương và một gam sinh vật âm vì các chất kháng khuẩn có thể có các hoạt tính khác nhau.
Các chủng vi khuẩn thử phải lấy từ các thành viên của Liên hiệp bảo tàng giống vi sinh vật quốc tế (WFCC).
Các loài vi khuẩn và nguồn cung cấp phải ghi trong báo cáo thử nghiệm.
CHÚ THÍCH 2: AS là Trung tâm lưu giữ nguồn vi sinh vật Trung Quốc (CGMCC), ATCC là Bảo tàng vi sinh vật Mỹ.
7.2 Lưu giữ các chủng vi khuẩn
Cấy ghép các chủng vi khuẩn vào thạch agar dinh dưỡng (NA) (6.3), và nuôi cấy ở (37 ± 2) °C trong 24 h. Lưu giữ ở (5 ± 3) °C (tối đa là một tháng) và giữ nó như các chủng vi khuẩn nuôi cấy gốc. Cấy chuyển mỗi tháng một lần.
Các chủng vi khuẩn có thể được bảo quản theo hướng dẫn của nhà cung cấp hoặc theo EN 12353.
8 Chuẩn bị chất cấy
Sử dụng một vòng cấy vô trùng, chuyển một khuẩn lạc (7.2) vào 20 ml canh thang dinh dưỡng (NB) (6.2) và nuôi cấy trong tủ ấm lắc (5.11) ở (37 ± 2) °C trong khoảng 16 h (nuôi cấy qua đêm). Ước tính số vi khuẩn bằng cách quan sát trên kính hiển vi hoặc bằng các phương pháp khác. Chuẩn bị muối sinh lý (6.5) với 1 % canh thang dinh dưỡng (NB) (6.2). Sử dụng môi trường này để chuẩn bị dịch huyền phù với nồng độ vi khuẩn (2,5 đến khoảng 10) x 105 CFU/ml làm chất cấy.
Nếu cần thiết, lưu giữ chất cấy trong nước đá và sử dụng trong vòng 4 h.
9 Chuẩn bị mẫu thử
9.1 Quy định chung
Chỉ thử các chi tiết hoặc vật liệu được cho là kháng khuẩn. Nếu toàn bộ giầy dép được cho là kháng khuẩn, các chi tiết chính, gồm mũ giầy, lót mũ giầy, đế trong, lót mặt, đế ngoài phải được thử riêng.
Trong trường hợp chỉ một vật liệu của một chi tiết được cho là kháng khuẩn, thử riêng vật liệu này. Nếu không thể thử riêng vật liệu thì phải thử toàn bộ chi tiết.
Mỗi mẫu thử phải được thử ít nhất là 80 % diện tích bề mặt của chi tiết hoặc vật liệu. Nếu vật liệu đơn lẻ nhỏ hơn 80 % thì lấy hai vật liệu chính được sử dụng trong thành phần của chi tiết.
Các mẫu thử có thể lấy trực tiếp từ vật liệu thô làm giầy dép.
9.2 Mẫu thử
Mẫu thử phải có diện tích khoảng 500 mm2. Đối với phương pháp thử A (xem Phụ lục A), diện tích mẫu thử phải có độ dày nhỏ hơn 2,0 mm. Diện tích và khối lượng mẫu thử phải được ghi trong báo cáo thử nghiệm. Nếu sử dụng mẫu thử lớn hơn thì lượng huyền phù vi khuẩn phải tăng lên cân xứng.
Nếu mẫu thử không thể có độ dày nhỏ hơn (ví dụ: các chi tiết dày hơn và không thể tách rời hoặc cắt mà không làm thay đổi các tính chất quan trọng, như hình thái bề mặt, mà có thể ảnh hưởng đến cách vi khuẩn tác động với bề mặt), thì phải ghi rõ độ dày này trong báo cáo thử nghiệm.
Phải lấy ít nhất 6 mẫu thử cho từng vật liệu hoặc chi tiết và cho từng chủng vi khuẩn thử.
9.3 Xử lý sơ bộ mẫu thử
Xử lý sơ bộ phần mẫu thử là không bắt buộc và chỉ nên thực hiện nếu cần thiết do số lượng vi khuẩn bề mặt cao (sự nhiễm bẩn v.v...).
Nếu áp dụng các phương pháp khử trùng thì phải ghi lại chi tiết các phương pháp này, và không được ảnh hưởng đến tính chất kháng khuẩn hoặc bản thân vật liệu.
CHÚ THÍCH: Mẫu thử và mẫu đối chứng có thể được khử trùng bằng nồi hấp (5.4) ở (121 ± 2) °C và 103 kPa trong 15 min, hoặc bằng tia tử ngoại [đèn tử ngoại (5.6), 30 W, để cách mẫu 300 mm, mỗi mặt tương ứng với một giờ] hoặc bằng các phương pháp khử trùng phù hợp khác.
10 Cách tiến hành
Bảng 1 liệt kê các trường hợp để áp dụng cho từng phương pháp thử.
Phương pháp thử A (xem Phụ lục A) chỉ được sử dụng cho vật liệu thấm hút đơn lẻ. Phương pháp thử B (xem Phụ lục B) chỉ được sử dụng cho vật liệu không thấm hút đơn lẻ. Phương pháp thử C (xem Phụ lục C) có thể áp dụng cho cả vật liệu thấm hút và vật liệu không thấm hút hoặc vật liệu kết hợp.
CHÚ THÍCH: Đối với vật liệu đơn lẻ, nên sử dụng phương pháp A và B.
Bảng 1 - Danh mục các phương pháp thử
| STT | Loại vật liệu | Phương pháp thử | Ghi chú |
| 1 | Hấp thụ | Phép thử yêu cầu tĩnh trong Phụ lục A | Vật liệu dệt và da |
| 2 | Không hấp thụ | Phương pháp tiếp xúc màng trong Phụ lục B | Lỗ xốp nhỏ, cụ thể: da tráng phủ, da nặng, các vật liệu tổng hợp/nhân tạo, vật liệu tạo bọt EVA, vật liệu tạo bọt PU; và vật liệu đặc, cụ thể chất dẻo hoặc vật liệu tráng phủ. |
| 3 | Hấp thụ và không hấp thụ | Phép thử yêu cầu động (thử bình lắc) trong Phụ lục C | Các chi tiết của các vật liệu khác nhau; vật liệu được tạo hình; các vật liệu có chất kháng khuẩn cố định. |
11 Biểu thị kết quả
Tính năng kháng khuẩn của giầy dép hoặc các chi tiết của giầy dép phải được ghi lại riêng rẽ dựa trên tỷ lệ hoạt tính kháng khuẩn.
Tính tỷ lệ hoạt tính kháng khuẩn (R) theo công thức (1) hoặc R* theo công thức (2). Ghi lại kết quả, tính bằng phần trăm với ba chữ số sau dấu phẩy.
(1)
Trong đó
Ct là số trung bình các khuẩn lạc của ba mẫu đối chứng sau 24 h hoặc sau khoảng thời gian nuôi cấy quy định, tính bằng CFU/ml;
Tt là số trung bình các khuẩn lạc của ba mẫu thử sau 24 h hoặc sau khoảng thời gian nuôi cấy quy định, tính bằng CFU/ml.
Trong trường hợp không có mẫu đối chứng, tính R* bằng cách thay Ct trong công thức (1) bằng T0 ở công thức (2)
(2)
Trong đó
T0 là số trung bình các khuẩn lạc của ba mẫu thử ngay sau khi nuôi cấy, tính bằng CFU/ml.
12 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm ít nhất các thông tin sau:
a) Viện dẫn tiêu chuẩn này;
b) Các chi tiết thử được xử lý và vị trí, diện tích, khối lượng của các chi tiết này;
c) Các phương pháp thử cho các vật liệu khác nhau;
d) Chuẩn bị mẫu thử, gồm phương pháp xử lý sơ bộ, nếu áp dụng, cho các mẫu thử khác nhau (cụ thể: phương pháp khử trùng);
e) Loài, số seri và số tế bào có thể sống được của các chủng vi khuẩn thử đối với các vật liệu khác nhau;
f) Chất có hoạt tính bề mặt và nồng độ của nó được thêm vào chất cấy để thử;
g) Đánh giá hiệu quả phép thử;
h) Tính tỷ lệ hoạt tính kháng khuẩn của các vật liệu hoặc chi tiết khác nhau;
i) Bất kỳ sai khác nào so với phương pháp thử của tiêu chuẩn này.
Phụ lục A
(quy định)
Phép thử yêu cầu tĩnh
A.1 Cách tiến hành
A.1.1 Quy trình cấy
Đặt từng mẫu trong sáu mẫu thử và sáu mẫu đối chứng vào các bình miệng rộng được khử trùng (5.7) riêng rẽ. Dùng pipet lấy (1,0 ± 0,1) ml chất cấy được chuẩn bị trong Điều 8 cho vào từng mẫu thử và đậy chặt nắp có ren. Số lượng mẫu vải sử dụng phụ thuộc vào loại mẫu.
Nếu không có mẫu đối chứng, cấy trong các bình miệng rộng không có mẫu để làm đối chứng xác định hiệu quả phép thử.
A.1.2 Rửa giải sau khi cấy (thời gian zero)
Thêm 20 ml môi trường SCDLP (6.4) vào từng mẫu trong ba mẫu thử cấy và mẫu đối chứng (nếu có). Đậy chặt nắp và lắc theo một cung tròn khoảng 30 cm trong 30 s, hoặc trộn trong 5 s x 5 chu kỳ bằng cách dùng máy trộn vortex (5.9) để rửa giải các vi khuẩn vào trong môi trường này.
A.1.3 Môi trường nuôi cấy
Nuôi cấy ba mẫu thử được cấy và mẫu đối chứng (nếu có) ở (37 ± 2) °C trong (24 ± 1) h.
A.1.4 Rửa giải sau khi nuôi cấy (thời gian 24 h)
Thực hiện theo A.1.2.
A.1.5 Xác định số lượng vi khuẩn có thể sống - Nuôi cấy bề mặt
Lấy 1 ml dung dịch rửa giải từ A.1.2 hoặc dung dịch rửa giải từ A.1.4 bằng pipet đã khử trùng và cho vào ống thử cùng với (9,0 ± 0,1) ml muối sinh lý (6.5) và lắc đều. Pha loãng dung dịch rửa giải với muối sinh lý (6.5) để có được các dung dịch pha loãng 10 lần.
Cấy 100 mL của từng dung dịch pha loãng lên thạch agar dinh dưỡng (NA) (6.3) hai lần, lật thạch quay ngược xuống dưới và nuôi cấy từ 24 h đến 48 h.
Sau khi nuôi cấy, đếm số lượng khuẩn lạc trong đĩa Petri có chứa từ 30 đến 300 khuẩn lạc. Nếu số lượng khuẩn lạc tối thiểu nhỏ hơn 30 thì đếm và ghi lại số lượng khuẩn lạc trong các đĩa này. Nếu không thu được khuẩn lạc ở trong đĩa, ghi lại số lượng khuẩn lạc là < 1.
A.2 Biểu thị kết quả
A.2.1 Tính số lượng vi khuẩn có thể sống
Đối với từng mẫu thử, xác định số lượng vi khuẩn có thể sống thu được theo công thức (A.1):
M = Z x B x 20 (A.1)
Trong đó
M là số lượng vi khuẩn có thể sống của từng mẫu thử;
Z là số lượng vi khuẩn có thể sống trung bình trong hai đĩa Petri;
B là tỷ lệ pha loãng;
20 là thể tích dung dịch rửa giải, tính bằng mililít (ml).
A.2.2 Đánh giá hiệu quả phép thử
Giá trị chênh lệch cực lớn của ba mẫu đối chứng sau khi cấy và nuôi cấy phải có ∆ (IgC) ≤ 1. Số trung bình các khuẩn lạc của các mẫu đối chứng ngay sau khi cấy phải tối thiểu 1 x 105 CFU. Trong phương pháp đếm đĩa, tính giá trị tăng vi khuẩn (F) theo công thức (A.2), và F phải ≥ 0.
F = IgCt - IgC0 (A.2)
Trong đó
F là giá trị tăng vi khuẩn của mẫu đối chứng;
Ct là số trung bình các khuẩn lạc của ba mẫu đối chứng ngay sau khi nuôi cấy, tính bằng CFU/ml;
C0 là số trung bình các khuẩn lạc của ba mẫu đối chứng ngay sau khi cấy, tính bằng CFU/ml;
Nếu các điều kiện trên được thỏa mãn, phép thử được cho là có giá trị. Nếu các điều kiện trên không được thỏa mãn, phép thử không có giá trị và phải thử lại các mẫu.
A.2.3 Tính tỷ lệ hoạt tính kháng khuẩn
Tính tỷ lệ hoạt tính kháng khuẩn theo Điều 11.
Phụ lục B
(quy định)
Phương pháp tiếp xúc màng
B.1 Chuẩn bị mẫu
B.1.1 Mẫu thử
Nếu có thể, nên sử dụng mẫu thử có kích thước lớn hơn thay cho kích thước được quy định trong (9.2). Kích thước mẫu thử phải được ghi trong báo cáo thử nghiệm.
CHÚ THÍCH: Chất cấy có thể được cấy trải trên đĩa Petri khi đặt màng lên trên mặt mẫu thử nhỏ, tùy thuộc vào thành phần mẫu.
B.1.2 Màng phủ
Tạo kích thước và hình dáng của màng phủ phù hợp với mẫu thử hoặc mẫu đối chứng. Điều quan trọng là chất cấy để thử không rỉ ra ngoài mép của màng. Màng phải nhỏ hơn mẫu. Kích thước và hình dáng thực tế sử dụng phải ghi trong báo cáo thử nghiệm.
Màng phải được làm bằng PE, PP, PET không ảnh hưởng đến sự phát triển của vi khuẩn. Màng nên có độ dày khoảng từ 0,05 mm đến 0,1 mm.
B.1.3 Khử trùng mẫu thử (tùy chọn)
Nếu không thực hiện theo quy trình trong 9.3, có thể thực hiện theo quy trình sau. Làm sạch bề mặt của các mẫu đối chứng và mẫu thử bằng dung dịch etanol 70 %. Sau 5 min, rửa các mẫu bằng nước cất vô trùng và để khô tự nhiên. Các mẫu thử không thể xử lý bằng etanol thì có thể rửa trực tiếp bằng nước cất vô trùng hoặc khử trùng bằng phương pháp khác mà không ảnh hưởng đến hoạt tính kháng khuẩn và kết quả thử nghiệm.
B.2 Cách tiến hành
B.2.1 Quy trình cấy
Đặt sáu mẫu thử và sáu mẫu đối chứng vào trong các đĩa Petri riêng rẽ và để bề mặt thử quay lên trên. Dùng pipet lấy chính xác từ 0,1 ml đến 0,2 ml chất huyền phù vi khuẩn và nhỏ giọt chậm xuống bề mặt thử. Kẹp chặt màng phủ (5.8) bằng kẹp đã khử trùng và cấy trải trên bề mặt thử mà không tạo bong bóng sao cho chất cấy có thể tiếp xúc đều với mẫu. Đậy đĩa lại, xem Hình B.1.
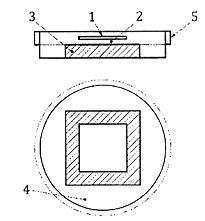
CHÚ DẪN
1 Màng phủ
2 Chất cấy để thử
3 Mẫu thử
4 Đĩa Petri
5 Nắp của đĩa
Hình B.1 - Quy trình cấy và đặt màng phủ
Nếu không có mẫu đối chứng, cấy trên đĩa Petri mà không có mẫu để tạo ra phần đối chứng để xác định hiệu quả phép thử.
B.2.2 Rửa giải sau khi cấy (thời gian zero)
Sau khi cấy ba mẫu thử hoặc phần đối chứng, thêm 10 ml môi trường SCDLP (6.4) vào từng đĩa Petri. Lắc ở 50 vòng/phút bằng máy lắc hai hoặc ba chiều (5.10) trong 5 min để rửa các vi khuẩn khỏi mẫu thử và phần đối chứng.
B.2.3 Môi trường nuôi cấy
Nuôi cấy ba mẫu thử và ba phần đối chứng ở nhiệt độ (37 ± 2) °C và độ ẩm tương đối không nhỏ hơn 90% trong (24 ± 1) h.
B.2.4 Rửa giải sau khi nuôi cấy (thời gian 24 h)
Thực hiện theo B.2.2.
B.2.5 Xác định số lượng vi khuẩn có thể sống
Xác định số lượng vi khuẩn có thể sống của từng dung dịch rửa giải mẫu từ B.2.2 hoặc B.2.4 theo A.1.5.
B.3 Biểu thị kết quả
B.3.1 Tính số lượng vi khuẩn lạc
Đối với từng mẫu thử, xác định số lượng vi khuẩn có thể sống thu được theo công thức (B.1):
M = Z x B x 10 x I (B.1)
Trong đó
M là số lượng vi khuẩn có thể sống của từng mẫu thử;
Z là số lượng vi khuẩn có thể sống trung bình trong hai đĩa Petri;
B là tỷ lệ pha loãng;
10 là thể tích dung dịch rửa giải, tính bằng mililít (ml);
I là hệ số pha loãng: 10 đối với chất cấy 0,1 ml hoặc 5 đối với chất cấy 0,2 ml.
B.3.2 Đánh giá hiệu quả phép thử
a) Số lượng vi khuẩn có thể sống trung bình thu được trên phần đối chứng ngay sau khi cấy phải ít nhất là 1,0 x 104 CFU.
b) Giá trị logarit của số lượng vi khuẩn có thể sống thu được trên ba phần đối chứng ngay sau khi cấy phải thỏa mãn yêu cầu sau (công thức B.2):
(B.2)
Trong đó
Lmax là logarit thập phân (cụ thể: logarit cơ số 10) của số lượng vi khuẩn có thể sống tối đa thu được;
Lmin là logarit thập phân của số lượng vi khuẩn có thể sống tối thiểu thu được;
Lmean là logarit thập phân của số lượng vi khuẩn có thể sống trung bình thu được;
Phần đối chứng phải không có hoạt tính kháng khuẩn rõ ràng. Số lượng vi khuẩn có thể sống thu được trên từng phần đối chứng sau khi nuôi cấy phải không nhỏ hơn một phần mười số lượng vi khuẩn có thể sống thu được ngay sau khi cấy. Nếu thỏa mãn các điều kiện trên, phép thử là có giá trị. Nếu không, phép thử bị coi là không có giá trị và cần phải thử lại.
B.3.3 Tính tỷ lệ hoạt tính kháng khuẩn
Tính tỷ lệ hoạt tính kháng khuẩn theo Điều 11.
Phụ lục C
(quy định)
Phép thử yêu cầu động
C.1 Cách tiến hành
C.1.1 Quy trình cấy
Đặt sáu mẫu thử và sáu mẫu đối chứng vào các bình nón 250 ml được khử trùng riêng rẽ.
Dùng pipet lấy (50,0 ± 0,5) ml chất cấy được chuẩn bị theo Điều 8 và cấy từng mẫu thử và mẫu đối chứng.
Nếu không có mẫu đối chứng, cấy trong các bình nón vô trùng không có mẫu thử để tạo ra mẫu đối chứng để xác định hiệu quả phép thử.
C.1.2 Rửa giải sau khi cấy (thời gian zero)
Dùng pipet lấy 2 ml từ ba mẫu thử được cấy và ba mẫu đối chứng vào các bình vô trùng được chuẩn bị riêng, mỗi bình chứa 18 ml môi trường SCDLP (6.4) để trung hòa hoạt tính kháng khuẩn.
Lắc bình theo một cung tròn khoảng 30 cm trong 30 s, hoặc trộn trong 5 s x 5 chu kỳ trên máy trộn vortex (5.9).
C.1.3 Môi trường nuôi cấy
Nuôi cấy ba mẫu thử được cấy và ba mẫu đối chứng được cấy khác ở (37 ± 2) °C trong (24 ± 1) h trong tủ ấm lắc (5.11) ở 120 vòng/phút.
C.1.4 Rửa giải sau khi nuôi cấy (thời gian 24 h)
Thực hiện theo C.1.2.
C.1.5 Xác định số lượng vi khuẩn có thể sống
Xác định số lượng vi khuẩn có thể sống của từng dung dịch rửa giải mẫu từ C.1.2 và C.1.4 theo A.1.5.
C.2 Biểu thị kết quả
C.2.1 Tính số lượng vi khuẩn có thể sống
Đối với từng mẫu thử, xác định số lượng vi khuẩn có thể sống thu được theo công thức (C.1):
M = Z x B x 10 (C.1)
Trong đó
M là số lượng vi khuẩn có thể sống của từng mẫu thử, tính bằng CFU/ml;
Z là số lượng vi khuẩn có thể sống trung bình trong hai đĩa Petri;
B là tỷ lệ pha loãng;
10 là hệ số pha loãng của phản ứng trung hòa.
C.2.2 Đánh giá hiệu quả phép thử
Giá trị chênh lệch lớn nhất của ba phần đối chứng sau khi cấy và nuôi cấy có ∆(IgC) ≤ 1.
Số trung bình các khuẩn lạc của các phần đối chứng ngay sau khi cấy phải tối thiểu là 1 x 105 CFU/ml.
Trong phương pháp đếm đĩa, tính giá trị phát triển vi khuẩn (F) theo công thức (C.2), và F phải ≥ 0.
F = IgCt - IgC0
Trong đó
F là giá trị phát triển vi khuẩn của phần đối chứng;
Ct là số trung bình các khuẩn lạc của ba mẫu đối chứng sau khi nuôi cấy, tính bằng CFU/ml;
C0 là số trung bình các khuẩn lạc của ba phần đối chứng ngay sau khi cấy, tính bằng CFU/ml;
Nếu các điều kiện trên được thỏa mãn, phép thử được cho là có giá trị. Nếu các điều kiện trên không được thỏa mãn, phép thử không có giá trị và phải thử lại các mẫu.
C.2.3 Tính tỷ lệ hoạt tính kháng khuẩn
Tính tỷ lệ hoạt tính kháng khuẩn theo Điều 11.
Phụ lục D
(tham khảo)
Kết quả của các phép thử liên phòng được tóm tắt
D.1 Thông tin cơ bản
Trong năm 2010, phép thử liên phòng đầu tiên được thực hiện bởi một số phòng thử nghiệm ở Trung Quốc, Đức và Anh. Các kết quả của phép thử này được sử dụng để cải tiến phương pháp thử.
Trong năm 2011, phép thử liên phòng thứ hai, với sáu loại mẫu, được thực hiện bởi các phòng thử nghiệm ở Trung Quốc, Đức, Anh, Bồ Đào Nha và Tây Ban Nha. Phép thử này khẳng định các phương pháp thử cho các kết luận được nêu tại Điều D.3.
D.2 Các mẫu được thử
Các mẫu dưới đây được thử bằng phương pháp thử được nêu trong Bảng D.1.
Bảng D.1 - Các mẫu được thử trong phép thử liên phòng
| Mẫu | Phương pháp thử |
| 1 # - Vật liệu dệt | A (Phụ lục A) C (Phụ lục C) |
| 2 # - Xốp | A (Phụ lục A) C (Phụ lục C) |
| 3 # - EVA | B (Phụ lục B) |
| 4 # - đế ngoài/đế giữa PU | B (Phụ lục B) C (Phụ lục C) |
| 5 # - Vải tráng phủ PU (màu xám) | B (Phụ lục B) |
| 6 # - Vải tráng phủ PU (màu xám) | B (Phụ lục B) |
| CHÚ THÍCH: Các mẫu 5 # và 6 # có các cách xử lý khác nhau bằng các hoạt tính kháng khuẩn khác nhau. | |
D.3 Kết luận của phép thử liên phòng
- Đối với mẫu 1 và mẫu 2, dù sử dụng phương pháp thử A (Phụ lục A) hay phương pháp thử C (Phụ lục C), độ lặp lại của các kết quả thử từ tất cả các phòng thí nghiệm là tốt. Điều này có nghĩa là các kết quả thử (cả R và R*) của phương pháp thử A hay phương pháp thử C là tương tự nhau.
- Các kết quả độ lặp lại (cả R và R*) của mẫu 3 sử dụng phương pháp thử B (Phụ lục B) tốt như các kết quả thu được từ mẫu 1 và mẫu 2.
- Đối với mẫu 4, nếu mẫu được khử trùng bằng nồi hấp (5.4), cả R và R* là 0,0 %, nhưng nếu mẫu được khử trùng bằng etanol, R* là 64,4 % khi sử dụng phương pháp thử B (Phụ lục B). Bởi vậy, có thể kết luận là các phương pháp khử trùng khác nhau có thể ảnh hưởng đến các kết quả thử. Nếu có thể, tránh các quy trình khử trùng ở các mẫu thử của các sản phẩm kháng khuẩn.
- Phương pháp thử phù hợp cho từng vật liệu phải được quyết định bởi chuyên viên kỹ thuật có kinh nghiệm.
- Kết quả phương pháp thử B (Phụ lục B) của mẫu 5 tương tự với mẫu 4, bởi vì các phương pháp khử trùng khác nhau có thể ảnh hưởng đến các kết quả thử.
- Tất cả các phòng thử nghiệm tham gia báo cáo là hoạt tính kháng khuẩn của mẫu 6 yếu.
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] ISO 5725 (tất cả các phần), Accuracy (trueness and precision) of measurement methods and results
[2] ISO 7218, Microbiology of food and animal feeding stuffs - General requirements and guidance for microbiological examinations
[3] ISO/TS 11133-1, Microbiology of food and animal feeding stuffs - Guidelines on preparation and production of culture media - Part 1: General guidelines on quality assurance for the preparation of culture media in the laboratory
[4] ISO/TS 11133-2, Microbiology of food and animal feeding stuffs - Guidelines on preparation and production of culture media - Part 2: Practical guidelines on performance testing of culture media
[5] ISO 20645, Textile fabrics - Determination of antibacterial activity - Agar diffusion plate test
[6] ISO 20743, Textiles - Determination of antibacterial activity of textile products
[7] ISO 22196, Measurement of antibacterial activity on plastics and other non-porous surfaces
[8] ISO/IEC 17025, General requirements for the competence of testing and calibration laboratories
[9] IEC 60068-2-10, Environmental testing - Part 2-10: Tests - Test J and guidance: Mould growth
[10] EN 1040, Chemical disinfectants and antiseptics - Quantitative suspension test for the evaluation of basic bactericidal activity of chemical disinfectants and antiseptics - Test method and requirements (phase 1)
[11] EN 12353, Chemical disinfectants and antiseptics - Preservation of test organisms used for the determination of bactericidal, sporicidal, fungicidal activity
[12] ASTM E 1054, Standard Test Methods for Evaluation of Inactivators of Antimicrobial Agents
[13] ASTM E 2149-10, Standard Test Methods for determining the antimicrobial activity of immobilized antimicrobial agents under dynamic contact conditions.
[14] JIS L1902-2008, Testing for antibacterial activity and efficacy on textiles products
[15] AATCC Test Method 100-2004, Antibacterial Finishes on Textile Materials: Assessment of
MỤC LỤC
Lời nói đầu
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Thuật ngữ và định nghĩa
4 An toàn
5 Thiết bị, dụng cụ và vật liệu
6 Thuốc thử và môi trường cấy
7 Vi sinh vật thử
7.1 Chủng vi khuẩn thử
7.2 Lưu giữ các chủng vi khuẩn
8 Chuẩn bị chất cấy
9 Chuẩn bị mẫu thử
9.1 Quy định chung
9.2 Mẫu thử
9.3 Xử lý sơ bộ mẫu thử
10 Cách tiến hành
11 Biểu thị kết quả
12 Báo cáo thử nghiệm
Phụ lục A (quy định) Phép thử yêu cầu tĩnh
Phụ lục B (quy định) Phương pháp tiếp xúc màng
Phụ lục C (quy định) Phép thử yêu cầu động
Phụ lục D (tham khảo) Kết quả của các phép thử liên phòng được tóm tắt
Thư mục tài liệu tham khảo
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 10944:2015 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 10944:2015 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 10944:2015 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 10944:2015 DOC (Bản Word)