- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 4328-2:2011 Xác định nitơ, protein thô trong thức ăn chăn nuôi
| Số hiệu: | TCVN 4328-2:2011 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Công nghiệp , Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2011 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 4328-2:2011
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 4328-2:2011
TIÊU CHUẨN QUỐC GIA
TCVN 4328-2:2011
THỨC ĂN CHĂN NUÔI – XÁC ĐỊNH HÀM LƯỢNG NITƠ VÀ TÍNH HÀM LƯỢNG PROTEIN THÔ – PHẦN 2: PHƯƠNG PHÁP PHÂN HỦY KÍN VÀ CHƯNG CẤT BẰNG HƠI NƯỚC
Animal feeding stuffs – Determination of nitrogen content and calculation of crude protein content – Part 2: Block digestion and steam distillation method
Lời nói đầu
TCVN 4328-2:2011 hoàn toàn tương đương với ISO 5983-2:2009;
TCVN 9124:2011 hoàn toàn tương đương với ISO 6867:2000;
TCVN 9125:2011 hoàn toàn tương đương với ISO 6866:1985;
TCVN 9126:2011 hoàn toàn đương đương với ISO 17375:2006;
TCVN 9127:2011 hoàn toàn đương đương với ISO 14797:1999;
TCVN 9128:2011 hoàn toàn đương đương với ISO 14939:2001;
TCVN 9129:2011 hoàn toàn đương đương với ISO 6655:1997;
TCVN 9130:2011 hoàn toàn đương đương với ISO 14902:2001;
TCVN 9131:2011 hoàn toàn đương đương với ISO 6870:2002;
TCVN 9132:2011 hoàn toàn đương đương với ISO 7485:2000.
TCVN 4328-2:2011; TCVN 9109:2010; TCVN 9124:2011 ¸ TCVN 9132:2011 do Cục Chăn nuôi biên soạn, Bộ Nông nghiệp và Phát triển nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
THỨC ĂN CHĂN NUÔI – XÁC ĐỊNH HÀM LƯỢNG NITƠ VÀ TÍNH HÀM LƯỢNG PROTEIN THÔ – PHẦN 2: PHƯƠNG PHÁP PHÂN HỦY KÍN VÀ CHƯNG CẤT BẰNG HƠI NƯỚC
Animal feeding stuffs – Determination of nitrogen content and calculation of crude protein content – Part 2: Block digestion and steam distillation method
CẢNH BÁO – Việc áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác gây nguy hiểm. Tiêu chuẩn này không đưa ra được tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Người sử dụng tiêu chuẩn này phải tự thiết lập các thao tác an toàn thích hợp và xác định khả năng áp dụng các giới hạn quy định trước khi sử dụng tiêu chuẩn.
1. Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp xác định hàm lượng nitơ trong thức ăn nuôi bằng phương pháp Kjeldahl và phương pháp tính hàm lượng protein thô.
Phương pháp này thích hợp để sử dụng như một phương pháp nhanh bán vi lượng sử dụng bằng phân hủy kín, chất xúc tác đồng và chưng cất bằng hơi nước vào axit boric.
Phương pháp này có thể dùng để xác nhận hàm lượng nitơ lớn hơn 0,5% khối lượng trong thức ăn chăn nuôi, thức ăn cho thú cảnh và các nguyên liệu của chúng.
Phương pháp này không xác định được các dạng nitơ đã oxy hóa và các hợp chất nitơ dị vòng.
Phương pháp này không phân biệt giữa nitơ protein và nitơ phi protein.
CHÚ THÍCH: Nếu cần xác định hàm lượng nitơ phi protein thì có thể sử dụng phương pháp thích hợp khác.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 6952 (ISO 6498), Thức ăn chăn nuôi – Chuẩn bị mẫu thử
ISO 1871, Food and feed products – Graduated guidelines for the determination of nitrogen by the Kjeldahl method (Thực phẩm và thức ăn chăn nuôi – Hướng dẫn xác định nitơ bằng phương pháp Kjeldahl)
3. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau đây:
3.1. Hàm lượng nitơ (nitrogen content)
Phần khối lượng của nitơ được xác định bằng quy trình quy định trong tiêu chuẩn này.
CHÚ THÍCH: Hàm lượng nitơ được biểu thị bằng phần trăm khối lượng hoặc bằng gam trên kilogam.
3.2. Hàm lượng protein thô (crude protein content)
Hàm lượng nitơ (3.1) nhân với hệ số 6,25
CHÚ THÍCH: Hàm lượng protein thô được biểu thị bằng phần trăm khối lượng hoặc gam trên kilogam.
4. Nguyên tắc
Phần mẫu thử đã được phân hủy trong bộ phận hủy hình khối hoặc các thiết bị tương đương. Dùng axit sulfuric đậm đặc để chuyển nitơ protein thành amoni sulfat bổ sung kali sulfat để tăng điểm sôi. Chất xúc tác đồng thường được sử dụng để làm tăng tốc độ phản ứng. Bổ sung một lượng dư natri hydroxit nào dịch phân hủy đã nguội để giải phóng amoniac.
Amoniac giải phóng được chưng cất, bằng bộ chưng cất hơi nước thủ công, bán tự động hoặc hoàn toàn tự động. Trong trường hợp chưng cất thủ công hoặc bán tự động, thì chưng cất amoniac vào trong dung dịch axit boric dư, sau đó được chuẩn độ bằng dung dịch axit clohydric tới điểm kết thúc so màu. Khi hệ thống tự động hoàn toàn thì chuẩn độ tự động amoniac được thực hiện đồng thời với chưng cất và điểm kết thúc chuẩn độ cũng có thể được phát hiện bằng hệ thống đo pH bằng điện thế.
Hàm lượng nitơ tính được từ lượng amoniac sinh ra. Hàm lượng protein thô thu được bằng cách nhân hàm lượng nitơ với hệ số chuyển đổi được quy ước là 6,25.
CHÚ THÍCH: Về nguyên tắc, axit sulfuric cũng có thể sử dụng để chuẩn độ.
5. Thuốc thử
Chỉ sử dụng thuốc thử loại tinh khiết phân tích và chỉ sử dụng nước cất hoặc nước đã khử khoáng hoặc nước có độ tinh khiết tương đương, trừ khi có quy định khác.
5.1. Viên xúc tác Kjeldahl, gồm 3,5 g kali sulfat và 0,4 g đồng (II) sulfat ngậm năm phân tử nước.
Các viên này có bán sẵn trên thị trường.
Có thể sử dụng các viên loại khác với điều kiện là:
a) mỗi viên chứa 7 g kali sulfat và 0,8 g đồng (ll) sulfat ngậm năm phân tử nước; và
b) chúng không chứa muối của các kim loại độc như selen hoặc thủy ngân.
5.2. Axit sulfuric (H2SO4), ít nhất 98% khối lượng, không chứa nitơ (ρ20 ![]() 1,84 g/ml).
1,84 g/ml).
5.3. Dung dịch hydro peroxit, mỗi 100 ml chứa khoảng 30 g H2O2.
5.4. Chất chống tạo bọt. Nên chuẩn bị silicon, ví dụ 30% khối lượng nhũ tương.
5.5. Dung dịch natri hydroxit (NaOH), khoảng 40% khối lượng, không chứa nitơ (< 5 μg nitơ/g).
5.6. Dung dịch chỉ thị.
5.6.1. Dung dịch đỏ metyl. Hòa tan 100 mg đỏ metyl (C15H15N3O2) trong 100 ml etanol hoặc metanol.
5.6.2. Dung dịch xanh bromocresol. Hòa tan 100 mg xanh bromocresol (C21H14Br4O5S) trong 100 ml etanol hoặc metanol.
5.7. Dung dịch axit boric đậm đặc, c(H3BO3) = 40,0 g/l.
Hòa tan 400 g axit boric trong khoảng 5 l đến 6 l nước nóng. Trộn và cho thêm nước nóng đến khoảng 9 lít. Để nguội đến nhiệt độ phòng. Thêm 70 ml dung dịch đỏ metyl (5.6.1) và 100 ml dung dịch xanh bromocresol (5.6.2) và trộn. Pha loãng bằng nước đến thể tích cuối là 10 lít và trộn đều. Tùy thuộc vào nước được sử dụng, mà pH của dung dịch axit boric có thể khác nhau từ lần pha này đến lần pha khác. Thông thường việc điều chỉnh bằng một thể tích nhỏ của chất kiềm là cần thiết để thu được một mẫu trắng dương tính (từ 0,05 ml đến 0,15 ml chất chuẩn độ). Màu sẽ chuyển sang màu xanh khi thêm 100 ml nước vào 250 ml dung dịch axit boric. Nếu dung dịch vẫn còn đỏ, thì chuẩn độ bằng NaOH 0,1 mol/l cho đến khi có “màu xám trung tính” và tính lượng kiềm cần cho mẻ 10 lít.
Bảo quản dung dịch màu đỏ ở nhiệt độ phòng, tránh ánh sáng và nguồn hơi amoniac trong suốt quá trình bảo quản.
5.8. Dung dịch axit boric loãng, c(H3BO3) = 10,0 g/l (dung dịch bẫy tùy chọn để sử dụng cho chuẩn độ tự động khi bắt đầu chưng cất).
Hòa tan 100 g axit boric trong khoảng từ 5 lít đến 6 lít nước nóng, trộn và thêm nước nóng đến khoảng 9 lít. Để nguội đến nhiệt độ phòng. Thêm 70 ml dung dịch đỏ metyl (5.6.1) và 100 ml dung dịch xanh bromocresol (5.6.2) và trộn. Pha loãng bằng nước đến thể tích cuối là 10 lít và trộn đều. Tùy thuộc vào nước được sử dụng, mà pH của dung dịch axit boric có thể khác nhau từ mẻ này đến mẻ khác. Thông thường việc điều chỉnh bằng một thể tích nhỏ của chất kiềm là cần thiết để thu được một mẫu trắng dương tính (0,05 ml đến 0,15 ml chất chuẩn độ). Màu sẽ chuyển sang màu xanh khi thêm 100 ml nước vào 25 ml dung dịch axit boric. Nếu dung dịch vẫn còn màu đỏ, thì chuẩn độ bằng NaOH 0,1 mol cho đến khi có “màu xám trung tính” và tính lượng kiềm cần cho mẻ 10 lít.
Bảo quản dung dịch màu đỏ ở nhiệt độ phòng và bảo vệ dung dịch ánh sáng và nguồn hơi amoniac trong suốt quá trình bảo quản.
CHÚ THÍCH Thêm khoảng 3 ml đến 4 ml NaOH 0,1 mol/l vào 1 lít boric 1% khối lượng thường cho kết quả điều chỉnh tốt.
5.9. Dung dịch thể tích chuẩn axit clohydric, c(HCl) = 0,100 0 mol/l.
Có thể sử dụng nồng độ khác của HCl hoặc axit sulfuric nếu điều này được hiệu chỉnh trong phần tính toán. Các nồng độ này luôn được biểu thị đến bốn chữ số thập phân.
5.10. Amoni sulfat [(NH4)2SO4], tối thiểu là 99,5% khối lượng, có độ tinh khiết đã được đánh giá. Sấy amoni sulfat ở 102 oC ± 2 oC trong 4 h và bảo quản trong bình hút ẩm.
Phần trăm khối lượng nitơ trong amoni sulfat (ở độ tinh khiết 99,5% khối lượng) là 21,09.
5.11. Amoni sắt (ll) sulfat [(NH4)2Fe(SO4)2.6H2O], có độ tinh khiết đã được đánh giá.
Phần trăm khối lượng nitơ trong amoni sắt (ll) sulfat (ở độ tinh khiết 100% khối lượng) là 7,145.
5.12. Chất chuẩn
Có thể được sử dụng 5.12.1 hoặc 5.12.2.
Ngoài các chất chuẩn được liệt kê trong 5.12.1 và 5.12.2, có thể sử dụng các chất chuẩn thích hợp hàm lượng nitơ và protein thô được đánh giá, khi thích hợp.
CHÚ THÍCH Hàm lượng ẩm có thể được kiểm tra trên các phần riêng rẽ.
5.12.1. Tryptophan (C11H12N2O2), có điểm nóng chảy 282 oC, hàm lượng nitơ 137,2 g/kg. Sấy khô trytophan trước khi sử dụng.
5.12.2. Axetanilit (C8H9NO), ít nhất 99% khối lượng, hàm lượng nitơ 103,6 g/kg. Không được sấy khô trong tủ sấy trước khi sử dụng.
5.13. Saccaroza (C12H22O11), có hàm lượng nitơ không lớn hơn 0,002 % khối lượng. Không được làm khô trong tủ sấy trước khi sử dụng.
6. Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm thông thường và cụ thể như sau:
6.1. Cân phân tích, có thể cân chính xác đến 0,1 mg và có thể đọc đến 0,1 mg.
6.2. Thiết bị phân hủy, bằng hợp kim nhôm hoặc thiết bị tương đương, được gắn với bộ điều chỉnh nhiệt độ và dụng cụ đo nhiệt độ của thiết bị phân hủy, có thể duy trì ở 420 oC ± 5 oC.
6.3. Ống phân hủy, dung tích 250 ml, thích hợp để sử dụng với thiết bị phân hủy (6.2).
6.4. Ống thoát khí, thích hợp để sử dụng với ống phân hủy (6.3).
6.5. Thiết bị lọc hơi ly tâm, bơm lọc hoặc máy hút, được cấu tạo bằng vật liệu bền với axit, để sử dụng với nguồn cung cấp nước.
6.6. Pipet tự động (bộ phân phối), có khả năng phân phối các lượng tới 25 ml, ISO 8655-2[6] (ISO 8655-5[8]).
6.7. Ống đong chia độ, dung tích 50 ml.
6.8. Bộ phận chưng cất, có khả năng chưng cất bằng hơi nước, thủ công hoặc bán tự động, thích hợp để dùng với ống phân hủy (6.3) và bình nón (6.9), hoặc có khả năng chưng cất bằng hơi nước và chuẩn độ tự động.
6.9. Bình nón, dung tích 250 ml.
6.10. Buret, dung tích 25 ml hoặc dung tích thích hợp khác, có thể đọc được đến 0,05 ml, loại A nêu trong TCVN 7149 (ISO 385)[1].
Ngoài ra, có thể sử dụng buret tự động, ISO 8655-3[7], đáp ứng các yêu cầu tương tự.
6.11. Bộ chuẩn độ tự động, có điện lực pH được hiệu chuẩn trong dải pH 4 đến pH 7.
7. Lấy mẫu
Mẫu gửi đến phòng thử nghiệm phải đúng là mẫu đại diện. Mẫu không bị hư hỏng hoặc thay đổi trong suốt quá trình vận chuyển hoặc bảo quản.
Việc lấy mẫu không quy định trong tiêu chuẩn này, nên lấy mẫu theo TCVN 4325 (ISO 6497)[5].
8. Chuẩn bị mẫu thử
Chuẩn bị mẫu thử theo TCVN 6952 (ISO 6498).
9. Cách tiến hành
9.1. Yêu cầu chung
Thông thường, các mẫu thử được phân tích theo các mẻ phù hợp với quy trình quy định. Đối với các yêu cầu chung áp dụng cho phương pháp Kjeldahl, xem ISO 1871.
9.2. Phần mẫu thử
Cân phần mẫu thử, chính xác tới 0,1 mg:
a) khoảng 1,0 g đối với các nguyên liệu có chứa protein từ 3% đến 30% khối lượng;
b) khoảng 0,5 g đối với các nguyên liệu có chứa protein từ 30% đến 80% khối lượng;
c) khoảng 0,3 g đối với các nguyên liệu có chứa protein nhiều hơn 80% khối lượng protein.
Không vượt quá 1,2 g.
Luôn thực hiện kiểm soát chất lượng và chất chuẩn cũng như thuốc thử trắng đối với mỗi mẻ.
9.3. Phép xác định
9.3.1. Phân hủy
Chuyển phần mẫu thử (9.2) vào ống phân hủy (6.3) và thêm hai viên chất xúc tác (5.1) vào mỗi ống. Dùng pipet phân phối (6.6), cho 12 ml axit sulfuric (5.2) vào mỗi ống. Dùng 15 ml đối với mẫu chứa hàm lượng chất béo cao (chất béo > 10 % khối lượng). Có thể dừng công việc tại thời điểm này và tiếp tục vào ngày hôm sau.
Nếu xảy ra hiện tượng tạo bọt, thì thêm từ 3 ml đến 5 ml hydro peroxit (5.3). Xoay nhẹ và để phản ứng xảy ra. Ngoài ra, có thể sử dụng vài giọt chất chống tạo bọt (5.4).
Gắn tấm cách nhiệt vào giá đựng ống nghiệm. Đặt ống thoát khí (6.4) khít vào các ống nghiệm và bật máy hút nước hoặc bộ lọc khí (6.5). Đặt giá đựng các ống vào trong thiết bị phân hủy (6.2) đã làm nóng trước đến 420 oC.
Sau 10 min, đưa máy hút nước xuống cho đến khi khói axit chỉ còn lại trong tủ hút khói. Cần duy trì vùng cô đặc trong ống. Sau khi phần lớn khói lưu huỳnh oxit được tạo thành trong suốt giai đoạn đầu của quá trình phân hủy, thì giảm nguồn chân không để tránh thất thoát axit sulfuric.
Phân hủy thêm 50 min. Tổng thời gian phân hủy khoảng 60 min.
Tắt thiết bị phân hủy. Tháo giá đựng ống nghiệm trong khi ống hút khói vẫn để nguyên vị trí và để cho nguội từ 10 min đến 20 min. Khi hết khói, tháo ống hút khói và tắt máy hút. Tháo các tấm cách nhiệt ra.
Để ống nguội. Nên pha loãng sơ bộ mẫu trước khi chưng cất. Mang găng tay và kính bảo vệ mắt, cẩn thận thêm vài mililit nước vào mỗi ống. Nếu bị tắc thì có nghĩa là các ống vẫn còn quá nóng. Để nguội thêm vài phút. Thêm nước vào mỗi ống cho đến khi tổng thể tích khoảng 80 ml.
Nếu mẫu trở nên đông đặc, thì đặt ống chứa dịch phân hủy đã pha loãng vào thiết bị phân hủy và cẩn thận làm ấm, thỉnh thoảng khuấy cho đến khi muối hòa tan, hoặc chưng cất thêm từ 30 s đến 60 s.
CHÚ THÍCH 1 Một số dụng cụ thực hiện thêm nước tự động. Chỉ pha loãng sơ bộ trước khi đặt vào thiết bị nếu hình thành mảng rất cứng.
CHÚ THÍCH 2 Một số thiết bị chưng cất bắt đầu với việc bổ sung hơi nước trước khi bổ sung kiềm, dẫn đến không hòa tan các tảng muối và phản ứng ít mạnh hơn trong quá trình thêm kiềm. Sự kết tinh trong quá trình phân hủy có thể làm thất thoát nitơ.
9.3.2. Chưng cất
Chuyển ống phân hủy (xem 9.3.1) vào thiết bị chưng cất (6.8).
Khi chuẩn độ hàm lượng amoniac của dịch chiết được tiến hành thủ công thì áp dụng quy trình dưới đây. Khi thiết bị chưng cất tự động hoàn toàn kể cả việc chuẩn độ hàm lượng amoniac của dịch chiết, thì thực hiện theo hướng dẫn của nhà sản xuất thiết bị chưng cất.
Đặt bình nón (6.9) chứa từ 25 ml đến 30 ml dung dịch axit boric đậm đặc (5.7) dưới đầu ra của thiết bị ngưng tụ sao cho ống phân phối thấp hơn bề mặt của dung dịch axit boric dư. Điều chỉnh thiết bị chưng cất để phân phối được 50 ml dung dịch natri hydroxit (5.5). Vận hành thiết bị chưng cất theo hướng dẫn của nhà sản xuất và chưng cất lấy lượng amoniac giải phóng do việc bổ sung dung dịch natri hydroxit. Thu lấy dịch cất vào dung dịch chứa axit boric. Lượng dịch cất (thời gian chưng cất bằng hơi nước) phụ thuộc vào lượng nitơ có trong mẫu. Tuân theo hướng dẫn của nhà sản xuất.
CHÚ THÍCH Trong thiết bị chưng cất bán tự động, việc bổ sung dung dịch natri hydroxit dư và chưng cất hơi nước được thực hiện tự động.
9.3.3. Chuẩn độ
9.3.3.1. Phép đo màu. Chuẩn độ hàm lượng trong bình nón (6.9) bằng dung dịch thể tích chuẩn axit clohydric (5.9) sử dụng buret (6.10) và đọc lượng chất chuẩn độ đã sử dụng. Điểm kết thúc chuẩn độ đạt được khi xuất hiện vết màu hồng đầu tiên. Ước lượng số đọc buret chính xác đến 0,05 ml. Tấm khuấy từ được rọi sáng hoặc detector đo quang có thể giúp cho việc nhận biết điểm kết thúc.
Điều này có thể thực hiện tự động sử dụng bộ chưng cất hơi nước có chuẩn độ tự động.
9.3.3.2. Phép đo điện thế. Chuẩn độ lượng chứa trong bình nón (xem 6.9) bằng dung dịch thể tích chuẩn axit clohydric (5.9) sử dụng bộ chuẩn độ tự động hiệu chuẩn được trang bị một máy đo pH (6.11). Điểm kết thúc pH của chuẩn độ đạt được tại pH 4,6 là điểm uốn nhất trong đường chuẩn độ (điểm uốn). Đọc lượng chất chuẩn độ đã sử dụng từ bộ chuẩn độ tự động.
Thực hiện theo hướng dẫn của nhà sản xuất về vận hành thiết bị chưng cất cụ thể hoặc bộ chưng cất kết hợp và bộ chuẩn độ.
Khi sử dụng hệ thống chuẩn độ tự động, việc chuẩn độ bắt đầu ngay sau khi bắt đầu chưng cất và cần sử dụng dung dịch axit boric loãng (5.8).
9.4. Phép thử trắng
Thực hiện phép thử trắng theo quy trình quy định trong 9.1 đến 9.3.3, lấy 2 ml nước và khoảng 0,7 g sucroza (5.13) thay cho phần thử. Ghi lại các giá trị phép thử trắng. Nếu các giá trị phép thử trắng thay đổi thì phải tìm nguyên nhân.
Lượng chất chuẩn độ đã sử dụng trong phép thử trắng luôn phải lớn hơn 0,0 ml. Các phép thử mẫu trắng trong cùng một phòng thử nghiệm phải nhất quán theo thời gian.
9.5. Phép thử độ thu hồi
9.5.1. Yêu cầu chung
Các phép thử độ thu hồi cần được thực hiện thường xuyên để kiểm tra độ chính xác của quy trình và thiết bị được quy định trong 9.5.2 đến 9.5.4.
9.5.2. Thất thoát nitơ
Sử dụng 0,12 g amoni sulfat (5.10) và 0,67 g sucroza (5.13) cho mỗi bình cầu. Thêm tất cả các thuốc thử khác như đã nêu trong 9.3. Phân hủy và chưng cất dưới cùng các điều kiện như đối với mẫu thử. Độ thu hồi phải ≥ 99% khối lượng.
9.5.3. Hiệu suất phân hủy
Sử dụng phần mẫu thử ít nhất 0,15 g tryptophan (5.12.1)( hoặc axetanilit (5.12.2), được cân chính xác đến 0,1 mg, và thêm khoảng 0,7 g sucroza (5.13). Xác định hàm lượng nitơ theo quy trình mô tả trong 9.1 đến 9.3.3. Độ thu hồi phải ≥ 99,5% khối lượng đối với axetanilit và ≥ 98,5 % khối lượng đối với tryptophan (Tài liệu tham khảo [9])
9.5.4. Hiệu suất chưng cất và chuẩn độ
Cân từ 0,10 g đến 0,15 g amoni sulfat (5.10), chính xác đến 0,000 1 g, hoặc từ 0,3 g đến 0,5 g amoni sắt (ll) sulfat (5.11), chính xác đến 0,000 1 g cho vào ống nghiệm. Thêm 80 ml nước và tiến hành theo 9.3.2 và 9.3.3. Độ thu hồi phải ≥ 99,5 % khối lượng.
9.5.5. Hạn chế
Độ thu hồi nhỏ hơn các giá trị quy định hoặc lớn hơn 101,0 % khối lượng, trong bất kỳ các phép thử thu hồi ở trên cho thấy có sai sót trong các quy trình và/hoặc nồng độ không chính xác của dung dịch axit clohydric thể tích chuẩn (5.9).
10. Tính và biểu thị kết quả
10.1. Tính kết quả
10.1.1. Tính hàm lượng nitơ
Tính hàm lượng nitơ trong mẫu, wN, bằng phần trăm khối lượng:
![]() (1)
(1)
Trong đó:
Vs là thể tích của dung dịch thể tích chuẩn axit clohydric (5.9) được sử dụng trong phép xác định (9.3), được biểu thị chính xác đến 0,05 ml, tính bằng mililit (ml);
Vb là thể tích của dung dịch thể tích chuẩn axit clohydric (5.9) được sử dụng trong phép thử trắng (9.4), được biểu thị chính xác đến 0,05 ml, tính bằng mililít (ml);
Cs là nồng độ chính xác dung dịch thể tích chuẩn axit clohydric (5.9), được biểu thị tới bốn chữ số thập phân, tính bằng mol trên lít (mol/l);
m là khối lượng phần mẫu thử (9.2), tính bằng gam (g);
Để báo cáo kết quả bằng gam trên kilogam, thì có thể dùng hệ số 14,007 trong công thức (1) thay cho 1,400 7.
10.1.2. Tính độ thu hồi đối với muối amoni
Tính độ thu hồi đối với amoni sulfat có độ tinh khiết 99,5% khối lượng, w1, như sau:
![]() (2)
(2)
Trong đó wN,r là độ thu hồi của nitơ, tính bằng phần trăm khối lượng.
Tính độ thu hồi của amoni sắt (ll) sulfat có độ tinh khiết với 100% khối lượng, w2, như sau:
![]() (3)
(3)
Điều chỉnh mẫu số trong công thức (2) và (3) nếu sử dụng độ tinh khiết khác của muối amoni.
10.2. Tính hàm lượng protein thô
Tính hàm lượng protein thô, wp, tính bằng phần trăm khối lượng, theo công thức (4):
wp = wN . fK (4)
Trong đó:
wN là hàm lượng nitơ của mẫu, tính bằng phần trăm khối lượng chính xác đến bốn chữ số thập phân (10.1);
fk là hệ số chuyển đổi đối với nitơ xác định được bằng phương pháp Kjeldahl về protein – của thức ăn chăn nuôi, fK = 6,25.
Để báo cáo hàm lượng protein thô bằng gam trên kilogam, nhân vế bên phải của công thức (4) với (10).
10.3. Biểu thị kết quả
Biểu thị kết quả đến bốn chữ số thập phân nếu cần cho các phép tính toán tiếp theo. Đối với kết quả cuối cùng thì biểu thị kết quả thu được đối với hàm lượng nitơ đến ba chữ số thập phân, đối với hàm lượng protein đến hai chữ số thập phân.
Các kết quả không nên làm tròn tiếp dùng để tính toán đến các giá trị thử nghiệm cuối cùng. Điều này đặc biệt đúng khi các giá trị được sử dụng để tính toán tiếp theo.
VÍ DỤ 1 Khi các giá trị thử nghiệm riêng lẻ thu được từ phép phân tích của nhiều vật liệu mẫu được dùng để tính thống kê hiệu suất của phương pháp đối với biến thiên trong và giữa các phòng thử nghiệm.
VÍ DỤ 2 Khi các giá trị được sử dụng làm chuẩn để hiệu chuẩn thiết bị (ví dụ máy phân tích hồng ngoại), các giá trị thu được từ nhiều mẫu được sử dụng phép tính đơn lẻ hoặc phép tính hồi quy trước khi chúng được sử dụng để tính toán tiếp.
11. Độ chụm
11.1. Thử liên phòng thử nghiệm
Các chi tiết của phép thử liên phòng thử nghiệm sử dụng phép so màu, về độ chụm của phương pháp được nêu trong Phụ lục A. Các giá trị thu được từ phép thử có thể không áp dụng cho các dải nồng độ và chất nền khác với các dải nồng độ và chất nền đã nêu.
Các chi tiết của phép thử thành thạo khi có sự so sánh cho thấy sự tương đương của phép xác định điểm cuối bằng so màu và phép đo điện thế của chuẩn độ được nêu trong Phụ lục B.
11.2. Độ lặp lại
Chênh lệch tuyệt đối giữa các kết quả của hai phép thử độc lập, đơn lẻ thu được khi sử dụng cùng phương pháp trên vật liệu thử giống hệt nhau trong cùng một phòng thử nghiệm, do một người thực hiện, sử dụng cùng thiết bị, thực hiện trong một khoảng thời gian ngắn, không được quá 5% các trường hợp lớn hơn giới hạn của độ lặp lại, r, như phần trăm khối lượng protein, thu được từ công thức (5):
![]() (5)
(5)
Trong đó ![]() là giá trị trung bình của hai kết quả phép thử đơn lẻ về hàm lượng protein thô, tính bằng phần trăm khối lượng.
là giá trị trung bình của hai kết quả phép thử đơn lẻ về hàm lượng protein thô, tính bằng phần trăm khối lượng.
11.3. Độ tái lập
Chênh lệch tuyệt đối giữa các kết quả của hai phép thử độc lập, thu được khi sử dụng cùng phương pháp, tiến hành thử trên vật liệu thử giống nhau trong các phòng thử nghiệm khác nhau, do các nhà phân tích khác nhau, sử dụng các thiết bị khác nhau thực hiện, không được quá 5% các trường hợp lớn hơn giá trị độ tái lập, R, như phần trăm khối lượng protein, thu được từ công thức (6):
![]() (6)
(6)
12. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải ghi rõ:
a) mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
b) phương pháp lấy mẫu đã sử dụng, nếu biết;
c) phương pháp thử đã dùng, cũng như viện dẫn tiêu chuẩn này;
d) tất cả các chi tiết thao tác không quy định trong tiêu chuẩn này, hoặc tùy chọn cùng với chi tiết bất thường nào khác có thể ảnh hưởng tới kết quả;
e) kết quả thử nghiệm thu được, hàm lượng nitơ được biểu thị bằng phần trăm khối lượng hoặc bằng gam trên kilogam, hoặc hàm lượng protein thô được biểu thị bằng phần trăm khối lượng hoặc bằng gam trên kilogam, được định lượng với hệ số chuyển đổi, 6,25;
f) Nếu độ lặp lại được kiểm tra thì nêu kết quả cuối cùng thu được;
g) Nếu độ thu được hồi kiểm tra thì nêu kết quả cuối cùng thu được.
PHỤ LỤC A
(Tham khảo)
CÁC KẾT QUẢ CỦA PHÉP THỬ LIÊN PHÒNG THỬ NGHIỆM
Phép thử liên phòng thử nghiệm đầu tiên sử dụng phương pháp phân hủy kín và phương pháp chưng cất bằng hơi nước có phát hiện điểm kết thúc đo màu do AOAC quốc tế tổ chức trong năm 2001 và được tiến hành phù hợp với TCVN 6910-2 (ISO 5725-2)[3]. Trong phép thử này, có 13 phòng thử nghiệm của Nam Mỹ và Châu Âu tham gia. Đã nghiên cứu trên 14 mẫu mù, bao gồm bột thịt và bột xương, thức ăn cho chó, thức ăn cho sóc chinchilla, thức ăn dạng hạt cho chim, hạt đậu tương, ngô ủ chua, thức ăn xanh, cỏ khô, cỏ alfalfa, thức ăn thay thế sữa, albumin, thức ăn viên cho lợn, hạt hướng dương, protein block (có urê) và bột cá. Kết quả xem Bảng A.1.
Độ thu hồi nitơ từ hợp chất chuẩn là 100,1% đối với axetanilit và 98,8% đối với tryptophan.
Bảng A.1 – Kết quả phép thử liên phòng thử nghiệm đầu tiên
| Thông số | Mẫu | |||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | |
| Protein block | Thức ăn viên cho lợn | Ngô ủ chua | Cỏ khô | Bột cá | Thức ăn cho chó | Thức ăn cho sóc chinchilla | Albumin | Thức ăn dạng hạt cho chim | Bột thịt và bột xương | Thức ăn thay thế sữa | Hạt đậu tương | Hạt hướng dương | Cây họ đậu khô | |
| Số phòng thử nghiệm giữ lại sau khi trừ ngoại lệ | 11 | 11 | 13 | 12 | 12 | 12 | 10 | 11 | 12 | 12 | 12 | 11 | 12 | 12 |
| Hàm lượng protein thô trung bình, | 40,20 | 37,00 | 7,10 | 7,10 | 64,60 | 24,50 | 18,10 | 79,10 | 13,50 | 50,10 | 20,80 | 38,80 | 17,40 | 18,80 |
| Độ lệch chuẩn lặp lại, sr, % protein thô | 0,20 | 0,20 | 0,20 | 0,10 | 0,50 | 0,20 | 0,20 | 0,30 | 0,10 | 0,90 | 0,30 | 0,40 | 0,40 | 0,30 |
| Hệ số biến thiên lặp lại, % | 0,40 | 0,50 | 1,90 | 1,90 | 0,70 | 0,80 | 0,80 | 0,40 | 0,80 | 1,80 | 1,30 | 0,90 | 2,30 | 1,40 |
| Giới hạn lặp lại, r(= 2,8 sr), % protein thô | 0,50 | 0,50 | 0,40 | 0,40 | 1,30 | 0,60 | 0,40 | 0,90 | 0,30 | 2,60 | 0,80 | 1,00 | 1,10 | 0,70 |
| Tỷ số Horwitz, HorRata | 0,3 | 0,3 | 1,0 | 1,0 | 0,5 | 0,5 | 0,5 | 0,3 | 0,5 | 1,3 | 0,8 | 0,6 | 1,3 | 0,8 |
| Độ lệch chuẩn tái lập, sR, % protein thô | 0,30 | 0,20 | 0,20 | 0,10 | 0,70 | 0,20 | 0,20 | 0,40 | 0,20 | 0,90 | 0,30 | 0,40 | 0,40 | 0,30 |
| Hệ số biến thiên tái lập % | 0,70 | 0,60 | 2,70 | 1,90 | 1,00 | 0,90 | 0,80 | 0,50 | 1,30 | 1,80 | 1,30 | 1,00 | 2,30 | 1,40 |
| Giới hạn tái lập, R(= 2,8 sR) % protein thô | 0,80 | 0,60 | 0,50 | 0,40 | 1,90 | 0,60 | 0,40 | 1,00 | 0,50 | 2,60 | 0,80 | 1,00 | 1,10 | 0,70 |
| Tỷ số Horwitz, HorRata | 0,3 | 0,2 | 0,9 | 0,6 | 0,5 | 0,4 | 0,3 | 0,2 | 0,5 | 0,8 | 0,5 | 0,4 | 0,9 | 0,5 |
| a Giá trị 1 thường cho thấy độ chụm đạt yêu cầu, trong khi giá trị > 2 cho thấy độ chụm không đạt yêu cầu, nghĩa là quá biến đổi với hầu hết các mục đích phân tích hoặc trong trường hợp biến thiên thu được là lớn hơn dự kiến cho các loại phương pháp được sử dụng ([9],[10]). | ||||||||||||||
Phép thử liên phòng thử nghiệm thứ hai sử dụng phát hiện điểm cuối phép đo màu được tổ chức ở Thái Lan năm 2004, bao gồm 26 phòng thử nghiệm từ các thành phần nhà nước và công lập theo ISO 5725-2[3]. Bảy mẫu được thử nghiệm. Kết quả xem Bảng A.2.
Bảng A.2 – Kết quả phép thử liên phòng thử nghiệm thứ hai
| Thông số | Mẫu a | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| thức ăn cho cá, dạng viên nổi nhỏ (được dập ép) | Thức ăn cho cá, dạng viên nổi lớn (được dập ép) | Thức ăn cho tôm, dạng vụn | thức ăn cho tôm, dạng viên nổi lớn | thức ăn cho tôm, dạng viên nổi nhỏ | thức ăn cho ấu trùng, flake | hạt lúa mì | |
| Số phòng thử nghiệm giữ lại sau khi trừ ngoại lệ | 24 | 24 | 24 | 25 | 26 | 26 | 25 |
| Hàm lượng protein thô trung bình, | 33,65 | 29,18 | 40,48 | 37,73 | 38,04 | 51,07 | 15,76 |
| Độ lệch chuẩn lặp lại, sr, % protein thô | 0,20 | 0,13 | 0,10 | 0,17 | 0,14 | 0,18 | 0,10 |
| Hệ số biến thiên lặp lại, % | 0,58 | 0,44 | 0,24 | 0,44 | 0,37 | 0,35 | 0,63 |
| Giới hạn lặp lại, r (= 2,8 sr) | 0,55 | 0,36 | 0,28 | 0,46 | 0,39 | 0,50 | 0,28 |
| Tỷ số Horwitz, HorRat | 0,38 | 0,28 | 0,16 | 0,29 | 0,24 | 0,24 | 0,36 |
| Độ lệch chuẩn tái lập, sR, % protein thô | 0,40 | 0,38 | 0,42 | 0,49 | 0,45 | 0,64 | 0,25 |
| Hệ số biến thiên tái lập, % | 1,18 | 1,31 | 1,03 | 1,31 | 1,18 | 1,26 | 1,59 |
| Giới hạn tái lập, R (= 2,8 sR), % protein thô | 1,11 | 1,07 | 1,17 | 1,38 | 1,26 | 1,80 | 0,70 |
| Tỷ số Horwitz, HorRat | 0,50 | 0,54 | 0,45 | 0,56 | 0,51 | 0,57 | 0,60 |
| a Phương pháp lấy mẫu: TCVN 4325 (ISO 6497)[5]. | |||||||
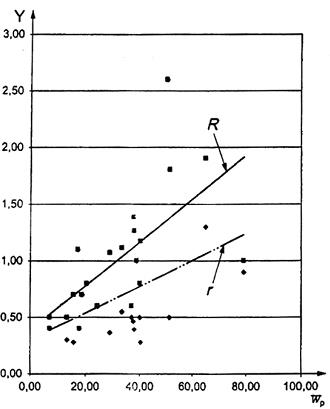
CHÚ DẪN
![]() hàm lượng protein thô trung bình, % khối lượng
hàm lượng protein thô trung bình, % khối lượng
Y các giới hạn độ chụm, % khối lượng
r giới hạn lặp lại, r = 0,005 ![]() + 0,234
+ 0,234
R giới hạn tái lập, R = 0,029![]() + 0,193
+ 0,193
Hình A.1 – Mối liên hệ giữa các giá trị độ chụm (r, R) và h hàm lượng protein thô trung bình, ![]()
PHỤ LỤC B
(Tham khảo)
CÁC KẾT QUẢ CỦA PHÉP THỬ THÀNH THẠO; SO SÁNH ĐIỂM KẾT THÚC CỦA PHƯƠNG PHÁP SO MÀU VÀ PHÉP ĐO ĐIỆN THẾ
Trong chương trình thử nghiệm thành thạo của Hà Lan, được tổ chức bởi Kwaliteitsdenst Landbouwkundige Laboratoria (KDLL), cả hai phép xác định điểm kết thúc chuẩn độ phương pháp so màu và đo điện thế được áp dụng cho các loại thức ăn chăn nuôi khác nhau. Các kết quả nêu trong Bảng B.1 thể hiện cả hai phương pháp có các kết quả phát hiện điểm kết thúc chuẩn độ cho kết quả tương đương.
Bảng B.1 – Thống kê đánh giá phép thử nghiệm thành thạo
| Thông số | Mẫu | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| Thức ăn cho mèo | Thức ăn cho mèo | Ngô | Ngô | Đậu tương ép | Thức ăn cho lợn | |
| Xác định bằng phép so màu | ||||||
| Hàm lượng protein thô trung bình, | 29,8 | 29,7 | 9,2 | 9,2 | 42,2 | 16,0 |
| Độ lệch chuẩn, scol, % khối lượng | 0,38 | 0,33 | 0,17 | 0,13 | 0,63 | 0,24 |
| Số phòng thử nghiệm, Ncol | 24 | 24 | 25 | 25 | 25 | 22 |
| Xác định bằng phép đo điện thế | ||||||
| Hàm lượng protein thô trung bình, | 29,9 | 29,9 | 9,3 | 9,2 | 42,3 | 16,0 |
| Độ lệch chuẩn, spot, % khối lượng | 0,25 | 0,43 | 0,13 | 0,15 | 0,60 | 0,21 |
| Số phòng thử nghiệm, Npot | 14 | 14 | 14 | 14 | 15 | 15 |
| Phép thử F về sự tương đương của sự biến thiên | ||||||
| F | 2,28 | 1,65 | 1,76 | 1,30 | 1,11 | 1,39 |
| Fcrit | 2,43 | 2,18 | 2,42 | 2,15 | 2,35 | 2,38 |
| Kết luận | Không khác nhau đáng kể | Không khác nhau đáng kể | Không khác nhau đáng kể | Không khác nhau đáng kể | Không khác nhau đáng kể | Không khác nhau đáng kể |
| Phép thử t về sự tương đương của giá trị trung bình | ||||||
| tstat | 0,94 | 1,40 | 0,48 | 0,85 | 0,55 | 0,12 |
| tcrit | 2,03 | 2,03 | 2,03 | 2,03 | 2,02 | 2,03 |
| Kết luận | Không khác nhau đáng kể | Không khác nhau đáng kể | Không khác nhau đáng kể | Không khác nhau đáng kể | Không khác nhau đáng kể | Không khác nhau đáng kể |
| CHÚ THÍCH Mức ý nghĩa = 5%; F < Fcrit = không khác nhau đáng kể; tstat < tcrit = không khác nhau đáng kể. | ||||||
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] TCVN 7149:2007 (ISO 385:2005) Dụng cụ thí nghiệm bằng thủy tinh – Buret.
[2] TCVN 6910-1:2001 (ISO 5725-1:1994) Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo – Phần 1: Nguyên tắc và định nghĩa chung.
[3] TCVN 6910-2:2001 (ISO 5725-2:1994) Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo – Phần 2: Phương pháp cơ bản xác định độ lặp lại và độ tái lập của phương pháp đo tiêu chuẩn.
[4] TCVN 4328-1:2007 (ISO 5983-1:2005) Thức ăn chăn nuôi – Xác định hàm lượng nitơ và tính hàm lượng protein thô – Phần 1: Phương pháp Kjeldahl
[5] TCVN 4325 (ISO 6497), Thức ăn chăn nuôi – Lấy mẫu.
[6] ISO 8655-2, Piston – operated volumetric apparatus – Part 2: Piston pipettes.
[7] ISO 8655-3, Piston – operated volumetric apparatus – Part 3: Piston burettes
[8] ISO 8655-5, Piston – operated volumetric apparatus – Part 5: Dispensers
[9] THIEX, N.J., MANSON, S., PERSSON, J.A. Determination of crude protein in animal feed, forage, grain and oilseeds by using block digestion with a copper catalyst and steam distillation into boric axit: Collaborative study. J.AOAC Int. 2002, 85, pp.309-317.
[10] HORWITZ, W. Evaluation of analytical methods used for regulation foods and drugs. Anal. Chem. 1982 54, pp.67A- 76A.
[11] PEELER, J.T., HORWITZ, W., ALBERT,R. Precision parameters of standard methods of analysis for dairy products. J. Assoc. Off. Anal. Chem. 1989, 72, pp.784-806
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 4328-2:2011 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 4328-2:2011 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 4328-2:2011 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 4328-2:2011 DOC (Bản Word)