- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 12551:2019 ISO 18453:2004 Khí thiên nhiên - Hàm lượng nước và điểm sương
| Số hiệu: | TCVN 12551:2019 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Công nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
08/08/2019 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 12551:2019
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 12551:2019
TIÊU CHUẨN QUỐC GIA
TCVN 12551:2019
ISO 18453:2004
KHÍ THIÊN NHIÊN - SỰ TƯƠNG QUAN GIỮA HÀM LƯỢNG NƯỚC VÀ ĐIỂM SƯƠNG THEO NƯỚC
Natural gas - Correlation between water content and water dew point
Lời nói đầu
TCVN 12551:2019 hoàn toàn tương đương với ISO 18453:2004.
TCVN 12551:2019 do Ban kỹ thuật Tiêu chuẩn quốc gia TCVN/TC193 Sản phẩm khí biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Tiêu chuẩn này đưa ra mối quan hệ toán học tương đối giữa hàm lượng nước và điểm sương theo nước trong khí thiên nhiên. Phương pháp tính toán được xây dựng bởi GERG1); có thể áp dụng cả hai phương pháp, nghĩa là hoặc tính hàm lượng nước hoặc tính điểm sương theo nước. Các thông tin liên quan đến nguyên lý động nhiệt học được nêu trong Phụ lục A; các thông tin liên quan đến truy xuất nguồn gốc, các ứng dụng và các độ không đảm bảo kèm theo với công việc này được nêu trong Phụ lục B.
Một số các vấn đề về vận hành trong công nghiệp khí thiên nhiên có thể được truy xuất hàm lượng nước trong khí thiên nhiên. Ngay cả khi hàm lượng hơi nước thấp trong khí, thay đổi các điều kiện áp suất và nhiệt độ vận hành có thể làm cho nước ngưng tụ và do vậy dẫn đến các vấn đề về ăn mòn, hydrat hóa hoặc tạo thành băng. Để tránh các vấn đề này, các thiết bị hydrat hóa đắt tiền đã được lắp đặt bởi các công ty khí thiên nhiên. Thiết kế và chi phí của các thiết bị này phụ thuộc vào sự hiểu biết chính xác hàm lượng nước tại điểm sương và hàm lượng nước được yêu cầu (thỏa thuận hợp đồng).
Các thiết bị do các cải tiến thiết bị đo độ ẩm trong thập niên trước tập trung vào phép xác định hàm lượng nước hơn là điểm sương theo nước. Do vậy, nếu hàm lượng nước được xác định, mối tương quan được yêu cầu để biểu thị điểm sương theo nước.
Nó tiếp tục được trình bày dải độ không đảm bảo của các mối tương quan đang có có thể được cải thiện.
Do đó, mối tương quan chính xác hơn, phụ thuộc vào thành phần, được xây dựng thành công trên cơ sở dữ liệu mới.
Tiêu chuẩn này nhằm tiêu chuẩn hóa quy trình tính toán được xây dựng bởi GERG liên quan đến mối quan hệ giữa hàm lượng nước và điểm sương theo nước trong lĩnh vực khí thiên nhiên điển hình để giao nhận thương mại.
KHÍ THIÊN NHIÊN - SỰ TƯƠNG QUAN GIỮA HÀM LƯỢNG NƯỚC VÀ ĐIỂM SƯƠNG THEO NƯỚC
Natural gas - Correlation between water content and water dew point
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp cung cấp cho người sử dụng mối liên hệ về mặt toán học đáng tin cậy giữa hàm lượng nước và điểm sương theo nước trong khí thiên nhiên khi biết một trong hai giá trị. Phương pháp tính toán do GERG xây dựng, được áp dụng với cả phép tính hàm lượng nước và điểm sương theo nước.
Tiêu chuẩn này quy định độ không đảm bảo đối với sự tương quan nhưng không định lượng độ không đảm bảo đo.
2 Thuật ngữ và định nghĩa
Tiêu chuẩn này áp dụng các thuật ngữ và định nghĩa sau.
2.1
Sự tương quan (correlation)
Mối liên hệ giữa hai hoặc một vài biến ngẫu nhiên trong phạm vi phân bố của hai hoặc nhiều hơn các biến ngẫu nhiên.
[ISO 3534-1]
CHÚ THÍCH: Biểu thị của dải nhiệt độ, áp suất và thành phần mà sự tương quan có hiệu lực được nêu trong Điều 3.
2.2
Dải làm việc (working range)
Dải các thông số mà sự tương quan được xác nhận hiệu lực.
2.3
Dải làm việc mở rộng (extended working range)
Dải các thông số mà sự tương quan được xây dựng, nhưng ngoài dải mà sự tương quan được xác nhận hiệu lực.
2.4
Độ không đảm bảo của sự tương quan (uncertainty of the correlation)
Độ lệch tuyệt đối của giá trị được tính từ cơ sở dữ liệu thực nghiệm
CHÚ THÍCH: Điều này không bao gồm bất kỳ độ không đảm bảo đo trong lĩnh vực
2.5
Hệ số không trung tâm (acentric factor)
Thông số đặc trưng cho tính không trung tâm hoặc độ không tròn của phân tử
CHÚ THÍCH: Định nghĩa này được lấy từ tài liệu tham khảo [1] ở Thư mục tài liệu tham khảo
2.6
Các điều kiện quy chiếu thông thường (normal reference conditions)
Các điều kiện quy chiếu về áp suất, nhiệt độ và độ ẩm (trạng thái bão hòa) bằng với 101,325 kPa và 273,15 K đối với khí thực, khô.
[ISO 14532:2001]
2.7
Khả năng truy xuất (traceability)
Đặc tính của kết quả đo hoặc giá trị của một chuẩn mà nó có thể liên quan đến các chuẩn quy chiếu đã công bố, thường là các chuẩn quốc tế hoặc quốc gia, thông qua một chuỗi so sánh liên tục tất cả các độ không đảm bảo đã công bố.
[ISO 14532:2011]
3 Xây dựng sự tương quan
Trong quá khứ, GERG đã xác định sự cần thiết đối với việc chuyển đổi chính xác giữa hàm lượng nước và điểm sương theo nước đối với khí thiên nhiên có các đặc tính khí thương phẩm. Để đạt được mục tiêu này, GERG đã xác định một chương trình nghiên cứu. Ở giai đoạn đầu tiên của dự án, số liệu đáng tin cậy về hàm lượng nước cùng với số liệu về điểm sương của nước được thu thập đối với một số khí thiên nhiên đối với dải nhiệt độ điểm sương được quan tâm: -15 °C đến +5 °C và đối với dải áp suất (tuyệt đối) được quan tâm: 0,5 MPa đến 10 MPa. Cùng với các phép đo trên bảy khí thiên nhiên đại diện, các phép đo cũng được thực hiện trên hệ thống đôi chính metan/nước. Quy trình được sử dụng để thu thập số liệu được đo là phương pháp bão hòa.
Lấy các giá trị đã xác định đối với độ lặp lại và độ tái lập của thiết bị Karl Fischer làm tiêu chí nhất quán đối với tất cả hàm lượng nước được đo, chỉ một vài giá trị không đồng nhất được phát hiện. Những giá trị này chủ yếu ở dải hàm lượng nước thấp (dải nhiệt độ thấp, áp suất cao). Các giá trị không đạt kiểm tra độ đồng nhất hoặc bị loại bỏ hoặc trong một số trường hợp, được đánh giá thấp hơn nhiều trong vung (kho) dữ liệu. Trong hầu hết các trường hợp, những giá trị này được thay thế bằng các phép đo lặp lại được thực hiện tại cùng các điều kiện về nhiệt độ và áp suất.
Thông tin chi tiết về quy trình thực nghiệm và thành phần của khí thiên nhiên được sử dụng trong các thí nghiệm có thể thấy ở chuyên khảo GERG[2].
Mối quan hệ đã xây dựng được đánh giá ở các nhiệt độ điểm sương từ -15 °C đến +5 °C và áp suất (tuyệt đối) từ 0,5 MPa đến 10 MPa.
Khí thiên nhiên đại diện được sử dụng để xác nhận sự tương quan được lấy mẫu về mặt kỹ thuật không có glycol, metanol, hydrocacbon lỏng và có hàm lượng H2S lớn nhất là 5 mg/m3 (ở điều kiện thông thường). Không có nỗ lực điều tra nào được thực hiện để đánh giá tác động của độ không đảm bảo gây ra bởi các tạp chất như vậy.
Nền tảng nhiệt động học của mối quan hệ đã xây dựng khiến nó có thể mở rộng dải áp dụng bên ngoài dải làm việc đến nhiệt độ -50 °C đến +40 °C và áp suất (tuyệt đối) từ 0,1 MPa đến 30 MPa với độ không đảm bảo chưa được biết.
Giả định rằng sự tương quan được diễn giải là tương hỗ giữa hàm lượng nước và điểm sương của nước. Lưu ý rằng mối quan hệ này được dẫn xuất (rút ra) từ các điều kiện phòng thí nghiệm sử dụng một số thành phần của khí thiên nhiên được lấy mẫu tại hiện trường. Theo các điều kiện hoạt động (vận hành) thực tế tại hiện trường, độ không đảm bảo bổ sung đáng kể được tạo thành.
Bên cạnh độ không đảm bảo trong quá trình chuyển đổi của chính phép đo, độ không đảm bảo của các giá trị được đo cũng cần được xem xét.
Trừ khi có các quy định khác, thể tích được công bố trong các điều kiện quy chiếu thông thường (2.6).
4 Dải áp dụng và độ không đảm bảo của sự tương quan
4.1 Dải làm việc
Dải làm việc nằm trong các dải được xác định ở trên và độ không đảm bảo kèm theo như sau.
a) Dải áp suất: 0,5 MPa ≤ p ≤ 10 10 MPa
b) Dải điểm sương: -15°C ≤ t ≤ +5°C
c) Dải thành phần: sự tương quan chấp nhận nước và các cấu tử được nêu trong Bảng 1 là các thông số đầu vào. Phương pháp tính toán có thể áp dụng với khí thiên nhiên đáp ứng các giới hạn được liệt kê ở Bảng 1. Các ví dụ về sự ảnh hưởng của thành phần được nêu tại Phụ lục C.
Bảng 1 - Dải thành phần theo nồng độ % mol
| Hợp chất | Nồng độ % mol |
| Metan (CH4) | ≥ 40,0 % |
| Nitơ (N2) | ≤ 55,0 % |
| Cacbon dioxit (CO2) | ≤ 30,0 % |
| Etan (C2H6) | ≤ 20,0 % |
| Propan (C3H6) | ≤ 4,5 % |
| 2-Metyl propan (C4H10) | ≤ 1,5 % |
| n-Butan (C4H10) | ≤ 1,5% |
| 2,2-Dimetyl propan (C5H12) | ≤ 1,5% |
| 2-Metyl butan (C5H12) | ≤ 1,5% |
| n-Pentan (C5H12) | ≤ 1,5% |
| C6 (tổng của hexan + các hydrocacbon nặng hơn) (C6H14) | ≤ 1,5 % |
| CHÚ THÍCH: C6+ được xử lý như là n-hexan. | |
Trong phạm vi dải nêu trên độ không đảm bảo như sau:
- Đối với điểm sương theo nước được tính từ hàm lượng nước: ± 2 °C
- Đối với hàm lượng nước được tính từ điểm sương theo nước:
1) βw < 580 mg/m3: 0,14 + 0,021 × βw ± 20 (mg/m3);
2) βw ≥ 580 mg/m3: -18,84 + 0,0537 × βw ± 20 (mg/m3).
Đối với việc áp dụng những công thức này, tham khảo Phụ lục B và các ví dụ được nêu ở Phụ lục C.
CHÚ THÍCH: Việc chuyển đổi giữa các điều kiện quy chiếu thông thường và các điều kiện quy chiếu tiêu chuẩn được nêu trong TCVN 12548 (ISO 13443).
4.2 Dải làm việc mở rộng
Mở rộng dải áp dụng có thể được ngoại suy trong phạm vi các dải sau, tuy nhiên các độ không đảm bảo kèm theo chưa được biết.
a) Dải áp suất: dải mở rộng của áp suất (tuyệt đối) là 0,1 MPa ≤ p < 0,5 MPa và 10 MPa < p ≤ 30 MPa;
b) Dải nhiệt độ: dải mở rộng của nhiệt độ điểm sương là -50 °C ≤ t < -15 °C và +5 °C < t ≤ + 40 °C;
c) Dải thành phần: dải các cấu tử tương tự như 4.1.
5 Sự tương quan
5.1 Tổng quan
Phương pháp tương quan được dựa trên phương trình trạng thái Peng và Robinson (xem Phụ lục A để biết thông tin chi tiết).
Để đảm bảo tính toán chính xác áp suất hơi nước trên băng đá và chất lỏng, cần chia hàm α mới thành hai phần:
- Dải nhiệt độ 223,15 K đến 273,16 K, nghĩa là số liệu áp suất hơi nước trên băng đá;
- Dải nhiệt độ 273,16 K đến 313,15 K, nghĩa là số liệu áp suất hơi nước trên nước dạng lỏng.
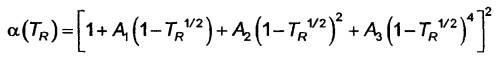
trong đó TR là nhiệt độ rút gọn như sau:
![]()
Các hệ số hàm α mới được liệt kê như sau
a) Đối với dải: 223,15 K ≤ T < 273,16 K
1) A1 = 0,106025
2) A2 = 2,683845
3) A3 = -4,75638
b) Đối với dải: 273,16 K ≤ T < 313,15 K
1) A1 = 0,905436
2) A2 = -0,213781
3) A3 = 0,26005
Ước lượng tin cậy đối với thông số thu được từ bộ số liệu cân bằng lỏng - hơi phù hợp.
Các thông số tối ưu của các thông số hai cấu tử kij được tìm bằng cách thỏa mãn tiêu chí thống kê xác định (tối thiểu hóa hàm mục tiêu qua thuật toán phù hợp bình phương nhỏ nhất). Đối với các hệ hai cấu tử, cacbon dioxit/nước, metan/nước và etan/nước, cần sử dụng các thông số tương tác phụ thuộc vào nhiệt độ để đạt được sự mô tả thỏa đáng cân bằng lỏng - hơi). Sự phụ thuộc vào nhiệt độ được đưa ra theo phương trình:
![]()
Việc xác định kij (T) có lợi thế vì kij bằng với kij,0 khi nhiệt độ bằng 0 °C. Các thông số của hệ nước hai cấu tử được tối ưu hóa đối với dải làm việc mở rộng của sự tương quan này (-50 °C đến 40 °C). Không được phép ngoại suy số liệu trên dải làm việc mở rộng.
Số liệu cấu tử tinh khiết được liệt kê ở Bảng 2 và tổng quát về thông số tương quan hai cấu tử đầy đủ được nêu ở Bảng 3.
Bảng 2 - Số liệu thành phần thuần túy (các đặc tính hợp chất được sử dụng trong phép tính)
| Cấu tử | ω | pc | Tc | Nguồn |
| Nước (H2O) | 0,34437 | 220,64 | 647,14 | Knapp (1982) |
| Nitơ (N2) | 0,03593 | 33,99 | 126,26 | Knapp (1982) |
| Cacbon dioxit (CO2) | 0,22394 | 73,86 | 304,21 | Knapp (1982) |
| Metan (CH4) | 0,0114 | 45,99 | 190,55 | Knapp (1982) |
| Etan (C2H6) | 0,09909 | 48,72 | 305,33 | Knapp (1982) |
| Propan (C3H8) | 0,15611 | 42,46 | 369,85 | Knapp (1982) |
| 2-Metyl propan (i-C4H10) | 0,18465 | 36,4 | 407,85 | Knapp (1982) |
| n-Butan (n-C4H10) | 0,19777 | 37,84 | 425,14 | Knapp (1982) |
| 2,2-Dimetyl propan (neo-C5H12) | 0,19528 | 31,96 | 433,75 | Knapp (1982) |
| 2-Metyl butan (i-C5H12) | 0,22606 | 33,7 | 460,39 | Knapp (1982) |
| n-Pentan (n-C5H12) | 0,24983 | 33,64 | 469,69 | Knapp (1982) |
| n-hexan (C6H14) | 0,296 | 30,2 | 507,85 | Knapp (1982) |
| ω là hệ số không trung tâm pc là áp suất tới hạn, tính theo bar Tc là nhiệt độ tới hạn, tính theo Kelvins | ||||
Bảng 3 - Các thông số tương quan nhị nguyên
| Cấu tử i | Cấu tử j | kij,0 | kij,1 | Nguồn |
| Nước | Nitơ | 0,4800 | 0 | GERG [2] |
| Nước | Cacbon dioxit | 0,184 | 0,236 | GERG [2] |
| Nước | Metan | 0,651 | -1,385 | GERG [2] |
| Nước | Metan | 0,635 | -0,93 | GERG [2] |
| Nước | Propan | 0,53 | 0 | GERG [2] |
| Nước | n-Butan | 0,69 | 0 | GERG [2] |
| Nước | n-Pentan | 0,5 | 0 | GERG [2] |
| Nước | n-Hexane | 0,5 | 0 | GERG [2] |
| Nước | 2-Metyl propan | 0,69 | 0 | GERG [2] |
| Nước | 2,2-Dimetyl propan | 0,5 | 0 | GERG [2] |
| Nước | 2-Metyl butan | 0,5 | 0 | GERG [2] |
| Nitơ | Cacbon dioxit | -0,0170 | 0 | Knapp (1982) [9] |
| Nitơ | Metan | 0,0311 | 0 | Knapp (1982) [9] |
| Nitơ | Metan | 0,0515 | 0 | Knapp (1982) [9] |
| Nitơ | Propan | 0,0852 | 0 | Knapp (1982) [9] |
| Nitơ | n-Butan | 0,0800 | 0 | Knapp (1982) [9] |
| Nitơ | n-Pentan | 0,1000 | 0 | Knapp (1982) [9] |
| Nitơ | n-Hexan | 0,1496 | 0 | Knapp (1982) [9] |
| Nitơ | 2-Metyl propan | 0,1033 | 0 | Knapp (1982) [9] |
| Nitơ | 2,2-Dimetyl propan | 0,0930 | 0 | Avlonitis (1994) [8] |
| Nitơ | 2-Metyl butan | 0,0922 | 0 | Knapp (1982) [9] |
| Cacbon dioxit | Metan | 0,0919 | 0 | Knapp (1982) [9] |
| Cacbon dioxit | Metan | 0,1322 | 0 | Knapp (1982) [9] |
| Cacbon dioxit | Propan | 0,1241 | 0 | Knapp (1982) [9] |
| Cacbon dioxit | n-Butan | 0,1333 | 0 | Knapp (1982) [9] |
| Cacbon dioxit | n-Pentan | 0,1222 | 0 | Knapp (1982) [9] |
| Cacbon dioxit | n-Hexan | 0,1100 | 0 | Knapp (1982) [9] |
| Cacbon dioxit | 2-Metyl propan | 0,1200 | 0 | Knapp (1982) [9] |
| Cacbon dioxit | 2,2-Dimetyl propan | 0,1260 | 0 | Kordas (1994) [10] |
| Cacbon dioxit | 2-Metyl butan | 0,1219 | 0 | Knapp (1982) [9] |
| Metan | Metan | -0,0026 | 0 | Knapp (1982) [9] |
| Metan | Propan | 0,0140 | 0 | Knapp (1982) [9] |
| Metan | n-Butan | 0,0133 | 0 | Knapp (1982) [9] |
| Metan | n-Pentan | 0,0230 | 0 | Knapp (1982) [9] |
| Metan | n-Hexan | 0,0422 | 0 | Knapp (1982) [9] |
| Metan | 2-Metyl propan | 0,0256 | 0 | Knapp (1982) [9] |
| Metan | 2,2-Dimetyl propan | 0,0180 | 0 | Kordas (1995) [10] |
| Metan | 2-Metyl butan | -0,0056 | 0 | Knapp (1982) [9] |
| Metan | Propan | 0,0011 | 0 | Knapp (1982) [9] |
| Metan | n-Butan | 0,0096 | 0 | Knapp (1982) [9] |
| Metan | n-Pentan | 0,0078 | 0 | Knapp (1982) [9] |
| Metan | n-Hexan | -0,0100 | 0 | Knapp (1982) [9] |
| Metan | 2-Metyl propan | -0,0067 | 0 | Knapp (1982) [9] |
| Metan | 2,2-Dimetyl propan | 0,0230 | 0 | Nishiumi (1988) [7] |
| Metan | 2-Metyl butan | 0,0160 | 0 | Nishiumi (1988) [7] |
| Propan | n-Butan | 0,0033 | 0 | Knapp (1982) [9] |
| Propan | n-Pentan | 0,0267 | 0 | Knapp (1982) [9] |
| Propan | n-Hexan | 0,0007 | 0 | GERG [2] |
| Propan | 2-Metyl propan | -0,0078 | 0 | Knapp (1982) [9] |
| Propan | 2,2-Dimetyl propan | 0 | 0 |
|
| Propan | 2-Metyl butan | 0,0111 | 0 | Knapp (1982) PI |
| 2-Metyl propan | n-Butan | -0,0004 | 0 | GERG [2] |
| 2-Metyl propan | n-Pentan | 0 | 0 |
|
| 2-Metyl propan | n-Hexan | 0 | 0 |
|
| 2-Metyl propan | 2,2-Dimetyl propan | 0 | 0 |
|
| 2-Metyl propan | 2-Metyl butan | 0 | 0 |
|
| n-Butan | n-Pentan | 0,0174 | 0 | Knapp (1982) [9] |
| n-Butan | n-Hexan | -0,0056 | 0 | K-BP [2][12] |
| n-Butan | 2,2-Dimetyl propan | 0 | 0 |
|
| n-Butan | 2-Metyl butan | 0 | 0 |
|
| 2,2-Dimetyl propan | 2-Metyl butan | 0 | 0 |
|
| 2,2-Dimetyl propan | n-Pentan | 0 | 0 |
|
| 2,2-Dimetyl propan | n-Hexan | 0 | 0 |
|
| 2-Metyl butan | n-Pentan | 0,060 | 0 | Knapp (1982) [9] |
| 2-Metyl butan | n-Hexane | 0 | 0 |
|
| n-Pentan | n-Hexane | 0 | 0 |
|
5.2 Đầu vào và đầu ra
5.2.1 Đầu vào
Các thông số đầu vào đối với sự tương quan hàm lượng nước/điểm sương theo nước là:
a) Thành phần khí khô (% mol)
b) Áp suất tuyệt đối (bar)
c) Hàm lượng nước (mg/m3) hoặc điểm sương theo nước (°C)
5.2.2 Đầu ra
Sự tương quan tính theo hoặc điểm sương theo nước (°C) hoặc hàm lượng nước (mg/m3).
Phụ lục A
(Quy định)
Các nguyên lý nhiệt động học
CHÚ THÍCH: Phụ lục này trình bày chi tiết đối với Điều 5 và tài liệu tham khảo [6] mô tả chương trình PC để tính hàm lượng nước hoặc điểm sương theo nước.
A.1 Nhiệt động học cân bằng pha
A.1.1 Tổng quan
Nguyên lý thứ hai của nhiệt động học xác định trạng thái cân bằng nhiệt động học của hệ kín là trạng thái entropy lớn nhất. Entropy, S, của hệ cô lập chỉ có thể tăng, vì vậy trạng thái cân bằng ban đầu của hệ cô lập là trạng thái bền.
Khi hệ bị xáo trộn ở vùng cân bằng, hệ quay về trạng thái cân bằng ngay khi sự xáo trộn dừng lại. Do vậy, điều kiện cân bằng được viết như sau:
∆S < 0 (A.1)
Sự nhiễu có thể được phát triển đối với tất cả các bậc:
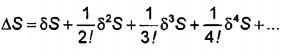 (A.2)
(A.2)
Trong đó δ biểu thị các dạng thức vi phân.
Khi số hạng đối với tất cả các bậc lớn hơn 1 là số âm:
δS = O và δ2S < 0 δ3S < 0δ4S < 0 ... (A.3)
Trạng thái cân bằng ổn định.
Khi số hạng bậc hai là số dương:
δS = O và δ2S > 0 (A.4)
Trạng thái cân bằng không ổn định.
Khi một số số hạng bậc cao hơn là số dương:
∆S = 0 và δ2S < 0 nhưng δ3S > 0 δ4S > 0 (A.5)
Trạng thái cân bằng giả ổn định
Giới hạn giả ổn định được xác định như sau
δ2S = 0 (A.6)
Nghiên cứu trạng thái cân bằng nhiệt động học của hệ được thực hiện trên cơ sở các thế nhiệt động; tính theo năng lượng tự do Gibbs, G, tại giá trị T và p cố định, trạng thái cân bằng được xác định bằng giá trị cực tiểu:
dG = 0 và d2G > 0 (A.7)
Tương tự, tại giá trị T và V cố định, trạng thái cân bằng sẽ được xác định bằng cực tiểu của năng lượng tự do Helmholtz A. Đối với một hệ bao gồm các hợp phần “nc" được phân bố trong các pha “nФ”, năng lượng tự do nhỏ nhất là:
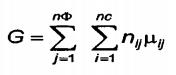 (A.8)
(A.8)
Với các ràng buộc sau
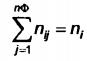 (A.9)
(A.9)
trong đó
ni là tổng số mol của cấu tử i;
nij là số mol của cấu tử i trong pha j;
μij là thế hóa học của cấu tử i trong pha j.
Như vậy, nghiên cứu trực tiếp trạng thái cân bằng là sự tối thiểu hóa hàm số của các biến (nФ, nc) với nc ràng buộc. Sự đơn giản của tuyên bố về vấn đề này che dấu các khó khăn thực tế của nghiên cứu.
Áp dụng định luật thứ nhất nhiệt động học đối với hệ đóng đồng thể, đặc biệt hơn đối với các lưu chất có thành phần không đổi hoặc tinh khiết, phương trình sau được rút ra.
dU = dW + dQ (A.10)
Với quá trình thuận nghịch, từ định luật thứ hai nhiệt động học
dW = -pdV (A.11)
và
dQ = TdS (A.12)
Kết hợp các phương trình (A.10), (A.11) và (A.12) thu được
dU = TdS - pdV (A.13)
Hệ đóng dị thể chứa hai hoặc nhiều pha. Trong hệ như vậy, mỗi pha có thể được xem như một hệ mở đồng thể, vì bất kỳ cấu tử nào trong hệ đều có thể di chuyển qua các lớp biên pha, từ pha này sang pha khác.
Nội năng, U, của hệ mở đồng thể phụ thuộc vào các biến bổ sung: lượng mỗi cấu tử trong hệ. Lượng các cấu tử có thể được biểu diễn bằng số mol của các cấu tử.
Với hệ mở chứa N cấu tử,
U = U(S,V,n1,n2,…nN) (A.14)
Áp dụng quy tắc chuỗi với phương trình (A.14) để nhận được vi phân toàn phần
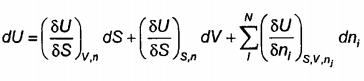 (A.15)
(A.15)
trong đó j đại diện cho tất cả các hợp phần ngoài i
Do

Sau đó kết phương trình (A.15) và (A.16) mang lại
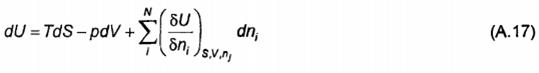
Đạo hàm riêng phần 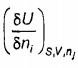 được gọi là “thế hóa học” và thường được biểu thị bằng μi
được gọi là “thế hóa học” và thường được biểu thị bằng μi

Vào năm 1923, G.N. Lewis giới thiệu hoạt áp, f, tương đương với hóa thế và được biểu thị bằng đơn vị áp suất
dμi = RTd(lnfi) (A.19)
Với khí thực, hoạt áp có thể coi như áp suất riêng phần đã hiệu chỉnh, được thể hiện bằng hệ số hoạt độ φi

Trong đó xi,v, phần mol của cấu tử i trong pha hơi xem xét.
Hệ số hoạt độ biểu thị sự sai lệch so với định luật khí lý tưởng. Do vậy, đối với các khí lý tưởng, hệ số hoạt độ bằng đơn vị.
A.1.2 Các điều kiện cân bằng
Sự tương đương của các thế hóa học của từng hợp phần trong hai pha là điều kiện cần cho cân bằng:
μi,l = μi,v đối với bất kỳ i = 1 đến nc
Tương tự được áp dụng với tính loãng dần sau
fi,l = fi,v đối với bất kỳ i=1 đến nc
Và đối với nhiệt độ và áp suất
Ti,l = Ti,v đối với bất kỳ i =1 đến nc
Phần lớn thuật toán tính toán cân bằng dựa vào những điều kiện này.
Khi đạt được điều kiện này, hệ số cân bằng được xác định bằng tỷ số của các hệ số hoạt độ:
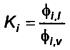 đối với bất kỳ i =1 đến nc
đối với bất kỳ i =1 đến nc
Trong hệ cân bằng lỏng - hơi hai cấu tử (chỉ số v = hơi, l = lỏng) bộ các phương trình được rút gọn thành:
Tl = TV
pl = pV (A.21)
fil = fiV (i = 1,2)
Điều kiện cân bằng (A.7) có thể được rút ra cho mỗi cấu tử i từ cân bằng chất (A.21) sử dụng định nghĩa về hệ số hoạt độ (A.20) trong đó xi là phần mol trong pha lỏng và yi là phần mol trong pha khí.
Фlixi = Фviyi (i = 1…..N) (A.22)
Mối quan hệ giữa hệ số hoạt độ của cấu tử i trong pha bất kỳ và các biến trạng thái của pha này thường được liên kết với các phương trình trạng thái nhiệt. Đối với phương trình trạng thái, tính theo áp suất, hệ số hoạt độ có dạng:
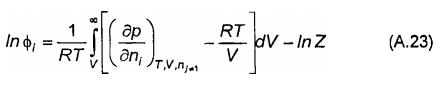
Với hệ số nén Z
![]() (A.24)
(A.24)
Hệ số nén là số đo sự sai lệch so với định luật khí lý tưởng, mà khi đó Z bằng đơn vị.
A.2 Phương trình trạng thái
A.2.1 Hợp chất tinh khiết
Phương trình trạng thái nhiệt cho biết mối quan hệ giữa áp suất p, thể tích V và nhiệt độ T đối với hợp chất tinh khiết
f(p,V,T) = 0 (A.25)
Phương trình trạng thái đơn giản nhất là định luật khí lý tưởng
pV = nRT (A.26)
Mô hình khí lý tưởng dựa trên giả định rằng các phân tử không tương tác với nhau và thể tích vốn có của chúng không đáng kể. Do vậy, quy định khí lý tưởng có hiệu lực chỉ với tỷ trọng thấp mà những giả định này được minh chứng. Do lực hút không đáng kể giữa các phân tử, các pha ngưng tụ không thể được miêu tả bằng mô hình này. Để khắc phục những hạn chế này, nhiều phương trình trạng thái đã được phát triển, bao gồm quy định khí lý tưởng là điều kiện giới hạn. Các phương trình có thể được phân chia thành các nhóm sau:
- Các phương trình bán thực nghiệm khối, Peng-Robinson, Soave-Redlich-Kwong, v.v...;
- Các phương trình virian được sửa đổi, phương trình virian chỉ là phương trình lý thuyết;
- Các tính toán pVT dựa trên nguyên lý các trạng thái tương ứng;
- Các phương trình dựa trên nhiệt động lực học thống kê.
Trong phụ lục này, chỉ phần được lựa chọn của nhóm sẽ được thảo luận. Chú trọng vào các phương trình bán thực nghiệm khối mà những phương trình này tạo nền tảng cho phương pháp tính toán mới (BWT). Đối với việc mô tả chi tiết hơn các nhóm khác, có thể tham khảo các công trình của Dohrn, Walas và Anderko.
Phương trình trạng thái khối đầu tiên do J.D. Van der Waals xây dựng năm 1873 như sau:
![]() hoặc
hoặc ![]() (A.27)
(A.27)
Lực hút giữa các phân tử được tính bằng số hạng hiệu chỉnh áp suất ![]()
Đại lượng b được gọi là thông số đồng thể tích. Nó là số đo thể tích vốn có của các phân tử và đặc trưng cho các lực đẩy. Phương trình Van der Waals (VDW) là phương trình đầu tiên thành công trong việc tái tạo định lượng hành vi của các lưu chất trong đồng thời pha lỏng và khí (chỉ với một phương trình). Tuy nhiên, phương trình này cho thấy không đủ độ chính xác đối với nhiều áp dụng. Do đó, một lượng lớn các phương trình bậc 3 đã được phát triển vào thế kỷ trước, trong đó thường giữ lại việc chia thành các số hạng hút và đẩy. Mặc dù tất cả những biến đổi này khác nhau về nhiều chi tiết, chúng có thể được rút gọn thành cấu trúc năm thông số tổng quát.
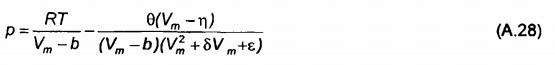
Các biến số θ,δ,ε,η đối với một số phương trình trạng thái khối quan trọng được nêu ở Bảng A.1.
Bảng A.1 - Các biến số đối với phương trình (A.28)
| Phương trình trạng thái | Thuật ngữ viết tắt | θ | δ | ε | η |
| Van der Waals (1873) | VDW | a | 0 | 0 | b |
| Soave-Redlich-Kwong (1972) | SRK | a(T) | b | 0 | b |
| Peng-Robinson (1976) | PR | a(T) | 2b | -b2 | b |
| Patel-Teja (1982) | PT | a(T) | b+c | -cb | b |
Đối với các phương trình hai thông số, các thông số (a và b) có thể được xác định từ điều kiện điểm tới hạn. Đường đẳng nhiệt tới hạn của chất lỏng nguyên chất biểu lộ điểm nút trong biểu đồ p, V, tại điểm tới hạn.

Đối với các phương trình có hơn hai thông số, các điều kiện biên bổ sung phải được xác định.
Trong số tất cả các cải tiến của phương trình Van der Waals (VDW), phương trình Peng-Robinson (PR) có giá trị nổi bật. Phương trình này đầu tiên được xây dựng cho hệ ngưng tụ khí, nó đóng vai trò công cụ tiêu chuẩn trong nhiều áp dụng. So với VDW, phương trình PR chỉ có số hạng điều kiện được sửa đổi. Phương trình PR có dạng:
![]() (A.30)
(A.30)
Từ các điều kiện điểm tới hạn [phương trình (A.31)] như sau:
![]() (A.31)
(A.31)
![]() (A.32)
(A.32)
Đối với nhiệt độ khác với Tcrit, hàm phụ thuộc vào nhiệt độ α(TR) được đưa ra để đạt được độ tái lập tốt hơn của đường cong áp suất hơi nước.
a(T) = a(Tcrit).α(TR) (A.33)
![]() (A.34)
(A.34)
Thuật ngữ α(TR) là hàm không thứ nguyên của nhiệt độ rút gọn TR. Tại nhiệt độ tới hạn, nó trở thành đồng nhất. Thông số b của phương trình PR phụ thuộc vào nhiệt độ.
Peng và Robinson tìm thấy dạng thức hàm số đối với kỳ α sử dụng áp suất hơi nước từ tài liệu. Chúng tạo thành mối quan hệ tuyến tính giữa α1/2 và TR1/2
α(TR)1/2= 1 +k(1 -TR1/2) (A.35)
Hệ số К là một hằng số cụ thể của chất được tổng quát hóa sử dụng hệ số không trung tâm ω
К = 0,37464 + 1,54226ω - 0,26993 ω2 (A.36)
A.2.2 Hỗn hợp
Để áp dụng các phương trình trạng thái đối với phép tính các đặc tính hỗn hợp, các thông số phương trình (a, b, ...) của các hợp chất nguyên chất phải được thay thế bằng các thông số hỗn hợp (am, bm, ...). Mối quan hệ giữa các thông số hỗn hợp và các thông số hợp chất nguyên chất được thiết lập bằng các quy tắc về trộn. Quy trình này dựa trên thuyết “một chất lỏng”. Nó giả định rằng chất lỏng tinh khiết (giả định) tồn tại, hoạt động (theo các điều kiện đã cho p, T) tương tự với hỗn hợp. Quy tắc trộn đơn giản nhất hiện có là quy tắc về đối xứng do Van der Waals xây dựng. Đối với phương trình trạng thái hai thông số, được đọc là:

kij = kij (A.40)
kii = kjj = 0 (A.41)
Phần mol xi của một số cấu tử trong hỗn hợp được sử dụng làm hệ số khối lượng đối với các thông số. Hơn nữa, hệ số chéo aij của số hạng a được hiệu chỉnh bằng thông số tương tác hai cấu tử kij. Những giá trị kij thường được xác định bằng cách điều chỉnh phù hợp với số liệu cân bằng lỏng hơi của hỗn hợp hai cấu tử. Mặc dù trong hầu hết các trường hợp, những thông số tương tác đạt được chỉ các giá trị nhỏ, chúng có ảnh hưởng lớn đến độ tái lập của cân bằng pha, đặc biệt tại áp suất cao. Trong tài liệu, có nhiều quy tắc trộn và sửa đổi tồn tại, những quy tắc và sửa đổi này cung cấp một số lợi thế cho các vấn đề cụ thể (ví dụ tài liệu tham khảo [23], [24] và [28]).
A.3 Đặc tính pha
Từ các điều kiện cân bằng sau, một số các biến số trạng thái chuyên sâu và các thành phần trong các pha khác nhau không thể được lựa chọn độc lập đối với hệ thống ở trạng thái cân bằng. Đối với hệ dị thể, số các biến số hợp lệ tự do được xác định bằng quy tắc pha của Gibb.
F = 2 - P + N (A.42)
trong đó
F là số độ tự do
N là số các hợp chất
P là số pha
Với quy tắc pha này (A.25), có thể rút ra rằng các đại lượng quan trọng nhất đối với hàm lượng nước trong pha khí là áp suất, nhiệt độ và thành phần khí. Những đại lượng chính này ảnh hưởng đến lực liên kết phân tử và cân bằng pha. Ảnh hưởng của thành phần khí phụ thuộc mạnh vào các chất có trong khí, đặc biệt đối với hỗn hợp khí có các tính chất phân tử khác nhau nhiều, về khía cạnh này, đại lượng quan trọng là sự phân bố điện tích phân tử. Sự phân bổ điện tích này có ảnh hưởng đến cân bằng pha đặc biệt ở tỷ trọng cao, nghĩa là tại áp suất cao hoặc trong chất lỏng. Các hydrocacbon, xuất hiện trong khí thiên nhiên, là các chất không phân cực hoặc phân cực yếu. Tuy nhiên, nước thuộc các chất có sự phân cực mạnh do mô men lưỡng cực lớn. Liên kết hydro giữa các phân tử nước trong pha lỏng đặc tạo thuận lợi để hình thành các hydrat khí (mạng tinh thể).
Phụ lục B
(Tham khảo)
Khả năng truy xuất
B.1 Tổng quát
Mối tương quan dựa trên phép xác định ban đầu hàm lượng nước đã biết, sử dụng tiêu chuẩn phương pháp thử phù hợp, từ đó có thể được dẫn xuất bằng sự tương quan này, điểm sương theo nước có liên quan đến các giới hạn hoạt động thực tế được biểu thị ở Điều B.2 đến Điều B.4
B.2 Khả năng truy xuất
Mối tương quan đặc biệt này được xem xét mang lại sự biểu thị về khả năng truy xuất khi bắt đầu với một thông số đầu vào mà có thể được so sánh trực tiếp qua một chuỗi so sánh liên tục với Tiêu chuẩn quốc gia hoặc quốc tế.
Do có các tạp chất trong khí thiên nhiên và đặc tính không lý tưởng của nó dưới áp suất gia tăng, xác định điểm sương theo nước trực tiếp không thể so sánh được với Tiêu chuẩn mà không áp dụng độ không đảm bảo không thể xác định được số lượng một cách đáng kể.
Vì vậy, sử dụng giá trị điểm sương theo nước được xác định trong trường là thông số đầu vào sẽ không đưa ra biểu thị khả năng truy xuất đối với hàm lượng nước. Hơn nữa, biểu thị về độ không đảm bảo sẽ cần được xác định để phản ánh độ không đảm bảo liên quan đến thực hiện xác định trường trực tiếp, như các biến số về nhiệt độ, áp suất và phương pháp thử nghiệm sẽ áp dụng tại mỗi điểm lấy mẫu.
Nhiệt độ mà tại đó bất kỳ sự ngưng tụ nào (điểm sương) có thể bắt đầu xảy ra, bị ảnh hưởng, ngoài những yếu tố khác, bởi các tạp chất có trong dòng khí. Vì vậy, độ không đảm bảo đi cùng với đầu vào của điểm sương được xác định đối với khí có chứa các tạp chất thông thường không thể đánh giá được.
B.3 Độ không đảm bảo của mối tương quan
Các công bố về độ không đảm bảo trong tiêu chuẩn này được mô tả liên quan đến xác định hàm lượng nước và điểm sương theo nước. Cần lưu ý rằng những công bố này được tạo ra theo các điều kiện phòng thí nghiệm và đại diện cho cách thức tốt nhất với khí thiên nhiên như đã miêu tả trước đó. Các nỗ lực xác định giá trị trường chuẩn xác đối với điểm sương theo nước trong khí thiên nhiên bị cản trở bởi sự xuất hiện của bất kỳ tạp chất nào như methanol, glycol hoặc các hydrocacbon lỏng, những chất sẽ tác động đến sự cân bằng hơi nước dọc theo đường ống làm gia tăng một loạt các điểm sương thay vì một giá trị tuyệt đối. Như vậy có các độ không đảm bảo kèm theo lớn hơn đi cùng với các xác định trực tiếp này so với phép đo hàm lượng nước. Những xem xét thực tế này có tầm quan trọng đối với việc áp dụng mối tương quan.
B.4 Khả năng áp dụng
Ứng dụng chủ yếu của sự tương quan là trong trường hợp vận chuyển khí và chuyển giao quyền giám hộ mà khí thiên nhiên sạch “về mặt kỹ thuật” được vận chuyển. Trong những trường hợp như vậy, sự tương quan đưa ra biểu thị khả năng truy xuất của điểm sương theo nước khi sử dụng hàm lượng nước được xác định tạo vết là giá trị đầu vào. Điều kiện để biểu thị hàm lượng nước được xác định tạo vết là điểm sương theo nước có thể giúp các công ty tránh phải thay đổi đơn vị đối với các hợp đồng khí mà trước đó cách hiểu về thuật ngữ điểm sương theo nước đã sử dụng.
Đối với các công ty sản xuất khí, chất hút ẩm, các hydrocacbon lỏng và các tạp chất khác thường có trong đường ống khí và cơ sở sản xuất khí. Bất cứ ở đâu có sự xuất hiện của metanol, các hydrocacbon lỏng hoặc glycol đều có khả năng thiết lập sự cân bằng giữa hỗn hợp glycol/nước/hydrocacbon mà hỗn hợp này thay đổi dọc theo đường ống. Trong những trường hợp như vậy “điểm sương theo nước” không có ý nghĩa vật lý hợp lý. Trong những trường hợp như vậy, sự tương quan không được coi là phù hợp với các khu vực hướng ngược, trừ khi bắt đầu với hàm lượng nước đã biết để dự đoán phạm vi các điểm sương có thể xảy ra.
Tình huống thứ ba liên quan đến vận chuyển khí từ nơi sản xuất đến cơ sở xử lý bằng đường ống vận chuyển hai pha. Điều này đặc biệt liên quan đến sản xuất ở ngoài khơi. Như trong tình huống thứ hai, tạp chất như methanol hoặc glycol thường xuất hiện khi trong quá trình vận chuyển làm thay đổi cân bằng hơi và không có ý nghĩa khi sử dụng điểm sương là phép đo hàm lượng hơi nước của khí. Các hydrocacbon lỏng chứa nước hòa tan và/hoặc khuếch tán và có thể can thiệp vào sự thiết lập cân bằng giữa hỗn hợp nước/glycol và hơi nước trong khí. Trong những trường hợp như vậy, có thể phù hợp hơn khi hoạt động liên quan đến nồng độ hơi nước.
Tuy nhiên, sự tương quan này có giá trị đối với mô phỏng quá trình dự đoán điểm sương theo nước từ hàm lượng nước đã biết và sự tương quan tạo ra số liệu mô phỏng đáng tin cậy hơn trong quá trình thực hiện đối với nhiều ứng dụng bình áp suất mà sự hình thành hydrat hoặc ăn mòn có thể xảy ra.
Phụ lục C
(Tham khảo)
Các ví dụ tính toán
C.1 Ví dụ về tính điểm sương theo nước với các thành phần khí khác nhau
C.1.1 Đầu vào
βw = 60 mg/m3 (nghĩa là giá trị đo)
Thành phần khí và áp suất như được xác định ở Bảng C.1.
C.1.2 Đầu ra
Nhiệt độ điểm sương T như được xác định ở Bảng C.1 (độ không đảm bảo ± 2 °C).
Bảng C.1 - Ví dụ về tính toán điểm sương theo nước với các thành phần khí khác nhau
| Thành phần khí khô | p(tuyệt đối) = 2 MPa T(°C) | p(tuyệt đối) = 5 MPa T(°C) | p(tuyệt đối) = 8 MPa T(°C) |
| 90 % metan, 8 % metan, 2 % propan | -16,3 | -6,7 | -2,0 |
| 80 % metan, 13 % metan, 4 % propan, 3 % metan | -16,3 | -6,8 | -2,2 |
| 75 % metan, 16 % metan, 4,5 % propan, 4,5 % metan | -16,4 | -6,9 | -2,2 |
| 70 % metan, 20 % metan, 4,5 % propan, 5,5 % metan | -16,4 | -6,9 | -2,1 |
C.2 Ví dụ về tính toán hàm lượng nước với các thành phần khí khác nhau
C.2.1 Đầu vào
Nhiệt độ điểm sương T = -5 °C (nghĩa là quy định kỹ thuật theo hợp đồng).
Thành phần khí và áp suất như được xác định ở Bảng C.2.
C.2.2 Đầu ra
βw như được quy định trong Bảng C.2 (độ không đảm bảo được tính như được biểu thị ở 4.1 và các ví dụ được đưa ra ở Điều C.3).
Bảng C.2 - Ví dụ về các tính toán hàm lượng nước với những thành phần khí khác nhau
| Thành phần khí khô | p(tuyệt đối) = 2 MPa βw (mg/m3) | p(tuyệt đối) = 5 MPa βw (mg/m3) | p(tuyệt đối) = 8 MPa βw (mg/m3) |
| 90 % metan, | 167,3 | 70 | 45,3 |
| 80 % metan, | 168,5 | 70,9 | 46,1 |
| 75 % metan, | 169 | 71,3 | 46,3 |
| 70 % metan, | 169 | 71,1 | 45,7 |
C.3 Ví dụ về tính toán đối với độ không đảm bảo trong hàm lượng nước
C.3.1 Ví dụ 1: Tính độ không đảm bảo đối với βw = 100 mg/m3
| Độ không đảm bảo: (0,14 + 0,021 x 100 ± 20) mg/m3 0,14 + 2,1 ± 20 => độ không đảm bảo trên: + 22,24 mg/m3 => độ không đảm bảo dưới: -17,76 mg/m3 βw trên: 100 + 22,24 = 122,24 mg/m3 βw dưới: 100 - 17,76 = 82,24 mg/m3 Vì vậy: 82,24 mg/m3 ≤ βw ≤ 122,24 mg/m3 |
C.3.2 Ví dụ 2: Tính độ không đảm bảo đối với βw = 600 mg/m3
| Độ không đảm bảo: (-18,84 + 0,0537 × 600 ± 20) mg/m3 -18,84 + 32,22 ± 20 => độ không đảm bảo trên: + 33,38 mg/m3 => độ không đảm bảo dưới: -6,62 mg/m3 βw trên: 600 + 33,38 = 633,38 mg/m3 βw dưới: 600 - 6,62 = 593,38 mg/m3 Vì vậy: 593,38 mg/m3 ≤ βw ≤ 633,38 mg/m3 |
Phụ lục D
(Tham khảo)
Các ký hiệu chỉ số dưới, ký hiệu, đơn vị, hệ số chuyển đổi và từ viết tắt
D.1 Ký hiệu chỉ số dưới, ký hiệu và đơn vị
D.1.1 Ký hiệu chỉ số dưới
c tại điểm tới hạn
R các điều kiện rút gọn
v pha hơi
w nước
D.1.2 Ký hiệu và đơn vị
b thông số đồng thể tích m3/kmol
x phần mol
p áp suất (tuyệt đối) kPa
R hằng số khí (8,314510) J/(K.mol)
t nhiệt độ độ Celsius ºC
T nhiệt độ nhiệt động học (tuyệt đối) K
V thể tích m3
Vm thể tích mol m3/kmol
βw nồng độ khối lượng của hàm lượng nước mg/m3 (ở điều kiện thông thường)
kij thông số tương tác hai cấu tử
ω hệ số không trung tâm phụ thuộc vào chất
К hằng số phụ thuộc vào chất
D.2 Hệ số chuyển đổi đối với áp suất, nhiệt độ, thể tích và khối lượng thể tích
D.2.1 Áp suất
Để chuyển đổi từ
| kPa | thành | bar | sử dụng công thức => |
| MPa | thành | bar | sử dụng công thức => bar = MPa x 10 |
| atm | thành | bar | sử dụng công thức => bar = atm x 1,01325 |
| psia | thành | bar | sử dụng công thức => |
| psig | thành | bar | sử dụng công thức => |
D.2.2 Nhiệt độ
Để chuyển đổi từ
K thành ºC sử dụng công thức => ºC = K - 273,15
D.2.3 Thể tích
Để chuyển đổi từ
| m3 (các điều kiện tiêu chuẩn) | thành | m3 (các điều kiện thông thường) | sử dụng công thức | => | m3(n.c.) = m3(s.c) × 0,947 (xấp xỉ đối với khí thiên nhiên) |
D.2.4 Khối lượng thể tích
Để chuyển đổi từ
| ppm | thành | mg/m3 (các điều kiện thông thường) | sử dụng công thức | => | mg/m3 = ppm × 1,245 (xấp xỉ đối với nước) |
D.3 Danh sách các thuật ngữ viết tắt
ASTM Hội thử nghiệm và vật liệu Hoa Kỳ
CEN Ủy ban tiêu chuẩn hóa Châu Âu
GERG Groupe Europeen de Recherches Gazieres
IEC Ủy ban kỹ thuật điện quốc tế
IGU Tổ chức khí quốc tế
ISO Tổ chức tiêu chuẩn hóa quốc tế
Thư mục tài liệu tham khảo
[1] AHMED, Tarek. Hydrocarbon phase behaviour (Đặc tính pha hydrocacbon, Vol. 7, USA, 1989)
[2] GERG, Technical monograph TM14 (L.R. OELLRICH, K. ALTHAUS). Relationship between water content and water dew point keeping in consideration the gas composition in the fied of natural gas (Verein Deutscher Ingenieure, Reihe3-Nr.679, 2001, Postfach 10 10 54, 40001 Dusseldorf, E-mail gps@vdi.de) [[Chuyên khảo kỹ thuật TM14 (L.R. OELLRICH, K. ALTHAUS). Mối quan hệ giữa hàm lượng nước và điểm sương theo nước khi xem xét thành phần khí trong lĩnh vực khí thiên nhiên (Verein Deutscher Ingenieure, Reihe3-Nr.679, 2001, Postfach 10 10 54, 40001 Dusseldorf, E-mail gps@vdi.de)]
[3] IGRC 1995, Development of a mathematical correlation between water content and water dew point (Xây dựng tương quan toán học giữa hàm lượng nước và điểm sương theo nước)
[4] IGRC 1998, GERG model predictions and experimental verification of water dew points of natural gas (Dự báo mô hình GERG và kiểm chứng thí nghiệm điểm sương theo nước của khí thiên nhiên)
[5] ASTM D 1142-95, Water vapour content of gaseous fuel by measurements of dew point temperature (Hàm lượng hơi nước của nhiên liệu khí theo phép đo nhiệt độ điểm sương)
[6] PC Program for the calculation of water content or water dew point according to this international standards: DEW POINT - Program to calculate the water content, the dew point temperature and the charateristic variables of natural gases. RUHRGAS, Halterner Strape 125, 46284 Dorsten (Germany), Fax +48 2362 938780, 18.9.2000 (Chương trình PC tính hàm lượng nước hoặc điểm sương theo nước theo tiêu chuẩn quốc tế: Điểm sương - Chương trình tính hàm lượng nước, nhiệt độ điểm sương và các biến số đặc tính của khí thiên nhiên. RUHRGAS, Halterner Strape 125, 46284 Dorsten (Germany), Fax +48 2362 938780, 18.9.2000)
[7] NISHIUMI, H.; ARAI, T.; TAUKEUCHI, K. Generalization of the binary interaction parameter of the Peng and Robinson equation of state by component family. Fluid phase equillibria, 42, 1988, pp. 43-62 (Tổng quát hóa thống số tương tác nhị nguyên của phương trình trạng thái theo nhóm hợp phần Peng và Robinson. Cân bằng pha chất lỏng, 42, 1988, trang. 43-62)
[8] AVLONITIS, G. Et al. Generalization of the binary interaction coefficients of nitrogen- hydrocarbon binary mixtures. Fluid phase equillibria (AVLONITIS, G. Cùng cộng sự. Tương quan tổng quát đối với hệ số tương tác của các hỗn hợp nhị nguyên nitơ - hydrocacbon, Cân bằng pha chất lỏng, 101, 1994, trang 53-58)
[9] KNAPP, H., DORING, R., OELLRICH, L., PLOCKER, U., PRAUSNITZ, J.M. Vapour-liquid equillibria for mixtures of low boiling substances Dechema Vol. VI, Part 1. Frankfurt, 1982.
(Cân bằng hơi-chất lỏng đối với hỗn hợp các chất có điểm sôi thấp. Chuỗi số liệu Dechema Vol. VI, Phần 1. Frankfurt, 1982)
[10] KORDAS, A., TSOUTSOURAS, K., STAMATAKI, S., TASSIOS, D. A generalized correlation for the interaction coefficients of CO2-hydrocarbon binary mixtures. Fluid phase equillibria (Tương quan tổng quát hóa hệ số tương tác của các hỗn hợp nhị nguyên CO2 - hydrocacbon. Cân bằng pha chất lỏng, 93,1994, trang 141-166)
[11] KORDAS, A., TSOUTSOURAS, K., STAMATAKI, S., TASSIOS, D.: Methane-hydrocarbon- interaction parameters correlation for the Peng-Robinson and the t-mPR equation of state. Fluid phase equillibria (Tương quan các thông số tương tác metan - hydrocacbon đối với phương trình trạng thái Peng-Robinson và t-mPR. Cân bằng pha chất lỏng, 112 (1), 1995, trang 33-44)
[12] KNAPP, H., OELLRICH, L.R., K-BP2 - Karlsruhe-Berliner-Prozep-Berechnungs-Paket. Institut fur technische Thermodynamik und Kaltetechnik, Universitat Karlsruhe
[13] DOHRN, R. Berechnung von Phasengleichgewichten. Vieweg Verlag, 1994
[14] GMEHLING, J.; KOLBE, B. Thermodynamik. 2. Uberarb. Aufl., Weinheim: VCH, 1992
[15] WALAS, St. M. Phase equillibria in chemical engineering. 2 pr. Boston: Butterworth, 1985 (Cân bằng pha trong kỹ thuật hóa học. 2 prr. Boston: Butterworth, 1985)
[16] ANDERKO, A. Review: EoS methods for the modelling of phase equillibria. Fluid phase equillibria. 61, 1990, pp 145-225 (Rà soát: Các phương pháp EoS mô hình hóa cân bằng pha. Cân bằng pha chất lỏng, 61, 1990, trang 145-225)
[17] ABBOTT, M.M. Cubic EoS: An interpretive review: Advances in chemistry series, 182, 1979, pp. 47-70 (EoS khối: Rà soát thông dịch. Những tiến triển trong hóa học, 182, 1979, trang 47-70)
[18] VAN DER WAALS, J.D. Over de continuuiteit van den gas - en vloestoftoestand. Dissertation Universitat Leiden, 1873
[19] SOAVE, G. Equillibrium constant from a modified Redlich-Kwong equation of state. Chem. Eng. Sci., 27, 1972, pp. 1197-1203 (Hằng số cân bằng từ phương trình trạng thái sửa đổi Redlich- Kwong. Chem.Eng. Sci., 27, 1972, trang 1197-1203)
[20] PENG, D.Y., ROBINSON, D.B. A new two-constant equation of state. Ind. Eng. Chem, Fundam., 15 (1), 1976, pp. 59-64 (Phương trình trạng thái hai hằng số mới. Ind. Eng. Chem. Fundam., 15(1), 1976, trang 59-64)
[21] PATE, N.C. Improvements of the Patel-Teja equation of state. Int. J. Thermophysics, 17 (3), 1996 (Các cải tiến của phương trình trạng thái Patel-Teja. Int. J. Lý nhiệt, 17 (3), 1996)
[22] COPEMAN, T.W., MATHIAS P.M. Recent mixing rules for equation of state. Equation of state: Theories and applications (K.C. ChAO, ed.),,ACS symposium series 300, 1986, pp.353-370 (Các quy tắc gần đây đối với phương trình trạng thái. Phương trình trạng thái: Lý thuyết và ứng dụng (K.C. ChAO, ed.), các hội nghị chuyên đề ACS 300, 1986, trang 353-370)
[23] MANSOORI, G.A. Mixing rules for equations of state. Equation of state: Theories and applications ACS symposium series 300, 1986, pp. 314-330 (Các quy tắc hỗn hợp đối với phương trình trạng thái khối Phương trình trạng thái: Lý thuyết và ứng dụng, (K.C. CHAO, ed.), Chuyên đề ACS chuỗi 300, 1986, trang 314-330)
[24] MICHEL, S.; HOOPER, H.H.; PRAUSNITZ, J.M. Mutual solubilities of water and hydrocarbons from an equation of state need for an unconventional mixing rule. Fluid phase equillibria, 45, 1989,pp. 173-189 (Tính hòa tan lẫn nhau của nước và các hydrocacbon từ nhu cầu phương trình trạng thái đối với quy tắc hỗn hợp không theo quy ước)
[25] RICCI, J.E. The phase rules D. Van. Nostrand Co., New York, 1951 (Quy tắc pha.)
[26] ROOZEBOOM BAKHUIS, H. W. Die heterogenen Glleichgewichte vom Standpunkt der Phasenlehre. 1. Heft, Braunschweig, Vieweg & Sohn, 1901
[27] ECONOMOU, I.G.; DONOHUE, M.D. Equations of State for hydrogen bonding systems. Fluid phase equilibria, 116, 1996, pp. 518-529 (Các phương trình trạng thái đối với hệ thống liên kết hydro. Cân bằng pha chất lỏng, 116, 1996, trang 518-529)
[28] KABADI, V.N.; DAINNER, R.P. A modified Soave-Redlich-Kwong equation of state for water- hydrocarbon phase equilibria. Ind. Eng. Chem. Proc. Des. Dev., 24, 1985, pp. 537-541 (Phương trình trạng thái Soave-Redlich-Kwong sửa đổi đối với cân bằng pha nước - hydrocacbon. Ind. Eng. Chem. Proc. Des. Dev., 24,1985, trang 537-541)
[29] ISO 31-3, Số lượng và đơn vị - Phần 3: Cơ khí
[30] ISO 3534-1:1993, Statistics - Vocabulary and symbols - Part 1: Probability and general statistical terms (Thống kê - Từ vựng và biểu tượng - Phần 1: Xác suất và các thuật ngữ thống kê tổng quát)
[31] TCVN 12045:2017 (ISO 6327:1981) Phân tích khí - Xác định điểm sương theo nước của khí thiên nhiên - Ẩm kế ngưng tụ bề mặt lạnh
[32] ISO 6568:1981, Natural gas - Simple analysis by gas chromatography (Khí thiên nhiên - Phân tích đơn giản bằng sắc ký khí)
[33] TCVN 12047-1:2017 (ISO 6974-1:2012) Khí thiên nhiên - Xác định thành phần và độ không đảm bảo kèm theo bằng phương pháp sắc ký khí - Phần 1: Hướng dẫn chung và tính thành phần.
[34] TCVN 12047-2:2017 (ISO 6974-2:2012) Khí thiên nhiên - Xác định thành phần và độ không đảm bảo kèm theo bằng phương pháp sắc ký khí - Phần 2: Tính độ không đảm bảo.
[35] TCVN 12047-3:2017 (ISO 6974-3:2000) Khí thiên nhiên - Xác định thành phần với độ không đảm bảo xác định bằng phương pháp sắc ký khí - Phần 3: Xác định hydro, heli, oxy, nitơ, carbon dioxit và các hydrocarbon đến C8 sử dụng hai cột nhồi.
[36] TCVN 12047-4:2017 (ISO 6974-4:2000) Khí thiên nhiên - Xác định thành phần với độ không đảm bảo xác định bằng phương pháp sắc ký khí - Phần 4: Xác định nitơ, carbon dioxit và hydrocarbon C1 đến C5 và C6+ đối với hệ thống đo phòng thử nghiệm và đo trực tuyến sử dụng hai cột.
[37] TCVN 12047-5:2017 (ISO 6974-5:2014) Khí thiên nhiên - Xác định thành phần với độ không đảm bảo kèm theo bằng phương pháp sắc ký khí - Phần 5: Phương pháp đẳng nhiệt đối với nito, carbon dioxit, hydrocarbon C1 đến C5 và C6+.
[38] TCVN 12047-6:2017 (ISO 6974-6:2000) Khí thiên nhiên - Xác định thành phần với độ không đảm bảo xác định bằng phương pháp sắc ký khí - Phần 6: Xác định hydro, heli, oxy, nito, carbon dioxit và các hydrocarbon C1 đến C8 sử dụng ba cột mao quản.
[39] ISO 6975:1997, Natural gas - Extended analysis - Gas chromatographic method (Khí thiên nhiên - Phân tích mở rộng - Phương pháp sắc ký khí)
[40] ISO 6976:1995, Natural gas -- Calculation of calorific values, density, relative density and Wobbe indices from composition (Khí thiên nhiên - Tính nhiệt trị, khối lượng riêng, tỷ khối và chỉ số Wobbe từ thành phần)
[41] ISO 7504:2001, Gas anlysis - Vocabulary (Phân tích khí - Từ vựng)
[42] TCVN 12545-1:2018 (ISO 10101-1:1993), Khí thiên nhiên - Xác định nước bằng phương pháp Karl Fischer - Phần 1: Yêu cầu chung)
[43] TCVN 12545-2:2018 (ISO 10101-2:1993), Khí thiên nhiên - Xác định nước bằng phương pháp Karl Fischer - Phần 2: Quy trình chuẩn độ)
[44] TCVN 12545-2:2018 (ISO 10101-2:1993), Khí thiên nhiên - Xác định nước bằng phương pháp Karl Fischer - Phần 3: Quy trình điện lượng)
[45] TCVN 12546:2018 (ISO 10715:1997) Khí thiên nhiên - Hướng dẫn lấy mẫu)
[46] TCVN 12547:2018 (ISO 11541:1997) Khí thiên nhiên - Xác định hàm lượng nước tại áp suất cao
[47] TCVN 12548:2018 (ISO 13443:1996) Khí thiên nhiên - Các điều kiện quy chiếu tiêu chuẩn
[48] TCVN 12049:2017 (ISO 13686:2013) Khí thiên nhiên - Yêu cầu chất lượng
[49] ISO 14532:2001, Natural gas - Vocabulary (Khí thiên nhiên - Từ vựng)
[50] Guide 30:1992, Terms and definitions used in connection with reference materials (Hướng dẫn 30:1992, Các thuật ngữ và định nghĩa sử dụng liên quan đến các vật liệu chuẩn)
[51] International vocabulary of basic and general terms in metrology (VIM). BIPM, IEC, IFCC, ISO, IUPAC, IUPAP, OIML (Từ vựng về các thuật ngữ chung và cơ bản mang tính quốc tế trong hệ thống đo lường (VIM). BIPM, IEC, IFCC, ISO, IUPAC, IUPAP, OIML, xuất bản lần 2., 1993)
1) GERG là viết tắt của Groupe Europeen de Recherche Gaziere (Tập đoàn nghiên cứu Khí của châu Âu).
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 12551:2019 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 12551:2019 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 12551:2019 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 12551:2019 DOC (Bản Word)