- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 11525-3:2020 ISO 1431-3:2017 Độ bền rạn nứt ôzôn
| Số hiệu: | TCVN 11525-3:2020 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Công nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
19/11/2020 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 11525-3:2020
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 11525-3:2020
TIÊU CHUẨN QUỐC GIA
TCVN 11525-3:2020
ISO 1431-3:2017
CAO SU LƯU HÓA HOẶC NHIỆT DẺO - ĐỘ BỀN RẠN NỨT ÔZÔN - PHẦN 3: PHƯƠNG PHÁP SO SÁNH VÀ THAY THẾ ĐỂ XÁC ĐỊNH NỒNG ĐỘ ÔZÔN TRONG BUỒNG THỬ NGHIỆM PHÒNG THÍ NGHIỆM
Rubber, vulcanized or thermoplastic - Resistance to ozone cracking - Part 3: Reference and alternative methods for determining the ozone concentration in laboratory test chambers
Lời nói đầu
TCVN 11525-3:2020 hoàn toàn tương đương ISO 1431-3:2017.
TCVN 11525-3:2020 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC45 Cao su và sản phẩm cao su biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
Bộ TCVN 11525 (ISO 1431), Cao su lưu hóa hoặc nhiệt dẻo - Độ bền rạn nứt ôzôn, gồm các tiêu chuẩn sau:
- TCVN 11525-1:2016 (ISO 1431-1:2012), Phần 1: Thử nghiệm biến dạng tĩnh và động
- TCVN 11525-3:2020 (ISO 1431-3:2017), Phần 3: Phương pháp so sánh và thay thế để xác định nồng độ ôzôn trong buồng thử nghiệm phòng thí nghiệm
Lời giới thiệu
Hiện nay một số kỹ thuật phân tích hỗn hợp khí ôzôn/không khí được sử dụng để kiểm tra vết nứt ôzôn cao su. Chúng bao gồm các quy trình hóa học-ướt, pin điện hóa, hấp thụ tia cực tím và phát quang hóa với etylen.
Về nguyên tắc, các phương pháp hấp thụ hóa học-ướt, điện hóa và UV đều tuyệt đối, nhưng trong thực tế chúng thường không đưa ra kết quả giống nhau.
Phương pháp hóa học-ướt, thường bao gồm sự hấp thụ ôzôn trong dung dịch kali iodua và chuẩn độ iốt được giải phóng với natri thiosulfate, theo truyền thống được sử dụng trong ngành công nghiệp cao su và được quy định trong tiêu chuẩn quốc gia. Chúng không thích hợp cho hoạt động hoặc kiểm soát liên tục và do đó ít được mong muốn trong thực hành hơn phương pháp sử dụng thiết bị. Các kết quả thu được đã được chứng minh là nhạy cảm với các thay đổi nhỏ về nồng độ, độ tinh khiết của thuốc thử trong quy trình thử nghiệm và đã có nhiều tranh cãi về cân bằng hóa học của phản ứng.
Phương pháp điện hóa được sử dụng rộng rãi trong ngành công nghiệp cao su và được cho là thuận tiện trong việc liên tục giám sát và kiểm soát ôzôn. Phương pháp hóa phát quang cũng đã được sử dụng.
Gần đây, các máy phân tích hấp thụ tia cực tím, có cùng khả năng giám sát và kiểm soát, đã ngày càng được sử dụng. Quan trọng nhất, kỹ thuật này đã được tất cả các cơ quan môi trường lớn áp dụng như là tiêu chuẩn và được coi là tuyệt đối.
Do đó, phương pháp hấp thụ tia cực tím tiêu chuẩn này được chấp nhận là kỹ thuật chuẩn để hiệu chuẩn cho tất cả các phương pháp khác. Giống như bất kỳ thiết bị đo lường nào, độ chính xác của bất kỳ thiết bị UV cụ thể nào đều phụ thuộc vào sự hiệu chuẩn và bảo trì các bộ phận của nó, và do đó, ngay cả máy phân tích UV cũng cần được kiểm tra xác nhận thiết bị chuẩn. Các nghiên cứu đang được thực hiện ở một số quốc gia để đề xuất một thiết bị chuẩn đầu.
Mặc dù tiêu chuẩn này liên quan đến phân tích ôzôn, nhưng cũng đưa ra sự lưu ý đến ảnh hưởng của áp suất khí quyển về tốc độ nứt rạn của cao su ở nồng độ ôzôn không đổi như thường được biểu thị trong phần điều khoản theo thể tích. Khi được thiết lập bởi các thử nghiệm liên phòng được tiến hành ở Bắc Mỹ[3], sự khác biệt trong độ bền ôzôn có thể dẫn đến giữa các phòng thí nghiệm hoạt động ở áp suất khí quyển khác nhau đáng kể có thể được điều chỉnh bằng cách quy định nồng độ ôzôn theo áp suất riêng phần của ôzôn (xem Phụ lục C).
Cân lưu ý đến tính chất độc hại cao của ôzôn. cần nỗ lực để giảm thiểu sự phơi nhiễm của người lao động mọi lúc. Trong trường hợp không có các quy định an toàn quốc gia nghiêm ngặt hơn hoặc trái với quy định, khuyến nghị rằng 10 phần ôzôn trên một trăm triệu phần không khí của khí quyển xung quanh theo thể tích được coi là nồng độ tối đa tuyệt đối, trong khi nồng độ trung bình tối đa nên thấp hơn đáng kể.
Trừ khi một hệ thống hoàn toàn kín đang được sử dụng, nên sử dụng ống thông hơi để loại bỏ không khí chứa đầy ôzôn.
CAO SU LƯU HÓA HOẶC NHIỆT DẺO - ĐỘ BỀN RẠN NỨT ÔZÔN - PHẦN 3: PHƯƠNG PHÁP SO SÁNH VÀ THAY THẾ ĐỂ XÁC ĐỊNH NỒNG ĐỘ ÔZÔN TRONG BUỒNG THỬ NGHIỆM PHÒNG THÍ NGHIỆM
Rubber, vulcanized or thermoplastic - Resistance to ozone cracking - Part 3: Reference and alternative methods for determining the ozone concentration in laboratory test chambers
1 Phạm vi áp dụng
Tiêu chuẩn này quy định ba loại phương pháp xác định nồng độ ôzôn trong buồng thử nghiệm phòng thí nghiệm.
Phương pháp A - Hấp thụ tia cực tím: đây là phương pháp chuẩn và được sử dụng làm phương tiện hiệu chuẩn cho phương pháp thay thế B và C.
Phương pháp B - Kỹ thuật thiết bị:
B1: điện hóa
B2: phát quang hóa
Phương pháp C - Kỹ thuật hóa học-ướt:
Quy trình I
Quy trình II
Quy trình III
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau đây là cần thiết để áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 11525-1 (ISO 1431-1), Cao su lưu hóa hoặc nhiệt dẻo - Độ bền rạn nứt ôzôn - Phần 1: Thử nghiệm biến dạng tĩnh và động
ISO 13964, Air quality - Determination of ozone in ambient air - Ultraviolet photometric method (Chất lượng không khí - Xác định ozone trong không khí xung quanh - Phương pháp trắc quang tử ngoại)
3 Thuật ngữ và định nghĩa
Tiêu chuẩn này không đưa ra các thuật ngữ và định nghĩa.
4 Nguyên tắc
Một hỗn hợp ôzôn/không khí được lấy mẫu từ buồng phơi nhiễm ôzôn và nồng độ ôzôn được xác định bởi phương pháp tham chiếu hấp thụ UV hoặc bằng các phương pháp sử dụng thiết bị hoặc phân tích hóa học thay thế được hiệu chuẩn ứng với phương pháp hấp thụ tia cực tím.
5 Thiết bị, dụng cụ
Thiết bị được sử dụng để xác định nồng độ ôzôn phải là một trong các loại sau:
Hấp thụ tia cực tím
Điện hóa
Hóa phát quang
Hóa học-ướt
Phương pháp chuẩn là hấp thụ UV và tất cả các thiết bị phải được hiệu chuẩn theo phương pháp hấp thụ UV được quy định trong Điều 6.
Thiết bị được sử dụng cho phương pháp hấp thụ tia cực tím phải theo ISO 13964, trừ khi thiết bị phải có khả năng đo nồng độ ôzôn theo quy định trong TCVN 11525-1 (ISO 1431-1).
Mô tả phương pháp thay thế được nêu trong Phụ lục B (phương pháp thiết bị) và Phụ lục C (phương pháp hóa học-ướt).
6 Hiệu chuẩn
Hiệu chuẩn thiết bị để xác định nồng độ ôzỏn phải theo quy trình nêu trong ISO 13964.
7 Cách tiến hành
Phương pháp UV phải được thực hiện theo ISO 13964.
Các phương pháp thiết bị khác phải được sử dụng theo hướng dẫn của nhà sản xuất, đặc biệt chú ý đến việc thiết lập ban đầu, điều chỉnh về “0”, duy trì và kiểm tra thiết bị như đã đề cập trong Phụ lục B.
Phương pháp hóa học-ướt phải được thực hiện theo Phụ lục C.
8 Biểu thị kết quả
Thông thương, nồng độ ôzôn, ![]() , được biểu thị bằng các phần ôzôn theo thể tích trên một trăm triệu phần không khí theo thể tích (pphm).
, được biểu thị bằng các phần ôzôn theo thể tích trên một trăm triệu phần không khí theo thể tích (pphm).
Tuy nhiên, nồng độ ôzôn cũng có thể được biểu thị bằng mg/m3 hoặc tính bằng mPa. Biểu thị mg/m3 chỉ số lượng phân tử ôzôn trong thể tích có sẵn làm nứt rạn ôzôn và phụ thuộc vào cả áp suất và nhiệt độ.
Đối với mục đích chuyển đổi, công thức sau là hợp lệ:
![]()
trong đó:
p là áp suất khí quyển, tính bằng hPa;
T là nhiệt độ, tính bằng K.
Xét về áp suất riêng phần của ôzôn:
![]()
trong đó:
p là áp suất khí quyển, tính bằng hPa.
Tại 1 013 hPa và 273 K, 1 pphm = 1,01 mPa.
9 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm những thông tin sau đây:
a) viện dẫn tiêu chuẩn này, nghĩa là: TCVN 11525-3 (ISO 1431-3);
b) phương pháp sử dụng, nghĩa là phương pháp thiết bị hoặc phương pháp hóa học-ướt;
c) khoảng thời gian đo nếu phép đo không liên tục;
d) nồng độ ôzôn hoặc dải nồng độ đo được, biểu thị bằng pphm hoặc mg/m3 hoặc mPa áp suất riêng phần của O3, được điều chỉnh nếu cần hệ số hiệu chuẩn;
e) ngày thử nghiệm.
Phụ lục A
(tham khảo)
Ảnh hưởng của áp suất khí quyển môi trường lên sự rạn nứt bởi ôzôn của cao su
Tốc độ phản ứng của ôzôn với cao su, tức là tốc độ rạn nứt, là một hàm của tốc độ va chạm của các phân tử ôzôn với bề mặt cao su và do đó là một hàm của số lượng các phân tử ôzôn có mặt, tất cả các yếu tố khác là không đổi.
Phương trình khí-hoàn hảo và định luật Dalton cho phép áp suất riêng phần của ôzôn ![]() được tính như là một hàm của số mol ôzôn
được tính như là một hàm của số mol ôzôn ![]() theo thể tích V của hỗn hợp ôzôn/không khí, được đo ở nhiệt độ T:
theo thể tích V của hỗn hợp ôzôn/không khí, được đo ở nhiệt độ T:
![]()
trong đó:
![]() là áp suất riêng phần của ôzôn, tính bằng mPa;
là áp suất riêng phần của ôzôn, tính bằng mPa;
T là nhiệt độ, tính bằng K;
V là thể tích của hỗn hợp ôzôn/không khí, tính bằng m3;
R là hằng số khí (R = 8,314 Ra-m3-mol-1 -K-1).
CHÚ THÍCH: Dưới các điều kiện tiêu chuẩn về nhiệt độ (273 K) và áp suất (1 atm., 760 torr hoặc 1 013 hPa), 1 pphm = 1,01 mPa.
Có thể chứng minh rằng, với cùng hàm lượng ôzôn, tính theo thể tích, của không khí ôzôn hóa, được đo ở cùng một nhiệt độ nhưng ở áp suất khí quyển khác nhau, áp suất riêng phần của ôzôn và số mol của ôzôn khác nhau trong cùng tỷ lệ với áp suất khí quyển.
Kết quả của một chương trình thử nghiệm liên phòng được tiến hành ở Bắc Mỹ[3] chứng minh hiệu quả của áp suất môi trường xung quanh lên tốc độ nứt tại hàm lượng ôzôn thể tích không đổi.
Do đó, biểu thị nồng độ ôzôn trong buồng thử nghiệm trên cơ sở thể tích trên thể tích là không phù hợp khi có sự khác biệt về áp suất khí quyển.
Ảnh hưởng của các thay đổi này có thể được điều chỉnh bằng cách làm việc ở áp suất buồng thử nghiệm không đổi hoặc bằng cách thay đổi hàm lượng ôzôn thể tích của hỗn hợp ôzôn/không khí theo tỷ lệ nghịch với áp suất khí quyển. Ảnh hưởng có thể cũng được khắc phục bằng cách biểu thị nồng độ ôzôn là áp suất riêng phần của ôzôn trong không khí ôzôn hóa.
Phụ lục B
(quy định)
Phương pháp thiết bị thay thế
B.1 Phương pháp điện hóa
B.1.1 Nguyên tắc
Không khí ôzôn hóa được tạo bọt tại tốc độ cố định qua bình đo điện lượng có chứa dung dịch đệm kali iodua và có một catot platin và một anot bạc (ưu tiên) hoặc thủy ngân.
Ôzôn phản ứng với kali iodua để giải phóng iốt tự do. lốt bị ion hóa ở catot platin và loại bỏ tại anot để tạo ra bạc iodua hoặc thủy ngân iodua. Hai đơn vị điện tích được tạo ra cho mỗi phân tử ôzôn và dòng điện được tạo ra tỷ lệ thuận với nồng độ ôzôn. Suất điện động tịnh (net emf) của bình đo bị triệt tiêu bởi một suất điện động nghịch đặt vào và hiệu chỉnh được thực hiện cho nhiệt độ và áp suất môi trường (xem Thư mục tài liệu tham khảo [1]).
Cân bằng hóa học là:
O3 + 2KI + H2O → 2KOH + O2 + l2
Tại catot: l2 + 2e → 2I-
Tại anot: 2I- - 2e + 2Hg → Hg2l2
Theo định luật Faraday ta có:
O3 → 2I- → 2e → 2 x 96 500 culông
B.1.2 Thiết bị, dụng cụ
Thiết bị phân tích phải bao gồm một bình đo điện lượng đo kiểu chung như nêu trong Hình B.1. Các kiểu mẫu (model) chuẩn có sẵn trên thị trường.
Catot có dạng một giỏ platin mà qua đó không khí đã bị ôzôn hóa được sục vào. Anot có thể là một trong những dạng sau, mặc dù b) là loại ưa thích:
a) một bể thủy ngân;
b) một lưới xoắn (spiral) bằng bạc.
Iốt được giải phóng khỏi dung dịch bởi ôzôn bị ion hóa ở catot và được chuyển đến anot bởi sự tuần hoàn của chất lỏng gây ra theo hướng mũi tên do tác động sủi bọt. Tại anot, bạc iodua không tan hoặc thủy ngân iodua được tạo thành với sự giải phóng các điện tích ion tương đương chính xác với ôzôn do dòng không khí đưa vào.
Bình đo phải được kết nối với một mạch điện của máy phân tích thuộc loại chung như nêu trong Hình B.2.
Một nguồn điện áp một chiều (DC) ổn định được dùng làm phương tiện chống lại điện thế chuẩn xuất hiện tại các điện cực nguồn (điện hóa) khi không khí không chứa ôzôn đi qua bộ nguồn này. Điện thế chuẩn này sẽ phụ thuộc vào vật liệu chế tạo anot.
B.1.3 Thuốc thử
Chuẩn bị dung dịch đệm kali iodua như sau:
Cân các hóa chất có chất lượng thuốc thử phân tích sau đây và hòa tan trong 1 L nước cất không chứa clorua và không chứa Sulfat:
Kali iodua (KI) 1,50 g
Natri monohydro phosphat (Na2HPO4) 1,50 g
Kali dihydro Phosphat (KH2PO4) 1,40 g
Điều này sẽ cung cấp một dung dịch đệm có pH từ 6,5 đến 6,8.
B.1.4 Hiệu chuẩn bình đo
Giả sử lưu lượng khí 150 cm3/min được đo tại nhiệt độ và áp suất tiêu chuẩn và hàm lượng ôzôn là 100 pphm, cường độ dòng điện là:
![]()
Do đó, trong mạch điện điển hình như nêu trong Hình B.2, thiết bị phân tích có thể được hiệu chuẩn trực tiếp bằng quan hệ giữa dòng điện bình đo và nồng độ ôzôn.
B.2 Quang hóa
Trong các thiết bị quang hóa, không khí đã được ôzôn hóa được đưa qua một buồng nơi có tiếp xúc với dòng khí etylen và hai khí trải qua phản ứng quang hóa với sự phát xạ photon (ánh sáng) ở bước sóng khoảng 430 nm. Sự phát xạ năng lượng này được đo bằng máy nhân quang và được chuyển đổi thành sản lượng điện tỷ lệ với nồng độ ôzôn.
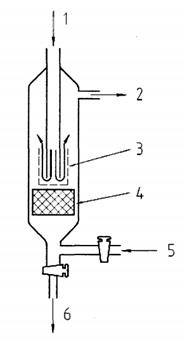
CHÚ DẪN:
1 không khí/O3
2 không khí
3 catot
4 anod
5 dung dịch
6 để thải
Hình B.1 - Thiết bị phân tích
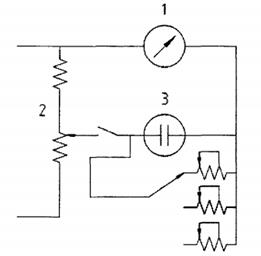
CHÚ DẪN:
1 micro-ampe kế
2 bộ nguồn một chiều ổn định
3 bình đo
Hình B.2 - Mạch thiết bị phân tích đơn giản
Phụ lục C
(quy định)
Phương pháp hóa học-ướt
C.1 Lý thuyết chung
C.1.1 Sự hấp thụ ôzôn trong dung dịch đệm Kl trung tính lỏng tạo ra iốt tự do bằng quá trình oxy hóa:
O3 + 2Kl + H2O → 2KOH + O2 + I2
Việc bổ sung dung dịch natri thiosulfate vào dung dịch Kl trước khi hấp thụ gây ra phản ứng tức thời giữa iốt tự do và thiosulfate:
I2 + 2Na2S2O3 → Na2S4O6 + 2Nal
Do đó, một O3 tương đương với 2Na2S2O3.
C.1.2 Ba quy trình thay thế có sẵn, I, II và III, bất kỳ quy trình nào có thể được sử dụng.
C.1.2.1 Quy trình I là kỹ thuật được thiết lập tốt nhờ đó O3 được hấp thụ trong dung dịch KI đệm với Na2S2O3 dư, trong một khoảng thời gian cố định, tiếp theo là chuẩn độ Na2S2O3 dư theo cách thông thường với dung dịch l2 chuẩn hóa đến điểm cuối đo bằng điện kế.
C.1.2.2 Quy trình II là sửa đổi quy trình I và sử dụng máy ghi để theo dõi điện áp trên các điện cực của một thiết bị phát hiện điểm cuối điện kế. Một lượng nhỏ hơn (dung dịch loãng hơn) của Na2S2O3 là được thêm vào dung dịch Kl đệm và quá trình hấp thụ được tiếp tục cho đến khi Na2S2O3 được tiêu thụ hoàn toàn. Tại điểm này, điện áp tăng đột ngột. Từ biểu đồ ghi lại tổng thời gian đã trôi qua đề hoàn thành phần ứng được xác định dễ dàng và điều này được sử dụng để tính toán nồng độ ôzôn.
C.1.2.3 Quy trình III là một biến thể tiếp theo sử dụng thiết bị điện phân dòng không đổi kết hợp với detector điểm cuối đo bằng điện kế.
C.2 Quy trình I
C.2.1 Thuốc thử
C.2.1.1 Dung dịch kali iodua đệm. Một dung dịch Kl trong dung dịch đệm 0,1 mol/L được sử dụng. Sử dụng dung này được chuẩn bị bằng cách hòa tan trong 1 L nước cất:
17,8 g tinh thể dinatri hydro phosphat dihydrate (Na2HPO4.2H2O) hoặc lượng tương ứng một hydrat khác của disodium hydro phosphat;
13,6 g kali dihydro Phosphat (KH2PO4);
30 g ± 2 g kali iodua (KI).
Dung dịch này phải có pH là 6,8. Trước khi sử dụng, kiểm tra không có iốt. Đối với mục đích này, lấy 10 mL dung dịch và xác định không có sự thay đổi màu xảy ra khi thêm vài giọt HCI 2 mol/L cùng với 0,5 mL hồ tinh bột. Giữ dung dịch đã chuẩn bị trong chai màu nâu có nắp ở nơi thoáng mát, tránh ánh sáng.
C.2.1.2 Dung dịch natri thiosulfat, c(Na2S2O3) = 0,1 mol/L
Dung dịch này có thể được chuẩn bị dễ dàng bằng cách sử dụng dung dịch tiêu chuẩn có sẵn trên thị trường1). Bảo quản dung dịch này tránh ánh sáng ở nơi mát. Trong những điều kiện này dung dịch chuẩn độ sẽ duy trì ổn định trong 6 tháng.
________
1 Titrisol® từ Merck là một ví dụ về một sản phẩm phù hợp có sẵn trên thị trường. Thông tin này được cung cấp để thuận tiện cho người sử dụng tiêu chuẩn này và không phải là chứng thực của ISO cho sản phẩm này.
C.2.1.3 Dung dịch natri thiosulfat, c(Na2S2O3) = 0,002 mol/L
Chuẩn bị dung dịch này mới vào ngày phân tích từ dung dịch 0,1 mol/L bằng cách pha loãng thích hợp với nước cất. Ví dụ, dùng pipet lấy 5 mL dung dịch 0,1 mol/L cho vào bình định mức dung tích 250 mL và làm đầy đến vạch mức bằng nước cất mới đun sôi.
C.2.1.4 Dung dịch iốt, c(I2) = 0,05 mol/L
Dung dịch này có thể được chuẩn bị dễ dàng bằng cách sử dụng dung dịch tiêu chuẩn có sẵn trên thị trường1). Bảo quản dung dịch này tránh ánh sáng ở nơi mát. Trong những điều kiện này, dung dịch chuẩn độ sẽ duy trì ổn định trong 6 tháng.
C.2.1.5 Dung dịch iốt, c(I2) = 0,001 mol/L
Chuẩn bị từ dung dịch C.2.1.4 theo cách tương tự như C.2.1.3.
C.2.2 Thiết bị, dụng cụ
C.2.2.1 Thiết bị pha chế thuốc thử
C.2.2.1.1 Bình định mức dung tích 250 mL và 1 000 mL
C.2.2.1.2 Pipet dung tích 5 mL.
C.2.2.1.3 Cân, chính xác đến 5 mg.
C.2.2.2 Thiết bị hấp thụ ôzôn
Vật liệu tiếp xúc với không khí ôzôn hóa sẽ không hấp thụ đáng kể ôzôn. Tất cả các thiết bị thủy tinh phải được tiếp xúc với ôzôn trong một vài giờ trước khi sử dụng. Các ống kết nối phải càng ngắn càng tốt và phải có đường kính ít nhất 4 mm. Các ống kết nối không thể tránh được phải có diện tích tiếp xúc nhỏ nhất có thể với ôzôn.
C.2.2.2.1 Hai chai thủy tinh hấp thụ khí dung tích 100 mL, được kết nối với nhau như trong Hình C.1.
CẢNH BÁO - Không sử dụng chai có bọt thủy tinh thiêu kết, vì điều này cản trở việc xác định.
C.2.2.2.2 Đồng hồ đo lưu lượng, chính xác đến 1 %.
C.2.2.2.3 Nhiệt kế, chia độ trong các khoảng 0,5 °C.
C.2.2.3 Thiết bị chuẩn độ
C.2.2.3.1 Bình đo dung tích 100 mL.
C.2.2.3.2 Pipet dung tích 2 mL.
C.2.2.3.3 Buret dung tích 2 mL, chính xác đến 0,005 mL.
C.2.2.3.4 Cốc dung tích 250 mL.
C.2.2.3.5 Ống đong dung tích 100 mL.
C.2.2.4 Mạch phát hiện điểm cuối (xem Hình C.2)
C.2.2.4.1 Hai điện cực platinum, đường kính 2,5 mm và dài 25 mm, được gắn trong các ống thủy tinh được cung cấp kết nối điện. Thay vì hai điện cực riêng biệt, có thể sử dụng một cặp điện cực được gắn với nhau một khoảng cách ngắn (điện cực kép). Trong trường hợp sau, đường kính của mỗi điện cực phải là 1 mm và dài 6 mm. Tại cuối mỗi đầu phải có một viên bi đường kính 1,5 mm. Khoảng cách giữa các viên bi là 0,7 mm. Khi sử dụng điện cực kép với bề mặt nhỏ hơn, độ nhạy của ampe kế được sử dụng phải được tăng theo hệ số ít nhất là 10.
C.2.2.4.2 Micro-ampe kế, dải đo từ 0 µA đến 20 µA.
C.2.2.4.3 Hai điện trở, mắc nối tiếp, một điện trở biến đổi có thể tăng lên 1 000 Ω, còn điện trở kia cố định là 30 000 Ω.
C.2.2.4.4 Pin 1,5 V.
C.2.3 Cách tiến hành
C.2.3.1 Hấp thụ ôzôn
Hút một thể tích hỗn hợp không khí-ôzôn theo quy định thông qua hai chai hấp thụ được nối tiếp, mỗi chai chứa khoảng 100 mL dung dịch đệm kali iodua và chính xác đến 2,00 mL dung dịch natri thiosulfat 0,002 mol/L. Tốc độ truyền khí phải nằm trong khoảng từ 1 L/min đến 3 L/min và khí phải được truyền qua ít nhất 10 min. Ghi lại thời gian chính xác đến ± 1 s.
C.2.3.2 Chuẩn độ
Chuyển dung dịch từ hai chai hấp thụ vào cốc thủy tinh. Chuẩn độ lượng natri thiosultat dư bằng dung dịch iot 0,002 mol/L sử dụng phương pháp chỉ thị điểm cuối được mô tả trong C.2.3.3.
C.2.3.3 Chỉ thị điểm cuối
Một hiệu điện thế nhỏ được duy trì giữa hai điện cực được nhúng trong dung dịch đệm kali iodua chứa một lượng dư natri thiosulfat. Các điện cực được phân cực và dòng điện rất nhỏ đi qua ampe kế. Tại thời điểm chính xác khi iốt được thêm vào không còn phản ứng nữa, tương ứng với thời điểm khi tất cả các dung dịch natri thiosultat đã được tiêu thụ, catot khử cực và dòng điện lớn hơn nhiều đi qua. Do đó, điểm cuối được biểu thị bằng độ lệch sắc nét của kim ampe kể từ điểm thấp nhất.
C.2.3.4 Phép thử trắng
Tiến hành phép thử trắng theo cách chính xác giống như trong C.2.3.1 đến C.2.3.3, nhưng truyền không khí thông thường qua các chai hấp thụ.
C.2.4 Biểu thị kết quả
Tính nồng độ ôzôn ![]() tính bằng pphm (phần thể tích ôzôn trên 108 phần thể tích không khí), sử dụng công thức sau:
tính bằng pphm (phần thể tích ôzôn trên 108 phần thể tích không khí), sử dụng công thức sau:
![]()
trong đó:
Vb là thể tích dung dịch iốt được sử dụng trong phép thử trắng, tính bằng mL;
Va là thể tích dung dịch iốt được sử dụng trong phép xác định thực tế, tính bằng mL;
c là nồng độ của dung dịch iốt, tính bằng mol/L;
T là nhiệt độ của dòng không khí/ôzôn, tính bằng K;
p là áp suất tại đầu vào của đồng hồ đo lưu lượng, tính bằng hPa;
F là lưu lượng khí, tính bằng L/min;
t là khoảng thời gian dòng khí-ôzôn được đi qua các chai hấp thụ, tính bằng min;
R là hằng số khí (8,314 Pa∙m3∙mol-1 K-1).
C.3 Quy trình II
C.3.1 Chuẩn bị thuốc thử
C.3.1.1 Dung dịch đệm kali iodua
Dung dịch này giống hệt với dung dịch được quy định trong C.2.1.1.
C.3.1.2 Dung dịch natri thiosulfat chuẩn hóa
Các dung dịch này phải được chuẩn bị mới vào ngày phân tích từ dung dịch 0,1 mol/L quy định trong C.2.1.2. Các nồng độ cần thiết phụ thuộc vào nồng độ ôzôn. Các nồng độ sau đây là phù hợp:
0,000 1 mol/L đối với ôzôn 25 pphm
0,000 2 mol/L đối với ôzôn 50 pphm
0,000 5 mol/L đối với ôzôn 100 pphm
0,001 mol/L đối với ôzôn 200 pphm
Việc pha loãng với nước cất có thể được thực hiện trong một hoặc hai bước bằng cách sử dụng pipet và bình tiêu chuẩn.
C.3.2 Thiết bị, dụng cụ
C.3.2.1 Thiết bị pha chế thuốc thử
Đối với các yêu cầu chung, xem C.2.2.1.
C.3.2.2 Thiết bị hấp thụ ôzôn
Đối với các yêu cầu chung, xem C.2.2.2.
Thiết bị được minh họa dưới dạng sơ đồ trong Hình C.3. Bình hấp thụ được thể hiện chi tiết hơn trong Hình C.4. Nếu không có loại bình này, bình ba cổ dung tích 250 mL cũng phù hợp. Bình hấp thụ được đặt trên máy khuấy từ. Một cặp điện cực platin hoặc điện cực kép được đưa vào bình và kết nối với máy ghi biểu đồ được thiết lập để tạo ra độ lệch toàn thang đo là 50 mV hoặc 100 mV. Tốc độ biểu đồ sẽ được kiểm tra bằng một chiếc đồng hồ bấm giờ.
C.3.3 Cách tiến hành
C.3.3.1 Sử dụng van nhánh, điều chỉnh lưu lượng khí ôzôn/không khí thành 1 L/min.
C.3.3.2 Lấy khoảng 60 mL dung dịch KI đệm và dùng pipet lấy chính xác 5 mL dung dịch chuẩn hóa Na2S2O3 cho vào bình. Bắt đầu khuấy mạnh và khởi động máy ghi ở tốc độ biểu đồ tốt nhất là 10 mm/min.
C.3.3.3 Chuyển dòng khí sang bình hấp thụ và đồng thời đánh dấu điểm trên biểu đồ ghi (hoặc bật đồng hồ bấm giờ và đánh dấu sau).
C.3.3.4 Điều chỉnh lưu lượng khí nếu cần và cho phép sự hấp thụ tiếp tục cho đến khi tín hiệu đường nền mV trên biểu đồ cho thấy một sự gia tăng đột ngột. Đo thời gian đã trôi qua bằng cách sử dụng đồng hồ bấm giờ hoặc từ dấu vết biểu đồ. Trong trường hợp sau, lấy điểm cuối là điểm giao nhau của đường nền với đường tăng dần sau điểm cuối.
C.3.3.5 Nếu sử dụng thuốc thử cấp phân tích và được bảo quản tránh ánh sáng ở nơi mát, thì không cần thiết tiến hành phép thử trắng.
C.3.4 Biểu thị kết quả
Tính nồng độ ôzôn ![]() như sau:
như sau:
![]()
trong đó:
V là thể tích dung dịch Na2S2O3 đã dùng, tính bằng mL;
c là nồng độ của dung dịch Na2S2O3, tính bằng mol/L;
T là nhiệt độ của không khí ôzôn hóa, tính bằng K;
F là lưu lượng của không khí ôzôn hóa, tính bằng L/min;
t là thời gian trôi qua, tính bằng min;
p là áp suất ở đầu vào của đồng hồ đo lưu lượng, tính bằng hPa;
R là hằng số khí (8,314 Pa∙m3∙mol-1∙K-1).
C.4 Quy trình III
C.4.1 Chuẩn bị thuốc thử
C.4.1.1 Dung dịch đệm kali iodua
Dung dịch này tương tự như được quy định trong C.2.1.1. Chuẩn bị bằng cách trộn dung dịch natri dihydro phosphat 0,1 mol/L và dung dịch monobasic kall phosphat 0,1 mol/L theo tỷ lệ 3 : 2 theo thể tích và hòa tan trong đó đủ kali iodua để cung cấp nồng độ từ 10 % đến 20 %.
C.4.1.2 Dung dịch natri thiosulfat chuẩn hóa
Chuẩn bị dung dịch natri thiosulfat khoảng 0,1 mol/L, chuyển một lượng thích hợp vào bình định mức và pha loãng 10 lần để có nồng độ khoảng 0,01 mol/L. Chuẩn hóa dung dịch này bằng một phương pháp phù hợp.
CHÚ THÍCH: Các dung dịch có nồng độ đã biết có thể có sẵn trên thị trường (xem C.2.1.2).
C.4.1.3 Dung dịch hấp thụ
Để chuẩn bị 300 mL dung dịch theo C.4.1.1, thêm 2 mL dung dịch natri thiosulfate được chuẩn bị theo C.4.1.2.
C.4.2 Thiết bị, dụng cụ
C.4.2.1 Thiết bị pha chế thuốc thử
Đối với các yêu cầu chung, xem C.2.2.1.
C.4.2.2 Thiết bị hấp thụ ôzôn
Thiết bị được minh họa trong Hình C.5. Tốt nhất là sử dụng thiết bị làm bằng thủy tinh màu. Được nhồi bằng thủy tinh hạt có đường kính 3 mm đến 4 mm.
C.4.2.3 Detector điểm cuối
Ví dụ về một mạch phù hợp được nêu trong Hình C.6.
C.4.2.4 Thiết bị điện phân
Ví dụ về một mạch phù hợp được nêu trong Hình C.6.
C.4.2.5 Thiết bị khác
C.4.2.5.1 Đồng hồ bấm giờ.
C.4.2.5.2 Đồng hồ đo lưu lượng, cỡ 5 mL.
C.4.2.5.3 Pipet, dung tích lần lượt là 5 mL và 2 mL.
C.4.2.5.4 Máy khuấy điện.
C.4.3 Cách tiến hành
C.4.3.1 Dùng pipet lấy 7 mL dung dịch hấp thụ cho vào thiết bị hấp thụ.
C.4.3.2 Kết nối nguồn cung cấp không khí ôzôn hóa với đầu vào của thiết bị và đồng hồ đo lưu lượng đến cửa xả.
C.4.3.3 Cho khoảng 5 L không khí ôzôn hóa qua thiết bị với tốc độ khoảng 2 L/min.
C.4.3.4 Khi thao tác này hoàn tất, tháo ống đầu vào và dừng bơm. Sau đó mở khóa, cùng thời điểm rót 100 mL nước vào đầu trên của thiết bị để xả dung dịch hấp thụ vào cốc dung tích 250 mL.
C.4.3.5 Cho các điện cực platin của detector điểm cuối và các điện cực của thiết bị điện phân vào dung dịch hấp thụ (xem Hình C.6) và áp khoảng 0,15 V vào các điện cực của detector điểm cuối. Xác nhận số đọc của ampe kế bằng “0”. Bật thiết bị điện phân và cho dòng điện 200 A đi qua giữa các điện cực trong khi khuấy dung dịch ở tốc độ không đổi. Khởi động đồng hồ bấm giờ cùng lúc với quá trình điện phân bắt đầu.
C.4.3.6 Khi ampe kế của detector điểm cuối chỉ 0,3 A, dừng đồng hồ bấm giờ, tắt thiết bị điện phân và đọc thời gian t1 cần thiết cho điện phân.
C.4.3.7 Tiến hành phép thử trắng bằng cách lặp lại quá trình điện phân bằng 7 mL dung dịch hấp thụ (C.4.1.3), theo đó 100 mL nước đã được thêm vào, trong cốc có mỏ sạch. Đo thời gian to cần thiết cho khoảng trống.
C.4.4 Biểu thị kết quả
Tính nồng độ ôzôn ![]() theo thể tích trong hỗn hợp ôzôn/không khí từ các công thức sau:
theo thể tích trong hỗn hợp ôzôn/không khí từ các công thức sau:
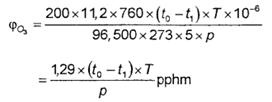
trong đó:
t1 là thời gian thực hiện để điện phân dung dịch thử, tính bằng giây;
t0 là thời gian thực hiện để điện phân dung dịch trắng, tính bằng giây;
p bằng 760 - ∆p tính bằng mmHg (trong đó: ∆p là chênh lệch giữa áp lực ở đầu vào của dòng chảy mét trong khi xác định thực tế và áp lực trong quá trình tiến hành phép thử trắng);
T là nhiệt độ của dung dịch, tính bằng K.
Kích thước tính bằng milimét
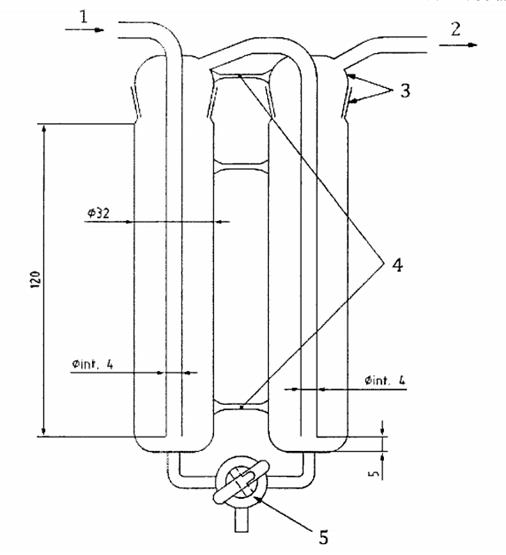
CHÚ DẪN:
1 khí vào
2 khí ra
3 nút nhám 29/42 hoặc 34/45
4 mảnh kính chéo
5 nút khóa PTFE 3-chiều đường kính 3 mm
Hình C.1 - Thiết bị hấp thụ ôzôn
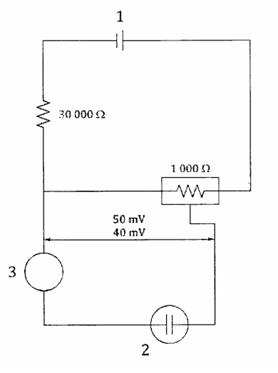
CHÚ DẪN:
1 pin 1,5 mV
2 hai điện cực platin
3 micro-ampe kế
Hình C.2 - Mạch phát hiện điểm cuối đo bằng điện kế
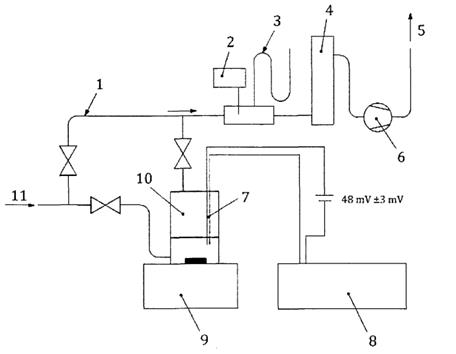
CHÚ DẪN:
| 1 | van nhánh | 7 | điện cực platin |
| 2 | cặp nhiệt điện | 8 | máy ghi âm |
| 3 | áp kế | 9 | máy khuấy |
| 4 | đồng hồ đo lưu lượng | 10 | bình hấp thụ |
| 5 | khí ra | 11 | khí vào |
| 6 | bơm |
|
|
Hình C.3 - Bố trí chung của thiết bị đối với quy trình II
Kích thước tính bằng milimét
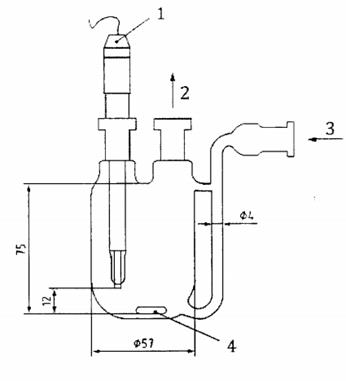
CHÚ DẪN:
| 1 | điện cực platin |
| 2 | khí ra |
| 3 | khí vào |
| 4 | thanh khuấy |
Hình C.4 - Bình hấp thụ ôzôn đối với quy trình II
Kích thước tính bằng milimét
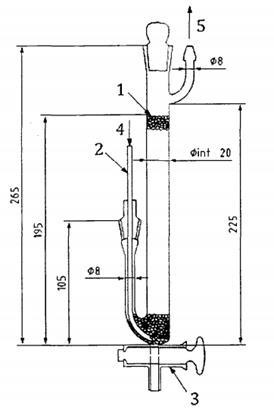
CHÚ DẪN:
1 hạt thủy tinh, đường kính 3 mm đến 4 mm
2 ống PTFE, đường kính 2 mm đến 3 mm
3 khóa, đường kính 3 mm
4 khí vào
5 khí ra
Hình C.5 - Thiết bị hấp thụ ôzôn đối với quy trình III
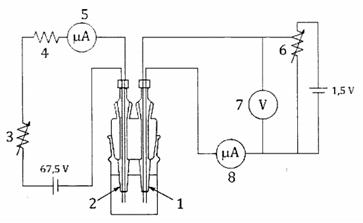
CHÚ DẪN:
1 điện cực của detector điểm cuối
2 điện cực của thiết bị điện phân
3 biến trở, có thể chuyển đổi giữa 30 kΩ và 500 kΩ
4 điện trở 60 kΩ
5 micro-ampe kế, độ lệch toàn thang đo 200 µA
6 biến trở 2 kΩ
7 vôn kế, độ lệch toàn thang đo 0,5 V
8 micro-ampe kế, độ lệch toàn thang đo 10 µA
Hình C.6 - Ví dụ về mạch điện phân và detector phù hợp
Thư mục tài liệu tham khảo
[1] BREWER, A.W., and MILFORD, J.R.: Proceedings of the Royal Society, Series A, 256, No. 1287, p. 470 (1960).
[2] BYERS, D.H., and SALTZMAN, B E.: Advances in Chemistry Series, 21, p. 93 (1957).
[3] VEITH, A.G., and EVANS, R.L.: The Effect of Atmospheric Pressure on Ozone Cracking of Rubber, Polymer Testing, 1(1), pp. 27-38 (1980).
[4] VEITH, A.G.: A Rapid Quantitative Method for Measuring Ozone Cracking, Rubber Chemistry and Technology, 45(1), pp. 293-308 (1972).
Mục lục
Lời nói đầu
Lời giới thiệu
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Thuật ngữ và định nghĩa
4 Nguyên tắc
5 Thiết bị, dụng cụ
6 Hiệu chuẩn
7 Quy trình
8 Biểu thị kết quả
9 Báo cáo thử nghiệm
Phụ lục A (tham khảo) Ảnh hưởng của áp suất khí quyển môi trường lên sự rạn nứt bởi ôzôn của cao su
Phụ lục B (quy định) Phương pháp thiết bị thay thế
Phụ lục C (quy định) Phương pháp hóa học-ướt
Thư mục tài liệu tham khảo
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 11525-3:2020 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 11525-3:2020 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 11525-3:2020 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 11525-3:2020 DOC (Bản Word)