- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn ngành 10TCN 833:2006 Xác định hàm lượng chlotetracycline thức ăn chăn nuôi
| Số hiệu: | 10TCN 833:2006 | Loại văn bản: | Tiêu chuẩn ngành |
| Cơ quan ban hành: | Bộ Nông nghiệp và Phát triển nông thôn | Lĩnh vực: | Công nghiệp , Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
29/12/2006 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN NGÀNH 10TCN 833:2006
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
TIÊU CHUẨN NGÀNH
10TCN 833:2006
THỨC ĂN CHĂN NUÔI - XÁC ĐỊNH HÀM LƯỢNG CHLOTETRACYCLINE, OXYTETRACYLINE VÀ TETRACYCLINE BẰNG PHƯƠNG PHÁP SẮC KÝ LỎNG HIỆU NĂNG CAO
Animal feeding stuffs - Determination of content of chlotetracycline, oxytetracycline and tetracycline by high - performance liquid chromatographic method
(Ban hành kèm theo Quyết định số 4099/QĐ/BNN-KHCN ngày 29 tháng 12 năm 2006 của Bộ trưởng Bộ Nông nghiệp và Phát triển nông thôn)
1. Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp sắc ký lỏng hiệu năng cao (HPLC) để xác định hàm lượng các kháng sinh chlotetracycline (CTC), oxytetracycline (OTC) và tetracycline (TC) trong thức ăn chăn nuôi. Giới hạn phát hiện của phương pháp là 0,1 mg/kg.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau đây rất cần thiết cho việc áp dụng tiêu chuẩn. Đối với các tài liệu viện dẫn ghi năm ban hành thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm ban hành thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi:
TCVN 4851 (ISO 3696). Nước dùng để phân tích trong phòng thí nghiệm. Yêu cầu kỹ thuật và phương pháp thử.
ISO 6497:2002 (E): Animal feeding stuffs - Sampling.
3. Nguyên tắc
Các kháng sinh nhóm tetracycline trong mẫu thức ăn chăn nuôi được chiết bằng dung dịch đệm ở pH 4. Dịch chiết được làm sạch bằng cột chiết pha rắn RP - C18. Các tetracycline được tách và định lượng trên hệ thống sắc ký lỏng hiệu năng cao (HPLC) với detector UV ở bước sóng 350 nm.
4. Thiết bị, dụng cụ
4.1. Máy nghiền mẫu phòng thí nghiệm.
4.2. Sàng phòng thí nghiệm, có kích thước lỗ sàng 1,00 mm và 3,00 mm.
4.3. Cân phân tích có độ chính xác 0,0001 g.
4.4. Cân kỹ thuật có độ chính xác 0,01 g.
4.5. Máy ly tâm có tốc độ 3000 vòng/phút, sử dụng ống ly tâm dung tích 50 ml.
4.6. ống ly tâm, dung tích 50 ml bằng polypropylen hoặc bằng thuỷ tinh, có nắp đậy.
4.7. Máy nghiền đồng thể (Homorgenizer).
4.8. Máy lắc tròn hoặc máy lắc ngang có thể đạt tốc độ 250 vòng/phút.
4.9. Máy đo pH có độ chính xác đến 0,05 đơn vị.
4.10. Phễu lọc Buchner đường kính 5,5 cm.
4.11. Giấy lọc tốc độ nhanh.
4.12. Bình định mức dung tích 10, 100, 500, 1000 ml.
4.13. Pipet tự động điều chỉnh được từ 2 ml đến 10 ml.
4.14. Micropipet dung tích từ 10 ml đến 100 ml.
4.15. Hút dung môi tự động 2 ml, 10 ml, 20 ml.
4.16. Bể siêu âm.
4.17. Bơm hút chân không.
4.18 Màng lọc syranh có kích thước 0,45 àm.
4.19. Lọ nhỏ đựng dịch mẫu chuyên dụng cho HPLC, có nắp vặn PTFE .
4.20. Thiết bị trộn mẫu phòng thí nghiệm loại Hobart Model C 100 T hoặc tương đương.
4.21. Thiết bị chia mẫu:
Thiết bị chia đôi hoặc chia tư mẫu: ví dụ như thiết bị chia tư hình nón, thiết bị chia nhiều ngăn có hệ thống phân hạt hoặc các thiết bị chia khác đảm bảo phân chia mẫu thí nghiệm thành mẫu thử đồng nhất.
4.22. Hộp đựng mẫu có nắp kín.
4.23. Hệ thống HPLC gồm có:
4.23.1. Máy sắc kí lỏng hiệu năng cao, bình chứa dung môi, hệ thống bơm mẫu, Detector UV đặt được ở bước sóng 350nm, máy ghi hoặc bộ tích phân.
4.23.2. Cột phân tích HPLC pha đảo có kèm cột bảo vệ
- Chiều dài 250mm
- Đường kính trong 4,6mm
- Hạt nhồi C 18, 5mm hoặc tương đương
Chú ý : có thể sử dụng cột ngắn hơn, ví dụ có chiều dài 120mm-150mm.
5. Hoá chất và thuốc thử
5.1 Hoá chất
Chỉ sử dụng hoá chất được công nhận đạt chất lượng tinh khiết phân tích và nước cất cấp hạng 1 theo TCVN 4851 (ISO 3696). Các dung môi phải đạt chất lượng để dùng cho phân tích HPLC.
5.1.1. Natri hydrophotphat khan (Na2HPO4).
5.1.2. axit xitric ngậm 1 phân tử nước (C6H8O7.H2O).
5.1.3. axit oxalic ngậm 2 phân tử nước (H2C2O4.2 H2O).
5.1.4. Dinatri etylen diamin tetraaxetat ngậm 2 phân tử nước (Na2EDTA. 2H2O).
5.1.5. Metanol.
5.1.6. axetonnitrile.
5.1.7. Natri hydroxit.
5.1.8. axit clohydric.
5.1.9. Chất chuẩn kháng sinh nhóm tetracycline bao gồm: chlotetracycline hydrocloride (CTC), oxytetracyclin hydrochlorid (OTC) và tetraclohydrochlorid (TC) loại tinh khiết có kèm theo giấy chứng nhận về hàm lượng.
5.2. Thuốc thử
5.2.1. Dung dịch đệm McILvaine (pH 4 ± 0,05):
Dung dịch A: Cân 14,2 gam natri hyđrophotphat khan cho vào bình định mức dung tích 500 ml, hoà tan và định mức đến vạch bằng nước cất, lắc đều
Dung dịch B: Cân 10,5 gam axit xitric ngậm 1 phân tử nước cho vào bình định mức dung tích 500 ml, hoà tan và định mức đến vạch bằng nước cất, lắc đều
Dung dịch đệm McILvaine (pH 4 ± 0,05): Lấy 312,5 ml dung dịch A và 500 ml dung dịch B cho vào bình định mức 1000 ml, lắc đều. Sử dụng máy đo pH điều chỉnh pH của dung dịch trong bình đến pH 4 ± 0,05 bằng dung dịch HCl 0,1M hoặc dung dịch NaOH 0,1M. Dung dịch sử dụng trong một tuần.
5.2.2. Dung dịch đệm McILvaine - EDTA: Hoà tan 30,25 gam dinatri etylen diamin tetra axetat ngậm 2 phân tử nước vào 812,5 ml dung dịch đệm McILvaine (5.2.1), lắc đến tan hết và trộn đều. Dung dịch sử dụng trong một tuần.
5.2.3. Dung dịch axit oxalic trong metanol: Cân 1,26 gam axit oxalic ngậm 2 phân tử nước cho vào bình định mức dung tích 1000 ml, hoà tan và định mức đến vạch bằng methanol, lắc đều. Dung dịch này sử dụng trong ngày.
5.2.4. Pha động cho HPLC: Cân 1,26 gam Axit oxalic ngậm 2 phân tử nước vào bình định mức 1000 ml, hoà tan và định mức tới vạch bằng nước cất, lắc đều. Trộn 600 ml dung dịch axit oxalic này với 300 ml axetonnitril và 100 ml metanol, lọc hỗn hợp dung dịch thu được qua màng lọc 0,45 àm (lọc chân không), siêu âm đuổi khí ở nhiệt độ phòng trong 30 phút. Dung dịch này sử dụng trong ngày.
5.2.5. Dung dịch kháng sinh chuẩn:
CHÚ Ý: Việc pha các dung dịch chuẩn phải được tiến hành ở điều kiện tránh ánh sáng trực tiếp và bảo quản trong lọ sẫm màu.
5.2.5.1. Dung dịch chuẩn gốc 1000 µg/ml:
Cân 108 mg (chính xác đến 0,1mg) mỗi loại chuẩn gồm CTC, OTC, TC cho vào 3 bình định mức riêng biệt dung tích 100 ml (lượng cân được điều chỉnh theo hàm lượng kháng sinh ghi trong giấy chứng nhận). Hoà tan và định mức đến vạch bằng metanol, lắc đều.
Các dung dịch chuẩn gốc được bảo quản ở - 200C, có thể sử dụng những dung dịch này trong vòng 3 tháng.
5.2.5.2. Dung dịch chuẩn gốc hỗn hợp 100 µg/ml:
Hút chính xác 10 ml mỗi dung dịch chuẩn gốc 1000 µg/ml (5.2.5.1) vào bình định mức 100 ml, định mức đến vạch bằng metanol, lắc đều.
5.2.5.3. Dung dịch chuẩn làm việc 25 µg/ml:
Hút chính xác 2,5 ml dung dịch chuẩn hỗn hợp 100 µg/ml (5.2.5.2) vào bình định mức 100 ml, định mức đến vạch bằng metanol, lắc đều.
Bảo quản dung dịch trong tủ lạnh, dung dịch bền trong 1 tuần.
5.2.5.4. Dãy dung dịch chuẩn phân tích sắc ký 0,25; 0,50; 1,25; 2,50 và 5,00 µg/ml:
Hút chính xác 100, 200, 500, 1000, 2000 ml dung dịch chuẩn làm việc 25 àg/ml (5.2.5.3) của hỗn hợp các tetracyclin cho vào bình định mức dung tích 10 ml. Thêm 6 ml dung dịch axit oxalic trong metanol (5.2.3) và định mức đến vạch bằng nước cất, lắc đều.
Bảo quản dung dịch trong tủ lạnh, dung dịch này bền trong 1 tuần.
5.2.6 Dung dịch HCl 0,1 M
5.2.7. Dung dịch NaOH 0,1 M
6. Lấy mẫu và chuẩn bị mẫu
6.1. Lấy mẫu
Phương pháp lấy mẫu không quy định trong tiêu chuẩn này, nên lấy mẫu theo ISO 6497:2002. Điều quan trọng là mẫu gửi đến phòng thí nghiệm phải là mẫu trung thực và có tính đại diện, không bị hư hại hoặc bị biến đổi thành phần trong quá trình vận chuyển và bảo quản. Khối lượng mẫu phân tích phải không được ít hơn 500 gam.
6.2. Chuẩn bị mẫu
6.2.1. Mẫu ở dạng bột mịn
Nếu mẫu thí nghiệm ở dạng bột lọt hoàn toàn qua sàng có kích thước lỗ sàng 1,00 mm thì trộn thật đều mẫu (500 gam) bằng máy trộn phòng thí nghiệm loại Hobart (hoặc tương đương) trong vòng 10 phút. Sau đó chia hỗn hợp bằng thiết bị chia đôi hoặc thiết bị chia tư cho đến khi thu được lượng mẫu thử không dưới 100 gam. Cho toàn bộ mẫu thử vào hộp đựng mẫu và đậy nắp cẩn thận.
6.2.2. Mẫu có kích thước hạt vừa
6.2.2.1. Nếu mẫu thí nghiệm không lọt hết qua sàng có kích thước lỗ sàng 1,00 mm nhưng lọt hoàn toàn qua sàng có kích thước lỗ 3,00 mm thì trộn thật đều mẫu (không ít hơn 500 gam) bằng máy trộn phòng thí nghiệm loại Hobart (hoặc tương đương) trong vòng 10 phút.
6.2.2.2. Dùng thiết bị chia đôi hoặc thiết bị chia tư mẫu đã trộn đều (6.2.2.1) cho đến khi thu được lượng mẫu thử không dưới 100 gam. Nghiền lượng mẫu này cẩn thận trong máy nghiền (4.1) cho dến khi mẫu lọt hoàn toàn qua sàng có kích thước lỗ sàng 1,00 mm.
6.2.3. Mẫu có kích thước hạt to
6.2.3.1. Nếu mẫu không lọt qua sàng có kích thước lỗ sàng 3,00 mm thì cần nghiền mẫu (không ít hơn 500 gam) trên máy nghiền (4.1) cho đến khi mẫu lọt hoàn toàn qua sàng có kích thước lỗ sàng 3,00 mm, sau đó trộn thật đều mẫu bằng máy trộn phòng thí nghiệm loại Hobart (hoặc tương đương) trong vòng 10 phút.
6.2.3.2. Dùng thiết bị chia đôi hoặc thiết bị chia tư mẫu đã trộn đều (6.2.3.1) cho đến khi thu được lượng mẫu thử không dưới 100 gam. Nghiền lượng mẫu này cẩn thận trong máy nghiền (4.1) cho đến khi mẫu lọt hoàn toàn qua sàng có kích thước lỗ sàng 1,00 mm.
Mẫu thử được bảo quản trong các lọ đựng mẫu (4.22) ở điều kiện nhiệt độ 2 – 250C, nơi khô ráo.
Chú ý: Nên nghiền, trộn mẫu trong các phòng có thông gió, nên đeo kính, khẩu trang và găng tay bảo vệ.
7. Cách tiến hành
7.1. Chiết mẫu
7.1.1. Cân chính xác đến 0,01g từ 1 – 5 gam mẫu đã được nghiền mịn theo mục 6 (tuỳ theo hàm lượng kháng sinh có trong mẫu) cho vào ống ly tâm dung tích 50 ml (ống ly tâm 1), thêm tiếp 20 ml dung dịch đệm McILvaine – EDTA (5.2.2), làm đồng nhất mẫu trong 1 phút bằng máy nghiền đồng thể. Tráng rửa đầu máy nghiền đồng thể 2 lần, mỗi lần bằng 2 ml dung dịch đệm McILvaine – EDTA. Đậy nắp ống ly tâm và lắc ống trong 10 phút ở tốc độ cao. Chuyển ống vào máy ly tâm, ly tâm trong 10 phút ở tốc độ 3000 vòng/phút.
7.1.2. Gạn phần dịch trong phía trên ống ly tâm 1 vào một ống ly tâm khác (ống ly tâm 2). Thêm tiếp 20 ml dung dịch đệm McILvaine – EDTA (5.2.2) vào ống ly tâm 1, đậy nắp, lắc trong 10 phút và ly tâm trong 10 phút ở tốc độ 3000 vòng/phút. Tiếp tục gạn phần dịch trong phía trên ống ly tâm 1 vào ống ly tâm 2. Sau đó lại thêm 10 ml dung dịch đệm McILvaine – EDTA (5.2.2) vào ống ly tâm 1, lắc và ly tâm như trên và gạn tiếp phần dịch trong phía trên ống ly tâm 1 vào ống ly tâm 2.
7.1.3. Ly tâm ống ly tâm 2 trong 20 phút ở tốc độ 3000 vòng/phút. Sau đó lọc bằng chân không qua giấy lọc trên phễu Buchner vào bình tam giác 125 ml. Tráng rửa ống ly tâm và phễu lọc 2 lần, mỗi lần bằng 2 ml dung dịch đệm McILvaine – EDTA (5.2.2).
7.2. Chuẩn bị mẫu trắng
Mẫu trắng là mẫu thức ăn chăn nuôi được xác định là không có kháng sinh nhóm tetracyclin. Mẫu trắng được chuẩn bị tương tự như mẫu thử theo 7.1.
7.3. Chuẩn bị mẫu để xác định độ thu hồi
Mẫu này được bổ sung một lượng kháng sinh xấp xỉ dung dịch chuẩn gốc. Ví dụ, chuẩn bị dịch mẫu thu hồi có hàm lượng kháng sinh là 1 mg/kg: dùng pipet hút 200 ml dung dịch chuẩn làm việc 25 àg/ml (5.2.5.3) cho vào 5 gam mẫu trắng (7.2) và tiếp tục quá trình chiết mẫu tương tự như đối với mẫu thử (7.1).
7.4. Làm sạch
7.4.1. Nối cột SPE - C18 với đầu ra của một syranh thuỷ tinh dung tích 100 ml, rửa cột bằng 20 ml metanol, sau đó bằng 20 ml nước cất, loại bỏ dịch qua cột.
7.4.2. Lần lượt cho các dịch chiết trong ống ly tâm thu được từ 7.1.3, 7.2 và 7.3 qua syranh vào cột SPE - C18 đã được chuẩn bị ở trên, dùng bơm hút chân không và điều chỉnh tốc độ chảy không quá 2ml/phút. Tráng ống li tâm bằng 10 ml dung dịch đệm McILvaine - EDTA (5.2.2) và chuyển hết vào cột SPE – C18, không để cột bị khô trong giai đoạn này, rửa cột bằng 20 ml nước cất và tiếp tục hút chân không để làm khô cột thêm 2 phút.
7.4.3. Rửa giải các kháng sinh trong cột SPE - C18 bằng cách cho 6 ml dung dịch axit oxalic trong methanol (5.2.3) chảy qua cột với tốc độ 1,5 ml/phút. Thu dịch qua khỏi cột vào bình định mức 10 ml. Sau khi dịch rửa giải chảy hết, tiếp tục hút chân không thêm khoảng 10 giây để đảm bảo thu hết được dịch rửa giải. Định mức dịch thu được đến vạch bằng nước cất, lắc đều, sau đó lọc qua màng lọc 0,45 àm vào lọ nhỏ chuyên dụng cho HPLC (4.19) để phân tích trên hệ thống sắc kí.
7.5. Tiến hành trên HPLC
7.5.1. Điều kiện chạy máy
Tốc độ dòng 1 ml/phút
Nhiệt độ cột nhiệt độ phòng
Detector detector UV bước sóng 350 nm
Thể tích bơm mẫu 50 ml
7.5.2. Tiến hành
7.5.2.1. Nên sử dụng bảo vệ cột, việc sử dụng bảo vệ cột không có bất cứ ảnh hưởng nào đến kết quả phân tích.
7.5.2.2. Cân bằng hệ thống sắc ký bằng pha động 30 phút trước khi bơm mẫu.
7.5.2.3. Quy trình bơm mẫu theo thứ tự như sau:
- Dịch mẫu trắng
- Dung dịch chuẩn làm việc
- Dịch mẫu thu hồi
- Dịch mẫu thử
- Dung dịch chuẩn làm việc
Chú ý: Cần bơm các dịch chuẩn trước và sau mỗi đợt phân tích, không nên để quá 20 lần bơm mẫu cho mỗi đợt phân tích. Nếu quá 20 lần thì phải bơm các dung dịch chuẩn thêm lần nữa vào khoảng giữa đợt bơm mẫu.
7.5.2.4. Xác định diện tích (hoặc chiều cao) pic đối với các dung dịch chuẩn và dung dịch mẫu thử tương ứng
7.5.2.5. Sau khi chạy máy phải làm sạch hệ thống HPLC bằng hỗn hợp gồm nước cất : axetonnitril : methanol theo tỷ lệ thể tích 7 : 2 : 1 trong 30 phút.
8. Tính toán kết quả
8.1. Đường chuẩn
8.1.1. Phải đảm bảo rằng các diện tích pic của mẫu thử đều nằm trong phạm vi của đường chuẩn. Nếu mẫu thử nào có diện tích pic vượt quá diện tích của đường chuẩn ở nồng độ cao nhất thì sẽ bị loại và phải tiến hành thử lại với sự pha loãng.
8.1.2. Xây dựng đường chuẩn biểu thị mối quan hệ giữa diện tích pic thu được của dung dịch chuẩn với nồng độ của từng loại theo quan hệ tuyến tính bậc 1:
y = ax + b
Trong đó: y là diện tích pic (hoặc chiều cao của pic).
x là nồng độ của kháng sinh.
a là hệ số góc.
b là hằng số.
8.2. Tính toán
8.2.1. Hàm lượng các kháng sinh có trong mẫu thử được tính toán dựa vào đường chuẩn hồi qui tuyến tính (8.1.2) theo công thức sau:
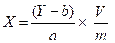
Trong đó: X là hàm lượng kháng sinh có trong mẫu thử, tính bằng mg/kg.
Y là hiệu số giữa diện tích pic của dịch chiết mẫu thử và diện tích pic của mẫu trắng.
a, b là các thông số của đường chuẩn y = ax + b
V là thể tích dịch chiết thu được sau khi làm sạch (7.4.3), tính bằng ml
m là khối lượng mẫu thử, tính bằng gam.
8.2.2. Kết quả cuối cùng là giá trung bình của hai lần phân tích nhắc lại. Trong quá trình tính toán luôn phải lấy hai số sau dấu phẩy. Giá trị trung bình được làm tròn đến một chữ số thập phân.
8.2.3. Xác định độ thu hồi (R) theo công thức sau:
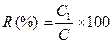
Trong đó:
C1 là hàm lượng tetracyline xác định được theo quy trình phân tích (tính bằng
mg/kg).
C là hàm lượng tetracyline được nạp thêm vào mẫu (1,25 mg/kg).
Độ thu hồi được xác định cho mỗi lần chạy mẫu ít nhất phải đạt 80%.
9. Báo cáo thử nghiệm
Báo cáo kết quả phải bao gồm ít nhất các thông tin dưới đây:
- Mọi thông tin cần thiết để nhận biết mẫu thử.
- Viện dẫn của tiêu chuẩn này hoặc phương pháp thử.
- Kết quả và đơn vị biểu thị kết quả.
- Ngày tháng lấy mẫu và kiểu loại lấy mẫu (nếu có).
- Ngày tháng thử nghiệm.
- Các điểm đặc biệt quan sát được trong quá trình thử nghiệm.
- Mọi thao tác không qui định trong tiêu chuẩn này, hoặc được coi là tuỳ chọn, cùng với các chi tiết của sự cố bất kỳ mà có thể ảnh hưởng đến kết quả.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn ngành 10TCN 833:2006 DOC (Bản Word)
Tiêu chuẩn ngành 10TCN 833:2006 DOC (Bản Word)